Перейти к:
Миоинозитол и D-хироинозитол в комплексе с фолатами и марганцем как факторы мужского здоровья: воздействие на структуру и фертильность сперматозоидов
https://doi.org/10.17749/2313-7347/ob.gyn.rep.2025.687
Аннотация
Важным фактором вторичного мужского бесплодия является дефицит витаминов и микроэлементов. В настоящей работе систематизирован комплекс исследований миоинозитола (МИ), D-хироинозитола (ДХИ), их синергистов (фолаты, ионы марганца) в поддержании структуры и функционирования гамет. МИ и ДХИ улучшают общее количество подвижных и прогрессивно подвижных сперматозоидов посредством участия в сигнальных каскадах рецепторов репродуктивных гормонов (что нормализует обмен андрогенов и способствует профилактике инсулинорезистентности) и улучшения функции митохондрий. МИ и ДХИ оказывают воздействие на созревание/функционирование сперматозоидов, их подвижность и процесс оплодотворения ооцитов, в том числе с участием инозитол-зависимого сигнального белка фосфолипазы C-дзета (англ. phospholipase C-zeta, PLCz) и посредством модуляции электрических полей гамет. Клинические данные по использованию МИ и ДХИ при мужском бесплодии указывают на улучшение состояния zona pellucida, плазматической мембраны, цитоплазмы и рецепции сперматозоидов. Ионы марганца способствуют улучшению функционирования гаметоцитов посредством влияния на концентрацию тестостерона, повышения активности антиоксидантных ферментов и мембранного потенциала митохондрий. Фолаты, снижая уровни гаметотоксичного гомоцистеина, способствуют сохранению целостности ДНК сперматозоидов. Перспективно назначение МИ/ДХИ в сочетании с органическими солями марганца и фолатами пациентам с идиопатической патоспермией, особенно на фоне нарушений обмена углеводов (инсулинорезистентность) и сниженной антиоксидантной защиты.
Для цитирования:
Громова О.А., Торшин И.Ю., Тапильская Н.И. Миоинозитол и D-хироинозитол в комплексе с фолатами и марганцем как факторы мужского здоровья: воздействие на структуру и фертильность сперматозоидов. Акушерство, Гинекология и Репродукция. 2025;19(5):737-757. https://doi.org/10.17749/2313-7347/ob.gyn.rep.2025.687
For citation:
Gromova O.A., Torshin I.Yu., Tapilskaya N.I. Myoinositol and D-chiroinositol in combination with folates and manganese as factors of male health: effect on sperm structure and fertility. Obstetrics, Gynecology and Reproduction. 2025;19(5):737-757. (In Russ.) https://doi.org/10.17749/2313-7347/ob.gyn.rep.2025.687
Введение / Introduction
Бесплодие определяется как неспособность пары зачать ребенка по прошествии одного года без контрацепции. Это состояние стало глобальной проблемой здравоохранения, затрагивающей около 187 млн пар по всему миру, и примерно в половине случаев оно обусловлено мужским фактором. Окислительный стресс является распространенной причиной ряда состояний, связанных с мужским бесплодием. Высокий уровень активных форм кислорода (АФК) ухудшает качество спермы, снижая ее подвижность и усиливая окисление ДНК, белков и липидов. Прием мультиантиоксидантных добавок считается эффективным для улучшения показателей мужской фертильности благодаря синергетическому эффекту антиоксидантов [1].
Помимо микронутриентов и нутрицевтиков с ярко выраженными антиоксидантными свойствами (витамины С, Е, полифенолы и др.), другие микронутриенты также улучшают качество спермы [1]. В частности, инозитолы (витамин В8) играют регулирующую роль в мужской и женской репродуктивной функции, влияя на развитие ооцитов, сперматозоидов и эмбрионов [2]. Такие формы инозитолов, как миоинозитол (МИ) и D-хироинозитол (ДХИ), являются субстратом для биосинтеза фосфатидилинозитол фосфатов (англ. phosphatidylinositol phosphates, PIPs) – важной разновидности сигнальных молекул, играющих важнейшие роли в цитогенезе, морфогенезе и росте клеток, в том числе развитии гаметоцитов и оплодотворении [3].
Инозитолы важны для матурации гаметоцитов: и ооцитов, и сперматозоидов, и оплодотворения. Комбинированная терапия МИ плюс ДХИ улучшает результаты экстракорпорального оплодотворения (ЭКО) [4]. Добавление МИ к фолиевой кислоте у пациенток без синдрома поликистозных яичников (СПКЯ), проходящих циклы интрацитоплазматической инъекции сперматозоида (ИКСИ), т. е. процедуру введения сперматозоида в цитоплазму ооцита, позволяет уменьшить число используемых для ИКСИ зрелых ооцитов и увеличить число случаев успешной имплантации оплодотворенных ооцитов [5]. Высокие концентрации МИ в фолликулярной жидкости играют важную роль в созревании фолликулов и в эмбриональном развитии [6]. Концентрация МИ в семенных канальцах существенно выше, чем в сыворотке крови [7], и увеличивается при движении клеток через придатки яичка и семявыносящие протоки [8].
В настоящей статье представлены результаты систематического анализа воздействия инозитолов на структуру и функцию мужских гамет – сперматозоидов. Как показал проведенный анализ, МИ/ДХИ, их биологически активные производные, марганец и фолаты играют ключевые роли в функционировании сперматозоидов, начиная с их вызревания и заканчивая оплодотворением ооцитов. Далее последовательно рассмотрено участие МИ и ДХИ в оплодотворении ооцитов, в том числе через инозитол-зависимые ферменты и формирование гликозил-инозитоловых «якорей» белков. Рассмотрены результаты экспериментальных и клинических исследований моделей глубокого дефицита инозитолов (делеции определенных генов), а также воздействия МИ/ДХИ и их синергистов на подвижность сперматозоидов, в том числе через модуляцию их электрических полей.
Молекулярные механизмы участия миоинозитола и D-хироинозитола в поддержке функционирования гамет / Myonositol and D-chiroinositol molecular mechanisms in supporting gamete functioning
Сложность сигнальных путей, в которые вовлечены производные МИ и ДХИ, позволяет утверждать, что внутриклеточная сигнализация с участием МИ/ДХИ – своего рода «биологический код», который нуждается в расшифровке. Системно-биологический анализ белков протеома человека, проведенный в рамках такой расшифровки, показал, что МИ и ДХИ участвуют в поддержке сердечно-сосудистой системы, иммунитета (снижение аутоиммунных воспалительных реакций), функционировании центральной нервной системы (профилактика когнитивных расстройств, депрессий), метаболизме сахаров (прежде всего, в сигнальном каскаде инсулина и профилактике диабета), в функционировании почек и печени, в других физиологических процессах и способствуют торможению полиорганной патологии [9].
Хорошо известно, что МИ и ДХИ полезны при женском бесплодии, а их влияние на мужское бесплодие интенсивно изучается. Применение МИ и ДХИ улучшает биофункциональные параметры гамет, повышая мембранный потенциал митохондрий, компактность хроматина сперматозоидов, снижая фрагментацию ДНК и окислительный стресс. Благодаря инсулиносенсибилизирующему действию МИ и ДХИ (особенно в соотношениях МИ:ДХИ = 10:1 и 5:1 [10]), эти молекулы весьма полезны для лечения бесплодия, ассоциированного с инсулинорезистентностью и ожирением. Способствуя повышению внутриклеточного уровня кальция, инозитолы могут усиливать подвижность сперматозоидов, в том числе через поддержку функции митохондрий [11].
МИ и ДХИ улучшают подвижность сперматозоидов и могут быть назначены пациентам с идиопатической патоспермией. На метаболическое бесплодие, вызванное ожирением, нарушением соотношения эстрогенов и андрогенов и инсулинорезистентностью, можно воздействовать как МИ, так и ДХИ, благодаря их инсулиносенсибилизирующему действию. Наконец, МИ может повышать чувствительность к эффектам эндогенного фолликулостимулирующего гормона (ФСГ) (рис. 1).
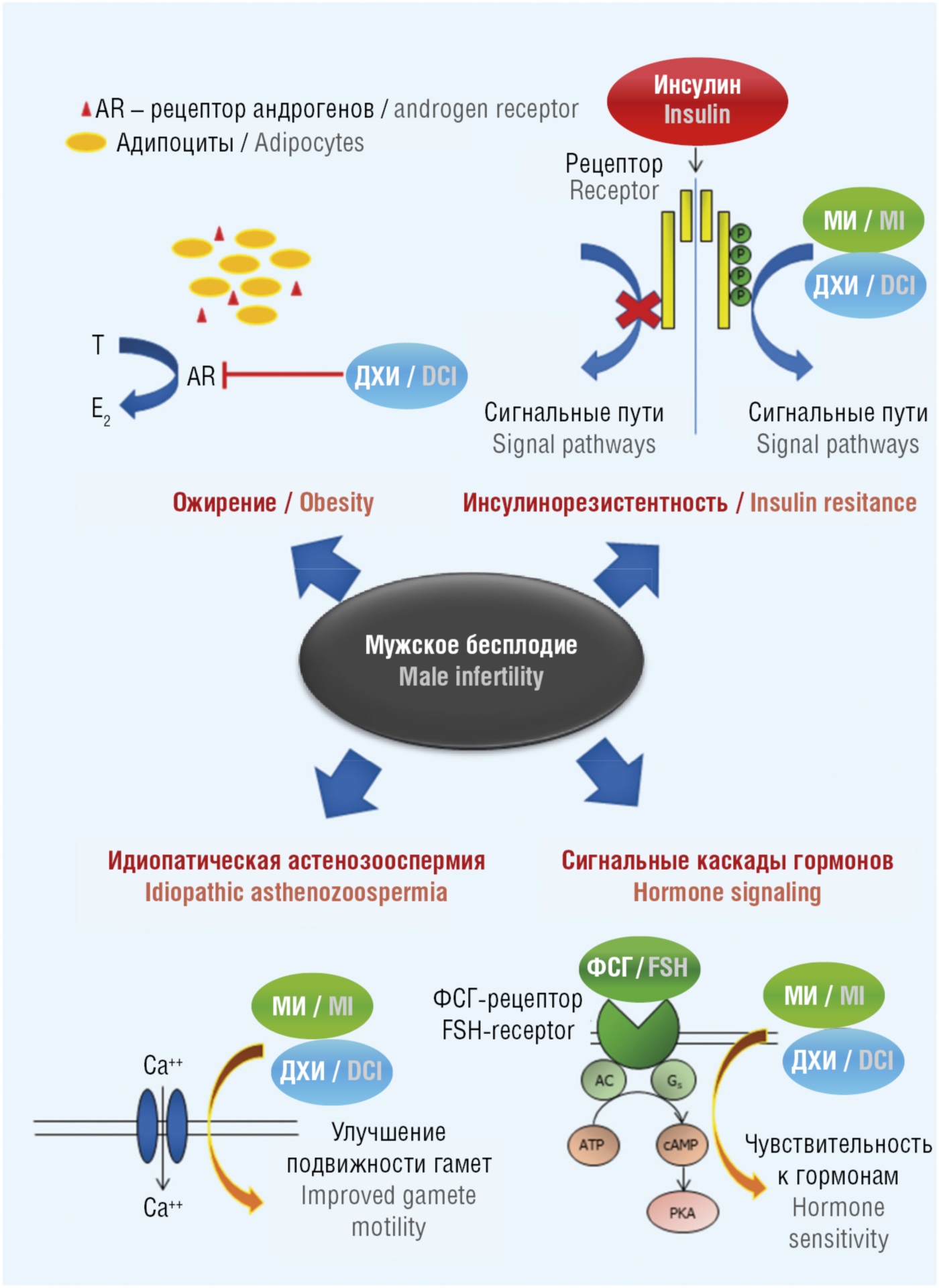
Рисунок 1. Показания к применению инозитолов при лечении мужского бесплодия [рисунок авторов].
Примечание: МИ – миоинозитол; ДХИ – D-хироинозитол; Е2 – эстрадиол; Т – тестостерон; AR – рецептор андрогенов; Р – фосфат-анион; AC – аденилциклаза; Gs – сигнальный Gs-белок; АТP – аденозинтрифосфат; cAMP – циклический аденозинмонофосфат; ФСГ – фолликулостимулирующий гормон; PKA – протеинкиназа А; Са++ – ионы кальция.
Figure 1. Indications for inositols application in male infertility treatment [drawn by authors].
Note: MI – myoinositol; DHI – D-chiroinositol; Е2 – estradiol; Т – testosterone; AR – androgen receptor; P – phosphate anion; AC – adenyl cyclase; Gs – signaling Gs protein; ATP – adenosine triphosphate; cAMP – cyclic adenosine monophosphate; FSH – follicle-stimulating hormone; PKA – protein kinase A; Са++ – calcium ions.
Благодаря участию в описанных выше каскадах передачи эндокринных сигналов, дотации МИ и ДХИ способствуют улучшению функционирования сперматозоидов. Будучи эффективной альтернативой классическим инсулиновым сенсибилизаторам, МИ и ДХИ хорошо переносятся и являются полезными средствами для профилактики и лечения метаболических и репродуктивных нарушений, в том числе приводящих к нарушениям мужской фертильности (например, к аномалиям сперматогенеза). Криоконсервация гамет с разбавителем, обогащенным МИ, улучшала общее количество подвижных и прогрессивно подвижных клеток (p < 0,05) [12]. МИ и ДХИ влияют на стероидогенез, регулируя уровни андрогенов и эстрогенов. В частности, ДХИ опосредует инсулин-индуцированный биосинтез тестостерона и напрямую влияет на синтез эстрогенов, модулируя экспрессию фермента ароматазы [13].
Миоинозитол/D-хироинозитол и процесс оплодотворения ооцитов // Myoinositol/D-chiroinositol and oocyte fertilization
Обеспеченность МИ/ДХИ важна для вызревания, движения сперматозоидов по маточным трубам и для процесса оплодотворения. МИ/ДХИ оказывают воздействие на созревание и функционирование сперматозоидов, регулируя осмолярность и объем семенной плазмы, экспрессию белков, необходимых для эмбриогенетического развития, и подвижность сперматозоидов [14]. Достаточные концентрации МИ/ДХИ в питательной среде культуры клеток значительно увеличивают процент подвижных сперматозоидов как у здоровых мужчин, так и у пациентов с олигоастенотератозооспермией. Улучшение подвижности в последней группе было связано, в частности, со значительным увеличением доли сперматозоидов с высоким мембранным потенциалом митохондрий [15].
Сигнальный миоинозитол-зависимый белок фосфатидилинозитол-3-киназа (англ. phosphatidylinositol- 3-kinase, PI3K) участвует в передаче сигнала от рецепторов различных гормонов, ростовых факторов и цитокинов, активность которых важна для вызревания сперматозоидов. В частности, фермент PI3K необходим для передачи внутриклеточного сигнала от рецептора интерлейкина-1β (англ. interleukin, IL-1β) в клетках Сертоли (рис. 2). IL-1β обеспечивает тонкую настройку клеточных процессов, вовлеченных в поддержание сперматогенеза. Ингибитор PI3K вортманнин уменьшает стимулируемый IL-1β транспорт глюкозы и синтез молочной кислоты, необходимых для нормального развития сперматозоидов [16]. Клетки предварительно инкубировали в течение 15 минут с вортманнином (0,01 и 0,1 ммоль/л) и затем стимулировали в течение 15 минут 50 нг/мл IL-1β. В норме активация миоинозитол-зависимой PI3K при связывании IL-1β одноименным рецептором приводит к увеличению фосфорилированной формы важнейшего сигнального белка – протеинкиназы В (англ. phosphorylated protein kinase B, P-РКВ) без изменения общего уровня протеинкиназы В (англ. total PKB, T-РКВ). Очевидно, что применение ингибитора PI3K привело к значительному снижению фосфорилированной формы (P-РКВ).
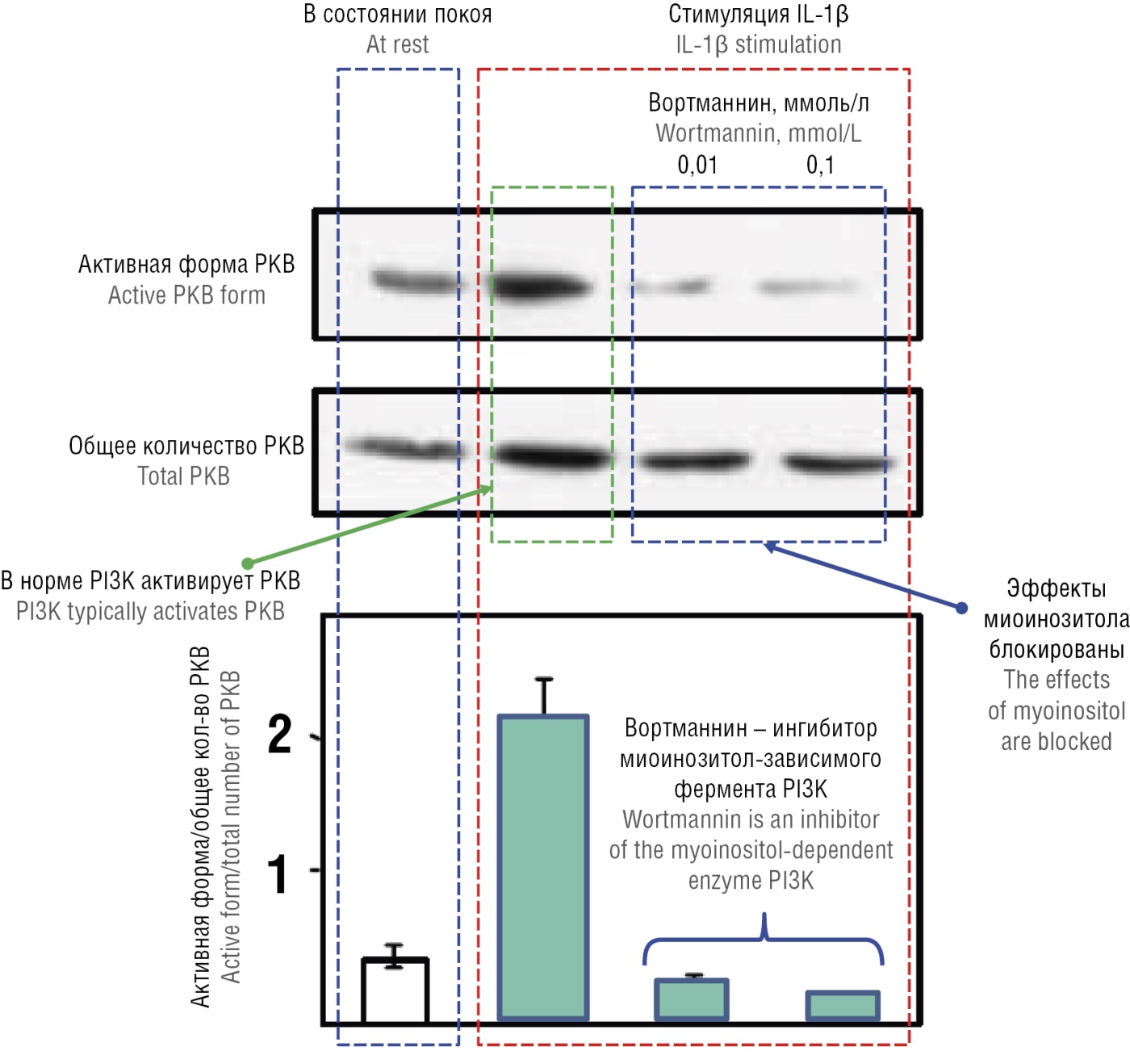
Рисунок 2. Влияние ингибитора фосфатидилинозитол-3-киназы (PI3K) – вортманнина на сигнальный каскад рецептора интерлейкина-1β (IL-1β) в клетках Сертоли [адаптировано из 16].
Примечание: РКВ – протеинкиназа B.
Figure 2. Effect of the phosphatidylinositol 3-kinase (PI3K) inhibitor – wortmannin on the interleukin-1β (IL-1β) receptor signaling cascade in Sertoli cells [adapted from 16].
Note: PKB – protein kinase B.
Фосфат-производные миоинозитола необходимы для поддержания термотаксического ответа сперматозоидов при движении по маточным трубам. В норме капацитированные сперматозоиды обладают термотаксисом, т. е. способны различать даже небольшую разницу в температуре (доли градуса) и передвигаться по яйцеводу из области с более низкой температурой в область с более высокой температурой. Исследование in vitro показало, что процесс термотаксиса подавляется ионом гадолиния (Gd³⁺), который является блокатором кальциевых каналов, и 2-аминоэтоксидифенил боратом (англ. 2-aminoethoxydiphenyl borate, 2-APB), который является специфическим ингибитором инозитол-1,4,5-трифосфат рецепторов (англ. inositol-1,4,5-triphosphate receptors, IP3R) (рис. 3).
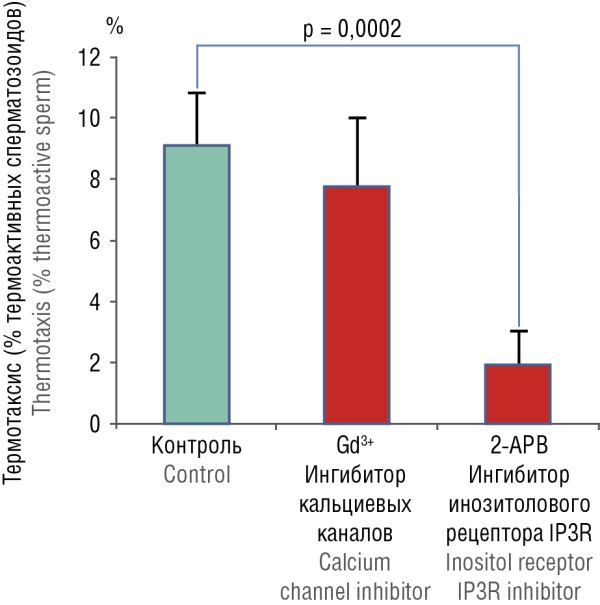
Рисунок 3. Эффекты ингибирования кальциевых каналов и инозитол-1,4,5-трифосфат рецепторов (IP3R) на термотаксис (адаптировано из [17]).
Примечание: 2-APB – 2-аминоэтоксидифенил борат; Gd³⁺ – ион гадолиния (III).
Figure 3. Thermotaxis affected by calcium channel and inositol-1,4,5-triphosphate receptor (IP3R) inhibition on thermotaxis (adapted from [17]).
Note: 2-APB – 2-aminoethoxydiphenyl borate; Gd³⁺ – gadolinium (III) ion.
Таким образом, активация миоинозитол-зависимых рецепторов (IP3R) стимулирует секрецию кальция из внутриклеточных компартментов в цитоплазму [17], обеспечивая термотаксис сперматозоидов. Сперматозоиды предварительно инкубировали в течение 20 минут с 2-APB (0,3 ммоль/л) – ингибитором IP3R или с Gd³⁺ (40 мкмоль/л) – ингибитором кальциевых каналов.
Инозитол-зависимая фосфолипаза С-дзета как основной белок, инициирующий капацитацию и акросомную реакцию в сперматозоидах в процессе оплодотворения / Inositol-dependent phospholipase С-zeta as the major protein initiating capacitation and acrosome reaction in sperm during fertilization
Перед взаимодействием с ооцитом сперматозоиды претерпевают ряд биохимических и физиологических изменений, известных как «капацитация», которая включает удаление с апикального тельца сперматозоида гликопротеиновой оболочки, после чего сперматозоид, не меняясь морфологически, приобретает способность к оплодотворению. Затем происходит так называемая «акросомная реакция» – определенное изменение в форме гамет. Акросома является своего рода «покрытием» передней половины головки сперматозоида, которая по мере того как сперматозоид приближается к ооциту, претерпевает изменение формы, направленное на слияние спермы с плазматической мембраной ооцита.
Специфический для сперматозоидов белок фосфолипаза С-дзета (англ. phospholipase C-zeta, PLCz) участвует в активации яйцеклетки, и недостаток активности PLCz связан с мужским бесплодием. Некоторые типы генетического мужского бесплодия включают нарушения экспрессии, внутриклеточной локализации, структуры и функции PLCz в мужских гаметах [18].
В норме внутриклеточная локализация PLCz наблюдается в области акросомы, экваториальном сегменте и в постакросомной области, а при нарушениях фертильности отмечается резкое снижение уровня PLCz наряду с абнормальной локализацией фермента в головке сперматозоида (рис. 4) [19].
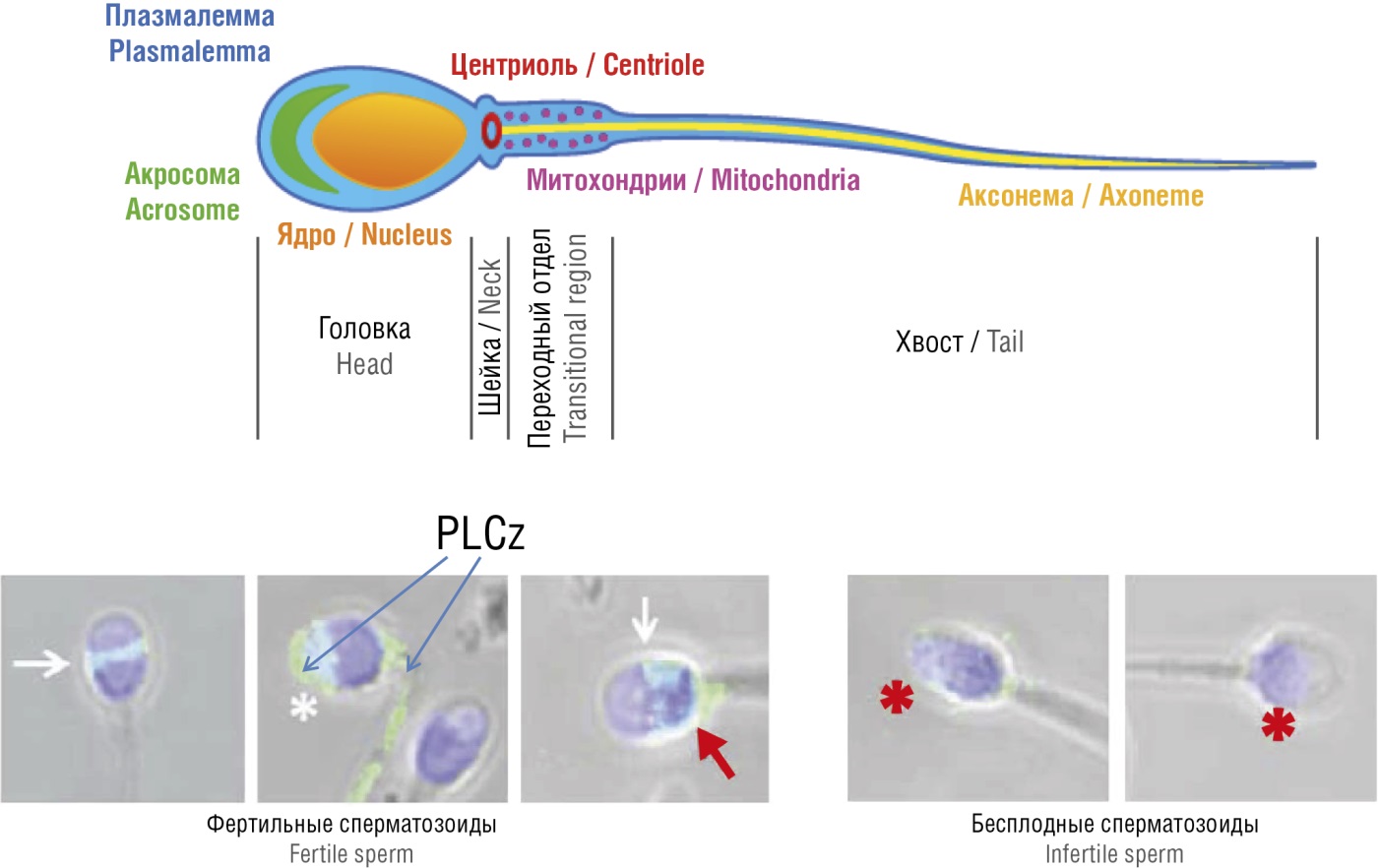
Рисунок 4. Иммунофлуоресценция фермента фосфолипазы С-дзета (PLCz): в фертильных сперматозоидах (левая панель) и в бесплодных гаметах (правая панель) (адаптировано из [19]).
Примечание: на изображениях представлены ядра клеток (синий цвет) и PLCz (зеленоватые полоски). Белые стрелки указывают на локализацию PLCz в экваториальном сегменте; белая «звездочка» – PLCz в акросоме, красная стрелка – PLCz в постакросомной области. На правой панели показан образец от пациента с бесплодием вследствие генетического дефекта PLCz-H398P; красные «звездочки» указывают на резко сниженный уровень PLCz с абнормальной локализацией – в головке сперматозоида.
Figure 4. Phospholipase C-zeta (PLCz) immunofluorescence in fertile sperm (left panel) and infertile gametes (right panel) (adapted from [19]).
Note: cell nuclei (blue) and PLCz (greenish stripes) are visualized. White arrows denote PLCz localization in the equatorial segment; white “asterisk” – PLCz in the acrosome, red arrow – PLCz in the post-acrosomal region. Right panel: a sample from a patient with infertility due to the genetic defect PLCz-H398P; red “asterisks” denote sharply lowered PLCz level with abnormally localized in the sperm head.
Фосфолипаза С-дзета принципиально необходима для успешного оплодотворения ооцита и развития эмбриона, так как участвует в формировании колебаний уровня кальция в ооците (рис. 5) в ходе «активации ооцитов» – одной из самой ранних стадий эмбриогенеза. По оплодотворении самым ранним событием является резкий подъем ионов кальция (Ca²⁺) ооцита, за которым следует деление оплодотворенной яйцеклетки. Именно PLCz, поступающая из сперматозоида, и опосредует секрецию Ca²⁺ из внутриклеточных депо путем гидролиза мембраны с образованием инозитол-1,4,5-трифосфата (англ. inositol-1,4,5-triphosphate, IP3).
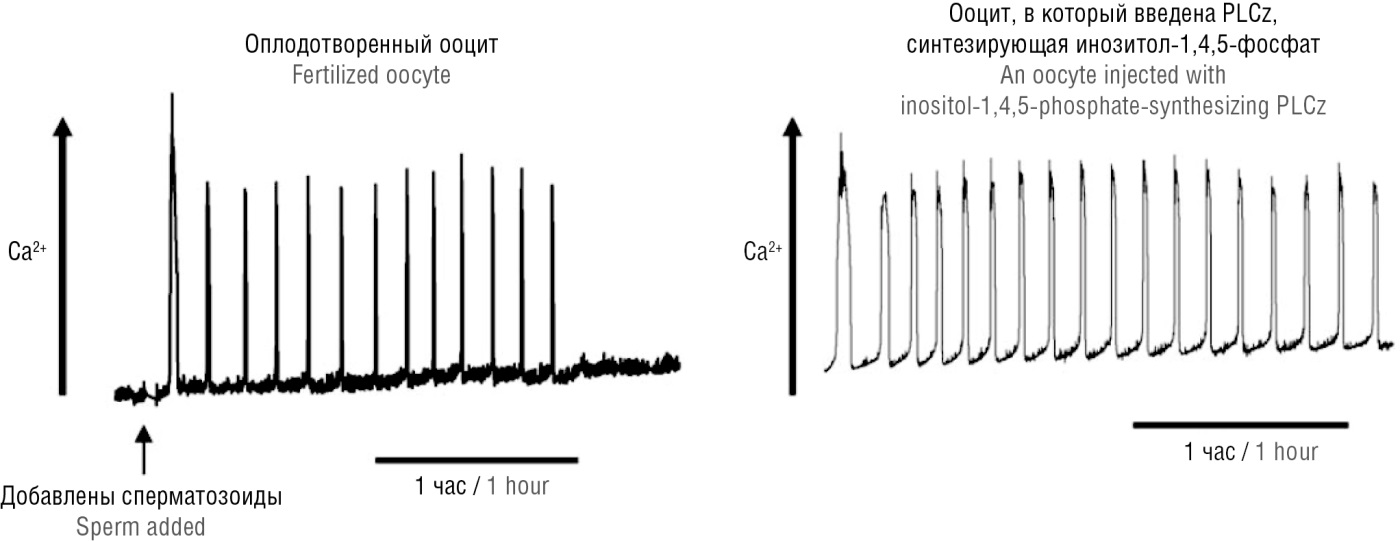
Рисунок 5. Колебания уровня ионов кальция (Ca²⁺) в ооцитах при оплодотворении поддерживаются за счет проникновения в ооцит фосфолипазы С-дзета (PLCz) из сперматозоидов (адаптировано из [21]).
Figure 5. Calcium ion (Ca²⁺) oscillations in oocytes during fertilization maintained due to the penetration of sperm phospholipase C-zeta (РLCz) into the oocyte (adapted from [21]).
Фермент PLCz активирует синтез IP3, который стимулирует высвобождение кальция из внутриклеточных компартментов ооцита. Фермент PLCz наиболее активен в начале капацитации, в результате чего происходит временная инактивация PI3K. Одновременно IP3 взаимодействует с IP3-рецепторами (IP3R) 1-го и 3-го типов [20], которые и стимулирует секрецию Ca²⁺, ведущую к активации ооцита [21]. В процессе капацитации PLCz постепенно инактивируется протеинкиназой А, что снова активирует PI3K [22], что и приводит к возникновению колебаний уровня кальция (рис. 6).
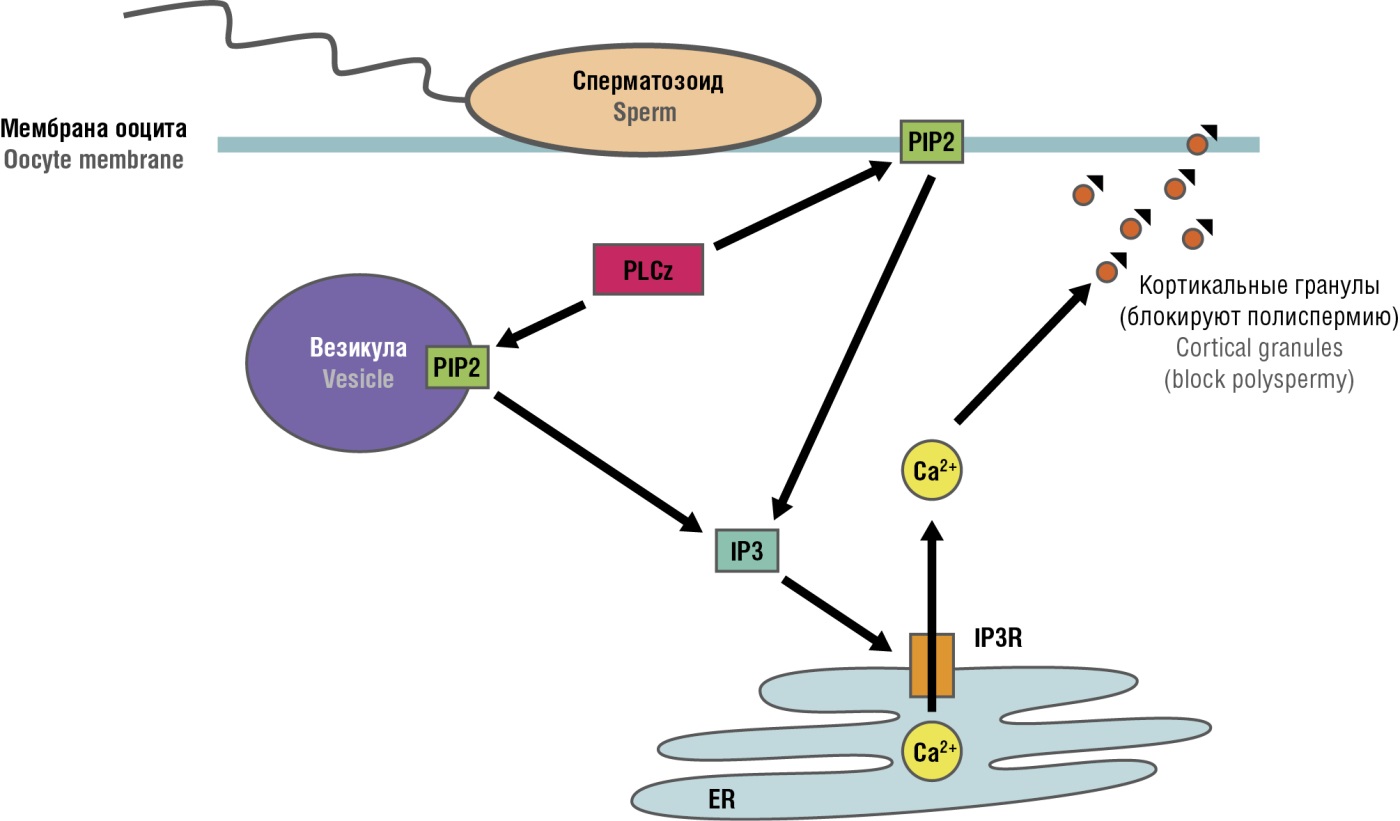
Рисунок 6. Фосфолипаза С-дзета (PLCz) сперматозоида стимулирует «волны» ионов кальция (Ca²⁺), необходимые для активации ооцита [22].
Примечание: PIP2 – фосфатидилинозитол 4,5-бисфосфат; IP3R – инозитол-1,4,5-трифосфат рецептор; по слиянии мембран сперматозоида и ооцита PLCz диффундирует из головки сперматозоида в яйцеклетку. PLCz осуществляет высвобождение активной формы миоинозитола (IP3) из фосфолипидов мембраны, секрецию Са²⁺ из эндоплазматической сети (ER) с последующим экзоцитозом корковых гранул и делением оплодотворенного ооцита.
Figure 6. Sperm phospholipase C-zeta (PLCz) stimulates calcium ions (Ca²⁺) "waves" required for oocyte activation [22].
Note: PIP2 – phosphatidylinositol 4,5-bisphosphate; IP3R – inositol-1,4,5-triphosphate receptor; upon fusion of the sperm and oocyte membranes, PLCz diffuses from the sperm head into the oocyte. PLCz enables release of active myoinositol IP3 from membrane phospholipids, Ca²⁺ secretion from the endoplasmic reticulum (ER) followed by exocytosis of cortical granules and fertilized oocyte division.
Другие механизмы участия миоинозитола/D-хироинозитола в капацитации сперматозоидов / Other mechanisms for myoinositol/D-chiroinositol role in sperm capacitation
Возникающие при оплодотворении миоинозитол-опосредованные колебания внутриклеточной концентрации Са²⁺ стимулируют активность митохондрий. Митохондриальный синтез АТФ поддерживает колебания Са²⁺ и имеет принципиальное значение для фертильности [23].
МИ/ДХИ опосредуют воздействие стероидного гормона прогестерона на функционирование сперматозоидов. Прогестерон стимулирует приток Са²⁺ с помощью кальциевых каналов типов SOC (англ. store-operated channel; канал, управляемый депо кальция) и ROC (англ. receptor-operated channel; канал, управляемый рецептором кальция) и упоминаемой выше PLCz [24]. Кроме того, в некапацитированных сперматозоидах лептин повышает отток холестерина. В капацитированных сперматозоидах инсулин и лептин увеличивают активность инозитол-зависимого фермента PI3K [25].
Важно отметить, что инозитолы принимают участие в функции гаметоцитов через регуляцию взаимодействия этих клеток с электрическими полями. Функционирование гаметоцитов, также как кардиомиоцитов, нейронов и других видов клеток, существенно зависит от отклика клеток на внешние и внутренние электрические поля. В частности, белок потенциал-чувствительная фосфатаза (англ. voltage-sensitive phosphatase, VSP) проявляет потенциал-зависимую фосфатазную активность в отношении фосфопроизводных МИ/ДХИ. VSP активируется во время созревания сперматозоидов, что указывает на важность электрических сигналов в незрелых сперматозоидах. Примечательно, что мутантная форма фосфатазы VSP (V312R) со сниженной чувствительностью к электрическим полям демонстрирует аномальную подвижность сперматозоидов именно после капацитации (рис. 7). Кроме того, мутантная форма V312R демонстрирует значительные нарушения в структуре цепочек инозитолфосфатов. В целом, сбалансированное содержание фосфопроизводных МИ/ДХИ имеет важное значение для электрически-зависимой подвижности сперматозоидов [26].
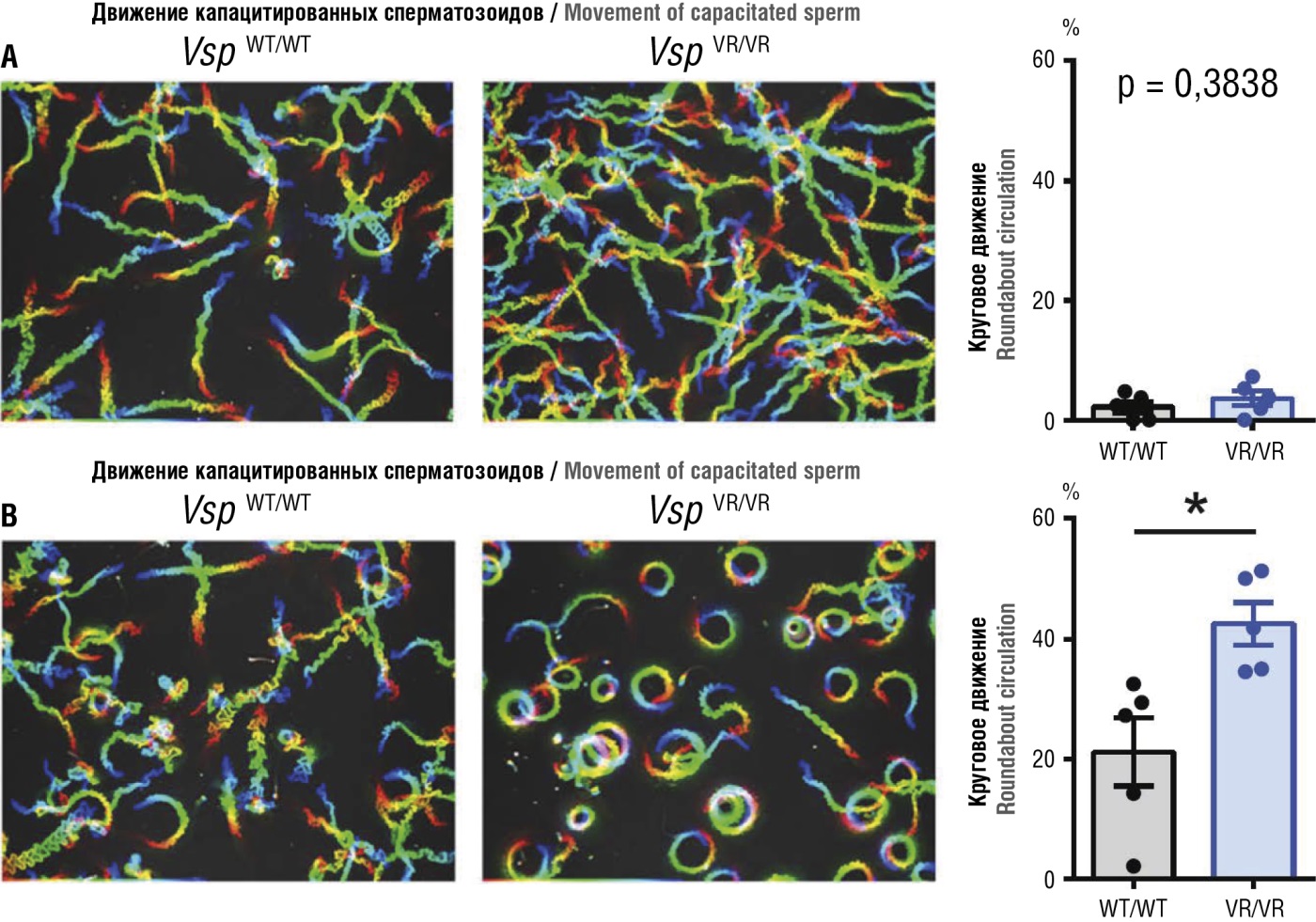
Рисунок 7. Анализ подвижности сперматозоидов до и после капацитации у интактных мышей (VspWT/WT) и мышей с делецией гена инозитол-зависимой потенциал-чувствительной фосфатазы VSP (VspVR/VR) (адаптировано из [26]).
Примечание: VSP – потенциал-чувствительная фосфатаза; делеция гена соответствует глубокому дефициту МИ/ДХИ. Слева: траектории сперматозоидов, выделенных у интактных и VspVR/VR мышей. Сперматозоиды инкубировали в питательной среде 10 минут (А) и 2 часа (В). Справа: статистический анализ был проведен для процента клеток, демонстрирующих круговое движение, с использованием непарного двустороннего t-критерия (*p < 0,05). Данные представлены как среднее значение ± стандартная ошибка.
Figure 7. Analysis of sperm motility before and after capacitation in wild type (VspWT/WT) and inositol-dependent voltage-sensitive phosphatase gene VSP knockout (VspVR/VR) mice (adapted from [26]).
Note: VSP – voltage-sensitive phosphatase; the gene deletion corresponds to severe MI/DHI deficiency. Left: sperm trajectories isolated from wild type and VspVR/VR mice. Sperm was incubated in culture medium for 10 min (А) and 2 hours (В). Right: percentage of cells showing circular motion was analyzed by using an unpaired two-tailed t-test (*p < 0.05). Data are presented as mean ± SE.
Участие миоинозитола/D-хироинозитола в формировании гликозил-инозитоловых «якорей» белков // Myoinositol/D-chiroinositol in protein glycosyl-inositol anchor formation
МИ/ДХИ принципиально важны для поддержания структуры и функции сперматозоидов, так как участвуют в закреплении определенных белков на поверхности гамет. МИ/ДХИ входят в состав гликозилфосфатидилинозитолов (англ. glycosylphosphatidylinositol, GPI) – гликолипидных «якорей», посредством которых тот или иной белок закрепляется в клеточной мембране через липид на основе пальмитиновой кислоты. Нарушение процесса прикрепления и открепления белков, закрепленных на поверхности сперматозоидов с помощью МИ/ДХИ-зависимых GPI-якорей, приводит к мужскому бесплодию [27].
Например, белок PGAP1 (англ. post-GPI attachment protein-1; пост-GPI соединяющий белок-1) отделяет пальмитиновую кислоту от молекул МИ/ДХИ в GPI-якорях. Экспериментальная делеция гена PGAP1 приводит к тяжелым врожденным порокам развития и высокой ранней смертности. У выживших животных отмечались задержка роста (рис. 8) и выраженное снижение фертильности [27].
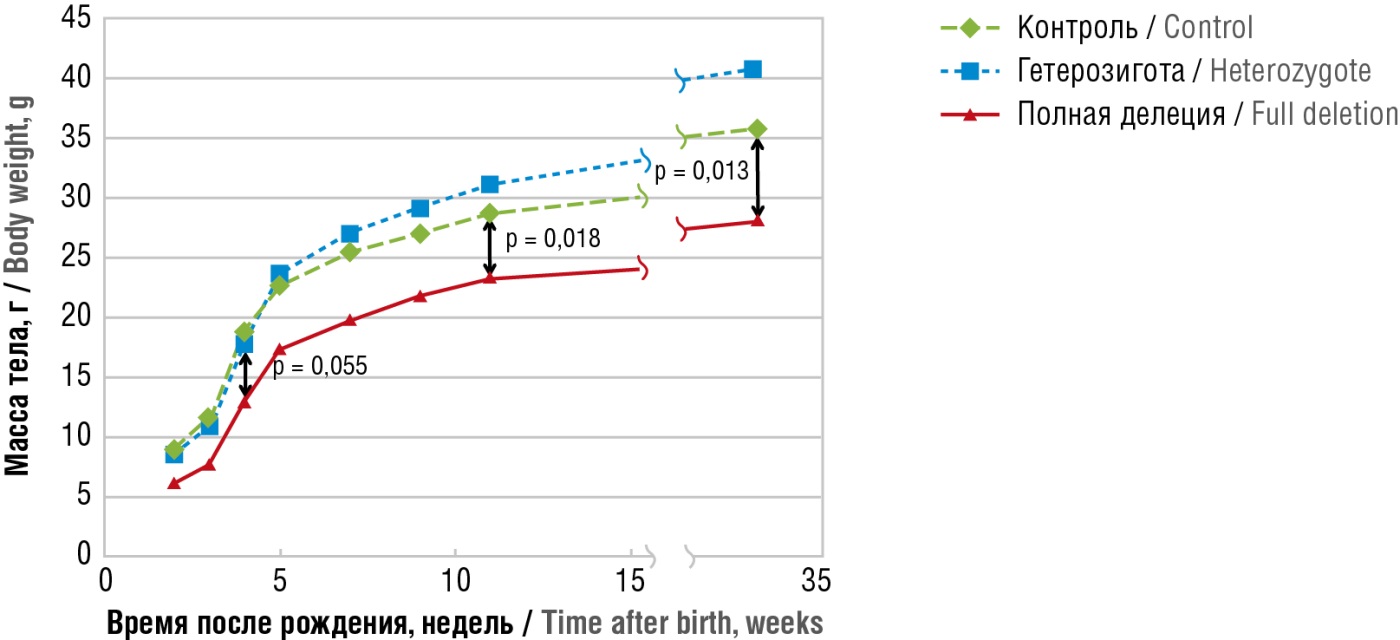
Рисунок 8. Скорость роста у самцов при делеции гена PGAP1 (адаптировано из [27]).
Примечание: PGAP1 – пост-GPI соединяющий белок-1; значения «р» для сравнений между особями дикого типа и нокаут-мышей – 0,0055 в 4 недели, 0,0175 – в 11 недель, 0,0132 – в 33 недели.
Figure 8. Growth rate in PGAP1 gene knockout male mice (аdapted from [27]).
Note: PGAP1 – post-GPI attachment protein-1; the p-values comparing wild-type vs. knockout mice: 0.0055 – at 4 weeks, 0.0175 – at 11 weeks, 0.0132 – at 33 weeks.
Важно отметить, что снижение фертильности животных с делецией PGAP1 было связано не со сниженным количеством сперматозоидов и не со снижением подвижности гамет, а с нарушением вхождения в маточные трубы и продвижения по ним (рис. 9). Такое нарушение оплодотворения, вероятно, связано с упоминавшейся выше взаимосвязью МИ/ДХИ со взаимодействием гамет с электрическими полями, направляющими движение клеток [28].
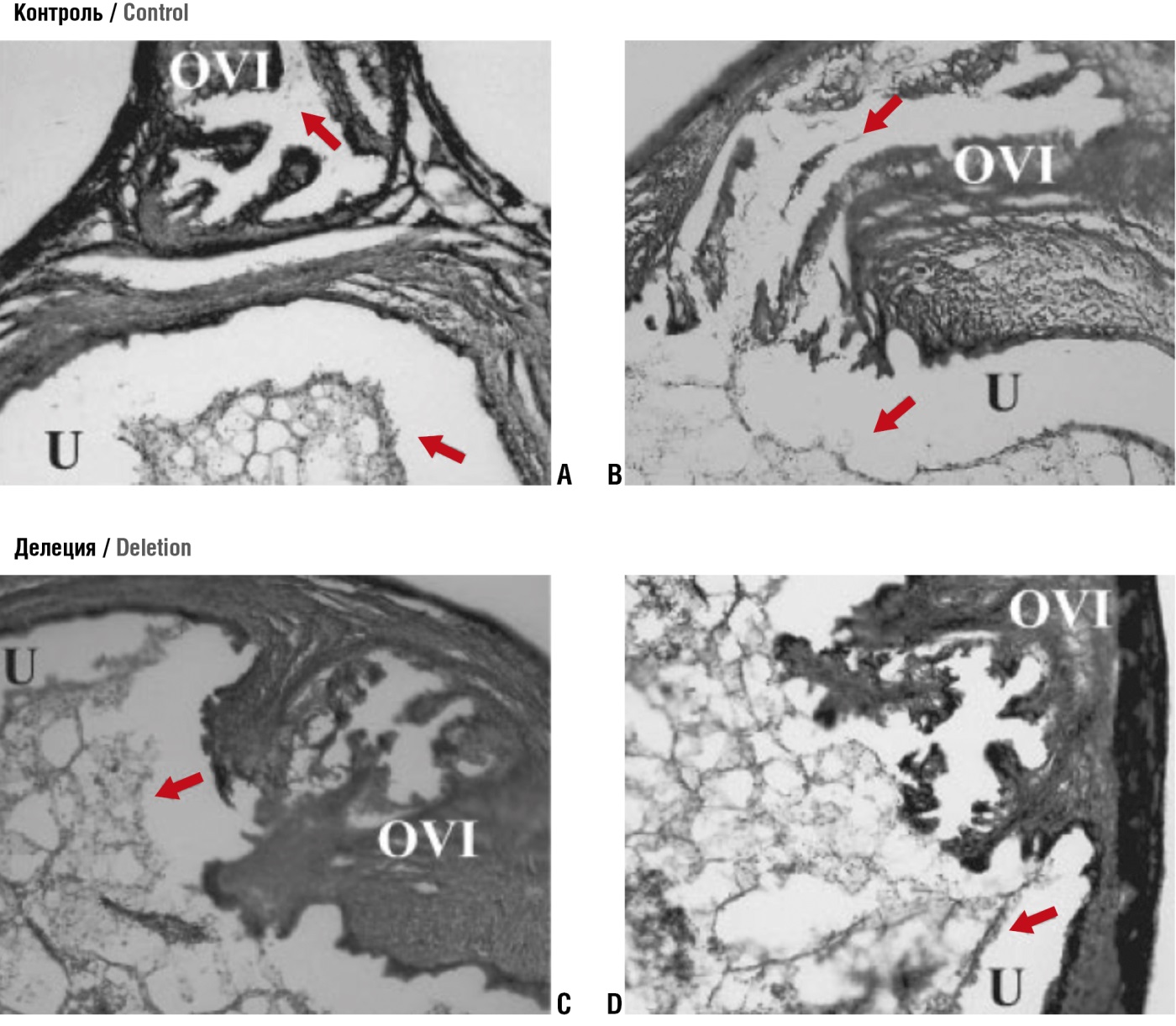
Рисунок 9. Отсутствие миграции сперматозоидов с делецией гена PGAP1 в маточной трубе. Восхождение спермы из матки (U) в маточную трубу (OVI) исследовалось при окрашивании гематоксилином и эозином (адаптировано из [28]).
Примечание: PGAP1 – пост-GPI соединяющий белок-1; А и В – норма; С и D – делеция гена. Стрелки обозначают сперматозоиды; при делеции гена не отмечено попадания сперматозоидов в маточные трубы.
Figure 9. No PGAP1 knockout sperm migration inside the fallopian tube. Sperm ascent from the uterus (U) to the fallopian tube (OVI) was examined using hematoxylin and eosin staining (adapted from [28]).
Note: PGAP1 – post-GPI attachment protein-1; A and B – normal; C and D – PGAP1 gene knockout. Arrows depict sperm; no sperm migration migration into the oviduct was observed in PGAP1 gene knockout mice.
Кроме того, при делеции гена PGAP1 сперматозоиды характеризуются слабым связыванием с zona pellucida. Так, мутантная форма спермы показала связывание 2,9 сперматозоидов на яйцо, в норме – 11,9 (р = 0,0001). Фертильность мутантной формы составила 2,7 % по сравнению с 51,0 % для нормальных сперматозоидов (рис. 10) [28].
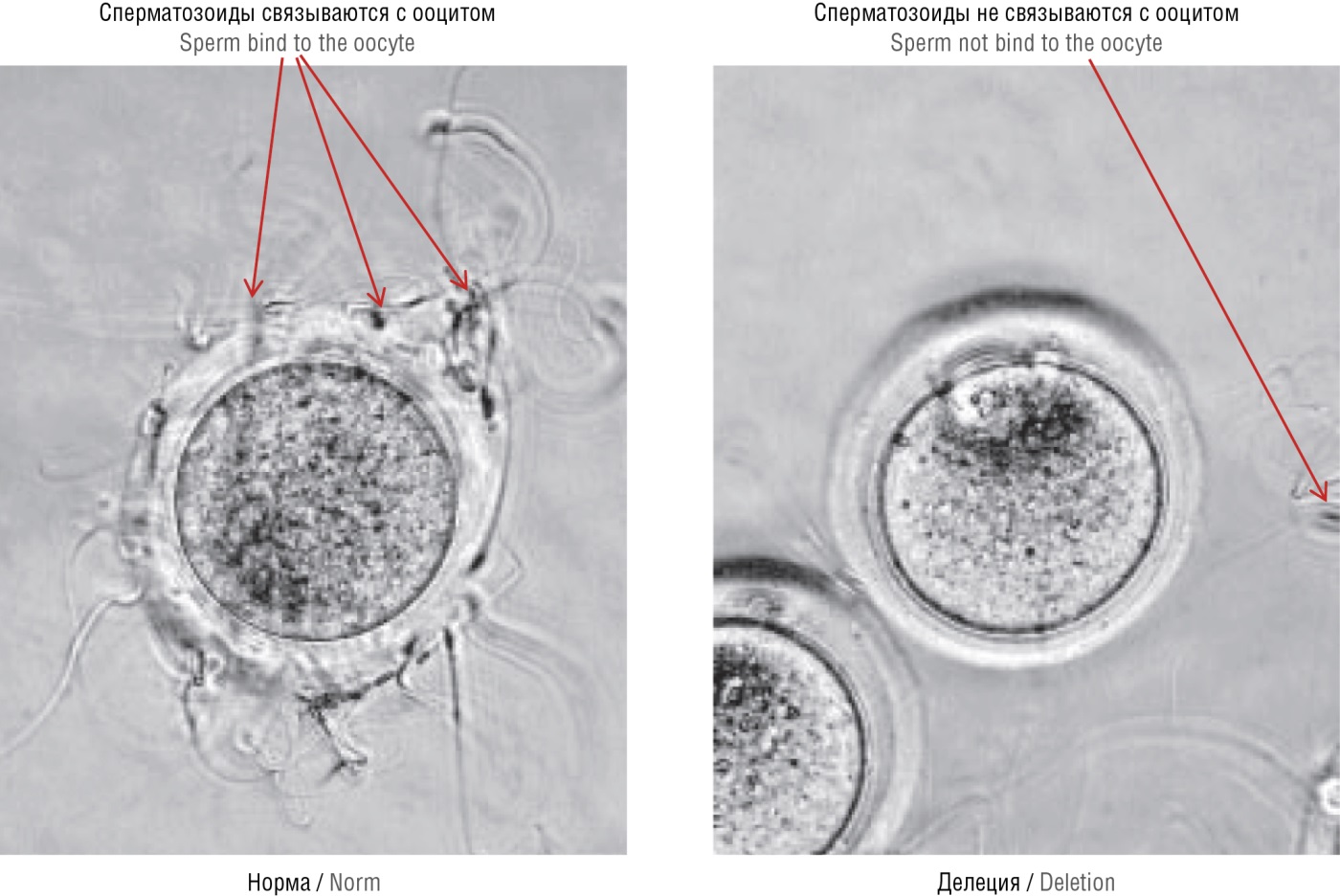
Рисунок 10. Нарушение связывания сперматозоидов с zona pellucida при делеции гена PGAP1, участвующего в формировании гликозилфосфатидил инозитоловых «якорей» белков (адаптировано из [28]).
Figure 10. Disrupted PGAP1 gene knockout sperm binding to the zona pellucida, which is involved in the formation of glycosylphosphatidylinositol "anchors" (adapted from [28]).
В целом, МИ/ДХИ-содержащие GPI-якоря играют важную роль в высвобождении внеклеточных белков во время капацитации, что позволяет сперматозоиду оплодотворять яйцеклетку. Обработка сперматозоидов фосфатидилинозитол-специфической фосфолипазой С (англ. рhosphatidylinositol-specific phospholipase С, PIPLC) приводит к расщеплению инозитоловых GPI-якорей этих белков – CD52 [29], GP20 [30] и др. и ухудшает фертильность спермы (рис. 11) [31].
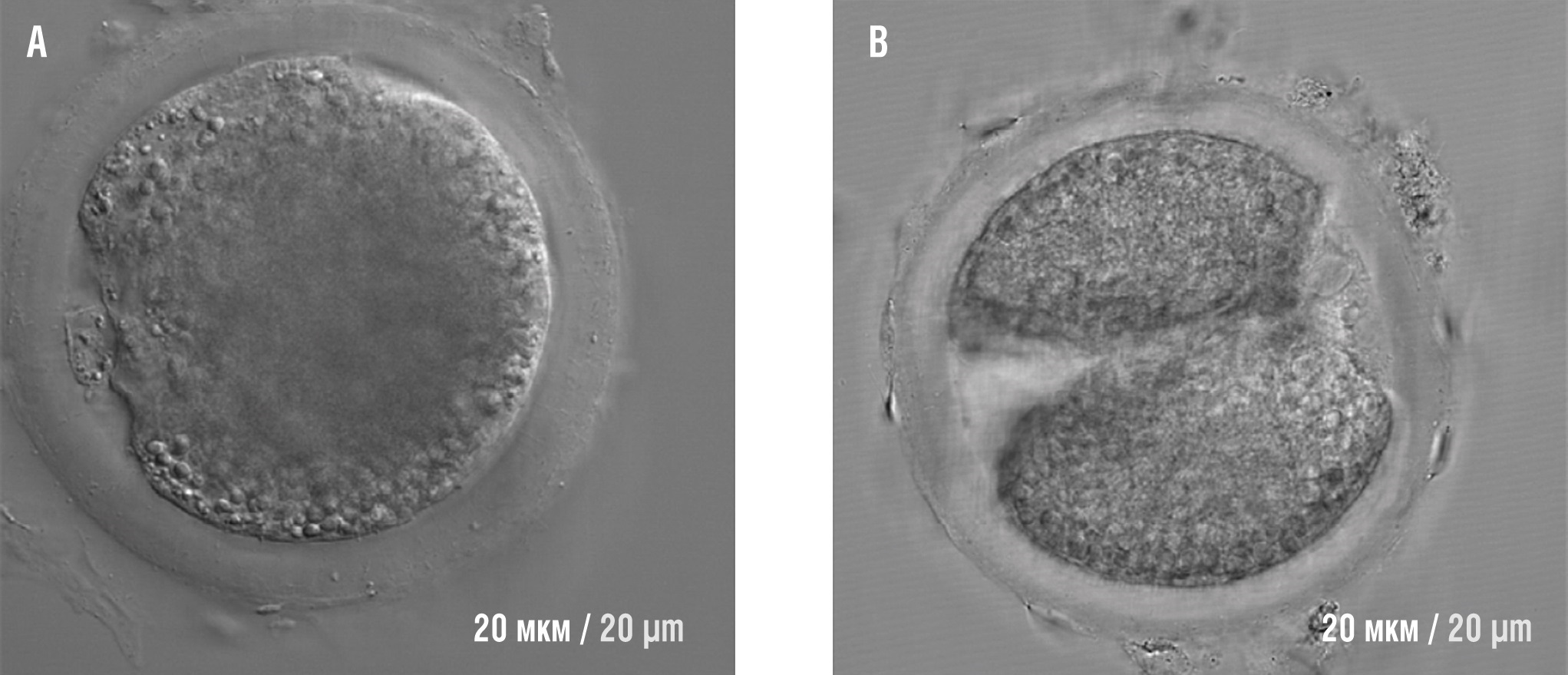
Рисунок 11. Обработка фосфатидилинозитол-специфической фосфолипазой С (PIPLC) поверхности сперматозоида разрушает миоинозитоловые «якоря» белков на его поверхности и резко снижает фертильность (адаптировано из [31]).
Примечание: А – обработка фосфолипазой PIPLC приводит к потере оплодотворения яйцеклеток (фертильность – 0 %); В – без обработки PIPLC, оплодотворенная яйцеклетка после первого деления (фертильность – 62 % ооцитов были оплодотворены); шкала – 20 микрон.
Figure 11. Exposure to рhosphatidylinositol-specific phospholipase С (PIPLC) destroys protein myoinositol "anchors" on sperm surface and profoundly affects fertility (adapted from [31]).
Note: A – phospholipase PIPLC treatment leads to loss of oocyte fertilization (fertility – 0 %); B – no PIPLC treatment, fertilized oocytes after the first division (fertility – 62 % of oocytes were fertilized); scale bar – 20 microns.
Миоинозитол/D-хироинозитол и подвижность сперматозоидов // Myoinositol/D-chiroinositol and sperm motility
Делеция МИ/ДХИ-зависимого гена инозитол-полифосфат-5-фосфатазы (англ. inositol polyphosphate 5-phosphatase, INPP5B) является одной из известных экспериментальных моделей глубокого дефицита МИ/ДХИ. Сперматозоиды с делецией INPP5B-/- характеризуются значительным снижением оплодотворения ооцитов даже с удаленной zona pellucida [32]. Делеция INPP5B-/- приводит к снижению параметров подвижности (табл. 1) и фертильности сперматозоидов (рис. 12), несмотря на то что капацитация и акросомная реакция происходят.
Таблица 1. Параметры спермограммы при делеции гена инозитол-полифосфат-5-фосфатазы (INPP5B-/-).
Table 1. Spermogram parameters in case of inositol polyphosphate-5-phosphatase gene knockout (INPP5B-/-) animals.
|
Параметр Parameter |
Норма Normal range |
INPP5B-/- |
Процент нормы Percentage of norm |
р |
|
N (в придатках), ×10⁶ / N (in appendages), ×10⁶ |
8,82 ± 2,40 |
4,71 ± 1,94 |
53,0 |
0,026 |
|
N (в матке), ×10⁶ / N (in the uterus), ×10⁶ |
1,16 ± 1,40 |
0,03 ± 0,05 |
2,5 |
0,11 |
|
Процент подвижных, % / Percentage of mobile, % |
85,0 |
61,0 |
71,0 |
0,032 |
|
Нелинейная скорость, мкм/с / Nonlinear velocity, µm/s |
121 ± 12 |
73 ± 20 |
59,0 |
0,0069 |
|
Прямолинейная скорость, мкм/с / Linear velocity, µm/s |
72 ± 7 |
37 ± 14 |
52,0 |
0,0043 |
|
Прогрессивная подвижность, мкм/с / Progressive motility, µm/s |
45 ± 6 |
20 ± 8 |
44,0 |
0,0029 |
|
Спонтанная акросомная реакция, % / Spontaneous acrosome reaction, % |
45 ± 28 |
51 ± 29 |
113,0 |
0,79 |
Примечание: N – количество сперматозоидов.
Note: N – sperm count.
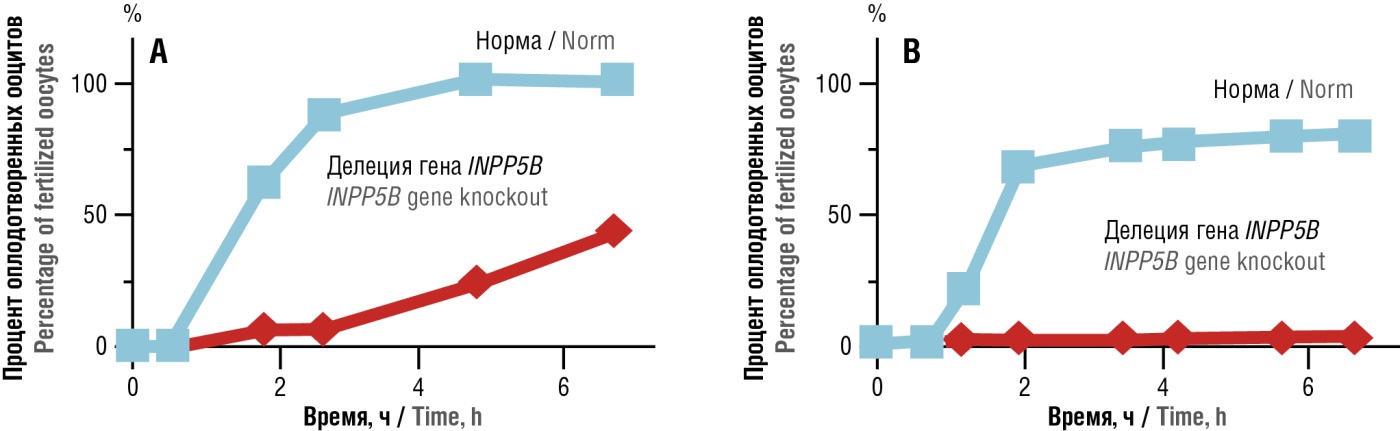
Рисунок 12. Процент ооцитов, оплодотворенных нормальными сперматозоидами и сперматозоидами с делецией гена инозитолполифосфат-5-фосфатазы (INPP5B-/-) (адаптировано из [33]).
Примечание: у 30–40 ооцитов была удалена zona pellucida, и их оплодотворяли сперматозоидами в концентрации 1,3×10⁶ клеток/мл (А) или 2,6×10⁶ клеток/мл (В). Каждые 2 часа определяли процент ооцитов, у которых отмечен характерный признак оплодотворения – второе полярное тельце.
Figure 12. Percentage of oocytes fertilized by wild type and inositol polyphosphate-5-phosphatase gene knockout (INPP5B-/-) sperm (adapted from [33]).
Note: the zona pellucida was removed in 30–40 oocytes followed by inseminating with sperm at a concentration of 1.3×10⁶ cells/ml (А) or 2.6×10⁶ cells/ml (В). Every 2 hours, the percentage of oocytes with typical sign of fertilization – a second polar body – was quantitated.
Кроме того, отмечено снижение уровня белка фертилина на поверхности сперматозоида, который в норме проходит протеолиз при прохождении придатков яичка. Отклонения в созревании и функционировании сперматозоидов при делеции гена INPP5B ассоциированы с нарушениями функционирования клеток Сертоли [33].
В эксперименте прием МИ улучшал показатели состояния сперматозоидов у крыс со стрептозотоциновой моделью сахарного диабета. Животные (n = 18) были разделены на 3 группы: контрольная (n = 6), диабет (n = 6) и диабет+МИ (300 мг/кг, 56 суток). В группе с диабетом количество сперматозоидов, их жизнеспособность и нормальная морфология значительно снизились наряду с более низкими уровнями супероксиддисмутазы, тестостерона, ФСГ и лютеинизирующего гормона (ЛГ). В группе, получавшей МИ, количество сперматозоидов, их жизнеспособность, морфология и подвижность значительно улучшились (р < 0,001) на фоне повышения уровней тестостерона, ЛГ и ФСГ (р < 0,001) [34].
Клинические данные по использованию миоинозитола и D-хироинозитола при мужском бесплодии / Clinical data on myoinositol and D-chiroinositol use in male infertility
Прием пациентами 550 мг/сут МИ + 300 мг/сут ДХИ (приблизительно 2:1) в течение 3 месяцев улучшал состояние плазматической мембраны, zona pellucida и цитоплазмы сперматозоидов [35]. МИ повышал подвижность сперматозоидов от пациентов с астенозооспермией за счет повышения мембранного потенциала митохондрий (МПМ) сперматозоидов – биофункционального параметра сперматозоидов, тесно связанного с их подвижностью. Образцы 15 пациентов с астенозооспермией и 15 здоровых мужчин с нормозооспермией инкубировали с возрастающими концентрациями ДХИ (75 и 750 мкг/мл) или с фосфатным буферным физиологическим раствором (30 минут). Инкубация гамет с ДХИ значительно улучшала МПМ, показывая, что ДХИ положительно влияет на функцию митохондрий сперматозоидов in vitro [36] (рис. 13).
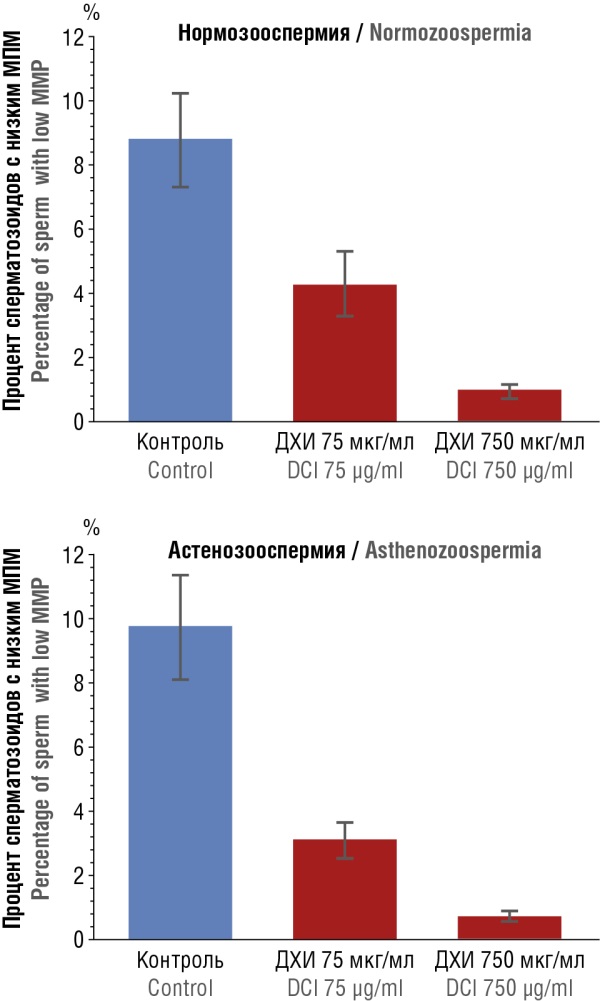
Рисунок 13. Влияние D-хироинозитола (ДХИ) на процент сперматозоидов с низким мембранным потенциалом митохондрий (МПМ) у мужчин с нормозооспермией и астенозооспермией [36].
Figure 13. The effect of D-chiroinositol (DCI) on percentage of sperm with low mitochondrial membrane potential (MMP) in normozoospermic and asthenozoospermic males [36].
Метаанализ 16 рандомизированных исследований подтвердил влияние МИ на улучшение качества спермы и результатов ЭКО: терапия МИ оказывала положительное влияние на показатели спермы (общее количество подвижных и прогрессивно подвижных сперматозоидов), а также на уровень тестостерона (рис. 14). Терапия МИ была ассоциирована со значительным увеличением общего количества подвижных сперматозоидов (0,90 у.е.; 95 % доверительный интервал (ДИ) = 0,34–1,46; p = 0,001) и прогрессивно подвижных сперматозоидов (1,48 у.е.; 95 % ДИ = 0,37–2,59; p = 0,008). Кроме того, наблюдалось значительное повышение уровня тестостерона (0,54 у.е.; 95 % ДИ = 0,34–0,73; p < 0,0001) и значительное снижение количества сперматозоидов с фрагментацией ДНК (–1,37 у.е.; 95 % ДИ от –2,43 до –0,32; p = 0,01) [37].
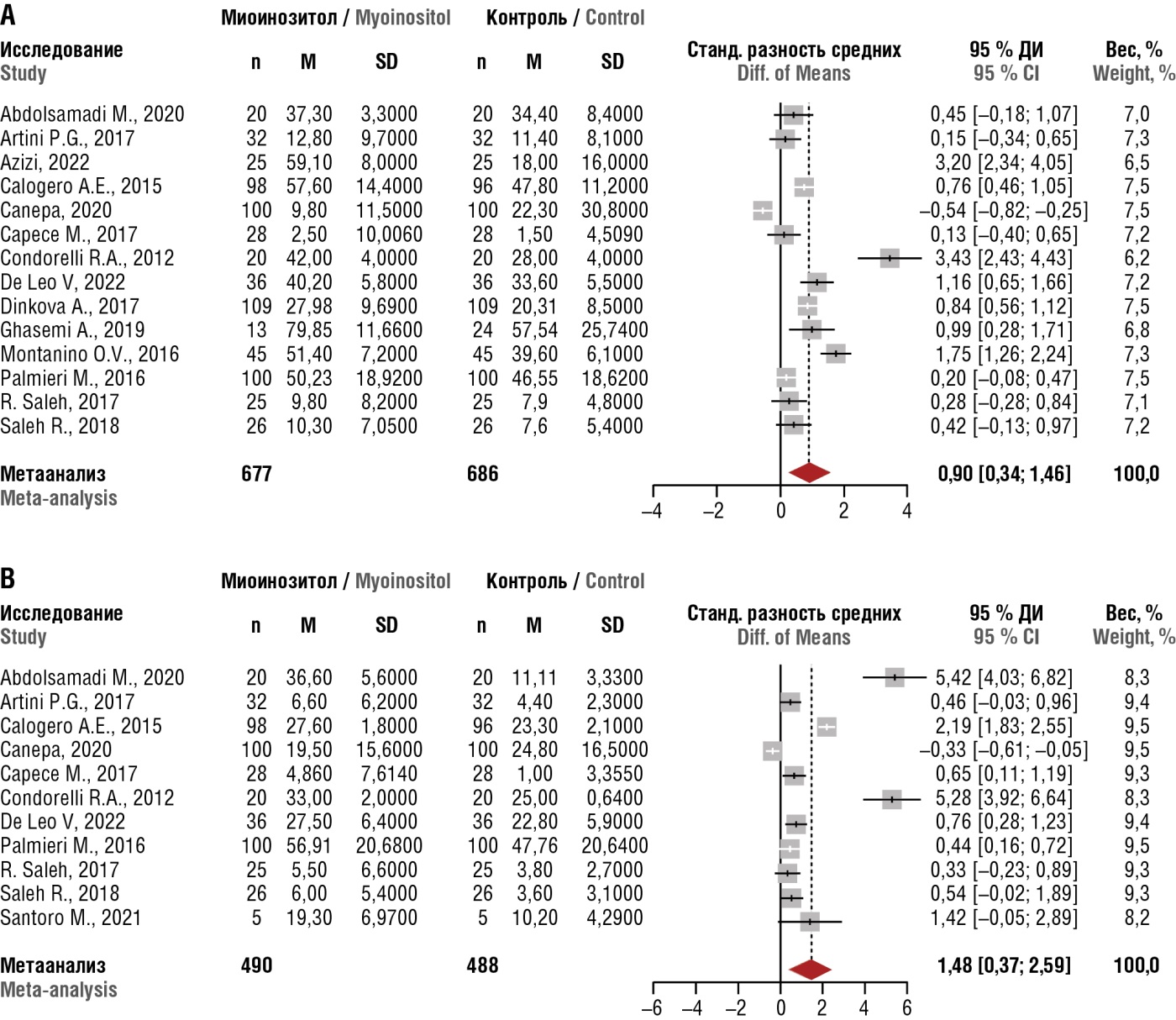
Рисунок 14. Результаты метаанализа клинического использования миоинозитола для повышения (А) общего количества подвижных сперматозоидов и (В) прогрессивно подвижных сперматозоидов [37].
Примечание: М – среднее; SD – стандартное отклонение; 95 % ДИ – 95 % доверительный интервал; вес – вес исследования как процент размера выборки.
Figure 14. A meta-analysis of myoinositol clinical use to increase (А) overall sperm motility and (В) progressive sperm motility [37].
Note: M – mean; SD – standard deviation; 95 % CI – 95 % confidence interval; weight – the weight of the study presented as a percentage of the sample size.
Миоинозитол улучшает подвижность и митохондриальную функцию сперматозоидов у пациентов с олигоастенотератозооспермией (ОАТС). Сперматозоиды от 20 пациентов с ОАТС и от 20 здоровых мужчин инкубировали в пробирке с 2 мг/мл МИ или плацебо (фосфатно-солевой буфер) в течение 2 часов (рис. 15). Были определены параметры спермограммы, цитометрия была использована для анализа МПМ. МИ значимо (р < 0,05) улучшал подвижность клеток от пациентов: общее количество подвижных (с 28 ± 4 % до 42 ± 4 %), прогрессивно подвижных (с 25 ± 1 % до 33 ± 2 %), процент сперматозоидов с нормальным МПМ (с 58 ± 4 % до 80 ± 2 %). Отметим, что в соответствии с критериями Всемирной организации здравоохранения нормальные значения для общего количества подвижных сперматозоидов > 40 % и > 32 % для прогрессивно подвижных [38].
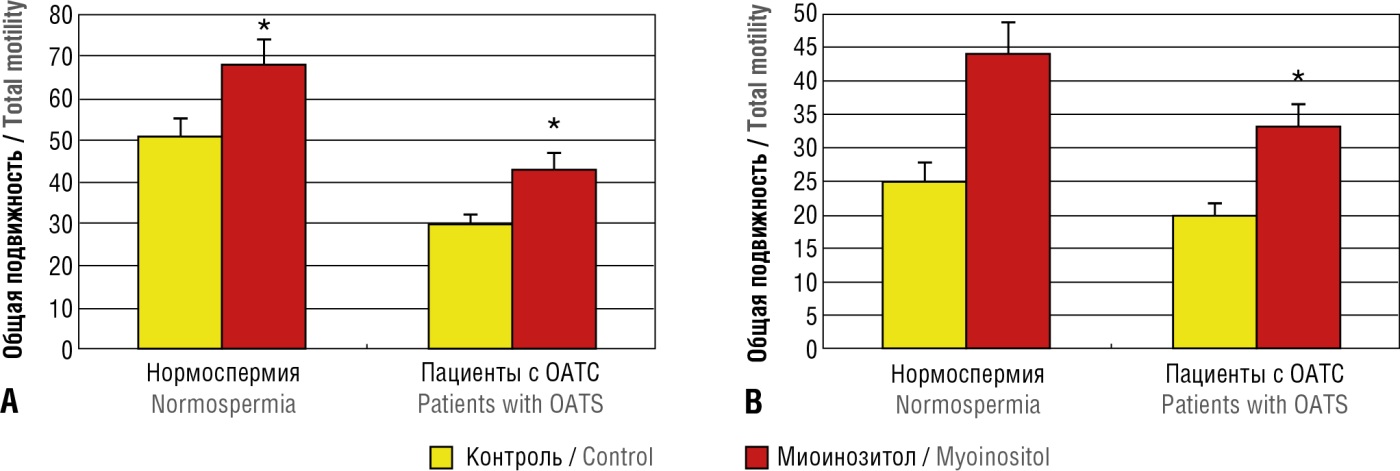
Рисунок 15. Количество прогрессивно подвижных сперматозоидов (А) и общее количество подвижных сперматозоидов (В) у 20 пациентов с олигоастенотератоспермией (ОАТС) и в контрольной группе (n = 20) до и после инкубации с миоинозитолом в течение 2 часов (адаптировано из [38]).
Figure 15. Progressive (А) and total (В) sperm motility in 20 patients with oligoasthenoteratospermia (OATS) and in control group (n = 20) before and after two-hour-long incubation with myoinositol (adapted from [38]).
Марганец в поддержке функции гамет / Manganese in supporting gamete function
В настоящее время диагностирование мужского бесплодия основано на оценке показателей семенной жидкости, количества и качества сперматозоидов. Достаточно высокая частота диагностических ошибок свидетельствует о необходимости использования дополнительных биомаркеров в оценке функции сперматозоидов.
Такими биомаркерами являются уровни определенных микроэлементов. Микроэлементы являются жизненно важными компонентами для улучшения работы мужской репродуктивной системы из-за их участия в антиоксидантных и клеточных сигнальных путях [39].
Например, сравнение содержания микроэлементов у самцов стерильных мышей с делецией гена PМСА4 (кодирует Ca²⁺-АТФазу плазматической мембраны гамет) со здоровыми животными показало выраженные изменения в профилях эссенциальных элементов, особенно с антиоксидантыми свойствами (железо, марганец, селен, медь и цинк). Микроэлементный анализ образцов спермы (в том числе на содержание марганца) может быть весьма полезен для оценки жизнеспособности гамет [40].
Систематический анализ молекулярной физиологии марганца позволил выявить 27 молекулярных механизмов и 35 патологий, коморбидных нарушениям гомеостаза этого микроэлемента. Ионы марганца необходимы не только для поддержания менструального цикла, структуры соединительной ткани у беременной и плода, системы антиоксидантной защиты и лечения железодефицитной анемии, но и для поддержки функционирования гамет [41].
Марганец играет центральную роль в активации секреции репродуктивных гормонов и полового созревания у самцов крыс. В экспериментах in vitro наблюдалась дозозависимая стимуляция секреции ЛГ-рилизинг-гормона (ЛГРГ) медиальным базальным гипоталамусом, а введение антагониста рецепторов ЛГРГ in vivo блокировало вызванное марганцем высвобождение ЛГ. Когда мышам вводили MnCl2 (25 мкг/кг per os, с 15-х по 55-е сутки), у животных наблюдалось повышение уровней ЛГ (p < 0,05), ФСГ (p < 0,01) и тестостерона (p < 0,01) (рис. 16). Кроме того, наблюдалось сопутствующее увеличение суточной продукции спермы (p < 0,05) и эффективности сперматогенеза (p < 0,05), что свидетельствует об ускорении сперматогенеза в присутствии марганца [42].
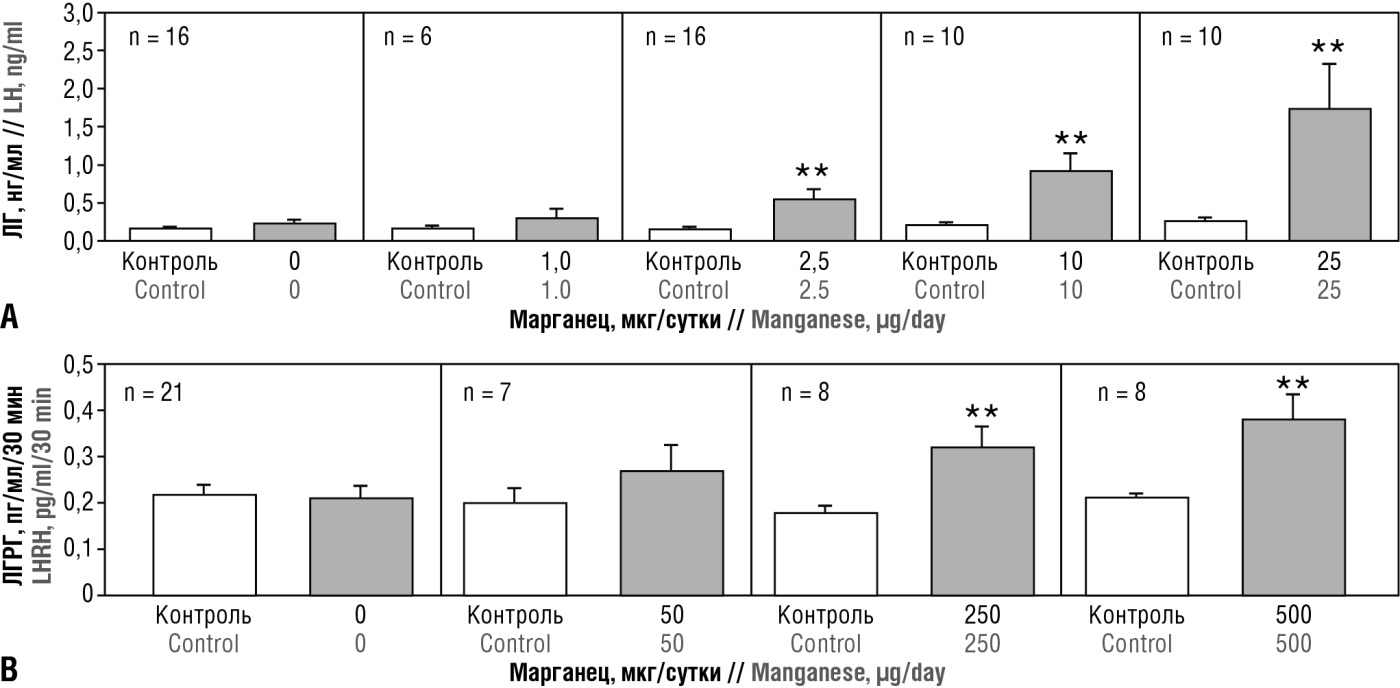
Рисунок 16. Влияние введения MnCl2 на секрецию лютеинизирующего гормона (ЛГ) и высвобождение ЛГ-рилизинг-гормона (ЛГРГ) у неполовозрелых самцов крыс на поздней ювенильной фазе развития (адаптировано из [42]).
Примечание: столбцы отображают базальный и стимулированный уровни ЛГ в сыворотке крови. Животным вводили либо физиологический раствор (0), либо указанную дозу соли марганца. У животных, получавших дозу ≥ 2,5 мкг MnCl2, наблюдалось значительное увеличение секреции ЛГ и ЛГРГ по сравнению с базальным уровнем. Значения представлены как среднее значение ± стандартная ошибка среднего; **p < 0,01 – различия статистически значимы по сравнению с контролем.
Figure 16. Effect of MnCl2 administration on luteinizing hormone (LH) secretion and LH-releasing hormone (LHRH) release in immature male rats at the late juvenile stage (adapted from [42]).
Note: bars depict baseline and stimulated serum LH levels. Animals were treated with either saline (0) or the indicated dose of manganese salt. Animals treated with ≥ 2.5 μg MnCl2 showed significantly increased LH and LHRH secretion compared with baseline levels. Values are presented as mean ± SEM; **p < 0.01 – significant differences compared to the control.
Исследование различных фармацевтических форм меди, цинка и марганца (сульфаты, гидроксихлориды, аминохелаты), скармливаемых баранам, указало на воздействия марганца на концентрацию тестостерона в плазме и на характеристики спермы. Концентрация тестостерона в плазме, активность антиоксидантных ферментов семенной плазмы и общая антиоксидантная емкость были выше (p < 0,05) в группах гидроксихлорида и аминохелата марганца, тогда как в группе сульфата марганца не было значительных изменений со дня 0, в то время как в контроле значения снизились (p < 0,05). С 42-го дня в группах гидроксихлорида и аминохелата марганца подвижность, жизнеспособность и функциональность мембран сперматозоидов улучшились (p < 0,05), а в контроле снизились (p < 0,05). В контрольной группе установлен самый высокий процент морфологически аномальных сперматозоидов на 70‑й день эксперимента (p < 0,05), а в группе аминохелата марганца найдено наименьшее число апоптотических сперматозоидов [43].
Добавление наносукцинатов марганца, цинка или меди к замораживающему разбавителю улучшало некоторые характеристики спермы баранов после размораживания. Например, добавление 5,0 мкг/л наносукцината Mn²⁺ значительно увеличило количество прогрессивно подвижных сперматозоидов и общую кинетику движения сперматозоидов на фоне повышения активности глутатионпероксидаз и каталаз, что важно для сохранения структурной целостности гамет [44].
Дотации марганца влияют на целостность мембран и мембранный потенциал митохондрий спермы быков. Шестьдесят быков Bos taurus indicus в возрасте 18–20 месяцев были случайным образом разделены на 4 группы по 15 особей, получавших диету, обогащенную марганцем, в течение 70 суток. Уровень Mn²⁺ в сперме положительно коррелировал с частотой неповрежденных сперматозоидов и отрицательно коррелировал с количеством поврежденных сперматозоидов и гамет с низким МПМ. Дотации марганца в рационе быков должны быть ограничены дозой 540 мкг/кг, так как более высокие дозы пагубно влияли на целостность плазматических и акросомальных мембран сперматозоидов [45].
Фолаты в поддержке функции гамет / Folates in supporting gamete function
Фолаты (витамин В9) участвуют в биосинтезе и метилировании геномной ДНК, различных видов РНК и белков, тем самым будучи принципиально важными для роста и развития клеток. Дефицит фолатов связан с мужской субфертильностью и с нарушениями сперматогенеза, в том числе через повышение гомоцистеина – характерной особенности фолатного дефицита [46]. Установлено влияние уровней фолатов в крови, витаминов B12, D3 и E, мелатонина в фолликулярной жидкости, полученной методом ИКСИ, на беременность [47].
В эксперименте низкое содержание фолатов в рационе отрицательно влияло на сперматогенез мышей: общее количество сперматозоидов значительно снижалось (p < 0,001), а количество сперматозоидов с дефектами головки значительно увеличивалось (p < 0,05). Дефицит фолатов в среде культивации сперматозоидов in vitro вызывает дисфункцию сборки митотического веретена, способствуя хромосомной нестабильности при делении клеток. По сравнению с условиями достаточного содержания фолата в среде культивации (2000 нМ), гаметоциты, культивируемые с 0, 20 или 200 нМ фолата, демонстрировали дозозависимую задержку роста и усиление апоптоза [48].
Дефекты метилирования ДНК сперматозоидов у мышей с мутацией 5,10-метилентетрагидрофолатредуктазы (MTHFR 677C>T) могут быть скорректированы приемом фолиевой кислоты. Хорошо известно, что распространенный у людей генетический вариант MTHFR 677C>T связан с пониженной активностью этого фермента и с различными нарушениями, в том числе с мужским бесплодием. В сперме мышей с генотипом 677TT установлено существование 360 фрагментов генома, дифференциально метилированных по сравнению с мышами 677CC. Было обнаружено, что добавление фолиевой кислоты частично корректирует нарушения метилирования ДНК в сперматозоидах, связанные с генотипом 677TT [49].
В эксперименте фолиевая кислота, проявляя детоксикационные свойства, способствует восстановлению нормальной репродуктивной функции белых мышей-самцов, подвергшихся воздействию ядов: бисфенола А [50] или ацетамиприда [51]. Как известно, фенолы и их различные производные (бисфенолы, парабены и др.) вмешиваются в гомеостаз эстрогенов, стимулируют онкогенез и тератогению [52]. Совместный прием пищевого сульфата цинка и фолиевой кислоты улучшает объем яичек и гемодинамику, уровень тестостерона и качество спермы у баранов в условиях теплового стресса [53].
У мужчин с бесплодием показана взаимосвязь целостности ДНК сперматозоидов с уровнями фолатов и витамина В12 в сыворотке крови. Уровень фолатов в сыворотке положительно коррелировал с количеством прогрессивно подвижных сперматозоидов и индексом фрагментации ДНК гамет от мужчин с бесплодием. Сравнение стандартных показателей спермы между двумя группами пациентов по концентрации фолатов (< 4,8 нг/мл и > 4,8 нг/мл) показало значительно более высокую концентрацию сперматозоидов и прогрессивно подвижных сперматозоидов в группе с более высокими уровнями фолатов в крови [54].
Метаанализ 50 клинических исследований подтвердил, что добавление цинка и фолиевой кислоты повышало концентрацию сперматозоидов [55]. Метаанализ 8 рандомизированных исследований (n = 2168) показал, что фолиевая кислота значительно увеличивала подвижность сперматозоидов (стандартное отклонение (SD) = 3,63 у.е.; 95 % ДИ = –1,22–6,05; р = 0,003) и улучшала морфологию сперматозоидов (SD = –0,02 у.е.; 95 % ДИ = –0,29–0,24; р = 0,86) у бесплодных мужчин [56].
Таким образом, МИ, ДХИ, фолаты и ионы марганца принимают важное участие в сперматогенезе и в оплодотворении (рис. 17). В начале сперматогенеза пул стволовых клеток и его микроокружение поддерживается и регулируется посредством межклеточных взаимодействий, pH, концентрациями ионов электролитов. Клетки Сертоли в эпителии семенных канальцев играют важную роль в развитии гаметоцитов, обеспечивая структурную и питательную поддержку. Электролит-ионы Na⁺, Cl⁻, HCO3⁻, K⁺, Ca²⁺, Mg²⁺ переносятся через различные мембранные насосы, ионные каналы и аквапорины, обеспечивая надлежащий ионный состав, осмолярность и pH жидкости во время сперматогенеза и оплодотворения. Концентрации этих ионов и соответствующие показатели электрического поля изменяются по ходу морфологического развития гаметоцитов [57].
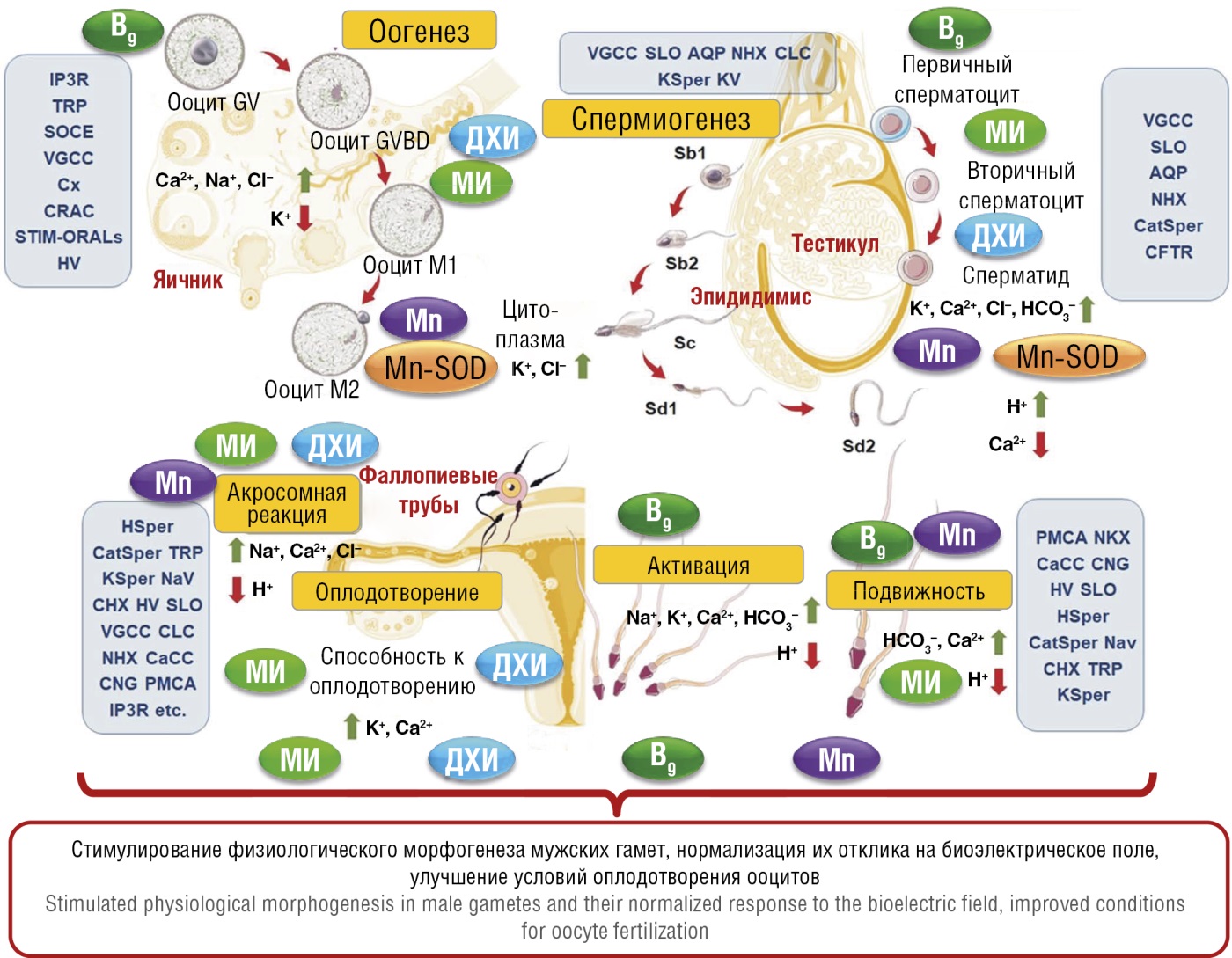
Рисунок 17. Ионные каналы и микронутриенты, участвующие в стадиях развития и созревания гаметоцитов и в оплодотворении [57].
Примечание: AQP – аквапорин; CaCC – активируемые Ca²⁺ каналы Cl⁻; CHX – обменник Ca²⁺/H⁺; CRAC – активируемые высвобождением Ca²⁺ каналы; HSper – канал H⁺ сперматозоидов; NKX – обменник Na⁺/K⁺; CatSper – катионный канал сперматозоидов; KSper – канал K⁺ сперматозоидов; SLO – специфический канал K⁺ сперматозоидов; SOCE – управляемый депо вход Ca²⁺; STIM-ORAI – управляемые депо кальциевые каналы ORAI; TRP – канал транзитного рецепторного потенциала; VGCC – потенциалзависимый канал Ca²⁺; HV – потенциалзависимый канал H⁺; KV – потенциалзависимый канал K⁺; NaV – потенциалзависимый канал Na⁺; CLC – потенциалзависимые Cl⁻-каналы; CFTR – муковисцидозные трансмембранные регуляторы проводимости Cl⁻-каналов; CNG – циклические нуклеотидзависимые каналы; PMCA – Ca²⁺-АТФаза плазматической мембраны; IP3R – IP3 (инозитол-3-фосфатные) рецепторы; Cx – коннексин; GV – зародышевый пузырек; GVBD – разрыв зародышевого пузырька; ооцит M2 – ооцит отделился от полярного тельца, созрел и готов к оплодотворению или криоконсервации, это средняя степень зрелости ооцита; Sb, Sd – стадии созревания сперматозоидов; Mn-SOD – Mn-супероксиддисмутаза.
Figure 17. Ion channels and micronutrients involved in gametocyte development and maturation as well as fertilization [57].
Note: AQP – aquaporin; CaCC – Ca²⁺-activated Cl⁻ channels; CHX – Ca²⁺/H⁺ exchanger; CRAC – Ca²⁺ release-activated channels; HSper – sperm H⁺ channel; NKX – Na⁺/K⁺ exchanger; CatSper – sperm cation channel; KSper – sperm K⁺ channel; SLO – sperm-specific K⁺ channel; SOCE – store-operated Ca²⁺ entry; STIM-ORAI – store-operated calcium channels ORAI; TRP – transit receptor potential channel; VGCC – voltage-gated Ca²⁺ channel; HV – voltage-gated H⁺ channel; KV – voltage-gated K⁺ channel; NaV – voltage-gated Na⁺ channel; CLC – voltage-gated Cl⁻ channels; CFTR – cystic fibrosis transmembrane conductance regulator; CNG – cyclic nucleotide-gated channels; PMSA – plasma membrane Ca²⁺-ATPase; IP3R – inositol trisphosphate receptors; Cx – connexin; GV – germinal vesicle; GVBD – germinal vesicle breakdown; ооцит M2 – M2 oocyte; Sb, Sd – sperm maturation stages; Mn-SOD – Mn-superoxide dismutase.
В России зарегистрирован витаминно-минеральный комплекс Дикироген® (Pizeta Pharma S.p.A., Италия), включающий 1000 мг МИ и 200 мг ДХИ (т.е. в соотношении 5:1), фолиевую кислоту (200 мкг) и Mn (5 мг). Дикироген® рекомендован для улучшения функционального состояния женской репродуктивной системы, в том числе при нарушениях менструального цикла и в период прегравидарной подготовки, в том числе при подготовке к ЭКО, применении вспомогательных репродуктивных технологий. Дикироген® рекомендован для улучшения функционального состояния мужской репродуктивной системы, в том числе при снижении фертильности, при ухудшении качества спермы (патозооспермии). Mn в составе средства Дикироген® представлен в виде органической соли (пироглутамата марганца), характеризующейся хорошими органолептическими свойствами, высокой биодоступностью и низкой токсичностью [10]. Пироглутамат-анион повышает биодоступность марганца, способствуя эффективному транспорту ионов Mn²⁺ в клетки, также проявляя нейропротекторные, антигипертензивные, антидепрессивные свойства и др. [41].
Заключение / Conclusion
Важным фактором мужского бесплодия является дефицит витаминов и микроэлементов. В настоящей работе систематизированы результаты исследований МИ, ДХИ, их фармакодинамических синергистов (ионы марганца, фолаты) в поддержании структуры и функционирования мужских гамет. МИ и ДХИ улучшают подвижность сперматозоидов и функцию митохондрий посредством участия в сигнальных каскадах рецепторов репродуктивных гормонов, что нормализует обмен андрогенов, и способствуют профилактике инсулинорезистентности. МИ и ДХИ оказывают воздействие на вызревание/функционирование сперматозоидов, общее количество подвижных и прогрессивно подвижных сперматозоидов, восприятие биоэлектрических полей и процесс оплодотворения ооцитов. Клинические данные по использованию МИ и ДХИ при мужском бесплодии указывают на улучшение состояния zona pellucida, плазматической мембраны, цитоплазмы и рецепции сперматозоидов. Ионы марганца важны для функции гамет посредством влияния на концентрацию тестостерона, повышение активности антиоксидантных ферментов и МПМ. Фолаты, снижая уровни гаметотоксичного гомоцистеина, способствуют сохранению целостности ДНК сперматозоидов. Перспективно назначение МИ/ДХИ в сочетании с органическими солями марганца и фолатами пациентам с идиопатической патоспермией, а также на фоне нарушения обмена углеводов (инсулинорезистентности), ожирения и в условиях действия факторов, повышающих оксидативный стресс.
Список литературы
1. De Luca M.N., Colone M., Gambioli R. et al. Oxidative stress and male fertility: role of antioxidants and inositols. Antioxidants (Basel). 2021;10(8):1283. https://doi.org/10.3390/antiox10081283.
2. Etrusco A., Laganà A.S., Chiantera V. et al. Myo-inositol in assisted reproductive technology from bench to bedside. Trends Endocrinol Metab. 2024;35(1):74–83. https://doi.org/10.1016/j.tem.2023.09.005.
3. Carlomagno G., Nordio M., Chiu T.T., Unfer V. Contribution of myo-inositol and melatonin to human reproduction. Eur J Obstet Gynecol Reprod Biol. 2011;159(2):267–72. https://doi.org/10.1016/j.ejogrb.2011.07.038.
4. Colazingari S., Treglia M., Najjar R., Bevilacqua A. The combined therapy myo-inositol plus D-chiro-inositol, rather than D-chiro-inositol, is able to improve IVF outcomes: results from a randomized controlled trial. Arch Gynecol Obstet. 2013;288(6):1405–11. https://doi.org/10.1007/s00404-013-2855-3.
5. Lisi F., Carfagna P., Oliva M.M. et al. Pretreatment with myo-inositol in non-polycystic ovary syndrome patients undergoing multiple follicular stimulation for IVF: a pilot study. Reprod Biol Endocrinol. 2012;10:52. https://doi.org/10.1186/1477-7827-10-52.
6. Chiu T.T., Rogers M.S., Briton-Jones C., Haines C. Effects of myo-inositol on the in-vitro maturation and subsequent development of mouse oocytes. Hum Reprod. 2003;18(2):408–16. https://doi.org/10.1093/humrep/deg113.
7. Chauvin T.R., Griswold M.D. Characterization of the expression and regulation of genes necessary for myo-inositol biosynthesis and transport in the seminiferous epithelium. Biol Reprod. 2004;70(3):744–51. https://doi.org/10.1095/biolreprod.103.022731.
8. Hinton B.T., White R.W., Setchell B.P. Concentrations of myo-inositol in the luminal fluid of the mammalian testis and epididymis. J Reprod Fertil. 1980;58(2):395–9. https://doi.org/10.1530/jrf.0.0580395.
9. Громова О.А., Богачева Т.Е., Торшин И.Ю. и др. Метаболическое моделирование жировой болезни печени – фактора для проградиентного течения синдрома поликистозных яичников. Вопросы гинекологии, акушерства и перинатологии. 2025;24(1):120–31. https://doi.org/10.20953/1726-1678-2025-1-120-131.
10. Громова О.А., Торшин И.Ю., Тетруашвили Н.К. Перспективы применения экзогенных инозитолов для поддержания состояния кожи, волос и ногтей. Гинекология. 2022;24(4):261–70. https://doi.org/10.26442/20795696.2022.4.201824.
11. Condorelli R.A., Cannarella R., Crafa A. et al. Advances in non-hormonal pharmacotherapy for the treatment of male infertility: the role of inositols. Expert Opin Pharmacother. 2022;23(9):1081–90. https://doi.org/10.1080/14656566.2022.2060076.
12. Niroomand M.J., Farahavar A., Aliarabi H., Yavari M. Ram semen response to сryopreservation with extender subjected to ultrasonic vibration and myo-inositol enrichment. Reprod Domest Anim. 2025;60(7):e70091. https://doi.org/10.1111/rda.70091.
13. Dinicola S., Unfer V., Facchinetti F. et al. Inositols: from established knowledge to novel approaches. Int J Mol Sci. 2021;22(19):10575. https://doi.org/10.3390/ijms221910575.
14. Condorelli R.A., La Vignera S., Di Bari F. et al. Effects of myoinositol on sperm mitochondrial function in-vitro. Eur Rev Med Pharmacol Sci. 2011;15(2):129–34.
15. Condorelli R.A., La Vignera S., Bellanca S. et al. Myoinositol: does it improve sperm mitochondrial function and sperm motility? Urology. 2012;79(6):1290–5. https://doi.org/10.1016/j.urology.2012.03.005.
16. Riera M.F., Galardo M.N., Pellizzari E.H. et al. Participation of phosphatidyl inositol 3-kinase/protein kinase B and ERK1/2 pathways in interleukin-1beta stimulation of lactate production in Sertoli cells. Reproduction. 2007;133(4):763–73. https://doi.org/10.1530/rep.1.01091.
17. Bahat A., Eisenbach M. Human sperm thermotaxis is mediated by phospholipase C and inositol trisphosphate receptor Ca2+ channel. Biol Reprod. 2010;82(3):606–16. https://doi.org/10.1095/biolreprod.109.080127.
18. Amdani S.N., Jones C., Coward K. Phospholipase C zeta (PLCζ): oocyte activation and clinical links to male factor infertility. Adv Biol Regul. 2013;53(3):292–308. https://doi.org/10.1016/j.jbior.2013.07.005.
19. Kashir J., Jones C., Lee H.C. et al. Loss of activity mutations in phospholipase C zeta (PLCζ) abolishes calcium oscillatory ability of human recombinant protein in mouse oocytes. Hum Reprod. 2011;26(12):3372–87. https://doi.org/10.1093/humrep/der336.
20. Kuroda Y., Kaneko S., Yoshimura Y. et al. Are there inositol 1,4,5-triphosphate (IP3) receptors in human sperm? Life Sci. 1999;65(2):135–43. https://doi.org/10.1016/s0024-3205(99)00230-1.
21. Saunders C.M., Swann K., Lai F.A. ФЛС-ζeta, a sperm-specific PLC and its potential role in fertilization. Biochem Soc Symp. 2007;(74):23–36. https://doi.org/10.1042/BSS0740023.
22. Ickowicz D., Finkelstein M., Breitbart H. Mechanism of sperm capacitation and the acrosome reaction: role of protein kinases. Asian J Androl. 2012;14(6):816–21. https://doi.org/10.1038/aja.2012.81.
23. Dumollard R., Marangos P., Fitzharris G. et al. Sperm-triggered [Ca2+] oscillations and Ca2+ homeostasis in the mouse egg have an absolute requirement for mitochondrial ATP production. Development. 2004;131(13):3057–67. https://doi.org/10.1242/dev.01181.
24. Blackmore P.F. Extragenomic actions of progesterone in human sperm and progesterone metabolites in human platelets. Steroids. 1999;64(1–2):149–56. https://doi.org/10.1016/s0039-128x(98)00109-3.
25. Aquila S., Gentile M., Middea E. et al. Leptin secretion by human ejaculated spermatozoa. J Clin Endocrinol Metab. 2005;90(8):4753–61. https://doi.org/10.1210/jc.2004-2233.
26. Kawai T., Morioka S., Miyata H. et al. The significance of electrical signals in maturing spermatozoa for phosphoinositide regulation through voltage-sensing phosphatase. Nat Commun. 2024;15(1):7289. https://doi.org/10.1038/s41467-024-51755-2.
27. Kooyman D.L., Byrne G.W., Logan J.S. Glycosyl phosphatidylinositol anchor. Exp Nephrol. 1998;6(2):148–51. https://doi.org/10.1159/000020516.
28. Ueda Y., Yamaguchi R., Ikawa M. et al. PGAP1 knock-out mice show otocephaly and male infertility. J Biol Chem. 2007;282(42):30373–80. https://doi.org/10.1074/jbc.M705601200.
29. Xue J., Guo Z. Convergent synthesis of a GPI containing an acylated inositol. J Am Chem Soc. 2003;125(52):16334–9. https://doi.org/10.1021/ja0382157.
30. Flori F., Giovampaola C.D., Focarelli R. et al. Epitope analysis of immunoglobulins against gp20, a GPI-anchored protein of the human sperm surface homologous to leukocyte antigen CD52. Tissue Antigens. 2005;66(3):209–16. https://doi.org/10.1111/j.1399-0039.2005.00463.x.
31. Boerke A., van der Lit J., Lolicato F. et al. Removal of GPI-anchored membrane proteins causes clustering of lipid microdomains in the apical head area of porcine sperm. Theriogenology. 2014;81(4):613–24. https://doi.org/10.1016/j.theriogenology.2013.11.014.
32. Marcello M.R., Evans J.P. Multivariate analysis of male reproductive function in Inpp5b-/- mice reveals heterogeneity in defects in fertility, sperm-egg membrane interaction and proteolytic cleavage of sperm ADAMs. Mol Hum Reprod. 2010;16(7):492–505. https://doi.org/10.1093/molehr/gaq029.
33. Hellsten E., Evans J.P., Bernard D.J. et al. Disrupted sperm function and fertilin beta processing in mice deficient in the inositol polyphosphate 5-phosphatase Inpp5b. Dev Biol. 2001;240(2):641–53. https://doi.org/10.1006/dbio.2001.0476.
34. Kiani M., Mehranjani M.S., Shariatzadeh M.A. Myoinositol improves sperm parameters in diabetic rats by reducing oxidative stress and regulating apoptosis-related genes. J Mol Histol. 2025;56(3):165. https://doi.org/10.1007/s10735-025-10451-1.
35. Mendoza N., Galan M.I., Molina C. et al. High dose of d-chiro-inositol improves oocyte quality in women with polycystic ovary syndrome undergoing ICSI: a randomized controlled trial. Gynecol Endocrinol. 2020;36(5):398–401. https://doi.org/10.1080/09513590.2019.1681959.
36. Condorelli R.A., Barbagallo F., Calogero A.E. et al. D-chiro-inositol improves sperm mitochondrial membrane potential: in vitro evidence. J Clin Med. 2020;9(5):1373. https://doi.org/10.3390/jcm9051373.
37. Ghaemi M., Seighali N., Shafiee A. et al. The effect of myo-inositol on improving sperm quality and IVF outcomes: a systematic review and meta-analysis. Food Sci Nutr. 2024;12(11):8515–24. https://doi.org/10.1002/fsn3.4427.
38. Colone M., Marelli G., Unfer V. et al. Inositol activity in oligoasthenoteratospermia – an in vitro study. Eur Rev Med Pharmacol Sci. 2010;14(10):891–6.
39. Morabbi A., Karimian M. Trace and essential elements as vital components to improve the performance of the male reproductive system: Implications in cell signaling pathways. J Trace Elem Med Biol. 2024;83:127403. https://doi.org/10.1016/j.jtemb.2024.127403.
40. Zhang B.L., Zhang Z.P., Shi S.M. et al. Dynamic elementomics of single-cell ICP-MS-derived signals in normal and calcium pump PMCA4-deficient mouse epididymal sperm during capacitation. Metallomics. 2023;15(10):mfad059. https://doi.org/10.1093/mtomcs/mfad059.
41. Громова О.А., Андреева Е.Н., Торшин И.Ю. и др. Системно-биологический анализ ролей марганца в акушерстве и гинекологии: репродуктивное здоровье женщины, регуляция менструального цикла и профилактика пороков развития плода. Вопросы гинекологии, акушерства и перинатологии. 2020;19(1):103–13. https://doi.org/10.20953/1726-1678-2020-1-103-113.
42. Lee B., Pine M., Johnson L. et al. Manganese acts centrally to activate reproductive hormone secretion and pubertal development in male rats. Reprod Toxicol. 2006;22(4):580–5. https://doi.org/10.1016/j.reprotox.2006.03.011.
43. Zargari S., Towhidi A., Rezayazdi K., Kastelic J. Chemical form of trace minerals (copper, zinc and manganese) fed to rams affects plasma testosterone concentrations and semen characteristics. Reprod Domest Anim. 2025;60(8):e70115. https://doi.org/10.1111/rda.70115.
44. Sharan O., Stefanyk V., Bartlewski P.M., Sharan M. The effect of supplementing freezing extender with Mn2+-, Zn2+- or Cu2+-nanosuccinate on select post-thaw characteristics of ram semen. Reprod Biol. 2024;24(3):100932. https://doi.org/10.1016/j.repbio.2024.100932.
45. Reis L.S., Ramos A.A., Camargos A.S., Oba E. Effect of manganese supplementation on the membrane integrity and the mitochondrial potential of the sperm of grazing Nelore bulls. Anim Reprod Sci. 2014;150(1–2):1–6. https://doi.org/10.1016/j.anireprosci.2014.06.033.
46. Ogawa S., Ota K., Takahashi T., Yoshida H. Impact of homocysteine as a preconceptional screening factor for in vitro fertilization and prevention of miscarriage with folic acid supplementation following frozen-thawed embryo transfer: a hospital-based retrospective cohort study. Nutrients. 2023;15(17):3730. https://doi.org/10.3390/nu15173730.
47. Demir K., Caliskan S.T., Celik S. et al. The effect of Folic Acid, B12, D, and E Vitamins and Melatonin levels in the follicular fluid taken by the Intracytoplasmic Sperm Injection method on pregnancy. Pak J Med Sci. 2024;40(3Part–II):433–7. https://doi.org/10.12669/pjms.40.3.7929.
48. Ren H., Wang K., Liu Z. et al. Effect of low dietary folate on mouse spermatogenesis and spindle assembly checkpoint dysfunction may contribute to folate deficiency-induced chromosomal instability in cultured mouse spermatogonia. DNA Cell Biol. 2023;42(8):515–25. https://doi.org/10.1089/dna.2023.0035.
49. Rebolledo E.M.D., Chan D., Christensen K.E. et al. Sperm DNA methylation defects in a new mouse model of the 5,10-methylenetetrahydrofolate reductase 677C>T variant and correction with moderate dose folic acid supplementation. Mol Hum Reprod. 2024;30(4):gaae008. https://doi.org/10.1093/molehr/gaae008.
50. Mustari A., Alam M., Miah M.A. et al. Retrieval action of zinc and folic acid for the restoration of normal reproductive function in bisphenol – a exposed male albino mice. Vet Med (Praha). 2022;67(9):479–86. https://doi.org/10.17221/13/2022-VETMED.
51. Toghan R., Amin Y.A., Ali R.A. et al. Protective effects of Folic acid against reproductive, hematological, hepatic, and renal toxicity induced by Acetamiprid in male Albino rats. Toxicology. 2022;469:153115. https://doi.org/10.1016/j.tox.2022.153115.
52. Торшин И.Ю., Громова О.А. Проблемы использования фенола (гидроксибензола) и парабенов в качестве стабилизаторов фармацевтических средств: анализ с применением методов машинного обучения. ФАРМАКОЭКОНОМИКА. Современная фармакоэкономика и фармакоэпидемиология. 2025;18(1):125–39. https://doi.org/10.17749/2070-4909/farmakoekonomika.2024.263.
53. Fadl A.M., Abdelnaby E.A., El-Sherbiny H.R. Supplemental dietary zinc sulphate and folic acid combination improves testicular volume and haemodynamics, testosterone levels and semen quality in rams under heat stress conditions. Reprod Domest Anim. 2022;57(6):567–76. https://doi.org/10.1111/rda.14096.
54. Boushaba S., Helis Y., Lebaal R. et al. The relationship of sperm DNA integrity with serum vitamin levels (folate and cobalamin) and food consumption in infertile men. Clin Exp Reprod Med. 2023;50(1):53–62. https://doi.org/10.5653/cerm.2022.05736.
55. Michaelsen M.P., Poulsen M., Bjerregaard A.A. et al. The effect of dietary supplements on male infertility in terms of pregnancy, live birth, and sperm parameters: a systematic review and meta-analysis. Nutrients. 2025;17(10):1710. https://doi.org/10.3390/nu17101710.
56. Li X., Zeng Y.M., Luo Y.D. et al. Effects of folic acid and folic acid plus zinc supplements on the sperm characteristics and pregnancy outcomes of infertile men: a systematic review and meta-analysis. Heliyon. 2023;9(7):e18224. https://doi.org/10.1016/j.heliyon.2023.e18224.
57. Darbandi S., Darbandi M., Khorshid H.R.K., Sengupta P. Electrophysiology of human gametes: a systematic review. World J Mens Health. 2022;40(3):442–55. https://doi.org/10.5534/wjmh.210107.
Об авторах
О. А. ГромоваРоссия
Громова Ольга Алексеевна - д.м.н., проф. Scopus Author ID: 7003589812. WoS ResearcherID: J-4946-2017.
119333 Москва, ул. Вавилова, д. 44, корп. 2
И. Ю. Торшин
Россия
Торшин Иван Юрьевич - к.ф.-м.н., к.х.н. Scopus Author ID: 7003300274. WoS ResearcherID: C-7683-2018.
119333 Москва, ул. Вавилова, д. 44, корп. 2
Н. И. Тапильская
Россия
Наталья Игоревна Тапильская - д.м.н., проф. Scopus Author ID: 23013489000. WoS ResearcherID: A-7504-2016.
199034 Санкт-Петербург, Менделеевская линия, д. 3
Что уже известно об этой теме?
► Бесплодие – глобальная проблема здравоохранения, в половине случаев обусловленная состоянием мужского репродуктивного здоровья.
► Микронутриенты-антиоксиданты улучшают качество спермы.
► Миоинозитол (МИ) и D-хироинозитол (ДХИ) являются «сырьем» для биосинтеза фосфатидилинозитол фосфатов – важной разновидности сигнальных молекул, играющих важнейшие роли в цитогенезе, морфогенезе и росте ооцитов.
Что нового дает статья?
► МИ/ДХИ, их биологически активные производные, марганец и фолаты играют ключевые роли в функционировании сперматозоидов, начиная с вызревания сперматозоидов и заканчивая оплодотворением ооцитов.
► МИ и ДХИ принципиально необходимы для оплодотворения ооцитов; ионы марганца важны для функции гамет посредством влияния на концентрацию тестостерона, повышение активности антиоксидантных ферментов и митохондриального потенциала; фолаты, снижая уровни гаметотоксичного гомоцистеина, способствуют сохранению целостности ДНК сперматозоидов.
► Результаты экспериментальных и клинических исследований моделей глубокого дефицита инозитолов указывают на воздействия МИ/ДХИ и их синергистов на подвижность сперматозоидов, в том числе через модуляцию электрических полей.
Как это может повлиять на клиническую практику в обозримом будущем?
► Перспективно назначение МИ/ДХИ в сочетании с органическими солями марганца и фолатами пациентам с идиопатической патоспермией, инсулинорезистентностью, ожирением и в условиях оксидативного стресса.
Рецензия
Для цитирования:
Громова О.А., Торшин И.Ю., Тапильская Н.И. Миоинозитол и D-хироинозитол в комплексе с фолатами и марганцем как факторы мужского здоровья: воздействие на структуру и фертильность сперматозоидов. Акушерство, Гинекология и Репродукция. 2025;19(5):737-757. https://doi.org/10.17749/2313-7347/ob.gyn.rep.2025.687
For citation:
Gromova O.A., Torshin I.Yu., Tapilskaya N.I. Myoinositol and D-chiroinositol in combination with folates and manganese as factors of male health: effect on sperm structure and fertility. Obstetrics, Gynecology and Reproduction. 2025;19(5):737-757. (In Russ.) https://doi.org/10.17749/2313-7347/ob.gyn.rep.2025.687

Контент доступен под лицензией Creative Commons Attribution-NonCommercial-ShareAlike 4.0 International License.











































