Перейти к:
Исследование уровней биомаркеров – растворимой fms-подобной тирозинкиназы-1 (sFlt-1), плацентарного фактора роста (PlGF) и их соотношения sFlt-1/PlGF у пациенток с экстрагенитальными заболеваниями для диагностики ранней и поздней преэклампсии
https://doi.org/10.17749/2313-7347/ob.gyn.rep.2025.671
Аннотация
Введение. Преэклампсия (ПЭ) остается одной из наиболее актуальных проблем современного акушерства, являясь ведущей причиной материнской и перинатальной заболеваемости и смертности. Это мультисистемное расстройство, возникающее после 20 недель беременности и характеризующееся артериальной гипертензией в сочетании с протеинурией и/или полиорганной дисфункцией.
Цель: определить содержание биомаркеров – растворимой fms-подобной тирозинкиназы-1 (англ. soluble fms-like tyrosine kinase-1, sFlt-1), плацентарного фактора роста (англ. placental growth factor, PlGF) и их соотношение (sFlt-1/PlGF) у пациенток с экстрагенитальными заболеваниями для диагностики ранней и поздней ПЭ.
Материалы и методы. В проспективное исследование включены 439 пациенток с экстрагенитальными заболеваниями (сахарным диабетом 1-го и 2-го типа, хронической артериальной гипертензией, хроническим пиелонефритом, хроническим гломерулонефритом), среди которых были выделены подгруппы с ПЭ (n = 94) и без ПЭ (n = 345). Обследование пациенток проводили на всем протяжении беременности, начиная с 12 недель. Определение PlGF и sFlt-1 в сыворотке крови выполняли с помощью электрохемилюминесцентных диагностических тестов на автоматических анализаторах с последующим расчетом соотношения sFlt-1/PlGF для каждого образца сыворотки. С целью определения прогностической ценности соотношения sFlt1/PlGF для выявления ПЭ выполнялось построение ROC-кривых с последующей оценкой качества прогноза.
Результаты. Сроки манифестации ранней и поздней ПЭ имели различную динамику ангиогенных биомаркеров. При ранней ПЭ статистически значимое изменение уровня маркера sFlt-1 (р = 0,001) и коэффициента sFlt-1/PlGF (р = 0,003) фиксировали уже с 22–24 недель по сравнению с предыдущими периодами гестации. При поздней ПЭ изменения были менее выражены и статистически значимы лишь эпизодически на сроке гестации 25–27 недель (р = 0,027). В прогнозе развития ПЭ изменения биомаркеров являлись ранними предикторами, предшествуя родам за 6 недель. Для пациенток с экстрагенитальной патологией установлена пониженная точка отсечения соотношения sFlt-1/PlGF – 11,8.
Заключение. Проведенное исследование позволяет сделать вывод о высокой диагностической значимости определения ангиогенных биомаркеров у пациенток с экстрагенитальной патологией в сроки конца II – начала III триместра гестации (28–33 недели). Анализ диагностической ценности биомаркеров, основанный на построении ROC-кривых, выявил следующую иерархию по их прогностической эффективности: наивысшая прогностическая ценность характерна для соотношения sFlt-1/PlGF, которое превосходит по своим показателям изолированное определение sFlt-1 и PlGF. Ключевые показатели (чувствительность, специфичность и площадь под ROC-кривой – AUC) подтверждают, что соотношение sFlt-1/PlGF является наиболее эффективным предиктором по сравнению с изолированным измерением значений sFlt-1 и PlGF в диагностике ПЭ в данной когорте пациенток. Оптимальным пороговым значением для соотношения sFlt-1/PlGF является 11,8. Установлено, что максимальная глубина прогнозирования риска развития ПЭ с использованием данного критерия составляет 6 недель, что определяет его высокую клиническую ценность для своевременного формирования групп риска и назначения превентивных мероприятий.
Ключевые слова
Для цитирования:
Матвеев М.О., Прокопенко Е.И., Никольская И.Г., Федосов А.А., Блинов Д.В., Бицадзе В.О. Исследование уровней биомаркеров – растворимой fms-подобной тирозинкиназы-1 (sFlt-1), плацентарного фактора роста (PlGF) и их соотношения sFlt-1/PlGF у пациенток с экстрагенитальными заболеваниями для диагностики ранней и поздней преэклампсии. Акушерство, Гинекология и Репродукция. 2025;19(5):632-653. https://doi.org/10.17749/2313-7347/ob.gyn.rep.2025.671
For citation:
Matveev M.O., Prokopenko E.I., Nikolskaya I.G., Fedosov A.A., Blinov D.V., Bitsadze V.O. Quantitating soluble fms-like tyrosine kinase-1 (sFlt-1) and placental growth factor (PlGF) biomarker levels along with sFlt-1/PlGF ratio in patients with extragenital diseases for diagnostics of early- and late-onset preeclampsia. Obstetrics, Gynecology and Reproduction. 2025;19(5):632-653. (In Russ.) https://doi.org/10.17749/2313-7347/ob.gyn.rep.2025.671
Введение / Introduction
Преэклампсия (ПЭ) является одной из главных проблем современного акушерства, частота встречаемости заболевания, по данным мировой литературы, составляет 2–5 % среди всех беременностей [1–6]; последствия как тяжелой, так и умеренной ПЭ крайне пагубны. ПЭ остается одной из ведущих причин материнской и детской смертности. Согласно мировой статистике, ПЭ определяется ежегодно у 4 млн женщин, что приводит к смерти более 70 тыс. женщин и 500 тыс. младенцев в мире [7]. Помимо этого, данное осложнение является одной из ведущих причин преждевременного индуцированного родоразрешения, что в свою очередь также вызывает перинатальную заболеваемость и смертность [8–10], особенно при родоразрешении в глубоко недоношенные сроки, когда шансы на выживание ребенка очень низки [11][12].
Преэклампсия характеризуется как мультисистемное заболевание, диагностируемое как внезапно возникшая артериальная гипертензия после 20 недель беременности, с осложнениями, включающими в себя протеинурию, дисфункцию органов матери или нарушения в маточно-плацентарном кровотоке [13][14].
Современный прогресс в медицине дает возможность большинству современных женщин получать возможность реализовать свой репродуктивный потенциал, несмотря на рост частоты экстрагенитальных заболеваний в популяции, которые, как известно, являются дополнительными факторами риска развития ПЭ [15][16].
По данным Росстата [17], количество экстрагенитальных заболеваний у беременных в России имеет лишь незначительную тенденцию к снижению (рис. 1).
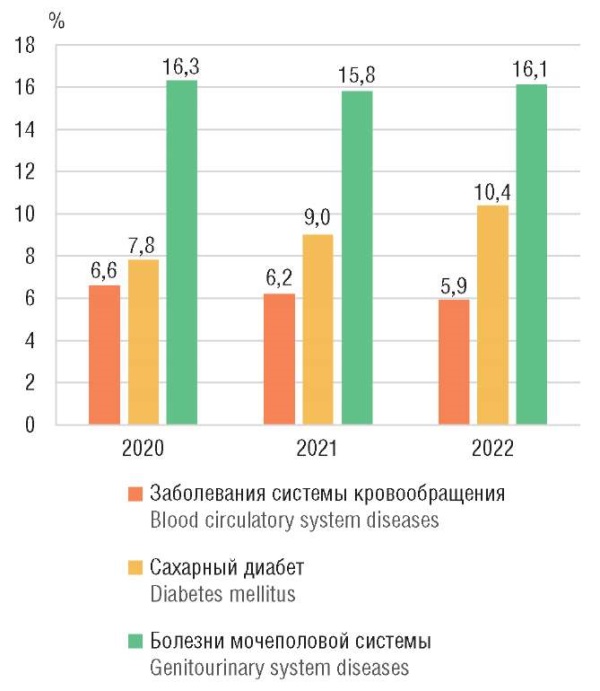
Рисунок 1. Распространенность экстрагенитальных заболеваний у беременных [17].
Figure 1. Prevalence of extragenital diseases in pregnant women [17].
Учитывая высокую частоту заболеваемости современных женщин соматическими заболеваниями, которые могут обостряться или манифестировать во время гестации, проявляясь идентичными с ПЭ симптомами, такими как артериальная гипертензия (АГ), протеинурия, отеки, в настоящее время назрела необходимость поиска новых или усовершенствования старых биомаркеров, способствующих ранней верификации ПЭ. Сходность проявления соматического заболевания с признаками ПЭ характерна для таких болезней, как сахарный диабет 1-го и 2-го типа (СД-1 и СД-2), хроническая артериальная гипертензия (ХАГ), хронический пиелонефрит, хронический гломерулонефрит. Среди таких пациенток особенно часто отмечается разнообразие клинических проявлений ПЭ, а также увеличивается частота ее атипичных форм или слабо выраженных симптомов [18][19]. Все это разнообразие симптомов может приводить к неправильной диагностике и, как следствие, неправильно выбранной тактике подхода к данной когорте пациенток, что еще раз обосновывает важность изучения проблемы ранней диагностики. Целесообразность изучения биомаркеров ПЭ в клинической практике подчеркнута в резолюции Совета экспертов, посвященного вопросам организации скрининга прогнозирования ПЭ в Российской Федерации (2021) [20], что позволит сэкономить средства бюджета здравоохранения за счет своевременного выявления ПЭ, маршрутизации таких пациенток для наблюдения и, при наличии показаний, родоразрешения [21].
В настоящее время для диагностики и прогнозирования ПЭ используются ангиогенные биомаркеры: растворимая fms-подобная тирозинкиназа-1 (англ. soluble fms-like tyrosine kinase-1, sFlt-1) и плацентарный фактор роста (англ. placental growth factor, PlGF). Установлено, что значение соотношения sFlt/PlGF < 38 позволяет исключить развитие ПЭ в течение 7 дней. При сроке беременности до 34 недель значение соотношения sFlt/PlGF > 85, а при сроке беременности более 34 недель соотношение sFlt/PlGF > 110 свидетельствует о высокой вероятности развития ПЭ или о ее наличии [22][23]. Однако при экстрагенитальных заболеваниях показатели sFlt-1, PlGF и их соотношение при ПЭ могут отличаться от общепринятых критериев.
Цель: определить содержание биомаркеров – sFlt-1, PIGF и их соотношение (sFlt-1/PlGF) у пациенток с экстрагенитальными заболеваниями для диагностики ранней и поздней ПЭ.
Материалы и методы / Materials and Methods
Дизайн исследования / Study design
В проспективное исследование включены 439 пациенток с экстрагенитальными заболеваниями (СД-1, СД-2, ХАГ, хроническим пиелонефритом, хроническим гломерулонефритом), обследование которых проводили на различных сроках гестации: в 12–15, 16–18, 19–21, 22–24, 25–27, 28–30, 31–33, 34–36, 37–39, 40–42 недели. Исследование проводилось в рамках выполнения государственной программы Министерства здравоохранения Московской области «Ранний скрининг преэклампсии у беременных Московской области».
Критерии включения и исключения / Inclusion and exclusion criteria
Критерии включения: наличие экстрагенитальной патологии – СД-1 и СД-2, ХАГ, хронического пиелонефрита, хронического гломерулонефрита; одноплодная беременность; добровольное информированное согласие на участие в исследовании.
Критерии исключения: многоплодная беременность; отказ от участия.
Группы пациенток / Patient groups
Среди 439 беременных с экстрагенитальными заболеваниями были выделены пациентки без ПЭ (n = 345) и с ПЭ (n = 94), в том числе с ранним началом ПЭ до 33 недель 6 дней беременности (n = 37) и с поздним началом ПЭ после 34 недель беременности (n = 57).
Методы исследования / Study methods
Проанализирован каждый из показателей – sFlt-1 и PlGF и соотношение sFlt-1/PlGF у пациенток с экстрагенитальными заболеваниями с ПЭ и без ПЭ.
Определение содержания PlGF и sFlt-1 в сыворотке крови выполняли в ГБУЗ МО МОНИИАГ им. Академика В.И. Краснопольского с помощью электрохемилюминесцентных диагностических тестов Elecsys sFlt-1 и Elecsys PlGF (F. Hoffmann-La Roche, Швейцария) на автоматических анализаторах Сobas e411 (Roche Diagnostics, Швейцария) с последующим расчетом соотношения sFlt-1/PlGF для каждого образца сыворотки.
Статистический анализ / Statistical analysis
Статистический анализ выполняли в программе BioStat Версия 7 (AnalystSoft Inc., США). Показатели с распределением, отличающимся от нормального, описывались как медиана, 1‑й и 3‑й квартиль (Ме [Q1; Q3]) и сравнивались при помощи непараметрического U-критерия Манна–Уитни для двух независимых выборок.
С целью определения прогностической ценности соотношения sFlt1/PlGF для выявления ПЭ выполнялось построение ROC-кривых с последующей оценкой качества прогноза. Значения AUC (площадь под ROC-кривой) 0,8…0,9 рассматривались как свидетельствующие об очень хорошем прогностическом качестве модели, 0,7…0,8 – о хорошем, 0,6…0,7 – среднем, 0,5…0,6 – неудовлетворительном прогностическом качестве модели. Для отнесения конкретных случаев к тому или другому классу (разовьется ПЭ или нет) определяли точки отсечения (cut-off value) коэффициента sFlt1/PlGF.
В качестве критического уровня значимости различий был принят уровень 0,05, использовали двусторонний р-уровень значимости.
Результаты / Results
Анализ показателей sFlt-1 и PlGF и соотношения sFlt-1/PlGF у пациенток с экстрагенитальными заболеваниями с ранней ПЭ и без ПЭ / Quantitating sFlt-1 and PlGF levels along with sFlt-1/PlGF ratio in patients with extragenital pathologies with and without early-onset preeclampsia
Результаты анализа значений биомаркера sFlt-1 у беременных с ранней ПЭ и экстрагенитальными заболеваниями представлены в таблице 1 и на рисунке 2. Для антиангиогенного биомаркера sFlt-1 статистически значимый рост был получен, начиная с 22–24‑й недели гестации: у пациенток без ПЭ значения sFlt-1 составили 1480 [ 1019; 1908] пг/мл и с ранней ПЭ – 4421 [ 2914; 6808] пг/мл (р = 0,001). В сроки 25–27 недель беременности значения биомаркера составили у пациенток без ПЭ 1756 [ 1096; 2246] пг/мл и с ПЭ – 7270 [ 2658; 12657] пг/мл (р = 0,016); в сроки 28–30 недель у беременных без ПЭ – 1672 [ 1247; 2109] пг/мл и с ПЭ – 8784 [ 4848; 9106] пг/мл (р = 0,001); в 31–33 недели беременности у пациенток без ПЭ – 2016 [ 1444; 2760] пг/мл и с ранней ПЭ – 8041 [ 5851; 10353] пг/мл (р < 0,0001).
Таблица 1. Значения растворимой fms-подобной тирозинкиназы-1 (sFlt-1) в различные сроки беременности у пациенток с экстрагенитальной патологией без преэклампсии и с ранней преэклампсией.
Table 1. Gestational age-related soluble fms-like tyrosine kinase-1 (sFlt-1) levels in patients with extragenital pathology without preeclampsia and with early-onset preeclampsia.
|
Срок гестации, недель Gestational age, weeks |
sFlt-1, пг/мл // sFlt-1, pg/mL Ме [ Q1; Q3] |
p |
|
|
Без преэклампсии / No preeclampsia n = 345 |
Ранняя преэклампсия / Early-onset preeclampsia n = 37 |
||
|
12–15 |
1174 [ 876; 1574] |
2226 |
– |
|
16–18 |
1501 [ 996; 1773] |
2247 [ 1808; 2676] |
0,089 |
|
19–21 |
1584 [ 1295; 2350] |
2319 [ 1464; 2607] |
0,564 |
|
22–24 |
1480 [ 1019; 1908] |
4421 [ 2914; 6808] |
0,001 |
|
25–27 |
1756 [ 1096; 2246] |
7270 [ 2658; 12657] |
0,016 |
|
28–30 |
1672 [ 1247; 2109] |
8784 [ 4848; 9106] |
0,001 |
|
31–33 |
2016 [ 1444; 2760] |
8041 [ 5851; 10353] |
< 0,0001 |
Примечание: выделены значимые различия.
Note: significant differences are highlighted in bold.
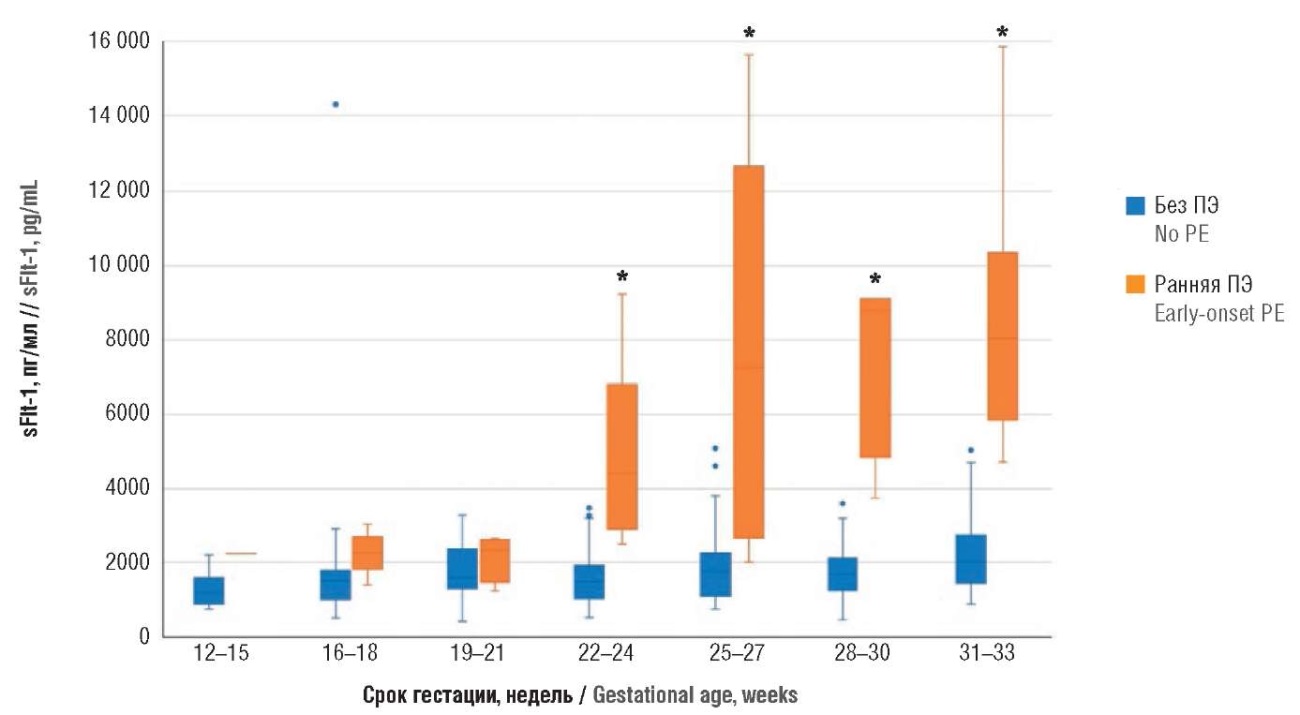
Рисунок 2. Сравнение значений растворимой fms-подобной тирозинкиназы-1 (sFlt-1) в различные сроки беременности у пациенток с экстрагенитальной патологией без преэклампсии и с ранней преэклампсией (ПЭ).
Примечание: *р < 0,05 – различия статистически значимы по сравнению с пациентками без преэклампсии; свободные элементы – выбросы.
Figure 2. Comparison of gestational age-related soluble fms-like tyrosine kinase-1 (sFlt-1) levels in patients with extragenital pathology without preeclampsia and with early-onset preeclampsia (PE).
Note: *p < 0.05 – significant differences compared with patients without preeclampsia; free elements are outliers.
Также проанализирован проангиогенный биомаркер PlGF (табл. 2, рис. 3). При его определении на 22–24‑й неделях гестации отмечена лишь тенденция к значимости различий: у пациенток без ПЭ значения PlGF составили 259 [ 167; 387] пг/мл и у пациенток с ранней ПЭ – 120 [ 15; 236] пг/мл (р = 0,053). В последующем различия становились статистически значимыми по сравнению с пациентками без ПЭ. Так, в сроке гестации 25–27 недель у пациенток без ПЭ значения биомаркера PlGF составили 350 [ 236; 537] пг/мл и с ПЭ – 78 [ 15; 166] пг/мл (р = 0,011), в сроки 28–30 недель у пациенток без ПЭ – 410 [ 334; 681] пг/мл и с ПЭ – 82 [ 56; 85] пг/мл (р = 0,001), в сроки 31–33 недели у пациенток без ПЭ – 284 [ 177; 462] пг/мл и с ПЭ – 82 [ 55; 164] пг/мл (р = 0,0004).
Таблица 2. Значения плацентарного фактора роста (PlGF) в различные сроки беременности у пациенток с экстрагенитальной патологией без преэклампсии и с ранней преэклампсией.
Table 2. Gestational age-related placental growth factor (PlGF) levels in patients with extragenital pathology without preeclampsia and with early-onset preeclampsia.
|
Срок гестации, недель Gestational age, weeks |
PlGF, пг/мл // PlGF, pg/mL Ме [ Q1; Q3] |
p |
|
|
Без преэклампсии / No preeclampsia n = 345 |
Ранняя преэклампсия / Early-onset preeclampsia n = 37 |
||
|
12–15 |
56 [ 35; 102] |
17 |
– |
|
16–18 |
109 [ 71; 157] |
88 [ 52; 120] |
0,282 |
|
19–21 |
164 [ 99; 224] |
145 [ 56; 161] |
0,374 |
|
22–24 |
259 [ 167; 387] |
120 [ 15; 236] |
0,053 |
|
25–27 |
350 [ 236; 537] |
78 [ 15; 166] |
0,011 |
|
28–30 |
410 [ 334; 681] |
82 [ 56; 85] |
0,001 |
|
31–33 |
284 [ 177; 462] |
82 [ 55; 164] |
0,0004 |
Примечание: выделены значимые различия.
Note: significant differences are highlighted in bold.
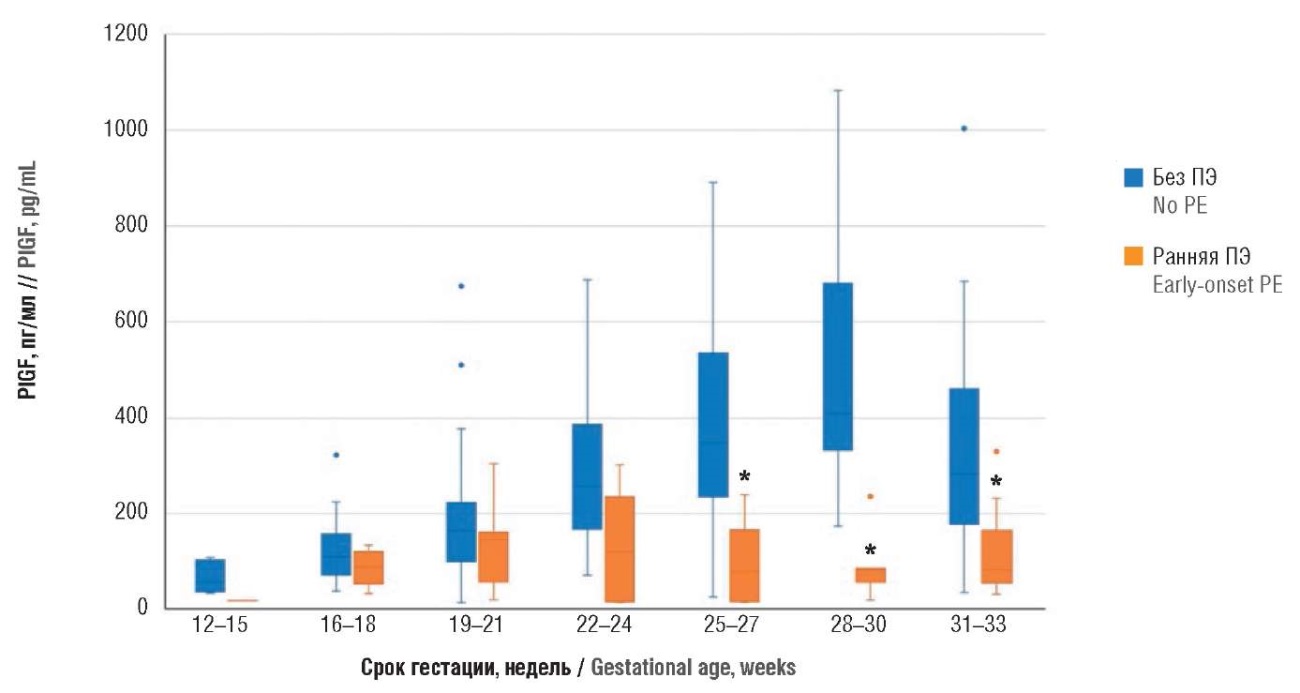
Рисунок 3. Сравнение значений плацентарного фактора роста (PlGF) в различные сроки беременности у пациенток с экстрагенитальной патологией без преэклампсии и с ранней преэклампсией (ПЭ).
Примечание: *р < 0,05 – различия статистически значимы по сравнению с пациентками без преэклампсии; свободные элементы – выбросы.
Figure 3. Comparison of gestational age-related рlacental growth factor (PlGF) levels in patients with extragenital pathology without preeclampsia and with early-onset preeclampsia (PE).
Note: *p < 0.05 – significant differences compared with patients without preeclampsia; free elements are outliers.
При анализе соотношения sFlt-1/PlGF в различные сроки беременности у пациенток с экстрагенитальными заболеваниями были получены данные (табл. 3, рис. 4), которые также свидетельствуют о статистически значимых изменениях у беременных с ПЭ по отношению к беременным без ПЭ, начиная с 22–24 недель гестации: у пациенток без ПЭ соотношение составило 6,2 [ 3,4; 10,0] и с ранней ПЭ – 213,1 [ 12,6; 424,2] (р = 0,003), в 25–27 недель у пациенток без ПЭ – 4,3 [ 3,2; 8,1] и у пациенток с ПЭ – 380,3 [ 13,7; 839,3] (р = 0,003), в 28–30 недель гестации у пациенток без ПЭ – 3,5 [ 2,1; 6,2] и с ПЭ – 103,7 [ 66,9; 110,9] (р = 0,0004), в 31–33 недели у пациенток без ПЭ – 6,4 [ 3,9; 12,3] и с ПЭ – 79,1 [ 49,2; 152,7] (р < 0,0001).
Таблица 3. Значения соотношения sFlt-1/PlGF в различные сроки беременности у пациенток с экстрагенитальной патологией без преэклампсии и с ранней преэклампсией.
Table 3. Gestational age-related sFlt-1/PlGF ratio in patients with extragenital pathology without preeclampsia and with early-onset preeclampsia.
|
Срок гестации, недель Gestational age, weeks |
sFlt-1/PlGF Ме [ Q1; Q3] |
p |
|
|
Без преэклампсии / No preeclampsia n = 345 |
Ранняя преэклампсия / Early-onset preeclampsia n = 37 |
||
|
12–15 |
20,3 [ 15,6; 20,9] |
127,8 |
– |
|
16–18 |
12,4 [ 8,9; 15,8] |
29,6 [ 22,3; 44,6] |
0,089 |
|
19–21 |
10,7 [ 6,6; 21,8] |
18,3 [ 9,1; 41,1] |
0,374 |
|
22–24 |
6,2 [ 3,4; 10,0] |
213,1 [ 12,6; 424,2] |
0,003 |
|
25–27 |
4,3 [ 3,2; 8,1] |
380,3 [ 13,7; 839,3] |
0,003 |
|
28–30 |
3,5 [ 2,1; 6,2] |
103,7 [ 66,9; 110,9] |
0,0004 |
|
31–33 |
6,4 [ 3,9; 12,3] |
79,1 [ 49,2; 152,7] |
< 0,0001 |
Примечание: выделены значимые различия.
Note: significant differences are highlighted in bold.
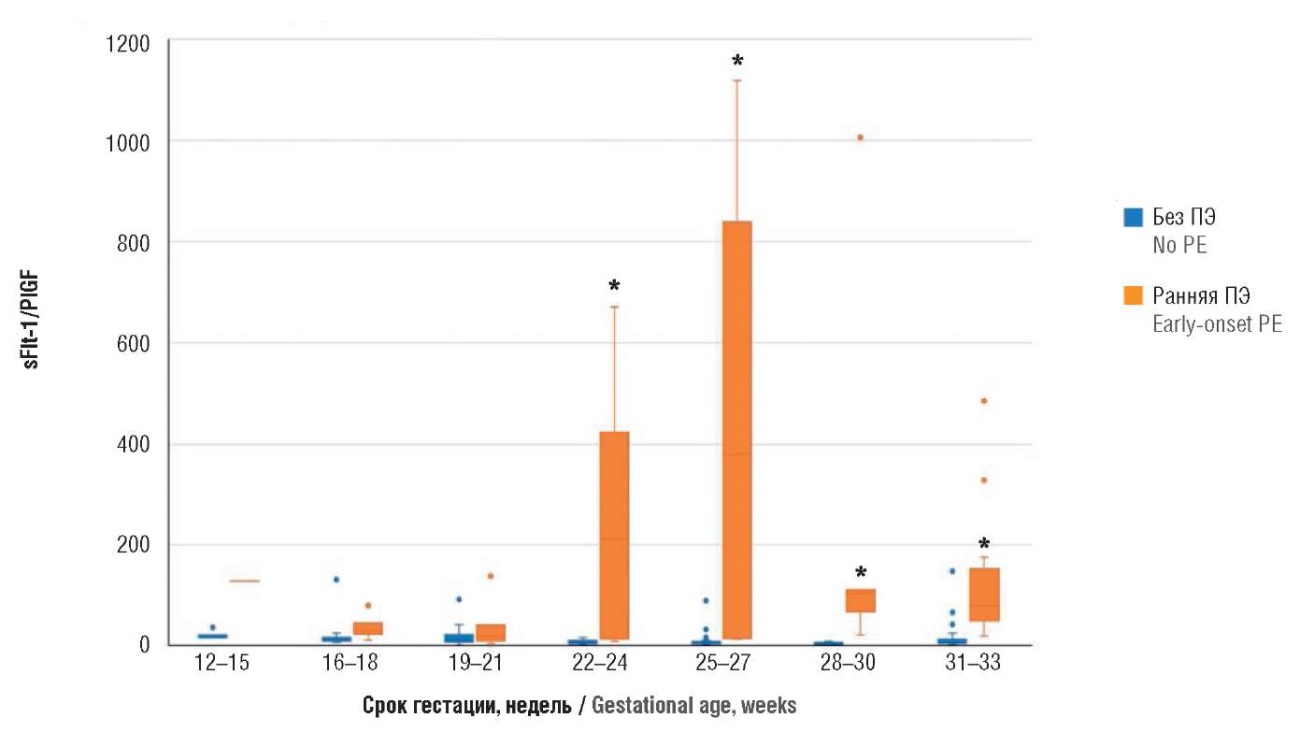
Рисунок 4. Сравнение значений соотношения sFlt-1/PlGF в различные сроки беременности у пациенток с экстрагенитальной патологией без преэклампсии и с ранней преэклампсией (ПЭ).
Примечание: *р < 0,05 – различия статистически значимы по сравнению с пациентками без преэклампсии; свободные элементы – выбросы.
Figure 4. Comparison of gestational age-related sFlt-1/PlGF ratio in patients with extragenital pathology without preeclampsia and with early-onset preeclampsia (PE).
Note: *p < 0.05 – significant differences compared with patients without preeclampsia; free elements are outliers.
Анализ показателей sFlt-1 и PlGF и соотношения sFlt-1/PlGF у пациенток с экстрагенитальными заболеваниями с поздней ПЭ и без ПЭ / Quantitating sFlt-1 and PlGF levels along with sFlt-1/PlGF ratio in patients with extragenital diseases with and without late-onset preeclampsia
Аналогичным образом были проанализированы данные у пациенток с экстрагенитальными заболеваниями с поздней ПЭ и без ПЭ. Для антиангиогенного фактора sFlt-1 статистически значимых различий не было получено, за исключением срока гестации в промежутке 25–27 недель беременности (табл. 4, рис. 5): у пациенток без ПЭ значения sFlt-1 составили 1756 [ 1096; 2246] пг/мл и с поздней ПЭ – 628 [ 548; 708] пг/мл (р = 0,027). При анализе проангиогенного фактора PlGF для пациенток, у которых развилась поздняя ПЭ, статистически значимых различий между беременными с поздней ПЭ и без ПЭ получено не было (табл. 5, рис. 6). При анализе соотношения sFlt-1/PlGF (табл. 6, рис. 7) статистически значимые различия между беременными были обнаружены на сроках гестации 25–27 недель (у пациенток без ПЭ – 4,3 [ 3,2; 8,1] и с поздней ПЭ – 1,3 [ 1,0; 1,6]; р = 0,027), а также в 28–30 недель гестации (у пациенток без ПЭ – 3,5 [ 2,1; 6,2] и с ПЭ – 8,1 [ 7,5; 8,7]; р = 0,047).
Таблица 4. Значения растворимой fms-подобной тирозинкиназы-1 (sFlt-1) в различные сроки беременности у пациенток с экстрагенитальной патологией без преэклампсии и с поздней преэклампсией.
Table 4. Gestational age-related soluble fms-like tyrosine kinase-1 (sFlt-1) levels in patients with extragenital pathology without preeclampsia and with late-onset preeclampsia.
|
Срок гестации, недель Gestational age, weeks |
sFlt-1, пг/мл // sFlt-1, pg/mL Ме [ Q1; Q3] |
p |
|
|
Без преэклампсии / No preeclampsia n = 345 |
Поздняя преэклампсия / Late-onset preeclampsia n = 57 |
||
|
12–15 |
1174 [ 876; 1574] |
– |
– |
|
16–18 |
1501 [ 996; 1773] |
– |
– |
|
19–21 |
1584 [ 1295; 2350] |
1435 |
– |
|
22–24 |
1480 [ 1019; 1908] |
– |
– |
|
25–27 |
1756 [ 1096; 2246] |
628 [ 548; 708] |
0,027 |
|
28–30 |
1672 [ 1247; 2109] |
2985 [ 2129; 3840] |
0,522 |
|
31–33 |
2016 [ 1444; 2760] |
1479 [ 1190; 1684] |
0,158 |
|
34–36 |
2832 [ 1722; 4510] |
4137 [ 3517; 5098] |
0,125 |
|
37–39 |
2643 [ 1947; 4639] |
2940 [ 1825; 3588] |
0,933 |
Примечание: выделены значимые различия.
Note: significant differences are highlighted in bold.
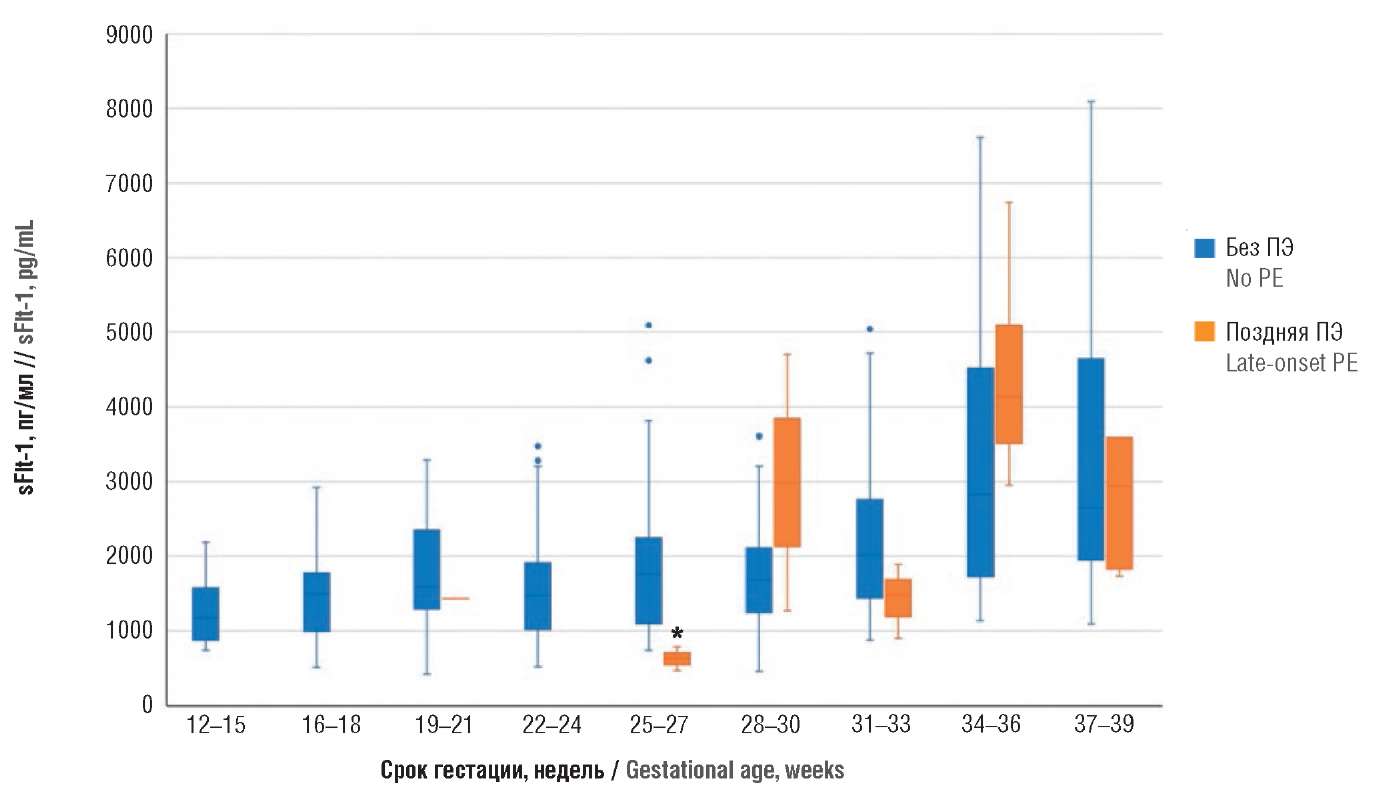
Рисунок 5. Сравнение значений растворимой fms-подобной тирозинкиназы-1 (sFlt-1) в различные сроки беременности у пациенток с экстрагенитальной патологией без преэклампсии и с поздней преэклампсией (ПЭ).
Примечание: *р < 0,05 – различия статистически значимы по сравнению с пациентками без преэклампсии; свободные элементы – выбросы.
Figure 5. Comparison of gestational age-related soluble fms-like tyrosine kinase-1 (sFlt-1) levels in patients with extragenital pathology without preeclampsia and with late-onset preeclampsia (PE).
Note: *p < 0.05 – significant differences compared with patients without preeclampsia; free elements are outliers.
Таблица 5. Значения плацентарного фактора роста (PlGF) в различные сроки беременности у пациенток с экстрагенитальной патологией без преэклампсии и с поздней преэклампсией.
Table 5. Gestational age-related placental growth factor (PlGF) levels in patients with extragenital pathology without preeclampsia and with late-onset preeclampsia.
|
Срок гестации, недель Gestational age, weeks |
PlGF, пг/мл // PlGF, pg/mL Ме [ Q1; Q3] |
p |
|
|
Без преэклампсии / No preeclampsia n = 345 |
Поздняя преэклампсия / Late-onset preeclampsia n = 57 |
||
|
12–15 |
56 [ 35; 102] |
– |
– |
|
16–18 |
109 [ 71; 157] |
– |
– |
|
19–21 |
164 [ 99; 224] |
161,5 |
– |
|
22–24 |
259 [ 167; 387] |
– |
– |
|
25–27 |
350 [ 236; 537] |
665 [ 460; 869] |
0,460 |
|
28–30 |
410 [ 334; 681] |
406 [ 272; 541] |
0,522 |
|
31–33 |
284 [ 177; 462] |
99 [ 96; 794] |
0,585 |
|
34–36 |
230 [ 139; 383] |
177 [ 123; 256] |
0,298 |
|
37–39 |
175 [ 90; 244] |
107 [ 66; 126] |
0,371 |
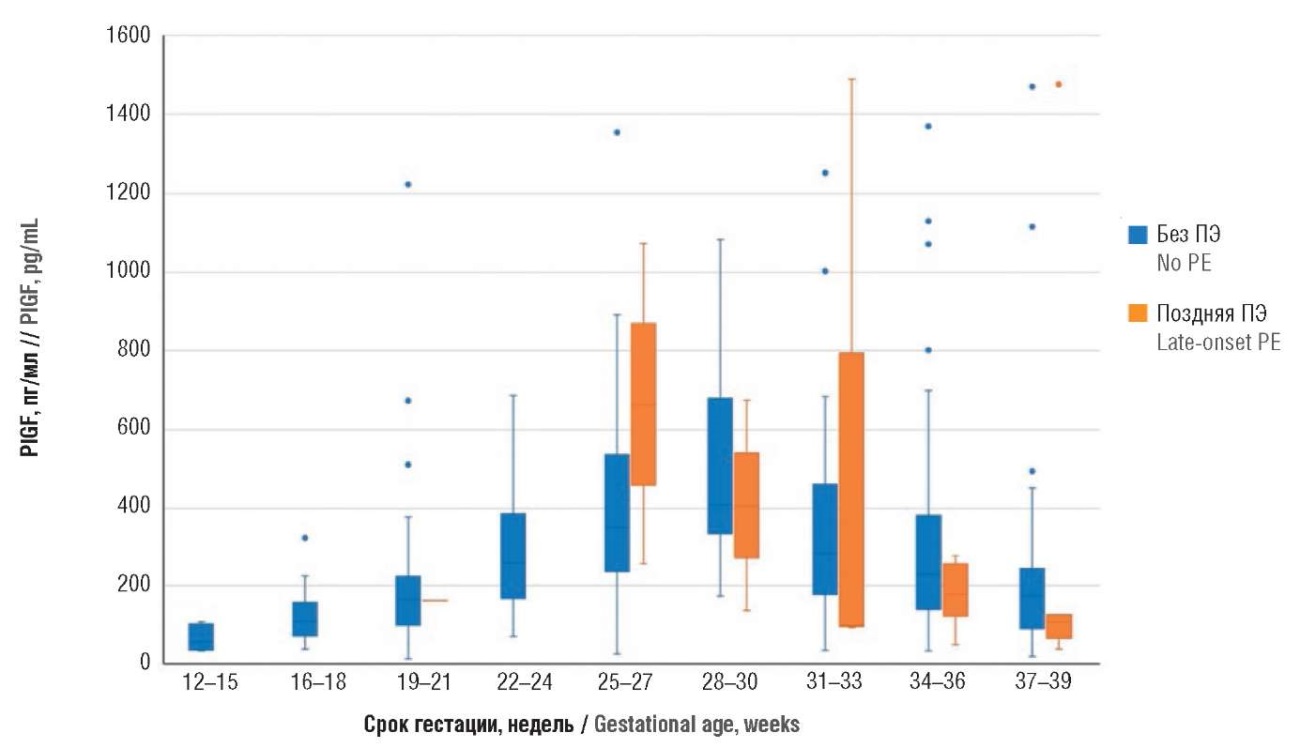
Рисунок 6. Сравнение значений плацентарного фактора роста (PlGF) в различные сроки беременности у пациенток с экстрагенитальной патологией без преэклампсии и с поздней преэклампсией (ПЭ).
Примечание: свободные элементы – выбросы.
Figure 6. Comparison of gestational age-related placental growth factor (PlGF) levels in patients with extragenital pathology without preeclampsia and with late-onset preeclampsia (PE).
Note: free elements are outliers.
Таблица 6. Значения соотношения sFlt-1/PlGF в различные сроки беременности у пациенток с экстрагенитальной патологией без преэклампсии и с поздней преэклампсией.
Table 6. Gestational age-related sFlt-1/PlGF ratio in patients with extragenital pathology without preeclampsia and with late-onset preeclampsia.
|
Срок гестации, недель Gestational age, weeks |
sFlt-1/PlGF Ме [ Q1; Q3] |
p |
|
|
Без преэклампсии / No preeclampsia n = 345 |
Поздняя преэклампсия / Late-onset preeclampsia n = 57 |
||
|
12–15 |
20,3 [ 15,6; 20,9] |
– |
– |
|
16–18 |
12,4 [ 8,9; 15,8] |
– |
– |
|
19–21 |
10,7 [ 6,6; 21,8] |
8,9 |
– |
|
22–24 |
6,2 [ 3,4; 10,0] |
– |
– |
|
25–27 |
4,3 [ 3,2; 8,1] |
1,3 [ 1,0; 1,6] |
0,027 |
|
28–30 |
3,5 [ 2,1; 6,2] |
8,1 [ 7,5; 8,7] |
0,047 |
|
31–33 |
6,4 [ 3,9; 12,3] |
15,0 [ 7,8; 17,7] |
0,682 |
|
34–36 |
11,7 [ 5,5; 31,6] |
24,4 [ 23,3; 28,7] |
0,116 |
|
37–39 |
18,1 [ 9,0; 40,9] |
28,6 [ 27,5; 46,1] |
0,353 |
Примечание: выделены значимые различия.
Note: significant differences are highlighted in bold.

Рисунок 7. Сравнение значений соотношения sFlt-1/PlGF в различные сроки беременности у пациенток с экстрагенитальной патологией без преэклампсии и с поздней преэклампсией (ПЭ).
Примечание: *р < 0,05 – различия статистически значимы по сравнению с пациентками без преэклампсии; свободные элементы – выбросы.
Figure 7. Comparison of gestational age-related sFlt-1/PlGF ratio in patients with extragenital pathology without preeclampsia and with late-onset preeclampsia (PE).
Note: *p < 0.05 – significant differences compared with patients without preeclampsia; free elements are outliers.
Таким образом, определение ангиогенных факторов в качестве биомаркера ПЭ высокоэффективно при ранней ПЭ и менее эффективно при поздней ПЭ.
Анализ показателей sFlt-1 и PlGF и соотношения sFlt-1/PlGF у пациенток с экстрагенитальными заболеваниями с ПЭ и без ПЭ на протяжении всей беременности / Quantitating pregnancy-related sFlt-1 and PlGF levels along with sFlt-1/PlGF ratio in pregnant women with extragenital diseases, with and without preeclampsia
Далее был проведен расчет эффективности биомаркеров у пациенток с экстрагенитальными заболеваниями с ПЭ и без ПЭ, проанализированы биомаркеры на всех сроках гестации.
При анализе уровня антиангиогенного маркера sFlt-1 (табл. 7, рис. 8) статистически значимые изменения начинались на сроке гестации 22–24 недели (р = 0,001), а также определены на сроках 28–30 (р = 0,001) и 31–33 (p = 0,0002) недели гестации соответственно.
Таблица 7. Значения антиангиогенного фактора – растворимой fms-подобной тирозинкиназы-1 (sFlt-1) на разных сроках гестации у пациенток с экстрагенитальными заболеваниями с преэклампсией и без преэклампсии (ПЭ).
Table 7. Gestational age-related anti-angiogenic factor – soluble fms-like tyrosine kinase-1 (sFlt-1) levels in patients with extragenital pathology with and without preeclampsia (PE).
|
Срок гестации, недель Gestational age, weeks |
sFlt-1, пг/мл // sFlt-1, pg/mL Ме [ Q1; Q3] |
p |
|
|
Без ПЭ / No PE n = 345 |
ПЭ / PE n = 94 |
||
|
12–15 |
1174 [ 876; 1574] |
2226 |
– |
|
16–18 |
1501 [ 996; 1773] |
2247 [ 1808; 2676] |
0,089 |
|
19–21 |
1584 [ 1295; 2350] |
1892 [ 1442; 2535] |
0,779 |
|
22–24 |
1480 [ 1019; 1908] |
4421 [ 2914; 6808] |
0,001 |
|
25–27 |
1756 [ 1096; 2246] |
2440 [ 1092; 9467] |
0,483 |
|
28–30 |
1672 [ 1247; 2109] |
4848 [ 4220; 8945] |
0,001 |
|
31–33 |
2016 [ 1444; 2760] |
6529 [ 4872; 9777] |
0,0002 |
|
34–36 |
2832 [ 1722; 4510] |
4137 [ 3517; 5098] |
0,125 |
|
37–39 |
2643 [ 1947; 4639] |
2940 [ 1825; 3588] |
0,933 |
|
40–42 |
3073 [ 2877; 3268] |
5629 |
– |
Примечание: выделены значимые различия.
Note: significant differences are highlighted in bold.
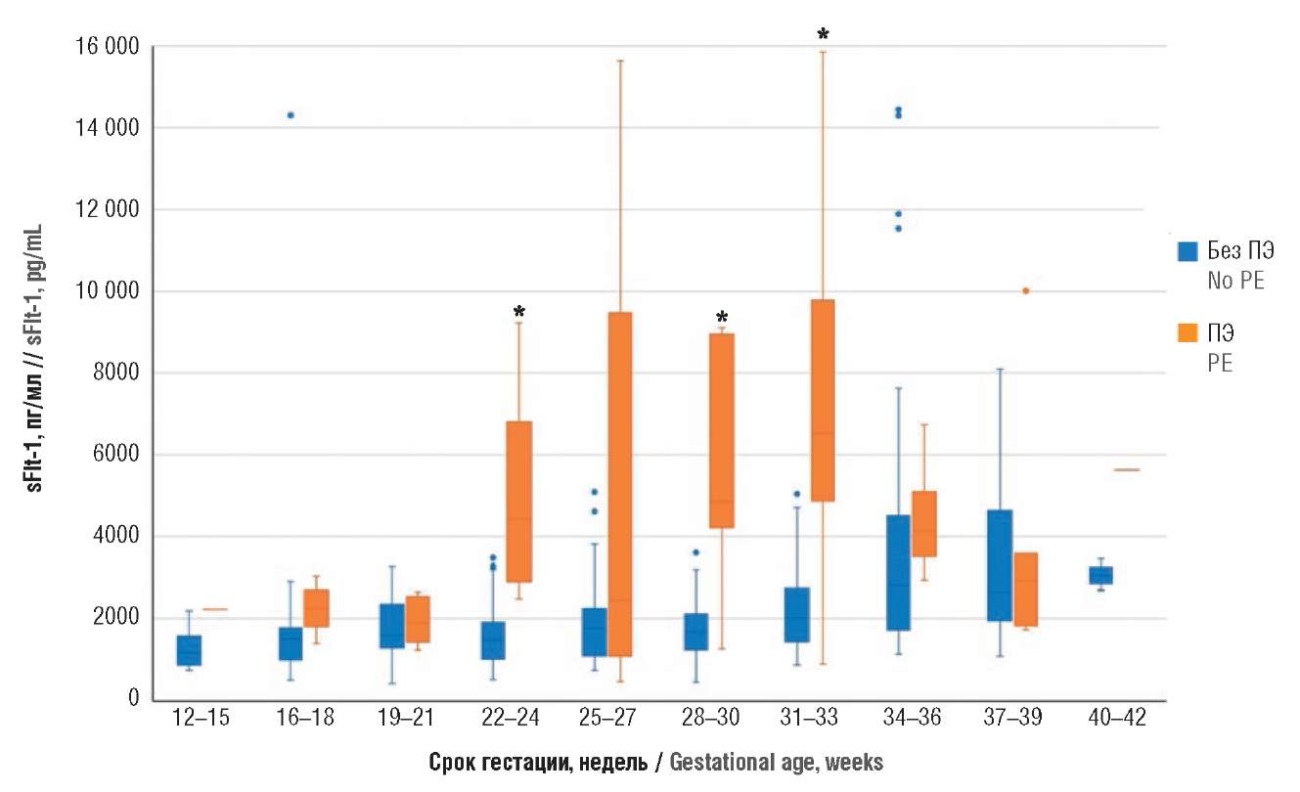
Рисунок 8. Сравнение уровней антиангиогенного фактора – растворимой fms-подобной тирозинкиназы-1 (sFlt-1) на разных сроках гестации у пациенток с экстрагенитальными заболеваниями с преэклампсией и без преэклампсии (ПЭ).
Примечание: *р < 0,05 – различия статистически значимы по сравнению с пациентками без преэклампсии; свободные элементы – выбросы.
Figure 8. Comparison of gestational age-related anti-angiogenic factor – soluble fms-like tyrosine kinase-1 (sFlt-1) levels in patients with extragenital pathology with and without preeclampsia (PE).
Note: *p < 0.05 – significant differences compared with patients without preeclampsia; free elements are outliers.
Аналогичным образом проанализирован и проангиогенный фактор PlGF, статистически значимые изменения содержания маркера отмечали на сроке гестации 28–30 (р = 0,002) и 31–33 (р = 0,001) недели (табл. 8, рис. 9) соответственно.
Таблица 8. Значения проангиогенного фактора – плацентарного фактора роста (PlGF) на разных сроках гестации у пациенток с экстрагенитальной патологией с преэклампсией и без преэклампсии (ПЭ).
Table 8. Gestational age-related pro-angiogenic factor – рlacental growth factor (PlGF) levels in patients with extragenital pathology with and without preeclampsia (PE).
|
Срок гестации, недель Gestational age, weeks |
PlGF, пг/мл // PlGF, pg/mL Ме [ Q1; Q3] |
p |
|
|
Без ПЭ / No PE n = 345 |
ПЭ / PE n = 94 |
||
|
12–15 |
56 [ 35; 102] |
17 |
– |
|
16–18 |
109 [ 71; 157] |
88 [ 52; 120] |
0,282 |
|
19–21 |
164 [ 99; 224] |
153 [ 78; 161] |
0,423 |
|
22–24 |
259 [ 167; 387] |
120 [ 15; 236] |
0,053 |
|
25–27 |
350 [ 236; 537] |
191 [ 47; 252] |
0,105 |
|
28–30 |
410 [ 334; 681] |
85 [ 69; 187] |
0,002 |
|
31–33 |
284 [ 177; 462] |
96 [ 63; 165] |
0,001 |
|
34–36 |
230 [ 139; 383] |
177 [ 123; 256] |
0,298 |
|
37–39 |
175 [ 90; 244] |
107 [ 66; 126] |
0,371 |
|
40–42 |
347 [ 306; 388] |
50 |
– |
Примечание: выделены значимые различия.
Note: significant differences are highlighted in bold.
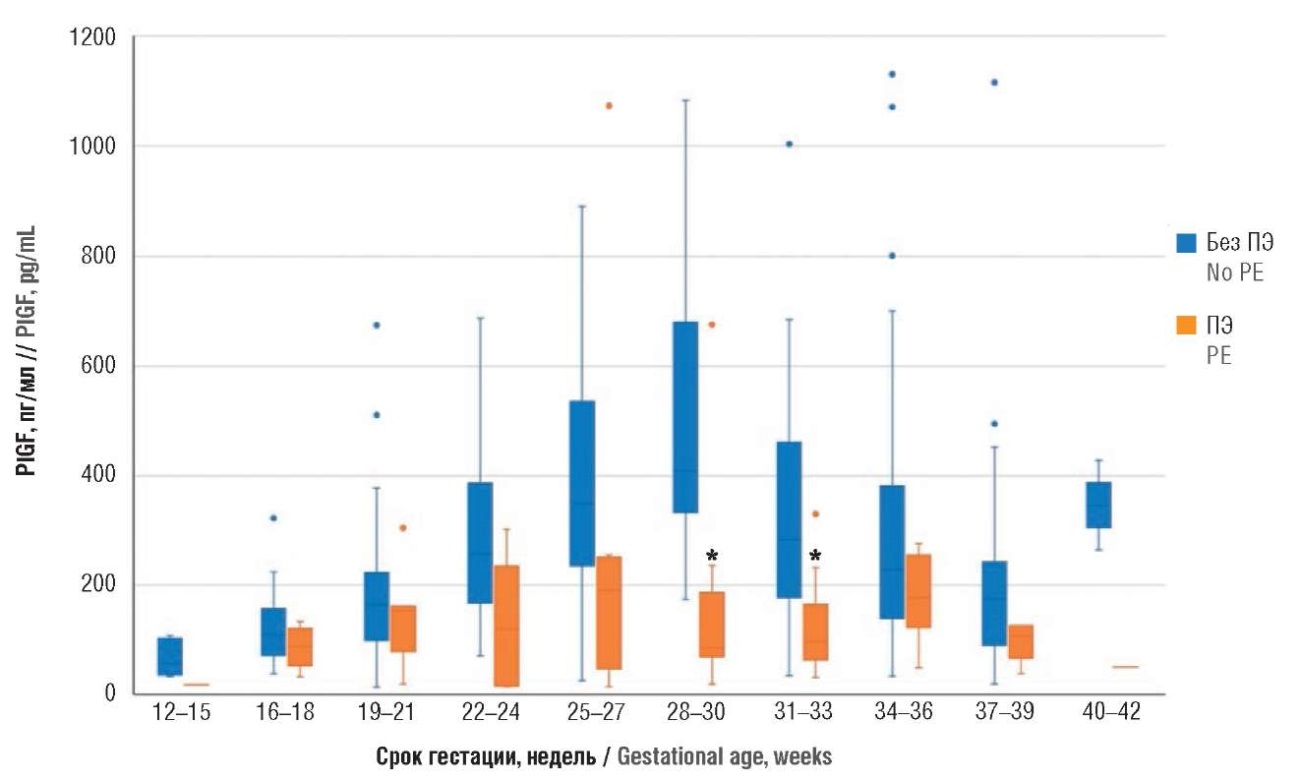
Рисунок 9. Сравнение уровней проангиогенного фактора – плацентарного фактора роста (PlGF) на разных сроках гестации у пациенток с экстрагенитальной патологией с преэклампсией и без преэклампсии (ПЭ).
Примечание: *р < 0,05 – различия статистически значимы по сравнению с пациентками без преэклампсии; свободные элементы – выбросы.
Figure 9. Comparison of gestational age-related pro-angiogenic factor – placental growth factor (PlGF) levels in patients with extragenital pathology with and without preeclampsia (PE).
Note: *p < 0.05 – significant differences compared with patients without preeclampsia; free elements are outliers.
Проведена и оценка коэффициента sFlt-1/PlGF (табл. 9, рис. 10), установлены статистически значимые изменения, начиная с 22–24 недель гестации (р = 0,003), а также на сроке 28–30 (р < 0,0001) и 31–33 (р < 0,0001) недели гестации.
Таблица 9. Значения соотношения sFlt-1/PlGF на разных сроках гестации у пациенток с экстрагенитальной патологией с преэклампсией и без преэклампсии (ПЭ).
Table 9. Gestational age-related sFlt-1/PlGF ratio in patients with extragenital pathology with and without preeclampsia (PE).
|
Срок гестации, недель Gestational age, weeks |
sFlt-1/PlGF Ме [ Q1; Q3] |
p |
|
|
Без ПЭ / No PE n = 345 |
ПЭ / PE n = 94 |
||
|
12–15 |
20,3 [ 15,6; 20,9] |
127,8 |
– |
|
16–18 |
12,4 [ 8,9; 15,8] |
29,6 [ 22,3; 44,6] |
0,089 |
|
19–21 |
10,7 [ 6,6; 21,8] |
13,7 [ 8,9; 35,4] |
0,548 |
|
22–24 |
6,2 [ 3,4; 10,0] |
213,1 [ 12,6; 424,2] |
0,003 |
|
25–27 |
4,3 [ 3,2; 8,1] |
13,1 [ 4,4; 563,3] |
0,253 |
|
28–30 |
3,5 [ 2,1; 6,2] |
66,9 [ 14,9; 107,3] |
< 0,0001 |
|
31–33 |
6,4 [ 3,9; 12,3] |
61,9 [ 21,2; 120,5] |
< 0,0001 |
|
34–36 |
11,7 [ 5,5; 31,6] |
24,4 [ 23,3; 28,7] |
0,116 |
|
37–39 |
18,1 [ 9,0; 40,9] |
28,6 [ 27,5; 46,1] |
0,353 |
|
40–42 |
9,6 [ 8,0; 11,3] |
112,6 |
– |
Примечание: выделены значимые различия.
Note: significant differences are highlighted in bold.
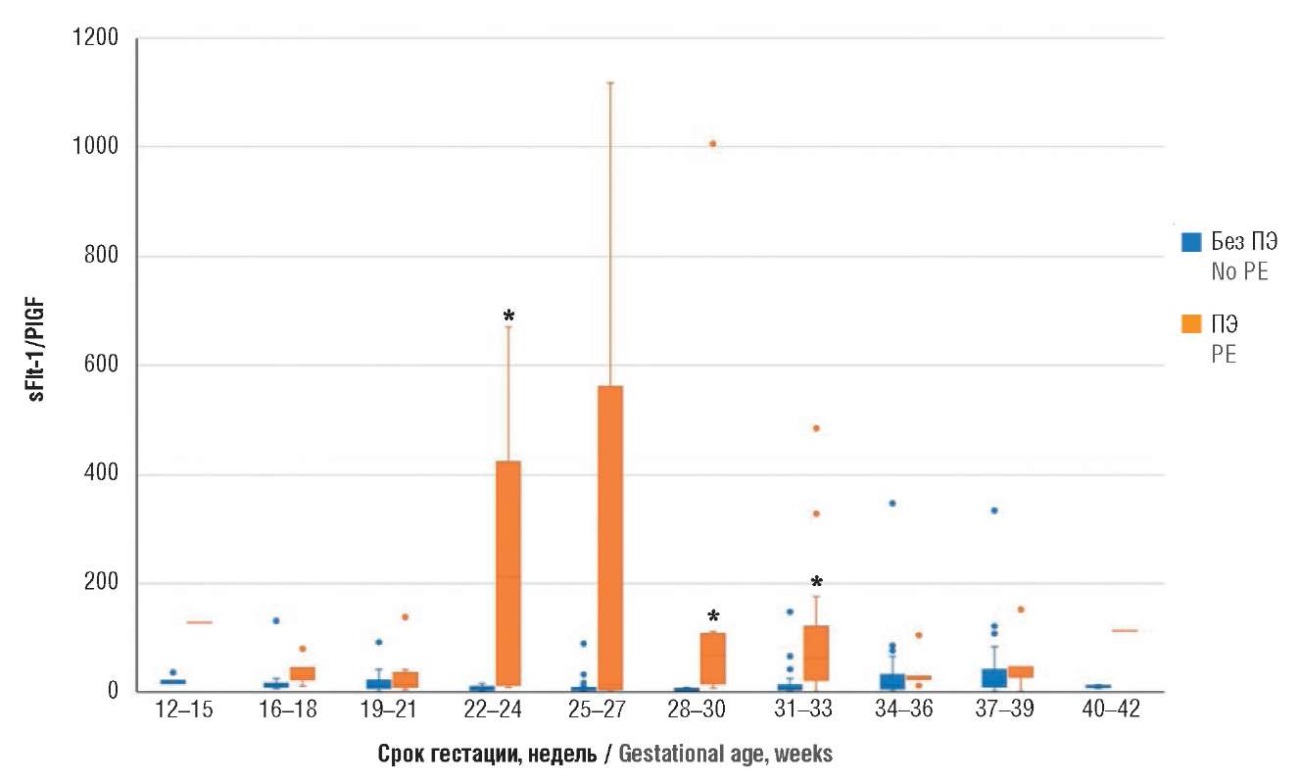
Рисунок 10. Сравнение соотношения sFlt-1/PlGF на разных сроках гестации у пациенток с экстрагенитальной патологией с преэклампсией и без преэклампсии (ПЭ).
Примечание: *р < 0,05 – различия статистически значимы по сравнению с пациентками без преэклампсии; свободные элементы – выбросы.
Figure 10. Comparison of gestational age-related sFlt-1/PlGF ratio in patients with extragenital pathology with and without preeclampsia (PE).
Note: *p < 0.05 – significant differences compared with patients without preeclampsia; free elements are outliers.
Таким образом, маркеры имеют прогностическую ценность с 22‑й по 33-ю неделю беременности, причем в этот период может выявляться как ранняя, так и поздняя ПЭ. После 33‑й недели гестации эти маркеры становятся неинформативными.
Анализ показателей sFlt-1 и PlGF и соотношения sFlt-1/PlGF у пациенток с экстрагенитальными заболеваниями с ПЭ и без ПЭ на протяжении всей беременности для прогнозирования времени наступления ПЭ / Quantitating pregnancy-related sFlt-1 and PlGF levels along with sFlt-1/PlGF ratio in pregnant women with extragenital diseases, with and without preeclampsia for predicting timing of preeclampsia onset
Для прогнозирования времени наступления ПЭ у беременных с экстрогенитальными заболеваниями были проанализированы биомаркеры, а также был произведен обратный отсчет сроков гестации до родов.
Так, при анализе антиангиогенного фактора sFlt-1 были получены статистически значимые различия у беременных с ПЭ по отношению к беременным без ПЭ (p = 0,0003), начиная с 4 недель до родов (табл. 10, рис. 11). В то же время при анализе проангиогенного фактора PlGF статистически значимые изменения (p = 0,015) были выявлены за 6 недель до родов (табл. 11, рис. 12). Аналогичным образом был произведен расчет и для соотношения sFlt-1/PlGF, статистически значимые изменения (p = 0,018) также обнаружены за 6 недель до родов (табл. 12, рис. 13).
Таблица 10. Значения антиангиогенного фактора – растворимой fms-подобной тирозинкиназы-1 (sFlt-1) в динамике у беременных с экстрагенитальными заболеваниями с преэклампсией и без преэклампсии (ПЭ), обратный отсчет времени до родов.
Table 10. Countdown to delivery: anti-angiogenic factor – soluble fms-like tyrosine kinase-1 (sFlt-1) levels in pregnant women with extragenital diseases with and without preeclampsia (PE) in dynamics.
|
Срок гестации, недель Gestational age, weeks |
sFlt-1, пг/мл // sFlt-1, pg/mL Ме [ Q1; Q3] |
p |
|
|
Без ПЭ / No PE n = 345 |
ПЭ / PE n = 94 |
||
|
–23 |
1432 [ 966; 1538] |
– |
– |
|
–18 |
1714 [ 1211; 2290] |
1993 [ 1426; 2676] |
0,453 |
|
–14 |
1550 [ 1043; 2072] |
1944 [ 1239; 2644] |
0,628 |
|
–10 |
1832 [ 1308; 2147] |
2162 [ 1822; 2360] |
0,502 |
|
–8 |
1624 [ 1267; 2560] |
2607 [ 1479; 2875] |
0,551 |
|
–6 |
2145 [ 1634; 2959] |
3743 [ 2816; 4792] |
0,232 |
|
–4 |
2130 [ 1608; 2845] |
6115 [ 4816; 8307] |
0,0003 |
|
–3 |
2427 [ 1849; 3645] |
6743 [ 5324; 8784] |
0,008 |
|
–2 |
2734 [ 1978; 5637] |
8087 [ 3756; 11250] |
0,107 |
|
–1 |
3280 [ 2379; 4246] |
6892 [ 4562; 10353] |
0,007 |
Примечание: выделены значимые различия.
Note: significant differences are highlighted in bold.
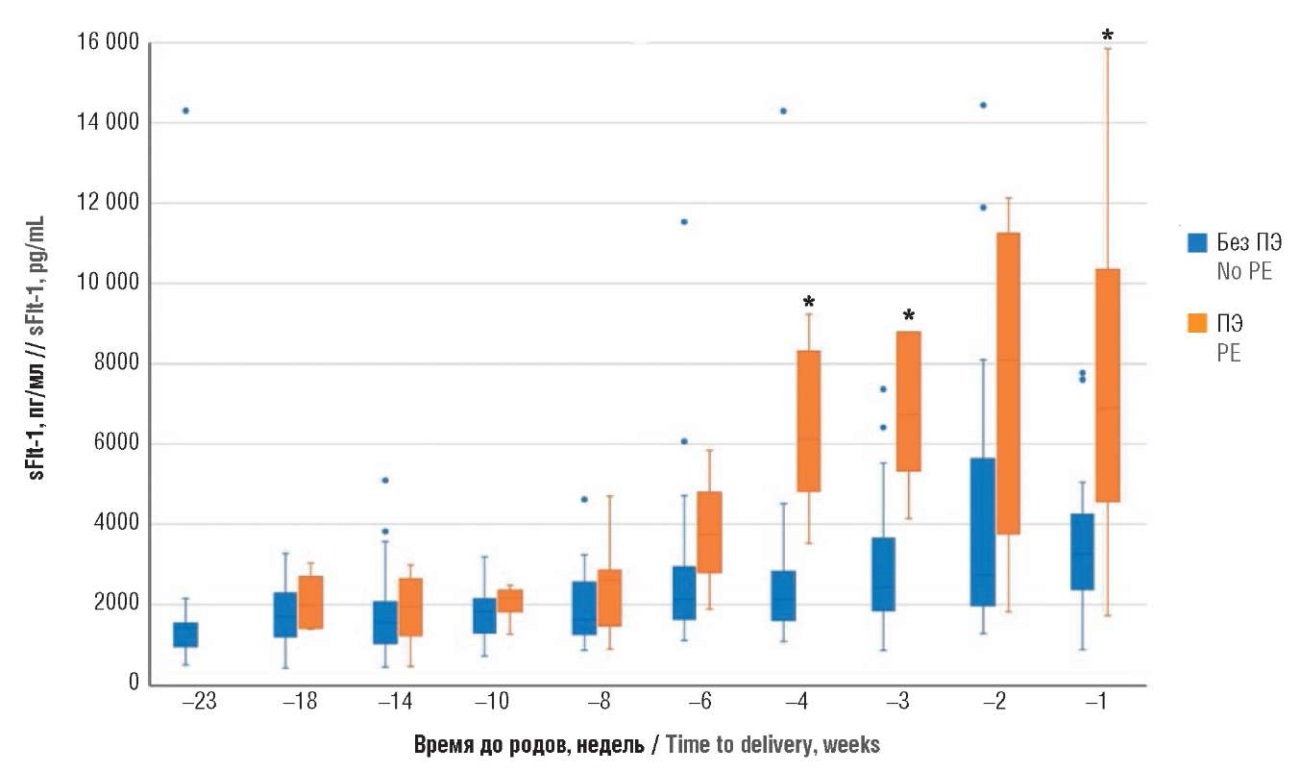
Рисунок 11. Сравнение значений антиангиогенного фактора – растворимой fms-подобной тирозинкиназы-1 (sFlt-1) в динамике у беременных с экстрагенитальными заболеваниями с преэклампсией и без преэклампсии (ПЭ), обратный отсчет времени до родов.
Примечание: *р < 0,05 – различия статистически значимы по сравнению с пациентками без преэклампсии; свободные элементы – выбросы.
Figure 11. Countdown to delivery: comparison of anti-angiogenic factor – soluble fms-like tyrosine kinase-1 (sFlt-1) levels in pregnant women with extragenital diseases with and without preeclampsia (PE) in dynamics.
Note: *p < 0.05 – significant differences compared with patients without preeclampsia; free elements are outliers.
Таблица 11. Значения проангиогенного фактора – плацентарного фактора роста (PlGF) в динамике у беременных с экстрагенитальными заболеваниями с преэклампсией и без преэклампсии (ПЭ), обратный отсчет времени до родов.
Table 11. Countdown to delivery: pro-angiogenic factor – placental growth factor (PlGF) levels in pregnant women with extragenital diseases with and without preeclampsia (PE) in dynamics.
|
Срок гестации, недель Gestational age, weeks |
PlGF, пг/мл // PlGF, pg/mL Ме [ Q1; Q3] |
p |
|
|
Без ПЭ / No PE n = 345 |
ПЭ / PE n = 94 |
||
|
–23 |
94 [ 52; 152] |
– |
– |
|
–18 |
183 [ 107; 225] |
125 [ 95; 140] |
0,133 |
|
–14 |
346 [ 224; 503] |
223 [ 145; 256] |
0,061 |
|
–10 |
354 [ 246; 696] |
139 [ 117; 181] |
0,024 |
|
–8 |
473 [ 309; 588] |
240 [ 99; 676] |
0,412 |
|
–6 |
283 [ 148; 516] |
56 [ 35; 74] |
0,015 |
|
–4 |
230 [ 172; 383] |
71 [ 41; 133] |
0,003 |
|
–3 |
248 [ 146; 409] |
107 [ 85; 177] |
0,058 |
|
–2 |
210 [ 125; 341] |
210 [ 90; 312] |
0,865 |
|
–1 |
146 [ 87; 254] |
50 [ 35; 94] |
0,006 |
Примечание: выделены значимые различия.
Note: significant differences are highlighted in bold.

Рисунок 12. Сравнение значений проангиогенного фактора – плацентарного фактора роста (PlGF) в динамике у беременных с экстрагенитальными заболеваниями с преэклампсией и без преэклампсии (ПЭ), обратный отсчет времени до родов.
Примечание: *р < 0,05 – различия статистически значимы по сравнению с пациентками без преэклампсии; свободные элементы – выбросы.
Figure 12. Countdown to delivery: comparison of pro-angiogenic factor – placental growth factor (PlGF) levels in pregnant women with extragenital diseases with and without preeclampsia (PE) in dynamics.
Note: *p < 0.05 – significant differences compared with patients without preeclampsia; free elements are outliers.
Таблица 12. Значения соотношения sFlt-1/PlGF в динамике у беременных с экстрагенитальными заболеваниями с преэклампсией и без преэклампсии (ПЭ), обратный отсчет времени до родов.
Table 12. Countdown to delivery: angiogenic sFlt-1/PlGF ratio in pregnant women with extragenital diseases with and without preeclampsia (PE) in dynamics.
|
Срок гестации, недель Gestational age, weeks |
sFlt-1/PlGF Ме [ Q1; Q3] |
p |
|
|
Без ПЭ / No PE n = 345 |
ПЭ / PE n = 94 |
||
|
–23 |
15,5 [ 9,4; 21,8] |
– |
– |
|
–18 |
11,0 [ 7,1; 15,7] |
18,4 [ 10,1; 39,6] |
0,300 |
|
–14 |
4,4 [ 2,8; 8,1] |
12,5 [ 4,1; 18,3] |
0,096 |
|
–10 |
5,0 [ 1,9; 6,9] |
11,8 [ 9,0; 21,0] |
0,009 |
|
–8 |
4,1 [ 2,3; 5,1] |
12,0 [ 6,9; 15,0] |
0,101 |
|
–6 |
6,8 [ 4,6; 12,6] |
66,9 [ 43,6; 240,1] |
0,018 |
|
–4 |
10,0 [ 3,7; 23,3] |
91,8 [ 43,7; 190,1] |
0,0003 |
|
–3 |
12,9 [ 5,4; 20,8] |
49,7 [ 24,4; 103,7] |
0,006 |
|
–2 |
14,9 [ 6,9; 51,2] |
46,4 [ 13,3; 132,6] |
0,329 |
|
–1 |
21,2 [ 10,4; 42,4] |
112,6 [ 37,3; 252,9] |
0,002 |
Примечание: выделены значимые различия.
Note: significant differences are highlighted in bold.
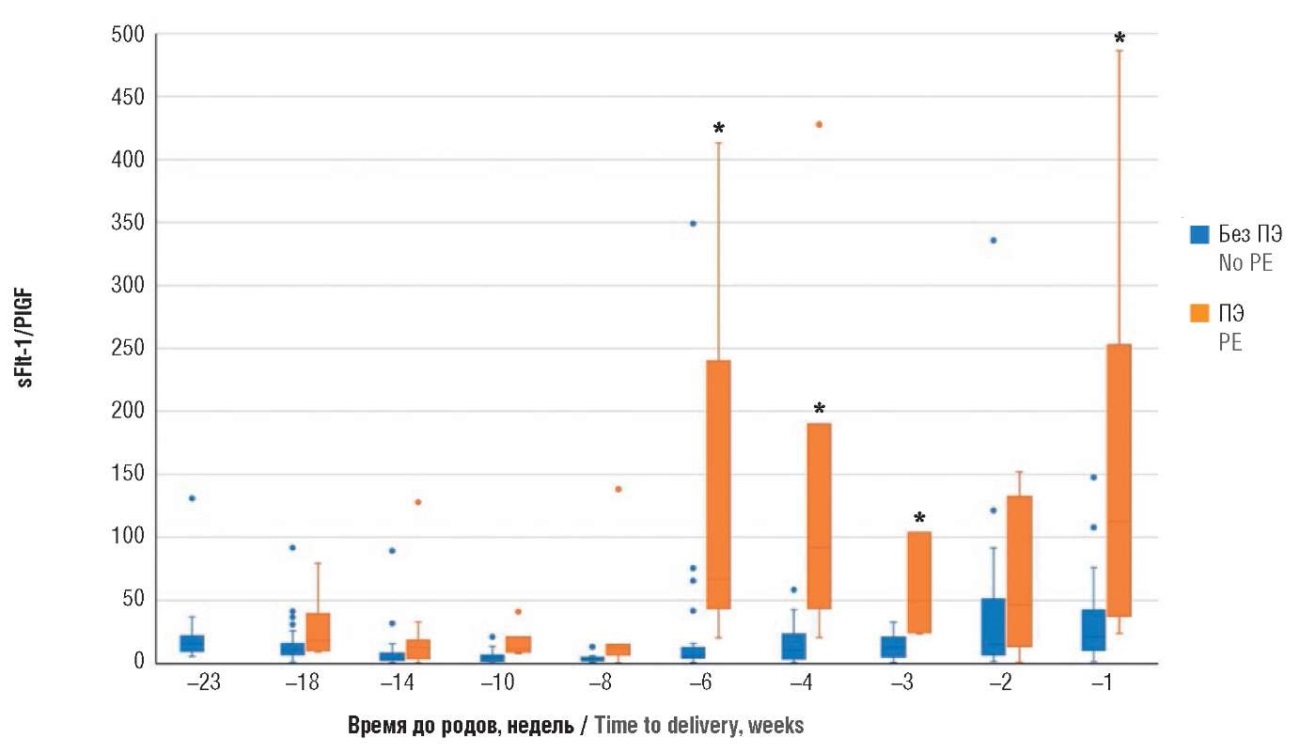
Рисунок 13. Сравнение соотношения sFlt-1/PlGF в динамике у беременных с экстрагенитальными заболеваниями с преэклампсией и без преэклампсии (ПЭ), обратный отсчет времени до родов.
Примечание: *р < 0,05 – различия статистически значимы по сравнению с пациентками без преэклампсии; свободные элементы – выбросы.
Figure 13. Countdown to delivery: comparison of angiogenic sFlt-1/PlGF ratio in pregnant women with extragenital diseases with and without preeclampsia (PE) in dynamics.
Note: *p < 0.05 – significant differences compared with patients without preeclampsia; free elements are outliers.
Анализ показателей sFlt-1 и PlGF и соотношения sFlt-1/PlGF у пациенток с экстрагенитальными заболеваниями с ПЭ для определения эффективности маркеров / Assessing prognostic value for sFlt-1 and PlGF levels along with sFlt-1/PlGF ratio in pregnant patients with extragenital diseases and preeclampsia
Для решения вопроса о диагностической значимости биомаркеров были построены ROC-кривые для определения их эффективности в диагностике ПЭ. Для построения ROC-кривых взяты данные определения биомаркеров в 22–33 недели гестации. Точка отсечения для каждого показателя взята при оптимальном соотношении чувствительности и специфичности, т. е. при их наиболее высоких значениях.
Для антиангиогенного фактора sFlt-1 точкой отсечения стало значение 3675, т. е. у пациенток с более высокими значениями развилась ПЭ (рис. 14). Точкой отсечения для проангиогенного фактора PlGF стало значение 256, при значениях ниже у пациенток развивалась ПЭ (рис. 15).
Аналогичным образом проанализировано соотношение sFlt-1/PlGF. По чувствительности, специфичности и AUC (площади под ROC-кривой) этот показатель оказался самым эффективным в диагностике ПЭ. Точка отсечения достаточно низкая – 11,8, т. е. при соотношении выше этого значения ПЭ развивалась у большинства пациенток с экстрагенитальными заболеваниями (рис. 16).
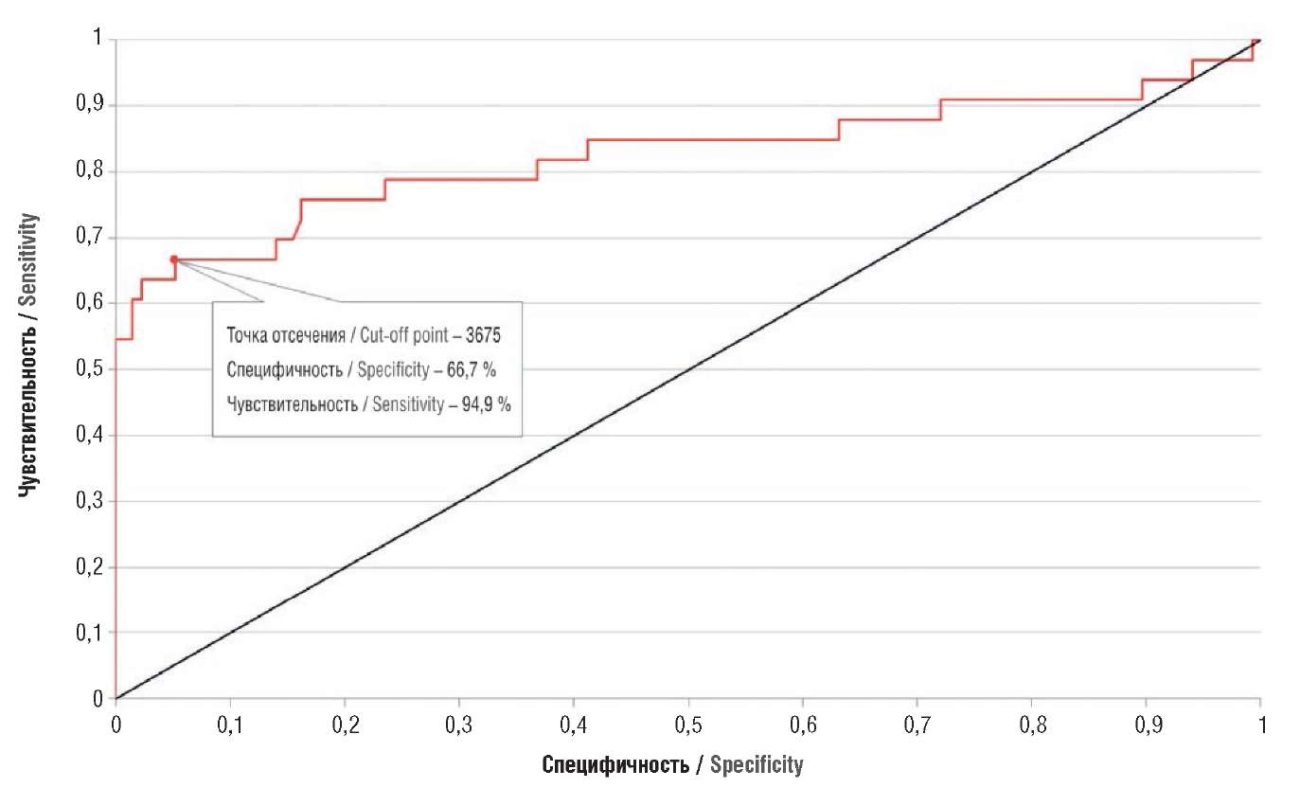
Рисунок 14. ROC-кривая для антиангиогенного фактора sFlt-1 у беременных с преэклампсией и экстрагенитальными заболеваниями; AUC = 0,825.
Figure 14. ROC curve for anti-angiogenic sFlt-1 factor in pregnant women with preeclampsia and extragenital diseases; AUC = 0.825.
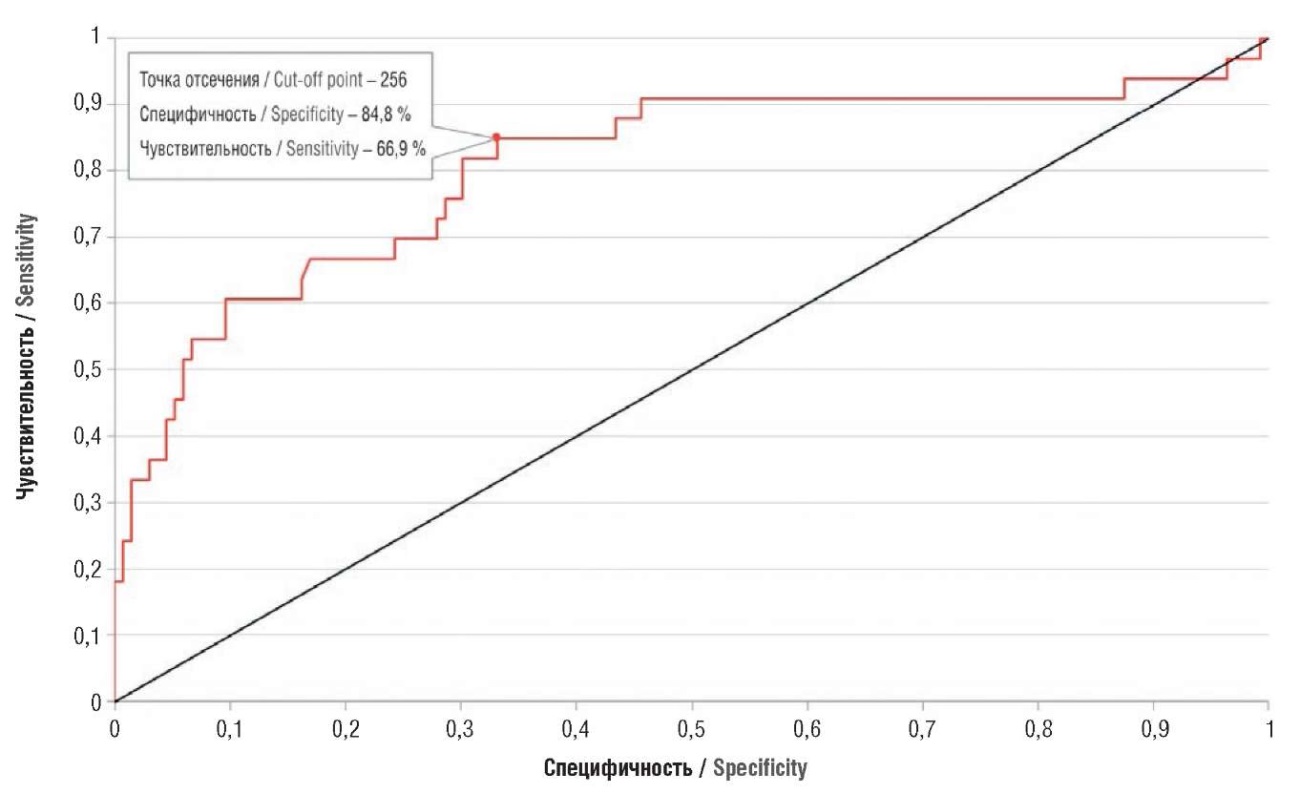
Рисунок 15. ROC-кривая для проангиогенного фактора PlGF у беременных с преэклампсией и экстрагенитальными заболеваниями; AUC = 0,806.
Figure 15. ROC curve for pro-angiogenic factor PlGF in pregnant women with preeclampsia and extragenital diseases; AUC = 0.806.
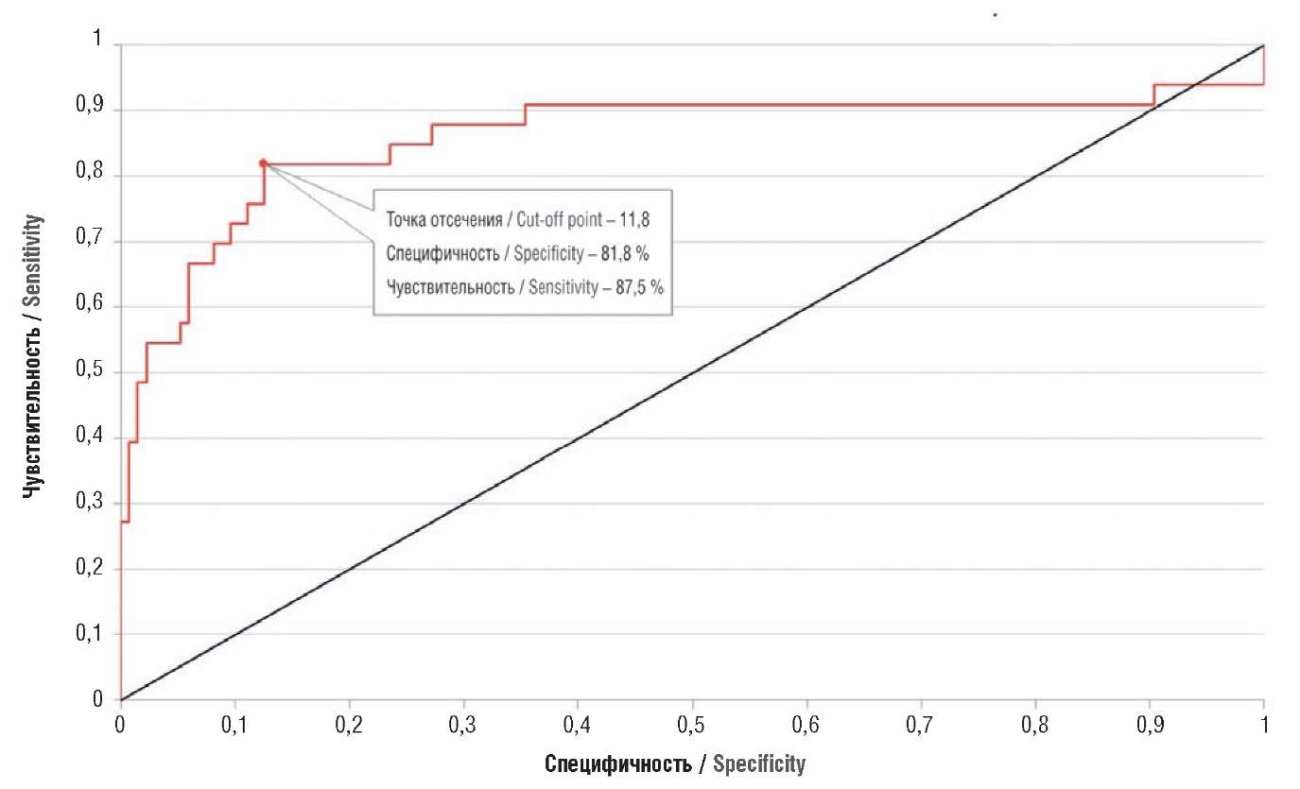
Рисунок 16. ROC-кривая для соотношения sFlt-1/PlGF у беременных с преэклампсией и экстрагенитальными заболеваниями; AUC = 0,859.
Figure 16. ROC curve for PlGF ratio in pregnant women with preeclampsia and extragenital diseases; AUC = 0.859.
Обсуждение / Discussion
Как было отмечено ранее, в настоящее время в диагностике и прогнозировании ПЭ используются антиангиогенный и проангиогенный биомаркеры – sFlt-1 и PlGF, соответственно. По данным литературы установлено, что значение соотношения sFlt/PlGF < 38 позволяет исключить развитие ПЭ в течение 7 дней. При сроке беременности до 34 недель значение соотношения sFlt/PlGF > 85, а при сроке беременности более 34 недель соотношение sFlt/PlGF > 110 свидетельствуют о высокой вероятности развития ПЭ или о ее наличии [2][3]. В отечественных источниках описываются исследования при некоторых соматических заболеваниях. Так, В.Ф. Беженарь с соавт. предлагают в качестве порога для дифференциальной диагностики между ПЭ и заболеванием почек использовать значение sFlt-1/PlGF = 150,25, которое дает чувствительность и специфичность 100 % [24]. Эффективность использования соотношения sFlt-1/PlGF для дифференциальной диагностики хронической болезни почек и ПЭ показана и в работе И.Г. Никольской с соавт. [25]. Однако и при других соматических заболеваниях, которые являются факторами риска развития ПЭ, значения биомаркеров sFlt-1, PLGF и их соотношения при ПЭ могут отличаться от общепринятых критериев, в связи с чем нами было инициировано данное исследование.
Согласно полученным нами результатам, определение в сыворотке крови ангиогенных факторов в качестве биомаркеров ПЭ высокоэффективно при ранней ПЭ и менее эффективно при поздней ПЭ у беременных с экстрагенитальными заболеваниями. Также в ходе определения более точного срока «работы» маркеров и их прогностической ценности на протяжении всего периода беременности выявлено, что исследуемые биомаркеры имеют прогностическую ценность с 22‑й по 33-ю неделю беременности, причем в этот период может выявляться как ранняя, так и поздняя ПЭ. После 33‑й недели гестации sFlt-1 и PlGF становятся неинформативными.
Клинически значимым для прогнозирования времени наступления ПЭ при расчетах для беременных с экрагенитальными заболеваниями, проведя анализ ангиогенных биомаркеров, можно сделать вывод, что развитие ПЭ можно прогнозировать за 6 недель до родоразрешения: расчет для соотношения sFlt-1/PlGF показал статистически значимые изменения (p = 0,018).
Немаловажным оказалось исследование точки отсечения, которое отличается от общепринятых значений sFlt/PlGF < 38: в нашем исследовании оно оказалось достаточно низким – 11,8, т. е. при соотношении выше этого значения ПЭ развивалась у большинства пациенток с экстрагенитальными заболеваниями.
Заключение / Сonclusion
Согласно полученным результатам, можно утверждать о прогностической и диагностической ценности определения sFlt-1 и PlGF как биомаркеров ПЭ у беременных с экстрагенитальными заболеваниями в конце II – начале III триместров беременности. В порядке убывания ценность биомаркеров располагается следующем образом: соотношение sFlt-1/PlGF > антиангиогенный фактор sFlt-1 > проангиогенный фактор PlGF, что ясно демонстрируют расчеты соответствующих ROC-кривых. По чувствительности, специфичности и AUC соотношение sFlt-1/PlGF оказалось самым эффективным в диагностике ПЭ. Точка отсечения достаточно низкая – 11,8, т. е. при соотношении выше этого значения ПЭ развивалась у большинства пациенток с экстрагенитальными заболеваниями. У беременных с экстрагенитальными заболеваниями значения ангиогенных биомаркеров существенно различаются: при ранней ПЭ на сроках беременности с 22‑й по 33-ю недели и при поздней – на сроках с 25‑й по 30-ю недели. Максимальная глубина прогноза риска возникновения ПЭ составляет 6 недель.
Список литературы
1. Tsigas E.Z. The Preeclampsia Foundation: the voice and views of the patient and her family. Am J Obstet Gynecol. 2022;226(2S):S1254–S1264.e1. https://doi.org/10.1016/j.ajog.2020.10.053.
2. Ma'ayeh M., Costantine M.M. Prevention of preeclampsia. Semin Fetal Neonatal Med. 2020;25(5):101123. https://doi.org/10.1016/j.siny.2020.101123.
3. Юсупова З.С., Новикова В.А., Оленев А.С. Современные представления о преэклампсии – патогенез, диагностика, прогнозирование. Практическая медицина. 2018;16(6):45–51. https://doi.org/10.32000/2072-1757-2018-16-6-45-51.
4. Ramos J.G.L., Sass N., Costa S.H.M. Preeclampsia. Rev Bras Ginecol Obstet. 2017;39(9):496–512. https://doi.org/10.1055/s-0037-1604471.
5. Сидорова И.С., Филиппов О.С., Никитина Н.А., Гусева Е.В. Причины материнской смертности от преэклампсии и эклампсии в 2013 году. Акушерство и гинекология. 2015;(4):11–7.
6. Серов В.Н. Профилактика материнской смертности. Акушерство и гинекология. 2011;(7–1):4–10.
7. Magee L.A., Brown M.A., Hall G.R. et al. The 2021 International Society for the Study of Hypertension in Pregnancy classification, diagnosis & management recommendations for international practice. Pregnancy Hypertens. 2022;27:148–69. https://doi.org/10.1016/j.preghy.2021.09.008.
8. Poon L., Shennan A., Hyett J.A. et al. The International Federation of Gynecology and Obstetrics (FIGO) initiative on pre-eclampsia: A pragmatic guide for first-trimester screening and prevention. Int J Gynaecol Obstet. 2019;145 Suppl 1(Suppl 1):1–33. https://doi.org/10.1002/ijgo.12802.
9. Pittara T., Vyrides A., Lamnisos D., Giannakou K. Pre-eclampsia and long-term health outcomes for mother and infant: an umbrella review. BJOG. 2021;128(9):1421–30. https://doi.org/10.1111/1471-0528.16683.
10. Kvalvik L., Wilcox A.J., Skjærven R. et al. Term complications and subsequent risk of preterm birth. BMJ. 2020;369:m1007. https://doi.org/10.1136/bmj.m1007.
11. Серов В.Н. Гестоз – современная лечебная тактика. Русский медицинский журнал. 2005;13(1):2–6.
12. Савельева Г.М., Кулаков В.И., Серов В.Н. и др. Современные подходы к диагностике, профилактике и лечению гестоза. Вестник Российской ассоциации акушеров-гинекологов. 2001;1(3):66–72.
13. Lee W., O'Connell C.M., Baskett T.F. Maternal and perinatal outcomes of eclampsia: Nova Scotia, 1981-2000. J Obstet Gynaecol Can. 2004;26(2):119–23. https://doi.org/10.1016/s1701-2163(16)30487-x.
14. Dimitriadis E., Rolnik D.L., Zhou W. et al. Pre-eclampsia. Nat Rev Dis Primers. 2023;9(1):8. https://doi.org/10.1038/s41572-023-00417-6.
15. Клинические рекомендации – Преэклампсия. Эклампсия. Отеки, протеинурия и гипертензивные расстройства во время беременности, в родах и послеродовом периоде – 2024-2025-2026 (05.09.2024). М.: Министерство здравоохранения Российской Федерации, 2024. 53 с. Режим доступа: http://disuria.ru/_ld/15/1564_kr24O10O16MZ.pdf. [Дата обращения: 15.05.2025].
16. Webster K., Fishburn S., Maresh M. et al. Diagnosis and management of hypertension in pregnancy: summary of updated NICE guidance. BMJ. 2019;366:l5119. https://doi.org/10.1136/bmj.l5119.
17. Здравоохранение в России: cтатистический сборник. М.: Федеральная служба государственной статистики (Росстат), 2023. 179 с.
18. ACOG Practice Bulletin No. 202: Gestational hypertension and preeclampsia. Obstet Gynecol. 2019;133(1):e1–25. https//doi.org/10.1097/AOG.0000000000003018.
19. Шалина Р.И., Михалева Л.М., Симухина М.А. и др. Особенности клинического течения тяжелых форм преэклампсии в современных условиях. Вопросы гинекологии, акушерства и перинатологии. 2017;16(6):16–23.
20. Резолюция Совета экспертов «Нормативный регламент и вопросы организации скрининга и прогнозирования преэклампсии в РФ». Акушерство и гинекология. 2021;(5):219–21. https://doi.org/10.18565/aig.2021.5.219-221.
21. Ходжаева З.С., Холин А.М., Шувалова М.П. и др. Российская модель оценки эффективности теста на преэклампсию sFlt-1/PlGF. Акушерство и гинекология. 2019;(2):52–8. https://doi.org/10.18565/aig.2019.2.52-58.
22. Stepan H., Hund M., Dilba P. et al. Elecsys® and Kryptor immunoassays for the measurement of sFlt-1 and PlGF to aid preeclampsia diagnosis: are they comparable? Clin Chem Lab Med. 2019;57(9):1339–48. https://doi.org/10.1515/cclm-2018-1228.
23. Гурьева В.М., Травкина А.А., Матвеев М.О. и др. Клиническое значение sFlt-1/PlGF в диагностике и прогнозировании преэклампсии. Акушерство и гинекология. 2021;(7):195–200. https://doi.org/10.18565/aig.2021.7.195-200.
24. Беженарь В.Ф., Смирнов А.В., Тимирбулатов Р.Р. и др. Почечная дисфункция при преэклампсии: прогнозирование и дифференциальный диагноз. Часть 1. Доктор Ру. 2020;19(6):23–9. https://doi.org/10.31550/1727-2378-2020-19-6-23-29.
25. Никольская И.Г., Прокопенко Е.И., Ватазин А.В., Будыкина Т.С. Ангиогенные и антиангиогенные факторы у беременных с хронической болезнью почек: роль коэффициента sFlt-1/PlGF в прогнозировании и диагностике преэклампсии. Нефрология и диализ. 2016;18(4):440–51.
Об авторах
М. О. МатвеевРоссия
Матвеев Максим Олегович
123423 Москва, ул. Саляма Адиля, д. 2/44
Е. И. Прокопенко
Россия
Прокопенко Елена Ивановна - д.м.н., проф. Scopus Author ID: 6603371670. WoS ResearcherID: M-4222-2014. eLibrary SPIN-code: 1396-4369.
129110 Москва, ул. Щепкина, д. 61/2; 101000, Москва, ул. Покровка, д. 22а
И. Г. Никольская
Россия
Никольская Ирина Георгиевна - д.м.н. Scopus Author ID: 57206276951. WoS ResearcherID: JZE-2597-2024. eLibrary SPIN-code: 9928-6390.
101000, Москва, ул. Покровка, д. 22а
А. А. Федосов
Россия
Федосов Алексей Анатольевич - к.м.н.
117198 Москва, ул. Миклухо-Маклая, д. 6
Д. В. Блинов
Россия
Блинов Дмитрий Владиславович - д.м.н. Scopus Author ID: 6701744871. WoS ResearcherID: E-8906-2017. eLibrary SPIN-code: 9779-8290.
101000 Москва, Лялин переулок, д. 11–13/1; 123056 Москва, 2-я Брестская ул., д. 5, с. 1–1а; 141551 Московская область, деревня Голубое, ул. Родниковая, стр. 6, к. 1
В. О. Бицадзе
Россия
Бицадзе Виктория Омаровна - д.м.н., проф., профессор РАН. Scopus Author ID: 6506003478. WoS ResearcherID: F-8409-2017.
119048 Москва, ул. Трубецкая, д. 8, стр. 2
Что уже известно об этой теме?
► Во время беременности у пациенток с экстрагенитальными заболеваниями повышается риск развития преэклампсии (ПЭ).
► Плацентарный фактор роста (PlGF) и растворимая fms-подобная тирозинкиназа-1 (sFlt-1) играют важную роль в развитии ПЭ, так как гиперпродукция одного фактора блокирует действия другого фактора, что приводит к развитию клинической симптоматики.
Что нового дает статья?
► Впервые в мире показана высокая значимость биомаркеров в диагностике ранней ПЭ у беременных с наличием экстрагенитальных заболеваний: сахарного диабета 1-го и 2-го типа, хронической артериальной гипертензии, хронического пиелонефрита, хронического гломерулонефрита.
► Определена точка отсечения соотношения sFlt-1/PlGF – 11,8, т. е. при коэффициенте выше этого значения ПЭ развивалась у большинства пациенток с экстрагенитальными заболеваниями.
► Максимальная глубина прогноза риска возникновения ПЭ составляет 6 недель.
Как это может повлиять на клиническую практику в обозримом будущем?
► Включение в рутинную практику исследований биомаркеров sFlt-1 и PlGF и их соотношения позволит более точно прогнозировать наступление ПЭ, а также вовремя оказывать помощь беременным.
Рецензия
Для цитирования:
Матвеев М.О., Прокопенко Е.И., Никольская И.Г., Федосов А.А., Блинов Д.В., Бицадзе В.О. Исследование уровней биомаркеров – растворимой fms-подобной тирозинкиназы-1 (sFlt-1), плацентарного фактора роста (PlGF) и их соотношения sFlt-1/PlGF у пациенток с экстрагенитальными заболеваниями для диагностики ранней и поздней преэклампсии. Акушерство, Гинекология и Репродукция. 2025;19(5):632-653. https://doi.org/10.17749/2313-7347/ob.gyn.rep.2025.671
For citation:
Matveev M.O., Prokopenko E.I., Nikolskaya I.G., Fedosov A.A., Blinov D.V., Bitsadze V.O. Quantitating soluble fms-like tyrosine kinase-1 (sFlt-1) and placental growth factor (PlGF) biomarker levels along with sFlt-1/PlGF ratio in patients with extragenital diseases for diagnostics of early- and late-onset preeclampsia. Obstetrics, Gynecology and Reproduction. 2025;19(5):632-653. (In Russ.) https://doi.org/10.17749/2313-7347/ob.gyn.rep.2025.671

Контент доступен под лицензией Creative Commons Attribution-NonCommercial-ShareAlike 4.0 International License.











































