Перейти к:
Предикторы неблагоприятных перинатальных исходов при преждевременном разрыве плодных оболочек
https://doi.org/10.17749/2313-7347/ob.gyn.rep.2025.622
Аннотация
Введение. У одной из 10 пациенток с преждевременными родами имеют место признаки внутриамниотического воспаления, которое нередко протекает субклинически и приводит к высокому риску развития преждевременного разрыва плодных оболочек (ПРПО).
Цель: выявить предикторы неблагоприятных перинатальных исходов при преждевременном излитии околоплодных вод.
Материалы и методы. В одноцентровое ретроспективное когортное исследование были включены пациентки с ПРПО в сроке от 28 0/7 до 36 6/7 недель беременности. Всего изучено 176 историй родов и стационарных историй болезни новорожденных. Были выделены 2 группы новорожденных: группа 1 – дети, имевшие благоприятный исход на момент выписки из стационара, и группа 2 – плоды или дети с неблагоприятным исходом к моменту выписки из стационара (антенатальная гибель плода, смерть ребенка в неонатальном периоде, внутрижелудочковое кровоизлияние 3-й степени, перивентрикулярная лейкомаляция, тяжелая форма бронхолегочной дисплазии, хирургическая стадия некротизирующего энтероколита). Проводили изучение анамнеза матери, течения беременности и родов, определение индекса амниотической жидкости, величины максимального вертикального размера свободного кармана околоплодных вод, определение тяжести дыхательной недостаточности и нарушений центральной гемодинамики у недоношенных детей, анализ заболеваемости детей, родившихся от матерей с ПРПО за период исследования. Для выявления факторов, влияющих на выживаемость новорожденных, был проведен многофакторный анализ.
Результаты. Антенатальная гибель плода была зарегистрирована в 7 из 176 (3,9 %) случаев, летальный исход из детей, рожденных живыми, составил 7 из 169 (4,1 %). Гестационный возраст (ГВ) при рождении в группе 2 составил 193,0 [180,0; 198,0] дней против группы 1 с благоприятным исходом 238,0 [223,5; 247,0] дней (р < 0,001). В группе 2 хориоамнионит (p < 0,001) и ангидрамнион (p = 0,003) регистрировались чаще; также у детей группы 2 в первые 72 часа жизни чаще требовались интубация трахеи (p < 0,001), введение сурфактанта (p < 0,001), искусственная вентиляция легких (ИВЛ) (p = 0,029) и высокочастотная осцилляторная ИВЛ (p < 0,001); оценка по модифицированной шкале неонатальной полиорганной недостаточности NEOMOD (англ. Neonatal Multiple Organ Dysfunction score) была выше (p < 0,001). У детей группы 2 чаще в носоглотке методом полимеразной цепной реакции выявлялась Ureaplasma рarvum (p = 0,015).
Заключение. Предикторами неблагоприятного исхода у плодов и недоношенных новорожденных детей при ПРПО являлись ангидрамнион, хориоамнионит, более низкие ГВ и масса тела ребенка при рождении, кесарево сечение, высокие значения С-реактивного белка (СРБ) в крови и количества лейкоцитов у беременных перед родами, индекс амниотической жидкости перед родами ≤ 32,0 мм, а также более высокая оценка по шкале NEOMOD, экхимозы по всему телу у ребенка с рождения, выявление у ребенка Ureaplasma рarvum, более низкий уровень гемоглобина и более высокие уровни прокальцитонина и СРБ в первые 72 часа жизни.
Ключевые слова
Для цитирования:
Карпова А.Л., Мостовой А.В., Пониманская М.А., Ли О.Н., Десятник К.А., Мартиросян С.В., Кадын С.Н., Карпов Н.Ю., Шичанина А.А., Кузнецова А.С. Предикторы неблагоприятных перинатальных исходов при преждевременном разрыве плодных оболочек. Акушерство, Гинекология и Репродукция. 2025;19(4):488-505. https://doi.org/10.17749/2313-7347/ob.gyn.rep.2025.622
For citation:
Karpova A.L., Mostovoi A.V., Ponimanskaya M.A., Lee O.N., Desyatnik K.A., Martirosyan S.V., Kadyn S.N., Karpov N.Yu., Shichanina A.A., Kuznetsova A.S. Predictors of unfavorable perinatal outcomes in premature rupture of membranes. Obstetrics, Gynecology and Reproduction. 2025;19(4):488-505. https://doi.org/10.17749/2313-7347/ob.gyn.rep.2025.622
Введение / Introduction
Преждевременные роды (ПР) являются одной из ведущих причин неблагоприятных перинатальных исходов во всем мире. Они ответственны за 70 % случаев неонатальной смертности, 36 % случаев младенческой смертности и 25–50 % случаев отдаленных неврологических нарушений у детей [1][2]. В 2020 г. в Российской Федерации количество ПР составило 59,9 тыс. (общее количество родов – 1220,8 тыс.) [3]. В настоящее время не вызывает сомнений тесная связь ПР с инфекцией нижних половых путей [4]. При этом у одной из 10 пациенток с ПР имеют место признаки внутриамниотического воспаления, которое в большинстве случаев протекает субклинически и приводит к высокому риску развития преждевременного разрыва плодных оболочек (ПРПО) [5–7].
В патогенезе ПРПО вследствие инфекционно-воспалительного процесса ведущую роль играет деградация внеклеточного матрикса с ремоделированием амниотической мембраны [8]. Длительно персистирующая инфекция приводит к развитию манифестного хориоамнионита и синдрома системной воспалительной реакции плода [9]. Именно поэтому при ПРПО показано проведение антибактериальной терапии, поскольку применение антибиотиков системного действия при данном состоянии ассоциировано со значительным снижением частоты хориоамнионита, неонатальной инфекции и перинатальной смертности [10].
На преобладание неонатального сепсиса, а также внутрижелудочковых кровоизлияний (ВЖК) в структуре заболеваемости и смертности новорожденных при ПРПО, возникшем ранее 24-й недели беременности, сделали в своей работе, опубликованной в 2017 г., акцент W.H. Sim с соавт. В данном исследовании средний временной интервал между началом ПРПО и родоразрешением находился в диапазоне от 20 до 43 дней. При ПРПО ранее 24 недель беременности частота рождения живого плода составляла 63,6 %, а количество выживших на момент выписки из стационара после выхаживания – 44,9 %. Выживаемость новорожденных была лучше на более поздних сроках беременности на момент ПРПО, при наличии достаточного объема амниотической жидкости, при уровне С-реактивного белка (СРБ) в крови матери < 10,0 мг/л в первые 24 часа после госпитализации и ПРПО [9].
Прогностическая роль остаточного объема амниотической жидкости при ПРПО – индекса амниотической жидкости (ИАЖ) и/или величины максимального вертикального кармана (МВК) по настоящее время является предметом особого интереса [11]. Для оценки количества околоплодных вод и подтверждения наличия ПРПО широко используется ультразвуковой метод исследования (УЗИ) [9][11–17]. Во всем мире применяются 2 метода оценки объема амниотической жидкости при проведении УЗИ: измерение МВК амниотической жидкости [18][19] и оценка ИАЖ [20][21]. Оба метода оценки объема амниотической жидкости обладают преимуществами в сравнении с субъективной оценкой ее объема, в том числе в отношении прогнозирования неблагоприятных перинатальных исходов [11].
А. Weissmann-Brenner с соавт. (2009) в своей работе, проведенной на 102 одноплодных беременностях с ПРПО и средним сроком гестации на момент разрыва плодных оболочек 29,0 ± 5,3 недель (диапазон: 14,0–36,6 недель), пришли к выводу, что при величине ИАЖ < 10 см чувствительность, специфичность, положительная и отрицательная прогностические ценности составили, соответственно, 89,2, 88,5, 72,2 и 96,0 % в отношении подтверждения наличия ПРПО. Средняя величина ИАЖ составила в группе с ПРПО и в контрольной группе, соответственно, 5,8 ± 3,6 см (0,0–18,5 см) и 13,7 ± 3,2 см (7,3–24,4 см) (р < 0,001) [12].
В настоящее время продолжается поиск взаимосвязей материнских и плодовых исходов при беременности, осложненной ПРПО, с величиной ИАЖ и/или МВК [11]. Так, Е. Weiner с соавт. в 2019 г. указали на то, что у пациенток с ПРПО количество околоплодных вод на момент поступления в стационар третьего уровня было независимо взаимосвязано с развитием тяжелой дыхательной заболеваемости у новорожденного [14], что перекликается с данными W.H. Sim с соавт. (2017), где самыми распространенными заболеваниями у новорожденных от матерей с ПРПО ранее 24 недель беременности были респираторный дистресс-синдром и бронхолегочная дисплазия (БЛД), а одной из наиболее частых причин гибели новорожденных стала гипоплазия легких [9].
С. Storness-Bliss с соавт. (2012) в поиске взаимосвязи материнских и плодовых исходов при беременности, осложненной ПРПО при сроке гестации менее 24 недель, в своем исследовании разделили пациенток на 2 группы: группа А – величина наиболее глубокого вертикального кармана ИАЖ ≥ 1 см и группа В – величина наиболее глубокого вертикального кармана ИАЖ < 1 см (тяжелый олигогидрамнион), и пришли к выводу, что больший объем околоплодных вод после ПРПО сочетается с более хорошим прогнозом для плода, а временной интервал от момента разрыва оболочек до родоразрешения удлиняется без увеличения частоты осложнений со стороны матери [15]. По мнению S.T. Vermillion с соавт. (2000), повышение риска развития инфекции в перинатальном периоде и укорочение временного интервала от момента разрыва плодных оболочек до родоразрешения при сроке беременности 24–32 недели может встречаться чаще, если после ПРПО величина ИАЖ составляет менее 5 см [16]. M. Bhagat и I. Chawla (2014) также в своем исследовании, посвященном поиску взаимосвязи перинатальных исходов с ИАЖ, отталкивались от его величины < 5 см и > 5 см [17].
С учетом отсутствия консенсуса в отношении наиболее прогностически значимой величины ИАЖ и/или МВК при ПР с ПРПО мы предприняли попытку проведения собственного исследования, направленного на поиск объективных предикторов неблагоприятного исхода у плода и новорожденного.
Цель: выявить предикторы неблагоприятных перинатальных исходов при преждевременном излитии околоплодных вод.
Материалы и методы / Materials and Methods
Дизайн исследования / Study design
На базе перинатального центра (ПЦ) ГБУЗ ГКБ № 67 им. Л.А. Ворохобова ДЗМ выполнено одноцентровое ретроспективное когортное исследование, в которое были включены пациентки с ПРПО в сроке от 28 0/7 до 36 6/7 недель беременности. Беременные, включенные в исследование, находились на госпитализации в ПЦ с 01.01.2023 по 01.11.2023 в течение всего безводного промежутка от начала ПРПО. Дети лечились в ПЦ с рождения до выписки.
Критерии включения и исключения / Inclusion and exclusion criteria
Критерии включения: гестационный возраст от > 28 0/7 и до < 37 0/7 недель; потребность в переводе пациента в отделение реанимации и интенсивной терапии новорожденных (ОРИТН) сразу же после рождения; указание в анамнезе на наличие длительного периода преждевременного излития околоплодных вод (ПРПО) более 18 часов.
Критерии исключения: врожденные пороки развития, оказывающие влияние на исход; хромосомные и/или генетические синдромы; перевод новорожденного ребенка в другую клинику.
Методы исследования / Study methods
Акушерский анамнез / Obstetric history
Анализ акушерского анамнеза предполагал оценку следующих клинико-лабораторных показателей: возраст матери; количество беременностей и родов; срок гестации на момент родоразрешения, выраженный в днях; длительность безводного промежутка, выраженная в часах; гипертермия (> 37,5 °С) и тахикардия (более 100 уд/мин) у беременной перед родами; ангидрамнион, хориоамнионит (оценка проводилась по клиническим критериям); операция кесарева сечения (КС); ИАЖ при поступлении в ПЦ и перед родами; МВК перед родами, измеренный при помощи УЗИ в мм; уровень СРБ в крови перед родами и после них; количество лейкоцитов при поступлении в ПЦ и перед родами; анализировали рост бактерий из цервикального канала до родов.
Определение индекса амниотической жидкости / Amniotic fluid index measurement
Методика определения ИАЖ заключалась в условном разделении живота беременной на 4 квадранта: пигментация по белой линии живота или linea nigra служит ориентиром для условного разделения живота на правую и левую половины, а пупок и условно проведенная через него горизонтальная линия – ориентир для условного разделения живота на нижнюю и верхнюю половины. Датчик ультразвукового прибора располагался строго перпендикулярно поверхности кушетки, на которой находилась пациентка во время проведения исследования. В каждом квадранте идентифицировался МВК амниотической жидкости. Проводилось измерение глубины максимального свободного кармана амниотической жидкости в каждом квадранте. Амниотический индекс рассчитывался путем суммы вертикальных размеров максимальных карманов амниотической жидкости. Маловодие/олигогидрамнион определяется как величина ИАЖ ≤ 5-го процентиля, рассчитанного для срока беременности, многоводие/полигидрамнион – как величина ИАЖ ≥ 95-го процентиля для срока беременности [22].
Величина максимального вертикального размера свободного кармана околоплодных вод / Maximum vertical length of free pocket of amniotic fluid
Собственно МВК определяется в правом углу маточного контура, а результат подразделяется на 3 категории: (а) менее 2 см свидетельствует о наличии олигогидрамниона (маловодия); (б) глубина кармана от 2 до 8 см свидетельствует о нормальном количестве околоплодных вод; (с) глубина кармана более 8 см свидетельствует о наличии полигидрамниона (многоводия) [18][19].
Определение тяжести дыхательной недостаточности и нарушений центральной гемодинамики / Severity of respiratory failure and central hemodynamic disorders
Для оценки тяжести дыхательной недостаточности (ДН) у недоношенных новорожденных оценивали потребность в применении сурфактанта (порактанта альфа) в родовом зале в стандартной дозе 200 мг/кг, повторное введение в дозе 100 мг/кг; принималась во внимание потребность в инвазивной механической вентиляции легких в родовом зале, проведении искусственной вентиляции легких (ИВЛ) или перевод на высокочастотную ИВЛ (ВЧО ИВЛ); также проводили анализ таких показателей, зарегистрированных у ребенка в первые 3-е суток после рождения, как максимально высокие уровни среднего давления в дыхательных путях (англ. mean airway pressure, МАР) и фракции ингаляционного кислорода (англ. fraction of inspired oxygen, FiO2). Тяжесть гемодинамических нарушений у ребенка оценивали при помощи модифицированного инотропного индекса (МИИ) [23]. Тяжесть полиорганной недостаточности (ПОН) у ребенка в первые 72 часа после рождения оценивали при помощи модифицированной шкалы неонатальной полиорганной недостаточности (англ. Neonatal Multiple Organ Dysfunction score, NEOMOD) [23][24].
Анализ заболеваемости детей / Analysis of children morbidity
Оценивалась заболеваемость детей по следующим нозологиям: ранний неонатальный сепсис [25], врожденная пневмония, легочное кровотечение, пневмоторакс, множественные экхимозы и геморрагии в кожу, хирургическая стадия ретинопатии недоношенных, ВЖК 3-й степени, перивентрикулярная лейкомаляция (ПВЛ), тяжелая форма БЛД, хирургическая стадия некротизирующего энтероколита (НЭК). Среди лабораторных показателей у ребенка для анализа были выбраны следующие [26][27]: количество лейкоцитов и нормобластов, уровень гемоглобина и нейтрофильный индекс (НИ) в крови в первые сутки жизни, уровень прокальцитонина (ПКТ) и СРБ, рост бактерий из стерильных (кровь) и нестерильных локусов (носоглотка и анус) методом полимеразной цепной реакции (ПЦР) в первые трое суток жизни.
Группы обследованных / Study groups
Всего изучено 176 историй родов и 176 медицинских карт недоношенных новорожденных. Мы разделили когорту обследованных детей на 2 группы в зависимости от исходов, выделив группу с благоприятным (группа 1) и неблагоприятным (группа 2) исходом. К неблагоприятным исходам в данном исследовании были отнесены следующие показатели: антенатальная гибель плода, смерть ребенка в неонатальном периоде, ВЖК 3-й степени, ПВЛ, тяжелая форма БЛД, хирургическая стадия НЭК (рис. 1).
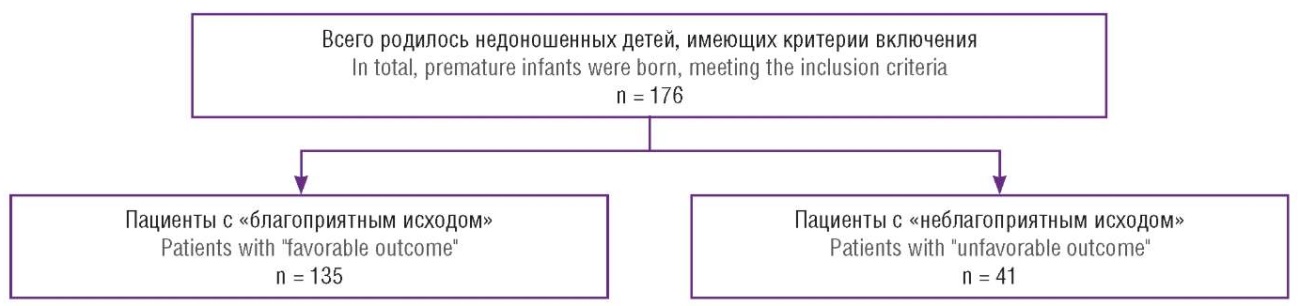
Рисунок 1. Блок-схема учета всех недоношенных пациентов, рожденных в перинатальном центре за период с 01.01.2023 по 01.11.2023. Две заключительные группы исследования: группа 1 «благоприятный исход» (n = 135) и группа 2 «неблагоприятный исход» (n = 41) в неонатальном периоде.
Figure 1. Flowchart of all premature patients born at the perinatal center from January 1, 2023 to November 1, 2023. Two final study groups were formed: Group 1 "favorable outcome" (n = 135) and Group 2 "unfavorable outcome" (n = 41) in the neonatal period.
Статистический анализ / Statistical analysis
Врачи перинатального центра осуществляли сбор показателей и заполнение деперсонифицированной базы данных, которая в свою очередь, включала 180 признаков с визуализацией полученных результатов в электронных таблицах Microsoft Office Excel 2016 (Microsoft, США). Статистическая обработка результатов проводилась средствами языка Python v 3.11 (США). Показатели оценивались на предмет соответствия нормальному распределению с помощью критерия Шапиро–Уилка. Если данные не соответствовали нормальному распределению, то использовались непараметрические методы, которые могли дать более точные результаты. В ходе анализов были определены следующие показатели статистики:
- медианы (Ме) – помогают определить центральную тенденцию всех наблюдений, сопровождая ее наиболее частыми результатами;
- квартильный разброс [ Q1; Q3] с целью определения величины разброса данных от медианы;
- U-критерий Манна–Уитни для тестирования группы с независимыми выборками;
- для работы с категориальными переменными, где интересовали наиболее значимые различия между сгруппированными переменными, использовался критерий χ² Пирсона. Когда количество значений в таблицах было менее 10, применяли точный критерий Фишера. Коэффициент ранговой корреляции Спирмена (Rs) использовался для проверки связей между количественными переменными, указывая на наличие корреляции их зависимости и силы.
Относительные показатели включали:
- отношение шансов (ОШ) с 95 % доверительным интервалом (ДИ) применяли для оценки вероятности какого-либо события в определенной группе по сравнению с другой;
- относительный риск (ОР) с 95 % ДИ демонстрировал преобладание или убыток в риске события в одной группе по сравнению со второй. Для определения насколько точны (в количественном выражении) данные для прогнозирования, применялся ROC-анализ для определения пациента по вероятности неблагоприятного исхода.
Чтобы оценить диагностическую значимость количественных признаков при прогнозировании определенного исхода, в том числе вероятности наступления исхода, рассчитанной с помощью регрессионной модели, использовался метод анализа ROC-кривых. С его помощью определялось оптимальное разделение значений количественного признака, позволяющее классифицировать пациентов по степени риска исхода, обладающее наилучшим сочетанием чувствительности и специфичности. Качество прогностической модели, полученной данным методом, оценивалось, исходя из значений площади под ROC-кривой со стандартной ошибкой и 95 % ДИ и уровня статистической значимости. Различия считали статистически значимыми при p ≤ 0,05, использовали двусторонний р-уровень значимости.
Результаты / Results
В таблице 1 представлены основные оцениваемые количественные клинико-лабораторные данные акушерского анамнеза в до- и послеродовом периодах.
Таблица 1. Акушерский анамнез (количественные переменные).
Table 1. Obstetric history (quantitative variables).
|
Переменные Variables Ме [ Q1; Q3] |
Все Total |
Группа 1 (благоприятный исход) Group 1 (favorable outcome) |
Группа 2 (неблагоприятный исход) Group 2 (unfavorable outcome) |
p |
|
Возраст матери, лет Maternal age, years |
33,0 [ 28,0; 37,0] n = 176 |
33,0 [ 28,0; 37,0] n = 135 |
35,0 [ 29,0; 38,0] n = 41 |
0,228 |
|
Порядковый номер беременности, n The ordinal number of the pregnancy, n |
2,0 [ 1,0; 3,0] n = 176 |
2,0 [ 1,0; 3,5] n = 135 |
2,0 [ 1,0; 3,0] n = 41 |
0,471 |
|
Порядковый номер родов, n The ordinal number of the birth, n |
2,0 [ 1,0; 2,0] n = 176 |
2,0 [ 1,0; 2,0] n = 135 |
1,0 [ 1,0; 2,0] n = 41 |
0,315 |
|
Срок беременности на момент родов, дней Gestation age at delivery, days |
229,5 [ 205,0; 245,0] n = 176 |
238,0 [ 223,5; 247,0] n = 135 |
193,0 [ 180,0; 198,0] n = 41 |
< 0,001 |
|
Длительность безводного промежутка, часы Duration of membrane rupture, hours |
81,0 [ 47,0; 169,0] n = 176 |
79,0 [ 43,5; 160,5] n = 135 |
107,0 [ 65,0; 252,0] n = 41 |
0,073 |
|
Индекс амниотической жидкости при поступлении в перинатальный центр, мм Amniotic fluid index at admission to perinatal center, mm |
96,5 [ 60,0; 120,75] n = 138 |
100,0 [ 73,5; 125,5] n = 106 |
60,0 [ 31,5; 98,5] n = 32 |
< 0,001 |
|
Индекс амниотической жидкости перед родами, мм Amniotic fluid index before delivery, mm |
40,0 [ 30,0; 60,0] n = 79 |
45,0 [ 30,0; 64,25] n = 62 |
30,0 [ 20,0; 32,0] n = 17 |
< 0,001 |
|
Максимальный вертикальный карман перед родами, мм Maximum vertical pocket before delivery, mm |
19,0 [ 18,0; 41,0] n = 99 |
30,0 [ 18,0; 48,0] n = 77 |
18,0 [ 13,5; 18,0] n = 22 |
< 0,001 |
|
Уровень С-реактивного белка в крови беременной перед родами, мг/л Maternal blood C-reactive protein level before delivery, mg/L |
7,36 [ 3,52; 21,13] n = 163 |
6,14 [ 3,44; 17,14] n = 123 |
14,63 [ 4,91; 45,77] n = 40 |
0,008 |
|
Количество лейкоцитов в крови беременной перед родами, ×10⁹/л Maternal blood leukocyte count before delivery, ×10⁹/L |
12,1 [ 10,0; 15,15] n = 175 |
11,5 [ 9,83; 14,4] n = 134 |
13,6 [ 11,4; 16,4] n = 41 |
0,014 |
Возраст беременных, паритет, порядковый номер родов и продолжительность безводного промежутка не имели статистически значимых различий между группами. В то же время срок беременности на момент родов, рассчитанный в днях, в группе детей с неблагоприятным исходом (группа 2) был статистически значимо ниже (р < 0,001) и составил 193,0 [ 180,0; 198,0] против 238,0 [ 223,5; 247,0] дней. Уровень СРБ в крови и количество лейкоцитов у пациентов группы 2 перед родами были статистически значимо выше, чем в группе 1. Значения ИАЖ в момент поступления в приемный покой ПЦ и непосредственно перед родами, а также МВК перед родами были статистически значимо ниже в группе 2.
Результаты, полученные в ходе анализа непараметрических переменных, характеризующих течение беременности и родов у обследованных женщин, представлены в таблице 2.
Таблица 2. Акушерский анамнез (непараметрические переменные).
Table 2. Obstetric history (nonparametric variables).
|
Переменные Variables |
Все Total |
Группа 1 (благоприятный исход) Group 1 (favorable outcome) |
Группа 2 (неблагоприятный исход) Group 2 (unfavorable outcome) |
p |
ОШ OR Ме [ Q1; Q3] |
ОР RR Ме [ Q1; Q3] |
|
Вид родов Route of delivery |
n = 176 |
n = 135 |
n = 41 |
0,046* |
2,04 [ 1,01; 4,14]* |
1,19 [ 1,0; 1,42] |
|
Роды естественным путем, n (%) Natural delivery, n (%) |
101 (57,4) |
83 (61,5) |
18 (44,0) |
|||
|
Роды путем операции кесарева сечения, n (%) Delivery by cesarean section, n (%) |
75 (42,6) |
52 (38,5) |
23 (56,0) |
|||
|
Наличие лихорадки у матери перед родами > 37,5 °С Maternal fever > 37.5 ° C before delivery |
n = 176 |
n = 135 |
n = 41 |
0,083 |
5,25 [ 0,85; 32,57] |
1,94 [ 0,66; 5,69] |
|
Нет, n (%) / No, n (%) |
171 (97,2) |
133 (98,5) |
38 (93,0) |
|||
|
Есть, n (%) / Yes, n (%) |
5 (2,8) |
2 (1,5) |
3 (7,0) |
|||
|
Наличие тахикардии у матери перед родами > 100 уд/мин Maternal tachycardia > 100 beats/min before delivery |
n = 176 |
n = 135 |
n = 41 |
0,232 |
3,41 [ 0,47; 25,0] |
1,55 [ 0,58; 4,14] |
|
Нет, n (%) / No, n (%) |
172 (97,7) |
133 (98,5) |
39 (95,0) |
|||
|
Есть, n (%) / Yes, n (%) |
4 (2,3) |
2 (1,5) |
2 (5,0) |
|||
|
Наличие ангидроамниона Anhydramnion |
n = 176 |
n = 135 |
n = 41 |
0,003* |
32,52 [ 1,71; 617,67]* |
7,83 [ 0,56; 108,72] |
|
Нет, n (%) / No, n (%) |
172 (97,7) |
135 (100,0) |
37 (90,0) |
|||
|
Есть, n (%) / Yes, n (%) |
4 (2,3) |
0 (0) |
4 (10,0) |
|||
|
Наличие хориоамнионита Chorioamnionitis |
n = 176 |
n = 135 |
n = 41 |
< 0,001* |
8,85 [ 3,77; 20,77]* |
2,19 [ 1,4; 3,43]* |
|
Нет, n (%) / No, n (%) |
145 (82,4) |
123 (91,1) |
22 (54,0) |
|||
|
Есть, n (%) / Yes, n (%) |
31 (17,6) |
12 (8,9) |
19 (46,0) |
|||
|
Наличие роста бактерий из цервикального канала до родов Positive cervical canal bacterial culture before delivery |
n = 146 |
n = 109 |
n = 37 |
0,360 |
2,58 [ 0,56; 11,93] |
1,2 [ 0,97; 1,48] |
|
Нет, n (%) / No, n (%) |
16 (11,0) |
14 (12,8) |
2 (5,0) |
|||
|
Есть, n (%) / Yes, n (%) |
130 (89,0) |
95 (87,2) |
35 (95,0) |
Примечание: * – различия между группами 1 и 2 статистически значимы; ОШ – отношение шансов; ОР – относительный риск.
Note: * – significant inter-group differences; OR – odds ratio; RR – relative risk.
Оказалось, что в группе с неблагоприятным исходом у новорожденных (группа 2) статистически значимо чаще требовалось родоразрешение путем операции КС. Антенатальная гибель плода была зарегистрирована в 7 из 176 (4,0 %) случаев, которые были отнесены к группе 2. Лихорадка (> 37,5 °С), тахикардия (> 100 уд/мин), как и рост бактерий из цервикального канала у беременных перед родами, регистрировались в обеих группах с практически одинаковой частотой. Однако при этом обращало на себя внимание, что у беременных группы 2 статистически значимо чаще диагностировался хориоамнионит (p < 0,001) и регистрировался ангидрамнион (p = 0,003).
Количественные клинические характеристики недоношенных новорожденных представлены в таблице 3.
Таблица 3. Клинические характеристики обследованных новорожденных (количественные данные).
Table 3. Clinical characteristics of the examined neonates (quantitative data).
|
Переменные Variables Ме [ Q1; Q3] |
Все Total |
Группа 1 (благоприятный исход) Group 1 (favorable outcome) |
Группа 2 (неблагоприятный исход) Group 2 (unfavorable outcome) |
p |
|
Масса тела, г Weight, g |
1980,0 [ 1335,0; 2362,5] n = 176 |
2120,0 [ 1820,0; 2530,0] n = 135 |
930,0 [ 750,0; 1075,0] n = 41 |
< 0,001 |
|
Гестационный возраст, недель Gestational age, weeks |
33,0 [ 29,75; 35,0] n = 176 |
34,0 [ 32,0; 35,0] n = 135 |
28,0 [ 26,0; 28,0] n = 41 |
< 0,001 |
|
Оценка по шкале Апгар на 1-й минуте, баллы Apgar score at 1 minute, points |
7,0 [ 6,0; 7,0] n = 175 |
7,0 [ 7,0; 8,0] n = 134 |
5,0 [ 1,0; 6,0] n = 41 |
< 0,001 |
|
Оценка по шкале Апгар на 5-й минуте, баллы Apgar score at 5 minutes, points |
8,0 [ 7,0; 8,0] n = 175 |
8,0 [ 7,0; 8,0] n = 134 |
6,0 [ 3,0; 7,0] n = 41 |
< 0,001 |
В группе 2 (неблагоприятный исход) гестационный возраст, масса тела на момент рождения, оценка по шкале Апгар оказались значимо более низкими по сравнению с группой 1. По половому признаку дети сравниваемых групп значимо не различались – 78 из 135 (57,8 %) и 27 из 41 (66,0 %) в группах 1 и 2 соответственно (ОШ = 1,41 [ 0,68; 2,93]; ОР = 1,08 [ 0,92; 1,27]; р = 0,356). Всего в исследовании мальчиков было 105 из 176 (59,7 %), девочек – 71 из 176 (40,3 %).
Основные клинические характеристики тяжести дыхательной недостаточности у обследованных детей обеих групп представлены в таблице 4.
Таблица 4. Основные клинические характеристики тяжести дыхательной недостаточности у обследованных детей (непараметрические переменные).
Table 4. Major clinical characteristics for respiratory failure severity in the examined neonates (nonparametric variables).
|
Переменные Variables |
Все Total |
Группа 1 (благоприятный исход) Group 1 (favorable outcome) |
Группа 2 (неблагоприятный исход) Group 2 (unfavorable outcome) |
p |
ОШ OR Ме [ Q1; Q3] |
ОР RR Ме [ Q1; Q3] |
|
Интубация трахеи в родильном зале Tracheal intubation in delivery room |
n = 169 |
n = 135 |
n = 34 |
< 0,001* |
21,58 [ 8,05; 57,84]* |
2,06 [ 1,53; 2,77]* |
|
Интубации трахеи в родильном зале не было, n (%) Without tracheal intubation in delivery room, n (%) |
117 (69,2) |
111 (82,2) |
6 (18,0) |
|||
|
Была интубация трахеи в родильном зале, n (%) Tracheal intubation in delivery room, n (%) |
52 (30,8) |
24 (17,8) |
28 (82,0) |
|||
|
Введение сурфактанта в родильном зале Surfactant administration in delivery room |
n = 169 |
n = 135 |
n = 34 |
< 0,001* |
26,35 [ 6,06; 114,64]* |
1,59 [ 1,34; 1,89]* |
|
Сурфактант не вводился, n (%) Without surfactant administration, n (%) |
86 (50,9) |
84 (62,2) |
2 (6,0) |
|||
|
Сурфактант вводился, n (%) Surfactant administration, n (%) |
83 (49,1) |
51 (37,8) |
32 (94,0) |
|||
|
Повторное введение сурфактанта Repeated surfactant administration |
n = 169 |
n = 135 |
n = 34 |
0,031* |
5,87 [ 1,25; 27,62]* |
1,9 [ 0,81; 4,48] |
|
Сурфактант повторно не вводился, n (%) Without repeated surfactant administration, n (%) |
162 (95,9) |
132 (97,8) |
30 (88,0) |
|||
|
Сурфактант повторно вводился, n (%) Repeated surfactant administration, n (%) |
7 (4,1) |
3 (2,2) |
4 (12,0) |
|||
|
Потребность в ИВЛ через ЭТТ в возрасте первых 72 часов Required endotracheal MV within the first 72 hours of life |
n = 169 |
n = 135 |
n = 34 |
0,029* |
2,8 [ 1,21; 6,48]* |
1,29 [ 1,0; 1,67] |
|
Потребность в ИВЛ менее 72 часов, n (%) Required endotracheal MV < 72 hours, n (%) |
135 (79,9) |
113 (83,7) |
22 (65,0) |
|||
|
Потребность в ИВЛ более 72 часов, n (%) Required endotracheal MV > 72 hours, n (%) |
34 (20,1) |
22 (16,3) |
12 (35,0) |
|||
|
Старт ВЧО ИВЛ в возрасте первых 72 часов HFOV onset at age of the first 72 hours |
n = 169 |
n = 135 |
n = 34 |
< 0,001* |
21,5 [ 7,45; 62,01]* |
3,39 [ 1,7; 6,76]* |
|
Без ВЧО ИВЛ в течение первых 72 часов жизни, n (%) Without HFOV within > 72 hours, n (%) |
146 (86,4) |
129 (95,6) |
17 (50,0) |
|||
|
С ВЧО ИВЛ в течение первых 72 часов жизни, n (%) Required HFOV within the first 72 hours, n (%) |
23 (13,6) |
6 (4,4) |
17 (50,0) |
Примечание: * – различия между группами 1 и 2 статистически значимы; ОШ – отношение шансов; ОР – относительный риск; ИВЛ – искусственная вентиляция легких; ЭТТ – эндотрахеальная трубка; ВЧО ИВЛ – высокочастотная ИВЛ.
Note: * – significant inter-group differences; OR – odds ratio; RR – relative risk; MV – mechanical ventilation; ETT – endotracheal tube; HFOV – high frequency oscillatory ventilation.
У детей группы 2 имело место статистически значимо более тяжелое течение ДН, чем в группе 1, по всем выбранным для оценки тяжести ДН клиническим показателям: дети чаще нуждались в интубации трахеи (p < 0,001) и введении сурфактанта (p < 0,001) в родовом зале; демонстрировали более выраженную потребность в традиционной ИВЛ через интубационную трубку (p = 0,029) и в переводе на ВЧО ИВЛ (p < 0,001) в первые 72 часа жизни. В родовом зале сурфактант детям вводился, как правило, на 10-й минуте после рождения (табл. 5).
Таблица 5. Основные показатели тяжести дыхательной недостаточности, полиорганной недостаточности и подходов к сурфактантной терапии у новорожденных младенцев (количественные показатели).
Table 5. Major indicators assessing severity of respiratory failure, multiple organ failure and approaches to surfactant therapy in premature neonates (quantitative indicators).
|
Переменные Variables Ме [ Q1; Q3] |
Все Total |
Группа 1 (благоприятный исход) Group 1 (favorable outcome) |
Группа 2 (неблагоприятный исход) Group 2 (unfavorable outcome) |
p |
|
Возраст при введении первой дозы сурфактанта, минут Age at administration of first dose of surfactant, minutes |
10,0 [ 10,0; 15,0] n = 82 |
10,0 [ 10,0; 15,0] n = 50 |
10,0 [ 10,0; 10,0] n = 32 |
0,093 |
|
Maксимальный уровень FiO2 в первые 72 часа жизни Maximum FiO2 during first 72 hours of life |
0,25 [ 0,21; 0,4] n = 169 |
0,21 [ 0,21; 0,3] n = 135 |
0,4 [ 0,35; 1,0] n = 34 |
< 0,001 |
|
Maксимальный уровень МАР в первые 72 часа жизни, см вод. ст. Maximum MAP during first 72 hours of life, cm H2O |
13,0 [ 11,0; 15,0] n = 28 |
12,0 [ 10,75; 14,25] n = 8 |
13,0 [ 11,75; 15,0] n = 20 |
0,292 |
|
Оценка по шкале NEOMOD в первые 72 часа жизни, баллы NEOMOD score during first 72 hours of life, points |
2,0 [ 1,75; 4,0] n = 140 |
2,0 [ 1,0; 2,0] n = 107 |
5,0 [ 4,0; 6,0] n = 33 |
< 0,001 |
|
Максимальный уровень модифицированного инотропного индекса в первые 72 часа жизни Maximum level of modified inotropic index during first 72 hours of life |
41,0 [ 22,25; 66,75] n = 26 |
30,0 [ 19,0; 41,0] n = 7 |
50,0 [ 29,0; 80,0] n = 19 |
0,193 |
Примечание: FiO2 – фракция ингаляционного кислорода; МАР – среднее давление в дыхательных путях.
Note: FiO2 – fraction of inspired oxygen; MAP – mean airway pressure.
Тяжесть ДН у недоношенных новорожденных детей в раннем неонатальном периоде характеризуется потребностью в дополнительном кислороде при проведении респираторной терапии, уровнем МАР и необходимостью повторного введения сурфактанта в первые 72 часа жизни. Последнее статистически значимо чаще (p = 0,031) требовалось детям группы 2 (табл. 4). Дети группы 2 нуждались в значимо более высокой FiO2 (p < 0,001). Потребность в кардиотонической поддержке, оцененная путем сравнения наиболее высоких значений МИИ в первые 72 часа жизни, у детей обеих групп не имела статистически значимых различий; оценка по шкале полиорганной недостаточности NEOMOD в этот период жизни демонстрировала более выраженную тяжесть ПОН у детей группы 2 (p < 0,001), что, безусловно, отразилось на их заболеваемости (табл. 6).
Таблица 6. Заболеваемость обследованных детей (непараметрические переменные).
Table 6. Morbidity in examined children (nonparametric variables).
|
Переменные Variables |
Все Total |
Группа 1 (благоприятный исход) Group 1 (favorable outcome) |
Группа 2 (неблагоприятный исход) Group 2 (unfavorable outcome) |
p |
ОШ OR Ме [ Q1; Q3] |
ОР RR Ме [ Q1; Q3] |
|
Врожденная пневмония Congenital pneumonia |
n = 168 |
n = 134 |
n = 34 |
0,697 |
1,16 [ 0,55; 2,46] |
1,03 [ 0,88; 1,2] |
|
Нет, n (%) / No, n (%) |
89 (53,0) |
72 (53,7) |
17 (50,0) |
|||
|
Есть, n (%) / Yes, n (%) |
79 (47,0) |
62 (46,3) |
17 (50,0) |
|||
|
Интровитреальное введение ранибизумаба для лечения ретинопатии недоношенных Intravitreal ranibizumab administration for prematurity retinopathy treatment |
n = 169 |
n = 135 |
n = 34 |
0,001* |
39,98 [ 2,1; 762,39]* |
8,16 [ 0,59; 113,28] |
|
Нет, n (%) / No, n (%) |
165 (97,6) |
135 (100,0) |
30 (88,0) |
|||
|
Есть, n (%) / Yes, n (%) |
4 (2,4) |
0 (0) |
4 (12,0) |
|||
|
Наличие пневмоторакса Pneumothorax |
n = 169 |
n = 135 |
n = 34 |
0,040* |
20,85 [ 0,98; 444,88] |
4,84 [ 0,38; 60,85] |
|
Нет, n (%) / No, n (%) |
167 (98,8) |
135 (100,0) |
32 (94,0) |
|||
|
Есть, n (%) / Yes, n (%) |
2 (1,2) |
0 (0) |
2 (6,0) |
|||
|
Легочное кровотечение Pulmonary hemorrhage |
n = 169 |
n = 135 |
n = 34 |
0,008* |
30,11 [ 1,52; 597,86]* |
6,49 [ 0,49; 86,85] |
|
Нет, n (%) / No, n (%) |
166 (98,2) |
135 (100,0) |
31 (91,0) |
|||
|
Есть, n (%) / Yes, n (%) |
3 (1,8) |
0 (0) |
3 (9,0) |
|||
|
Множественные экхимозы и геморрагии на коже с рождения Multiple ecchymoses and cutaneous hemorrhages since birth |
n = 169 |
n = 135 |
n = 34 |
< 0,001* |
61,81 [ 3,38; 1128,65]* |
11,57 [ 0,8; 167,4] |
|
Нет, n (%) / No, n (%) |
163 (96,4) |
135 (100,0) |
28 (82,0) |
|||
|
Есть, n (%) / Yes, n (%) |
6 (3,6) |
0 (0) |
6 (18,0) |
|||
|
Наличие положительного бактериального высева из крови Positive blood culture |
n = 166 |
n = 133 |
n = 33 |
1,000 |
1,32 [ 0,05; 33,14] |
1,06 [ 0,47; 2,37] |
|
Нет, n (%) / No, n (%) |
165 (99,4) |
132 (99,2) |
33 (100,0) |
|||
|
Есть, n (%) / Yes, n (%) |
1 (0,6) |
1 (0,8) |
0 (0) |
|||
|
Рост бактерий в нестерильных локусах (зев, анус) Positive bacterial culture in non-sterile loci (nasopharynx, anus) |
n = 168 |
n = 135 |
n = 33 |
0,228 |
0,6 [ 0,26; 1,39] |
0,91 [ 0,79; 1,05] |
|
Нет, n (%) / No, n (%) |
107 (63,7) |
83 (61,5) |
24 (73,0) |
|||
|
Есть, n (%) / Yes, n (%) |
61 (36,3) |
52 (38,5) |
9 (27,0) |
|||
|
Инфекция, вызванная Ureaplasma рarvum Verified Ureaplasma parvum infection |
n = 168 |
n = 135 |
n = 33 |
0,015* |
3,61 [ 1,32; 9,88]* |
1,44 [ 0,97; 2,13] |
|
Нет, n (%) / No, n (%) |
149 (88,7) |
124 (91,9) |
25 (76,0) |
|||
|
Есть, n (%) / Yes, n (%) |
19 (11,3) |
11 (8,1) |
8 (24,0) |
Примечание: * – различия между группами 1 и 2 статистически значимы; ОШ – отношение шансов; ОР – относительный риск.
Note: * – significant inter-group differences; OR – odds ratio; RR – relative risk.
У детей группы 2 статистически значимо чаще развивались множественные экхимозы и геморрагии на коже с рождения (p < 0,001), легочное кровотечение (p = 0,008), пневмоторакс (p = 0,040) и хирургическая стадия ретинопатии недоношенных (p = 0,001). Рост бактерий из крови был зарегистрирован только у 1 из 166 (0,6 %) детей, из нестерильных локусов (носоглотка и анус) – у 61 из 168 (36,3 %). Статистически значимых различий между группами 1 и 2 по росту бактерий из нестерильных локусов не выявлено (p = 0,228). Обращает на себя внимание то, что у детей группы 2 статистически значимо чаще в носоглотке методом ПЦР выявлялась Ureaplasma рarvum (p = 0,015).
Летальный исход из общей когорты включенных в исследование пациентов был зарегистрирован в 7 из 169 (4,1 %) случаях. Все дети были отнесены к группе 2, внутри которой летальность 7 из 34 детей, родившихся живыми, составила 21,0 % (ОШ = 73,91 [ 4,1; 1332,5]; ОР = 11.57 [ 0,8; 167,4]). ВЖК 3-й степени среди всех детей регистрировали в 3,6 % (6 из 169 детей) случаев, а в группе 2 – в 18,0 % (6 из 34 детей) (ОШ = 61,81 [ 3,38; 1128,65]; ОР = 11,57 [ 0,8; 167,4]). Хирургическая стадия НЭК в общей когорте пациентов в неонатальном периоде манифестировала у 1 из 169 (0,6 %) детей и, соответственно, у 1 из 34 (3,0 %) детей группы 2 (ОШ = 12,13 [ 0,48; 304,48]; ОР = 3,21 [ 0,29; 35,44]). Частота встречаемости БЛД (потребность в кислороде в 36 0/7 недель постконцептуального возраста) составила 7,1 % в общей группе (12 из 169 детей) и 35,0 % в группе 2 (12 из 34 детей) (ОШ = 150,56 [ 8,61; 2633,61]; ОР = 22,3 [ 1,47; 338,11]).
Исследованные показатели заболеваемости и исходов у новорожденных детей обеих групп сочетались с динамикой маркеров воспаления (табл. 7).
Таблица 7. Результаты лабораторных методов исследования у недоношенных новорожденных детей (параметрические данные).
Table 7. Laboratory assay data in premature neonates (parametric data).
|
Переменные Variables Ме [ Q1; Q3] |
Все Total |
Группа 1 (благоприятный исход) Group 1 (favorable outcome) |
Группа 2 (неблагоприятный исход) Group 2 (unfavorable outcome) |
p |
|
Количество лейкоцитов в крови в первые 24 часа жизни, ×10⁹/л Blood leukocyte count during first 24 hours of life, ×10⁹/L |
13,45 [ 10,5; 18,0], n = 152 |
13,2 [ 10,7; 17,3] n = 119 |
14,4 [ 9,5; 20,2] n = 33 |
0,439 |
|
Нейтрофильный индекс в первые 24 часа жизни Neutrophil index during first 24 hours of life |
0,08 [ 0,05; 0,15] n = 148 |
0,07 [ 0,06; 0,14] n = 115 |
0,1 [ 0,04; 0,2] n = 33 |
0,370 |
|
Уровень гемоглобина в крови в первые 24 часа жизни, г/л Blood hemoglobin level during first 24 hours of life, g/L |
170,5 [ 154,75; 189,0] n = 152 |
178,0 [ 159,5; 191,5] n = 119 |
157,0 [ 145,0; 164,0] n = 33 |
< 0,001 |
|
Уровень прокальцитонина в крови в возрасте < 24 часов жизни, нг/мл Blood procalcitonin level at age < 24 hours of life, ng/mL |
0,3 [ 0,19; 0,64] n = 122 |
0,26 [ 0,17; 0,62] n = 92 |
0,36 [ 0,3; 0,69] n = 30 |
0,017 |
|
Уровень прокальцитонина в крови в возрасте ≥ 24 – < 48 часов жизни, нг/мл Blood procalcitonin level at age of ≥ 24 – < 48 hours of life, ng/mL |
10,55 [ 2,19; 21,59] n = 30 |
4,78 [ 2,10; 18,00] n = 21 |
12,49 [ 10,0; 36,90] n = 9 |
0,175 |
|
Уровень прокальцитонина в крови в возрасте от 48 до 72 часов жизни, нг/мл Blood procalcitonin level at age of 48 to 72 hours of life, ng/mL |
1,57 [ 0,59; 5,3] n = 71 |
1,22 [ 0,43; 3,12] n = 52 |
3,81 [ 1,75; 9,89] n = 19 |
0,007 |
|
Уровень С-реактивного белка в крови в возрасте < 24 часов жизни, мг/л Blood C-reactive protein level at age < 24 hours of life, mg/L |
1,57 [ 0,49; 3,24] n = 141 |
1,54 [ 0,54; 3,14] n = 109 |
1,81 [ 0,20; 3,25] n = 32 |
0,794 |
|
Уровень С-реактивного белка в крови в возрасте ≥ 24 – < 48 часов жизни, мг/л Blood C-reactive protein level at age of ≥ 24 – < 48 hours of life, mg/L |
2,91 [ 1,29; 5,43] n = 29 |
1,74 [ 0,95; 4,52] n = 20 |
5,43 [ 3,85; 11,41] n = 9 |
0,015 |
|
Уровень С-реактивного белка в крови в возрасте ≥ 48 – < 72 часов жизни, мг/л Blood C-reactive protein level at age of ≥ 48 до – < 72 hours of life, mg/L |
2,56 [ 0,92; 4,48] n = 87 |
2,5 [ 0,96; 3,97] n = 66 |
2,76 [ 0,84; 5,31] n = 21 |
0,893 |
Количество лейкоцитов в крови и НИ первые 24 часа жизни в обеих группах было сопоставимо, в то время как уровень гемоглобина в группе 2 был статистически значимо ниже (p < 0,001). Содержание ПКТ и СРБ в крови в первые 72 часа жизни демонстрировало различную динамику показателей, однако оба маркера воспаления у детей группы 2 имели статистически значимо более высокие значения. Так, значения ПКТ в первые сутки жизни в группе 2 были статистически значимо выше (p = 0,017), далее (в возрасте от 24 до 48 часов после рождения) они становились сопоставимыми с показателями в группе 1, и вновь демонстрировали существенно более высокие значения в группе 2 в возрасте 72 часов (p = 0,007). Уровень СРБ в крови также, отражая более высокую заболеваемость детей группы 2, был статистически значимо выше у новорожденных с неблагоприятным исходом в возрасте от 24 до 48 часов после рождения (p = 0,015). Однако в первые 24 часа и от 48 до 72 часов жизни данный маркер воспаления оказался сопоставимым у детей обеих групп.
С целью оценки влияния длительности безводного промежутка на исходы у новорожденных детей был проведен корреляционный анализ методом Спирмена (табл. 8).
Таблица 8. Корреляционный анализ количественных данных в зависимости от групп исследования.
Table 8. Correlation analysis for quantitative data in study groups.
|
Переменная 1 Variable 1 |
Переменная 2 Variable 2 |
Все Total |
Группа 1 (благоприятный исход) Group 1 (favorable outcome) |
Группа 2 (неблагоприятный исход) Group 2 (unfavorable outcome) |
|||
|
Rs |
p |
Rs |
p |
Rs |
p |
||
|
Длительность безводного промежутка, часы Duration of rupture of membranes, hours |
Maксимальный уровень FiO2 в первые 72 часа жизни, см вод. ст. Maximum FiO2 in first 72 hours of life, cm Н2О |
0,230 |
0,003 |
0,168 |
0,052 |
0,168 |
0,343 |
|
Длительность безводного промежутка, часы Duration of rupture of membranes, hours |
Оценка по шкале NEOMOD в первые 72 часа жизни, баллы NEOMOD score in first 72 hours of life, points |
0,243 |
0,004 |
0,170 |
0,079 |
0,248 |
0,165 |
|
Длительность безводного промежутка, часы Duration of rupture of membranes, hours |
Уровень гемоглобина крови в первые 24 часа, г/л Blood hemoglobin level in first 24 hours, g/L |
–0,253 |
0,002 |
–0,196 |
0,033 |
–0,225 |
0,209 |
|
Длительность безводного промежутка, часы Duration of rupture of membranes, hours |
Уровень прокальцитонина крови в возрасте до 24 часов жизни, нг/мл Blood procalcitonin level in < 24 hours of life, ng/mL |
0,262 |
0,004 |
0,317 |
0,002 |
–0,169 |
0,373 |
Примечание: FiO2 – фракция ингаляционного кислорода; Rs – коэффициент ранговой корреляции Спирмена.
Note: FiO2 – fraction of inspired oxygen; Rs – Spearman's rank correlation coefficient.
Оказалось, что влияние продолжительности безводного промежутка на исходы у детей было более явным в общей когорте пациентов, а не отдельно в каждой группе. Чем продолжительней был безводный промежуток, тем статистически значимо чаще в последующем детям требовался дополнительный кислород, у них фиксировалась более высокая оценка по шкале NEOMOD в первые трое суток жизни, уровень гемоглобина в крови был статистически значимо ниже, а значения ПКТ в первые сутки жизни выше.
Наиболее сильным предиктором неблагоприятного исхода стала переменная «индекс амниотической жидкости перед родами». Она определяет неблагоприятный исход с точностью ROC-AUC = 0,791 (табл. 9, рис. 2). В ходе исследования было получено значение точки отсечения (cut-off) неблагоприятного исхода, которое оказалось равно 32,0 мм, т. е. если ИАЖ перед родами ≤ 32,0 мм, то вероятность неблагоприятного исхода выше; если ИАЖ перед родами > 32,0 мм, то неблагоприятный исход случается реже. Группы с неблагоприятным и с благоприятным исходом статистически значимо различались по переменной «ИАЖ» перед родами > 32,0 мм (p = 0,001). Группа с неблагоприятным исходом: ИАЖ перед родами ≤ 32,0 мм – 13 (76,47 %), ИАЖ перед родами > 32,0 мм – 4 (23,53 %). Группа с благоприятным исходом: ИАЖ перед родами ≤ 32,0 мм – 20 (32,26 %), ИАЖ перед родами > 32,0 мм – 42 (67,74 %) (ОШ = 6,82 [ 1,97; 23,58]; p = 0,001).
Таблица 9. Метрики оценки качества предикторной переменной.
Table 9. Metrical parameters for evaluating quality of a predictor variable.
|
Мера оценки / Assessed by |
Значение / Value Ме [ Q1; Q3] % |
|
ROC-AUC |
79,1 [ 69,6; 87,7] |
|
Точность / Accuracy |
69,6 [ 60,8; 78,5] |
|
Чувствительность (1) / Sensitivity (1) |
67,7 [ 57,8; 77,9] |
|
Специфичность (0) / Specificity (0) |
76,5 [ 58,8; 93,3] |
|
ROC ± Se |
79,1 ± 0,0019 |
Примечание: AUC – площадь под кривой; ROС – характеристика оператора приемника; Se – чувствительность.
Note: AUC – area under the curve; ROС – receiver operator characteristic; Se – sensitivity.
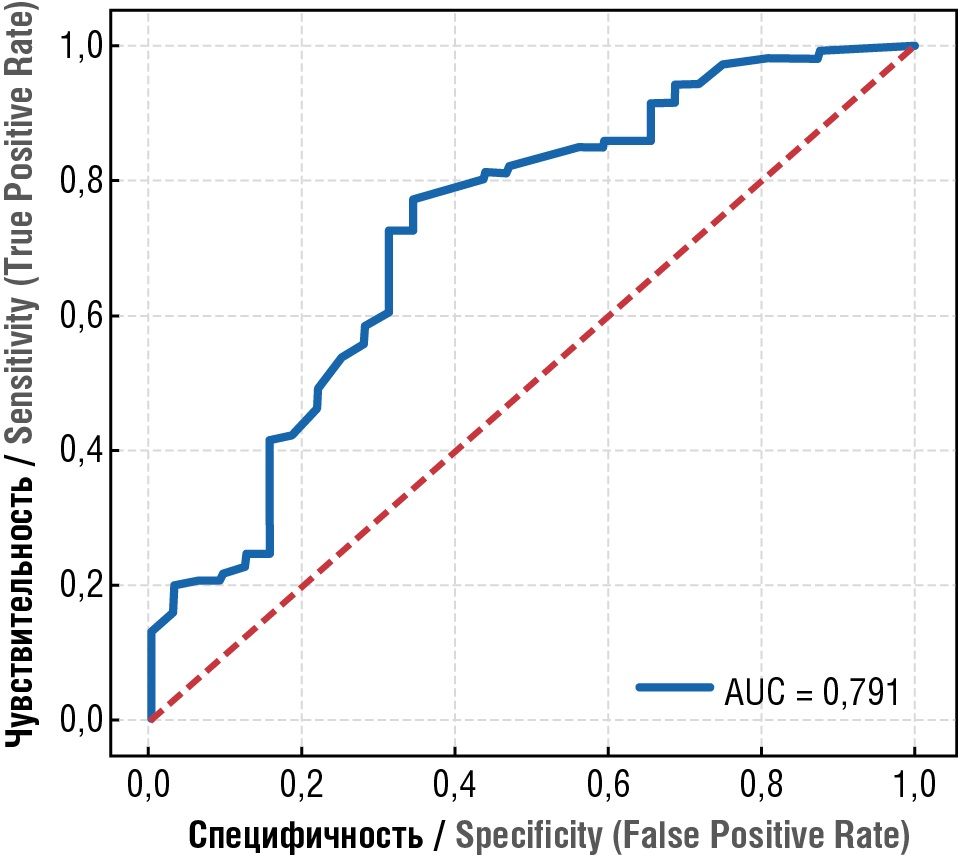
Рисунок 2. Индекс амниотической жидкости перед родами ≤ 32 мм может служить предиктором неблагоприятного исхода с точностью ROC-AUC = 0,791.
Figure 2. Prenatal amniotic fluid index ≤ 32 mm as a predictor for adverse outcome, ROC-AUC accuracy = 0.791.
Обсуждение / Discussion
Наш поиск предикторов неблагоприятного исхода в случае развития ПРПО при ПР выявил целый ряд клинико-лабораторных переменных, которые могут быть применены в клинической практике как маркеры негативного прогноза для плода и новорожденного. Неблагоприятный исход у плода и недоношенного новорожденного статистически значимо чаще сочетался с такими акушерскими показателями, как низкие срок гестации и масса тела ребенка к моменту рождения, проявления отсутствия околоплодных вод (ангидрамниона) и воспалительного процесса (хориоамнионита), потребность в родоразрешении путем операции КС, высокие значения СРБ, а также лейкоцитоз у беременных с ПРПО к моменту родов, ИАЖ перед родами ≤ 32,0 мм.
Малый гестационный возраст и более низкая масса тела при рождении объективно приводят к ухудшению прогноза у недоношенных детей, о чем свидетельствуют многочисленные опубликованные в нашей стране и в мире исследования [28][29]. Например, по данным N. Younge с соавт. (2017), среди рожденных при сроке беременности 220–236 смертность в течение нескольких недель составляет 97–98 %, при этом только 1,0 % выживает без нарушений развития нервной системы; среди рожденных при сроке беременности 240–246 недель 55 % новорожденных выживают, но только 32 % не имеют неврологических дефицитов в возрасте 18–22 месяцев жизни [30].
Среди наиболее типичных проблем со стороны матерей при ПРПО выделяют развитие хориоамнионита [9] и олиго- и ангидрамниона, причем последний чаще сочетается с потребностью в родоразрешении путем операции КС [17], что перекликается с результатами нашего исследования. Важно заметить, что хориоамнионит статистически значимо чаще встречался в группе детей с неблагоприятным исходом, чего нельзя сказать о лихорадке у беременных данной группы перед родами, т. е. хориоамнионит в отдельных случаях диагностировался при отсутствии лихорадки. Данное обстоятельство описано в литературе как субклиническое течение хориоамнионита, которое сопровождается отсутствием характерных клинических симптомов, в том числе лихорадки. При этом субклинически протекающая инфекция может манифестировать, например, в виде преждевременного дородового вскрытия плодных оболочек [31][32].
Более высокие значения СРБ в крови матери перед родами, полученные нами в группе с неблагоприятным исходом, где и частота встречаемости хориоамнионита была выше, лишний раз подтверждают описанные в литературе данные о том, что СРБ является наиболее точным маркером инфекционно-воспалительных заболеваний (чувствительность составляет 68,7 %, специфичность – 77,1 %) [33].
Отдельного внимания заслуживает наша находка в отношении переменной «индекс амниотической жидкости перед родами», поскольку она оказалась наиболее сильным предиктором неблагоприятного исхода, вероятность которого выше, если ИАЖ перед родами ≤ 32,0 мм (ROC-AUC = 0,791). В литературе обсуждаются различные показатели ИАЖ, начиная от 1 до 10 см, которые используются как прогностические критерии материнских и неонатальных исходов [9][12][15–17]; однако полученное в нашем исследовании значение ИАЖ перед родами ≤ 32,0 мм определено как сильный предиктор негативного прогноза у плода и новорожденного впервые.
В ретроспективном исследовании E.J. Okonek с соавт., выполненном в США и опубликованном в апреле 2025 г., также прослеживаются параллели с нашими данными, посвященными респираторным исходам, а именно, потребности в частом применении ВЧО ИВЛ, механической вентиляции легких, применению сурфактанта, терапии легочной гипертензии [34].
Таким образом, женщин с ПРПО рекомендуется маршрутизировать в стационары, способные обеспечить недоношенным новорожденным высокотехнологичную респираторную поддержку.
Неудивительно, что в нашем исследовании дети группы 2 с рождения статистически значимо чаще демонстрировали ПОН (в том числе более выраженную ДН), о чем свидетельствуют более низкие показатели оценки по шкале Апгар в конце 1-й и 5-й минут жизни, более высокую потребность в инвазивной респираторной поддержке, начиная с родильного зала, в повторном введении сурфактанта, в дополнительном кислороде и более высоких показателях МАР в первые 72 часа жизни. Более частое сочетание распространенных экхимозов у недоношенных детей при рождении с неблагоприятным исходом, согласно нашим данным, может расцениваться как предиктор негативного прогноза. Тоже самое у нас получилось в отношении более высоких значений ПКТ и СРБ у детей в первые 72 часа жизни и более низких значений гемоглобина в первые 24 часа после рождения при негативных исходах. Неким открытием стало также то, что у детей с негативным прогнозом статистически значимо чаще в носоглотке выявлялась Ureaplasma рarvum.
Ограничения исследования / Study limitations
Ограничениями нашего исследования явились ретроспективный характер работы, который может вносить погрешности в сбор данных, а также отсутствие гистологического подтверждения хориоамнионита. В плане дальнейших проспективных исследований для валидации выявленных предикторов, особенно в многоцентровых когортах, важно учитывать верификацию диагноза хориоамнионита не только клинически, но сопоставлять с гистологическими данными, особенно в случаях, когда у матери не проявляется лихорадка.
Заключение / Conclusion
Основными предикторами неблагоприятных перинатальных исходов при преждевременном излитии околоплодных вод являются более низкие срок беременности и масса тела ребенка на момент рождения, наличие ангидрамниона и хориоамнионита, операция КС, более высокие значения СРБ в крови и количества лейкоцитов у беременных перед родами, ИАЖ перед родами ≤ 32,0 мм. Выраженная гипоксия при рождении и тяжесть полиорганных нарушений, тяжелое течение ДН и множественные экхимозы с рождения, наличие у ребенка Ureaplasma рarvum, более низкие показатели гемоглобина и более высокие уровни ПКТ и СРБ в первые 72 часа жизни сочетаются с неблагоприятным исходом.
Список литературы
1. Davey M.A., Watson L., Rayner J.A., Rowlands S. Risk scoring systems for predicting preterm birth with the aim of reducing associated adverse outcomes. Cochrane Database Syst Rev. 2011;(11):CD004902. https://doi.org/10.1002/14651858.CD004902.pub4. Update in: Cochrane Database Syst Rev. 2015;(10):CD004902. https://doi.org/10.1002/14651858.CD004902.pub5.
2. Ancel P.-Y., Lelong N., Papiernik E. et al.; EUROPOP. History of induced abortion as a risk factor for preterm birth in European countries: results of the EUROPOP survey. Hum Reprod. 2004;19(3):734–40. https://doi.org/10.1093/humrep/deh107.
3. Здравоохранение в России. 2021. Статистический сборник. М.: Росстат, 2021. 171 с.
4. 2022 exceptional surveillance of preterm labour and birth (NICE guideline NG25). London: National Institute for Health and Care Excellence (NICE), 2022 Aug 4. Режим доступа: https://www.ncbi.nlm.nih.gov/books/NBK591661/. [Дата обращения: 25.02.2025].
5. Romero R., Miranda J., Chaiworapongsa T. et al. Prevalence and clinical significance of sterile intra-amniotic inflammation in patients with preterm labor and intact membranes. Am J Reprod Immunol. 2014;72(5):458–74. https://doi.org/10.1111/aji.12296.
6. Gomez-Lopez N., Romero R., Panaitescu B. et al. Inflammasome activation during spontaneous preterm labor with intra-amniotic infection or sterile intra-amniotic inflammation. Am J Reprod Immunol. 2018;80(5):e13049. https://doi.org/10.1111/aji.13049.
7. Boyle A.K., Rinaldi S.F., Norman J.E., Stock S.J. Preterm birth: inflammation, fetal injury and treatment strategies. J Reprod Immunol. 2017;119:62–6. https://doi.org/10.1016/j.jri.2016.11.008.
8. Keelan J.A. Intrauterine inflammatory activation, functional progesterone withdrawal, and the timing of term and preterm birth. J Reprod Immunol. 2018;125:89–99. https://doi.org/10.1016/j.jri.2017.12.004.
9. Sim W.H., Araujo Júnior E., Da Silva Costa F., Sheehan P.M. Maternal and neonatal outcomes following expectant management of preterm prelabour rupture of membranes before viability. J Perinat Med. 2017;45(1):29–44. https://doi.org/10.1515/jpm-2016-0183.
10. Kenyon S., Pike K., Jones D.R. et al. Childhood outcomes after prescription of antibiotics to pregnant women with preterm rupture of the membranes: 7-year follow-up of the ORACLE I trial. Lancet. 2008;372(9646):1310–8. https://doi.org/10.1016/S0140-6736(08)61202-7.
11. Nabhan A.F., Abdelmoula Y.A. Amniotic fluid index versus single deepest vertical pocket as a screening test for preventing adverse pregnancy outcome. Cochrane Database Syst Rev. 2008;2008(3):CD006593. https://doi.org/10.1002/14651858.CD006593.pub2.
12. Weissmann-Brenner A., O'Reilly-Green C., Ferber A., Divon M.Y. Values of amniotic fluid index in cases of preterm premature rupture of membranes. J Perinat Med. 2009;37(3):232–5. https://doi.org/10.1515/JPM.2009.078.
13. Thomson A.J.; Royal College of Obstetricians and Gynaecologists. Care of women presenting with Suspected preterm prelabour rupture of membranes from 24+0 weeks of gestation: Green-top Guideline No. 73. BJOG. 2019;126(9):e152–e166. https://doi.org/10.1111/1471-0528.15803.
14. Weiner E., Barrett J., Zaltz A. et al. Amniotic fluid volume at presentation with early preterm prelabor rupture of membranes and association with severe neonatal respiratory morbidity. Ultrasound Obstet Gynecol. 2019;54(6):767–73. https://doi.org/10.1002/uog.20257.
15. Storness-Bliss C., Metcalfe A., Simrose R. et al. Correlation of residual amniotic fluid and perinatal outcomes in periviable preterm premature rupture of membranes. J Obstet Gynaecol Can. 2012;34(2):154–8. https://doi.org/10.1016/S1701-2163(16)35158-1.
16. Vermillion S.T., Kooba A.M., Soper D.E. Amniotic fluid index values after preterm premature rupture of the membranes and subsequent perinatal infection. Am J Obstet Gynecol. 2000;183(2):271–6. https://doi.org/10.1067/mob.2000.107653.
17. Bhagat M., Chawla I. Correlation of amniotic fluid index with perinatal outcome. J Obstet Gynaecol India. 2014;64(1):32–5. https://doi.org/10.1007/s13224-013-0467-2.
18. Chamberlain P.F., Manning F.A., Morrison I. et al. Ultrasound evaluation of amniotic fluid volume. I. The relationship of marginal and decreased amniotic fluid volumes to perinatal outcome. Am J Obstet Gynecol. 1984;150(3):245–9. https://doi.org/10.1016/s0002-9378(84)90359-4.
19. Manning F.A., Platt L.D., Sipos L. Antepartum fetal evaluation: development of a fetal biophysical profile. Am J Obstet Gynecol. 1980;136(6):787–95. https://doi.org/10.1016/0002-9378(80)90457-3.
20. Phelan J.P., Ahn M.O., Smith C.V. et al. Amniotic fluid index measurements during pregnancy. J Reprod Med. 1987;32(8):601–4.
21. Phelan J.P., Smith C.V., Broussard P., Small M. Amniotic fluid volume assessment with the four-quadrant technique at 36-42 weeks' gestation. J Reprod Med. 1987;32(7):540–2.
22. Moore T.R., Cayle J.E. The amniotic fluid index in normal human pregnancy. Am J Obstet Gynecol. 1990;162(5):1168–73. https://doi.org/10.1016/0002-9378(90)90009-v.
23. Карпова А.Л., Мостовой А.В., Прутко Е.Е. и др. Интерлейкин-6 как индикатор тяжести полиорганной недостаточности у недоношенных детей с массой тела менее 1500 г: ретроспективное когортное исследование. Педиатрия имени Г.Н. Сперанского. 2023;102(1):54–63. https://doi.org/10.24110/0031-403X-2023-102-1-54-63.
24. Карпова А.Л., Мостовой А.В., Багаева З.Е. и др. Шкала NEOMOD в прогнозировании исходов у новорожденных детей с массой тела менее 1500 граммов: ретроспективное когортное исследование. Анестезиология и реаниматология. 2024;(2):49–57. https://doi.org/10.17116/anaesthesiology202402149.
25. Карпова А.Л., Мостовой А.В., Дудкина Е.А. и др. Ранний неонатальный сепсис в эпоху COVID-19. Акушерство, Гинекология и Репродукция. 2023;17(3):284–98. https://doi.org/10.17749/2313-7347/ob.gyn.rep.2023.389.
26. Карпова А.Л. Общий анализ крови: референсные интервалы для доношенных и поздних недоношенных новорожденных детей в первые сутки жизни (часть I). Педиатрия имени Г.Н. Сперанского. 2022;101(1):62–70. https://doi.org/10.24110/0031-403X-2022-101-1-62-70.
27. Карпова А.Л., Мостовой А.В., Бородич А.В. и др. Общий анализ крови: референсные интервалы для доношенных и поздних недоношенных новорожденных детей в первые сутки жизни (часть II). Педиатрия имени Г.Н. Сперанского. 2025;104(1):24–33. https://doi.org/10.24110/0031-403X-2025-104-1-24-33.
28. Мустафин Т.А., Карпова А.Л., Мостовой А.В., Колесников А.Н. Клинико-лабораторные индикаторы летального исхода у недоношенных новорожденных с массой тела менее 1500 г. Неонатология: новости, мнения, обучение. 2021;9(3):9–15. https://doi.org/10.33029/2308-2402-2021-9-3-9-15.
29. Мостовой А.В., Карпова А.Л., Харитонова Н.Р. и др. Заболеваемость и предикторы летального исхода у недоношенных новорожденных с гестационным возрастом менее 32 недель, получивших порактант альфа разными методами. Педиатрия имени Г.Н. Сперанского. 2022;101(1):27–38. https://doi.org/10.24110/0031-403X-2022-101-1-27-38.
30. Younge N., Goldstein R.F., Bann C.M. et al.; Eunice Kennedy Shriver National Institute of Child Health and Human Development Neonatal Research Network. Survival and neurodevelopmental outcomes among periviable infants. N Engl J Med. 2017;376(7):617–28. https://doi.org/10.1056/NEJMoa1605566.
31. Buscicchio G., Giannubilo S.R., Bezzeccheri V. et al. Computerized analysis of the fetal heart rate in pregnancies complicated by preterm premature rupture of membranes (pPROM). J Matern Fetal Neonatal Med. 2006;19(1):39–42. https://doi.org/10.1080/14767050500361505.
32. Vandenbroucke L., Doyen M., Le Lous M. et al. Chorioamnionitis following preterm premature rupture of membranes and fetal heart rate variability. PLoS One. 2017;12(9):e0184924. https://doi.org/10.1371/journal.pone.0184924.
33. Cataño Sabogal C.P., Fonseca J., García-Perdomo H.A. Validation of diagnostic tests for histologic chorioamnionitis: Systematic review and meta-analysis. Eur J Obstet Gynecol Reprod Biol. 2018;228:13–26. https://doi.org/10.1016/j.ejogrb.2018.05.043.
34. Okonek E.J., Schulz E.V., Belzer K. et al. Neonatal survival and outcomes following periviable rupture of membranes. Am J Perinatol. 2025;42(5):649–59. https://doi.org/10.1055/a-2414-1006.
Об авторах
А. Л. КарповаРоссия
Карпова Анна Львовна - к.м.н.
123423 Москва, ул. Саляма Адиля, д. 2/44; 123995 Москва, ул. Баррикадная, д. 2/1, корп. 1; 150000 Ярославль, ул. Революционная, д. 5
Scopus Author ID 57197280474
А. В. Мостовой
Россия
Мостовой Алексей Валерьевич - к.м.н.
123423 Москва, ул. Саляма Адиля, д. 2/44; 123995 Москва, ул. Баррикадная, д. 2/1, корп. 1; 150000 Ярославль, ул. Революционная, д. 5
Scopus Author ID 57201723894, Wos ResearcherID AAR-7908-2021
М. А. Пониманская
Россия
Пониманская Мария Александровна - к.м.н.
123423 Москва, ул. Саляма Адиля, д. 2/44
О. Н. Ли
Россия
Ли Ок Нам - к.м.н.
123423 Москва, ул. Саляма Адиля, д. 2/44
К. А. Десятник
Россия
Десятник Кирилл Александрович.
123423 Москва, ул. Саляма Адиля, д. 2/44
С. В. Мартиросян
Россия
Мартиросян Сергей Валерьевич - к.м.н.
236023 Калининград, Каштановая аллея, д. 145; 236041 Калининград, ул. Александра Невского, д. 14
С. Н. Кадын
Россия
Кадын Светлана Николаевна.
123423 Москва, ул. Саляма Адиля, д. 2/44
Н. Ю. Карпов
Россия
Карпов Николай Юрьевич.
152303 Тутаев, ул. Комсомольская, д. 104
А. А. Шичанина
Россия
Шичанина Анна Алексеевна.
119234 Москва, Ленинские горы, д. 1
А. С. Кузнецова
Россия
Кузнецова Анна Сергеевна.
119234 Москва, Ленинские горы, д. 1
Что уже известно об этой теме?
► Преждевременный разрыв плодных оболочек (ПРПО) составляет около 30 % всех преждевременных родов. Применение антибиотиков и кортикостероидов может продлить латентный период и улучшить исходы.
► ПРПО нередко сочетается с развитием манифестного хориоамнионита и синдрома системной воспалительной реакции у плода, ухудшая неонатальные исходы.
► ПРПО представляет собой серьезную проблему в акушерстве, особенно при раннем гестационном возрасте. Раннее выявление, тщательное наблюдение и своевременное вмешательство могут улучшить исходы для матери и ребенка.
Что нового дает статья?
► Неблагоприятные перинатальные исходы статистически значимо чаще сочетались с более высоким содержанием С-реактивного белка (СРБ) в крови и бóльшим количеством лейкоцитов перед родами у беременных с ПРПО, а также индексом амниотической жидкости (ИАЖ) перед родами ≤ 32,0 мм.
► Наличие распространенных экхимозов у недоношенных детей при рождении может расцениваться как предиктор негативного прогноза.
► У новорожденных детей с неблагоприятными исходами статистически значимо чаще выявлялась Ureaplasma рarvum.
Как это может повлиять на клиническую практику в обозримом будущем?
► ИАЖ перед родами ≤ 32,0 мм может быть применен в рутинной практике как один из наиболее объективных факторов риска неблагоприятных перинатальных исходов.
► Наше исследование подтвердило факт наличия хориоамнионита без лихорадки, а значит, возможно усиление внимания к субклиническим формам течения внутриамниотической инфекции.
► Активная профилактика Ureaplasma рarvum позволит улучшить исходы у недоношенных новорожденных детей.
Рецензия
Для цитирования:
Карпова А.Л., Мостовой А.В., Пониманская М.А., Ли О.Н., Десятник К.А., Мартиросян С.В., Кадын С.Н., Карпов Н.Ю., Шичанина А.А., Кузнецова А.С. Предикторы неблагоприятных перинатальных исходов при преждевременном разрыве плодных оболочек. Акушерство, Гинекология и Репродукция. 2025;19(4):488-505. https://doi.org/10.17749/2313-7347/ob.gyn.rep.2025.622
For citation:
Karpova A.L., Mostovoi A.V., Ponimanskaya M.A., Lee O.N., Desyatnik K.A., Martirosyan S.V., Kadyn S.N., Karpov N.Yu., Shichanina A.A., Kuznetsova A.S. Predictors of unfavorable perinatal outcomes in premature rupture of membranes. Obstetrics, Gynecology and Reproduction. 2025;19(4):488-505. https://doi.org/10.17749/2313-7347/ob.gyn.rep.2025.622

Контент доступен под лицензией Creative Commons Attribution-NonCommercial-ShareAlike 4.0 International License.











































