Перейти к:
Иммунные парадоксы вакцининдуцированной тромботической тромбоцитопении (ВИТТ), гепарин-индуцированной тромбоцитопении (ГИТ) и тромбозов: от общих механизмов к уникальному течению ВИТТ и ГИТ
https://doi.org/10.17749/2313-7347/ob.gyn.rep.2025.610
Аннотация
Цель: сравнительный анализ патогенеза, клинических проявлений, диагностических критериев и терапевтических стратегий вакцин-индуцированной тромботической тромбоцитопении (ВИТТ) и гепарин-индуцированной тромбоцитопении (ГИТ) – двух редких, но потенциально жизнеугрожающих состояний, связанных с антителозависимой активацией тромбоцитов.
Материалы и методы. Выполнен обзор современных данных по патогенезу, эпидемиологии, клинике, диагностике и лечению ВИТТ и ГИТ, включая анализ существующих диагностических шкал, лабораторных тестов и терапевтических подходов. Методология обзора включала анализ данных систематических обзоров, клинических исследований и актуальных клинических рекомендаций.
Результаты. ВИТТ и ГИТ объединяет общий патогенетический механизм, связанный с выработкой антител против фактора 4 тромбоцитов (англ. platelet factor 4, PF4) и развитием тромботических осложнений. Однако ключевое различие заключается в триггерах иммунного ответа: ГИТ индуцируется применением гепарина, тогда как ВИТТ развивается после введения аденовирусных векторных вакцин против SARS-CoV-2. ГИТ характеризуется тромбозами венозного русла, тогда как ВИТТ проявляется преимущественно атипичными тромбозами, включая церебральные венозные синусы. Оба состояния требуют немедленного вмешательства, но терапия ГИТ основывается на отмене гепарина и назначении альтернативных антикоагулянтов, тогда как ВИТТ требует применения внутривенных иммуноглобулинов и антикоагулянтов, в том числе препаратов гепарина.
Заключение. Несмотря на редкость, ВИТТ и ГИТ представляют серьезную угрозу здоровью пациентов. Современные диагностические методы, включая шкалу 4T и серологическое тестирование, позволяют своевременно выявлять ГИТ, в то время как диагностика ВИТТ остается сложной и требует дальнейшей стандартизации. Оптимизация терапевтических стратегий, включая применение новых антикоагулянтов и иммуносупрессивных методов, является приоритетной задачей для снижения смертности и улучшения исходов у пациентов с данными состояниями.
Ключевые слова
Для цитирования:
Макацария А.Д., Акиньшина С.В., Воробьев А.В., Бицадзе В.О., Хизроева Д.Х., Третьякова М.В., Макацария Н.А., Калашникова И.С., Гашимова Н.Р., Григорьева К.Н., Степанов И.А., Дикарева И.М., Татаринцева А.Ю., Лазарчук А.В., Хисамиева А.Р., Блинов Д.В., Ван Дреден П., Гри Ж., Элалами И., Геротзиафас Г. Иммунные парадоксы вакцининдуцированной тромботической тромбоцитопении (ВИТТ), гепарин-индуцированной тромбоцитопении (ГИТ) и тромбозов: от общих механизмов к уникальному течению ВИТТ и ГИТ. Акушерство, Гинекология и Репродукция. 2025;19(1):97-109. https://doi.org/10.17749/2313-7347/ob.gyn.rep.2025.610
For citation:
Makatsariya A.D., Akinshina S.V., Vorobev A.V., Bitsadze V.O., Khizroeva J.Kh., Tretyakova M.V., Makatsariya N.A., Kalashnikova I.S., Gashimova N.R., Grigoreva K.N., Stepanov I.A., Dikareva I.M., Tatarintseva A.Yu., Lazarchuk A.V., Khisamieva A.R., Blinov D.V., Van Dreden P., Gris J., Elalamy I., Gerotziafas G. Immune paradoxes of vaccine-induced thrombotic thrombocytopenia (VITТ), heparin-induced thrombocytopenia (HIT) and thrombosis: from general mechanisms to the unique VITТ and HIT course. Obstetrics, Gynecology and Reproduction. 2025;19(1):97-109. (In Russ.) https://doi.org/10.17749/2313-7347/ob.gyn.rep.2025.610
Введение / Introduction
Современная медицина сталкивается с широким спектром иммуноопосредованных патологических состояний, характеризующихся схожими патофизиологическими механизмами, но различающихся по клинической картине и терапевтическим стратегиям. В частности, значительный научный и клинический интерес вызывают вакцин-индуцированная тромботическая тромбоцитопения (ВИТТ) и гепарин-индуцированная тромбоцитопения (ГИТ), которые объединяет иммунный патогенез, но отличает различная этиологическая природа, особенности клинического течения и подходы к лечению. ВИТТ, впервые детально изученная в связи с применением аденовирусных векторных вакцин против SARS-CoV-2, представляет собой редкое, но потенциально жизнеугрожающее осложнение, связанное с выработкой антител к фактору 4 тромбоцитов (англ. platelet factor 4, PF4), что приводит к активации тромбоцитов и последующему тромбообразованию. Данный синдром характеризуется развитием тромбозов, преимущественно атипичных локализаций, таких как церебральные венозные синусы и мезентериальные сосуды, в сочетании с выраженной тромбоцитопенией. В отличие от ВИТТ, ГИТ представляет собой давно известное осложнение антикоагулянтной терапии, развивающееся у пациентов, получающих преимущественно нефракционированный (НФГ) или значительно реже низкомолекулярный гепарин (НМГ). В основе патогенеза ГИТ также лежит образование антител к комплексу гепарина и PF4, что приводит к массивной активации тромбоцитов, высвобождению протромботических медиаторов и развитию как венозных, так и артериальных тромбозов, зачастую с катастрофическими последствиями. Данное состояние требует немедленной отмены гепарина и применения альтернативных антикоагулянтов.
Несмотря на различие триггерных факторов (вакцинная экспозиция vs. фармакотерапия гепарином), оба синдрома демонстрируют сложность иммунного взаимодействия с системой гемостаза, подчеркивая необходимость углубленного изучения механизмов тромбообразования и разработки эффективных методов диагностики и лечения данных состояний. Впервые ГИТ была описана на V научном заседании Международного общества сосудистых хирургов в Нью-Йорке 1 июня 1957 года. В докладе R.E. Weismann и R.W. Tobin описали 10 пациентов, у которых развился тромбоз на фоне терапии гепарином, 6 из них умерли [1]. ГИТ является довольно редким (1 случай на 1500 госпитализаций в год) заболеванием, однако его последствия остаются крайне тяжелыми: тромбоцитопения коррелирует с артериальными и венозными тромбозами в 35–70 % случаев, из которых у 20 % пациентов данные тромбозы приводят к полному нарушению трофики тканей, последующему развитию некротических изменений (вплоть до гангрены) и требуют оперативного вмешательства – ампутации [2–4]; для 30 % пациентов ГИТ является фатальной [5].
Несмотря на то что ГИТ давно изучена и имеет четко разработанные протоколы диагностики и лечения, с 2021 г. научное сообщество столкнулось с новым феноменом – случаями тромбоза, сопровождающимися тромбоцитопенией, но не связанными с применением гепарина или его производных. Это наблюдение стало отправной точкой для гипотезы о существовании ранее неизвестного иммуноопосредованного состояния. Данное состояние вскоре было определено как последствие вакцинации нереплицируемой аденовирусной вакциной ChAdOx1 nCoV-19, произведенной компанией AstraZeneca (Великобритания) и Ad26.COV2.S от Johnson & Johnson (США), и позже получило название ВИТТ [6–11]. Под ВИТТ понимается состояние, возникающее в ответ на введение вакцин на основе нереплицирующихся аденовирусных векторов против COVID-19. Это состояние ассоциировано с развитием как венозных, так и артериальных тромбозов. Особое внимание привлекает атипичная локализация тромбозов, в частности, тромбоз церебральных вен, что привело к введению более широкого термина – синдром тромбоза с тромбоцитопенией (англ. thrombotic thrombocytopenic syndrome, TTS) [6].
Эпидемиология ВИТТ и ГИТ / VITТ and HIT epidemiology
Обе формы тромбоцитопении относятся к редким патологическим состояниям. Так, частота ГИТ варьируется в зависимости от типа применяемого антикоагулянта: среди пациентов, получавших терапию НФГ, данный синдром развивается приблизительно в 3 % случаев, тогда как при использовании НМГ его частота снижается до 0,2 % [12][13]. ВИТТ является еще более редким явлением: ее зарегистрированная частота составляет от 0,87 случаев на 1 млн первых введенных доз в странах Центральной Европы до 8,6 случаев на 1 млн в Соединенном Королевстве [14]. Эти данные подчеркивают исключительную редкость ВИТТ в популяции, однако высокая летальность и сложность диагностики обусловливают необходимость повышенного внимания к данному синдрому в клинической практике. Для конкретных вакцин эти показатели следующие: 3,2–16,1 случая для ChAdOx1 nCoV-19 (Vaxzevria, AstraZeneсa, Великобритания), 1,7–3,7 случая для Ad26.COV2.S (Jcovden, Johnson & Johnson–Janssen, США), 0,1 случай для Gam-COVID-Vac (Спутник V, ФГБУ НИЦЭМ им. Н.Ф. Гамалеи Минздрава России, Россия) и 0,0081 случая для Ad5-nCoV (Convidecia, CanSino Biologics Inc., Китай) на 1 млн доз [11]. Чаще ВИТТ развивается после введения первой дозы вакцины, лишь редкие случаи зафиксированы после двух доз с возможно более легким течением [15][16]. Во многом частоту ВИТТ сложнее рассматривать как стабильный показатель ввиду относительной новизны состояния и общей разнородности данных. Так, начиная с 2021 г., смертность от ВИТТ по одним исследованиям составляла 39,2 %, по другим – 22 % [15][17][18]. По данным же систематического обзора 2022 г., выполненного A.Y. Kim с соавт., смертность от ВИТТ составляла 32 % [19].
Развитие ГИТ отмечено только при условии применения гепарина или ортопедических операций, а также некоторых тяжелых инфекций (так называемая спонтанная или аутоиммунная ГИТ). Для этих пациентов характерна зависимость вероятности тромбообразования от концентрации препарата, так как при превышении концентрации одного из двух веществ (гепарина или белка PF4), необходимых для формирования иммунных комплексов гепарин/PF4, активация рецепторов на поверхности кровяных пластинок происходить не будет [20][21].
В то же время ВИТТ развивается в присутствии вектора аденовирусной вакцины и имеет корреляцию не только с препаратом-индуктором, но и с возрастом пациентов. Метаанализ от 2021 г. показал, что частота ВИТТ обратно пропорциональна возрасту пациента, в частности, пациенты старше 65 встречаются с данной тромбоцитопенией 1 раз на 1 млн, тогда как в группе младше 55 частота возрастает от 1 на 60 тыс. до 1 на 20 тыс. [22]. Что касается географического распределения, в 2021 г. в Норвегии на 130 тыс. человек, получивших вакцину AstraZeneca, наблюдалось 5 случаев ВИТТ (1 на 26 тыс.) [8]. В Великобритании в 2022 г. было зафиксировано 367 случаев ВИТТ после 24 млн первых доз и 44 случая после вторых доз – 1 случай на 67302 для первых и 1 случай на 518181 для вторых доз [23]. По данным Центров по контролю и профилактике заболеваний США (англ. Centers for Disease Control and Prevention, CDC), частота ВИТТ достигала 1 случая на 261 тыс. доз [24][25].
Патогенез ВИТТ и ГИТ / VITТ and HIT pathogenesis
Гепарин-индуцированная тромбоцитопения и вакцин-индуцированная тромботическая тромбоцитопения являются состояниями, относящимися к группе анти-PF4 иммуноглобулин-зависимых нарушений, которые характеризуются присутствием патогенных иммуноглобулинов G (IgG) против PF4 и/или PF4/гепарин комплексов. Данные IgG способны активировать тромбоциты, приводя к тромбоцитопении и тяжелым тромбозам [26–28]. По некоторым оценкам, данные антитела определяются у 5 % популяции [29][30].
В настоящее время патогенез ГИТ описывается так (рис. 1):
– гепарин связывается с катионным (положительно заряженным) белковым тетрамером PF4;
– происходят конформационные изменения тетрамеров PF4 из-за перераспределения заряда [31];
– образуется неоэпитоп, что запускает B-клетки маргинальной зоны селезенки;
– вырабатываются специфические IgG антитела к неоэпитопам гепарин-PF4;
– IgG связывают гепарин-PF4, образуются иммунные комплексы;
– данные иммунные комплексы связываются с рецепторами FcγRIIa на поверхности тромбоцитов;
– передающийся сигнал активирует тромбоциты, приводит к выбросу PF4 и повышению коагулянтной активности;
– эндотелиальные клетки сосудов также участвуют в патогенезе ГИТ, так как PF4 способен связываться с гепарансульфатом их гликокаликса, образуя сходные эпитопные комплексы [32];
– IgG взаимодействуют с эндотелием сосудов, активируя тканевой фактор, внешний путь свертывания, продукцию провоспалительных цитокинов;
– повреждение эндотелия усиливает активацию тромбоцитов, синтез тромбина;
– развивается тромбоз и тромбоцитопения;
– иммунные комплексы также способны активировать моноцины и нейтрофилы;
– возникает порочный круг, суть которого заключается в повышении концентрации иммунных комплексов и нарастании клинических проявлений.
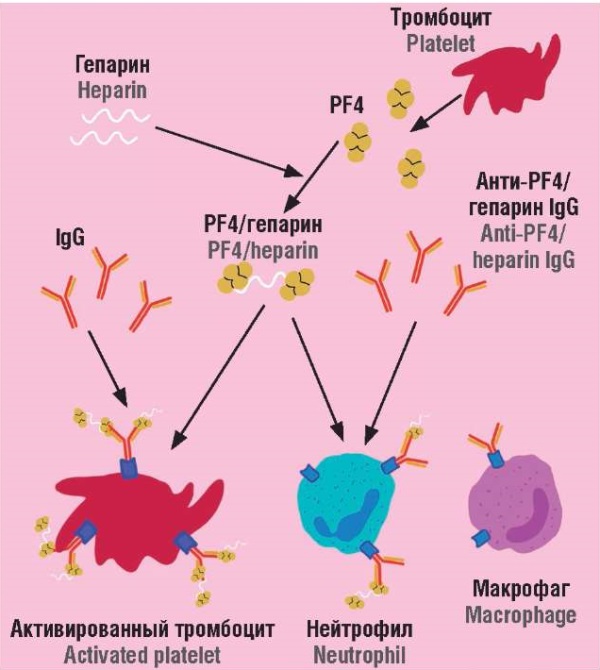
Рисунок 1. Патогенетический каскад гепарин-индуцированной тромбоцитопении [рисунок авторов].
Примечание: PF4 – фактор 4 тромбоцитов.
Figure 1. Pathogenetic cascade of heparin-induced thrombocytopenia [drawn by authors].
Note: PF4 – platelet factor 4.
Как видно из приведенной схемы патогенеза, в классическом варианте ГИТ для образования иммунных комлексов IgG-PF4/гепарин фактору тромбоцитов 4 необходимо связаться с гепарином. Являясь крупным анионным полисахаридом, гепарин находит свою мишень на положительно заряженной петле в области экватора белкового тетрамера. Электростатическое взаимодействие гепарина и PF4 приводит к изменению конформации последнего и образованию «Северного и Южного» полюсов, которые и выступают неоэпитопами или антигенными мишенями IgG [32]. Эти неоэпитопы считаются гепарин-зависимыми, требуют концентрации от 0,1 до 0,5 Ед/мл [33–35].
Что касается ВИТТ, то антитела (IgG) при ней связываются именно с положительно заряженными участками тетрамера PF4, то есть с мишенью гепарина [36][37]. Данное явление также наблюдается при аутоиммунной форме ГИТ [38]. По этим серологическим качествам анти-PF4 антитела разделяют на 3 типа [39] (рис. 2):
– непатогенные – не активирующие тромбоциты;
– гепарин-зависимые, активирующие тромбоциты;
– гепарин-независимые, активирующие тромбоциты через PF4.
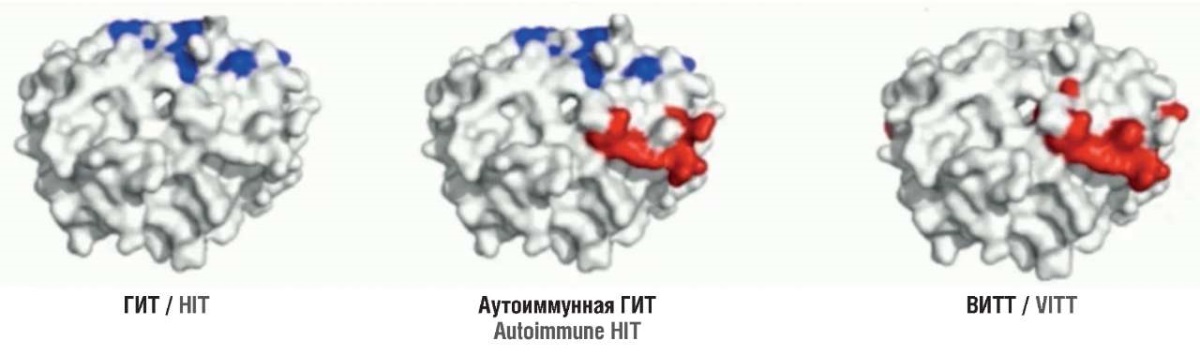
Рисунок 2. Антигенные сайты фактора 4 тромбоцитов (PF4) [33].
Примечание: ГИТ – гепарин-индуцированная тромбоцитопения; ВИТТ – вакцин-индуцированная тромботическая тромбоцитопения; связь гепарин-зависимых антител с сайтом PF4 (показано синим); связь гепарин-независимых антител с сайтом PF4 (показано красным).
Figure 2. Platelet factor 4 antigenic sites (PF4) [33].
Note: HIT – heparin-induced thrombocytopenia; VITТ – vaccine-induced thrombotic thrombocytopenia; heparin-dependent antibodies bind to the PF4 site shown in blue; heparin-independent antibodies bind to the PF4 site shown in red.
Второй тип характерен для классической ГИТ [40]. В таком случае показан переход на негепариновые антикоагулянты. Для аутоиммуной ГИТ характерны антитела, способные активировать тромбоциты, не завися от гепарина; иногда аутоиммунная ГИТ может запускаться крайне низкими дозами гепарина [41]. Она ассоциируется с чрезвычайно высоким риском тромбоза (75–90 %), тромбоцитопенией и частым ДВС [42][43]. Для спонтанной ГИТ характерно нарастание клинических и лабораторных проявлений на 5–10 день после ортопедической операции (на колене, тазобедренном суставе) или в результате инфекции, в связи с чем вырабатывающиеся на бактериальные или вирусные антигены антитела активируют белок PF4, уже связанный с отрицательной заряженной бактериальной стенкой/капсидом и взаимодействуют с рецепторами FcγRIIa на поверхности тромбоцитов, что приводит к их активации и аггрегации [44–46].
Для ВИТТ же характерно взаимодействие организма с нереплицирующейся векторной аденовирусной вакциной. Клиническая картина развивается на 5–30-й для ChAdOx1 nCoV-19 и 6–15-й день для Ad26.CoV2.S, при этом медиана клинических проявлений составляет 8 дней. В это время развиваются атипичные тромбозы и тромбоцитопения. Причем некоторые исследования позволяют сделать вывод, что вектор, основанный на человеческом геноме, в меньшей степени ассоциирован с ВИТТ [47][48]. В настоящее время принято считать, что патогенетически данное состояние развивается следующим образом (рис. 3):
– компоненты векторных вакцин, заряженные отрицательно (с большей вероятностью – гексоновые аденовирусные белки), связываются с катионным PF4 на поверхности тромбоцитов [49];
– данные тромбоциты транспортируются в селезенку, где ввиду антигенной структуры они подвергаются макрофагоцитозу с дальнейшей активацией B-клеток;
– B-клетки селезенки продуцируют антитела IgG, способные связывать PF4 и активировать FcγRIIa;
– активация данных рецепторов запускает агрегацию тромбоцитов, а также формирование внеклеточных ловушек нейтрофилов;
– запускается каскадная реакция с повышением содержания PF4 в сыворотке;
– сформированные антитела IgG электростатически связываются с PF4, формируя комплексы, еще дальше активирующие тромбоциты;
– развивается тромбоз и тромбоцитопения.
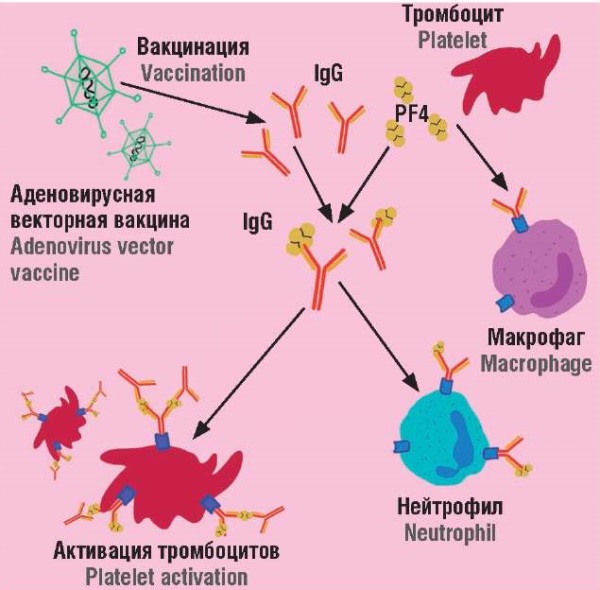
Рисунок 3. Патогенетический каскад вакцин-индуцированной тромботической тромбоцитопении [рисунок авторов].
Примечание: PF4 – фактор 4 тромбоцитов.
Figure 3. Pathogenetic cascade of vaccine-induced thrombotic thrombocytopenia [drawn by authors].
Note: PF4 – platelet factor 4.
Ключевым отличием ВИТТ от ГИТ с патогенетической точки зрения остается отсутствие гепарина в процессе образования иммунных комплексов. Этим ВИТТ больше напоминает развитие аутоиммунной или спонтанной формы ГИТ. Важно отметить, что несмотря на связь с вакциной от COVID-19, антитела при ВИТТ не взаимодействуют со спайк-белком коронавируса, что говорит об отсутствии кросс-реакции выработанных на вирус антител с PF4 [50][51].
Клинические проявления и диагностика ВИТТ и ГИТ / VITТ and HIT clinical manifestations and diagnostics
Основными проявлениями ВИТТ и ГИТ являются тромбоз и тромбоцитопения. Венозные тромбозы возникают у пациентов с ГИТ в 4 раза чаще артериальных [52], характерные локализации которых – это артерии конечностей, коронарные сосуды (возникают инфаркты) и сосуды головного мозга (возникают острые нарушения мозгового кровообращения). При этом такие грозные осложнения как кровоизлияния в надпочечники, гангрена конечностей или некроз кожи могут проходить и в отсутствие тромбоцитопении. И хотя у 95 % пациентов с ГИТ уровень тромбоцитов снижался менее 150×10⁹/л, диагноз по одному лабораторному показателю не ставится. Для диагностики ГИТ был разработан алгоритм четырех Т: тромбоцитопения, время (timing) падения количества тромбоцитов, тромбоз и прочие осложнения, иные причины тромбоцитопении [2][53] (табл. 1). Сумма баллов 1–3, 4–5 и 6–8 считаются соответствующими низкой, средней и высокой вероятности ГИТ соответственно.
Таблица 1. Оценка четырех Т для диагностики гепарин-индуцированной тромбоцитопении [2][53].
Table 1. 4Тs scoring assessment for diagnostics of heparin-induced thrombocytopenia [2][53].
|
Т-категория T-category |
2 балла 2 points |
1 балл 1 point |
0 баллов 0 points |
|
Тромбоцитопения Thrombocytopenia |
Снижение числа тромбоцитов более чем на 50 % Platelet count fall > 50 % and platelet nadir > 20 % |
Снижение числа тромбоцитов на 30–50 % Platelet count 30–50 % or platelet nadir 10–19 |
Снижение числа тромбоцитов менее чем на 30 % Platelet count fall < 30 % or platelet nadir < 10 |
|
Время падения числа тромбоцитов Time of platelet count fall |
Четкое начало на 5–10-й день или снижение числа тромбоцитов в течение одного дня при предшествующем применении гепарина в последние 30 дней Clear onset days 5–10 or platelet fall < 1 day (prior heparin exposure within 30 days) |
Соответствует падению на 5–10-й день или после 10-го дня, или снижение числа тромбоцитов в течение одного дня при применении гепарина 30–100 дней назад Consistent with days 5–10 fall, but not clear (eg, missing platelet counts); onset after day 10; or fall < 1 day (prior heparin exposure 30–100 days ago) |
Снижение числа тромбоцитов в течение 4 дней при отсутствии недавнего применения гепарина Platelet count < 4 days without recent exposure |
|
Тромбоз или другие последствия Thrombosis or other sequelae |
Новый подтвержденный тромбоз; некроз кожи; острая системная реакция после внутривенного болюса нефракционированного гепарина New thrombosis (confirmed); skin necrosis; acute systemic reaction postintravenous unfractionated heparin bolus |
Прогрессирующий или рецидивирующий тромбоз; не некротизирующие (эритематозные) кожные поражения; подозрение на тромбоз (не подтвержденный) Progressive or recurrent thrombosis; non-necrotizing (erythematous) skin lesions; suspected thrombosis (not proven) |
Отсутствует None |
|
Иные причины тромбоцитопении Other causes of thrombocytopenia |
Не выявлены None apparent |
Возможны Possible |
Очевидны Definite |
Для серологической диагностики рекомендуется применять иммунноферментный анализ с определением оптической плотности, так как он имеет высокую чувствительность (95 %; 95 % доверительный интервал (ДИ) = 95–99 %), но не самую высокую специфичность (82 %; 95 % ДИ = 84–90 %) [37]. При сопоставлении результатов серологического анализа и 4T системы можно рассчитать вероятность развития ГИТ у данного пациента и изменять врачебную тактику соответственно (табл. 2).
Таблица 2. Оценка вероятности развития гепарин-индуцированной тромбоцитопении (ГИТ) [2].
Table 2. Probability assessment for developing heparin-induced thrombocytopenia (HIT) [2].
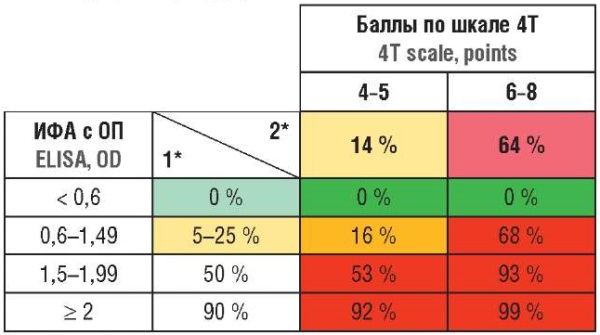
Примечание: ИФА – иммуноферментный анализ; ОП – оптическая плотность; 1* – вероятность ГИТ без учета количества баллов по шкале 4Т; 2* – вероятность ГИТ без учета результатов ИФА. Цветами отмечена вероятность диагностики ГИТ для пациентов с соответствующими показателями: зеленый – низкий риск; желтый – умеренный риск; красный – высокий риск.
Note: ELISA – enzyme immunoassay; OD – optical density; 1* – HIT probability based on ELISA OD data, not based on 4Ts scoring system; 2* – HIT probability based on 4Ts scoring system, not including ELISA OD data. Colors mark the probability of the HIT diagnosis in patients with correlating laboratory and clinical results: green – low probability; yellow – moderate probability; red – high probability.
При количестве баллов по критериям 4Т более 3 рекомендуется отмена гепарина и назначение альтернативных антикоагулянтов [53][54]. Далее необходимо выполнить иммуноферментный анализ с измерением оптической плотности (желательно, иммуноспецифичный к IgG), результаты которого позволят уточнить диагноз [2].
Клиническая картина ВИТ несколько отличается от ГИТ: для ВИТТ характерны тромбозы атипичных локализаций – синусов твердой мозговой оболочки (англ. cerebral sinus vein thrombosis, CSVT), тромбоз вен брюшной полости (англ. splanchnic vein thrombosis, SVT) [6–8]. Было определено, что у 83 % пациентов с подтвержденной ВИТТ определялись множественные очаги тромбоза, чаще в атипичных зонах [55].
По А. Greinacher с соавт. (2022) необходимо определить и отметить клинические признаки ВИТТ [18]:
1) симптомы, характерные для данного состояния:
– устойчивая и сильная головная боль;
– признаки прогрессирования и рефрактерность к терапии;
– постоянная и сильная боль в животе или пояснице;
– очаговая неврологическая симптоматика (включая нарушения зрения);
– одышка;
– сильная и устойчивая боль в груди;
– отек, покраснение конечности или ее бледность и похолодание;
2) наличие множественных тромбозов органов, что особенно важно для исключения дополнительных тробмозов у пациентов с вновь возникшими симптомами или с симптомами тромбоза различных органов и систем;
3) сроки появления симптомов: с 5 по 30-й день вакциенации, кроме некоторых пациентов с изолированным тромбозом глубоких вен или тромбоэмболией легочной артерии (ТЭЛА), для которых ВИТТ может оставаться клинически незаметной дольше.
Для диагностики ВИТТ L. Schönborn с соавт. в 2024 г. выпустили критерии определения данного состояния [56]:
1) тромбоцитопения соответствует одному или более пунктам:
– количество тромбоцитов < 150×10⁹/л;
– количество тромбоцитов менее нижней границы нормы лаборатории;
– снижение количества тромбоцитов более чем на 50 % от предыдущего описанного числа;
2) повышенный уровень D-димера – пик в 8 и более раз больше верхней границы нормы лаборатории (> 4000 нг/мл);
3) острый и заново диагностированный тромбоз и тромбоэмболия (один и более из следующих критериев):
– тромбоз подтвержден морфологически с помощью визуализации или интраоперационно;
– тяжелая непроходящая головная боль, наступающая через 5–30 дней после вакцинации;
4) характеристики интервала, прошедшего с момента вакцинации до начала клинических проявлений, начало симптоматики должно попадать в один из данных интервалов:
– 4–30-й день после вакцинации;
– 4–42 дня после вакцинации, если был изолированный тромбоз глубоких вен или ТЭЛА;
5) антитела к PF4, один и более из следующих критериев:
– положительный тест ELISA на анти-PF4 IgG;
– положительный функциональный тест для PF4-зависимых антител.
По данным критериям можно составить 3 уровня доказательности диагноза [56].
Уровень 1 – абсолютный. Присутствуют все 5 критериев, или есть подтвержденный функциональный тест на PF4-зависимые антитела (с ELISA или без), и присутствуют 3 из 4 оставшихся критериев.
Уровень 2 – вероятный. Подтвержденный тест на PF4 антитела с анализом ELISA и без результата функционального исследования на PF4-зависимые антитела, и присутствуют 3 из 4 любых критериев, и более вероятное объяснение болезни не подобрали.
Уровень 3 – возможный. Присутствие 3 из 5 критериев ВИТТ, и более вероятное объяснение болезни не нашлось.
В качестве инструментальной диагностики рационально применять комптютерную томографию (КТ) без контрастирования при подозрении на тромбоз венозных синусов для исключения внутричерепных кровоизлияний и гематом. Визуализацию при подозрении на такое осложнение следует проводить в сосудистом режиме и в паренхиматозной фазе с помощью КТ-венографии или магнитно-резонансной венографии и неотложной визуализации [55].
Терапия ВИТТ и ГИТ / VITТ and HIT therapy
Терапия ВИТТ и ГИТ неразрывно связана с их диагностикой и определением сопутствующих патологий. Учитывая высокий риск тромбозов при ВИТТ и ГИТ, показаны антикоагулянты, однако группы препаратов ввиду особенностей патогенеза различны [57–59]. Так, для пациентов с подозрением на ГИТ или с подтвержденной ГИТ первостепенным является прекращение использования гепарин-содержащих антикоагулянтов, а также рекомендованы альтернативные антикоагулянты в терапевтических дозах [60]. Отсутствие антикоагулянтной терапии (АКТ) связано с высоким риском тромботических осложнений при острой ГИТ (более 50 %), что еще раз указывает на необходимость АКТ [61–64].
Что касается ВИТТ, то в данном случае терапия также должна начаться незамедлительно ввиду высокой вероятности тромботических осложнений. Основой терапии при ВИТТ является АКТ, однако выбор препаратов более широк, так как патогенетически гепарин не участвует в формировании данного состояния. Несмотря на это, нужно с осторожностью подходить к применению гепариновых антикоагулянтов, так как у небольшого количества пациентов (около 5 %) в крови могут наблюдаться анти-PF4/гепарин антитела, а также не всегда есть возможность исключить кросс-реактивные состояния [65]. В терапии ВИТТ также применяются внутривенные иммуноглобулины (ВВИГ), которые позволяют ингибировать активацию тромбоцитов и снизить уровень антител против PF4. В качестве иных иммуносупрессивных методов применяются кортикостероиды. В крайне тяжелых случаях ВИТТ больным может быть показан плазмаферез.
Прямые оральные антикоагулянты (ПОАК), такие как ривароксабан, апиксабан и дабигатран не воздействуют на PF4. Они также не показывают кросс-реактивность с антителами при ГИТ, так как имеют отличную от гепарина структуру. Несмотря на небольшое количество сравнительных исследований, данные препараты показывают высокую эффективность при ВИТТ и ГИТ. Применение ривароксабана у 46 пациентов, из которых 25 получали препарат в качестве основной терапии, зафиксировало только 2,2 % повторных случаев тромбоза [66]. Данные препараты показывают также эффективность в лечении ВИТТ, в том числе в период неспецифичной симптоматики (пре-ВИТТ) и рекомендуются в качестве терапии при острой ВИТТ [67]. Фондапаринукс также широко применяется в терапии ГИТ, однако его опыт использования при ВИТТ весьма мал [60]. Несмотря на то что фондапаринукс является пентасахаридом гепарина, он не вызывает иммунного ответа ввиду недостаточной длины молекулы, которая не позволяет связать 2 белка PF4 [68][69]. Также in vitro было продемонстрировано, что около 97 % антител ГИТ не активируют тромбоциты и не провоцируют аггрегацию при фондапаринуксе [70]. По данным систематического обзора, в группе из 154 пациентов с ГИТ повторные тромбозы возникали с частотой 6,5 %, массивные кровотечения – в 16,9 % случаев, летальный исход – в 3,2 % [71]. В таблице 3 представлены основные препараты, используемые в терапии ВИТТ и ГИТ.
Таблица 3. Лекарственная терапия вакцин-индуцированной тромботической тромбоцитопении (ВИТТ) и гепарин-индуцированной тромбоцитопении (ГИТ) [60].
Table 3. Drug therapy for vaccine-induced thrombotic thrombocytopenia (VITТ) and heparin-induced thrombocytopenia (HITТ) [60].
|
Тип препарата Drug type |
Название Name |
Механизм действия Mechanism of action |
Необходимость наблюдения Follow-up required |
Противопоказания Contraindications |
Показан при ВИТТ/ГИТ Indicated in VINT/HIT |
Примечание Note |
|
Оральные Oral |
Ривароксабан Апиксабан Rivaroxaban Apixaban Дабигатран Dabigatran |
Прямой ингибитор фактора Xa Direct FXа inhibitor Прямой ингибитор тромбина Direct thrombin inhibitor |
Не требуется Not required |
Острая почечная недостаточность Acute renal failure |
+/+ |
Рекомендованы при подостром течении ГИТ, при ВИТТ Recommended for subacute HIT and VITT |
|
Подкожные Subcutaneous |
Фондапаринукс Fondaparinux |
Антитромбин-опосредованный ингибитор FХa Antithrombin-mediated FXa inhibitor |
Рекомендуется при острой ГИТ Recommended for acute HIT |
+/+ |
Долгий период полувыведения, возможно развитие аутоиммунной ГИТ [42] Long half-life, possible development of autoimmune HIT [42] |
|
|
Внутривенные Intravenous |
Аргатробан Argаtrоban |
Синтетический антикоагулянт Synthetic anticoagulant Прямой ингибитор тромбина Direct thrombin inhibitor |
Требуется (АЧТВ, анти-IIa активность) Required (APTT, anti-IIa activity) |
+/+ |
Короткий период полувыведения, рекомендован пациентам с почечными повреждениями Short half-life, recommended for patients with renal impairment |
|
|
Бивалирудин Bivalirudine |
Не требуется Not required |
+/+ |
Короткий период полувыведения Short half-life |
|||
|
Внутривенные или подкожные Intravenous or subcutaneous |
Данапароид Danaparoid |
Ингибитор FXa, низкая антитромбиновая активность FXa inhibitor, low antithrombin activity |
Рекомендовано до стабильного состояния Recommended until stable condition |
Высокий риск кровотечения High risk of bleeding |
+/+ |
Долгий период полувыведения, возможно подкожное применение при подостром течении ГИТ Long half-life, possible subcutaneous use in subacute HIT |
|
Гепарин (НФГ или НМГ) Heparin (UFH or LMWH) |
Ингибитор FXa, ингибитор тромбина (НФГ) FXa inhibitor, thrombin inhibitor |
Рекомендовано при НФГ Recommended for UFH |
НМГ (острая почечная недостаточность) LWWH (acute renal failure) |
+/– |
Рекомендован при ВИТТ в отсутствие альтернативных антикоагулянтов [72] Recommended for VITT in the absence of alternative anticoagulants [72] |
Примечание: АЧТВ – активированное частичное тромбопластиновое время; НФГ – нефракционированный гепарин; НМГ – низкомолекулярный гепарин.
Note: APTT – activated partial thromboplastin time; UFH – unfractionated heparin; LMWH – low molecular weight heparin.
Следует еще раз подчеркнуть, что одним из ключевых различий в терапии ВИТТ и ГИТ является возможность применения гепариновых антикоагулянтов. В случае ГИТ основным патогенетическим фактором является образование иммунных комплексов между гепарином и PF4, что делает абсолютно противопоказанным дальнейшее использование как НФГ, так и НМГ. В отличие от этого, при ВИТТ гепарин не является первичным триггером иммунного ответа, а антитела против PF4 чаще обладают гепарин-независимой активностью, аналогичной аутоиммунной ГИТ. Это создает условия применения НМГ при ВИТТ, особенно в случаях, когда альтернативные антикоагулянты недоступны. Однако следует помнить, что у небольшого числа пациентов (около 5 %) возможна перекрестная реакция антител с PF4, что может привести к усиленной активации тромбоцитов.
Заключение / Conclusion
ВИТТ и ГИТ представляют собой редкие, но потенциально жизнеугрожающие состояния, опосредованные иммунной реакцией против фактора 4 тромбоцитов. Несмотря на различие этиологических факторов – применение гепарина в случае ГИТ и введение аденовирусных векторных вакцин в случае ВИТТ – оба состояния объединены схожими патогенетическими механизмами, включающими образование патологических иммунных комплексов, активацию тромбоцитов и развитие тромботических осложнений.
ГИТ, будучи давно изученным состоянием, имеет четко определенные диагностические критерии, включая клиническую шкалу 4T и серологические тесты на антитела к PF4/гепарин-комплексам. В свою очередь, ВИТТ, впервые описанная в 2021 г., характеризуется атипичной локализацией тромбозов и высокой летальностью, что обусловливает необходимость разработки стандартизированных диагностических протоколов и алгоритмов терапии.
Патогенетические исследования показывают, что ключевым отличием ВИТТ от ГИТ является отсутствие гепарина в процессе формирования иммунных комплексов, что сближает его с аутоиммунной формой ГИТ. Это подтверждается наличием антител, активирующих тромбоциты независимо от гепарина, что делает ВИТТ более сложной для прогнозирования патологией.
Современные терапевтические подходы к контролю ВИТТ и ГИТ включают использование негепариновых антикоагулянтов, таких как прямые ингибиторы тромбина (дабигатран) и ингибиторы фактора Xa (ривароксабан, апиксабан), а также внутривенное введение иммуноглобулинов при ВИТТ. Продолжение изучения патофизиологии ВИТТ и ГИТ, а также внедрение новых биомаркеров для ранней диагностики является актуальной задачей современной гематологии и тромбоз-ассоциированных исследований. Принципиальное различие в подходах к антикоагулянтной терапии при данных нозологиях обусловлено механизмами антителозависимой тромбоцитарной активации: при ГИТ гепарин является непосредственным индуктором патологического процесса, требующим его немедленной отмены и исключения из терапии; при ВИТТ его патогенетическая роль отсутствует, что допускает возможность применения НМГ. Дальнейшие исследования необходимы для точного определения факторов риска гиперкоагуляции у пациентов с ВИТТ и оптимизации персонализированного подхода к их терапии.
Таким образом, ВИТТ и ГИТ являются важными клиническими проблемами, требующими междисциплинарного подхода и постоянного повышения осведомленности врачей. Углубленное изучение этих состояний позволит не только улучшить исходы для пациентов, но и разработать новые методы профилактики и лечения иммуноопосредованных тромботических осложнений.
Список литературы
1. Weismann R.E., Tobin R.W. Arterial embolism occurring during systemic heparin therapy. AMA Arch Surg. 1958;76(2):219–25. https://doi.org/10.1001/archsurg.1958.01280200041005.
2. May J., Cuker A. Practical guide to the diagnosis and management of heparin-induced thrombocytopenia. Hematology Am Soc Hematol Educ Program. 2024;2024(1):388–95. https://doi.org/10.1182/hematology.2024000566.
3. Dhakal B., Kreuziger L.B., Rein L. et al. Disease burden, complication rates, and health-care costs of heparin-induced thrombocytopenia in the USA: a population-based study. Lancet Haematol. 2018;5(5):e220–e231. https://doi.org/10.1016/S2352-3026(18)30046-2.
4. Greinacher A., Farner B., Kroll H. et al. Clinical features of heparin-induced thrombocytopenia including risk factors for thrombosis. A retrospective analysis of 408 patients. Thromb Haemost. 2005;94(1):132–5. https://doi.org/10.1160/TH04-12-0825.
5. Warkentin T.E. New approaches to the diagnosis of heparin-induced thrombocytopenia. Chest. 2005;127(2 Suppl):35S–45S. https://doi.org/10.1378/chest.127.2_suppl.35S.
6. Greinacher A., Thiele T., Warkentin T.E. et al. Thrombotic thrombocytopenia after ChAdOx1 nCov-19 vaccination. N Engl J Med. 2021;384(22):2092–101. https://doi.org/10.1056/NEJMoa2104840.
7. Scully M., Singh D., Lown R. et al. Pathologic antibodies to platelet factor 4 after ChAdOx1 nCoV-19 vaccination. N Engl J Med. 2021;384(23):2202–11. https://doi.org/10.1056/NEJMoa2105385.
8. Schultz N.H., Sørvoll I.H., Michelsen A.E. et al. Thrombosis and thrombocytopenia after ChAdOx1 nCoV-19 vaccination. N Engl J Med. 2021;384(22):2124–30. https://doi.org/10.1056/NEJMoa2104882.
9. Bhuyan P., Medin J., da Silva H.G. et al. Very rare thrombosis with thrombocytopenia after second AZD1222 dose: a global safety database analysis. Lancet. 2021;398(10300):577–8. https://doi.org/10.1016/S0140-6736(21)01693-7.
10. See I., Su J.R., Lale A. et al. US case reports of cerebral venous sinus thrombosis with thrombocytopenia after Ad26.COV2.S vaccination, March 2 to April 21, 2021. JAMA. 2021;325(24):2448–56. https://doi.org/10.1001/jama.2021.7517.
11. Herrera-Comoglio R., Lane S. Vaccine-induced immune thrombocytopenia and thrombosis after the Sputnik V vaccine. N Engl J Med. 2022;387(15):1431–2. https://doi.org/10.1056/NEJMc2210813.
12. Martel N., Lee J., Wells P.S. Risk for heparin-induced thrombocytopenia with unfractionated and low-molecular-weight heparin thromboprophylaxis: a meta-analysis. Blood. 2005;106(8):2710–5. https://doi.org/10.1182/blood-2005-04-1546.
13. Warkentin T.E., Levine M.N., Hirsh J. et al. Heparin-induced thrombocytopenia in patients treated with low-molecular-weight heparin or unfractionated heparin. N Engl J Med. 1995;332(20):1330–5. https://doi.org/10.1056/NEJM199505183322003.
14. Othman M., Baker A.T., Gupalo E. et al. To clot or not to clot? Ad is the question – insights on mechanisms related to vaccine-induced thrombotic thrombocytopenia. J Thromb Haemost. 2021;19(11):2845–56. https://doi.org/10.1111/jth.15485.
15. Pavord S., Scully M., Hunt B.J. et al. Clinical features of vaccine-induced immune thrombocytopenia and thrombosis. N Engl J Med. 2021;385(18):1680–9. https://doi.org/10.1056/NEJMoa2109908.
16. Krzywicka K., van de Munckhof A., Zimmermann J. et al. Cerebral venous thrombosis due to vaccine-induced immune thrombotic thrombocytopenia after a second ChAdOx1 nCoV-19 dose. Blood. 2022;139(17):2720–4. https://doi.org/10.1182/blood.2021015329.
17. Favaloro E.J. Laboratory testing for suspected COVID-19 vaccine-induced (immune) thrombotic thrombocytopenia. Int J Lab Hematol. 2021;43(4):559–70. https://doi.org/10.1111/ijlh.13629.
18. Greinacher A., Langer F., Makris M. et al. Vaccine-induced immune thrombotic thrombocytopenia (VITT): Update on diagnosis and management considering different resources. J Thromb Haemost. 2022;20(1):149–56. https://doi.org/10.1111/jth.15572.
19. Kim A.Y., Woo W., Yon D.K. et al. Thrombosis patterns and clinical outcome of COVID-19 vaccine-induced immune thrombotic thrombocytopenia: a systematic review and meta-analysis. Int J Infect Dis. 2022;119:130–9. https://doi.org/10.1016/j.ijid.2022.03.034.
20. Arepally G.M. Heparin-induced thrombocytopenia. Blood. 2017;129(21):2864–72. https://doi.org/10.1182/blood-2016-11-709873.
21. Arepally G.M., Hursting M.J. Platelet factor 4/heparin antibody (IgG/M/A) in healthy subjects: a literature analysis of commercial immunoassay results. J Thromb Thrombolysis. 2008;26(1):55–61. https://doi.org/10.1007/s11239-008-0217-y.
22. Chan B.T., Bobos P., Odutayo A., Pai M. Meta-analysis of risk of vaccineinduced immune thrombotic thrombocytopenia following ChAdOx1-S recombinant vaccine. medRxiv. May 8, 2021. https://doi.org/10.1101/2021.05.04.21256613.
23. Klok F.A., Pai M., Huisman M.V, Makris M. Vaccine-induced immune thrombotic thrombocytopenia. Lancet Haematol. 2022;9(1):e73–e80. https://doi.org/10.1016/S2352-3026(21)00306-9.
24. Mingot-Castellano M.E., Butta N., Canaro M. et al. COVID-19 vaccines and autoimmune hematologic disorders. Vaccines. 2022;10(6):961. https://doi.org/10.3390/vaccines10060961.
25. Oliver S. Updates to the benefit/risk assessment for Janssen COVID-19 vaccines: Applying the Evidence to Recommendation Framework. ACIP Meeting, December 16, 2021. Available at: https://www.cdc.gov/vaccinesacip/meetings/downloads/slides-2021-12-16/04_covid_oliver_2021-12-16.pdf. [Accessed: 10.01.2025].
26. Greinacher A., Schönborn L., Siegerist F. et al. Pathogenesis of vaccineinduced immune thrombotic thrombocytopenia (VITT). Semin Hematol. 2022;59(2):97–107. https://doi.org/10.1053/j.seminhematol.2022.02.004.
27. Warkentin T.E. How I diagnose and manage HIT. Hematology Am Soc Hematol Educ Program. 2011;2011(1):143–9. https://doi.org/10.1182/asheducation-2011.1.143.
28. Marchetti M., Zermatten M.G., Calderara D.B. et al. Heparin-induced thrombocytopenia: a review of new concepts in pathogenesis, diagnosis, and management. J Clin Med. 2021;10(4):683. https://doi.org/10.3390/jcm10040683.
29. Greinacher A., Holtfreter B., Krauel K. et al. Association of natural antiplatelet factor 4/heparin antibodies with periodontal disease. Blood. 2011;118(5):1395–401. https://doi.org/10.1182/blood-2011-03-342857.
30. Hursting M.J., Pai P.J., McCracken J.E. et al. Platelet factor 4/heparin antibodies in blood bank donors. Am J Clin Pathol. 2010;134(5):774–80. https://doi.org/10.1309/AJCPG0MNR5NGKNFX.
31. Brandt S., Krauel K., Gottschalk K.E. et al. Characterisation of the conformational changes in platelet factor 4 induced by polyanions: towards in vitro prediction of antigenicity. Thromb Haemost. 2014;112(7):53–64. https://doi.org/10.1160/TH13-08-0634.
32. Napolitano A., Spiezia L., Biolo M. et al. Anti-platelet factor 4 antibodymediated disorders: an updated narrative review. Semin Thromb Hemost. 2025, Jan 30. https://doi.org/10.1055/a-2528-5425. Online ahead of print.
33. Warkentin T.E. Platelet-activating anti-PF4 disorders: an overview. Semin Hematol. 2022;59(2):59–71. https://doi.org/10.1053/j.seminhematol.2022.02.005.
34. Favaloro E.J., Pasalic L., Henry B., Lippi G. Laboratory testing for platelet factor 4 antibodies: differential utility for diagnosis/exclusion of heparin induced thrombocytopenia versus suspected vaccine induced thrombotic thrombocytopenia. Pathology. 2022;54(3):254–61. https://doi.org/10.1016/j.pathol.2021.10.008.
35. Warkentin T.E., Greinacher A. Laboratory testing for heparin-induced thrombocytopenia and vaccine-induced immune thrombotic thrombocytopenia antibodies: a narrative review. Semin Thromb Hemost. 2022;49(6):621–33. https://doi.org/10.1055/s-0042-1758818.
36. Samuelson Bannow B., Warad D.M., Jones C.G. et al. A prospective, blinded study of a PF4-dependent assay for HIT diagnosis. Blood. 2021;137(8):1082–9. https://doi.org/10.1182/blood.2020008195.
37. Husseinzadeh H.D., Gimotty P.A., Pishko A.M. et al. Diagnostic accuracy of IgG-specific versus polyspecific enzyme-linked immunoassays in heparininduced thrombocytopenia: a systematic review and meta-analysis. J Thromb Haemost. 2017;15(6):1203–12. https://doi.org/10.1111/jth.13692.
38. Handtke S., Wolff M., Zaninetti C. et al. A flow cytometric assay to detect platelet activating antibodies in VITT after ChAdOx1 nCov-19 vaccination. Blood. 2021;137(26):3656–9. https://doi.org/10.1182/blood.2021012064.
39. Huynh A., Kelton J.G., Arnold D.M. et al. Antibody epitopes in vaccineinduced immune thrombotic thrombocytopaenia. Nature. 2021;596(7873):565–9. https://doi.org/10.1038/s41586-021-03744-4.
40. Brown J.A., Aranda-Michel E., Kilic A. et al. Outcomes with heparininduced thrombocytopenia after cardiac surgery. Ann Thorac Surg. 2021;112(2):487–93. https://doi.org/10.1016/j.athoracsur.2020.10.046.
41. Warkentin T.E. Autoimmune heparin-induced thrombocytopenia. J Clin Med. 2023;12(21):6921. https://doi.org/10.3390/jcm12216921.
42. Greinacher A., Selleng K., Warkentin T.E. Autoimmune heparin-induced thrombocytopenia. J Thromb Haemost. 2017;15(11):2099–114. https://doi.org/10.1111/jth.13813.
43. Manji F., Warkentin T.E, Sheppard J.-A.I., Lee A. Fondaparinux crossreactivity in heparininduced thrombocytopenia successfully treated with high-dose intravenous immunoglobulin and rivaroxaban. Platelets. 2020;31(1):124–7. https://doi.org/10.1080/09537104.2019.1652263.
44. Warkentin T.E., Greinacher A. Spontaneous HIT syndrome: knee replacement, infection, and parallels with vaccine-induced immune thrombotic thrombocytopenia. Thromb Res. 2021;204:40–51. https://doi.org/10.1016/j.thromres.2021.05.018.
45. Warkentin T.E., Makris M., Jay R.M., Kelton J.G. A spontaneous prothrombotic disorder resembling heparin-induced thrombocytopenia. Am J Med. 208;121(7):632–6. https://doi.org/10.1016/j.amjmed.2008.03.012.
46. Krauel K., Pötschke C., Weber C. et al. Platelet factor 4 binds to bacteria, inducing antibodies cross-reacting with the major antigen in heparininduced thrombocytopenia. Blood. 2011;117(4):1370–8. https://doi.org/10.1182/blood-2010-08-301424.
47. Pai M. Epidemiology of VITT. Semin Hematol. 2022;59(2):72–5. https://doi.org/10.1053/j.seminhematol.2022.02.002.
48. Craven B., Lester W., Boyce S. et al. Natural history of PF4 antibodies in vaccine-induced immune thrombocytopenia and thrombosis. Blood. 2022;139(16):2553–60. https://doi.org/10.1182/blood.2021014684.
49. McGonagle D., De Marco G., Bridgewood C. Mechanisms of immunothrombosis in vaccine-induced thrombotic thrombocytopenia (VITT) compared to natural SARS-CoV-2 infection. J Autoimmun. 2021;121:102662. https://doi.org/10.1016/j.jaut.2021.102662.
50. Selvadurai M.V., Favaloro E.J., Chen V.M. Mechanisms of thrombosis in heparin-induced thrombocytopenia and vaccine-induced immune thrombotic thrombocytopenia. Semin Thromb Hemost. 2023;49(5):444–52. https://doi.org/10.1055/s-0043-1761269.
51. Greinacher A., Selleng K., Mayerle J. et al.; Immune-Response in COVID19 Vaccination Study Group. Anti-platelet factor 4 antibodies causing VITT do not cross-react with SARS-CoV-2 spike protein. Blood. 2021;138(14):1269–77. https://doi.org/10.1182/blood.2021012938.
52. Nand S., Wong W., Yuen B. et al. Heparin-induced thrombocytopenia with thrombosis: incidence, analysis of risk factors, and clinical outcomes in 108 consecutive patients treated at a single institution. Am J Hematol. 1997;56(1):12–6. https://doi.org/10.1002/(sici)1096-8652(199709)56:13.0.co;2-5.
53. Cuker A., Gimotty P.A., Crowther M.A., Warkentin T.E. Predictive value of the 4Ts scoring system for heparin-induced thrombocytopenia: a systematic review and meta-analysis. Blood. 2012;120(20):4160–7. https://doi.org/10.1182/blood-2012-07-443051.
54. May J., Westbrook B., Cuker A. Heparin-induced thrombocytopenia: an illustrated review. Res Pract Thromb Haemost. 2023;7(5):100283. https://doi.org/10.1016/j.rpth.2023.100283.
55. Rogers P., Walker I., Yeung J. et al; RADIANT Group. Thrombus distribution in vaccine-induced immune thrombotic thrombocytopenia after ChAdOx1 nCov-19 vaccination. Radiology. 2022; 305(3):590–6. https://doi.org/10.1148/radiol.220365.
56. Schönborn L., Pavord S., Chen V.M.Y. et al. Thrombosis with thrombocytopenia syndrome (TTS) and vaccine-induced immune thrombocytopenia and thrombosis (VITT): Brighton Collaboration case definitions and guidelines for data collection, analysis, and presentation of immunisation safety data. Vaccine. 2024;42(7):1799–811. https://doi.org/10.1016/j.vaccine.2024.01.045.
57. Cuker A., Arepally G.M., Chong B.H. et al. American Society of Hematology 2018 guidelines for management of venous thromboembolism: heparin-induced thrombocytopenia. Blood Adv. 2018;2(22):3360–92. https://doi.org/10.1182/bloodadvances.2018024489.
58. Gruel Y., De Maistre E., Pouplard C. et al. Diagnosis and management of heparin-induced thrombocytopenia. Anaesth Crit Care Pain Med. 2020;39(2):291–310. https://doi.org/10.1016/j.accpm.2020.03.012.
59. Pavord S., Hunt B.J., Horner D. et al. Vaccine induced immune thrombocytopenia and thrombosis: summary of NICE guidance. BMJ. 2021;375:n2195. https://doi.org/10.1136/bmj.n2195.
60. Müller L., Dabbiru V.A.S., Schönborn L., Greinacher A. Therapeutic strategies in FcγIIA receptor-dependent thrombosis and thromboinflammation as seen in heparin-induced thrombocytopenia (HIT) and vaccine-induced immune thrombocytopenia and thrombosis (VITT). Expert Opin Pharmacother. 2024;25(3):281–94. https://doi.org/10.1080/14656566.2024.2328241.
61. Farner B., Eichler P., Kroll H. et al. A comparison of danaparoid and lepirudin in heparin-induced thrombocytopenia. Thromb Haemost. 2001;85(6):950–7. https://doi.org/10.1055/s-0037-1615946.
62. Fathi M. Heparin-induced thrombocytopenia (HIT): identification and treatment pathways. Glob Cardiol Sci Pract. 2018;2018(2):15. https://doi.org/10.21542/gcsp.2018.15.
63. Nilius H., Kaufmann J., Cuker A. et al. Comparative effectiveness and safety of anticoagulants for the treatment of heparin-induced thrombocytopenia. Am J Hematol. 2021;96(7):805–15. https://doi.org/10.1002/ajh.26194.
64. Warkentin T.E., Kelton J.G. A 14-year study of heparin-induced thrombocytopenia. Am J Med. 1996;101(5):502–7. https://doi.org/10.1016/S0002-9343(96)00258-6.
65. Schulman S., Arnold D.M., Bradbury C.A. et al. 2023 ISTH update of the 2022 ISTH guidelines for antithrombotic treatment in COVID-19. J Thromb Haemost. 2024;22(6);1779–97. https://doi.org/10.1016/j.jtha.2024.02.011.
66. Warkentin T.E., Pai M., Linkins L.-A. Direct oral anticoagulants for treatment of HIT: update of Hamilton experience and literature review. Blood. 2017;130(9):1104–13. https://doi.org/10.1182/blood-201704-778993.
67. Salih F., Schönborn L., Kohler S. et al. Vaccine-induced thrombocytopenia with severe headache. N Engl J Med. 2021;385(22):2103–5. https://doi.org/10.1056/NEJMc2112974.
68. Kreimann M., Brandt S., Krauel K. et al. Binding of anti-platelet factor 4/ heparin antibodies depends on the thermodynamics of conformational changes in platelet factor 4. Blood. 2014;124(15):2442–9. https://doi.org/10.1182/blood-2014-03-559518.
69. Nguyen T.-H., Greinacher A., Delcea M. Quantitative description of thermodynamic and kinetic properties of the platelet factor 4/heparin bonds. Nanoscale. 2015;7(22):10130–9. https://doi.org/10.1039/C5NR02132D.
70. Savi P., Chong B.H., Greinacher A. et al. Effect of fondaparinux on platelet activation in the presence of heparin-dependent antibodies: a blinded comparative multicenter study with unfractionated heparin. Blood. 2005;105(1):139–44. https://doi.org/10.1182/blood-2004-052010.
71. Linkins L.-.A, Hu G., Warkentin T.E. Systematic review of fondaparinux for heparin-induced thrombocytopenia: when there are no randomized controlled trials. Res Pract Thromb Haemost. 2018;2(4):678–83. https://doi.org/10.1002/rth2.12145.
72. Guidance for clinical case management of thrombosis with thrombocytopenia syndrome (TTS) following vaccination to prevent coronavirus disease (COVID-19). Geneva: World Health Organization, 2023. Available at: https://www.who.int/publications/i/item/9789240061989. [Accessed: 10.01.2025].
Об авторах
А. Д. МакацарияРоссия
Макацария Александр Давидович, д.м.н., проф., академик РАН
Scopus Author ID: 57222220144
WoS ResearcherID: M-5660-2016
119991 Москва, ул. Трубецкая, д. 8, стр. 2
С. В. Акиньшина
Россия
Светлана Владимировна Акиньшина, к.м.н
Scopus Author ID: 15072687000
119991 Москва, ул. Трубецкая, д. 8, стр. 2
А. В. Воробьев
Россия
Воробьев Александр Викторович, к.м.н.
Scopus Author ID: 57191966265
Wos ResearcherID: F-8804-2017
119991 Москва, ул. Трубецкая, д. 8, стр. 2
В. О. Бицадзе
Россия
Бицадзе Виктория Омаровна, д.м.н., проф., профессор РАН
Scopus Author ID: 6506003478
WoS ResearcherID: F-8409-2017
119991 Москва, ул. Трубецкая, д. 8, стр. 2
Д. Х. Хизроева
Россия
Хизроева Джамиля Хизриевна, д.м.н., проф.
Scopus Author ID: 57194547147
WoS ResearcherID: F-8384-2017
119991 Москва, ул. Трубецкая, д. 8, стр. 2
М. В. Третьякова
Россия
Третьякова Мария Владимировна, к.м.н.
119991 Москва, ул. Трубецкая, д. 8, стр. 2
Н. А. Макацария
Россия
Макацария Наталия Александровна, к.м.н.
WoS ResearcherID: F-8406-2017
119991 Москва, ул. Трубецкая, д. 8, стр. 2
И. С. Калашникова
Россия
Калашникова Ирина Сергеевна, к.м.н.
119991 Москва, ул. Трубецкая, д. 8, стр. 2
Н. Р. Гашимова
Россия
Гашимова Нилуфар Рамиль кызы, к.м.н.
119991 Москва, ул. Трубецкая, д. 8, стр. 2
К. Н. Григорьева
Россия
Григорьева Кристина Николаевна, к.м.н.
119991 Москва, ул. Трубецкая, д. 8, стр. 2
И. А. Степанов
Россия
Степанов Иван Алексеевич
119991 Москва, ул. Трубецкая, д. 8, стр. 2
И. М. Дикарева
Россия
Дикарева Ирина Максимовна
119991 Москва, ул. Трубецкая, д. 8, стр. 2
А. Ю. Татаринцева
Россия
Татаринцева Алёна Юрьевна
119991 Москва, ул. Трубецкая, д. 8, стр. 2
А. В. Лазарчук
Россия
119991 Москва, ул. Трубецкая, д. 8, стр. 2
А. Р. Хисамиева
Россия
Хисамиева Азалия Рустемовна
119991 Москва, ул. Трубецкая, д. 8, стр. 2
Д. В. Блинов
Россия
Блинов Дмитрий Владиславович, к.м.н.
Scopus Author ID: 6701744871
WoS ResearcherID: E-8906-2017
101000 Москва, Лялин переулок, д. 11–13/1;123056 Москва, 2-я Брестская ул., д. 5, с. 1–1а; 141551 Московская область, деревня Голубое, Родниковая ул., стр. 6, к. 1
П. Ван Дреден
Франция
Ван Дреден Патрик, д.м.н., проф.
Scopus Author ID: 55915955300
Париж, INSERM UМR_S_938
Ж.-К. Гри
Россия
Гри Жан-Кристоф, д.м.н., проф.
Scopus Author ID: 7005114260
WoS ResearcherID: AAA-2923-2019
119991 Москва, ул. Трубецкая, д. 8, стр. 2; 34090 Монпелье, ул. Огюста Бруссоне, д. 163
И. Элалами
Россия
Элалами Исмаил, д.м.н., проф.
Scopus Author ID: 7003652413
WoS ResearcherID: AAC-9695-2019
119991 Москва, ул. Трубецкая, д. 8, стр. 2; 75006 Париж, Улица медицинского факультета, д. 12;75020 Париж, Китайская улица, д. 4
Г. Геротзиафас
Россия
Геротзиафас Григориос, д.м.н., проф.
119991 Москва, ул. Трубецкая, д. 8, стр. 2; 75006 Париж, Улица медицинского факультета, д. 12;75020 Париж, Китайская улица, д. 4
Что уже известно об этой теме?
► Вакцин-индуцированная тромботическая тромбоцитопения (ВИТТ) – редкая, но тяжелая иммунологическая реакция, связанная с вакцинами от COVID-19 на основе аденовирусных векторов.
► ВИТТ – потенциально жизнеугрожающее осложнение, которое характеризуется развитием тромбозов, преимущественно атипичных локализаций, таких как церебральные венозные синусы и мезентериальные сосуды, в сочетании с выраженной тромбоцитопенией.
► Гепарин-индуцированная тромбоцитопения (ГИТ) и ВИТТ имеют общий патофизиологический механизм, включающий выработку антител против тромбоцитарного фактора 4 (PF4) с последующим развитием тромботических осложнений.
Что нового дает статья?
► Описан патогенез тромбоцитарных нарушений, связанных с PF4, включая различные формы ГИТ (классическую, аутоиммунную и спонтанную), а также молекулярные механизмы ВИТТ, включая спонтанные, не связанные с вакциной случаи.
► Новые данные свидетельствуют о том, что ВИТТ может развиваться не только вследствие вакцинации против SARS-CoV-2.
► Изложен диагностический алгоритм для быстрого выявления тромбоцитарных нарушений, связанных с PF4; описаны ключевые различия в патогенезе и стратегиях лечения ВИТТ и ГИТ.
Как это может повлиять на клиническую практику в обозримом будущем?
► Понимание эпидемиологии и механизмов ВИТТ имеет важное значение для планирования будущих исследований и для обеспечения безопасности вакцин.
► Оптимизация терапевтических стратегий, включая применение новых антикоагулянтов и иммуносупрессивных методов, является приоритетной задачей для снижения смертности и улучшения исходов у пациентов с ВИТТ и ГИТ.
Рецензия
Для цитирования:
Макацария А.Д., Акиньшина С.В., Воробьев А.В., Бицадзе В.О., Хизроева Д.Х., Третьякова М.В., Макацария Н.А., Калашникова И.С., Гашимова Н.Р., Григорьева К.Н., Степанов И.А., Дикарева И.М., Татаринцева А.Ю., Лазарчук А.В., Хисамиева А.Р., Блинов Д.В., Ван Дреден П., Гри Ж., Элалами И., Геротзиафас Г. Иммунные парадоксы вакцининдуцированной тромботической тромбоцитопении (ВИТТ), гепарин-индуцированной тромбоцитопении (ГИТ) и тромбозов: от общих механизмов к уникальному течению ВИТТ и ГИТ. Акушерство, Гинекология и Репродукция. 2025;19(1):97-109. https://doi.org/10.17749/2313-7347/ob.gyn.rep.2025.610
For citation:
Makatsariya A.D., Akinshina S.V., Vorobev A.V., Bitsadze V.O., Khizroeva J.Kh., Tretyakova M.V., Makatsariya N.A., Kalashnikova I.S., Gashimova N.R., Grigoreva K.N., Stepanov I.A., Dikareva I.M., Tatarintseva A.Yu., Lazarchuk A.V., Khisamieva A.R., Blinov D.V., Van Dreden P., Gris J., Elalamy I., Gerotziafas G. Immune paradoxes of vaccine-induced thrombotic thrombocytopenia (VITТ), heparin-induced thrombocytopenia (HIT) and thrombosis: from general mechanisms to the unique VITТ and HIT course. Obstetrics, Gynecology and Reproduction. 2025;19(1):97-109. (In Russ.) https://doi.org/10.17749/2313-7347/ob.gyn.rep.2025.610

Контент доступен под лицензией Creative Commons Attribution-NonCommercial-ShareAlike 4.0 International License.











































