Перейти к:
Роль нарушений стероидогенеза в формировании врожденной клиторомегалии
https://doi.org/10.17749/2313-7347/ob.gyn.rep.2024.494
Аннотация
Клиторомегалия является актуальной проблемой гинекологической эндокринологии и характеризуется увеличением размеров клитора более нормальных значений, характерных для здоровых женщин. Клиторомегалия возникает как идиопатическое состояние или формируется на фоне нарушений синтеза половых стероидов, сопровождающихся избытком андрогенов. Однако идиопатическая клиторомегалия является достаточно частым диагнозом, так как объективная причина этого симптома зачастую остается невыявленной. Изучение альтернативного пути синтеза андрогенов и 11-оксистероидов у женщин с клиторомегалией представляет большой интерес для практикующих эндокринологов и гинекологов ввиду новых возможностей диагностики и профилактики этого состояния. Данный литературный обзор посвящен современным представлениям о нарушениях стероидогенеза андрогенов у женщин и его роли в патогенезе клиторомегалии.
Ключевые слова
Для цитирования:
Иванов Н.В., Серебрякова И.П., Радугина Л.И., Радугин Ф.М., Юсупова Ш.К. Роль нарушений стероидогенеза в формировании врожденной клиторомегалии. Акушерство, Гинекология и Репродукция. 2024;18(5):679–692. https://doi.org/10.17749/2313-7347/ob.gyn.rep.2024.494
For citation:
Ivanov N.V., Serebryakova I.P., Radugina L.I., Radugin F.M., Yusupova Sh.K. The role of steroidogenesis disorders in developing congenital clitoromegaly. Obstetrics, Gynecology and Reproduction. 2024;18(5):679–692. (In Russ.) https://doi.org/10.17749/2313-7347/ob.gyn.rep.2024.494
Введение / Introduction
Клиторомегалия (или макроклитор) – аномальное увеличение клитора – является важнейшим проявлением целого ряда эндокринологических заболеваний, чаще всего характеризующихся повышенной продукцией андрогенов у женщин. Данному состоянию, его диагностике и лечению мы уделили достаточно много внимания в нашей предыдущей статье [1] и монографии «Принцип Лилит. К вопросу формирования пола у человека» [2]. В большинстве случаев клиторомегалия рассматривается как проявление нарушений формирования пола. Однако макроклитор может не сопровождаться другими признаками вирилизации, быть единственным симптомом, и установить четкие причины не всегда представляется возможным.
Клиторомегалия и «Принцип Лилит» / Clitoromegaly and «Lilith principle»
Важно отметить, что эмбрион человека на ранних стадиях своего развития является бипотенциальным и бисексуальным (рис. 1). Отличие между мужским и женским плодом возможно только на уровне кариотипа. Условно принято считать кариотип эмбриона 46,ХХ – женским, а 46,XY – мужским. Строение наружных и внутренних органов не отличается друг от друга до 8–9-й недели внутриутробного развития («Принцип Лилит»). В дальнейшем при формировании стероидпродуцирующих специализированных органов (надпочечников и половых желез) под воздействием андрогенов происходит вирилизация наружных гениталий плода. Для мальчиков (кариотип 46,ХY) – это нормальное явление эмбриогенеза, что сопровождается формированием пениса с уретрой на его головке, мошонки и опускания яичек в мошонку, увеличением аногенитального расстояния («Принцип Адама»). Формирование женских гениталий происходит под минимальным гормональным воздействием, можно сказать пассивно. В процессе эмбриогенеза эстрогены фактически не влияют на строение наружных половых органов. Однако минимальное действие андрогенов мы обнаруживаем в ходе непатологического течения эмбриогенеза, что сопровождается у эмбриона с кариотипом 46,ХХ нормальным увеличением размеров клитора и аногенитального расстояния. Несмотря на это минимальное воздействие андрогенов, образуются половые губы (не происходит их срастания) и развивается влагалище, точнее, его наружная треть, формирование которого зависит не от уровня антимюллерова гормона, а от концентрации андрогенов в крови («Принцип Евы») [2].

Рисунок 1. Варианты формирования соматического (гормонального) пола человека [2].
Figure 1. Scenarios for somatic (hormonal) sex development in human [2].
В рамках патологических состояний у эмбриона с кариотипом 46,ХХ (например, врожденной дисфункции коры надпочечников, ВДКН) или некоторых заболеваний беременной (например, лютеома беременных), сопровождающихся избытком андрогенов, может происходить патологическая вирилизация наружных гениталий, что приводит в легких случаях к клиторомегалии, а в тяжелых – к полной маскулинизации наружных половых органов с формированием пениса с уретрой и мошонкой (но без гонад внутри). Таким образом, клиторомегалия как проявление избыточной внутриутробной вирилизации может быть одним из семиотических явлений амбивалентных гениталий, расцениваемых как нарушения формирования пола (рис. 2). Такие отклонения довольно легко идентифицируются не только у новорожденных, но даже и у плода с помощью высококачественного ультразвукового исследования беременной. С другой стороны, пограничные состояния (в виде изолированной клиторомегалии) могут оставаться незамеченными, и причина развития такой вирилизации наружных гениталий остается «за кадром».
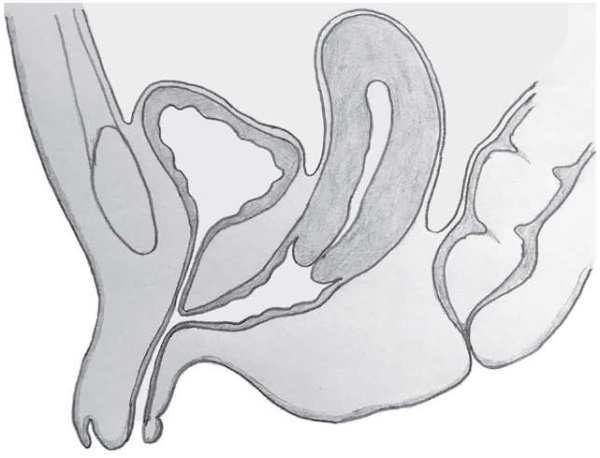
Рисунок 2. Вирилизация плода 46,XX с врожденной дисфункцией коры надпочечников [модифицировано по 3]. (Рисунок анатома А.А. Смирнова, издается с любезного разрешения автора).
Figure 2. Virilization of 46,XX fetus with congenital adrenal hyperplasia [modified from 3]. (Figure drawn by anatomist A.A. Smirnov, published with author’s kind permission).
Важно отметить, что независимо от наличия других признаков вирилизации, клиторомегалию следует интерпретировать как симптом эндокринного заболевания, что требует консультации врача-эндокринолога, тем более, что научные открытия позволяют понять механизм этого явления.
В патогенезе вирилизации наружных гениталий плода могут участвовать стероидпродуцирующие клетки и ферментативные системы целого ряда систем органов. По современным представлениям, такая функция принадлежит:
- надпочечникам плода (zona reticularis),
- надпочечникам матери (zona reticularis),
- половым железам плода,
- половым железам матери,
- плаценте (стероидпродуцирующим клеткам трофобласта),
- внегонадным источникам, продуцирующим предшественников активных стероидов (печень плода).
С учетом достижений науки формируется понимание, что строение наружных гениталий плода (а соответственно, и предписываемый после рождения «гражданский пол») зависит от гармоничного взаимодействия всех вышеперечисленных органов, обладающих гормональной активностью.
Врожденная клиторомегалия как состояние, связанное с внутриутробной вирилизацией и избыточным действием андрогенов, требует от врача-специалиста, не только понимания механизмов формирования данного отклонения, но и возможностей своевременной диагностики и профилактики этого состояния, что напрямую связано между собой.
Роль классического (канонического) пути стероидогенеза в патогенезе клиторомегалии / A role of the classical (canonic) steroidogenesis pathway in clitoromegaly pathogenesis
В современной эндокринологии понимание формирования врожденной клиторомегалии и вирилизации наружных гениталий у эмбриона с кариотипом 46,ХХ невозможно без новейших знаний о стероидогенезе в организме человека. В настоящее время мы можем выделить несколько источников синтеза половых гормонов (или их предшественников), участвующих в формировании наружных половых органов. Помимо половых желез, обладающих стероидпродуцирующей активностью, большая роль принадлежит целому каскаду ферментов zona reticularis коры надпочечников (рис. 3). Причем сейчас мы понимаем, что надпочечники оказывают наибольшее воздействие на формирование наружных гениталий, а не только половые железы, как предполагалось еще 10 лет назад.
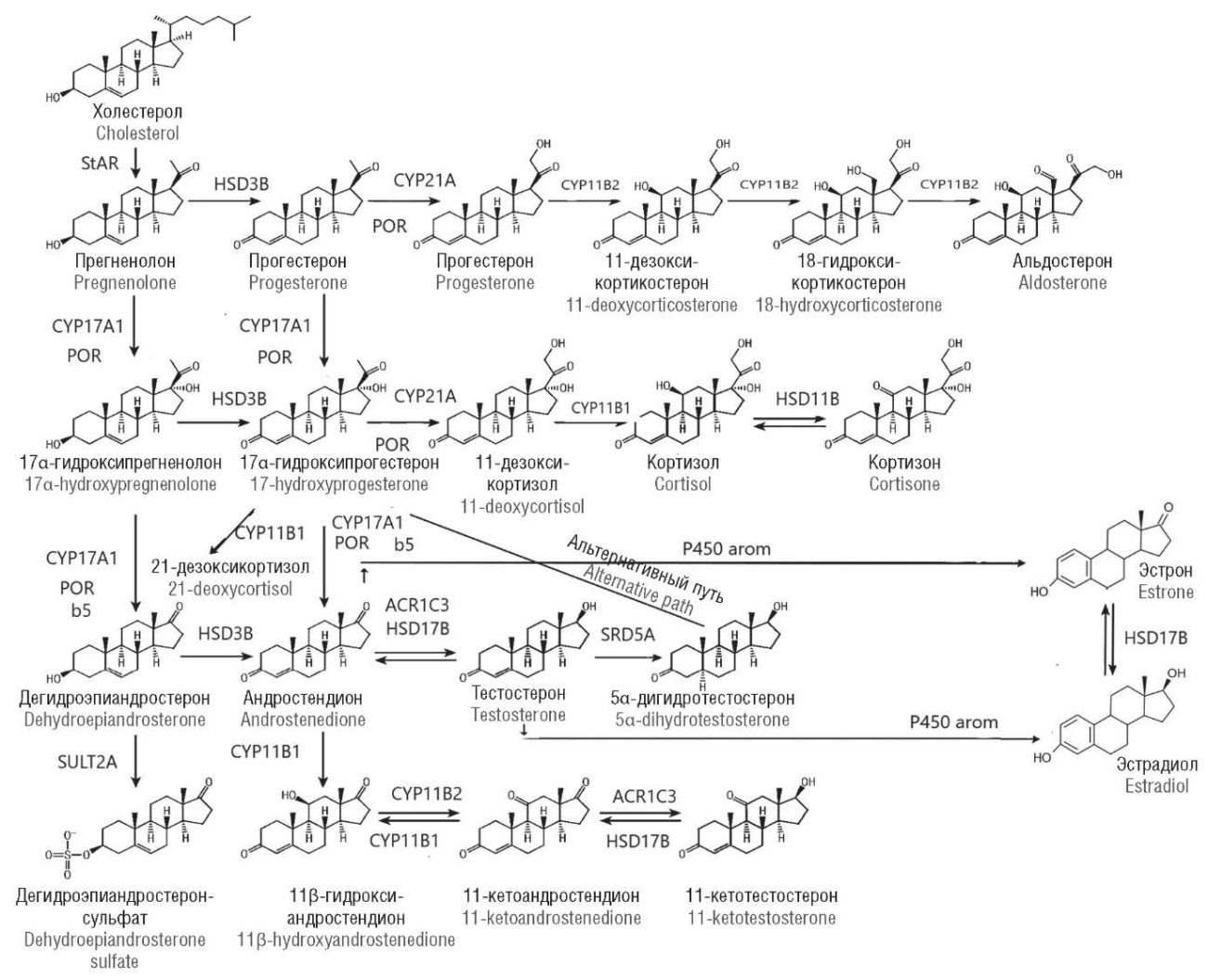
Рисунок 3. Стероидогенез в организме человека, представлены основные стероидные гормоны и ферменты, участвующие в их синтезе и метаболизме [модифицировано по 8–10].
Примечание: ACR1C – альдокеторедуктаза 1С типа; ACR1C3 – альдокеторедуктаза 3-го типа; b5 – цитохром b5; CYP11B – 11β-гидроксилаза; CYP11B2 – альдостеронсинтаза; CYP17A – 17α-гидроксилаза; CYP21A – 21-гидроксилаза; HSD17B – 17β-гидроксистероиддегидрогеназа; HSD3B – 3β-гидроксистероиддегидрогеназа; P450 arom – ароматаза; POR – цитохром Р450 оксидоредуктаза; SRD5A – 5α-редуктаза; StaR – стероидогенный острый регуляторный протеин; SULT2A – сульфатаза.
Figure 3. Human steroidogenesis, essential steroid hormones and enzymes involved in their synthesis and metabolism are presented [modified from 8–10].
Note: ACR1C – aldoketoreductase type 1C; ACR1C3 – aldoketoreductase type 3; b5 – cytochrome b5; CYP11B – 11β-hydroxylase; CYP11B2 – aldosterone synthase; CYP17A – 17α-hydroxylase, CYP21A – 21-hydroxylase; HSD17B – 17β-hydroxysteroid dehydrogenase; HSD3B – 3β-hydroxysteroid dehydrogenase; P450 arom – aromatase; POR – cytochrome P450 oxidoreductase; SRD5A – 5a-reductase; StaR – steroidogenic acute regulatory protein; SULT2A – sulfatase.
У людей в синтезе половых стероидов в корковом веществе надпочечников преобладает Δ5-путь. Тем самым надпочечники, в первую очередь, отвечают за продукцию глюкокортикоидов и минералокортикоидов, а также за синтез весьма слабых надпочечниковых андрогенов – дегидроэпиандростерона (ДГЭА) и андростендиола (А5). Однако необходимо отметить, что превращение холестерина в прегненолон в митохондриях представляет собой первый этап стероидогенеза, который протекает одинаково в надпочечниках, яичниках и плаценте. Этот процесс включает 3 химические реакции и катализируется ферментом CYP11A1.
В коре надпочечников – области надпочечникового стероидогенеза – выделяют 3 функциональные зоны: клубочковую, пучковую и сетчатую. Синтез андрогенов (А) происходит в основном в сетчатой зоне. Прегненолон преобразуется в 17-ОН-прегненолон, который, в свою очередь, превращается в ДГЭА. Эти реакции катализируются 17α-гидроксилазой, способной как к 17-гидроксилазной, так и к 17,20-лиазной активности. Деятельность 17α-гидроксилазы решающим образом зависит от кофактора – цитохрома b5, который экспрессируется только в сетчатой зоне. ДГЭА, являющийся предшественником активных А, частично превращается в андростендион (А4) под действием 3β-гидроксистероиддегидрогеназы (3β-ГСДГ). Часть синтезированного ДГЭА превращается в ДГЭА-сульфат (ДГЭА-С); эта реакция катализируется сульфотрансферазой, которая требует наличия 3-фосфоаденозин-5-фосфосульфатсинтазы типа 2 в виде кофактора.
Биосинтез А в надпочечниках происходит менее интенсивно, нежели в яичниках и плаценте. Так, альдокеторедуктаза типа 1С3 (AKR1C3), также называемая 3α-гидроксистероиддегидрогеназа, превращает андростендион в тестостерон (Т) в яичниках и в ряде других вненадпочечниковых тканей [4]. Данный фермент в малых количествах экспрессируется как в яичниках, так и в сетчатой зоне коры надпочечников, что подтверждает наибольший вклад яичников в синтез Т посредством AKR1C3 [5].
Ферменты 17β-гидроксистероиддегидрогеназа (17β-ГСДГ) 1-го и 2-го типов относятся к тому же семейству ферментов и по-своему влияют на синтез половых стероидов. В то время как 17β-ГСДГ 1-го типа необходим для синтеза эстрадиола (Е2) яичниками и эстрогенов плаценты, 17β-ГСДГ 2-го типа отвечает за инактивацию Е2 и его конверсию в эстрон, а также Т в андростендион в яичниках и плаценте [6].
Однако биосинтез А в надпочечниках даже при его избыточной активности у пациентов с ВДКН не приводит к вирилизации, так как ДГЭА и другие андрогены обладают очень слабыми вирильными свойствами. Скорее всего, их гиперпродукция под воздействием адренокортикотропного гормона (АКТГ) стимулирует образование предшественников (прекурсоров) более сильных андрогенов, например, повышенной продукции кетоандрогенов – 11-оксиандрогенов. Также в процессе эмбриогенеза в надпочечниках возможен альтернативный путь синтеза андрогенов, о чем будет сказано ниже.
Роль альтернативного пути синтеза андрогенов в патогенезе врожденной клиторомегалии / A role of the alternative («backdoor») androgen synthesis pathway in pathogenesis of congenital clitoromegaly
Общеизвестно, что маскулинизация наружных половых органов зависит от уровня дигидротестостерона (ДГТ). В настоящее время стало понятно, что существует 2 пути синтеза ДГТ: классический (canonic) и альтернативный (backdoor). Яички плода с кариотипом 46,ХY используют классический путь продукции А. Известно, что андростерон является основным источником для синтеза А в альтернативном пути. Основными ферментами альтернативного пути являются 5α-редуктаза 1-го типа, альдокеторедуктаза типа 1C2, альдокеторедуктаза типа 1C3, 17,20-лиаза (рис. 4).
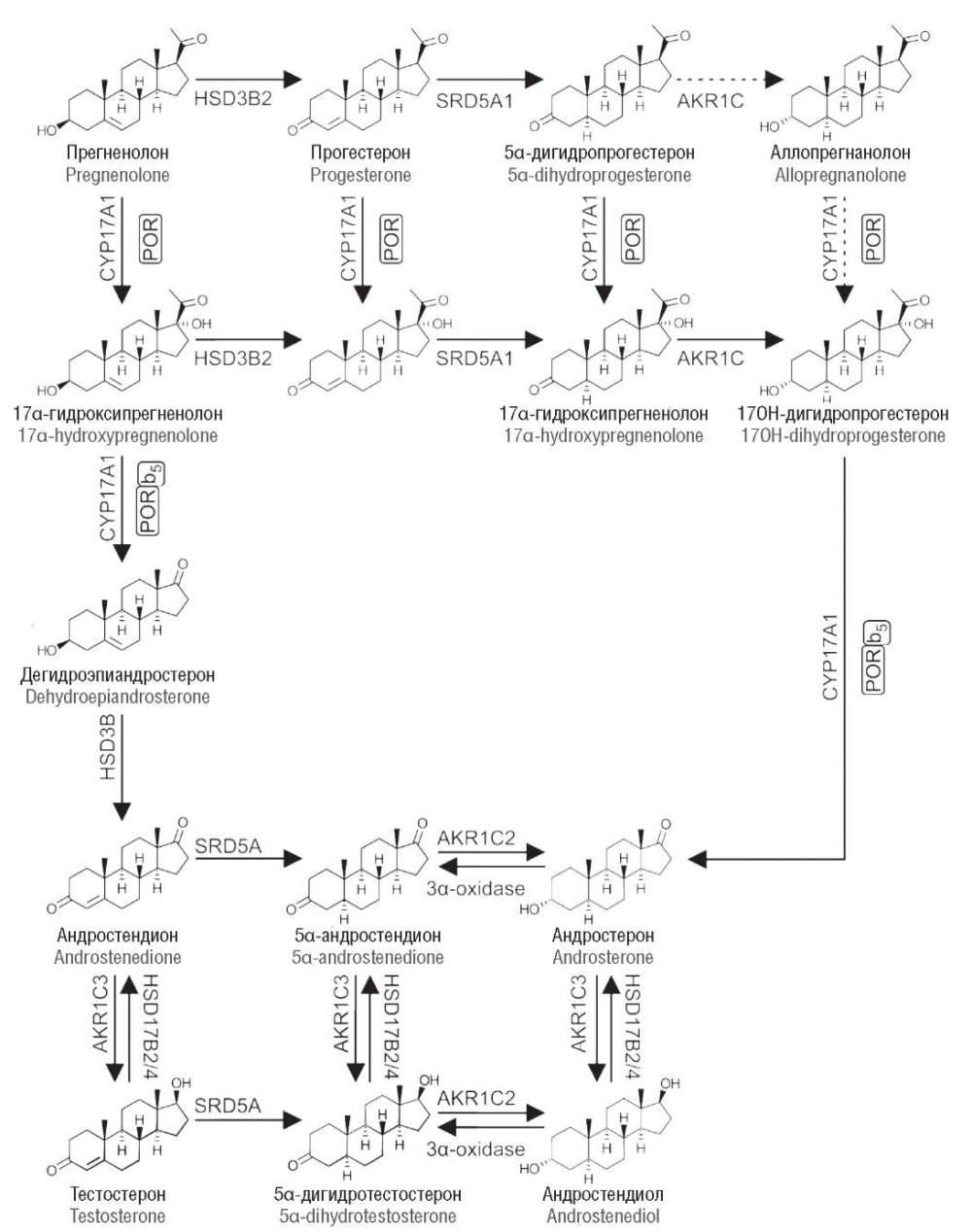
Рисунок 4. Альтернативный путь синтеза андрогенов, представлены классический и альтернативный пути синтеза дигидротестостерона [модифицировано по 8–10].
Примечание: AKR1C – альдокеторедуктаза 1-го семейства; AКR1C2 – альдокеторедуктаза 1С2; AКR1C3 – альдокеторедуктаза 1С3; b5 – цитохром b5; CYP17A – 17α-гидроксилаза; HSD17B – 17β-гидроксистероиддегидрогеназа; HSD3B – 3β-гидроксистероиддегидрогеназа; HSD3B2 – 3β-гидроксистероиддегидрогеназа 2-го типа; POR – цитохром Р450 оксидоредуктаза; SRD5A – 5α-редуктаза; SRD5A1 – 5α-редуктаза 1-го типа.
Figure 4. Alternative «backdoor» androgen synthesis pathway, classical and alternative dihydrotestosterone synthesis pathways are presented [modified from 8–10].
Note: AKR1C – aldoketoreductase family 1; AКR1C2 – aldoketoreductase 1C2; AКR1C3 – aldoketoreductase 3; b5 – cytochrome b5; CYP17A – 17α-hydroxylase; HSD17B – 17β-hydroxysteroid dehydrogenase; HSD3B – 3β-hydroxysteroid dehydrogenase; HSD3B2 – 3β-hydroxysteroid dehydrogenase type 2; POR – cytochrome P450 oxidoreductase; SRD5A – 5α-reductase; SRD5A1 – 5α-reductase type 1.
Альтернативный путь синтеза андрогенов представлен цепочкой ферментативных реакций, посредством которых 17-OH-прогестерон превращается в ДГТ без Т в качестве промежуточного звена. 17-OH-прогестерон подвергается 5-, затем 3-восстановлению через 5α-редуктазу (с промежуточным образованием 5α-прегнан-17α-ол-3,20-диона) с последующим расщеплением 17,20-лиазой, в результате чего превращается в андростерон. Андростерон превращается в ДГТ через 17-восстановление (с помощью 17β-гидроксистероиддегидрогеназы 2/4 типа и альдокеторедуктазы типа 1C3) и 3-окисление (3α-оксидазы и альдокеторедуктазы типа 1C2). Выявлено, что альтернативный путь синтеза андрогенов наиболее активен в эмбриональном периоде у людей, а также его вовлеченность доказана в патогенезе врожденной клиторомегалии.
Считается, что увеличение активности альтернативного пути способствует появлению избытка А при дефиците 21α-гидроксилазы, а это приводит к вирилизации наружных гениталий у плода 46,XX с данной патологией и формированию клиторомегалии и сращению половых губ. Активность альтернативного пути синтеза А снижается после первого года жизни.
Таким образом повышенная активность канонического и альтернативного путей синтеза А может быть основой вирилизации гениталий у плода с кариотипом 46,ХХ при различных типах врожденной гиперплазии коры надпочечников. Важно отметить, что эти каскады стероидогенеза необходимы для нормальной маскулинизации (вирилизации) гениталий плода с кариотипом 46,XY: для формирования мошонки, пениса, уретры с отверстием на головке полового члена и опускания яичек в мошонку.
Наилучшее понимание роли альтернативного пути синтеза андрогенов было получено при изучении такого заболевания, как дефицит фермента оксидоредуктазы цитохрома P450 (cytochrome P450 oxidoreductase, POR), относящегося к группе нарушений формирования пола и ВДКН. Основное клиническое проявление данного заболевания у девочек – это клиторомегалия и вирилизация наружных гениталий.
Так, в настоящее время стало известно, что важное значение в развитии гиперандрогении и вирилизации плода с кариотипом 46,ХХ имеют дефекты экспрессии POR. Данный энзим принимает участие в функционировании таких ферментов, как 17α-гидроксилаза, 21-гидроксилаза и ароматаза. Мутации POR вызывают их дефицит, что приводит к различным гонадным и внегонадным клиническим проявлениям.
Возможны 2 механизма вирилизации плода 46,XX с дефицитом POR. Во-первых, происходит стимуляция альтернативного пути стероидогенеза А, приводящая к увеличению ДГТ. Во-вторых, у беременных, вынашивающих плод с мутацией POR R457H, может происходить вирилизация также за счет нарушения ароматизации А в эстрогены [11][12].
Важно отметить, что вирилизация плода с кариотипом 46,ХХ также наблюдается при редком генетическом заболевании – дефиците ароматазы [13][14].
Роль 11-оксигенированных андрогенов надпочечников в патогенезе врожденной клиторомегалии / A role of 11-oxygenated adrenal androgens in the pathogenesis of congenital clitoromegaly
Другой класс активных андрогенов надпочечников – 11-оксигенированные стероиды C19 – широко изучается в последние годы (рис. 5). И андростендион и Т подвергаются 11-гидроксилированию, катализируемому 11β-гидроксилазой, в результате чего образуется 11-гидроксиандростендион и 11-гидрокситестостерон соответственно, которые затем восстанавливаются 11β-гидроксистероиддегидрогеназой типа 2 до 11-кетоандростендиона и 11-кетотестостерона соответственно [15]. 11-кетотестостерон может быть 5-восстановлен до 11-кетодигидротестостерона. Хотя 11-гидроксиандростендион был обнаружен в 1950-х годах, он получил мало внимания, поскольку предполагалось, что это часть инактивирующего пути для А надпочечников. Однако более поздние данные идентифицировали 11-оксигенированные стероиды C19 как отдельную группу А надпочечников. В то время как 11-гидроксиандростендион является слабым стероидом, действующим периферически, 11-кетотестостерон и 11-кетодигидротестостерон являются очень сильными А, трансактивирующими рецептор А в одинаковой степени с ДГТ. Кроме того, 11-кетотестостерон, по-видимому, имеет важную физиологическую роль во время адренархе, будучи основным циркулирующим А у девочек и женщин, за которым следуют Т и 11-гидрокситестостерон (табл. 1).
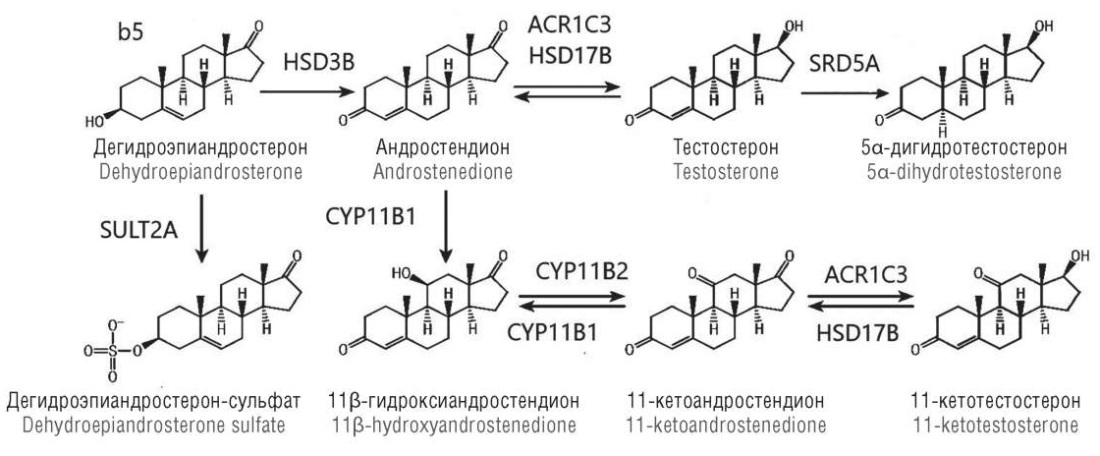
Рисунок 5. Биосинтез и химическая структура 11-оксиандрогенов [модифицировано по 16, 17].
Примечание: AКR1C3 – альдокеторедуктаза 1С3; b5 – цитохром b5; CYP11B1 – 11β-гидроксилаза; CYP11B2 – альдостеронсинтаза; HSD17B – 17β-гидроксистероиддегидрогеназа; HSD3B – 3β-гидроксистероиддегидрогеназа; SRD5A – 5α-редуктаза; SULT2A – сульфатаза.
Figure 5. Biosynthesis and chemical structure of 11-oxyandrogens [modified from 16, 17].
Note: AКR1C3 – aldoketoreductase 1С3; b5 – cytochrome b5; CYP11B1 – 11β-hydroxylase; CYP11B2 – aldosterone synthase; HSD17B – 17β-hydroxysteroid dehydrogenase; HSD3B – 3β-hydroxysteroid dehydrogenase; SRD5A – 5α-reductase; SULT2A – sulfatase.
Таблица 1. 11-оксиандрогены и их андрогенный (вирильный) потенциал [модифицировано по 18].
Table 1. 11-hydroxyandrogens and their androgenic (virile) potential [modified from 18].
|
Стероид Steroid |
Андрогенный потенциал (по отношению к тестостерону) Androgenic potential (relative to testosterone) |
|
Тестостерон Testosterone |
100 |
|
11-кетотестостерон 11-ketotestosterone |
100 |
|
11-гидрокситестостерон 11-hydroxytestosterone |
30 |
|
Андростендион Androstenedione |
менее 5 |
|
11-кетоандростендион 11-ketoandrostenedione |
менее 1 |
|
11-гидроксиандростендион 11-hydroxyandrostenedione |
менее 1 |
Также появляется все больше свидетельств относительно роли 11-оксигенированных C19 андрогенов в избытке А надпочечников у пациентов с ВДКН. Высокие концентрации 11-гидрокситестостерона, 11-кетотестостерона, 11-гидроксиандростендиона, 11-кетоандростендиона были обнаружены у пациентов с дефицитом 21-гидроксилазы. Было высказано предположение, что 11-оксигенированные C19 стероиды являются основной причиной вирилизации детей с ВДКН. Важно отметить, что у взрослых с 21-гидроксилазной недостаточностью было обнаружено, что концентрация 11-оксигенированных C19 А коррелирует с объемом надпочечников и может служить индикатором контроля над заболеванием. Кроме того, было высказано предположение, что 11-оксигенированные стероиды C19 могут являться лучшими маркерами избытка А у больных ВДКН по сравнению с ДГЭА, андростендионом и Т.
Клиническое значение 11-оксигенированных C19 стероидов было оценено и при синдроме поликистозных яичников (СПКЯ), где концентрация 11-оксигенированных стероидов C19 увеличена и коррелирует с маркерами метаболического риска, такими как индекс массы тела и степень инсулинорезистентности. Оксигенированные андрогены у беременных с симптомами вирилизации (ВДКН, в том числе стертые формы, и СПКЯ) могут проникать через плаценту, не подвергаясь ароматизации, что приводит к формированию клиторомегалии у плода с кариотипом 46,ХХ.
Современные научные данные указывают на большой диагностический потенциал этой группы гормонов, и можно ожидать, что они будут включены в качестве биомаркеров для мониторинга избытка андрогенов у пациенток с нормальным уровнем Т и 17-OH-прогестерона.
Таким образом, среди надпочечниковых А исследование 11-оксигенированных стероидов представляется наиболее значимым для диагностики клиторомегалии.
Роль ароматазы в патогенезе врожденной клиторомегалии / A role of aromatase in the pathogenesis of congenital clitoromegaly
В эмбриональном периоде ароматаза экспрессируется в яичниках, плаценте и в некоторой степени в жировой ткани и отвечает за превращение А в эстрогены. Функция, которую выполняет ароматаза в плаценте, по-видимому, состоит в защите плода женского пола (46,ХХ) от избытка действия материнских и собственных андрогенов, дабы избежать вирилизации наружных гениталий. Дефицит ароматазы у плода с кариотипом 46,ХХ сопровождается выраженной вирилизацией вследствие накопления А в крови. Так, в отсутствие дефицита 21-гидроксилазы гениталии плода с кариотипом 46,ХХ могут вирилизироваться при условии наличия дефицита ароматазы в плаценте. Весьма интересны наблюдения, когда у матерей с ВДКН 46,XX плод не подвергается избыточному действию А даже при уровне материнского Т более 10 нмоль/л [19].
Также следует отметить, что 11-оксигенированные стероиды (о которых говорилось выше) не подвергаются ароматизации и проникают через плаценту свободно к плоду (рис. 6). Таким образом, плацента не может полностью выполнить свои защитные «антивирилизирующие» свойства, что приводит к формированию клиторомегалии у плода женского пола (кариотип 46,ХХ) [17].
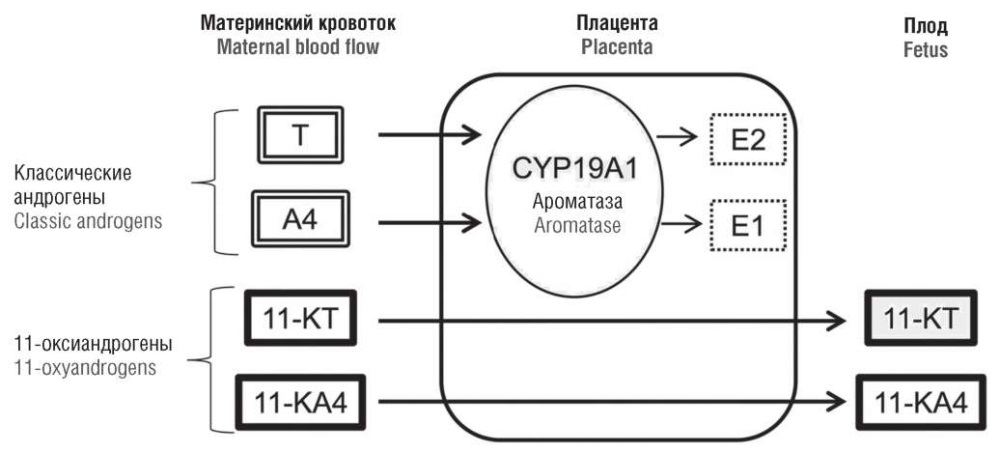
Рисунок 6. Классические андрогены и 11-оксиандрогены и их метаболизм в плаценте [модифицировано по 17].
Примечание: Т – тестостерон; А4 – андростендион; 11-КТ – 11-кетотестостерон; 11-КА4 – 11-кетоандростендион; Е1 – эстрон; Е2 – эстрадиол.
Figure 6. Classical androgens and 11-hydroxyandrogens and their placental metabolism [modified from 17].
Note: Т – testosterone; А4 – androstenedione; 11-КТ – 11-ketotestosterone; 11-КА4 – 11-ketoandrostenedione; E1 – estrone; E2 – estradiol.
В настоящее время достаточно изучен синдром врожденного дефицита ароматазы. Это заболевание сопровождается вирилизацией девочки во внутриутробном периоде, что приводит к формированию у нее врожденной клиторомегалии. По-видимому, это связано с тем, что плацента не ароматизирует андрогены, синтезируемые в обычных количествах в плаценте и надпочечниках [20]. При данном заболевании нет избытка продукции андрогенов, а есть только нарушения их конверсии в эстрогены. Такое заболевание является моделью по изучению роли ароматазы плаценты в патогенезе вирилизации гениталий у девочек. Возможно, относительная недостаточность ароматазы, имеющаяся при состояниях, ассоциированных с избытком андрогенов как у матери, так и у плода, играет одну из важнейших ролей в патогенезе вирилизации гениталий девочек и формировании клиторомегалии.
Роль плаценты в формировании клиторомегалии / A role of placenta in developing clitoromegaly
Вирилизация (маскулинизация) наружных гениталий плода с кариотипом 46,ХХ зависит от синтеза А не только надпочечниками, но и плацентой. Как уже было сказано выше, клетки трофобласта плаценты синтезируют достаточно большое количество ароматазы (рис. 7). Также трофобласт синтезирует важнейший фермент стероидогенеза – 11β-гидроксистероиддегидрогеназу. Данный энзим в плаценте отвечает за конверсию активного кортизола в менее активный кортизон. Этими механизмами плод защищается от избытка андрогенов и глюкокортикоидов.
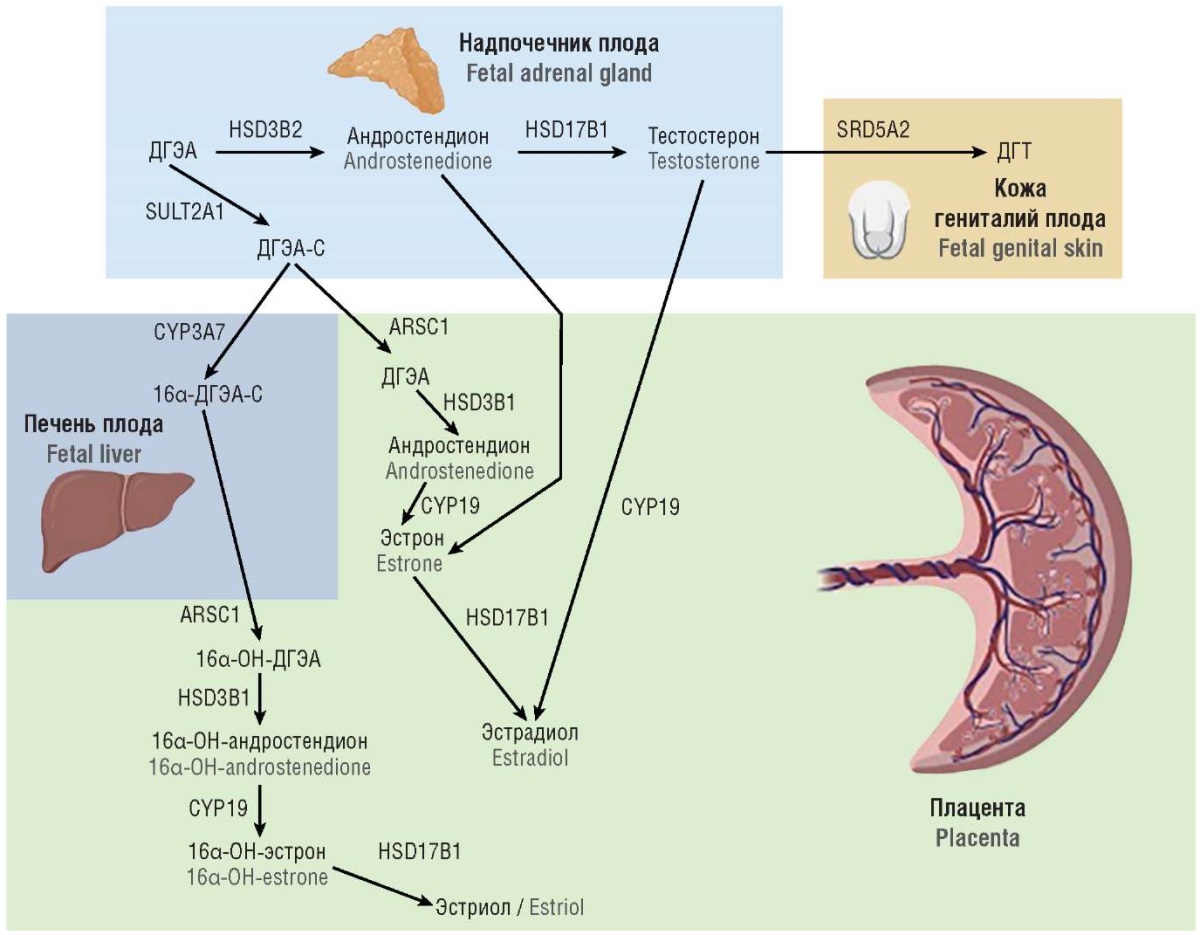
Рисунок 7. Стероидогенез в системе «плод–плацента» [модифицировано по 21].
Примечание: ДГЭА – дегидроэпиандростерон; ДГЭА-С – дегидроэпиандростерон-сульфат; ДГТ – дигидротестостерон; 16α-ДГЭА-С – 16α-дегидроэпиандростерон-сульфат; 16α-ОН-ДГЭА – 16α-гидроксидегидроэпиандростерон; 16α-ОН-андростендион – 16α-гидроксиандростендион; 16α-ОН-эстрон – 16α-гидроксиэстрон; HSD3B1 – 3β-гидроксистероиддегидрогеназа 1; HSD3B2 – 3β-гидроксистероиддегидрогеназа 2; HSD17B1 – 17β-гидроксистероиддегидрогеназа 1; HSD17B3 – 17β-гидроксистероиддегидрогеназа 3; SRD5A2 – 5α-редуктаза 2; SULT2A1 – сульфатаза 1; CYP3A7 – цитохром P450 семейства 3, член подсемейства 7; ARSC1 – стерилсульфатаза; CYP19 – ароматаза.
Figure 7. Steroidogenesis in the fetus-placenta axis [modified from 21].
Note: DHEA – dehydroepiandrosterone; DHEA-S – dehydroepiandrosterone-sulfate; DHT – dihydrotestosterone; 16α-DHEA-S – 16α-dehydroepiandrosterone-sulfate; 16α-OH-DHEA – 16α-hydroxydehydroepiandrosterone; 16α-OH-androstenedione – 16α-hydroxyandrostenedione; 16α-OH-estrone – 16α-hydroxyestrone; HSD3B1 – 3β-hydroxysteroid dehydrogenase 1; HSD3B2 – 3β-hydroxysteroid dehydrogenase 2; HSD17B1-17β – hydroxysteroid dehydrogenase 1; HSD17B3 – 17β-hydroxysteroid dehydrogenase 3; SRD5A2 – 5α-reductase 2; SULT2A1 – sulfatase 1; CYP3A7 – cytochrome P450 family 3, member of subfamily 7; ARSC1 – steryl-sulfatase; CYP19 – aromatase.
С другой стороны, трофобласт плаценты обладает способностью продуцировать альтернативным путем А, через аллопрегненалон и андростерон (рис. 8). В дальнейшем данные метаболиты-предшественники конвертируются в тканях гениталий плода в ДГТ, оказывающего мощное вирилизирующее действие на наружные половые органы. Для мальчиков (кариотип 46,ХY) этот процесс является важным механизмом формирования гениталий по мужскому типу (так называемое окно программируемой маскулинизации). Для девочек (кариотип 46,ХХ) активизация данного пути синтеза А может приводить к избыточной вирилизации гениталий и формированию клиторомегалии и сращению половых губ. Возможно, данный путь продукции биологически активных А работает при ВДКН, даже при стертых формах этого заболевания.
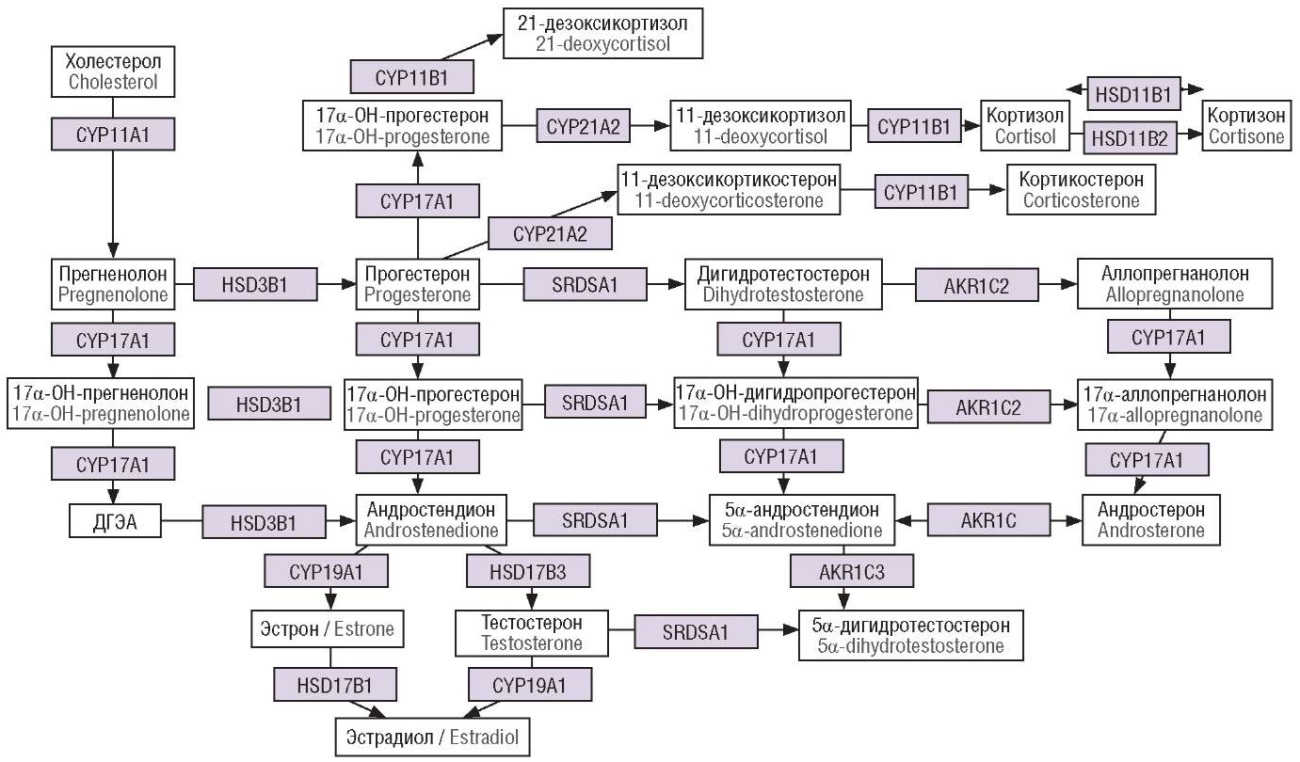
Рисунок 8. Стероидогенез в плаценте [модифицировано по 22].
Примечание: AКR1C – альдокеторедуктаза 1-го семейства; AKR1C2 – альдокеторедуктаза 1С2; AKR1C3 – альдокеторедуктаза 1С3; CYP11A1 – 20,22-десмолаза; HSD3B1 – 3β-гидроксистероиддегидрогеназа 1; CYP17A1 – 17α-гидроксилаза; CYP21A2 – 21-гидроксилаза 2 типа; CYP11B1 – 11β-гидроксилаза; HSD11B1 – 11β-гидроксистероиддегидрогеназа 1 типа; HSD11B2 – 11β-гидроксистероиддегидрогеназа 2 типа; HSD17B1 – 17β-гидроксистероиддегидрогеназа 1; HSD17B3 – 17β-гидроксистероиддегидрогеназа 3; CYP19A1 – ароматаза; SRD5A1 – 5α-редуктаза 1; ДГЭА – дегидроэпиандростерон.
Figure 8. Placental steroidogenesis [modified from 22].
Note: ACR1C – aldoketoreductase family 1; AKR1C2 – aldoketoreductase 1C2; AKR1C3 – aldoketoreductase 1C3; CYP11A1 – 20,22-desmolase; HSD3B1 – 3β-hydroxysteroid dehydrogenase 1; CYP17A1 – 17α-hydroxylase; CYP21A2 – 21-hydroxylase type 2; CYP11B1 – 11β-hydroxylase; HSD11B1 – 11β-hydroxysteroid dehydrogenase type 1; HSD11B2 – 11β-hydroxysteroid dehydrogenase type 2; HSD17B1 – 17β-hydroxysteroid dehydrogenase 1; HSD17B3 – 17β-hydroxysteroid dehydrogenase 3; CYP19A1 – aromatase; SRD5A1 – 5α-reductase 1; DHEA – dehydroepiandrosterone.
Данные последних лет о физиологии и патофизиологии стероидогенеза позволяют врачам-клиницистам рассмотреть новые подходы к диагностике профилактики и лечению врожденной клиторомегалии. Современные методы лабораторной диагностики гиперандрогенных состояний у 46,XX пациентов с клиторомегалией раскрывают новые возможности оценки андрогенного статуса у таких пациенток и потенциально позволяют врачам различных специальностей (эндокринологам, детским эндокринологам, гинекологам) воздействовать на патогенез таких состояний. Это обусловлено развитием неинвазивной пренатальной диагностики, молекулярной генетики и современной лабораторной эндокринологии – газовой хроматографии и масс-спектрометрии стероидного профиля мочи. Данные методы позволяют изучать и понять механизм развития клиторомегалии у плода женского пола, оценивая функциональное состояние надпочечников и плаценты (рис. 9).
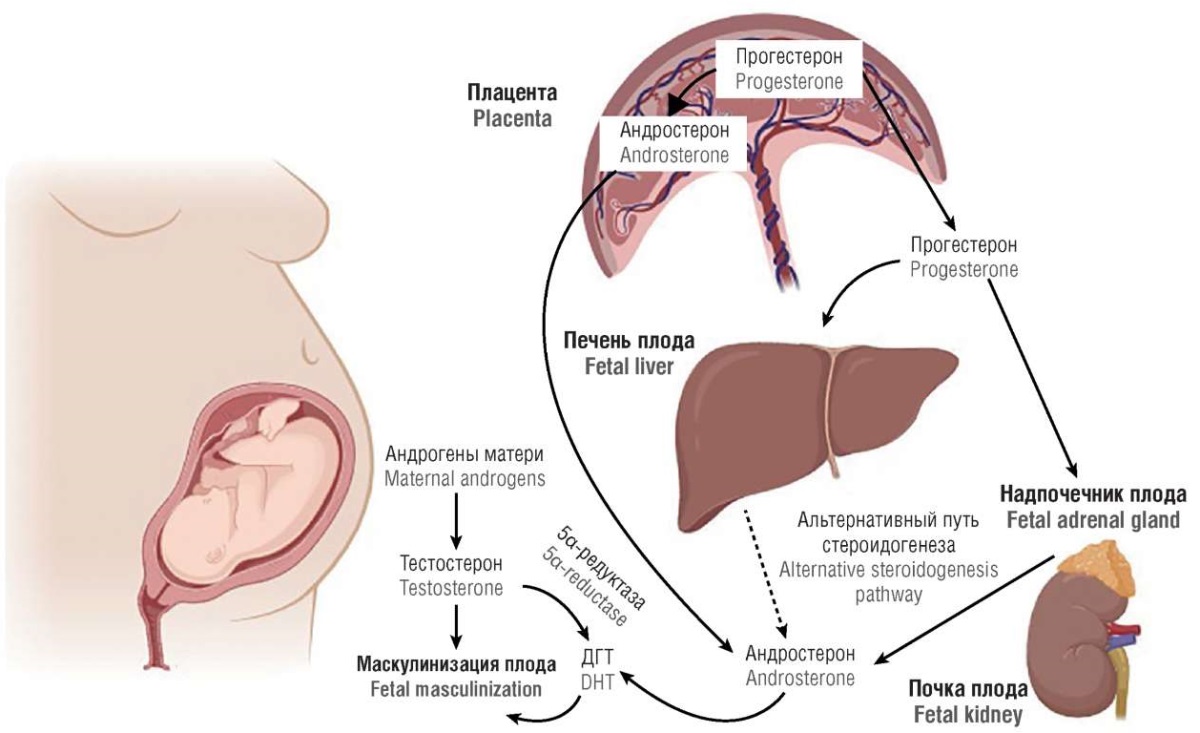
Рисунок 9. Роль плаценты, надпочечников и печени плода в вирилизации (маскулинизации) гениталий плода 46,ХХ [модифицировано по 23, 24].
Примечание: ДГТ – дигидротестостерон.
Figure 9. A role of placenta, adrenal glands and fetal liver in virilization (masculinization) of 46,XX fetal genitalia [modified from 23, 24].
Note: DHT – dihydrotestosterone.
Современное понимание механизмов физиологической и патологической вирилизации наружных гениталий позволили создать модель формирования эндокринного пола человека. Так, учеными была сформулирована концепция «окна программируемой вирилизации (маскулинизации)» гениталий плода (рис. 10). В английской литературе предложен термин «окно программируемой маскулинизации» или «masculinization programming window» [24]. Эта модель описывает нормальное развитие половых органов девочек и мальчиков, что сопровождается увеличением аногенитального расстояния, размеров клитора и пениса. При патологических состояниях, ассоциированных с избытком андрогенов, у девочек удлиняется время патологического вирилизирующего воздействия А на наружные гениталии, что приводит к увеличению у них аногенитального расстояния и клитора. В ряде случаев может сформироваться мошонка и уретра по мужскому типу.
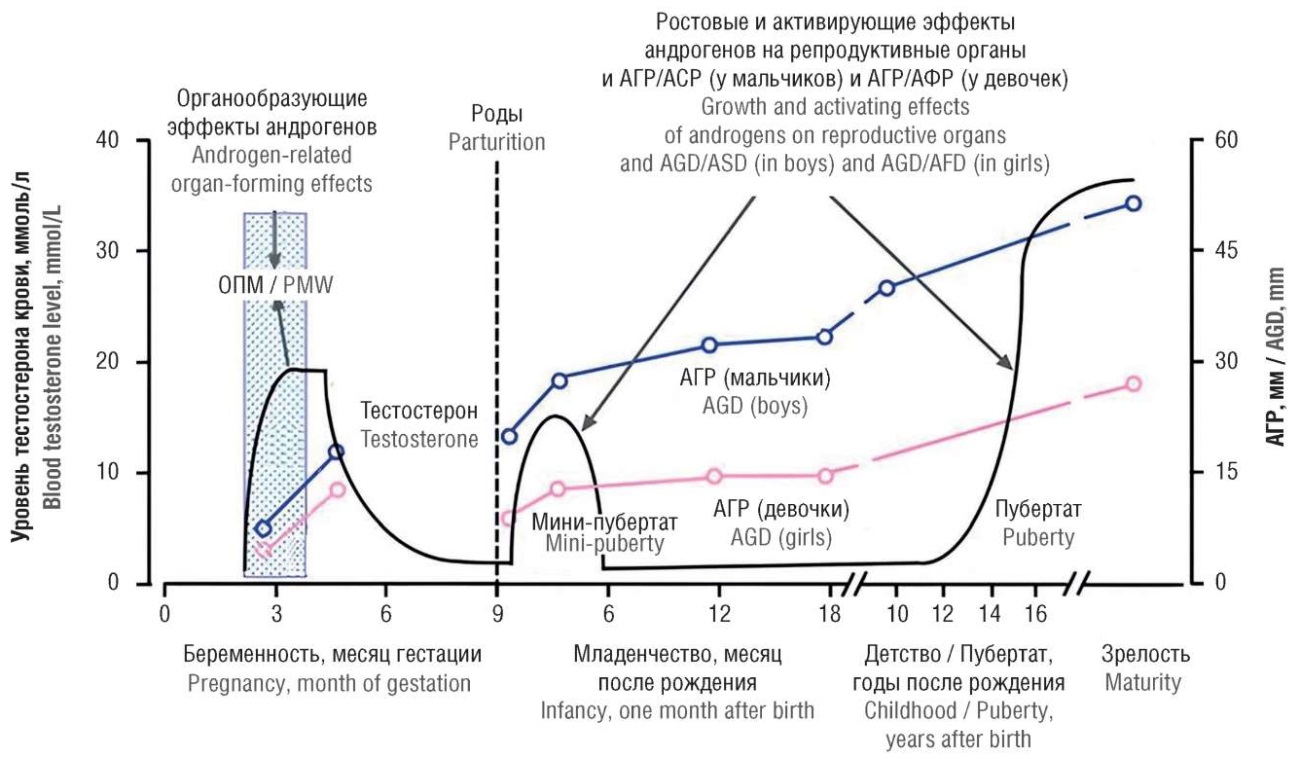
Рисунок 10. Окно пренатальной вирилизации плода. Динамика аногенитального расстояния и размеров клитора и пениса в процессе онтогенеза человека [24].
Примечание: АГР – аногенитальное расстояние; АФР – анофуршетное расстояние (от центра ануса до уздечки половых губ); АСР – аноскротальное расстояние; ОПМ – окно программируемой маскулинизации.
Figure 10. Window of prenatal fetal virilization. Temporally changed anogenital distance as well as clitoris and penis size during human ontogenesis [24].
Note: AGD – anogenital distance; AFD – ano-fourchette distance (from the center of the anus to posterior fourchette); ASD – anoscrotal distance; PMW – masculinization programming window.
Важнейшей задачей современной медицины является профилактика и лечение внутриутробной вирилизации эмбриона с кариотипом 46,ХХ. Назначение дексаметазона беременной до 9-й недели внутриутробного развития плода (с учетом возможностей современной пренатальной неинвазивной генетической диагностики) позволяет проводить профилактику развития клиторомегалии и вирилизации у эмбриона женского пола у матерей в группах риска (например, когда у самой женщины имеется ВДКН, или уже есть ребенок с этим заболеванием). Старт терапии необходимо произвести до «окна программируемой маскулинизации», что связано с активизацией стероидогенеза А на данном этапе эмбрионального развития. Дексаметазон, проникая через плаценту, подавляет избыточную продукцию АКТГ у плода и подавляет гиперпродукцию А zona reticularis коры надпочечников, что приводит к снижению риска развития клиторомегалии и урогенитального синуса (рис. 11).
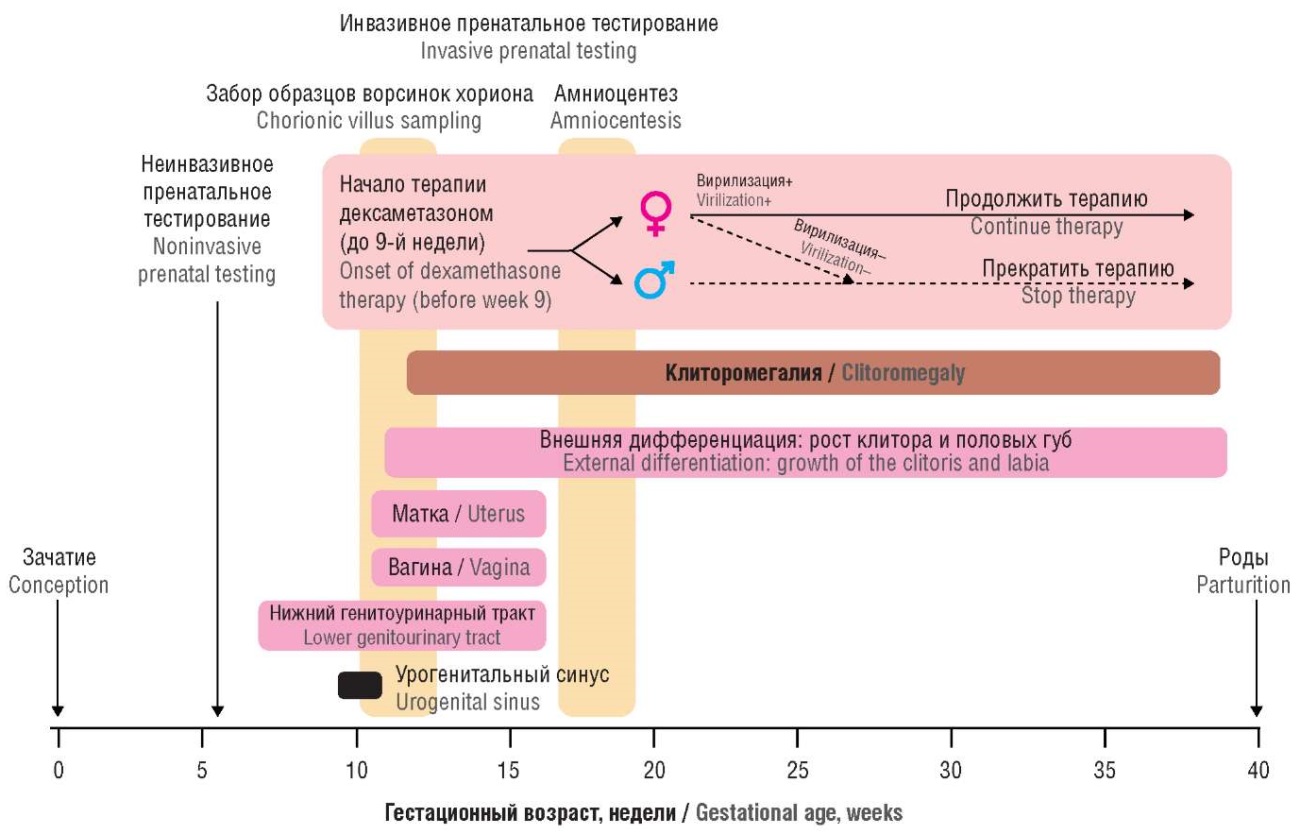
Рисунок 11. Схема пренатальной терапии вирилизации плода 46,ХХ с врожденной дисфункцией коры надпочечников [модифицировано по 25, 26].
Figure 11. A prenatal treatment scheme for virilization of 46,XX fetus with congenital adrenal hyperplasia [modified from 25, 26].
Заключение / Conclusion
Таким образом, диагностика, профилактика и лечение клиторомегалии является одной важнейших задач современной медицины, позволяющей избежать трагедий человеческих судеб. Успешность данного подхода зависит от компетентного междисциплинарного подхода специалистов целого ряда профилей: гинекологов, неонатологов, генетиков и эндокринологов.
Список литературы
1. Иванов Н.В., Серебрякова И.П., Худякова Н.B., Федорова А.И. Клиторомегалия: принципы диагностики и лечения. Акушерство, Гинекология и Репродукция. 2023;17(4):462–75. https://doi.org/10.17749/2313-7347/ob.gyn.rep.2023.400.
2. Андроник Д.И., Башнина Е.Б., Бурцев Е.А. и др. Принцип Лилит. К вопросу формирования пола у человека: практическое руководство для врачей. Под ред. Н.В. Иванова, Е.Б. Башниной. СПб.: ПОЛИТЕХ-ПРЕСС, 2021. 382 с.
3. Speiser P.W., Arlt W., Auchus R.J. et al. Congenital adrenal hyperplasia due to steroid 21-hydroxylase deficiency: An Endocrine Society Clinical Practice Guideline. J Clin Endocrinol Metab. 2018;103(11):4043–88. https://doi.org/10.1210/jc.2018-01865.
4. Penning T.M., Burczynski M.E., Jez J.M. et al. Human 3α-hydroxysteroid dehydrogenase isoforms (AKR1C1-AKR1C4) of the aldo-keto reductase superfamily: functional plasticity and tissue distribution reveals roles in the inactivation and formation of male and female sex hormones. Biochem J. 2000;351(Pt1):67–77. https://doi.org/10.1042/0264-6021:3510067.
5. Nakamura Y., Hornsby P.J., Casson P. et al. Type 5 17β-hydroxysteroid dehydrogenase (AKR1C3) contributes to testosterone production in the adrenal reticularis. J Clin Endocrinol Metab. 2009;94(6):2192–8. https://doi.org/10.1210/jc.2008-2374.
6. Claahsen-van der Grinten H.L., Speiser P.W., Ahmed S.F. Congenital adrenal hyperplasia – current insights in pathophysiology, diagnostics, and management. Endocr Rev. 2022;43(1):91–159. https://doi.org/10.1210/endrev/bnab016.
7. Серебрякова И.П., Великанова Л.И., Ворохобина Н.В. и др. Особенности адреналового стероидогенеза у больных с врожденной дисфункцией коры надпочечников вследствие дефекта 21-гидроксилазы. Проблемы эндокринологии. 2005;51(4):22–6. https://doi.org/10.14341/probl200551422-26.
8. Schiffer L., Barnard L., Baranowski E.S. et al. Human steroid biosynthesis, metabolism and excretion are differentially reflected by serum and urine steroid metabolomes: A comprehensive review. J Steroid Biochem Mol Biol. 2019;194:105439. https://doi.org/10.1016/j.jsbmb.2019.105439.
9. Storbeck K.H., Schiffer L., Baranowski E.S. et al. Steroid metabolome analysis in disorders of adrenal steroid biosynthesis and metabolism. Endocr Rev. 2019;40(6):1605–25. https://doi.org/10.1210/er.2018-00262.
10. Miller W.L., Auchus R.J. The "backdoor pathway" of androgen synthesis in human male sexual development. PLoS Biol. 2019;17(4):e3000198. https://doi.org/10.1371/journal.pbio.3000198.
11. Fukami M., Horikawa R., Nagai T. et al. Cytochrome P450 oxidoreductase gene mutations and Antley-Bixler syndrome with abnormal genitalia and/or impaired steroidogenesis: molecular and clinical studies in 10 patients. J Clin Endocrinol Metab. 2005;90(1):414–26. https://doi.org/10.1210/jc.2004-0810.
12. Fukami M., Ogata T. Cytochrome P450 oxidoreductase deficiency: rare congenital disorder leading to skeletal malformations and steroidogenic defects. Pediatr Int. 2014;56(6):805–8. https://doi.org/10.1111/ped.12518.
13. Reisch N., Idkowiak J., Hughes B.A. et al. Prenatal diagnosis of congenital adrenal hyperplasia caused by P450 oxidoreductase deficiency. J Clin Endocrinol Metab. 2013;98(3):E528–36. https://doi.org/10.1210/jc.2012-3449.
14. Reisch N., Auchus R.J., Shackleton C.H.L. et al. Reply to Fluck et al.: Alternative androgen pathway biosynthesis drives fetal female virilization in P450 oxidoreductase deficiency. Proc Natl Acad Sci U S A. 2020;117(26):14634–5. https://doi.org/10.1073/pnas.2007695117.
15. Gent R., Van Rooyen D., Atkin S.L., Swart A.C. C11-hydroxy and C11-oxo C19 and C21 steroids: pre-receptor regulation and interaction with androgen and progesterone steroid receptors. Int J Mol Sci. 2023;25(1):101. https://doi.org/10.3390/ijms25010101.
16. Turcu A.F., Rege J., Auchus R.J. et al. 11-Oxygenated androgens in health and disease. Nat Rev Endocrinol. 2020;16(5):284–96. https://doi.org/10.1038/s41574-020-0336-x.
17. Fukami M. 11-Oxyandrogens from the viewpoint of pediatric endocrinology. Clin Pediatr Endocrinol. 2022;31(3):110–5. https://doi.org/10.1297/cpe.2022-0029.
18. Rosenfield R.L. Normal and premature adrenarche. Endocr Rev. 2021;42(6):783–814. https://doi.org/10.1210/endrev/bnab009.
19. Lo J.C., Grumbach M.M. Pregnancy outcomes in women with congenital virilizing adrenal hyperplasia. Endocrinol Metab Clin North Am. 2001;30(1):207–29. https://doi.org/10.1016/s0889-8529(08)70027-6.
20. Belgorosky A., Guercio G., Pepe C. et al. Genetic and clinical spectrum of aromatase deficiency in infancy, childhood and adolescence. Horm Res. 2009;72(6):321–30. https://doi.org/10.1159/000249159.
21. White P.C. Ontogeny of adrenal steroid biosynthesis: why girls will be girls. J Clin Invest. 2006;116(4):872–4. https://doi.org/10.1172/JCI28296.
22. Karahoda R., Kallol S., Groessl M. Revisiting steroidogenic pathways in the human placenta and primary human trophoblast cells. Int J Mol Sci. 2021;22(4):1704. https://doi.org/10.3390/ijms22041704.
23. Noyola-Martínez N., Halhali A., Barrera D. Steroid hormones and pregnancy. Gynecol Endocrinol. 2019;35(5):376–84. https://doi.org/10.1080/09513590.2018.1564742.
24. Sharpe R.M. Androgens and the masculinization programming window: human-rodent differences. Biochem Soc Trans. 2020;48(4):1725–35. https://doi.org/10.1042/BST20200200.
25. New M.I., Tong Y.K., Yuen T. et al. Noninvasive prenatal diagnosis of congenital adrenal hyperplasia using cell-free fetal DNA in maternal plasma. J Clin Endocrinol Metab. 2014;99:E1022–30. https://doi.org/10.1210/jc.2014-1118.
26. Khattab A., Yuen T., Sun L. et al. Noninvasive prenatal diagnosis of congenital adrenal hyperplasia. Endocr Dev. 2016;30:37–41. https://doi.org/10.1159/000439326.
Об авторах
Н. В. ИвановRussian Federation
Иванов Никита Владимирович, к.м.н.
191015 Санкт-Петербург, Кирочная ул., д. 41
Scopus Author ID: 57221190481. WoS ResearcherID: JRZ-0207-2023
И. П. Серебрякова
Russian Federation
Серебрякова Инна Павловна, к.м.н.
191015 Санкт-Петербург, Кирочная ул., д. 41
Scopus Author ID: 58679099300. WoS ResearcherID: JRZ-0285-2023
Л. И. Радугина
Russian Federation
Радугина Любовь Игоревна
191015 Санкт-Петербург, Кирочная ул., д. 41
Ф. М. Радугин
Russian Federation
Радугин Федор Михайлович
194044 Санкт-Петербург, ул. Чугунная, д. 46
Ш. К. Юсупова
Uzbekistan
Юсупова Шахноза Кадиржановна, д.м.н.
170127 Андижан, ул. Ю. Отабекова, д. 1
Что уже известно об этой теме?
► Клиторомегалия является частым симптомом эндокринологических заболеваний: от нозологий, относящихся к нарушениям формирования пола, до вирилизирущих форм адренокортикального рака и синдрома поликистозных яичников. Однако механизмы развития клиторомегалии зачастую мало изучены.
Что нового дает статья?
► Рассмотрены механизмы возникновения гиперандрогении и развития клиторомегалии у пациенток, ассоциированные с классическими формами врожденной дисфункции коры надпочечников.
► Рассмотрена роль в формировании гиперандрогении у лиц с кариотипом 46,XX нарушений синтеза андрогенов в надпочечниках и плаценте в рамках понимания роли альтернативного стероидогенеза андрогенов и механизмах гиперпродукции 11-оксигенированных стероидов.
► Представлена роль ароматазы в плаценте матери в формировании клиторомегалии.
Как это может повлиять на клиническую практику в обозримом будущем?
► Данный обзор предполагает расширение диагностических подходов при ведении пациенток с клиторомегалией с целью разработки эффективных методов профилактики и лечения данного недуга.
Рецензия
Для цитирования:
Иванов Н.В., Серебрякова И.П., Радугина Л.И., Радугин Ф.М., Юсупова Ш.К. Роль нарушений стероидогенеза в формировании врожденной клиторомегалии. Акушерство, Гинекология и Репродукция. 2024;18(5):679–692. https://doi.org/10.17749/2313-7347/ob.gyn.rep.2024.494
For citation:
Ivanov N.V., Serebryakova I.P., Radugina L.I., Radugin F.M., Yusupova Sh.K. The role of steroidogenesis disorders in developing congenital clitoromegaly. Obstetrics, Gynecology and Reproduction. 2024;18(5):679–692. (In Russ.) https://doi.org/10.17749/2313-7347/ob.gyn.rep.2024.494
JATS XML

Контент доступен под лицензией Creative Commons Attribution-NonCommercial-ShareAlike 4.0 International License.










































