Перейти к:
Мигрень на фоне антифосфолипидного синдрома и наследственной тромбофилии: клинико-диагностические особенности и вопросы терапии в период беременности
https://doi.org/10.17749/2313-7347/ob.gyn.rep.2024.536
Аннотация
Введение. Мигрень – одна из наиболее часто встречающихся первичных головных болей, являющаяся фактором риска сердечно-сосудистых и цереброваскулярных заболеваний. Антифосфолипидный синдром (АФС) и наследственная тромбофилия (НТ), вызывающие патологическое течение беременности, в высокой степени ассоциированы с мигренью. Своевременное распознавание мигрени в рамках АФС и НТ способствует более раннему назначению патогенетической терапии тромбофилии и предупреждению возможных осложнений.
Цель: проанализировать данные литературы о клинико-диагностических особенностях мигрени при АФС и НТ, вопросах терапии в период беременности.
Материалы и методы. Поиск научной литературы выполнен в электронных базах данных PubMed, Google Scholar, eLibrary с 2004 г. по май 2024 г. Методологическая основа поиска включала наличие следующих ключевых слов и их сочетаний на русском и английском языках: «мигрень», «антифосфолипидный синдром», «тромбофилия», «мигрень и беременность», «мигрень и тромбофилия», «мигрень и сердечно-сосудистые заболевания», «migraine», «antiphospholipid syndrome», «thrombophilia», «migraine and pregnancy», «migraine and thrombophilia», «migraine and cardiovascular diseases». По результатам поиска было получено 184 публикации. В результате отбора в обзор включены 62 статьи.
Результаты. На современном этапе неврологи не обладают возможностями диагностирования мигрени на фоне АФС и НТ по характеристикам самой цефалгии. Беременность повышает риск тромботических осложнений. Факт наличия мигрени в анамнезе должен являться важным моментом при оценке акушерского риска в период беременности. Неврологам при диагностировании мигрени необходимо выяснять акушерский анамнез пациентки. Недостаточно данных о наиболее эффективной и безопасной терапии приступов мигрени во время беременности.
Заключение. Частая ассоциация АФС и НТ с мигренью, отсутствие четких клинических особенностей мигрени при тромбофилии, репродуктивный возраст пациенток, высокий риск тромботических осложнений диктуют необходимость взаимодействия врачей-неврологов и акушеров-гинекологов для своевременной диагностики заболевания и ведения данной категории пациентов. Влияние различных видов антитромботической терапии на течение мигрени нуждается в уточнении. Перспективными представляются исследования, которые смогут определить, способна ли профилактика приступов мигрени предотвратить неблагоприятные исходы беременности у женщин с мигренью в анамнезе.
Для цитирования:
Воскресенская О.Н., Дашдамирова Л.Р., Хизроева Д.Х., Макацария А.Д., Бицадзе В.О. Мигрень на фоне антифосфолипидного синдрома и наследственной тромбофилии: клинико-диагностические особенности и вопросы терапии в период беременности. Акушерство, Гинекология и Репродукция. 2024;18(5):667-678. https://doi.org/10.17749/2313-7347/ob.gyn.rep.2024.536
For citation:
Voskresenskaya O.N., Dashdamirova L.R., Khizroeva J.Kh., Makatsariya A.D., Bitsadze V.O. Migraine in antiphospholipid syndrome and hereditary thrombophilia: pregnancy-related clinical and diagnostic features and therapeutic issues. Obstetrics, Gynecology and Reproduction. 2024;18(5):667-678. (In Russ.) https://doi.org/10.17749/2313-7347/ob.gyn.rep.2024.536
Введение / Introduction
Мигрень – одна из форм первичных цефалгий, выделяющаяся наиболее дезадаптирующим влиянием на общественное здоровье популяции в целом. По последним данным, распространенность мигрени составляет 14–15 % и на ее долю приходится 4,9 % от общемирового бремени болезней [1][2]. В общей популяции мигренью страдает около 1 млрд человек, а среди женщин до 50 лет она становится частой причиной нетрудоспособности [3]. Результаты исследования оказания медицинской помощи в реальной клинической практике в нашей стране демонстрируют низкий уровень выявления мигрени среди пациентов, обращающихся за консультацией по поводу головной боли (ГБ), избыточное назначение инструментальных методов обследования и незначительный процент рекомендованной профилактической терапии [4][5]. Своевременная диагностика мигрени чрезвычайно важна в связи с тем, что данный вид ГБ может быть фактором риска многих сердечно-сосудистых заболеваний (ССЗ). Двукратное повышение риска ишемического инсульта (ИИ) выявлено у женщин с мигренью с аурой в возрасте до 45 лет, курильщиков и использующих оральные контрацептивы [6]. Мигрень выступает в качестве фактора риска возникновения инфаркта миокарда, ишемического, геморрагического инсульта и венозной тромбоэмболии [7–10]. Метаанализ 862 статей, посвященных исследованиям в этой области в период с 2013 по 2023 гг., подтверждает повышение риска сердечно-сосудистых и цереброваскулярных заболеваний у пациентов, страдающих мигренью [11]. Патогенетические механизмы, лежащие в основе такой ассоциации, остаются до конца неясными. Среди возможных факторов обсуждается дисфункция эндотелия. Описана корреляция повышения фактора фон Виллебранда (англ. von Willebrand factor, vWF), C-реактивного белка, клеток-предшественников эндотелия с продолжительностью заболевания. Доказано, что во время приступа мигрени повышается выделение пептида, связанного с геном кальцитонина (англ. calcitonin gene-related peptide, CGRP), активирующего vWF, который в свою очередь стимулирует рецепторы IIb/IIIa тромбоцитов, что приводит к гиперкоагуляции. Именно гиперкоагуляционными изменениями объясняют частую ассоциацию мигрени с аурой с антифосфолипидным синдромом (АФС) и системными заболеваниями соединительной ткани [12][13–16].
Тромбофилии активно изучаются в течение последних двух десятилетий. Среди всех форм гиперкоагуляции наиболее часто встречается АФС, развивающийся у лиц молодого возраста, у женщин в 5 раз чаще, чем у мужчин. Центральная нервная система при АФС повреждается за счет ишемического и иммуноопосредованного патогенетического механизма. Клинические проявления неврологических нарушений включают в себя нарушения мозгового кровообращения, эпилептические приступы, миелиты, мигрень, хорею, и др. Причины возникновения и механизмы развития АФС остаются не до конца изученными. Привычное невынашивание беременности в трети случаев объясняется синтезом антифосфолипидных антител (АФА), а наиболее частым поводом обращения к неврологу во время беременности является ГБ [17–20]. У пациентов с первичным АФС, не предъявляющих каких-либо неврологических жалоб, чаще определяется гиперинтенсивность белого вещества и лакунарные изменения по сравнению с пациентами без носительства АФА [21].
Не менее актуальной проблемой для неврологической и акушерской практики является наследственная тромбофилия (НТ) – гетерогенная группа тромбофилий, имеющих наследуемый характер и ассоциированных с мутациями факторов, задействованных в различных фазах коагуляционного каскада [22]. Носительство полиморфизмов генов тромбофилии может стать причиной осложнений беременности за счет усиления гиперкоагуляции. Отмечена корреляция НТ с такими осложнениями беременности, как преэклампсия (ПЭ), спонтанные аборты, отслойка плаценты, неразвивающаяся беременность, преждевременные роды (ПР), внутриутробная задержка роста плода [23][24]. НТ является фактором риска возникновения как мигрени, так и цереброваскулярных заболеваний [25][26]. Как показывает реальная клиническая практика, диагноз АФС и/или НТ устанавливается акушерами-гинекологами при обращении женщин репродуктивного возраста по поводу невынашивания беременности. Неврологи, занимающиеся лечением мигрени, на сегодняшний день не обладают возможностями диагностирования данных гиперкоагуляционных синдромов по характеристикам самой цефалгии [27]. Необходимость дифференциального подхода при диагностике мигрени с настороженностью в отношении форм, ассоциированных с АФС и НТ, продиктована в первую очередь различной тактикой лечения. Своевременное распознавание мигрени в рамках АФС и НТ способствует более раннему назначению патогенетической терапии тромбофилии и предупреждению возможных осложнений.
Цель: проанализировать данные литературы о клинико-диагностических особенностях мигрени при АФС и НТ, вопросах терапии в период беременности.
Материалы и методы / Materials and Methods
Поиск научной литературы выполнен в базах данных PubMed, Google Scholar, eLibrary с 2004 г. по май 2024 г. Методологическая основа поиска включала наличие следующих ключевых слов и их сочетаний на русском и английском языках: «мигрень», «антифосфолипидный синдром», «тромбофилия», «мигрень и беременность», «мигрень и тромбофилия», «мигрень и сердечно-сосудистые заболевания», «migraine», «antiphospholipid syndrome», «thrombophilia», «migraine and pregnancy», «migraine and thrombophilia», «migraine and cardiovascular diseases».
Авторы независимо друг от друга анализировали названия и аннотации статей, после чего извлекались полнотекстовые статьи. Цитируемые ссылки включают: оригинальные работы, систематические обзоры, открытые, ретроспективные и популяционные исследования, клинические случаи, соответствующие тематике обзора, опубликованные на русском и английском языках. Отбор публикаций осуществляли в соответствии с рекомендациями PRISMA. Все тематические статьи, опубликованные с 2004 г. по май 2024 г., были включены в обзор. В результате поиска было получено 184 публикации: 123 из PubMed, 31 из Google Scholar и 30 из eLibrary. Дубликаты и не полнотекстовые версии статей были исключены. Публикации оценивались на соответствие следующим критериям включения: исследование из области неврологии, акушерства и гинекологии; исследование включает только взрослых женщин; исследование описывает течение мигрени во время беременности, клинико-диагностические особенности и терапевтическую тактику при мигрени на фоне АФС и НТ. В результате отбора в обзор были включены 62 статьи. Алгоритм поиска публикаций представлен на рисунке 1.
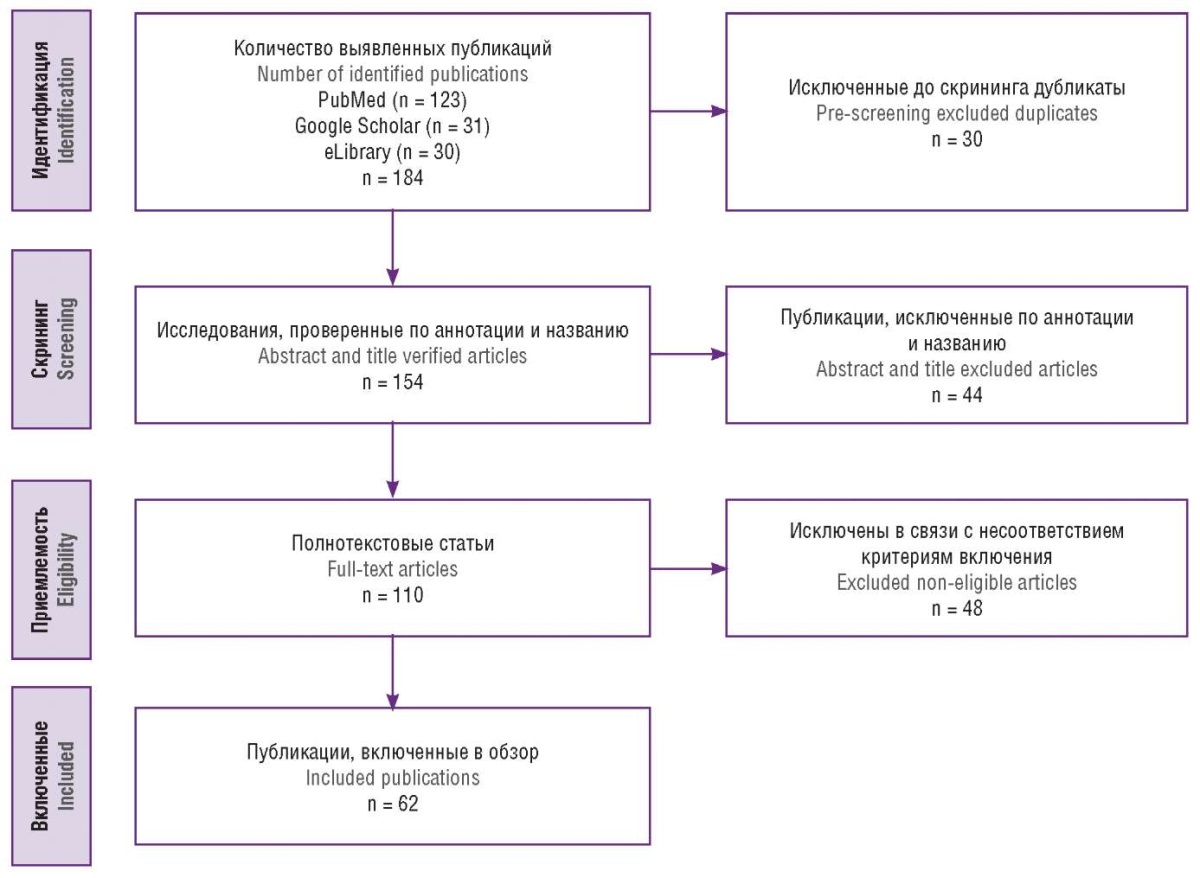
Рисунок 1. Алгоритм поиска публикаций.
Figure 1. Publication search algorithm.
Результаты / Results
Мигрень, ассоциированная с антифосфолипидным синдромом и наследственной тромбофилией / Migraine associated with antiphospholipid syndrome and hereditary thrombophilia
Мигрень является наиболее распространенным видом головной боли у АФА-положительных пациентов [12][17][19]. Механизм развития мигренозной головной боли при АФС заключается в связывании антител с фосфолипидами эндотелиоцитов интракраниальных артерий, что приводит к снижению порога чувствительности рецепторов системы тройничного нерва. Участие тромбоцитарного компонента состоит в высвобождении серотонина в результате связывания АФА с мембранными белками тромбоцитов. Некоторые авторы предлагают рассматривать мигрень при АФС с позиций аутоиммунно-ассоциированного заболевания [28].
Надо признать, что результаты исследований по поиску ранних, диагностических маркеров мигрени, ассоциированной с АФС и НТ, на сегодняшний день являются весьма скромными. Известно, что в подавляющем проценте наблюдений до развития явных клинических проявлений у пациентов можно было выявить так называемые «малые» признаки АФС в виде мигрени и сетчатого ливедо [29][30]. Для мигрени, ассоциированной с АФС, характерна наследственная предрасположенность, дебют в юношеском возрасте, возобновление или учащение приступов на фоне беременности. Интенсификация приступов сопровождается повышением фибриногена и индуцированной агрегационной активностью тромбоцитов. У всех пациенток с мигренью обнаружен повышенный уровень D-димера, что вместе с гиперфибриногенемией повышает риск возможных тромботических осложнений. Доплерографическая картина церебрального кровотока характеризуется снижением периферического сопротивления в средней и передней мозговых артериях [31].
Пациентки с мигренью на фоне АФС отличаются более ранним возрастом дебюта мигрени, более низкой частотой приступов, меньшей выраженностью реактивной и личностной тревожности, большей встречаемостью такой акушерской патологии, как ранний самопроизвольный аборт, задержка развития плода, повторные невынашивания беременности. Патогенез мигрени и ее распространенность при различных вариантах НТ изучены менее полно. Имеющиеся на сегодняшний день эмпирические данные представлены в основном результатами одномоментных исследований, согласно которым у пациентов с мигренью чаще встречается мутация в гене протромбина, мутация фактора V Лейдена, мутация фактора VII свертывания. Не было получено доказательств в пользу повышенной распространенности дефицита протеинов C, S и антитромбина III у пациентов с мигренью на фоне НТ [32].
У 67 % пациентов, страдающих мигренью с аурой и перенесших ишемический инсульт (ИИ), отмечена мутация гена фактора V. Также предполагается, что протромботические состояния являются фактором риска хронификации мигрени [25][32].
Мигрень во время беременности / Pregnancy-related migraine
При наступлении беременности гормональный профиль женщины претерпевает изменения, особенно это касается эстрадиола и прогестерона. Беременность является сложным процессом, при котором возникает перестройка иммунной системы женщины с изменением соотношения Т-клеток и преобладанием провоспалительного профиля с увеличением количества провоспалительных цитокинов [33]. Исходя из данных многих эпидемиологических исследований, частота и выраженность мигренозных эпизодов имеет тенденцию к снижению во время беременности [34][35]. Беременность можно рассматривать как благоприятное время для женщин, страдающих мигренью, поскольку повышенный уровень эстрогена и эндогенных опиоидов повышает болевой порог, а стабильный уровень гормонов, который больше не колеблется, устраняет основной фактор, провоцирующий приступы. Действительно, в подавляющем большинстве случаев симптомы мигрени спонтанно улучшаются на протяжении всей беременности. После родов частота повторения приступов мигрени увеличивается, особенно в течение первого месяца, а грудное вскармливание оказывает защитный эффект от рецидивов приступов [35][36]. В то же время замечена значительная ассоциация между наличием у беременной мигрени и артериальной гипертензии (АГ), в том числе ПЭ, и высоким риском развития ишемических осложнений во время гестации [37][38]. Женщины, страдающие мигренью, имеют повышенный риск рождения детей с низкой массой тела [39]. Наличие мигрени в анамнезе ассоциируется с повышением риска гипертензивных расстройств во время беременности, особенно в случаях, когда приступы цефалгии сохранялись в течение I триместра беременности и применялись лекарства для их купирования. Результаты исследований показывают, что мигрень является потенциальным фактором риска гипертензивных расстройств во время беременности [40]. Более того, у женщин, у которых мигрень усилилась во время беременности, риск гипертонических расстройств был в 13 раз выше, чем у женщин, у которых значительно уменьшилась частота приступов [34]. В основе первичных патогенетических механизмов как мигрени, так и ПЭ лежит эндотелиальная дисфункция с запуском цитокин-опосредованного воспаления и последующей измененной вазореактивностью. Согласно данным проспективного исследования, в котором приняли участие 3373 беременные, было обнаружено, что среди женщин с мигренью риск развития ПЭ был увеличен в 1,53 раза, при этом он значительно повышался, если беременная имела избыточную массу тела [41]. Беременные с эпизодами мигренозных болей в анамнезе имели на 21,3 % выше риск развития ПЭ, причем данный риск увеличивался до 43,8 %, если возраст испытуемой был выше 35 лет [42]. Коморбидными с мигренью расстройствами зачастую являются тревога и депрессия, которые, особенно при мигрени с аурой, могут повысить риск гипертензивных нарушений [43]. Беременные с мигренью в анамнезе чаще предъявляют жалобы на различные нарушения сна [44].
Инсульт – относительно редкое, но опасное осложнение периода гестации. Риск развития ИИ увеличивался в 15, а геморрагического инсульта – в 9,1 раз среди беременных с мигренью [45]. При изучении комбинированного влияния мигрени и АГ на долгосрочный риск сердечно-сосудистых и цереброваскулярных заболеваний были получены следующие данные: мигрень и АГ во время беременности по отдельности повышали риск преждевременной смерти. Риск преждевременной смерти среди женщин, у которых были и мигрень и АГ, был таким же, как и среди женщин только с АГ [46]. Высокая вероятность развития сердечно-сосудистой или цереброваскулярной патологии обусловлена измененной гемодинамикой во время беременности, а также склонностью к гиперкоагуляции в этот период. Мигрень и беременность связаны одним общим состоянием – гиперкоагуляцией. Сам факт наличия мигрени в анамнезе (даже в большей степени, чем фенотип мигрени) является важным моментом при оценке акушерского риска при ведении беременности [47]. При дородовом обследовании женщин необходимо акцентировать внимание на наличие у них в анамнезе первичной ГБ [39], а неврологи, диагностируя мигрень, должны выяснять акушерский анамнез пациентки [32].
Таким образом, мигрень должна рассматриваться с позиций существенного фактора риска сосудистых заболеваний, а сочетание мигрени с АФС и НТ многократно повышает вероятность сердечно-сосудистых осложнений.
Лечение мигрени во время беременности и в период лактации / Migraine treatment during pregnancy and lactation
В период беременности пациенткам с мигренью необходимо рекомендовать полноценный сон, регулярное питание, физические упражнения, поддержание адекватного водно-солевого баланса, следует по возможности стараться избегать приема фармакологических препаратов, учитывая, что подавляющее большинство рекомендаций имеют уровень доказательности консенсуса экспертов. Решение о приеме лекарственных средств должно быть принято, исходя из соотношения риска и пользы [48–52].
Препараты для купирования приступа мигрени / Anti-migraine drugs
Ацетаминофен / Acetaminophen
Ацетаминофен считается самым безопасным средством из всех препаратов для купирования приступа во время беременности и кормления ребенка грудью [35][49][51][52]. Однако есть указание на возможную связь его приема и повышением риска возникновения синдрома дефицита внимания и гиперактивности у ребенка [35][49].
Ацетилсалициловая кислота / Acetylsalicylic acid
Следует избегать применения ацетилсалициловой кислоты (АСК) в III триместре и в дозах более 100 мг/сут, поскольку может быть связь с преждевременным закрытием артериального протока и маловодием. Из-за своего влияния на функцию тромбоцитов АСК также может повышать риск неонатальных кровотечений. Женщинам, кормящим грудью, не рекомендуется применять АСК из-за потенциальной токсичности [35].
Нестероидные противовоспалительные препараты / Non-steroidal anti-inflammatory drugs
Ибупрофен, напроксен и диклофенак можно относительно безопасно использовать в I и II триместрах беременности [35][49][52]. Нестероидные противовоспалительные препараты (НПВП) не рекомендуется применять в III триместре, так как возможно повышение риска возникновения кардиальных пороков, детского церебрального паралича, нарушения функции почек и вентрикулярного кровотечения у новорожденных [35][49][51]. В некоторых исследованиях сообщалось о связи между врожденным пороком развития и пренатальным приемом НПВП в I триместре [35]. Хотя эти данные противоречивы и не находят повсеместного популяционного подтверждения, по возможности следует воздержаться от применения НПВП в I триместре беременности. Селективные ингибиторы циклооксигеназы (ЦОГ) противопоказаны при беременности [35]. Напроксен, индометацин и ибупрофен возможно использовать при грудном вскармливании; предпочтение отдается ибупрофену из-за его короткого периода полувыведения и низкой экскреции с грудным молоком [35].
Кофеин / Caffeine
Прием кофеина считается относительно безопасным [52]. Не рекомендовано использовать комбинированные препараты, содержащие парацетамол, АСК и кофеин. Низкие дозы кофеина считаются безопасными для матери и ребенка при грудном вскармливании [35].
Метоклопрамид / Metoclopramide
Метоклопрамид используется как симптоматическое средство [35][49][52]. Кроме этого, есть данные о его антиноцицептивном действии при мигрени [49][51].
Препараты эрготамина / Ergotamine preparations
Препараты эрготамина противопоказаны из-за повышенного риска прерывания беременности [49][51][52]. В период лактации применение эрготамина не рекомендовано в связи с возможностью подавления секреции пролактина [35][49][51].
Триптаны / Triptans
Безопасность применения триптанов, особенно суматриптана, наиболее тщательно изучена в группах беременных, при этом не была установлена взаимосвязь между приемом препарата и риском развития серьезных врожденных аномалий плода [35]. Триптаны могут быть рассмотрены для купирования приступа мигрени в I и II триместрах беременности, при этом ряд авторов указывают на возможность возникновения самопроизвольного аборта [49–52]. При употреблении триптанов на поздних сроках беременности могут развиться атония матки и послеродовые кровотечения [35].
Кортикостероиды / Corticosteroids
Показаниями для применения кортикостероидов являются частые, тяжело протекающие приступы мигрени и мигренозный статус. В I триместре беременности от их использования лучше воздержаться, а если такой возможности нет, применять только в низких дозах [35][52]. Длительное применение ассоциируется с различными пороками развития и угнетением функции надпочечников у плода/новорожденного [35][49]. Во время кормления грудью преднизолон возможно использовать в низких дозах, так как плоду передается около 1–2 % от дозы, принятой матерью. Более высокие дозы способны подавлять лактацию. Из всех стероидов предпочтителен преднизолон, поскольку он преобразуется плацентой в неактивную форму [35][49][51].
Препараты для профилактического лечения мигрени / Drugs for preventive migraine treatment
Бета-блокаторы / Beta-blockers
Бета-блокаторы, особенно при сочетании с АГ, остаются препаратами выбора во время беременности. Во избежание вероятности развития брадикардии плода и гипотонии матки рекомендуется уменьшить дозу или прекратить прием за несколько дней до родов. Из побочных эффектов, ассоциированных с их использованием, описаны задержка внутриутробного развития, ПР и дыхательная недостаточность [35][49][51]. В связи с низким выделением β-адреноблокаторов с грудным молоком, концентрации в плазме крови младенцев минимальны [35]. Во время кормления грудью предпочтительнее использовать метопролол. Возможными побочными эффектами у ребенка могут быть сонливость, гипогликемия, гипотензия и брадикардия [35].
Ингибиторы ангиотензинпревращающего фермента и антагонисты рецептов анигиотензина II / Angiotensin-converting enzyme inhibitors and angiotensin II receptor antagonists
Лизиноприл и кандесартан считаются противопоказанными на любой стадии беременности в связи со значительными рисками для плода. Кандесартан совместим с грудным вскармливанием, конкретных данных по применению лизиноприла в период лактации нет [35].
Блокаторы кальциевых каналов / Calcium channel blockers
Блокаторы кальциевых каналов (верапамил) относительно безопасно применять на ранних сроках беременности. В связи с возможностью понижения тонуса матки следует избегать их использования на поздних сроках. В период лактации противопоказаны [35][49–52].
Антидепрессанты / Antidepressants
Трициклические антидепрессанты в низких дозах считаются безопасными для применения во время беременности. Применение высоких дозировок сопровождается повышением риска пороков развития. Целесообразно придерживаться самой низкой терапевтически эффективной дозы, которую рекомендовано снизить за 4 недели до планируемых родов [35][49–51]. Использование амитриптилина, возможно, приводит к развитию гестационного сахарного диабета [50]. Применение венлафаксина, особенно на поздних сроках беременности, связано с синдромом отмены у новорожденных [49]. Нет четких указаний на возможный тератогенный или абортивный эффект дулоксетина [35].
Противоэпилептические средства / Antiepileptic medications
Препараты вальпроевой кислоты и топирамат приводят к повышению риска пороков развития плода, в связи с чем они не рекомендованы к применению [35][49][51][52]. Данные о внутриутробном воздействии габапентина ограничены. Есть указание на возможную связь с деформациями скелета у новорожденных, в связи с чем рекомендовано воздерживаться от его назначения [35]. Никаких данных о негативном влиянии габапентина на новорожденного при грудном вскармливании не представлено. Ламотриджин, как правило, хорошо переносится, обладает лучшим профилем безопасности по сравнению с другими противоэпилептическими препаратами и является предпочтительным среди всех антиконвульсантов для женщин детородного возраста. Недавний метаанализ показал, что частота выкидышей, мертворождений, ПР не увеличивается после внутриутробного применения ламотриджина по сравнению с общей популяцией [35]. Аналогичным образом внутриутробное воздействие ламотриджина, по-видимому, не связано с повышением частоты врожденных дефектов и долговременных нарушений развития нервной системы. Сообщений о серьезных побочных эффектах, изменениях когнитивных функций и нарушений физического развития ребенка при применении ламотриджина в период грудного вскармливания не поступало [35].
Препараты из группы моноклональных антител к кальцитонин-ген родственному пептиду / Calcitonin gene-related peptide-specific monoclonal antibody preparations
В настоящее время беременность является противопоказанием к назначению этого класса препаратов ввиду недостатка накопленных данных о безопасности применения среди беременных. Следует прекратить применение моноклональных антител (мАТ) к кальцитонин-ген родственному пептиду (англ. calcitonin gene-related peptide, CGRP) – антагонистов CGRP-рецепторов не менее чем за 5 мес до планируемой беременности [3].
Ботулинический токсин типа А / Botulinum toxin A
Ботулинический токсин типа А (онаботулотоксин А) разрешен к применению во время беременности, но проведенных исследований, особенно с долгосрочным катамнезом, явно недостаточно, чтобы сделать окончательные выводы о безопасности препарата, в связи с чем его использование является скорее исключением, нежели общепринятой практикой [35]. Сообщается о 45 пациентках, получавших онаботулотоксин А в течение 3 мес до даты зачатия. За исключением одного выкидыша в группе лечения, у всех пациенток родились доношенные здоровые дети с нормальной массой тела без пороков развития [53]. Из-за высокой молекулярной массы ботулинический токсин типа А вряд ли может передаваться с грудным молоком, но контролируемых исследований по этому поводу не проводилось. Учитывая приведенные выше данные, можно констатировать, что данный препарат следует применять только для пациентов с тяжелым течением хронической мигрени, резистентной к остальным видам терапии [35].
Пищевые добавки / Nutritional supplements
Коэнзим Q10 и магний возможно использовать при беременности [35][49]. При применении магния свыше 350 мг в сутки возможно развитие транзиторной неврологической симптоматики у новорожденных [35]. Сообщений о негативных последствиях применения коэнзима Q10 не выявлено [35].
Недостаточно доказательств, чтобы делать выводы о пользе или вреде нефармакологических методов лечения, используемых во время беременности, включая иглоукалывание, биологическую обратную связь, релаксационную терапию, физиотерапию и транскраниальную магнитную стимуляцию, хотя результаты некоторых исследований демонстрируют безопасность и эффективность отдельных из вышеуказанных методов [35][48][52].
Профилактика тромботических осложнений у беременных пациенток с тромбофилией и мигренью / Prevention of thrombotic complications in pregnant patients with thrombophilia and migraine
Учитывая взаимоусиливающее воздействие эндотелиального воспаления и гиперкоагуляции, наблюдаемые во время беременности при АФС и НТ, пациенток – носительниц позитивных титров АФА относят к группе высокого риска по тромботическим осложнениям, что требует назначения адекватной терапевтической профилактики для минимизации нежелательных последствий для матери и плода. Оценка возможных факторов риска должна осуществляться строго индивидуально. «Золотым стандартом» терапии АФС во время беременности является назначение АСК в низких дозах (75–100 мг/сут) и/или препаратов из группы низкомолекулярных гепаринов или нефракционированного гепарина [54][55]. Одним из наиболее важных клинических наблюдений за беременными, получавшими профилактическое лечение по поводу повышенного риска тромботических осложнений, стало полное разрешение ГБ после антикоагуляции гепарином или варфарином [56–59]. Ретроспективное наблюдение за 75 пациентами с рефрактерной мигренью и АФС, принимавшими АСК/клопидогрел или апиксабан, показало, что наилучший ответ по регрессу цефалгии был получен в группе, использовавшей антикоагулянт. Авторы указывают на необходимость проведения 2–4-недельного курса антитромботической терапии, обычно начинающегося с антитромбоцитарных препаратов, у позитивных по АФА пациентов с рефрактерной мигренью, особенно если другие варианты лечения были исчерпаны [60]. Рефрактерная ГБ может быть проявлением иммуноопосредованного гиперкоагуляционного расстройства, и необходимо понимать, что потенциальный риск отказа от решения этой проблемы может быть высоким [61]. Мигрень настолько часто ассоциируется с рассматриваемыми гиперкоагуляционными синдромами, что поднимается вопрос о включении данного вида цефалгии в будущие критерии АФС [62].
Заключение / Conclusion
Частая ассоциация АФС и НТ с мигренью, отсутствие четких клинических особенностей мигрени при тромбофилии, репродуктивный возраст пациенток, высокий риск тромботических осложнений диктуют необходимость взаимодействия врачей-неврологов и акушеров-гинекологов для своевременной диагностики заболевания и ведения данной категории пациентов. Влияние различных видов антитромботической терапии на течение мигрени нуждается в уточнении. Перспективными представляются исследования, которые смогут определить, способна ли профилактика приступов мигрени предотвратить неблагоприятные исходы беременности у женщин с мигренью в анамнезе.
Список литературы
1. Steiner T.J., Stovner L.J. Global epidemiology of migraine and its implications for public health and health policy. Nat Rev Neurol. 2023;19(2):109–17. https://doi.org/10.1038/s41582-022-00763-1.
2. Азимова Ю.Э., Амелин А.В., Алферова В.В. и др. Клинические рекомендации «Мигрень». Журнал неврологии и психиатрии имени С.С. Корсакова. 2022;122(1–3):4–36. https://doi.org/10.17116/jnevro20221220134.
3. Сергеев А.В., Табеева Г.Р., Филатова Е.Г. и др. Применение новой биологической патогенетической терапии мигрени в клинической практике: консенсус экспертов Российского общества по изучению головной боли. Неврология, нейропсихиатрия, психосоматика. 2022;14(5):109–16. https://doi.org/10.14412/2074-2711-2022-5-109-116.
4. Табеева Г.Р., Кацарава З., Дмитриев Г.В. и др. Мигрень в реальной клинической практике: результаты наблюдательного исследования паттернов диагностики и лечения среди городского населения Российской Федерации. Журнал неврологии и психиатрии имени С.С. Корсакова. 2021;121(12):40–50. https://doi.org/10.17116/jnevro202112112140.
5. Пожидаев К.А., Парфенов В.А. Магнитнорезонансная томография у пациентов с мигренью: результаты необоснованного назначения. Анналы клинической и экспериментальной неврологии. 2020;14(3):31–5 . https://doi.org/10.25692/ACEN.2020.3.4.
6. Schürks M., Rist P.M., Bigal M.E. et al. Migraine and cardiovascular disease: systematic review and meta-analysis. BMJ. 2009;339:b3914. https://doi.org/10.1136/bmj.b3914.
7. Adelborg K., Szépligeti S.K., Holland-Bill L. et al. Migraine and risk of cardiovascular diseases: Danish population based matched cohort study. BMJ. 2018;360:k96. https://doi.org/10.1136/bmj.k96.
8. Kurth T., Rohmann J.L., Shapiro R.E. Migraine and risk of cardiovascular disease BMJ. 2018;360:k275. https://doi.org/10.1136/bmj.k275.
9. Wood H. Migraine – a risk factor for cardiovascular disease? Nat Rev Neurol. 2018;14(4):194–5. https://doi.org/10.1038/nrneurol.2018.18.
10. Kim C., Schreiner P.J., Yin Z. et al. Migraines, vasomotor symptoms, and cardiovascular disease in the Coronary Artery Risk Development in Young Adults study. Menopause. 2024;31(3):202–8. https://doi.org/10.1097/GME.0000000000002311.
11. Zhang L., Zhang H., Zhou X. et al. Bibliometric analysis of research on migraine-stroke association from 2013 to 2023. J Pain Res. 2023;16:4089–112. https://doi.org/10.2147/JPR.S438745.
12. Табеева Г.Р. Цереброваскулярные расстройства, ассоциированные с мигренью. Медицинский совет. 2017;(10):32–5. https://doi.org/10.21518/2079-701x-2017-10-32-35.
13. Linstra K.M., Ibrahimi K., Terwindt G.M. et al. Migraine and cardiovascular disease in women. Maturitas. 2017;97:28–31. https://doi.org/10.1016/j.maturitas.2016.12.008.
14. Cavestro C., Ferrero M. Migraine in systemic autoimmune diseases. Endocr Metab Immune Disord Drug Targets. 2017;18(2):124–34. https://doi.org/10.2174/1871530317666171124124340.
15. Hassan M., Belavadi R., Gudigopuram S.V.R. et al. Migraine and stroke: in search of shared pathways, mechanisms, and risk factors. Cureus. 2021;13(12):e20202. https://doi.org/10.7759/cureus.20202.
16. Borgdorff P., Tangelder G.J. Migraine: possible role of shear-induced platelet aggregation with serotonin release. Headache. 2012;52(8):1298–318. https://doi.org/10.1111/j.1526-4610.2012.02162.x.
17. Тухфатуллина С.И., Гайнетдинова Д.Д. Ишемические и неишемические проявления при антифосфолипидном синдроме. Казанский медицинский журнал. 2015;96(1):61–9. https://doi.org/10.17750/kmj2015-061.
18. Табеева Г.Р. Мигрень и цереброваскулярная патология. Справочник поликлинического врача. 2014;(3):45.
19. Воскресенская О.Н., Бицадзе В.О., Хизроева Д.Х. и др. Особенности поражения нервной системы при антифосфолипидном синдроме. Акушерство, Гинекология и Репродукция. 2021;15(4):404–14. https://doi.org/10.17749/2313-7347/ob.gyn.rep.2021.242.
20. Asif S., Bali A., Dang A.K. et al. Neurological and neuropsychiatric manifestations of antiphospholipid-antibody syndrome (APS). Cureus. 2022;14(6):e26022. https://doi.org/10.7759/cureus.26022.
21. Wan L., Liu T., Chen T. et al. The high prevalence of abnormal magnetic resonance imaging findings in non-neuropsychiatric patients with persistently positive anti-phospholipid antibodies. Rheumatology (Oxford). 2022;61(SI):SI30–SI38. https://doi.org/10.1093/rheumatology/keab649.
22. Arachchillage D.R.J., Makris M. Inherited thrombophilia and pregnancy complications: should we test? Semin Thromb Hemost. 2019;45(1):50–60. https://doi.org/10.1055/s-0038-1657782.
23. Шаталов А.Е., Петров Ю.А. Тромбофилия как фактор невынашивания беременности. Журнал научных статей «Здоровье и образование в XXI веке». 2019;21(4):63–7. https://doi.org/10.26787/nydha-2226-7425-2019-21-4-63-67.
24. Хамани Н.М., Бицадзе В.О., Каплина О. Ю. и др. Беременность и роды у женщины с гомозиготной мутацией FV Leiden и тромбозом на фоне приема гормональных контрацептивов в анамнезе. Акушерство и гинекология. 2019;(2):175–9. https://doi.org/10.18565/aig.2019.2.175-179.
25. Табеева Г.Р., Васильев С.А., Азимова Ю.Э. Мигрень, ассоциированная с полиморфизмом генов свертывающей системы крови. Неврологический журнал. 2007;12(6):25–9.
26. Cavestro C., Mandrino S. Thrombophilic disorders in migraine. Front Neurol. 2014;5:120. https://doi.org/10.3389/fneur.2014.00120.
27. Schofield J.R., Hassell K.L. What you need to know about migraine in Hughes syndrome patients. Lupus. 2023;32(3):319–24. https://doi.org/10.1177/09612033231153790.
28. Islam M.A., Alam F., Wong K.K. Comorbid association of antiphospholipid antibodies and migraine: a systematic review and meta-analysis. Autoimmun Rev. 2017;16(5):512–22. https://doi.org/10.1016/j.autrev.2017.03.005.
29. Чапаева Н.Н., Маринкин И.О., Айдагулова С.В., Фирман А.А. Эволюция форм и клинических проявлений антифосфолипидного синдрома у женщин. Медицина и образование в Сибири. 2013;1:20–5.
30. Islam M.A., Alam F., Gan S.H. et al. Coexistence of antiphospholipid antibodies and cephalalgia. Cephalalgia. 2018;38(3):568–80. https://doi.org/10.1177/0333102417694881.
31. Гайнетдинова Д.Д., Тухфатуллина С.И. Клиническое и допплерографическое обследование женщин с цефалгией и антифосфолипидным синдромом. Журнал неврологии и психиатрии имени С.С. Корсакова. 2019;119(7):48–53. https://doi.org/10.17116/jnevro201911907148.
32. Дашдамирова Л., Воскресенская О., Хизроева Д. Клинические особенности мигрени при антифосфолипидном синдроме и генетической тромбофилии. Азербайджанский медицинский журнал. 2023;4:28–34. https://doi.org/10.34921/amj.2023.4.004.
33. Maddahi A., Warfvinge K., Holm A. et al. Progesterone distribution in the trigeminal system and its role to modulate sensory neurotransmission: influence of sex. J Headache Pain. 2023;24(1);154. https://doi.org/10.1186/s10194-023-01687-x.
34. Allais G., Castagnoli Gabellari I., Airola G. et al. Is migraine a risk factor in pregnancy? Neurological Sciences. 2007;28 Suppl 2:S184–7. https://doi.org/10.1007/s10072-007-0774-4.
35. Negro A., Delaruelle Z., Ivanova T.A. et al. Headache and pregnancy: a systematic review. J Headache Pain. 2017;18(1):106. https://doi.org/10.1186/s10194-017-0816-0.
36. Allais G., Chiarle G., Sinigaglia S. et al. Migraine during pregnancy and in the puerperium. Neurol Sci. 2019;40(Suppl 1):81–91. https://doi.org/10.1007/s10072-019-03792-9.
37. Faubion S.S., Smith T., Thielen J. et al. Association of migraine and vasomotor symptoms. Mayo Clinic Proceedings. 2023;98(5):701–12. https://doi.org/10.1016/j.mayocp.2023.01.010.
38. Adeney K.L., Williams M.A. Migraine headaches and preeclampsia: an epidemiologic review. Headache. 2006;46(5):794–803. https://doi.org/10.1111/j.1526-4610.2006.00432.x.
39. Facchinetti F., Allais G., Nappi R.E. et al. Migraine is a risk factor for hypertensive disorders in pregnancy: A prospective cohort study. Cephalalgia. 2009;29(3):286–92. https://doi.org/10.1111/j.1468-2982.2008.01704.x.
40. Crowe H.M., Wesselink A.K., Hatch E.E. et al. Migraine and risk of hypertensive disorders of pregnancy: A population-based cohort study. Cephalalgia, 2023;43(4):3331024231161746. https://doi.org/10.1177/03331024231161746.
41. Williams M.A., Peterlin B.L., Gelaye B. et al. Trimester-specific blood pressure levels and hypertensive disorders among pregnant migraineurs. Headache. 2011;51(10):1468–82. https://doi.org/10.1111/j.1526-4610.2011.01961.x.
42. Grossman T.B., Robbins M.S., Govindappagari S., Dayal A.K. Delivery outcomes of patients with acute migraine in pregnancy: A retrospective study. Headache. 2017;57(4):605–11. https://doi.org/10.1111/head.13023.
43. Cripe S.M., Sanchez S., Lam N. et al. Depressive symptoms and migraine comorbidity among pregnant Peruvian women. J Affect Disord. 2010;122(1–2):149–53. https://doi.org/10.1016/j.jad.2009.07.014.
44. Qiu C., Frederick I.O., Sorensen T. et al. Sleep disturbances among pregnant women with history of migraines: A cross-sectional study. Cephalalgia. 2015;35(12):1092–102. https://doi.org/10.1177/0333102415570493.
45. Wabnitz A., Bushnell C. Migraine, cardiovascular disease, and stroke during pregnancy: Systematic review of the literature. Cephalalgia. 2017;35(2):132–9. https://doi.org/10.1177/0333102414554113.
46. Fuglsang C.H., Pedersen L., Schmidt M. et al. Combined impact of migraine and pregnancy-induced hypertension on long-term risk of premature myocardial infarction and stroke. Neurology. 2024;102(1):e207813. https://doi.org/10.1212/WNL.0000000000207813.
47. Purdue-Smithe A.C., Stuart J.J., Farland L.V. et al. Prepregnancy migraine, mmigraine phenotype, and risk of adverse pregnancy outcomes. Neurology. 2003;100(14):e1464–e1473. https://doi.org/10.1212/WNL.0000000000206831.
48. Airola G., Allais G., Gastagnoli Gabellari I. et al. Non-pharmacological management of migraine during pregnancy. Neurol Sci. 2010;31 Suppl 1:S63–5. https://doi.org/10.1007/s10072-010-0276-7.
49. Barus J., Sudharta H., Adriani, D. Study of the mechanisms and therapeutic approaches of migraine in women and pregnancy: A literature review. Cureus. 2023;15(2):e35284. https://doi.org/10.7759/cureus.35284.
50. Sader E., Rayhill M. Headache in pregnancy, the puerperium, and menopause. Semin Neurol. 2018;38(6):627–33. https://doi.org/10.1055/s-0038-1673681.
51. Андреева К.В., Гасраталиева С.М., Рустамова У.Г. Мигрень у беременных. Аллея науки. 2023;1(7):145–56.
52. Карпова М.И., Заряда А.А., Долгушина В.Ф. и др. Мигрень у женщин: клинические и терапевтические аспекты. Журнал неврологии и психиатрии имени С.С. Корсакова. 2019;119(3):98107. https://doi.org/10.17116/jnevro201911903198.
53. Wong H.T., Khalil M., Ahmed F. OnabotulinumtoxinA for chronic migraine during pregnancy: a real world experience on 45 patients. J Headache Pain. 2020;21(1):129. https://doi.org/10.1186/s10194-020-01196-1.
54. Гри Ж.К., Макацария А.Д, Бицадзе В.О. и др. Антифосфолипидный синдром и беременность. Акушерство и гинекология. 2018;(10):5–11. https://doi.org/10.18565/aig.2018.10.5-11.
55. Оруджова Э.А., Самбурова Н.В., Аничкова Е.В. и др. Тромбофилии в патогенезе задержки роста плода. Акушерство, Гинекология и Репродукция. 2021;15(2):189–200. https://doi.org/10.17749/2313-7347/OB.GYN.REP.2021.223.
56. Hughes G.R.V. (2008). Hughes Syndrome (the antiphospholipid syndrome): ten clinical lessons. Autoimm Rev. 2028;7(3):262–6. https://doi.org/10.1016/j.autrev.2007.11.017.
57. Wammes-Van Der Heijden E.A., Tijssen C.C., van’t Hoff A.R., Egberts A.C.G. A thromboembolic predisposition and the effect of anticoagulants on migraine. Headache. 2004;44(5):399–402. https://doi.org/10.1111/j.1526-4610.2004.04090.x.
58. Asherson R.A., Giampaulo D., Singh S., Sulman L. Dramatic response of severe headaches to anticoagulation in a patient with antiphospholipid syndrome. J Clin Rheumatol. 2007;13(3):173–4. https://doi.org/10.1097/RHU.0b013e3180690af6.
59. Nilsson B., Back V., Wei R. et al. Potential antimigraine effects of warfarin: An exploration of biological mechanism with survey of patients. TH Open. 2019;3(2):e180–e189. https://doi.org/10.1055/s-0039-1692989.
60. Schofield J.R., Hughes H.N., Birlea M., Hassell K.L. A trial of antithrombotic therapy in patients with refractory migraine and antiphospholipid antibodies: A retrospective study of 75 patients. Lupus. 2012;30(4):568–77. https://doi.org/10.1177/0961203320983913.
61. Schofield J.R., Hassell K.L. What you need to know about migraine in Hughes syndrome patients. Lupus. 2023;32(3):319–24. https://doi.org/10.1177/09612033231153790.
62. Noureldine M.H.A., Haydar A.A., Berjawi A. et al. Antiphospholipid syndrome (APS) revisited: Would migraine headaches be included in future classification criteria? Immunol Res. 2017;65(1): 230–41. https://doi.org/10.1007/s12026-016-8831-9.
Об авторах
О. Н. ВоскресенскаяРоссия
Воскресенская Ольга Николаевна, д.м.н., проф.
119991 Москва, ул. Трубецкая, д. 8, стр. 2
Л. Р. Дашдамирова
Россия
Дашдамирова Лейла Расим кызы
119991 Москва, ул. Трубецкая, д. 8, стр. 2
Д. Х. Хизроева
Россия
Хизроева Джамиля Хизриевна, д.м.н., проф.
Scopus Author ID: 57194547147.
WoS ResearcherID: F-8384-2017.
119991 Москва, ул. Трубецкая, д. 8, стр. 2
А. Д. Макацария
Россия
Макацария Александр Давидович, д.м.н., проф., академик РАН
Scopus Author ID: 57222220144.
WoS ResearcherID: M-5660-2016.
119991 Москва, ул. Трубецкая, д. 8, стр. 2
В. О. Бицадзе
Россия
Бицадзе Виктория Омаровна, д.м.н., проф., профессор РАН
Scopus Author ID: 6506003478.
WoS ResearcherID: F-8409-2017.
119991 Москва, ул. Трубецкая, д. 8, стр. 2
Что уже известно об этой теме?
► Мигрень – одна из самых распространенных форм первичной головной боли. У пациентов с мигренью повышен риск сердечно-сосудистых и цереброваскулярных заболеваний. Антифосфолипидный синдром (АФС) и наследственная тромбофилия (НТ), вызывающие патологическое течение беременности, в высокой степени ассоциированы с мигренью.
► Мигрень является потенциальным фактором риска гипертензивных расстройств во время беременности.
► При беременности возникает гиперкоагуляция, а сочетание мигрени с АФС и НТ многократно повышает вероятность сердечно-сосудистых осложнений. Четких клинико-диагностических критериев мигрени на фоне АФС и НТ на сегодняшний день не выявлено.
Что нового дает статья?
► Представлены результаты последних исследований о безопасности медикаментозной терапии для купирования и профилактики мигрени во время беременности.
► Применение во время беременности профилактического лечения по поводу повышенного риска тромботических осложнений, связанных с тромбофилией, сопровождается купированием или значительным регрессом мигренозных головных болей, особенно при использовании антикоагулянтов.
► У позитивных по антифосфолипидным антителам (АФА) пациентов с рефрактерной мигренью необходимо проведение 2–4-недельного курса антитромботической терапии.
Как это может повлиять на клиническую практику в обозримом будущем?
► Факт наличия мигрени в анамнезе независимо от ее фенотипа, является важным моментом при оценке акушерского риска при ведении беременности. Неврологи, диагностируя мигрень, должны выяснять акушерский анамнез пациентки.
► Необходимо взаимодействие врачей-неврологов и акушеров-гинекологов для своевременной диагностики заболевания и наблюдения данной категории пациентов.
► В повседневной клинической практике необходимо учитывать эффективность антитромботической терапии на течение рефрактерной мигрени, что является основанием для более широкого ее применения. Перспективными представляются исследования, которые смогут определить, способна ли профилактика приступов мигрени предотвратить неблагоприятные исходы беременности у женщин с мигренью в анамнезе.
Рецензия
Для цитирования:
Воскресенская О.Н., Дашдамирова Л.Р., Хизроева Д.Х., Макацария А.Д., Бицадзе В.О. Мигрень на фоне антифосфолипидного синдрома и наследственной тромбофилии: клинико-диагностические особенности и вопросы терапии в период беременности. Акушерство, Гинекология и Репродукция. 2024;18(5):667-678. https://doi.org/10.17749/2313-7347/ob.gyn.rep.2024.536
For citation:
Voskresenskaya O.N., Dashdamirova L.R., Khizroeva J.Kh., Makatsariya A.D., Bitsadze V.O. Migraine in antiphospholipid syndrome and hereditary thrombophilia: pregnancy-related clinical and diagnostic features and therapeutic issues. Obstetrics, Gynecology and Reproduction. 2024;18(5):667-678. (In Russ.) https://doi.org/10.17749/2313-7347/ob.gyn.rep.2024.536

Контент доступен под лицензией Creative Commons Attribution-NonCommercial-ShareAlike 4.0 International License.











































