Перейти к:
Профилактика преждевременных родов у пациенток с бактериальным вагинозом с использованием комплекса природных антимикробных пептидов и цитокинов
https://doi.org/10.17749/2313-7347/ob.gyn.rep.2024.531
Аннотация
Введение. Распространенность бактериального вагиноза (БВ) составляет 23–29 %. БВ у беременных является известным фактором риска преждевременных родов (ПР) с увеличением их частоты в 2,9 раза. Лечение БВ антибиотиками не снижает частоту ПР, что делает актуальным поиск других средств.
Цель: оценить эффективность лечения, включающего антибактериальную терапию и комплекс природных антимикробных пептидов и цитокинов, для снижения частоты ПР у беременных с БВ.
Материал и методы. Выполнено проспективное открытое сравнительное когортное исследование в параллельных группах. Обследована 101 беременная: группа I (n = 69) получала метронидазол, табл. 500 мг внутрь 2 раза в день в течение 7 дней и комплекс природных антимикробных пептидов и цитокинов (Суперлимф®) суппозитории по 25 ЕД 1 раз в день вагинально вечером в течение 20 дней; группа II (n = 32) получала только метронидазол (по той же схеме). Методы обследования включали клинические, принятые в акушерстве, и лабораторные исследования – микроскопия мазков влагалищного содержимого, полимеразная цепная реакция (ПЦР) в режиме реального времени.
Результаты. Частота ПР (в сроки 240–366 нед ) у пациенток группы I была статистически значимо ниже, чем в группе II и составила 2,9 % против 21,9 % соответственно (р = 0,004) с уменьшением риска ПР в 8 раз (относительный риск (ОР) = 0,13; 95 % доверительный интервал (ДИ) = 0,03–0,60), при этом доля беременных с высоким риском (ПР в анамнезе) и частота ПР у них была сопоставима (р = 0,39) и не отличалась от беременных без ПР в анамнезе. Микробиологического выздоровления после лечения БВ по данным ПЦР в реальном времени удалось добиться у 85,5 % пациенток группы I против 56,3 % в группе II (ОР = 1,52; 95 % ДИ = 1,10–2,10; р = 0,002). Персистенция анаэробной флоры после лечения была значимо ниже в группе I по сравнению с группой II – 7,2 % против 34,4 % (р < 0,001) с риском ПР ниже в 5 раз (ОР = 0,21; 95 % ДИ = 0,08–0,56). Прекращение выделения вирусов от числа пациенток с исходным вирусовыделением было достигнуто у 94,6 % против 8,3 % пациенток соответственно со снижением риска в 50 раз (ОР = 0,02; 95 % ДИ = 0,005–0,08; р < 0,001). Количество новорожденных с массой тела менее 2500 г было существенно меньше у пациенток, получавших Суперлимф® – 2,9 % против 15,6 % среди тех, кто его не применял (р = 0,03), при этом риск рождения маловесных детей был в 6 раз меньше (ОР = 0,16; 95 % ДИ = 0,03–0,88). Состояние детей при рождении по шкале Апгар было сопоставимым.
Заключение. Применение комплекса Суперлимф® (25 ЕД вагинально 1 раз в день № 20) наряду с антибиотиком метронидазол внутрь у беременных с БВ способствует снижению частоты ПР в сроки 240–366 нед до 2,9 % со снижением риска ПР, превосходящим антибактериальную терапию в 8 раз, в том числе у пациенток с ПР в анамнезе.
Ключевые слова
Для цитирования:
Суханов А.А., Дикке Г.Б., Кукарская И.И., Шилова Н.В. Профилактика преждевременных родов у пациенток с бактериальным вагинозом с использованием комплекса природных антимикробных пептидов и цитокинов. Акушерство, Гинекология и Репродукция. 2024;18(3):300-315. https://doi.org/10.17749/2313-7347/ob.gyn.rep.2024.531
For citation:
Sukhanov A.A., Dikke G.B., Kukarskaya I.I., Shilova N.V. Prevention of premature birth in female patients with bacterial vaginosis using a complex of natural antimicrobial peptides and cytokines. Obstetrics, Gynecology and Reproduction. 2024;18(3):300-315. (In Russ.) https://doi.org/10.17749/2313-7347/ob.gyn.rep.2024.531
Введение / Introduction
Распространенность бактериального вагиноза (БВ) варьирует от 20 до 60 % и зависит от географических, расовых и этнических различий исследуемой популяции и использованных критериев верификации диагноза [1]. По данным систематического обзора и метаанализа, БВ является наиболее распространенной формой нарушений вагинальной среды у женщин репродуктивного возраста – в общемировом масштабе она составляет 23–29 % [2]. Сведения о распространенности БВ в Российской Федерации (РФ) ограничены. Так, по данным Центрального НИИ эпидемиологии, у субъективно асимптомных пациенток БВ выявлен у 31 % [3], в популяционном исследовании среди коренных народов Севера ханты и манси – у 7 % [4], а у женщин, проживающих в Республике Дагестан, – у 53 % [5].
Среди беременных распространенность БВ такая же, как и у небеременных и варьирует от 12 до 49 % [2]. Во время беременности у пациенток с БВ нередко возникают акушерские осложнения, в частности, самопроизвольные выкидыши (СПВ, отношение шансов (ОШ) = 9,9), преждевременный разрыв плодных оболочек (ПРПО, ОШ = 2,6) и преждевременные роды (ПР, ОШ = 2,9) [6–8].
По данным систематического обзора и метаанализа 26 исследований, выполненного в 2023 г. и оценившего исходы для матери и плода у беременных с БВ, наиболее частым осложнением были ПР с распространенностью 17,9 % (95 % доверительный интервал (ДИ) = 13,0–23,3 %) [8].
В общей когорте беременных почти половина имеют вагинальный микробиом, классифицированный как микробное сообщество IV (высокое разнообразие), а у одной трети доминируют L. iners [9]. Авторами оценена связь между вагинальной микробиотой на ранних сроках беременности и спонтанными ПР, и риск оказался выше у этих беременных со значениями относительного риска (ОР) 7,7 и 4,1 соответственно. Отмечено также, что носительство G. vaginalis, L. iners, Mobiluncus, A. vaginae и Prevotella amnii, а также других БВ-ассоциированных бактерий было связано со спонтанными ПР.
Исследования, посвященные изучению длины шейки матки – признанного фактора риска ПР у беременных, показали, что во II и начале III триместра короткая шейка матки наблюдалась значительно чаще у пациенток с бóльшим разнообразием микробиоты [10]. Присутствие L. iners, которая является доминирующим видом в вагинальной микробиоте при БВ, было связано с увеличением частоты ПР независимо от длины шейки матки [11].
Распространенность ПР (28–36 нед) в РФ остается стабильной на протяжении последних 10 лет, и в 2018 г. составила 6 % от общего числа родов, в 2022 г. – 5,81 % [12], для сравнения, в мире – 9,9 % всех родов [13]. По данным мировой статистики, 60–70 % недоношенных детей погибают в первые дни жизни. Мёртвыми рождаются в 8–13 раз чаще, чем при доношенных родах, а 50 % недоношенных детей страдают тяжёлыми неврологическими расстройствами и хроническими заболеваниями дыхательной системы [13].
Лечение бессимптомного БВ у беременных в настоящее время остается спорным; до сих пор отсутствуют сведения, позволяющие оценить эффективность лечения в отношении предотвращения ПР. В проведенном метаанализе испытаний было доказано, что лечение бессимптомных беременных не снижает частоту ПР [14].
Для лечения БВ с симптомами у беременных рекомендуют назначение препаратов перорально, допустимо также интравагинальное введение антибиотиков. Вагинальное использование антибиотиков может оказаться неэффективным, если микроорганизмы уже проникли в матку. Зарубежные исследователи рекомендуют применять у беременных системную терапию метронидазолом в связи с необходимостью элиминации возбудителей из вышележащих отделов полового тракта для предупреждения ПР.
Некоторые авторы постулируют, что своевременное и эффективное лечение БВ во время беременности является важным фактором для предотвращения ПР, однако доказательные данные также дают противоречивый результат. По данным систематического обзора и метаанализа Кохрейновского сообщества, терапия антибиотиками эффективна для эрадикации БВ во время беременности (ОР = 0,42), снижает риск позднего выкидыша (ОР = 0,20), но не снижает риск ПР ранее 37 нед или преждевременного излития околоплодных вод [15]. Однако в этом же обзоре на основании двух исследований показано, что у женщин с аномальной вагинальной флорой (промежуточная флора или БВ) лечение может снизить риск ПР до 37 нед на 53 %.
Пероральные антибиотики не более эффективны по сравнению с вагинальными в уменьшении риска ПР. Пероральный прием антибиотиков имел некоторое преимущество перед вагинальным (будь то метронидазол или клиндамицин) в отношении госпитализации новорожденных в неонатальное отделение, продления гестационного возраста (в среднем на 9 дней) и увеличения массы тела при рождении (в среднем на 342 г) [15].
Эффективность введения пробиотиков как оральным, так и вагинальным путем в отношении профилактики ПР хотя и выглядит многообещающей, но пока является неопределенной из-за отсутствия единообразия в применении [16]. Для профилактики ПР Т.Н. Бебнева и Г.Б. Дикке (2019) применяли у беременных с рецидивирующим дисбиозом антибиотикотерапию внутрь с последующим введением пробиотика вагинально и, учитывая высокий риск ПРПО у беременных с БВ (ОР = 7,3), дополнили лечение вагинальным микронизированным прогестероном и отметили снижение частоты ПР на 70 % [17].
Позиционируемое ранее преимущество клиндамицина перед метронидазолом в профилактике ПР не подтверждается метаанализом 2023 г. (23 исследования, 11979 участников, из которых в 13 исследованиях проводился анализ с использованием индивидуальных данных), где показано, что ни метронидазол, ни клиндамицин не оказывали влияния на частоту ПР [18].
Ранее причины трети всех ПР были неизвестны и классифицировались как идиопатические. Сегодня признано, что субклиническая внутриутробная инфекция играет ключевую роль в патогенезе 30–40 % ПР. К децидуальной активации приводит высвобождение провоспалительных цитокинов, включая интерлейкины (англ. interleukin, IL) IL-1β, IL-6 и фактор некроза опухоли альфа (англ. tumor necrosis factor alpha, TNF-α), что связано с БВ [19]. Кроме того, факторы вирулентности, такие как коллагеназы, муциназы и сиалидазы, продуцируемые микроорганизмами при БВ, оказывают литическое воздействие на основное вещество шейки матки, могут синергически действовать, вызывая изменения, которые приводят к ее укорочению [20]. Показано, что существует связь между длиной шейки матки (< 25 мм), БВ, инфекциями мочевыводящих путей и ПРПО с увеличением частоты ПР [21].
Инфицирование микроорганизмами, вызывающими БВ, приводит к воспалению, о чем свидетельствует повышение уровней толл-подобного рецептора (англ. toll-like receptor, TLR) TLR4, TNF-α, IL-1β и IL-6 в околоплодных водах [22]. Высвобождение провоспалительных цитокинов приводит к апоптозу, ПРПО, созреванию шейки матки и началу ПР [23]. Это дает основание для вывода о том, что введение противовоспалительных препаратов может быть перспективным терапевтическим вариантом для предотвращения ПР и улучшения исходов для плода [23]. Предполагается, что риск ПР, скорее всего, повышается за счет сложных взаимодействий хозяин-микроб, а не из-за присутствия одного таксона или состояния разнообразия микробного сообщества. Эффект пероральных антибиотиков был показан у беременных в отношении разрешения БВ и снижения цитокинов IL-1β и IL-6 [23].
Несколькими отечественными исследователями было показано снижение частоты ПР у пациенток, получавших лечение по поводу инфекций мочевыводящих путей с использованием комплекса природных противомикробных пептидов и цитокинов [24–26]. Применение этого средства в составе комплексной терапии пациенток с хроническим эндометритом и нарушением репродуктивной функции на прегравидарном этапе способствовало наступлению беременности и снижению частоты ПР по сравнению в пациентками, получавшими лечение без него (9,3 % против 16,7 % соответственно; р = 0,04) с уменьшением риска рождения недоношенного ребенка почти в 2 раза [27].
Влияние комплекса природных противомикробных пептидов и цитокинов на снижение частоты ПР у беременных с БВ ранее не изучалось.
Цель: оценить эффективность лечения, включающего антибактериальную терапию и комплекс природных противомикробных пептидов и цитокинов, для снижения частоты ПР у беременных с БВ.
Материалы и методы / Materials and Methods
Дизайн исследования / Study design
Проведено проспективное открытое сравнительное когортное исследование в параллельных группах. С февраля 2021 г. по январь 2023 г. на базе женской консультации ГБУЗ ТО «Перинатальный центр» (Тюмень) проведен отбор пациенток, лечение и наблюдение. Статистическая обработка и анализ полученных результатов выполнялись экспертами, которые не были связаны с ведением пациенток, участвующих в исследовании, для создания условий объективной оценки результатов.
Критерии включения и исключения / Inclusion and exclusion criteria
Критерии включения: возраст 18 лет и старше; беременность после 12 нед (II–III триместр); диагноз: бактериальный вагиноз, подтвержденный лабораторным исследованием; подписанное информированное добровольное согласие пациентки на участие в исследовании.
Критерии исключения: возраст до 18 лет; срок беременности до 12 нед гестации; инфекции, передаваемые половым путем (ИППП); тяжелые соматические заболевания; резус-отрицательная кровь; преэклампсия; угроза прерывания беременности; установленная ранее аллергическая реакция и другие побочные эффекты при использовании изучаемых препаратов; наличие противопоказаний; отказ от участия в исследовании.
Этические аспекты / Ethical aspects
Протокол исследования подготовлен с учетом положений Хельсинкской декларации Всемирной медицинской ассоциации (пересмотр 2013 г.), документов «Международные этические рекомендации по проведению биомедицинских исследований с участием людей» Совета международной организации медицинских наук (ред. 2002 г.), «Об утверждении Правил надлежащей клинической практики Евразийского экономического союза» (утверждены Решением Совета Евразийской экономической комиссии от 3 ноября 2016 г. N 79), Приказа Минздрава России от 1 апреля 2016 г. N 200н «Об утверждении правил надлежащей клинической практики», других законодательных и нормативных документов РФ. Все пациентки подписали информированное добровольное согласие на участие в исследовании после предоставления им устных и письменных объяснений относительно исследования.
Расчет выборки и контингент / Sample calculation and patient cohorts
Расчет объема выборки выполняли с помощью программы G*Power (Heinrich-Heine-Universität Düsseldorf, Германия). В расчет были приняты сведения о частоте ПР среди беременных с БВ по данным исследования в РФ, которая составила 25,0 % [17]. Предпринятое в цитируемом исследовании лечение позволило снизить показатель ПР в основной группе до 4,8 %. Учитывали α – значение допустимой ошибки I рода 0,05; β – значение допустимой ошибки II рода 0,2, коэффициент распределения 2/1. Количество пациенток для обеспечения рекомендованной (не менее 80 %) мощности статистического теста для проведения данного исследования должно составлять не менее 64 и 32 пациенток в основной и контрольной группах соответственно. Необходимым условием для принятия такой выборки является включение всей популяции пациентов на условиях intent-to-treat (получающие лечение) в статистический анализ. Для достижения цели исследования первоначально оценено на приемлемость участия в исследовании 200 беременных с диагнозом БВ. Отобрана и включена в окончательный анализ 101 (69 и 32 соответственно) участница. Пациентки с недостающими данными были исключены. Дизайн исследования представлен на рисунке 1.
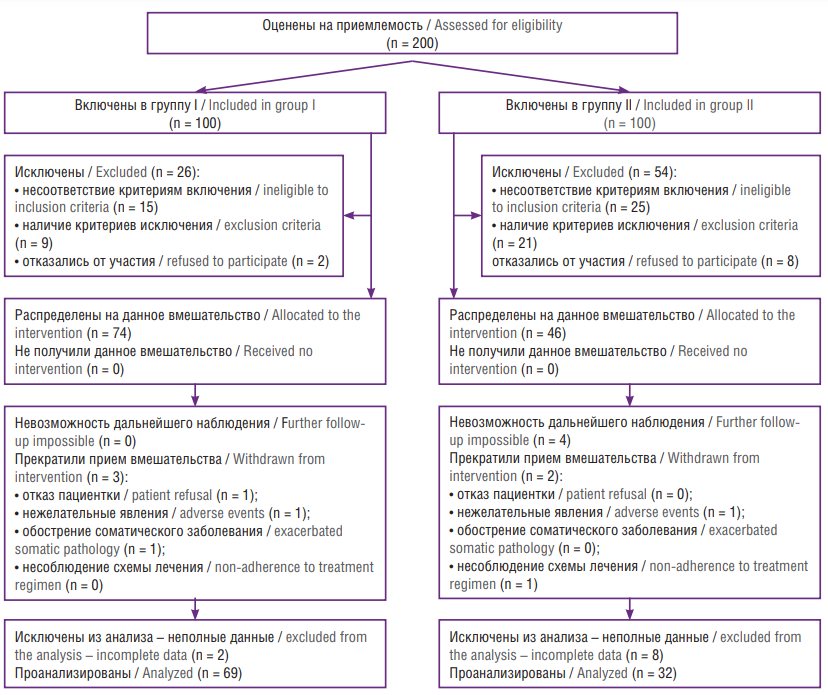
Рисунок 1. Блок-схема дизайна исследования.
Figure 1. Study design flowchart.
Группы пациентов и методы лечения / Patient groups and treatment
Распределение пациенток выполняли на 2 группы случайным методом. Пациентки группы I (n = 69) получали антибиотик метронидазол, табл. 500 мг внутрь 2 раза в день в течение 7 дней (ООО «Озон», Россия; разрешен для применения во время беременности во II–III триместрах) и комплекс экзогенных природных антимикробных пептидов и цитокинов (МНН: белково-пептидный комплекс из лейкоцитов крови свиней – Суперлимф®, ООО «Альтфарм», Россия; применение при беременности возможно) суппозитории по 25 ЕД 1 раз в день вагинально вечером в течение 20 дней. Пациентки группы II (n = 32) получали только антибиотик метронидазол по той же схеме.
Пациентки с высоким риском с момента диагностики длины шейки матки (ДШМ) 25 мм и менее применяли акушерский пессарий.
Методы обследования / Study methods
Применяли клинические, принятые в акушерстве и гинекологии, и лабораторные исследования на этапе отбора пациенток в исследование – опрос (жалобы, анамнез), общее и акушерское обследование, микроскопия мазков влагалищного содержимого (окраска по Граму, ×40, ×100), полимеразная цепная реакция (ПЦР) в режиме реального времени (Фемофлор 16, ООО «ДНК-Технология», Россия).
Пациенткам с высоким риском ПР (ПР в анамнезе) проводили УЗ-мониторинг ДШМ с 13–14 нед каждые 2 нед.
Безопасность лечения (наличие/отсутствие побочных эффектов) оценивали на основании дневников наблюдения, которые пациентки заполняли самостоятельно и предъявляли врачу-исследователю на каждом визите.
Наблюдение проводили на протяжении беременности до родов с оценкой первичных и вторичных результатов лечения. Сведения о результатах получали путем выкопировки из индивидуальных карт беременной и родильницы (уч. форма № 111/у-20), медицинских карт беременной, роженицы и родильницы, получающей медицинскую помощь в стационарных условиях (№ 096/у-20) и историй развития новорожденных (№ 097–1/у-97). Данные внесены в электронную базу (предварительно анонимизированы) и подвергались проверке специалистом-статистиком на готовность к анализу (удалялись пациентки с неполными данными).
Оценка результатов / Data assessment
Первичные исходы – частота ПР (240–366 нед) и срочных родов (370–416 нед), продолжительность гестации (нед). Вторичные исходы – частота микробиологического выздоровления после лечения БВ, состояние новорожденного (масса тела, шкала Апгар). Критерием микробиологического выздоровления считали достижение состояния нормоценоза с преобладанием лактобактерий не менее 80 % в общей бактериальной массе по данным ПЦР в реальном времени.
Статистический анализ / Statistical analysis
Использовали пакет программ SPSS Statistics Version 25,0 (IBM, США; лицензия № Z125-3301-14). Критерий Колмогорова–Смирнова применяли для оценки закона распределения количественных признаков. Количественные показатели представляли в формате медианы (Ме) с межквартильным диапазоном (Q25; Q75), качественные признаки указывали в абсолютных числах (n) и относительных величинах (%). Анализ различий количественных показателей в независимых выборках проводили с помощью U-критерия Манна–Уитни, качественных – при помощи критерия χ2 с поправкой Йейтса на непрерывность. Значимость динамических изменений количественных показателей зависимых выборок оценивали с помощью критерия Уилкоксона. Различия считали значимыми при р < 0,05 (ошибки первого и второго рода α = 5 % и β = 20 % соответственно). Зависимость вмешательства и исхода определяли путем расчета отношения рисков (ОР) с 95 % доверительным интервалом (ДИ). Величину эффекта оценивали путем расчета разницы абсолютных рисков (аРР) или разницы медиан с 95 % ДИ. Для расчета разности медиан использовали оценку Ходжеса–Лемана, рассчитанную с помощью пакета «NPSM», для расчета разницы рисков применяли пакет «FMSB» для программы R – статистическое программирование в среде RStudio (Posit Software, США).
Результаты / Results
Общие сведения о пациентках / General patient characteristics
Возраст пациенток варьировал от 18 до 45 лет, Ме = 35,0 (32,0; 38,0) и 35,0 (33,0; 37,0) лет в группах I и II соответственно (р = 0,72). Социальная и клиническая характеристика пациенток представлены в таблице 1, анализ которой показал отсутствие статистически значимых различий между показателями в группах I и II.
Как можно видеть, большинство пациенток были работающими, замужними, без отягощенной наследственности, с нормальным менструальным циклом. У половины из них не было родов, а у рожавших в большинстве наблюдений было по 2 и более родов. Около 20 % в прошлом перенесли ИППП. Преждевременные роды в анамнезе были у каждой третьей-четвертой женщины.
Таблица 1. Социальная и клиническая характеристика пациенток с бактериальным вагинозом.
Table 1. Social and clinical characteristics of patients with bacterial vaginosis.
Показатель Parameter | Группа I Group I n = 69 | Группа II Group II n = 32 | р |
Образование и социальный статус / Education and social status, n (%) | |||
Высшее, ученая степень / Higher, academic degree | 31 (44,9) | 13 (40,6) | 0,22 |
Среднее специальное, среднее / Secondary specialized education | 38 (55,1) | 19 (59,4) | |
Работает / Employed | 45 (65,2) | 20 (62,5) | 0,79 |
Домохозяйка / Householder | 24 (34,8) | 12 (37,5) | |
Семейное положение / Family status, n (%) | |||
Замужем / Married | 40 (58,0) | 22 (68,8) | 0,36 |
Не замужем / Single | 18 (26,1) | 8 (25,0) | |
Разведена, вдова / Divorced, widow | 11 (15,9) | 2 (6,2) | |
Отягощающие наследственные факторы / Aggravating hereditary factors, n (%) | |||
Наследственность не отягощена / Genetic background not burdened | 37 (53,6) | 19 (59,4) | 0,29 |
Наследственность отягощена / Genetic background burdened: сахарный диабет / disbetes mellitus заболевания сердечно-сосудистой системы / cardiovascular diseases | 23 (33,3) | 6 (18,8) | |
8 (11,6) | 5 (15,6) | ||
Наличие профессиональных вредностей / Occupational hazards | 28 (40,6) | 15 (46,9) | 0,55 |
Показатель Parameter | Группа I Group I n = 69 | Группа II Group II n = 32 | р |
Менструальная и половая функции / Menstrual and sexual functions | |||
Менархе, лет, Ме (Q25; Q75) / Menarche, years, Ме (Q25; Q75) | 14 (13; 14) | 14 (13; 14) | 0,46 |
Продолжительность менструаций, дней, Ме (Q25; Q75) Duration of menstruation, days, Ме (Q25; Q75) | 5 (5; 7) | 6 (5; 6) | 0,86 |
Менструальный цикл, дней, Ме (Q25; Q75) / Menstrual cycle, days, Ме (Q25; Q75) | 29 (28; 30) | 30 (30; 30) | 0,30 |
Объем менструаций, n (%) / Volume of menstruation, n (%): умеренные / moderate скудные / hypomenorrhea обильные / excessive | 50 (73,5) | 27 (84,4) | 0,48 |
3 (4,4) | 1 (3,1) | ||
15 (22,1) | 4 (12,5) | ||
Нерегулярный характер менструаций, n (%) / Irregular menstruation, n (%) | 9 (13,2) | 5 (15,6) | 0,76 |
Коитархе, лет, Ме (Q25; Q75) / Coitarche, years, Ме (Q25; Q75) | 18 (18; 18) | 18 (18; 18) | 0,58 |
Коитархе до 18 лет, n (%) / Coitarche under 18, n (%) | 15 (21,7) | 4 (12,5) | 0,27 |
Репродуктивная функция / Reproductive function, n (%) | |||
Не было родов / No delivery | 36 (52,2) | 15 (46,9) | 0,62 |
Одни роды / Birth 1 | 7 (10,1) | 2 (6,2) | |
Двое родов и более / At least 2 births | 26 (37,7) | 15 (46,9) | |
Аборты / Abortions | 23 (33,3) | 9 (28,1) | 0,60 |
Выкидыши / Miscarriages | 6 (8,7) | 6 (18,8) | 0,19 |
Преждевременные роды в анамнезе / Preterm delivery in history | 18 (26,1) | 11 (34,4) | 0,65 |
Гинекологические заболевания в анамнезе / Gynecological diseases in history, n (%) | |||
Отсутствуют / None | 27 (39,1) | 14 (43,8) | 0,81 |
Инфекции, передаваемые половым путем / Sexually transmitted infections | 15 (21,7) | 5 (15,6) | |
Воспалительные заболевания органов малого таза / Pelvic inflammatory diseases | 4 (5,8) | 1 (3,1) | |
Нарушения менструального цикла / Menstrual disorders | 23 (33,3) | 12 (37,5) | |
Операции на органах малого таза / Pelvic organ surgeries, n (%) | |||
Отсутствуют / None | 7 (10,1) | 2 (6,2) | 0,81 |
Внутриматочные вмешательства с лечебно-диагностической целью (гистероскопия) Intrauterine interventions for diagnostic and treatment purposes (hysteroscopy) | 46 (66,7) | 22 (68,8) | |
Лапароскопия / Laparoscopy | 16 (23,2) | 8 (25,0) | |
Соматические заболевания в анамнезе / Somatic diseases in history, n (%) | |||
Отсутствуют / None | 39 (56,5) | 16 (50,0) | 0,63 |
Болезни органов дыхания / Respiratory diseases | 5 (7,2) | 1 (3,1) | |
Болезни органов пищеварения / Digestive system diseases | 5 (7,2) | 2 (6,2) | |
Болезни сердечно-сосудистой системы / Cardiovascular diseases | 20 (29,0) | 13 (40,6) | |
Примечание: разность показателей оценивали по критерию χ2.
Note: inter-group parameter difference was assessed using the χ2 criterion.
Оценка эффективности лечения / Evaluation of treatment effectiveness
Первичные исходы / Primary endpoints
Частота ПР и продолжительность гестации представлены в таблице 2. Анализ показал, что частота ПР в группе I была статистически значимо ниже, чем в группе II – 2,9 % против 21,9 % соответственно с уменьшением риска ПР в 8 раз (ОР = 0,13; 95 % ДИ = 0,03–0,60), при этом доля беременных с ПР в анамнезе была сопоставима (р = 0,39).
Учитывая наличие в группах беременных с высоким риском (ПР в анамнезе), количество которых составляло 18/69 (26,1 %) и 11/32 (34,4 %) в группах I и II соответственно, оценили отдельно у них частоту ПР (табл. 3). Укорочение ДШМ у них диагностировано в среднем в сроках 22,0 (21,5; 24,5) нед со средним показателем 24,5 (24,0; 28,6) мм. Средний срок родоразрешения составил 32,0 (29,0; 34,8) нед.
В группе I частота ПР составила 1/69 (1,5 %), в группе II – 4/32 (12,5%) без статистически значимой разницы (ОР = 0,12; 95 % ДИ = 0,01–1,0; р = 0,10). Также статистически значимой разницы не было по сравнению с пациентками без ПР в анамнезе: в группе I ОР = 1,06 (95 % ДИ = 0,06–15,67; р = 1,0) и в группе II ОР = 1,33 (95 % ДИ = 0,32–5,49; р = 1,0). Срок гестации при родоразрешении в обеих группах у пациенток с ПР в анамнезе был сопоставим – 32 (32; 32) и 30 (30; 31) нед (р = 0,47).
Таблица 2. Исходы беременностей у пациенток с бактериальным вагинозом.
Table 2. Pregnancy outcomes in patients with bacterial vaginosis.
Показатель Parameter | Группа I Group I n = 69 | Группа II Group II n = 32 | ОР (95 % ДИ) RR (95 % CI) | аРР, РМ (95 % ДИ) (95 % CI) | р |
Преждевременные роды, 240–366 нед, n (%) Premature birth, 240–366 weeks, n (%) | 2 (2,9) | 7 (21,9) | 0,13 (0,03–0,60) | аРР = 0,19 (0,04–0,34) | 0,004* |
Срочные роды, 370–416 нед, n (%) Urgent delivery, 370–416 weeks, n (%) | 67 (97,1) | 25 (78,1) | 1,24 (1,03–1,50) | аРР = –0,19 (–0,34– –0,04) | |
Срок гестации, нед, Ме (Q25; Q75) Gestational age, weeks, Ме (Q25; Q75) | 39 (38; 40) | 38 (37; 39) | – | РМ = 2,0 (1,54–2,46) | 0,02** |
Примечание: различие показателей оценивалось по критерию *χ2 и **Манна – Уитни, разница в эффекте оценивалась по критерию Ходжеса–Лемана; ОР – относительный риск, аРР – разность абсолютных рисков; РМ – разность медиан; ДИ – доверительный интервал.
Note: inter-group parameter difference was evaluated by the *χ2 and **Mann – Whitney criteria, the effect-related difference was evaluated by using the Hodges–Lehman criterion; RR – relative risk, aPP – the difference in absolute risks; RM – median difference; CI – confidence interval.
Таблица 3. Исходы беременностей у пациенток с бактериальным вагинозом и высоким риском преждевременных родов.
Table 3. Pregnancy outcomes in patients with bacterial vaginosis and a high risk of premature birth.
Показатель Parameter | Группа I Group I n = 69 | Группа II Group II n = 32 | ОР (95 % ДИ) RR (95 % CI) | аРР, РМ (95 % ДИ) (95 % CI) | р |
Преждевременные роды в анамнезе, n (%) History of premature birth, n (%) | 18 (26,1) | 11 (34,4) | 0,78 | –0,08 | 0,65 |
Преждевременные роды 240–366 нед у пациенток с высоким риском, n (%) Premature birth in high-risk patients at gestational age of 240–366 weeks, n (%) | 1 (1,5) | 4 (12,5) | 0,12 | –0,11 | 0,06 |
Преждевременные роды 240–366 нед у пациенток без высокого риска, n (%) Premature birth in patients without high risk at gestational age of 240–366 weeks, n (%) | 1 (1,5) | 3 (9,4) | 0,16 | –0,08 | 0,18 |
ОР (95 % ДИ) OR (95 % CI) | 1,06 (0,06–15,67) | 1,33 (0,32–5,49) | – | – | – |
р | 1,0 | 1,0 | – | – | – |
Примечание: ОР – относительный риск; аРР – разность абсолютных рисков; РМ – разность медиан; ДИ – доверительный интервал; различие показателей оценивалось по критерию χ2.
Note: RR – relative risk; aРР – the difference in absolute risks; RM – median difference; CI – confidence interval; inter-group difference was evaluated using the criterion χ2.
Вторичные исходы / Secondary endpoints
Частота микробиологического выздоровления после лечения БВ по данным ПЦР в реальном времени представлена в таблице 4, из которой видно, что нормоценоза удалось добиться у 85,5 % пациенток из группы I против 56,3 % в группе II. Вероятность микробиологического выздоровления у пациенток, принимавших Суперлимф®, была в 1,5 раза выше по сравнению с пациентками, которые лечились только антибиотиком (ОР = 1,52; 95 % ДИ = 1,10–2,10; р = 0,002).
Эрадикация анаэробных микроорганизмов произошла у 18/29 (62,1 %) пациенток, получавших метронидазол, тогда как при дополнении лечения препаратом Суперлимф® эрадикация была достигнута у 56/61 (91,8 %), что было статистически значимо выше. Риск обнаружить анаэробную флору у пациенток, пролеченных с использованием препарат Суперлимф®, был в 4,5 раз ниже по сравнению с теми, кто получал только метронидазол (ОР = 0,22; 95 % ДИ = 0,08–0,57).
Персистенция анаэробной флоры после лечения была значимо ниже в группе I по сравнению с группой II – 7,2 % против 34,4 % (р < 0,001) с риском ниже почти в 5 раз (ОР = 0,21; 95 % ДИ = 0,08–0,56).
Существенным является прекращение вирусовыделения у беременных, получавших Суперлимф®: от числа пациенток с исходным вирусовыделением оно было достигнуто у 94,6 % против 8,3% пациенток соответственно (р < 0,001). Изначально в структуре вирусов преобладали вирусы простого герпеса 1-го и 2-го типов (ВПГ-1 и ВПГ-2) в 80 % наблюдений, остальные включали цитомегаловирус (ЦМФ), Эпштейн-Барр и вирус папилломы человека (ВПЧ) – по 50 % (у 45 % пациенток имело место сочетание нескольких видов вирусов). Шансы обнаружить вирусы после комбинированного лечения были в 50 раз ниже по сравнению с лечением метронидазолом (ОР = 0,02; 95 % ДИ = 0,01–0,08; р < 0,001).
Таблица 4. Динамика структуры микробиоты влагалища в результате лечения.
Table 4. Dynamics in post-treatment vaginal microbiota pattern.
Показатель Parameter | Группа I / Group I n = 69 | Группа II / Group II n = 32 | ||||||
До лечения Before treatment n (%) | После лечения After treatment n (%) | Δ, % | р | До лечения Before treatment n (%) | После лечения After treatment n (%) | Δ, % | р | |
Нормоценоз* Normocenosis* | 0 (0,0) | 59 (85,5) | – | < 0,001 | 0 (0,0) | 18 (56,3)1 | – | 0,002 |
Анаэробные Anaerobic spp. | 61 (88,4) | 5 (7,2) | 54/61 (91,8) | < 0,001 | 29 (90,6) | 11 (34,4)2 | 18/29 (62,1) | < 0,001 |
Candida spp. | 14 (20,3) | 3 (4,3) | 11/14 (78,6) | < 0,001 | 10 (31,2) | 3 (9,4)3 | 7/10 (30,0) | 0,02 |
Другие УПМ Other OpM | 31 (44,9) | 0 (0,0) | 31/31 (100,0) | < 0,001 | 12 (38,7) | 0 (0,0) | 12/12 (100,0) | < 0,001 |
Вирусы Viruses | 56 (81,2) | 3 (4,4) | 53/56 (94,6) | < 0,001 | 24 (75,0) | 22 (68,8)1 | 2/24 (8,3) | 0,78 |
Примечание: УПМ – условно-патогенные микроорганизмы; Δ, % – количество пациенток с эрадикацией микроорганизмов и их доля (процент от исходного); разность показателей оценивалась по критерию χ2; *нормоценоз – количество лактобактерий в общей бактериальной массе 80 % и более. До лечения статистически значимой разницы между показателями групп I и II не было; после лечения: 1 – р < 0,001; 2 – р = 0,001; 3 – р = 0,38.
Note: OpM – opportunistic microorganisms; Δ, % – the number of patients with microbial eradication and and relevant proportion (percentage out of baseline); inter-group difference was evaluated using the criterion χ2; *normocenosis – Lactobacillus prevalence in total bacterial mass at least 80 %. No significant
pre-treatment inter-group difference; post-treatment: 1 – р < 0.001; 2 – р = 0.001; 3 – р = 0.38.
Оценка состояния новорожденных / Newborn assessment
Характеристики родившихся детей представлены в таблице 5.
Таблица 5. Антропометрические показатели и состояние новорожденных у пациенток с бактериальным вагинозом.
Table 5. Newborn anthropometric parameters and condition in paired female patients with bacterial vaginosis.
Показатель Parameter | Группа I / Group I Ме (Q1; Q3) n = 69 | Группа II / Group II Ме (Q1; Q3) n = 32 | Разность медиан (95 % ДИ) Median difference (95% CI) | p |
Масса тела при рождении, г Birth weight, g | 3500 (3200; 3640) | 3400 (3075; 3500) | 125,0 (47,7–297,8) | 0,05 |
Апгар 1 мин, баллы Apgar 1 min, points | 8 (8; 8) | 8 (7; 8) | 3,45×10–5 (3,45×10–5–3,45×10–5) | 0,18 |
Апгар 5 мин, баллы Apgar 5 min, points | 8 (8; 8) | 8 (8; 8) | 2,49×10–5 (2,49×10–5–2,49×10–5) | 0,23 |
Примечание: разность показателей оценивалась по критерию Манна–Уитни, разница в эффекте оценивалась путем расчета оценки Ходжеса–Лемана.
Note: inter-group difference was estimated using the Mann–Whitney criterion, effect difference was estimated by calculating the Hodges–Lehman score.
Масса тела детей при рождении была на 125,0 (47,7; 297,8) г больше в группе I по сравнению с группой II (р = 0,05). Количество новорожденных с весом менее 2500 г было существенно меньше у пациенток, получавших Суперлимф® – 2/69 (2,9 %) против 5/32 (15,6 %) среди тех, кто его не применял (р = 0,03), при этом риск рождения маловесных детей был в 5 раз меньше (ОР = 0,19; 95 % ДИ = 0,04–0,91). Состояние детей при рождении по шкале Апгар было сопоставимым.
Безопасность / Safety
Лечение практически все пациентки переносили хорошо. Выявлено по одному случаю нежелательных явлений в каждой группе средней тяжести, связанное с приемом метронидазола, что потребовало отмены лекарства.
Таким образом, исследование показало, что применение комплекса Суперлимф® наряду с метронидазолом внутрь у беременных с БВ способствует снижению частоты ПР до 2,9 %, и показана зависимость частоты ПР от проведенного лечения со снижением риска ПР в 8 раз по сравнению с беременными, принимавшими только метронидазол.
Обсуждение / Discussion
Бактериальный вагиноз чаще встречается у беременных с симптомами по сравнению с бессимптомными (35,1 % против 16,8 %), а также в выборках II триместра по сравнению с I (23,7 % против 17,6 %) [28]. Инфекция, вызванная ВПГ-2, увеличивает риск БВ (ОР = 1,73; 95 % ДИ = 1,12–2,65) [29]. Предполагают, что биологический механизм этой ассоциации заключается в том, что выделение генитального герпеса усиливает воспаление, что приводит к увеличению присутствия и количества бактерий, связанных с БВ [30]. У ВПЧ-положительных беременных также имеет место высокий риск дисбиоза влагалища с увеличением его частоты до 38,7 % [17].
В настоящем исследовании лечение с использованием метронидазола и препарата Суперлимф® повышало вероятность микробиологического выздоровления в 1,5 раза по сравнению с лечением только метронидазолом. Эрадикация анаэробных микроорганизмов произошла у 62,1 % пациенток, получавших метронидазол, что совпадает с результатом в исследовании C.M. Mitchell с соавт. (62,3 %) [30], тогда как при дополнении лечения препаратом Суперлимф® эрадикация была достигнута у 91,8 %, что было статистически значимо выше. Хотя, по данным метаанализа лечение метронидазолом по сравнению с плацебо увеличивало шансы на эрадикацию в 5,9 раз (ОР = 0,17; 95 % ДИ = 0,15–0,20; 10 исследований) [31], лечение комбинацией метронидазол/Суперлимф® по сравнению с метронидазолом увеличивало шансы на эрадикацию еще в 4,5 раз (ОР = 0,22; 95 % ДИ = 0,08–0,57). Этот результат представляется важным с точки зрения реакции иммунной системы – присутствие БВ-ассоциированных бактерий во влагалище вызывает повышение уровней провоспалительных цитокинов, стимулирующих локальную секрецию простагландина, который связан с ПР [32]. Кроме того, в исследованиях показано, что присутствие лактобактерий во влагалищной среде снижает риск ПР [33]. Достижение нормоценоза с преобладанием лактобактерий у 85,5 % пациенток из группы I, вероятно, также вносит свой вклад в профилактику ПР у вылеченных пациенток.
Прекращение выделения вирусов было достигнуто в настоящем исследовании у 94,6 % против 8,3% пациенток соответственно (р < 0,001). Шансы обнаружить вирусы после комбинированного лечения метронидазолом/Суперлимф® были в 50 раз ниже по сравнению с метронидазолом. Влияние какого-либо лечения на прекращение выделения вирусов, в том числе ВПГ, у пациенток с БВ в публикациях найти не удалось. Имеется сообщение, что наличие ВПГ-2 независимо связано с потерей лактобактерий, продуцирующих молочную кислоту и перекись водорода [34]; следовательно, прекращение его выделения вероятно вносит вклад в восстановление нормальной микрофлоры во влагалище. Кроме того, воспаление, вызванное ВПГ, ЦМФ и ВПЧ, поддерживается высоким уровнем секреции провоспалительных цитокинов, роль которых в инициации ПР связана с ремоделированием шейки матки, что показано в нескольких исследованиях по данным обзора [35].
Влияние препарата Суперлимф® на предупреждение ПР было показано в нескольких отечественных исследованиях среди беременных с инфекциями мочеполовых путей (ИМП). Так, С.П. Синчихин с соавт. (2023) показали, что у беременных с бессимптомной бактериурией, которые получали терапию, включающую антибиотики, комплекс антимикробных пептидов и цитокинов (интравагинально по 1 свече 10 ЕД 2 раза в день, всего 10 дней) в сочетании с фитопрепаратом, частота ПР была в 2,9 раза ниже (3,1 % против 9,1 % соответственно) [24]. В исследовании В.Л. Тютюнника с соавт. (2022) у пациенток с аналогичным диагнозом лечение антибиотиками в сочетании с комплексом антимикробных пептидов и цитокинов (по той же схеме) привело к снижению частоты ПР в 4 раза по сравнению с получавшими только антибиотики (5,6 % против 22,7 % соответственно) и в 2 раза к снижению частоты ПРПО (18 % против 36,4 % соответственно) [25]. У беременных с рецидивом хронического неосложненного цистита во II или III триместре беременности (с 16-й по 32-ю неделю) лечение антибиотиками в сочетании с комплексом антимикробных пептидов и цитокинов (схема та же) позволило уменьшить частоту ПР в 2,5 раза по сравнению с получавшими только антибиотики (8,0 % против 20 % соответственно) [26].
В настоящем исследовании показано, что под влиянием комплекса Суперлимф® (интравагинально по 1 свече 25 ЕД 1 раз в день, в течение 20 дней) наряду с метронидазолом внутрь, у беременных с БВ частота ПР в сроки 240–366 нед была снижена до 2,9 % по сравнению с 21,9 % у пациенток без комплекса Суперлимф®, что означало снижение риска ПР в 8 раз по сравнению с получавшими только антибиотики (для сравнения: популяционная частота ПР в России в 2022 г. – 5,8 %, в Кемеровской области – 8,4 % [36]). Применение комбинации метронидазол/Суперлимф® оказалось почти в 2 раза более эффективным, чем клиндамицина и микронизированного прогестерона вагинально в исследовании Т.Н. Бебневой и Г.Б. Дикке у беременных с БВ, в котором частота ПР составила 4,8 % против 19,4 % без него [17].
Особую озабоченность представляли пациентки с высоким риском досрочного завершения беременности в связи с наличием ПР в анамнезе. Этим пациенткам в настоящем исследовании не назначался микронизированный прогестерон вагинально, так как систематический обзор и метаанализ 10 рандомизированных клинических исследований (2958 женщин), выполненный в 2022 г., не выявил доказательств, подтверждающих, что его использование предотвращает повторные ПР или улучшает перинатальные исходы (относительный риск ПР < 37 нед – 0,96, 95 % ДИ = 0,84–1,09 и < 34 нед – 0,90, 95 % ДИ = 0,71–1,15) [37]. Результаты применения Суперлимфа® у этих женщин оказались положительными как и в общей когорте – частота ПР не имела статистически значимой разницы по сравнению с пациентками без ПР в анамнезе.
Столь эффективное действие препарата Суперлимф® в отношении излечения БВ и профилактики ПР объясняется его составом, оказывающим патогенетическое действие – антимикробное, иммуномодулирующее и регенерирующее, а также, вероятно, дозой препарата и продолжительностью его применения, в результате чего профилактическое действие в отношении ПР в настоящем исследовании было в 2–3 раза выше по сравнению с указанными выше исследованиями.
Суперлимф®, разработанный в 1987 г., представляет собой белково-пептидный комплекс, получаемый из лейкоцитов крови свиней, и содержит секретóм – супернатант биоактивных молекул, секретируемый мононуклеарными клетками периферической крови (Т-, В- и NK-клетками, моноцитами и дендритными клетками). Его применение, по сути, представляет собой новое направление регенеративной медицины – бесклеточные технологии, обеспечивающие противовоспалительные, проангиогенные и трофические эффекты без использования самих клеток (в отличие от терапии стволовыми клетками). В 2015 г. секретóмная терапия была названа «прорывом в регенеративной медицине» [38].
Антимикробные пептиды (АМП) – молекулы, обладающие антибактериальной активностью, являющиеся ключевым компонентом систем иммунной защиты организмов: в составе комплекса содержится мощный и наиболее изученный протегрин-1, содержащий аминокислотные остатки, соединенные двумя дисульфидными мостиками. АМП действуют на грамотрицательные, грамположительные бактерии, грибы, вирусы и простейшие, в том числе и в отношении штаммов бактерий, устойчивых к антибиотикам [38]. Они активируют внутриклеточные механизмы гибели микроорганизмов – способствуют разрушению целостности бактериальной и вирусной оболочки (образование пор), ингибируют синтез ДНК, активность рибосом и ферментов, участвующих в репарации бактериальной клетки, и активируют выход лизосомальных ферментов (катепсина Д) из лизосом лейкоцитов [39].
Цитокины – небольшие пептидные информационные молекулы, включающие хемокины, интерфероны, интерлейкины (ранее общее название – лимфокины) и факторы некроза опухоли [38]. Суперлимф® обладает широким спектром влияния на клетки, участвующие в реакциях врожденного иммунитета: макрофаги, нейтрофилы и естественные киллеры. Разрешение воспалительной реакции происходит за счет подавления экспрессии эндогенных хемокинов противовоспалительными цитокинами IL-4 и IL-10 [40]. Изменение собственного цитокинового фона тканей под действием экзогенных цитокинов приводит к тому, что воспалительная реакция приобретает локальный и менее выраженный характер [41], а секретóм мононуклеарных клеток периферической крови оказывает выраженное репаративное действие на ткани, поврежденные воспалением, в результате активации тканеспецифичных клеток-предшественников, что приводит к регенерации [38].
Путь введения препарата максимально приближен к очагу воспаления – вагинальный, что обеспечивается удобной формой выпуска в виде торпедоподобной суппозитории. Известно, что влагалище является предпочтительным способом неинвазивной контролируемой доставки препаратов, предназначенных как для местного, так и для системного действия. Этот путь предполагает ряд преимуществ по сравнению с другими путями доставки лекарств, однако компоненты лекарственного средства Суперлимф® не проникают в кровоток и не оказывают системного действия. Механизм его заключается не в воздействии молекул непосредственно на клетки и ткани, как у большинства лекарственных препаратов, а состоит в стимуляции собственных клеток лимфоидного ряда, участвующих в реакциях врожденного и адаптивного иммунитета. Это действие обеспечивается «хоуминг-эффектом» – сродством лимфоцитов к рецепторам (адрессинам) эндотелия венул, дренирующих слизистые оболочки «домашнего региона», в частности, женского урогенитального тракта. Данный эффект обеспечивается миграцией «специализированных» (дифференцированных) лимфоцитов – стимулированных антигенами Т-лимфоцитов в лимфоузлах обратно в очаг инфекции, что и приводит к эффективной эрадикации возбудителей инфекции и противовоспалительному действию [42]. Благодаря описанному эффекту возможно введение препарата Суперлимф® не только вагинально, но и ректально по выбору пациентки, поскольку механизм влияния на стимуляцию Т-лимфоцитов будет таким же, как описано выше.
Вопрос о возможности применения препарата Супер-лимф® во время беременности решен положительно, что отражено в инструкции по медицинскому применению препарата и обосновано доклиническими исследованиями, проведенными в Национальном исследовательском центре эпидемиологии и микробиологии имени Н.Ф. Гамалеи (отчет 2000), показавшими, что Суперлимф® в диапазоне 5–500 мкг/мл (500 мкг/мл в 100 раз превышает терапевтическую дозу) при подкожном введении лабораторным животным на протяжении всей беременности не оказывает эмбриотоксического и тератогенного действия, а также не влияет на постнатальное развитие потомства первого поколения.
Заключение / Conclusion
Таким образом, применение комплекса антимикробных пептидов и цитокинов Суперлимф® (25 ЕД вагинально 1 раз в день № 20) в комплексе с антибиотиком метронидазол (500 мг 2 раза в день внутрь 7 дней) у беременных с БВ способствует снижению частоты ПР в сроки 240–366 нед до 2,9 % со снижением риска ПР, превосходящим антибактериальную терапию в 8 раз, в том числе у пациенток с ПР в анамнезе.
Список литературы
1. Coudray M.S., Madhivanan P. Bacterial vaginosis – a brief synopsis of the literature. Eur J Obstet Gynecol Reprod Biol. 2020; 245:143–8. https://doi.org/10.1016/j.ejogrb.2019.12.035.
2. Peebles K., Velloza J., Balkus J.E. et al. High global burden and costs of bacterial vaginosis: a systematic review and meta-analysis. Sex Transm Dis. 2019;46(5):304–11. https://doi.org/10.1097/OLQ.0000000000000972
3. Махова Т.И., Анисимова Н.С., Головешкина Е.Н. и др. Распространенность инфекций, передаваемых половым путем, и нарушений микробиоценоза влагалища у асимптомных пациенток. Клиническая дерматология и венерология. 2016;15(6):37–41. https://doi.org/10.17116/klinderma201615637-41.
4. Сафарова О.А., Дикке Г.Б., Чегус Л.А. и др. Распространенность ВПЧ-инфекции и региональные особенности факторов риска ассоциированных заболеваний шейки матки среди коренных народов Севера России. Акушерство и гинекология. 2019;(7):103–10. https://doi.org/10.18565/aig.2019.7.103-110.
5. Айсаева Б.М., Абусуева З.А., Хашаева Т.Х. и др. Эпидемиологические аспекты бактериального вагиноза в Республике Дагестан. Медицинский алфавит. 2022;(4):40–3. https://doi.org/10.33667/2078-5631-2022-4-40-43.
6. Kenfack-Zanguim J., Kenmoe S., Bowo-Ngandji A. et al. Systematic review and meta-analysis of maternal and fetal outcomes among pregnant women with bacterial vaginosis. Eur J Obstet Gynecol Reprod Biol. 2023; 289:9–18. https://doi.org/10.1016/j.ejogrb.2023.08.013.
7. Işik G., Demirezen Ş., Dönmez H.G., Beksaç M.S. Bacterial vaginosis in association with spontaneous abortion and recurrent pregnancy losses. J Cytol. 2016;33(3):135–40. https://doi.org/10.4103/0970-9371.188050.
8. Ng B.K., Chuah J.N., Cheah F.C. et al. Maternal and fetal outcomes of pregnant women with bacterial vaginosis. Front Surg. 2023;10:1084867. https://doi.org/10.3389/fsurg.2023.1084867.
9. Dunlop A.L., Satten G.A., Hu Y.J. et al. Vaginal microbiome composition in early pregnancy and risk of spontaneous preterm and early term birth among African American women. Front Cell Infect Microbiol. 2021;11:641005. https://doi.org/10.3389/fcimb.2021.641005.
10. Silvano A., Meriggi N., Renzi S. et al. Vaginal microbiome in pregnant women with and without short cervix. Nutrients. 2023;15(9):2173. https://doi.org/10.3390/nu15092173.
11. Sarmento S.G.P., Moron A.F., Forney L.J. et al. An exploratory study of associations with spontaneous preterm birth in primigravid pregnant women with a normal cervical length. J Matern Fetal Neonatal Med. 2022;35(25):5383–8. https://doi.org/10.1080/14767058.2021.1879786.
12. Естественное движение населения Российской Федерации за 2022 год. Федеральная служба государственной статистики, 2023. Режим доступа: https://rosstat.gov.ru/compendium/document/13269;?print=1. [Дата обращения: 30.04.2024].
13. Ohuma E.O., Moller A.B., Bradley E. et al. National, regional, and global estimates of preterm birth in 2020, with trends from 2010: a systematic analysis. Lancet. 2023;402(10409):1261–71. https://doi.org/10.1016/S0140-6736(23)00878-4.
14. Klebanoff M.A., Schuit E., Lamont R.F. et al. Antibiotic treatment of bacterial vaginosis to prevent preterm delivery: Systematic review and individual participant data meta-analysis. Paediatr Perinat Epidemiol. 2023; 37(3):239–51. https://doi.org/10.1111/ppe.12947.
15. Brocklehurst P., Gordon A., Heatley E., Milan S.J. Antibiotics for treating bacterial vaginosis in pregnancy. Cochrane Database Syst Rev. 2013;(1):CD000262. https://doi.org/10.1002/14651858.CD000262.pub4.
16. Onyango S., Mi J.D., Koech A. et al. Microbiota dynamics, metabolic and immune interactions in the cervicovaginal environment and their role in spontaneous preterm birth. Front Immunol. 2023;14:1306473. https://doi.org/10.3389/fimmu.2023.1306473.
17. Бебнева Т.Н., Дикке Г.Б. Риск невынашивания и недонашивания беременности у женщин с ВПЧ-инфекцией и рецидивирующими нарушениями биоценоза влагалища. Акушерство и гинекология. 2019;(2):135–42. https://doi.org/10.18565/aig.2019.2.135-142.
18. Herren H., Marcolin A.C., Barbieri M.A. et al. Cytokine quantification and association with cervical length in a prospective cohort of pregnant women. BMC Pregnancy Childbirth. 2023;23(1):45. https://doi.org/10.1186/s12884-023-05776-2.
19. Surbek D.V., Hoesli I.M., Holzgreve W. Morphology assessed by transvaginal ultrasonography differs in patients in preterm labor with vs. without bacterial vaginosis. Ultrasound Gynecol Obstet. 2000;15(3):242– 5. https://doi.org/10.1046/j.1469-0705.2000.00102.x.
20. Рrajarto H.W., Pramono B.A. The association of cervical length, bacterial vaginosis, urinary tract infection and premature rupture of membranes to the imminent preterm labour. Diponegoro International Medical Journal. 2020;1(2):39–45. https://doi.org/10.14710/dimj.v1i2.9538.
21. Pandey M., Chauhan M., Awasthi S. Interplay of cytokines in preterm birth. Indian J Med Res. 2017;146(3):316–27. https://doi.org/10.4103/ijmr.IJMR_1624_14.
22. Keelan J.A. Pharmacological inhibition of inflammatory pathways for the prevention of preterm birth. J Reprod Immunol. 2011;88(2):176–84. https://doi.org/10.1016/j.jri.2010.11.003.
23. Vasundhara D., Raju V.N., Hemalatha R. et al. Vaginal & gut microbiota diversity in pregnant women with bacterial vaginosis & effect of oral probiotics: an exploratory study. Indian J Med Res. 2021;153(4):492–502. https://doi.org/10.4103/ijmr.IJMR_350_19.
24. Синчихин С.П., Салов И.А., Проскурина Е.В., Синчихина Е.С. Оценка эффективности применения антимикробного пептидно-цитокинового препарата в комплексном лечении беременных с бессимптомной бактериурией. Гинекология. 2023;25(1):51–6. https://doi.org/10.26442/20795696.2023.1.202098.
25. Тютюнник В.Л., Михайлова О.И., Кан Н.Е., Мирзабекова Д.Д. Бессимптомная бактериурия при беременности: современный подход к терапии. Акушерство и гинекология. 2022;(11):137–42. https://doi.org/10.18565/aig.2022.11.165-170.
26. Тютюнник В.Л., Кан Н.Е., Тезиков Ю.В. и др. Комплексная терапия рецидивирующего вульвовагинального кандидоза при беременности. Акушерство и гинекология. 2023;(11):172–8. https://doi.org/10.18565/aig.2023.259.
27. Дикке Г.Б., Суханов А.А., Остроменский В.В., Кукарская И.И. Течение и исходы беременности у пациенток с хроническим эндометритом и нарушением репродуктивной функции, получавших комплексное лечение с использованием препарата «Суперлимф» (рандомизированное контролируемое испытание в параллельных группах «ТЮЛЬПАН»). Акушерство и гинекология. 2023;(4):132–44. https://doi.org/10.18565/aig.2023.74.
28. Yalew G.T., Muthupandian S., Hagos K. et al. Prevalence of bacterial vaginosis and aerobic vaginitis and their associated risk factors among pregnant women from northern Ethiopia: a cross-sectional study. PLoS One. 2022;17(2):e0262692. https://doi.org/10.1371/journal.pone.0262692.
29. Nagot N., Ouedraogo A., Defer M.C. et al. Association between bacterial vaginosis and Herpes simplex virus type-2 infection: implications for HIV acquisition studies. Sex Transm Infect. 2007;83(5):365–8. https://doi.org/10.1136/sti.2007.024794.
30. Mitchell C.M., Hitti J.E., Agnew K.J., Fredricks D.N. Comparison of oral and vaginal metronidazole for treatment of bacterial vaginosis in pregnancy: impact on fastidious bacteria. BMC Infect Dis. 2009;9:89. https://doi.org/10.1186/1471-2334-9-89.
31. McDonald H.M., Brocklehurst P., Gordon A. Antibiotics for treating bacterial vaginosis in pregnancy. Cochrane Database Syst Rev. 2007;(1):CD000262. https://doi.org/10.1002/14651858.CD000262.pub3.
32. Kumar M., Murugesan S., Singh P. et al. Vaginal microbiota and cytokine levels predict preterm delivery in Asian women. Front Cell Infect Microbiol. 2021;11:639665. https://doi.org/10.3389/fcimb.2021.639665.
33. Ahrodia T., Yodhaanjali J.R., Das B. Vaginal microbiome dysbiosis in preterm birth. Prog Mol Biol Transl Sci. 2022;192(1):309–29. https://doi.org/10.1016/bs.pmbts.2022.08.001.
34. Cherpes T.L., Hillier S.L., Meyn L.A et al. A delicate balance: risk factors for acquisition of bacterial vaginosis include sexual activity, absence of hydrogen peroxide-producing lactobacilli, black race, and positive herpes simplex virus type 2 serology. Sex Transm Dis. 2008;35(1):78–83. https://doi.org/10.1097/OLQ.0b013e318156a5d0.
35. Tantengco O.A.G., Menon R. Breaking down the barrier: the role of cervical infection and inflammation in preterm birth. Front Glob Womens Health. 2022;2:777643. https://doi.org/10.3389/fgwh.2021.777643.
36. Беглов Д.Е., Артымук Н.В., Новикова О.Н. и др. Факторы риска преждевременных родов. Фундаментальная и клиническая медицина. 2022;(4):8–17. https://doi.org/10.23946/2500-0764-2022-7-4-8-17.
37. Conde-Agudelo A., Romero R. Does vaginal progesterone prevent recurrent preterm birth in women with a singleton gestation and a history of spontaneous preterm birth? Evidence from a systematic review and meta-analysis. Am J Obstet Gynecol. 2022;227(3):440–61.e2. https://doi.org/10.1016/j.ajog.2022.04.023.
38. Юшкова Т.А., Слабинская Е.В., Яковлев А.А. Клиническая фармакология Суперлимфа при заболеваниях урогенитального тракта через призму уровней реализации его эффектов. Эффективная фармакотерапия. 2023;19(37):44–53. https://doi.org/10.33978/2307-3586-2023-19-37-44-53.
39. Абатуров А.Е. Катионные антимикробные пептиды системы неспецифической защиты респираторного тракта: дефензины и кателицидины. Дефензины – молекулы, переживающие ренессанс. Часть 4. Здоровье ребенка. 2011;7(34):154–60. https://doi.org/10.22141/2224-0551.0.3.38.2012.100764.
40. Eming S.A., Krieg T., Davidson J.M. Inflammation in wound repair: molecular and cellular mechanisms. J Invest Dermatol. 2007;127(3):514– 25. https://doi.org/10.1038/sj.jid.5700701.
41. Кореева Н.В., Доброхотова Ю.Э. Локальная цитокинотерапия в гинекологической практике (обзор литературы). Проблемы репродукции. 2013;(4):21–6.
42. Huang Y., Wu Q., Tam P.K.H. Immunomodulatory mechanisms of mesenchymal Stem cells and their potential clinical applications. Int J Mol Sci. 2022;23(17):10023. https://doi.org/10.3390/ijms231710023.
Об авторах
А. А. СухановРоссия
Суханов Антон Александрович – к.м.н., зав. отделением планирования семьи и репродукции ГБУЗ ТО «Перинатальный центр», Тюмень, Россия; доцент кафедры акушерства и гинекологии ФГБОУ ВО «Тюменский государственный медицинский университет» Министерства здравоохранения Российской Федерации
625002 Тюмень, ул. Даудельная, д. 1;
625013 Тюмень, ул. Пермякова, д. 10
Г. Б. Дикке
Россия
Дикке Галина Борисовна – д.м.н., профессор кафедры акушерства и гинекологии с курсом репродуктивной медицины
190013 Санкт-Петербург, Московский проспект, д. 22, литер М
И. И. Кукарская
Россия
Кукарская Ирина Ивановна – д.м.н., главный врач ГБУЗ ТО «Перинатальный центр»; профессор кафедры акушерства, гинекологии и реаниматологии с курсом клинической лабораторной диагностики Института непрерывного профессионального развития ФГБОУ ВО «Тюменский государственный медицинский университет» Министерства здравоохранения Российской Федерации; главный специалист по акушерству и гинекологии Департамента здравоохранения Тюменской области
625002 Тюмень, ул. Даудельная, д. 1;
625013 Тюмень, ул. Пермякова, д. 10
Н. В. Шилова
Россия
Шилова Наталья Владимировна – к.м.н., медицинский директор
107078 Москва, ул. Каланчевская, д. 31, стр. 4
Что уже известно об этой теме?
► Чаще всего причиной преждевременных родов (ПР) является инфекция.
► Нарушение микробиоценоза встречается у трети женщин во время беременности.
► Лечение нарушений микрофлоры влагалища во время беременности чаще всего антибактериальное.
Что нового дает статья?
► Показана взаимосвязь риска ПР и комплексного лечения бактериального вагиноза с помощью антимикробных пептидов и цитокинов.
► Доказано отсутствие рецидива во время беременности при комплексном лечении вагиноза у беременных.
► Доказано отсутствие отрицательного влияния комплексного лечения во время беременности на состояние новорожденного.
Как это может повлиять на клиническую практику в обозримом будущем?
► Снижение риска ПР в общей структуре родов и рецидивов бактериального вагиноза во время беременности.
► При снижении частоты ПР ожидается уменьшение материальных затрат и психологических нарушений у супружеских пар.
Рецензия
Для цитирования:
Суханов А.А., Дикке Г.Б., Кукарская И.И., Шилова Н.В. Профилактика преждевременных родов у пациенток с бактериальным вагинозом с использованием комплекса природных антимикробных пептидов и цитокинов. Акушерство, Гинекология и Репродукция. 2024;18(3):300-315. https://doi.org/10.17749/2313-7347/ob.gyn.rep.2024.531
For citation:
Sukhanov A.A., Dikke G.B., Kukarskaya I.I., Shilova N.V. Prevention of premature birth in female patients with bacterial vaginosis using a complex of natural antimicrobial peptides and cytokines. Obstetrics, Gynecology and Reproduction. 2024;18(3):300-315. (In Russ.) https://doi.org/10.17749/2313-7347/ob.gyn.rep.2024.531

Контент доступен под лицензией Creative Commons Attribution-NonCommercial-ShareAlike 4.0 International License.











































