Перейти к:
Показатели гемостаза как прогностические биомаркеры у онкогинекологических пациенток
https://doi.org/10.17749/2313-7347/ob.gyn.rep.2023.406
Аннотация
Гиперкоагуляция характерна для онкологических пациентов. Помимо этого, различные звенья системы гемостаза принимают участие в росте опухоли, инвазии, метастазировании, неоангиогенезе и уклонении от иммунного контроля. Выраженность активации системы гемостаза зависит от фенотипа опухоли. Показатели, характеризующие коагуляцию, интенсивность процессов фибринолиза, агрегацию и активацию тромбоцитов, а также активацию эндотелия отражают выраженность активации гемостаза на фоне онкологического процесса, но могут стать и кандидатами в маркеры прогрессии опухоли и прогнозирования исходов у онкологических пациенток. В данном обзоре обобщены данные исследований, в которых изучалась прогностическая ценность биомаркеров гемостаза в отношении общей выживаемости и ответа на терапию в онкогинекологии и маммологии. Выделены наиболее многообещающие биомаркеры, которые могут быть использованы для стратификации риска и персонализированного ведения пациентов в будущем.
Для цитирования:
Слуханчук Е.В., Бицадзе В.О., Солопова А.Г., Хизроева Д.Х., Гри Ж., Элалами И., Щербаков Д.В., Шкода А.С., Панкратьева Л.Л., Унгиадзе Д.Ю., Ашрафян Л.А., Макацария А.Д. Показатели гемостаза как прогностические биомаркеры у онкогинекологических пациенток. Акушерство, Гинекология и Репродукция. 2023;17(2):257-268. https://doi.org/10.17749/2313-7347/ob.gyn.rep.2023.406
For citation:
Slukhanchuk E.V., Bitsadze V.O., Solopova A.G., Khizroeva J.Kh., Gris J., Elalamy I., Shcherbakov D.V., Shkoda A.S., Pankratyeva L.L., Ungiadze J.Yu., Ashrafyan L.A., Makatsariya A.D. Hemostasis parameters as prognostic biomarkers in gynecological cancer patients. Obstetrics, Gynecology and Reproduction. 2023;17(2):257-268. (In Russ.) https://doi.org/10.17749/2313-7347/ob.gyn.rep.2023.406
Введение / Introduction
Опухолевый рост нарушает нормальное течение реакций гемостаза [1]. Многочисленными исследованиями подтверждена двунаправленная связь между гиперкоагуляцией с риском тромбоэмболических осложнений и онкологическими заболеваниями. Согласно последним эпидемиологическим данным, риск венозной тромбоэмболии (ВТЭ) у онкологических пациентов в 9 раз выше [2]. Однако этот риск неоднороден и зависит от лежащего в основе индивидуального протромботического профиля пациента [3], который складывается из таких факторов как возраст, пол, сопутствующие заболевания и варианты противоопухолевой терапии [4]. Риск онкотромбоза зависит от гистологического типа опухоли и стадии заболевания. Высоким риском тромбозов обладают опухоли поджелудочной железы и желудка [5]. Сам по себе тромбоз является независимым предиктором снижения выживаемости у онкологических больных, а тромботические осложнения есть отражение агрессивного типа опухоли, прогрессирования и неэффективности проводимой терапии [6][7].
Было показано, что ежегодная заболеваемость ВТЭ у онкологических больных составляет 0,5 % по сравнению с 0,1 % в общей популяции [8]. Активный рак составляет 20 % от общей заболеваемости ВТЭ [9][10]. Что еще более важно, рак является основной причиной смерти пациентов с ВТЭ и наоборот. Данные Framingham Heart Study показали, что в проспективной когорте из 9754 пациентов при рак-ассоциированном тромбозе выживаемость была хуже среди пациентов с ВТЭ [11].
ВТЭ является второй наиболее распространенной причиной смерти от рака, уступая только самому раку [12].
В 1856 г. Рудольф Вирхов озвучил триаду процессов, ведущих к тромбозу: повреждение эндотелия, нарушение микроциркуляции и гиперкоагуляция [13]. У онкологических больных есть одновременно несколько факторов, предрасполагающих к тромбообразованию. В терапии онкологических заболеваний порой необходимы серии хирургических вмешательств с длительной внутривенной катетеризацией и последующей химиотерапией (повреждение эндотелия). Опухолевые массы способствуют нарушению микроциркуляции за счет объемной компрессии сосудов. Иммобилизация также вносит свой вклад в нарушение циркуляции крови. С конца XIX века известно, что некоторые виды опухолей связаны с особой гиперкоагуляцией [14]. Совсем недавно было показано, что генетические характеристики опухоли, например, наличие мутации в гене KRAS (англ. Kirsten rat sarcoma) при опухолях толстой кишки и легкого связано с повышенным риском ВТЭ [15][16]. JAK2 V617F – мутация, часто присутствующая у пациентов с миелопролиферативным раком [17], также связана с повышенным риском ВТЭ [18].
Существуют различные патофизиологические пути взаимодействия между опухолью и звеньями системы гемостаза.
При различных видах рака выявлена повышенная экспрессия прокоагулянтных субстанций, основной из которых является тканевой фактор (англ. tissue factor, TF) [19][20]. С повышенной экспрессией TF связаны изменения генома опухолевой клетки [21]. Локально протромботический эффект опосредован экспрессией TF клетками опухоли и эндотелия сосудов, а системно – высвобождением в кровоток внеклеточных везикул, содержащих TF (TF-bearing Extracellular vesicles, EV-TF) [22–24].
Другим патофизиологическим путем является гипофибринолиз, который связан с повышенной экспрессией опухолью ингибитора активатора плазминогена-1 (англ. plasminogen activator inhibitor-1, PAI-1), главного ингибитора деградации фибрина [25].
Активация гемостаза напрямую способствует прогрессии опухоли. Активированные протеазы гемостаза, включая тромбин, непосредственно активируют клеточные рецепторы, которые представлены в большом количестве на поверхности опухолевых клеток (рецепторы, активируемые протеиназами) и запускают внутриклеточные каскады опухолевого роста, инвазии и ангиогенеза [26][27]. Локальная прокоагулянтная активность в опухолевой нише способствует созданию микроокружения опухоли, благоприятной для инвазии, неоангиогенеза и уклонения от иммунного надзора [28].
Тромбоциты играют большую роль в патофизиологии опухолевого роста [29]. Активация тромбоцитов у онкологических пациентов происходит либо непосредственно путем влияния на рецепторы тромбоцитов, либо опосредованно в результате высвобождения тромбоцит-активирующих молекул [30]. Тромбоциты поддерживают микроокружение опухоли и способствуют пролиферации опухоли и ангиогенезу за счет высвобождения цитокинов и факторов роста. Кроме того, тромбоциты облегчают метастазирование механически, образуя агрегаты с клетками опухоли, экранируя их и защищая от противоопухолевого иммунитета [31–33].
Запущенные опухолью местные и системные реакции воспаления активируют систему гемостаза через провоспалительные цитокины и нейтрофильные внеклеточные ловушки [34][35].
В данном обзоре обобщены имеющиеся данные о биомаркерах гемостаза, потенциально способных прогнозировать исход заболевания у онкогинекологических пациенток, выживаемость и эффективность терапии (рис. 1).
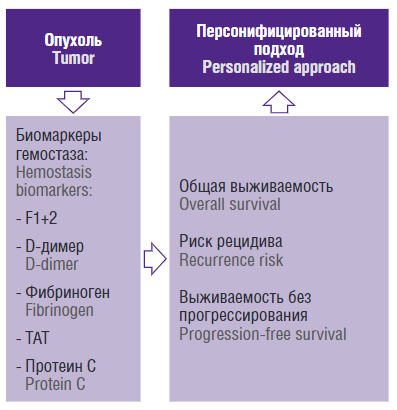
Рисунок 1. Роль биомаркеров гемостаза в прогнозировании исхода онкологического заболевания [рисунок авторов].
Примечание: ТАТ – комплексы тромбин-антитромбин, F1+2 – фрагменты протромбина.
Figure 1. The role of hemostasis biomarkers in predicting cancer outcome [drawn by authors].
Note: TAT – trombin-antithrombin complexes, F1+2 – prothrombin fragments.
Биомаркеры гемостаза / Hemostasis biomarkers
Биомаркеры гемостаза представляют собой гетерогенную группу биологических молекул, клеток и лабораторных параметров, которые отражают активность процессов коагуляции, фибринолиза, активации тромбоцитов и эндотелиальных клеток. Все больше данных свидетельствуют о прогностической ценности ряда показателей гемостаза у пациентов с онкологическими заболеваниями. Диапазон потенциального применения биомаркеров гемостаза в онкологии довольно широк и включает [36]:
– прогнозирование общей выживаемости;
– прогнозирование или мониторинг риска рецидива после радикального хирургического лечения (безрецидивная выживаемость);
– прогнозирование и мониторинг ответа на противо- опухолевую терапию;
– прогнозирование выживаемости без прогрессирования [37].
D-димер / D-dimer
D-димер является продуктом плазмин-опосредованной деградации фибрина. Молекулы D-димера образуются в результате деградации сшитого фибрина во время фибринолиза. Генерация D-димера требует активности трех ферментов: тромбина, активированного фактора XIII (фактор XIIIa) и плазмина. Процесс начинается, когда тромбин – продукт коагуляционного каскада превращает растворимый фибриноген в мономеры фибрина. Затем эти мономеры образуют полимеры фибрина за счет нековалентных взаимодействий, основанных на аллостерических изменениях в белке в результате разрыва тромбином фибринопептидов от N-концевого домена. Фибрин укрепляется за счет взаимодействия с фактором XIII, который после активации тромбином сшивает D-домены соседних мономеров фибрина. Расщепление плазмином сгустка фибрина приводит к образованию молекулы D-димера [38].
D-димер служит глобальным маркером активации свертывающей и фибринолитической систем и косвенным маркером тромботической и последующей тромболитической активности [38]. Он в целом используется в том числе и для диагностики ВТЭ.
Существует множество вариантов использования D-димера при различных патологических состояниях. Анализ D-димера имеет решающее значение для диагностики тромбоза глубоких вен [39], легочной эмболии [40], расслоения аорты [41] и синдрома диссеминированного внутрисосудистого свертывания крови (ДВС) [42]. Оценка D-димера эффективна в ситуациях, когда вероятность тромбоэмболии низкая и когда отрицательный тест исключает тромбоз, а положительный тест указывает на тромбоз, но не делает окончательных выводов.
Повышенная концентрация D-димера эффективна в персонализированном прогнозировании риска развития рак-ассоциированного тромбоза, а также прогнозировании выживаемости и ответа на терапию при различных видах опухолей [43–45].
Значимость концентрации D-димера в прогнозе выживаемости при раке изучалась в большом проспективном обсервационном когортном исследовании, включавшем 1178 пациентов с впервые диагностированным раком или рецидивом рака, наиболее частые виды опухолей: легкие – 15 %, молочная железа – 13,0 %, мозг – 13,0 %, нижний отдел желудочно-кишечного тракта – 11,0 %. Высокие концентрации D-димера при включении в исследование были независимыми прогностическими факторами повышенного риска смертности вне зависимости от типа опухоли, возраста, пола и тромбоэмболических осложнений во время наблюдения [43].
В 2018 г. опубликован крупный метаанализ, объединивший данные из 49 исследований, выявивших связь между концентрацией D-димера и исходами у 13001 онкологических пациентов. Вошедшие в метаанализ исследования различались по типам опухолей, видам лечебных учреждений, дизайну и пороговым значениям биомаркера. Несмотря на это, была доказана независимая прогностическая ценность D-димера для разных типов рака и независимо от сопутствующих переменных [44].
Фибриноген / Fibrinogen
Фибриноген является субстратом для образования фибрина. Он также представляет собой белок острой фазы, повышается в ответ на воспаление, травму и опухолевый рост. Данные о прогностической ценности фибриногена в отношении онкотромбозов противоречивы. При этом его концентрация используется для прогнозирования общей выживаемости и ответа на терапию при опухолевом процессе [36][46][47].
С. Perisanidis с соавт. оценили прогностическую ценность фибриногена у онкологических пациентов на дотерапевтическом этапе в крупном метаанализе, включившем в общей сложности 52 обсервационных исследования и 15371 пациента. Было показано, что смертность выше при более высоких исходных концентрациях фибриногена (наиболее информативно при почечно-клеточном раке, опухолях головы и шеи и колоректальном раке). Кроме того, более высокие исходные концентрации фибриногена были связаны со снижением показателей безрецидивной выживаемости [48].
Фактор фон Виллебранда и металлопротеиназа ADAMTS-13 / Von Willebrand factor and ADAMTS-13 metalloproteinase
Фактор фон Виллебранда (англ. von Willebrand factor, vWF) представляет собой большой полимерный гликопротеин, участвующий в адгезии и агрегации тромбоцитов, секретируется в плазму в виде «сверхбольших» мультимеров vWF (англ. ultra-large multimers, UL-vWF). Расщепление его при помощи металлопротеиназы ADAMTS-13 (англ. a disintegrin and metalloproteinase with thrombospondin type 1 motif, member 13) приводит к образованию меньших, менее активных субъединиц vWF. Полный дефицит ADAMTS-13 является причиной тромботической тромбоцитопенической пурпуры (ТТП), тромботической микроангиопатии (ТМА), отличительными симптомами которой являются микрососудистые тромбы, богатые тромбоцитами и vWF [49].
Одна из причин рак-ассоциированного тромбоза связана с повышенной агрегацией тромбоцитов, опосредованной vWF [50]. А.Т. Bauer с соавт. продемонстрировали in vitro, что клетки меланомы могут активировать эндотелиальные клетки сосудов и побуждать их к высвобождению UL-vWF, за которым следует гиперагрегация тромбоцитов [51]. Было показано, что сочетание высвобождения vWF и локального снижения концентрации ADAMTS-13 в опухолевой ткани способствует созданию прокоагуляционной среды. После инфузии рекомбинантной ADAMTS-13 (rADAMTS-13) снижалось количество комплексов UL-vWF с агрегированными тромбоцитами. Эффективность rADAMTS-13 в отношении снижения тромбообразования и подавления адгезии тромбоцитов к эндотелию также была установлена в других экспериментальных исследованиях [52–54].
По данным литературы, у онкологических пациентов отмечаются более низкие концентрации ADAMTS-13 и более высокие концентрации vWF, при этом интенсивность динамики показателей зависит от стадии заболевания [55–57]. Зависимое от стадии увеличение концентрации vWF и снижение концентрации ADAMTS-13 косвенно коррелирует с худшей выживаемостью онкологических больных. В одном из исследований была продемонстрирована взаимосвязь ADAMTS-13 и vWF с выживаемостью у пациентов со злокачественными новообразованиями. В конце двухлетнего периода наблюдения оставались в живых две трети пациентов со значениями vWF ниже 25-го процентиля и только одна треть пациентов со значениями vWF выше 75-го процентиля [58]. Аналогичные данные были получены для концентрации ADAMTS-13 и соотношения ADAMTS-13/vWF.
Фрагменты протромбина F1+2 / F1+2 prothrombin fragments
Фрагменты F1+2 являются фрагментами протромбина, возникающими при образовании тромбина. Концентрация F1+2 отражает активность внутрисосудистого свертывания. В онкологии концентрация F1+2 отражает риск рак-ассоциированного тромбоза. В настоящее время недостаточно данных о прогностической ценности данного показателя в отношении выживаемости [36][47][59].
Комплексы тромбин–антитромбин / Thrombin–antithrombin complexes
Концентрация комплексов тромбин–антитромбин (ТАТ) отражает уровень тромбина в плазме крови. Ограниченные данные свидетельствуют о возможности использования показателя для прогнозирования выживаемости и ответа на проводимую терапию. Высокие концентрации ТАТ, мономеров фибрина и F1+2 достоверно прогнозировали повышенный риск смертности в проспективном когортном исследовании [60].
Тест генерации тромбина / Thrombin generation assay
Тест генерации тромбина характеризует системную активацию системы гемостаза, отражает эндогенный тромбиновый потенциал и пиковые значения генерации тромбина. Показатель обладает прогностической ценностью в отношении рак-ассоциированных тромбозов. Ассоциация с онкологическими исходами оценена в нескольких исследованиях и оказалась особенно информативной при раке молочной железы [36][47][61].
Ингибитор активатора плазминогена 1 / Plasminogen activator inhibitor 1
PAI-1 является основным ингибитором фибринолиза, уровень которого повышается при всех типах опухолей. Концентрация PAI-1 отражает риск развития онкотромбоза. Показатель изучается для прогнозирования выживаемости и ответа на терапию при различных видах рака.
При раке яичников активатор плазминогена урокиназного типа (англ. urokinase plasminogen activator, uPA) и его ингибитор PAI-1 являются биомаркерами плохого прогноза, предикторами раннего рецидива заболевания и плохой выживаемости [62]. Кроме того, экспрессия uPA и PAI-1 значительно повышена в метастазах в сальник рака яичников у пациентов III и IV стадий по классификации FIGO (англ. International Federation of Gynecology and Obstetrics) по сравнению с первичной опухолевой тканью [63]. Тот факт, что как uPA, так и PAI-1 являются индикаторами плохого прогноза у пациентов с раком яичника или других органов, противоречит классической роли PAI-1 как ингибитора, блокирующего ферментативное действие uPA. Эта удивительная особенность может быть объяснена дополнительными, многофункциональными ролями uPA и PAI-1 в адгезии клеток, подвижности клеток, передаче клеточных сигналов и клеточной пролиферации. Клинические данные показали, что повышенные уровни опухолевого антигена uPA и/или PAI-1 способствуют распространению и метастазированию опухолевых клеток и связаны с плохим исходом заболевания при различных солидных опухолях [64–66]. При раке молочной железы uPA и PAI-1 предопределяют ответ на адъювантную химиотерапию [67], и их определение в первичной опухолевой ткани может влиять на принятие решения о терапии.
Антитромбин III и протеин С / Antithrombin III and protein C
Антитромбин III (англ. antithrombin III, АТ-III) и протеин С представляют собой ингибиторы коагуляционного каскада. Данные об их прогностической ценности в отношении выживаемости и оценки эффективности терапии ограничены.
Система протеина С регулирует активность факторов свертывания VIIIa и Va, кофакторов активации фактора X и протромбина, соответственно. Протеин С активируется на эндотелии комплексом тромбин-тромбомодулин-EPCR (англ. endothelial protein C receptor; рецептор эндотелиального протеина С). Опосредованное активированным протеином C (англ. activated protein C, APC) расщепление факторов VIIIa и Va происходит на отрицательно заряженных фосфолипидных мембранах с участием протеина S и фактора V. APC также обладает противовоспалительной и антиапоптотической активностью за счет взаимодействия APC с EPCR и расщепления PAR-1 (рецептор-1, активируемый протеазой; англ. protease-activated receptor-1).
Генетические дефекты, влияющие на систему протеина С, являются наиболее распространенными факторами риска венозного тромбоза. Более того, было обнаружено, что АPC может быть использован в лечении сепсиса за счет его уникальной комбинации антикоагулянтных, противовоспалительных и антиапоптотических свойств [68][69]. Резистентность к активированному протеину С (англ. activated protein C resistance, APC-R) на фоне мутации фактора V Лейдена (FVL) является наиболее частой причиной наследственной тромбофилии. Приобретенный APC-R на фоне повышенной концентрации свертывания крови, снижения концентрации ингибиторов или наличия аутоантител возникает при различных состояниях, например, при приеме оральных контрацептивов, менопаузальной гормональной терапии, во время беременности и при раке и является независимым фактором риска тромбоза.
Приобретенная APC-R часто встречается у пациентов со злокачественными новообразованиями с тромбозом и без него [70][71]. Приобретенная APC-R при солидных опухолях обусловлена повышенной концентрацией прокоагулянтных факторов, таких как фактор VIII [71]. Некоторые химиотерапевтические препараты также могут способствовать развитию APC-R. Одно ретроспективное клиническое исследование (n = 477) продемонстрировало связь более низкой концентрации протеина С с повышением показателя смертности у онкологических пациентов [72].
Фактор VIII / Factor VIII
Концентрация фактора VIII отражает системную активацию системы свертывания. Показатель используется в качестве предиктора рак-ассоциированного тромбоза. Данные о прогностической ценности в отношении выживаемости и оценки эффективности терапии ограничены [36][47].
Ингибитор пути тканевого фактора (англ. tissue factor pathway inhibitor, TFPI) представляет собой физиологический ингибитор коагуляционного каскада. В ряде исследований выявлена экспрессия TFPI опухолевой тканью. Концентрация TFPI в периферической крови отражает прогноз заболевания.
P-селектин / P-selectin
Р-селектин выделяется активированными тромбоцитами и клетками эндотелия. Высокие концентрации Р-селектина сопряжены с повышенным иском венозного и артериального тромбоза у онкологических пациентов. Показатель редко используется в качестве биомаркера при раке [47][59][73]. В проспективном когортном исследовании (n = 705) было показано, что риск смертности возрастает на 30 % у пациентов с повышенным уровнем растворимого P-селектина [74].
В проспективном когортном исследовании, включавшем 112 пациентов с недавно диагностированным или рецидивирующим раком, была выполнена оценка биомаркеров в течение курса химиотерапии. Пациенты, достигшие полной ремиссии за период наблюдения, имели значительно более низкие значения D-димера, F1+2 и фибриногена в динамике по сравнению с пациентами без полной ремиссии. Подобной закономерности не отмечалось для фактора VIII, растворимого P-селектина и теста генерации тромбина [75]. Данные результаты свидетельствуют о возможности мониторинга ответа на лечение с помощью оценки динамики концентрации биомаркеров гемостаза на фоне лечения.
Значение биомаркеров гемостаза в онкогинекологии и онкомаммологии / Importance of hemostasis biomarkers in oncogynecology and oncomammology
Рак яичников / Ovarian cancer
Метаанализ, включивший данные 15 исследований и 1437 пациентов с опухолями яичников, показал, что повышенные исходные концентрации D-димера являются достоверным прогностическим биомаркером высокой смертности [45]. Когортное исследование с участием 190 пациентов с эпителиальным раком яичников выявило достоверную зависимость смертности от повышенной исходной концентрации D-димера [76]. В другом исследовании была прослежена динамика D-димера и онкомаркера СА-125 у 26 пациентов при раке яичников на фоне химиотерапии. Было показано, что снижение концентрации обоих маркеров является предиктором ремиссии заболевания [77].
Рак тела матки / Uterine body cancer
Когортное исследование, включавшее 942 пациентки со злокачественными заболеваниями эндометрия в послеоперационном периоде, выявило достоверную связь между концентрацией фибриногена до операции и общей выживаемостью. При этом значения D-димера, АЧТВ (активированное частичное тромбопластиновое время) и ПВ (протромбиновое время) не обладали прогностической ценностью [78]. В многоцентровом ретроспективном когортном исследовании (n = 436) концентрация фибриногена до начала терапии были оценена как независимый предиктор общей и безрецидивной выживаемости [79].
Рак шейки матки / Cervical cancer
В исследовании с участием пациентов со злокачественными заболеваниями шейки матки было показано, что исходная концентрация D-димера является независимым предиктором общей выживаемости [80].
Рак молочной железы / Breast cancer
Пациенты со злокачественными опухолями молочной железы имеют более низкий риск развития рак-ассоциированных тромбозов по сравнению с другими типами опухолей [2]. Однако несмотря на отсутствие тромботических осложнений, у них отмечается системная активация гемостаза. Система гемостаза при опухолях молочной железы механически вовлечена в процессы прогрессирования и метастазирования [81].
В когортном исследовании, включавшем 102 пациентки с инвазивным раком молочной железы, было показано, что концентрация D-димера до операции коррелировала с поражением лимфатических узлов, наличием лимфоваскулярной инвазии и стадией заболевания [82]. В другом когортном исследовании, включавшем 235 пациенток на ранних стадиях рака молочной железы (I–IIa), изучалась прогностическая ценность исходных концентраций PAI-1, F1+2, ТАТ, фактора VIII и D-димера до начала терапии. Повышенные концентрации D-димера и фактора VIII были связаны со снижением общей выживаемости [83]. Еще одно когортное исследование, проведенное среди пациентов со злокачественными опухолями молочной железы, которые либо были прооперированы (n = 23), либо не получали терапии или имели прогрессию заболевания с метастазированием (n = 84), показало, что концентрация D-димера соответствовала опухолевой нагрузке, количеству метастазов и динамике прогрессии рака. Таким образом, D-димер был определен как независимый прогностический маркер [84].
В ретроспективном когортном исследовании с участием 102 пациенток с HER-2 (англ. human epidermal growth factor receptor 2; человеческий рецептор эпидермального фактора роста 2-го типа) положительным раком молочной железы на фоне использования трастузумаба повышенная исходная концентрация фибриногена (> 2,88 г/л) ассоциировалась со степенью дифференцировки опухоли и более низкими концентрациями экспрессии PTEN (англ. phosphatase and tensin homolog deleted on chromosome 10) – супрессора опухоли, который, как известно, регулирует процессы канцерогенеза рака молочной железы. Повышенные концентрации фибриногена соответствовали снижению общей и безрецидивной выживаемости [85].
Многоцентровое проспективное наблюдательное исследование HYPERCAN продемонстрировало результаты клинического применения биомаркеров гемостаза для стратификации исходов у пациенток со злокачественными заболеваниями молочной железы [86]. В когорте из 522 пациенток после оперативного лечения рака молочной железы показатель потенциала генерации тромбина до начала химиотерапии был идентифицирован как независимый предиктор раннего рецидива заболевания и включен в модели прогнозирования риска [87]. Кроме того, в когортном исследовании с участием 701 пациентки со злокачественными опухолями молочной железы значения D-димера, фибриногена, F1+2 и отношения фактор VIIa/антитромбин были оценены до начала химиотерапии. В исследовании концентрация F1+2 была оценена как независимый предиктор рецидива заболевания [61].
В когортном исследовании с участием 152 пациенток с опухолями молочной железы, ранее не получавших лечения, низкий уровень экспрессии опухолевого TFPI был связан с худшим прогнозом; кроме этого, концентрация TFPI в плазме крови коррелировала с характеристиками первичной опухоли [88]. В другом исследовании, включавшем 156 больных с опухолями молочной железы в послеоперационном периоде, низкая экспрессия TFPI-2 или его отсутствие были сопряжены с высоким риском рецидива опухоли и плохой выживаемостью [89].
Обсуждение / Discussion
Биомаркеры гемостаза обладают прогностической ценностью в отношении выживаемости и ответа на терапию у онкогинекологических пациенток. В основе этой прогностической значимости лежит тесная патогенетическая связь системы гемостаза с процессами онкогенеза и прогрессии опухоли. Биомаркеры гемостаза представляют собой потенциальные кандидаты для выработки стратегии лечения и ведения онкологических пациентов.
Однако существует и ограничения, препятствующие их широкому распространению в клинической практике.
Во-первых, дизайн и методология проведенных исследований в этой области весьма неоднородны, многие исследования ограничены небольшим размером выборки, часть из них ретроспективны.
Во-вторых, в связи с высокой гетерогенностью дизайна исследований, применяемых пороговых значений для определения повышенных концентраций биомаркеров и используемых методов статистической обработки, снижается эффективность и качество метаанализов.
В-третьих, биомаркеры гемостаза имеют ограничения для клинической практики в связи с их низкой специфичностью. Их концентрации могут в значительной степени зависеть от использования антикоагулянтов, перенесенных тромботических осложнений, параллельно протекающего системного провоспалительного ответа, беременности и других факторов. Снижение концентрации фибриногена может возникать, например, на фоне ДВС при таких заболеваниях, как острый промиелоцитарный лейкоз. Следовательно, клиническое применение биомаркеров гемостаза требует определения ситуаций, когда их не следует использовать для прогнозирования.
В-четвертых, использование в клинической практике некоторых исследованных биомаркеров гемостаза ограничено. Так, например, тест генерации тромбина недоступен для исполнения во многих клиниках.
Таким образом, биомаркеры гемостаза в настоящее время еще рассматриваются как низкоспецифические прогностические маркеры в онкологии, отражающие потенциальную агрессивность опухоли, прогноз течения заболевания и неблагоприятный исход.
Наиболее перспективным представляется использование биомаркеров гемостаза для предварительной оценки общей выживаемости, выявления отдельных прогностических подгрупп пациентов. Также оценка биомаркеров гемостаза в динамике на фоне противоопухолевой терапии в случае их повышения может указывать на прогрессию заболевания.
Интеграция биомаркеров гемостаза в алгоритм принятия клинических решений может улучшить качество ведения пациентов за счет более точного выявления подгрупп с неблагоприятным прогнозом, персонализации терапии при прогнозировании ответа на нее, расчета вероятности прогрессирования или рецидивирования заболевания при оценке биомаркеров в динамике. Однако перед внедрением биомаркеров гемостаза в клиническую практику необходимо проведение проспективных клинических и интервенционных исследований [90].
Заключение / Conclusion
Биомаркеры гемостаза являются многообещающими кандидатами для внедрения в клиническую практику с целью прогнозирования исходов у онкологических пациентов. Имеющиеся в настоящее время данные когортных исследований демонстрируют прогностическую ценность биомаркеров гемостаза, в частности D-димера и фибриногена, при различных типах опухолей и видах терапии. Необходимы дальнейшие проспективные, интервенционные исследования для включения биомаркеров гемостаза в клиническую практику с целью прогнозирования выживаемости и ответа на терапию, что будет способствовать персонализации ведения онкологических пациентов.
Список литературы
1. Hisada Y., Mackman N. Cancer-associated pathways and biomarkers of venous thrombosis. Blood. 2017;130(13):1499–506. https://doi.org/10.1182/blood-2017-03-743211.
2. Mulder F.I., Horvàth-Puhó E., van Es N. et al. Venous thromboembolism in cancer patients: a population-based cohort study. Blood. 2021;137(14):1959–69. https://doi.org/10.1182/blood.2020007338.
3. Moik F., Ay C., Pabinger I. Risk prediction for cancer-associated thrombosis in ambulatory patients with cancer: past, present and future. Thromb Res. 2020;191 Suppl 1:S3–S11. https://doi.org/10.1016/S0049-3848(20)30389-3.
4. Khorana A.A., Mackman N., Falanga A. et al. Cancer-associated venous thromboembolism. Nat Rev Dis Primers. 2022;8(1):11. https://doi.org/10.1038/s41572-022-00336-y.
5. Chew H.K., Wun T., Harvey D. et al. Incidence of venous thromboembolism and its effect on survival among patients with common cancers. Arch Intern Med. 2006;166(4):458–64. https://doi.org/10.1001/archinte.166.4.458.
6. Riedl J.M., Schwarzenbacher E., Moik F. et al. Patterns of thromboembolism in patients with advanced pancreatic cancer undergoing first-line chemotherapy with FOLFIRINOX or gemcitabine/nab-paclitaxel. Thromb Haemost. 2022;122(4):633–45. https://doi.org/10.1055/a-1548-4847.
7. Moik F., Chan W.-S.E., Wiedemann S. et al. Incidence, risk factors, and outcomes of venous and arterial thromboembolism in immune checkpoint inhibitor therapy. Blood. 2021;137(12):1669–78. https://doi.org/10.1182/blood.2020007878.
8. Elyamany G., Alzahrani A.M., Bukhary E. Cancer-associated thrombosis: an overview. Clin Med Insights Oncol. 2014;8:129–37. https://doi.org/10.4137/CMO.S18991.
9. Heit J.A., Spencer F.A., White R.H. The epidemiology of venous thromboembolism. J Thromb Thrombolysis. 2016;41(1):3–14. https://doi.org/10.1007/s11239-015-1311-6.
10. Laporte S., Mismetti P., Décousus H. et al. Clinical predictors for fatal pulmonary embolism in 15 520 patients with venous thromboembolism: findings from the Registro Informatizado de la Enfermedad TromboEmbolica venosa (RIETE) Registry. Circulation. 2008;117(13):1711–6. https://doi.org/10.1161/CIRCULATIONAHA.107.726232.
11. Puurunen M.K., Gona P.N., Larson M.G. et al. Epidemiology of venous thromboembolism in the Framingham Heart Study. Thromb Res. 2016;145:27–33. https://doi.org/10.1016/j.thromres.2016.06.033.
12. Khorana A., Francis C., Culakova E. et al. Thromboembolism is a leading cause of death in cancer patients receiving outpatient chemotherapy. J Thromb Haemost. 2007;5(3):632–4. https://doi.org/10.1111/j.1538-7836.2007.02374.x.
13. Blann A.D., Lip G.Y. Venous thromboembolism. BMJ. 2006;332(7535):215–9. https://doi.org/10.1136/bmj.332.7535.215.
14. Blann A.D., Dunmore S. Arterial and venous thrombosis in cancer patients. Cardiol Res Pract. 2011;2011:394740. https://doi.org/10.4061/2011/394740.
15. Ades S., Kumar S., Alam M. et al. Tumor oncogene (KRAS) status and risk of venous thrombosis in patients with metastatic colorectal cancer. J Thromb Haemost. 2015;13(6):998–1003. https://doi.org/10.1111/jth.12910.
16. Corrales-Rodriguez L., Soulières D., Weng X. et al. Mutations in NSCLC and their link with lung cancer-associated thrombosis: a case-control study. Thromb Res. 2014;133(1):48–51. https://doi.org/10.1016/j.thromres.2013.10.042.
17. Nielsen C., Birgens H.S., Nordestgaard B.G. et al. The JAK2 V617F somatic mutation, mortality and cancer risk in the general population. Haematologica. 2011;96(3):450–3. https://doi.org/10.3324/haematol.2010.033191.
18. Shetty S., Kulkarni B., Pai N. et al. JAK2 mutations across a spectrum of venous thrombosis cases. Am J Clin Pathol. 2010;134(1):82–5. https://doi.org/10.1309/AJCP7VO4HAIZYATP.
19. Regina S., Valentin J.-B., Lachot S. et al. Increased tissue factor expression is associated with reduced survival in non–small cell lung cancer and with mutations of TP53 and PTEN. Clin Chem. 2009;55(10):1834–42. https://doi.org/10.1373/clinchem.2009.123695.
20. Ribeiro F.S., Simao T.A., Amoêdo N.D. et al. Evidence for increased expression of tissue factor and protease-activated receptor-1 in human esophageal cancer. Oncol Rep. 2009;21(6):1599–604. https://doi.org/10.3892/or_00000393.
21. van den Berg Y.W., Osanto S., Reitsma P.H., Versteeg H.H. The relationship between tissue factor and cancer progression: insights from bench and bedside. Blood. 2012;119(4):924–32. https://doi.org/10.1182/blood-2011-06-317685.
22. Contrino J., Hair G., Kreutzer D.L., Rickles F.R. In situ detection of tissue factor in vascular endothelial cells: correlation with the malignant phenotype of human breast disease. Nat Med. 1996;2(2):209–15. https://doi.org/10.1038/nm0296-209.
23. Vrana J.A., Stang M.T., Grande J.P., Getz M.J. Expression of tissue factor in tumor stroma correlates with progression to Invasive human breast cancer: paracrine regulation by carcinoma cell-derived members of the transforming growth factor β family. Cancer Res. 1996;56(21):5063–70.
24. Hell L., Däullary T., Burghart V. et al. Extracellular vesicle-associated tissue factor activity in prostate cancer patients with disseminated intravascular coagulation. Cancers (Basel). 2021;13(7):1487. https://doi.org/10.3390/cancers13071487.
25. Hisada Y., Garratt K.B., Maqsood A. et al. Plasminogen activator inhibitor 1 and venous thrombosis in pancreatic cancer. Blood Adv. 2021;5(2):487–95. https://doi.org/10.1182/bloodadvances.2020003149.
26. Adams G.N., Rosenfeldt L., Frederick M. et al. Colon cancer growth and dissemination relies upon thrombin, stromal PAR-1, and fibrinogen. Cancer Res. 2015;75(19):4235–43. https://doi.org/10.1158/0008-5472.CAN-15-0964.
27. Wojtukiewicz M.Z., Hempel D., Sierko E. et al. Protease-activated receptors (PARs) – biology and role in cancer invasion and metastasis. Cancer Metastasis Rev. 2015;34(4):775–96. https://doi.org/10.1007/s10555-015-9599-4.
28. Liu Y., Jiang P., Capkova K. et al. Tissue factor-activated coagulation cascade in the tumor microenvironment is critical for tumor progression and an effective target. Cancer Res. 2011;71(20):6492–502. https://doi.org/10.1158/0008-5472.CAN-11-1145.
29. Franco A.T., Corken A., Ware J. Platelets at the interface of thrombosis, inflammation, and cancer. Blood. 2015;126(5):582–8. https://doi.org/10.1182/blood-2014-08-531582.
30. Roweth H.G., Battinelli E.M. Lessons to learn from tumor-educated platelets. Blood. 2021;137(23):3174–80. https://doi.org/10.1182/blood.2019003976.
31. Stegner D., Dütting S., Nieswandt B. Mechanistic explanation for platelet contribution to cancer metastasis. Thromb Res. 2014;133 Suppl 2:S149–57. https://doi.org/10.1016/S0049-3848(14)50025-4.
32. Labelle M., Begum S., Hynes R.O. Direct signaling between platelets and cancer cells induces an epithelial-mesenchymal-like transition and promotes metastasis. Cancer Cell. 2011;20(5):576–90. https://doi.org/10.1016/j.ccr.2011.09.009.
33. Gay L.J., Felding-Habermann B. Contribution of platelets to tumour metastasis. Nat Rev Cancer. 2011;11(2):123–34. https://doi.org/10.1038/nrc3004.
34. Nazari P.M.S., Marosi C., Moik F. et al. Low systemic levels of chemokine CC motif ligand 3 (CCL3) are associated with a high risk of venous thromboembolism in patients with glioma. Cancers (Basel). 2019;11(12):2020. https://doi.org/10.3390/cancers11122020.
35. Hisada Y., Grover S.P., Maqsood A. et al. Neutrophils and neutrophil extracellular traps enhance venous thrombosis in mice bearing human pancreatic tumors. Haematologica. 2020;105(1):218–25. https://doi.org/10.3324/haematol.2019.217083.
36. Moik F., Zöchbauer-Müller S., Posch F. et al. Systemic inflammation and activation of haemostasis predict poor prognosis and response to chemotherapy in patients with advanced lung cancer. Cancers (Basel). 2020;12(6):1619. https://doi.org/10.3390/cancers12061619.
37. Marchetti M., Falanga A. Hemostatic biomarkers in occult cancer and cancer risk prediction. Thromb Res. 2020;191 Suppl 1:S37–S42. https://doi.org/10.1016/S0049-3848(20)30395-9.
38. Olson J.D. D-dimer: an overview of hemostasis and fibrinolysis, assays, and clinical applications. Adv Clin Chem. 2015;69:1–46. https://doi.org/10.1016/bs.acc.2014.12.001.
39. Wells P.S., Anderson D.R., Rodger M. et al. Evaluation of D-dimer in the diagnosis of suspected deep-vein thrombosis. N Engl J Med. 2003;349(13):1227–35. https://doi.org/10.1056/NEJMoa023153.
40. Di Nisio M., Squizzato A., Rutjes A.W. et al. Diagnostic accuracy of D-dimer test for exclusion of venous thromboembolism: a systematic review. J Thromb Haemost. 2007;5(2):296–304. https://doi.org/10.1111/j.1538-7836.2007.02328.x.
41. Weber T., Ho S., Auer J. et al. D-dimer in acute aortic dissection. Chest. 2003;123(5):1375–8. https://doi.org/10.1378/chest.123.5.1375.
42. Lehman C.M., Wilson L.W., Rodgers G.M. Analytic validation and clinical evaluation of the STA LIATEST immunoturbidimetric D-dimer assay for the diagnosis of disseminated intravascular coagulation. Am J Clin Pathol. 2004;122(2):178–84. https://doi.org/10.1309/X4YN-001G-U51N-GG9Y.
43. Ay C., Dunkler D., Pirker R. et al. High D-dimer levels are associated with poor prognosis in cancer patients. Haematologica. 2012;97(8):1158–64. https://doi.org/10.3324/haematol.2011.054718.
44. Li W., Tang Y., Song Y. et al. Prognostic role of pretreatment plasma D-dimer in patients with solid tumors: a systematic review and metaanalysis. Cell Physiol Biochem. 2018;45:1663–76. https://doi.org/10.1159/000487734.
45. Wu J., Fu Z., Liu G. et al. Clinical significance of plasma D-dimer in ovarian cancer: a meta-analysis. Medicine (Baltimore). 2017;96(25):e7062. https://doi.org/10.1097/MD.0000000000007062.
46. Lin Y., Liu Z., Qiu Y. et al. Clinical significance of plasma D-dimer and fibrinogen in digestive cancer: a systematic review and meta-analysis. Eur J Surg Oncol. 2018;44(10):1494–503. https://doi.org/10.1016/j.ejso.2018.07.052.
47. Moik F., Posch F., Grilz E. et al. Haemostatic biomarkers for prognosis and prediction of therapy response in patients with metastatic colorectal cancer. Thromb Res. 2020;187:9–17. https://doi.org/10.1016/j.thromres.2020.01.002.
48. Perisanidis C., Psyrri A., Cohen E. et al. Prognostic role of pretreatment plasma fibrinogen in patients with solid tumors: a systematic review and meta-analysis. Cancer Treat Rev. 2015;41(10):960–70. https://doi.org/10.1016/j.ctrv.2015.10.002.
49. Asada Y., Sumiyoshi A., Hayashi T. et al. Immunohistochemistry of vascular lesion in thrombotic thrombocytopenic purpura, with special reference to factor VIII related antigen. Thromb Res. 1985;38(5):469–9. https://doi.org/10.1016/0049-3848(85)90180-x.
50. Goertz L., Schneider S.W., Desch A. et al. Heparins that block VEGF-A-mediated von Willebrand factor fiber generation are potent inhibitors of hematogenous but not lymphatic metastasis. Oncotarget. 2016;7(42):68527–45. https://doi.org/10.18632/oncotarget.11832.
51. Bauer A.T., Suckau J., Frank K. et al. von Willebrand factor fibers promote cancer-associated platelet aggregation in malignant melanoma of mice and humans. Blood. 2015;125(20):3153–63. https://doi.org/10.1182/blood-2014-08-595686.
52. Chauhan A.K., Motto D.G., Lamb C.B. et al. Systemic antithrombotic effects of ADAMTS13. J Exp Med. 2006;203(3):767–76. https://doi.org/10.1084/jem.20051732.
53. Bergmeier W., Chauhan A.K., Wagner D.D. Glycoprotein Ibα and von Willebrand factor in primary platelet adhesion and thrombus formation: lessons from mutant mice. Thromb Haemost. 2008;99(2):264–70. https://doi.org/10.1160/TH07-10-0638.
54. De Meyer S.F., Savchenko A.S., Haas M.S. et al. Protective anti-inflammatory effect of ADAMTS13 on myocardial ischemia/reperfusion injury in mice. Blood. 2012;120(26):5217–223. https://doi.org/10.1182/blood-2012-06-439935.
55. Blann A.D., Balakrishnan B., Shantsila E. et al. Endothelial progenitor cells and circulating endothelial cells in early prostate cancer: a comparison with plasma vascular markers. Prostate. 2011;71(10):1047–53. https://doi.org/10.1002/pros.21319.
56. Pépin M., Kleinjan A., Hajage D. et al. ADAMTS-13 and von Willebrand factor predict venous thromboembolism in patients with cancer. J Thromb Haemost. 2016;14(2):306–15. https://doi.org/10.1111/jth.13205.
57. Bittar L.F., de Paula E.V., Mello T.B. et al. Polymorphisms and mutations in vWF and ADAMTS13 genes and their correlation with plasma levels of FVIII and vWF in patients with deep venous thrombosis. Clin Appl Thromb Hemost. 2011;17(5):514–8. https://doi.org/10.1177/1076029610375815.
58. Obermeier H.L., Riedl J., Ay C. et al. The role of ADAMTS-13 and von Willebrand factor in cancer patients: results from the Vienna Cancer and Thrombosis Study. Res Pract Thromb Haemost. 2019;3(3):503–14. https://doi.org/10.1002/rth2.12197.
59. Moik F., Prager G., Thaler J. et al. Hemostatic biomarkers and venous thromboembolism are associated with mortality and response to chemotherapy in patients with pancreatic cancer. Arterioscler Thromb Vasc Biol. 2021;41(11):2837–47. https://doi.org/10.1161/ATVBAHA.121.316463.
60. Beer J., Haeberli A., Vogt A. et al. Coagulation markers predict survival in cancer patients. Thromb Haemost. 2002;88(8):745–49.
61. Giaccherini C., Marchetti M., Masci G. et al. Thrombotic biomarkers for risk prediction of malignant disease recurrence in patients with early stage breast cancer. Haematologica. 2020;105(6):1704–11. https://doi.org/10.3324/haematol.2019.228981.
62. Kuhn W., Schmalfeldt B., Reuning U. et al. Prognostic significance of urokinase (uPA) and its inhibitor PAI-1 for survival in advanced ovarian carcinoma stage FIGO IIIc. Br J Cancer. 1999;79(11–12):1746–51. https://doi.org/10.1038/sj.bjc.6690278.
63. Schmalfeldt B., Kuhn W., Reuning U. et al. Primary tumor and metastasis in ovarian cancer differ in their content of urokinase-type plasminogen activator, its receptor, and inhibitors types 1 and 2. Cancer Res. 1995;55(48):3958–63.
64. Schmitt M., Harbeck N., Thomssen C. et al. Clinical impact of the plasminogen activation system in tumor invasion and metastasis: prognostic relevance and target for therapy. Thromb Haemost. 1997;78(1):285–96.
65. Bharadwaj A.G., Holloway R.W., Miller V.A., Waisman D.V. Plasmin and plasminogen system in the tumor microenvironment: implications for cancer diagnosis, prognosis, and therapy. Cancers (Basel). 2021;13(8):1838. https://doi.org/10.3390/cancers13081838.
66. Duffy M.J. Urokinase-type plasminogen activator: a potent marker of metastatic potential in human cancers. Biochem Soc Trans. 2002;30(2):207–10.
67. Harbeck N., Kates R.E., Look M.P. et al. Enhanced benefit from adjuvant chemotherapy in breast cancer patients classified high-risk according to urokinase-type plasminogen activator (uPA) and plasminogen activator inhibitor type 1 (n = 3424). Cancer Res. 2002;62(16):4617–22.
68. Levi M., de Jonge E., van der Poll T. New treatment strategies for disseminated intravascular coagulation based on current understanding of the pathophysiology. Ann Med. 2004;36(1):41–9. https://doi.org/10.1080/07853890310017251.
69. Griffin J.H., Zlokovic B., Fernández J.A. Activated protein C: potential therapy for severe sepsis, thrombosis, and stroke. Semin Hematol. 2002;39(3):197–205. https://doi.org/10.1053/shem.2002.34093.
70. Castoldi E., Rosing J. APC resistance: biological basis and acquired influences. J Thromb Haemost. 2010;8(3):445–53. https://doi.org/10.1111/j.1538-7836.2009.03711.x.
71. Sarig G., Michaeli Y., Lanir N., Brenner B., Haim N. Mechanisms for acquired activated protein C resistance in cancer patients. J Thromb Haemost. 2005;3(3):589–90. https://doi.org/10.1111/j.1538-7836.2005.01168.x.
72. Wilts I., Hutten B., Meijers J. et al. Association between protein C levels and mortality in patients with advanced prostate, lung and pancreatic cancer. Thromb Res. 2017;154:1–6. https://doi.org/10.1016/j.thromres.2017.03.001.
73. Ferroni P., Roselli M., Martini F. et al. Prognostic value of soluble P-selectin levels in colorectal cancer. Int J Cancer. 2004;111(3):404–8. https://doi.org/10.1002/ijc.20189.
74. Kanz R., Vukovich T., Vormittag R. et al. Thrombosis risk and survival in cancer patients with elevated C-reactive protein. J Thromb Haemost. 2011;9(1):57–63. https://doi.org/10.1111/j.1538-7836.2010.04069.x.
75. Reitter E.M., Kaider A., Ay C. et al. Longitudinal analysis of hemostasis biomarkers in cancer patients during antitumor treatment. J Thromb Haemost. 2016;14(2):294–305. https://doi.org/10.1111/jth.13218.
76. Man Y.-N., Wang Y.-.N, Hao J. et al. Pretreatment plasma D-dimer, fibrinogen, and platelet levels significantly impact prognosis in patients with epithelial ovarian cancer independently of venous thromboembolism. Int J Gynecol Cancer. 2015;25(1):24–32. https://doi.org/10.1097/IGC.0000000000000303.
77. Mirshahi S., Pujade-Lauraine E., Soria C. et al. D-dimer and CA 125 levels in patients with ovarian cancer during antineoplastic therapy prognostic significance for the success of anti-cancer treatment. Cancer. 1992;69(9):2289–92. https://doi.org/10.1002/1097-0142(19920501)69:9<2289::aid-cncr2820690914>3.0.co;2-a.
78. Li Q., Cong R., Kong F. et al. Fibrinogen is a coagulation marker associated with the prognosis of endometrial cancer. Onco Targets Ther. 2019;12:9947–56. https://doi.org/10.2147/OTT.S222813.
79. Seebacher V., Polterauer S., Grimm C. et al. The prognostic value of plasma fibrinogen levels in patients with endometrial cancer: a multi-centre trial. Br J Cancer. 2010;102(6):952–6. https://doi.org/10.1038/sj.bjc.6605547.
80. Nakamura K., Nakayama K., Ishikawa M. et al. High pre-treatment plasma D-dimer level as a potential prognostic biomarker for cervical carcinoma. Anticancer Res. 2016;36(6):2933–38.
81. Lal I., Dittus K., Holmes C.E. Platelets, coagulation and fibrinolysis in breast cancer progression. Breast Cancer Res. 2013;15(4):1–11. https://doi.org/10.1186/bcr3425.
82. Blackwell K., Haroon Z., Broadwater G. et al. Plasma D-dimer levels in operable breast cancer patients correlate with clinical stage and axillary lymph node status. J Clin Oncol. 2000;18(3):600–8. https://doi.org/10.1200/JCO.2000.18.3.600.
83. Mandoj C., Pizzuti L., Sergi D. et al. Observational study of coagulation activation in early breast cancer: development of a prognostic model based on data from the real world setting. J Transl Med. 2018;16(1):1–9. https://doi.org/10.1186/s12967-018-1511-x.
84. Dirix L.Y., Salgado R., Weytjens R. et al. Plasma fibrin D-dimer levels correlate with tumour volume, progression rate and survival in patients with metastatic breast cancer. Br J Cancer. 2002;86(3):389–95. https://doi.org/10.1038/sj.bjc.6600069.
85. Liu Y.-L., Lu Q., Liang J.-W. et al. High plasma fibrinogen is correlated with poor response to trastuzumab treatment in HER2 positive breast cancer. Medicine (Baltimore). 2015;94(9):e481. https://doi.org/10.1097/MD.0000000000000481.
86. Falanga A., Santoro A., Labianca R. et al. Hypercoagulation screening as an innovative tool for risk assessment, early diagnosis and prognosis in cancer: the HYPERCAN study. Thromb Res. 2016;140 Suppl 1:S55–9. https://doi.org/10.1016/S0049-3848(16)30099-8.
87. Marchetti M., Giaccherini C., Masci G. et al. Thrombin generation predicts early recurrence in breast cancer patients. J Thromb Haemost. 2020;18(9):2220–31. https://doi.org/10.1111/jth.14891.
88. Tinholt M., Vollan H.K.M., Sahlberg K.K. et al. Tumor expression, plasma levels and genetic polymorphisms of the coagulation inhibitor TFPI are associated with clinicopathological parameters and survival in breast cancer, in contrast to the coagulation initiator TF. Breast Cancer Res. 2015;17(1):44. https://doi.org/10.1186/s13058-015-0548-5.
89. Xu C., Wang H., He H. et al. Low expression of TFPI-2 associated with poor survival outcome in patients with breast cancer. BMC Cancer. 2013;13:118. https://doi.org/10.1186/1471-2407-13-118.
90. Henry N.L., Hayes D.F. Cancer biomarkers. Mol Oncol. 2012;6(2):140–6. https://doi.org/10.1016/j.molonc.2012.01.010.
Об авторах
Е. В. СлуханчукРоссия
Слуханчук Екатерина Викторовна – к.м.н., доцент кафедры акушерства, гинекологии и перинатальной медицины Клинического института детского здоровья имени Н.Ф. Филатова
119991 Москва, ул. Большая Пироговская, д. 2, стр. 4
В. О. Бицадзе
Россия
Бицадзе Виктория Омаровна – д.м.н., профессор РАН, профессор кафедры акушерства, гинекологии и перинатальной медицины Клинического института детского здоровья имени Н.Ф. Филатова
Scopus Author ID: 6506003478, Researcher ID: F-8409-2017
119991 Москва, ул. Большая Пироговская, д. 2, стр. 4
А. Г. Солопова
Россия
Солопова Антонина Григорьевна – д.м.н., профессор кафедры акушерства, гинекологии и перинатальной медицины Клинического института детского здоровья имени Н.Ф. Филатова
Scopus Author ID: 6505479504, Researcher ID: Q-1385-2015
119991 Москва, ул. Большая Пироговская, д. 2, стр. 4
Д. Х. Хизроева
Россия
Хизроева Джамиля Хизриевна – д.м.н., профессор кафедры акушерства, гинекологии и перинатальной медицины Клинического института детского здоровья имени Н.Ф. Филатова
Scopus Author ID: 57194547147, Researcher ID: F-8384-2017
119991 Москва, ул. Большая Пироговская, д. 2, стр. 4
Ж.-К. Гри
Франция
Гри Жан-Кристоф – д.м.н., профессор кафедры акушерства, гинекологии и перинатальной медицины Клинического института детского здоровья имени Н.Ф. Филатова ФГАОУ ВО Первый Московский государственный медицинский университет имени И.М. Сеченова Министерства здравоохранения Российской Федерации (Сеченовский университет); профессор гематологии, зав. лабораторией гематологии факультета биологических и фармацевтических наук Университета Монпелье и Университетской больницы Нима, Франция; иностранный член РАН
Scopus Author ID: 7005114260, Researcher ID: AAA-2923-2019
119991 Москва, ул. Большая Пироговская, д. 2, стр. 4
Франция, 34090 Монпелье, ул. Огюста Бруссоне, д. 163
И. Элалами
Франция
Элалами Исмаил – д.м.н., профессор кафедры акушерства, гинекологии и перинатальной медицины Клинического института детского здоровья имени Н.Ф. Филатова ФГАОУ ВО Первый Московский государственный медицинский университет имени И.М. Сеченова Министерства здравоохранения Российской Федерации (Сеченовский Университет); профессор медицинского Университета Сорбонны, Париж, Франция; директор гематологии Центра Тромбозов, Госпиталь Тенон, Париж, Франция
Scopus Author ID: 7003652413, Researcher ID: AAC-9695-2019
119991 Москва, ул. Большая Пироговская, д. 2, стр. 4
75006 Париж, Улица медицинского факультета, д. 12
75020 Париж, Китайская улица, д. 4
Д. В. Щербаков
Россия
Щербаков Денис Викторович – к.м.н., доцент кафедры общей гигиены института общественного здоровья имени Ф.Ф. Эрисмана
119991 Москва, ул. Большая Пироговская, д. 2, стр. 4
А. С. Шкода
Россия
Шкода Андрей Сергеевич – д.м.н., профессор, главный врач ГБУЗ «Городская клиническая больница No 67 имени Л.А. Ворохобова Департамента здравоохранения города Москвы»
123423 Москва, ул. Саляма Адиля, д. 2/44
Л. Л. Панкратьева
Россия
Панкратьева Людмила Леонидовна – д.м.н., врач-неонатолог, врач-гематолог, руководитель научно-клинического центра ГБУЗ «Городская клиническая больница No 67 имени Л.А. Ворохобова Департамента здравоохранения города Москвы»; доцент, профессор кафедры педиатрии и организации здравоохранения ФГБУ «Национальный медицинский исследовательский центр детской гематологии, онкологии и иммунологии имени Дмитрия Рогачева» Министерства здравоохранения Российской Федерации
Scopus Author ID: 7006391091, Author ID: 697284
123423 Москва, ул. Саляма Адиля, д. 2/44
117997 Москва, ул. Саморы Машела, д. 1
Д. Ю. Унгиадзе
Грузия
Унгиадзе Джумбер Юрьевич – д.м.н., профессор медицинского факультета
6010 Батуми, ул. Ниношвили, д. 35
Л. А. Ашрафян
Россия
Ашрафян Лев Андреевич – д.м.н., профессор, академик РАН, заслуженный врач РФ, директор Института онкогинекологии и маммологии, зам. директора ФГБУ «Национальный медицинский исследовательский центр акушерства, гинекологии и перинатологии имени академика В.И. Кулакова» Министерства здравоохранения Российской Федерации
Scopus Author ID: 57194173388
117997 Москва, ул. академика Опарина, д. 4
А. Д. Макацария
Россия
Макацария Александр Давидович – д.м.н., профессор, академик РАН, зав. кафедрой акушерства, гинекологии и перинатальной медицины Клинического института детского здоровья имени Н.Ф. Филатова ФГАОУ ВО Первый Московский государственный медицинский университет имени И.М. Сеченова Министерства здравоохранения Российской Федерации (Сеченовский Университет); вице-президент Российского общества акушеров-
гинекологов (РОАГ); Заслуженный врач Российской Федерации; Почетный профессор Венского Университета
Scopus Author ID: 57222220144, Researcher ID: M-5660-2016
119991 Москва, ул. Большая Пироговская, д. 2, стр. 4
Рецензия
Для цитирования:
Слуханчук Е.В., Бицадзе В.О., Солопова А.Г., Хизроева Д.Х., Гри Ж., Элалами И., Щербаков Д.В., Шкода А.С., Панкратьева Л.Л., Унгиадзе Д.Ю., Ашрафян Л.А., Макацария А.Д. Показатели гемостаза как прогностические биомаркеры у онкогинекологических пациенток. Акушерство, Гинекология и Репродукция. 2023;17(2):257-268. https://doi.org/10.17749/2313-7347/ob.gyn.rep.2023.406
For citation:
Slukhanchuk E.V., Bitsadze V.O., Solopova A.G., Khizroeva J.Kh., Gris J., Elalamy I., Shcherbakov D.V., Shkoda A.S., Pankratyeva L.L., Ungiadze J.Yu., Ashrafyan L.A., Makatsariya A.D. Hemostasis parameters as prognostic biomarkers in gynecological cancer patients. Obstetrics, Gynecology and Reproduction. 2023;17(2):257-268. (In Russ.) https://doi.org/10.17749/2313-7347/ob.gyn.rep.2023.406

Контент доступен под лицензией Creative Commons Attribution-NonCommercial-ShareAlike 4.0 International License.











































