Перейти к:
Клиническое значение определения ADAMTS-13 и фактора фон Виллебранда у беременных после перенесенного COVID-19
https://doi.org/10.17749/2313-7347/ob.gyn.rep.2023.386
Аннотация
Введение. Коронавирусная инфекция связана с выраженной эндотелиопатией, тромбовоспалением и иммунотромбозом. Эти процессы приводят к чрезмерному высвобождению мультимеров фактора фон Виллебранда (англ. von Willebrand factor, vWF) из телец Вейбеля–Паладе, что может влиять на активность металлопротеиназы ADAMTS-13 (англ. a disintegrin and metalloproteinase with thrombospondin type 1 motif, member 13) и ось ADAMTS-13/vWF, изменения которых у небеременных с тяжелым COVID-19 показали наши предыдущие работы.
Цель: изучение клинической роли активации системы гемостаза, в частности, изменений в оси ADAMTS-13/vWF у беременных после перенесенного COVID-19.
Материалы и методы. Проведено проспективное исследование «случай–контроль», в которое были включены 135 беременных. Пациентки были разделены на 3 группы: в группу 1 вошли 45 женщин с перенесенным COVID-19 во время беременности, в группу 2 – 45 беременных с COVID-19 в острый период болезни, в группу 3 – 45 здоровых беременных. У всех женщин определяли содержание vWF и ADAMTS-13 в плазме крови.
Результаты. Концентрация антигена vWF (vWF:Ag) в острый период болезни у беременных с COVID-19 была значительно выше по сравнению с контрольной группой (p < 0,001). Уровень ADAMTS-13 у беременных после COVID-19 не отличался от контрольной группы, в то время как концентрация vWF была гораздо выше у 66,7 % (30/45) женщин. Отношение ADAMTS-13/vWF было повышено и достоверно отличалось как у беременных в острый период болезни (p < 0,001), так и у беременных после перенесенной инфекции (p = 0,0002) от контрольной группы.
Заключение. У беременных с COVID-19 наблюдается выраженная эндотелиопатия, которая сохраняется в течение нескольких месяцев после выздоровления. Отношение ADAMTS-13/vWF определяет функционирование оси, риск микроциркуляторных нарушений и клинических осложнений.
Для цитирования:
Гашимова Н.Р., Григорьева К.Н., Бицадзе В.О., Панкратьева Л.Л., Хизроева Д.Х., Третьякова М.В., Шаммут Я.М., Юпатов Е.Ю., Цибизова В.И., Гри Ж., Блинов Д.В., Макацария А.Д. Клиническое значение определения ADAMTS-13 и фактора фон Виллебранда у беременных после перенесенного COVID-19. Акушерство, Гинекология и Репродукция. 2023;17(1):8-17. https://doi.org/10.17749/2313-7347/ob.gyn.rep.2023.386
For citation:
Gashimova N.R., Grigoreva K.N., Bitsadze V.O., Pankratyeva L.L., Khizroeva J.Kh., Tretyakova M.V., Shammut Ya.M., Iupatov E.I., Tsibizova V.I., Gris J., Blinov D.V., Makatsariya A.D. Clinical significance of assessing ADAMTS-13 and von Willebrand factor level in COVID-19 convalescent pregnant women. Obstetrics, Gynecology and Reproduction. 2023;17(1):8-17. https://doi.org/10.17749/2313-7347/ob.gyn.rep.2023.386
ВВЕДЕНИЕ / INTRODUCTION
Коронавирусная инфекция 2019 г. (COVID-19) по-прежнему остается глобальной чрезвычайной проблемой в области здравоохранения. Хотя изначально считалось, что болезнь ограничена дыхательными путями, вскоре стало ясно, что это многосистемное заболевание, вызывающее коагулопатию, почечную недостаточность, дисфункцию печени и сердечную недостаточность [1]. Тяжелое течение заболевания чаще встречается у пожилых и у людей с хроническими заболеваниями, такими как сахарный диабет, гипертоническая болезнь, хроническая обструктивная болезнь легких, ишемическая болезнь сердца и хроническая болезнь почек [2]. Инфекция SARS-CоV-2 связана с колоссальным количеством тромботических осложнений, таких как тромбоз глубоких вен и тромбоэмболия легочной артерии [3]. Как правило, тяжелое течение инфекции SARS-CoV-2 наблюдается при сильной воспалительной реакции из-за высвобождения и инфильтрации нейтрофилов в различных органах с образованием внеклеточных ловушек нейтрофилов (англ. neutrophil extracellular traps, NETs), повышением в плазме содержания провоспалительных цитокинов и хемокинов, приводящих к цитокиновому шторму, массивному поражению эндотелия, активации макрофагов, тромбоцитов и эндотелиальных клеток [4][5]. Одними из основных причин смертности у пациентов с COVID-19 являются тромбовоспалительные сопутствующие заболевания, такие как гиперкоагуляция, тромбозы и дыхательная недостаточность из-за микрососудистого тромбоза легких [6][7].
У беременных с COVID-19 спектр клинических проявлений широко варьирует от бессимптомных до тяжелых. Действительно, клинические проявления варьируются от легких, как обычная простуда, до тяжелых заболеваний с тромботическими осложнениями [8]. Как известно, инфекция SARS-CoV-2 во время беременности может быть дополнительным триггером тяжелых тромботических осложнений [9], поскольку беременность уже является физиологическим гиперкоагуляционным состоянием. Патофизиологическими явлениями, лежащими в основе повышенного риска акушерских осложнений, в основном являются цитокиновый шторм, активация циркулирующих клеток, таких как макрофаги, Т-лимфоциты и эндотелиальные клетки. SARS-CoV-2 способствует развитию эндотелиита в различных органах и тканях, приводя к повреждению эндотелия [10] и, в свою очередь, тромботической микроангиопатии (ТМА), которая связана с наиболее угрожающими последствиями инфекции [11]. Важным этиологическим фактором, приводящим к ТМА, является недостаточность металлопротеиназы ADAMTS-13 (англ. a disintegrin and metalloproteinase with a thrombospondin type 1 motif, member 13). ADAMTS-13 принадлежит к семейству пептидазных белков, биологической функцией которой является расщепление мультимеров фактора фон Виллебранда (англ. von Willebrand factor, vWF). Эндотелиальное поражение приводит к чрезмерному высвобождению мультимеров vWF из телец Вейбеля–Паладе, что приводит к потреблению ADAMTS-13; также важно помнить, что NETs способны угнетать активность ADAMTS-13 с последующим повышением концентрации vWF. В свою очередь, избыточное накопление ультравысокомолекулярных мультимеров vWF в комплексе с тромбоцитами может вызывать тромбоз микроциркуляторного русла [12]. В мировой медицинской литературе появляется большое количество публикаций о возможной роли взаимоотношения ADAMTS-13 и vWF при оценке острых состояний, обусловленных СOVID-19. В норме баланс между ADAMTS-13 и vWF играет важнейшую роль в поддержании нормальной циркуляции в жизненно важных органах. В совокупности эти данные свидетельствуют о том, что острая активация эндотелиальных клеток и нарушение регуляции нормальной оси ADAMTS-13/vWF играют важную роль в патогенезе лежащего в основе иммунотромбоза COVID-19. В предыдущем нашем исследовании мы показали, что повышение значений vWF:Ag, снижение концентрации ADAMTS-13, дисбаланс оси ADAMTS-13/vWF достоверно коррелируют с низкой выживаемостью пациентов с тяжелой коронавирусной инфекцией [13].
В недавнем исследовании H. Fogarty с соавт. продемонстрировали, что уровни vWF:Ag, и фактора VIII (FVIII) в плазме крови остаются значительно повышенными через 3 мес у пациентов, переболевших коронавирусной болезнью, по сравнению со здоровой контрольной группой [14]. На основании этих данных можно предположить роль устойчивой активации эндотелиальных клеток у пациентов после COVID-19. В данном исследовании мы поставили цель изучить изменения в оси ADAMTS-13/vWF у беременных с перенесенной коронавирусной инфекцией, что может быть клинически значимо.
Цель: изучение клинической роли активации системы гемостаза, в частности, изменений в оси ADAMTS-13/vWF у беременных после перенесенного COVID-19.
МАТЕРИАЛЫ И МЕТОДЫ / MATERIALS AND МETHODS
Дизайн исследования / Study design
Проспективное рандомизированное исследование «случай-контроль» с участием 135 беременных проводилось на следующих клинических базах: Родильный дом № 4 при ГБУЗ ГКБ им. В.В. Виноградова ДЗМ, Перинатальный центр ГБУЗ ГКБ № 67 им. Л.А. Ворохобова ДЗМ, ГАУЗ РКИБ им. проф. А.Ф. Агафонова Минздрава Республики Татарстан.
Группы обследованных / Patient groups
Пациентки были разделены на 3 группы. В группу 1 вошли 45 пациенток с перенесенным COVID-19 во время беременности, в группу 2 – 45 беременных с COVID-19 в острый период болезни. Контрольную группу составили 45 здоровых беременных.
Критерии включения и исключения / Inclusion and exclusion criteria
Критерии включения: возраст более 18 лет; беременные с установленным диагнозом COVID-19 во время беременности (SARS-CoV-2 положительный ПЦР-тест); одноплодная беременность; добровольное информированное согласие на участие в исследовании.
Критерии включения в контрольную группу: возраст более 18 лет; одноплодная беременность; физиологическое течение беременности; добровольное информированное согласие на участие в исследовании.
Критерии исключения: возраст менее 18 лет; наличие активного инфекционного и/или воспалительного процесса; подтверждённый положительный анализ на антитела к ВИЧ; маркёры вирусных гепатитов, сифилиса; женщины, перенесшие ОРВИ, и вакцинированные; признаки тромботического или геморрагического синдрома на момент первого обследования; отказ от участия в исследовании.
Методы исследования / Study methods
Образцы периферической крови пациенток, полученные в день госпитализации до начала лечения, помещали в 3,2 % буферизованный раствор цитрата натрия и центрифугировали в течение 20 мин при 3000 g при комнатной температуре, отбирали плазму и хранили при температуре –80 °С. В полученных пробах определяли содержание антигена фактора фон Виллебранда (vWF:Ag), антигена ADAMTS-13 (ADAMTS-13:Ag), активности ADAMTS-13 (ADAMTS-13:Aс), ингибитора ADAMTS-13 (ADAMTS-13:i) с использованием коммерческих наборов тестов TECHNOZYM® (Technoclone Herstellung von Diagnostika und Arzneimitteln Gmb, Австрия). Согласно данным производителя, нормальным референтным диапазоном для ADAMTS-13:Ag считали 0,41–1,41 ЕД/мл, для ADAMTS-13:Aс – 0,4–1,3 МЕ/мл, для ADAMTS-13:i – менее 15 ЕД/мл; для vWF:Ag – 0,5– 1,5 МЕ/мл (50–150 %).
Этические аспекты / Ethical aspects
Исследование было одобрено локальным этическим комитетом ФГАОУ ВО Первый МГМУ им. И.М. Сеченова Минздрава России (Сеченовский Университет), протокол № 04-22 от 16.02.2022. Все пациентки, участвовавшие в исследовании, были проинформированы о характере исследования и включении результатов обследования в научно-исследовательскую работу. У всех пациенток получено письменное информированное согласие.
Исследование проведено в соответствии с этическими стандартами Хельсинской декларации Всемирной медицинской ассоциации.
Статистический анализ / Statistical analysis
Полученные данные были систематизированы в электронных таблицах Microsoft Office Excel 2021 (Microsoft, США). Статистическая обработка данных была выполнена с помощью программы Jamovi, версия 1.2.5 (The jamovi project, Австралия). Статистический анализ включал в себя расчёт описательных статистик: средней (M), медианы (Ме), среднеквадратического отклонения (SD), границы 95 % доверительного интервала (95 % ДИ). При сравнении количественных данных использовали критерий Манна–Уитни. Для проверки статистической значимости факторов использовали однофакторный дисперсионный анализ путем расчета точного критерия Фишера, значение которого менее 0,05 свидетельствовало о наличии статистически значимых различий, значение критерия Фишера «р» более 0,05 – об отсутствии различий.
РЕЗУЛЬТАТЫ И ОБСУЖДЕНИЕ/ RESULTS AND DISCUSSION
Клинико-анамнестические данные и перинатальные исходы обследованных участниц исследования представлены в таблице 1.
Таблица 1. Клинико-анамнестическая характеристика и перинатальные исходы.
Table 1. Clinical and anamnestic characteristics and perinatal outcomes.

Обследованные женщины достоверно не различались с точки зрения материнских характеристик. У двух пациенток из группы 1 и трех пациенток из группы 2 зафиксирована артериальная гипертензия, и еще в каждой из этих групп у 2 пациенток была легкая преэклампсия во время беременности. В случаях с перенесенным COVID-19 ни у одной из пациенток не было признаков плацентарной недостаточности и задержки роста плода. Большинство беременных из группы 1 (75,5 %; 34/45) перенесли коронавирусную инфекцию в легкой форме, 7/45 (15,6 %) – в средней и только 4/45 (8,9 %) – в тяжелой форме, что достоверно не отличалось от группы 2. Пациентки со средним и тяжелым течением COVID-19 были госпитализированы в инфекционный стационар для лечения и наблюдения. Тяжелые случаи COVID-19 не были критическими. Низкомолекулярный гепарин в острой фазе инфицирования получали 17 (37,7 %) пациенток из группы 1 и 12 (26,6 %) пациенток из группы 2.
Среди обследованных беременных не наблюдалось случаев перинатальной смертности; потери беременности в анамнезе имели 13,3 % (6/45) пациенток из группы 1, 46,6 % (21/45) из группы 2 и 15,6 % (7/45) из группы 3. Из анамнеза госпитализированных пациенток было выяснено, что на долю преждевременных родов приходилось 6,7 % (3/45) наблюдений из группы 2. В целом, роды через естественные родовые пути произошли у большинства женщин (91,1 %; 41/45) из группы 1 и группы 2 (60,0 %; 27/45). Преждевременные роды наблюдались только в группе 2 и составили 24,4 % (11/45).
В таблице 2 представлены результаты лабораторных показателей обследованных участниц исследования.
Таблица 2. Результаты изученных лабораторных показателей.
Table 2. Laboratory parameter assessment.
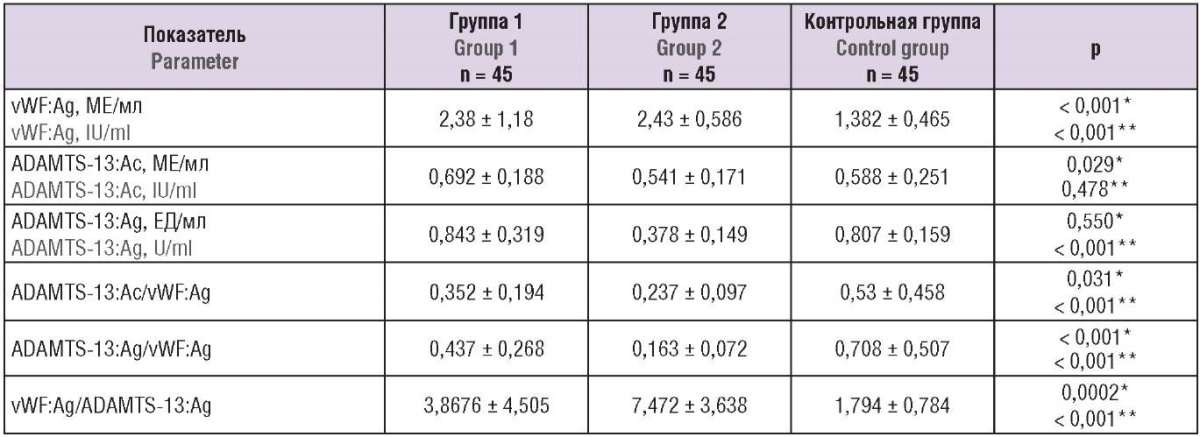
Примечание: *значимость различий между группой 1 и контрольной группой; **значимость различий между группой 2 и контрольной группой.
Note: *significance of differences between group 1 and control group; **significance of differences between group 2 and control group.
У обследованных женщин были выявлены значимые различия в содержании vWF:Ag между пациентками в острый период болезни (группа 2) и контрольной группой (p < 0,001), а также между беременными в постковидном состоянии (группа 1) и контрольной группой (p < 0,001). Были очевидны заметные межиндивидуальные различия в содержании vWF:Ag, которое варьировало от 1,063 до 6,074 МЕ/мл у реконвалесцентов. Соответственно, уровень vWF:Ag в плазме выше верхней границы нашего локального референтного диапазона нормы (0,5–1,5 МЕ/мл) наблюдали у 66,7 % (30/45) пациенток с перенесенным COVID-19 (группа 1), при этом средний уровень vWF:Ag в этой группе составлял 2,38 МЕ/мл, что значительно выше по сравнению с контрольной группой, где только у 40,0 % (18/45) беременных он был выше, составляя в среднем 1,382 МЕ/мл (рис. 1). Таким образом, высокий уровень vWF:Ag в плазме крови беременной после перенесенной коронавирусной инфекции указывает на продолжающуюся эндотелиопатию и активацию эндотелиальных клеток.
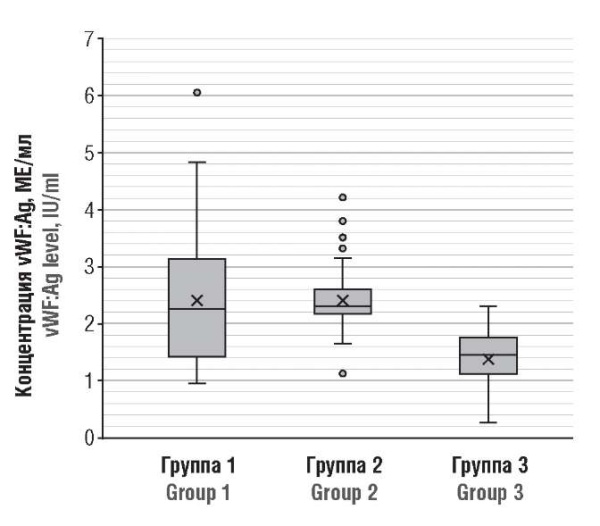
Рисунок 1. Концентрация антигена фактора фон Виллебранда (vWF:Ag) у беременных пациенток после перенесенного COVID-19 (группа 1), в острый период COVID-19 (группа 2) и у здоровых беременных (группа 3).
Figure 1. von Willebrand factor antigen (vWF:Ag) level in post-COVID-19 pregnant patients (Group 1), acute COVID-19 (Group 2), and healthy pregnant women (Group 3).
Значимых различий при оценке ADAMTS-13:Ac среди пациенток с перенесённой коронавирусной инфекцией (группа 1) и контрольной группой, а также среди пациенток с COVID-19 в острый период (группа 2) и контрольной группой выявлено не было.
При оценке концентрации ADAMTS-13:i были выявлены значимые различия при сравнении групп 1 и 2 с контрольной (рис. 2): у здоровых беременных (группа 3) содержание ADAMTS-13:i составило 3,144 ± 2,657 ЕД/мл, что существенно ниже, чем в группе 2 – 7,3920 ± 5,817 ЕД/мл (р < 0,001) и в группе 1 – 5,619 ± 3,227 ЕД/мл (р = 0,0002).
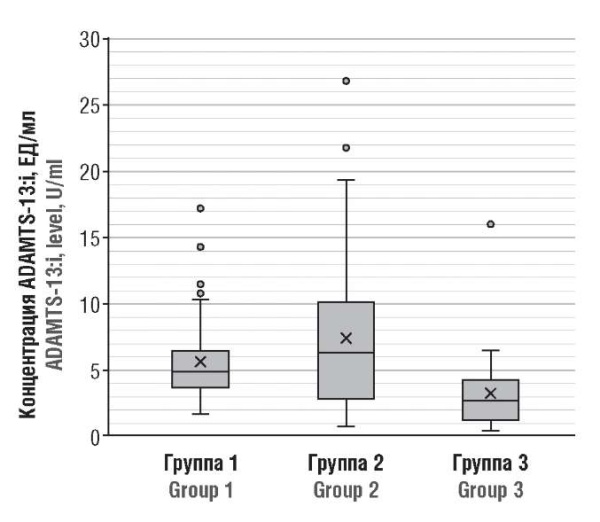
Рисунок 2. Концентрация ингибитора ADAMTS-13 (ADAMTS-13:i) у беременных пациенток после коронавирусной инфекции (группа 1), в острый период болезни (группа 2) и здоровых беременных (группа 3).
Figure 2. ADAMTS-13 inhibitor (ADAMTS-13:i) level in post-COVID-19 pregnant patients (Group 1), period COVID-19 (Group 2), and healthy pregnant women (Group 3).
Существенные различия были обнаружены в содержании ADAMTS-13:Ag между беременными в острый период болезни (группа 2) и здоровыми беременными (р < 0,001); значимой статистической разницы не было установлено при сравнении постковидных (группа 1) и здоровых беременных (рис. 3).
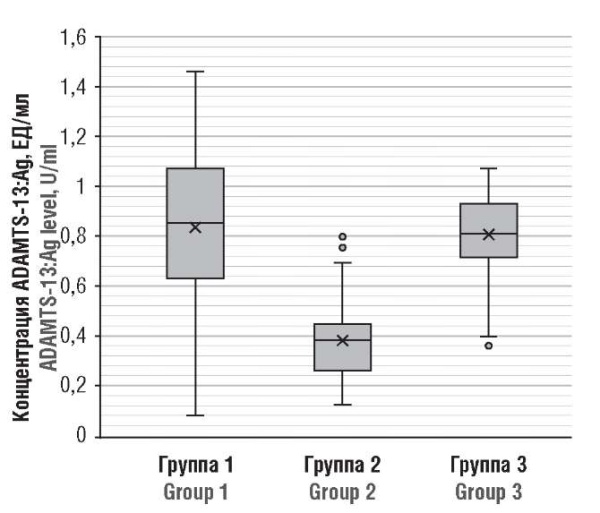
Рисунок 3. Концентрация антигена ADAMTS-13 (ADAMTS-13:Ag) у беременных пациенток после перенесенного COVID-19 (группа 1), в острый период COVID-19 (группа 2) и у здоровых беременных (группа 3).
Figure 3. ADAMTS-13 antigen (ADAMTS-13:Ag) level in post-COVID-19 pregnant patients (Group 1), acute COVID-19 (Group 2), and healthy pregnant women (Group 3).
Более чем у половины (55,6 %; 25/45) беременных в острый период COVID-19 (группа 2) наблюдали рост концентрации vWF:Ag c одновременным снижением уровня ADAMTS-13, что скорее всего явилось результатом вторичного потребления металлопротеиназы ADAMTS-13. А отношение vWF:Ag/ADAMTS-13:Ag значительно выше, чем у здоровых пациенток (p < 0,001), демонстрирует нарушение в оси vWF/ADAMTS-13 и системе регуляции нормальной микроциркуляции.
В постковидном состоянии (группа 1) только в 6,7 % (3/45) случаев определено повышение значений vWF:Ag c одновременным снижением содержания ADAMTS-13, следовательно, ADAMTS-13 не потребляется в таком количестве, как в острый период болезни. Таким образом, регуляторная функция оси vWF:Ag/ADAMTS-13:Ag остается неповрежденной в достоверно большем количестве процентов пациенток (рис. 4).
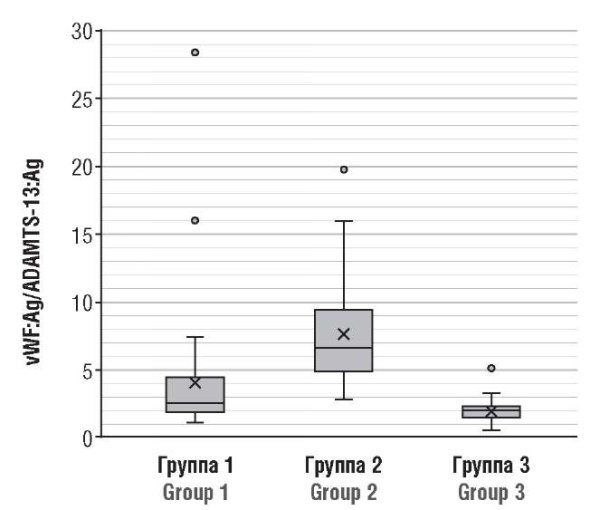
Рисунок 4. Ось vWF:Ag/ADAMTS-13:Ag у беременных пациенток после перенесенного COVID-19 (группа 1), в острый период COVID-19 (группа 2) и у здоровых беременных (группа 3).
Figure 4. vWF:Ag/ADAMTS-13:Ag axis in post-COVID-19 pregnant patients (Group 1), acute COVID-19 (Group 2), and healthy pregnant women (Group 3).
В острой фазе COVID-19 заболевание носит гипервоспалительный и протромботический характер и поэтому негативно влияет на уровень нескольких тромбовоспалительных маркеров, что приводит к эндотелиопатии и повышает восприимчивость к тромботическим и микрососудистым нарушениям (в том числе микротромбозам и ТМА) [15]. Поэтому неудивительно, что ось ADAMTS-13/vWF может участвовать в ТМА и цитокиновом шторме, наблюдаемых во время COVID-19 вне беременности. У взрослых небеременных, чем больше нарушена ось ADAMTS-13/vWF, тем тяжелее заболевание [13]. В данном исследовании большинство беременных с инфекцией SARS-CoV-2 имели легкую форму заболевания, но что касается исходов для плода и матери, мы обнаружили значительно более высокую распространенность преждевременных родов в острый период COVID-19 (24,4 %). Заслуживает внимания точка зрения E. Grandone с соавт., что одним из важнейших факторов преждевременных родов у женщин с COVID-19 является эндотелиопатия и дисбаланс vWF и ADAMTS-13, что может способствовать многоорганному тромбозу с клинической картиной ТМА [16]. Мы считаем крайне важным дальнейшее исследование в этой области для подтверждения роли эндотелиопатии и других скрытых нарушений гемостаза в возникновении осложнений беременности.
ЗАКЛЮЧЕНИЕ / CONCLUSION
Наши данные дают новое представление о природе устойчивой эндотелиопатии и дисбаланса оси ADAMTS-13/vWF у беременных после перенесенного COVID-19. Именно отношение ADAMTS-13/vWF определяет функционирование оси, риск микроциркуляторных нарушений и клинических осложнений. Таким образом, в клинической практике большое значение имеет определение отношения ADAMTS-13/vWF. В соответствии с ключевой ролью иммунотромбоза при остром COVID-19, наши результаты подтверждают гипотезу о том, что сохраняется стойкая эндотелиопатия и дисфункция гемостаза после COVID-19 во время беременности, что клинически значимо для ведения данных пациенток. Необходимы дальнейшие исследования на более крупных выборках с более длительным последующим наблюдением для подтверждения этих данных. Если полученные нами данные подтвердятся, то это может открыть новые возможности в терапии постковидных состояний.
Список литературы
1. Huang C., Wang Y., Li X. et al. Clinical features of patients infected with 2019 novel coronavirus in Wuhan, China. Lancet. 2020;395(10223):497– 506. https://doi.org/10.1016/S0140-6736(20)30183-5.
2. Wang D., Hu B., Hu C. et al. Clinical characteristics of 138 hospitalized patients with 2019 novel coronavirus-infected pneumonia in Wuhan, China. JAMA. 2020;323(11):1061–9. https://doi.org/10.1001/jama.2020.1585.
3. Kollias A., Kyriakoulis K.G., Dimakakos E. et al. Thromboembolic risk and anticoagulant therapy in COVID-19 patients: emerging evidence and call for action. Br J Haematol. 2020;189(5):846–7. https://doi.org/10.1111/bjh.16727.
4. Гашимова Н.Р., Бицадзе В.О., Панкратьева Л.Л. и др. Дисрегуляция функции тромбоцитов у больных COVID-19. Акушерство, Гинекология и Репродукция. 2022;16(6):692–705. https://doi.org/10.17749/2313-7347/ob.gyn.rep.2022.372.
5. Бицадзе В.О., Слуханчук Е.В., Хизроева Д.Х. и др. Внеклеточные ловушки нейтрофилов (NETs) в патогенезе тромбоза и тромбовоспалительных заболеваний. Вестник РАМН. 2021;76(1):75–85. https://doi.org/10.15690/vramn1395.
6. Gibson P.G., Qin L., Puah S.H. COVID-19 acute respiratory distress syndrome (ARDS): clinical features and differences from typical pre-COVID19 ARDS. Med J Aust. 2020;213(2):54–56.e1. https://doi.org/10.5694/mja2.50674.
7. Ribes A., Vardon-Bounes F., Mémier V. et al. Thromboembolic events and Сovid-19. Adv Biol Regul. 2020;77:100735. https://doi.org/10.1016/j.jbior.2020.100735.
8. Cardona-Perez ́ J.A., Villegas-Mota I., Helguera-Repetto A.C. et al. Prevalence, clinical features, and outcomes of SARS-CoV-2 infection in pregnant women with or without mild/moderate symptoms: results from universal screening in a tertiary care center in Mexico City, Mexico. PLoS One. 2021;16(4):e0249584. https://doi.org/10.1371/journal.pone.0249584.
9. Martinelli I., Ferrazzi E., Ciavarella A. et al. Pulmonary embolism in a young pregnant woman with COVID-19. Thromb Res. 2020;191:36–7. https://doi.org/10.1016/j.thromres.2020.04.022.
10. Varga Z., Flammer A.J., Steiger P. et al. Endothelial cell infection and endotheliitis in COVID-19. Lancet. 2020;395(10234):1417–8. https://doi.org/10.1016/S0140-6736(20)30937-5.
11. Makatsariya A.D., Slukhanchuk E.V., Bitsadze V.O. et al. Thrombotic microangiopathy, DIC-syndrome and COVID-19: link with pregnancy prothrombotic state. J Matern Neonatal Med. 2022;35(13):2536–44. https://doi.org/10.1080/14767058.2020.1786811.
12. Tiscia G., Favuzzi G., De Laurenzo A. et al. The prognostic value of adamts-13 and von willebrand factor in covid-19 patients: prospectiveevaluation by care setting. Diagnostics (Basel). 2021;11(9):1648. https://doi.org/10.3390/diagnostics11091648.
13. Бицадзе В.О., Хизроева Д.Х., Гри Ж. и др. Патогенетическое и прогностическое значение воспаления и нарушений в оси ADAMTS-13/vWF у больных тяжелой формой COVID-19. Акушерство, Гинекология и Репродукция. 2022;16(3):228–243. https://doi.org/10.17749/2313-7347/ob.gyn.rep.2022.327.
14. Fogarty H., Townsend L., Morrin H. et al. Persistent endotheliopathy in the pathogenesis of long COVID syndrome. J Thromb Haemost. 2021;19(10):2546–53. https://doi.org/10.1111/jth.15490.
15. Bonaventura A., VecchiéA., Dagna L. et al. Endothelial dysfunction and immunothrombosis as key pathogenic mechanisms in COVID-19. Nat Rev Immunol. 2021;21(5):319–29. https://doi.org/10.1038/s41577-021-00536-9.
16. Grandone E., Vimercati A., Sorrentino F. et al. Obstetric outcomes in pregnant COVID-19 women: the imbalance of von Willebrand factor and ADAMTS13 axis. BMC Pregnancy Childbirth. 2022;22(1):142. https://doi.org/10.1186/s12884-022-04405-8.
Об авторах
Н. Р. ГашимоваРоссия
Гашимова Нилуфар Рамиль кызы – аспирант кафедры акушерства, гинекологии и перинатальной медицины Клинического института детского здоровья имени Н.Ф. Филатова
1 Москва, ул. Большая Пироговская, д. 2, стр. 4
К. Н. Григорьева
Россия
Григорьева Кристина Николаевна – ассистент кафедры акушерства, гинекологии и перинатальной медицины Клинического института детского здоровья имени Н.Ф. Филатова
119991 Москва, ул. Большая Пироговская, д. 2, стр. 4
В. О. Бицадзе
Россия
Бицадзе Виктория Омаровна – д.м.н., профессор РАН, профессор кафедры акушерства, гинекологии и перинатальной медицины Клинического института детского здоровья имени Н.Ф. Филатова
Scopus Author ID: 6506003478
ResearcherID: F-8409-2017
119991 Москва, ул. Большая Пироговская, д. 2, стр. 4
Л. Л. Панкратьева
Россия
Панкратьева Людмила Леонидовна – д.м.н., доцент, профессор кафедры педиатрии и организации здравоохранения; врач-неонатолог, врач-гематолог, руководитель научно-клинического центра
Scopus Author ID: 7006391091
Author ID: 697284
117997 Москва, ул. Саморы Машела, д. 1
123423 Москва, ул. Саляма Адиля, д. 2/44
Д. Х. Хизроева
Россия
Хизроева Джамиля Хизриевна – д.м.н., профессор кафедры акушерства, гинекологии и перинатальной медицины Клинического института детского здоровья имени Н.Ф. Филатова
Scopus Author ID: 57194547147
Researcher ID: F-8384-2017
119991 Москва, ул. Большая Пироговская, д. 2, стр. 4
М. В. Третьякова
Россия
Третьякова Мария Владимировна – к.м.н., врач акушер-гинеколог, ассистент кафедры акушерства, гинекологии и перинатальной медицины Клинического института детского здоровья имени Н.Ф. Филатова
119991 Москва, ул. Большая Пироговская, д. 2, стр. 4
Я. М. Шаммут
Россия
Шаммут Яна Мархафовна – студент Клинического института детского здоровья имени Н.Ф. Филатова
119991 Москва, ул. Большая Пироговская, д. 2, стр. 4
Е. Ю. Юпатов
Россия
Юпатов Евгений Юрьевич – к.м.н., доцент, зав. кафедрой акушерства и гинекологии, Казанская государственная медицинская академия – филиал; доцент кафедры хирургии и последипломного образования Института фундаментальной медицины и биологии
Scopus Author ID: 57201192778
420015 Казань, ул. Бутлерова, д. 36
420008 Казань, Кремлёвская ул., д. 18
В. И. Цибизова
Россия
Цибизова Валентина Ивановна – к.м.н., врач акушер-гинеколог НИЛ оперативной гинекологии Института перинатологии и педиатрии, врач отделения функциональной ультразвуковой диагностики
197341 Санкт-Петербург, ул. Аккуратова, д. 2
Ж.-К. Гри
Россия
Гри Жан-Кристоф – д.м.н., профессор кафедры акушерства, гинекологии и перинатальной медицины Клинического института детского здоровья имени Н.Ф. Филатова; профессор гематологии в Университете Монпелье
Researcher ID: AAA-2923-2019
119991 Москва, ул. Большая Пироговская, д. 2, стр. 4
Франция, 34090 Монпелье, ул. Огюста Бруссоне, д. 163
Д. В. Блинов
Россия
Блинов Дмитрий Владиславович – к.м.н., ассистент кафедры спортивной медицины и медицинской реабилитации Института клинической медицины имени Н.В. Склифосовского; руководитель по медицинским и научным вопросам; доцент кафедры спортивной, физической и реабилитационной медицины
Scopus Author ID: 6701744871
Researcher ID: E-8906-2017
RSCI: 9779-8290
119991 Москва, ул. Большая Пироговская, д. 2, стр. 4
127006 Москва, ул. Садовая-Триумфальная, д. 4–10
123056 Москва, 2-я Брестская ул., д. 5, с. 1–1а
А. Д. Макацария
Россия
Макацария Александр Давидович – д.м.н., профессор, академик РАН, зав. кафедрой акушерства, гинекологии и перинатальной медицины Клинического института детского здоровья имени Н.Ф. Филатова
Scopus Author ID: 57222220144
Researcher ID: M-5660-2016
119991 Москва, ул. Большая Пироговская, д. 2, стр. 4
Рецензия
Для цитирования:
Гашимова Н.Р., Григорьева К.Н., Бицадзе В.О., Панкратьева Л.Л., Хизроева Д.Х., Третьякова М.В., Шаммут Я.М., Юпатов Е.Ю., Цибизова В.И., Гри Ж., Блинов Д.В., Макацария А.Д. Клиническое значение определения ADAMTS-13 и фактора фон Виллебранда у беременных после перенесенного COVID-19. Акушерство, Гинекология и Репродукция. 2023;17(1):8-17. https://doi.org/10.17749/2313-7347/ob.gyn.rep.2023.386
For citation:
Gashimova N.R., Grigoreva K.N., Bitsadze V.O., Pankratyeva L.L., Khizroeva J.Kh., Tretyakova M.V., Shammut Ya.M., Iupatov E.I., Tsibizova V.I., Gris J., Blinov D.V., Makatsariya A.D. Clinical significance of assessing ADAMTS-13 and von Willebrand factor level in COVID-19 convalescent pregnant women. Obstetrics, Gynecology and Reproduction. 2023;17(1):8-17. https://doi.org/10.17749/2313-7347/ob.gyn.rep.2023.386

Контент доступен под лицензией Creative Commons Attribution-NonCommercial-ShareAlike 4.0 International License.











































