Перейти к:
Раннее моделирование риска преждевременных родов на платформе биоколлекции образцов беременных, созданной на разных сроках гестации согласно стратегии «лонгитюдное биобанкирование»
https://doi.org/10.17749/2313-7347/ob.gyn.rep.2025.686
Аннотация
Цель: на платформе биоколлекции образцов беременных, созданной согласно стратегии «лонгитюдное биобанкирование», разработать алгоритм раннего моделирования высокого риска преждевременных родов (ПР) на основе клинических, протеомных и транскриптомных данных.
Материалы и методы. Проведено проспективное когортное исследование. Из биоколлекции были отобраны образцы сыворотки и плазмы крови, полученные в динамике в I и II триместрах гестации от 18 беременных с высоким риском ПР, реализовавших истмико-цервикальную недостаточность (ИЦН), и от 18 женщин с низким риском ПР, беременность которых не была осложнена ИЦН на любом сроке гестации. Проведен анализ клинико-анамнестических предикторов, определен уровень сывороточного релаксина и эластина, маркерных микроРНК (hsa-miR-432-5p, hsa-miR-134-5p, hsa-miR-431-5p, hsa-miR-122-5, hsa-miR-34a-5p).
Результаты. На основе наиболее значимых клинико-анамнестических предикторов, протеомного предиктора (уровень сывороточного релаксина), транскриптомных предикторов (экспрессия маркерных микроРНК) с использованием метода опорных векторов (англ. support vector machine, SVM) разработана прогностическая модель, высокая эффективность которой подтверждается ROC-кривыми (AUC = 0,83 при обучении и 0,67 в кросс-валидации), что позволяет использовать разработанный классификатор в качестве инструмента для оценки риска ПР.
Заключение. Биоколлекции образцов беременных, сформированные согласно стратегии «лонгитюдное биобанкирование», могут являться эффективной платформой для разработки технологий раннего прогнозирования риска акушерских осложнений.
Ключевые слова
Для цитирования:
Пачулия О.В., Лазарева Т.Е., Халенко В.В., Илларионов Р.А., Вашукова Е.С., Постникова Т.Б., Мальцева А.Р., Милютина Ю.П., Корнюшина Е.А., Беспалова О.Н., Глотов А.С. Раннее моделирование риска преждевременных родов на платформе биоколлекции образцов беременных, созданной на разных сроках гестации согласно стратегии «лонгитюдное биобанкирование». Акушерство, Гинекология и Репродукция. 2025;19(5):691-704. https://doi.org/10.17749/2313-7347/ob.gyn.rep.2025.686
For citation:
Pachuliya O.V., Lazareva T.E., Khalenko V.V., Illarionov R.A., Vashukova E.S., Postnikova T.B., Maltseva A.R., Milyutina Yu.P., Kornushina E.A., Bespalova O.N., Glotov A.S. Early modeling of preterm birth risk using a biocollection of pregnancy samples created at different gestational stages according to the "longitudinal biobanking" strategy. Obstetrics, Gynecology and Reproduction. 2025;19(5):691-704. (In Russ.) https://doi.org/10.17749/2313-7347/ob.gyn.rep.2025.686
Введение / Introduction
Биобанкирование и коллекции / Biobanking and collections
В последние годы биобанки становятся современной платформой для разработки новых технологий прогнозирования, диагностики и лечения, обеспечивающей доступ к коллекциям высококачественных образцов, стандартизованных на всех этапах их получения. В то же время для реализации различных научных задач профессиональным сообществам предстоит выработать подходы к формированию коллекций биообразцов во всех областях медицинской науки [1].
В акушерстве нами впервые были предложены стратегии формирования биоколлекций, одной из которых является «лонгитюдное биобанкирование» [2]. Согласно данному подходу, сбор биообразцов коллекции происходит в течение ограниченного исследователем времени (в акушерстве – в течение беременности). «Лонгитюдное биобанкирование» включает одно из таких направлений как «динамическое биобанкирование» – сбор биообразцов с определением контрольных «точек» (к примеру, сбор образцов у одной беременной в I, II, III триместрах). Такой принцип создания коллекции является наиболее сложным ввиду длительности формирования коллекции, необходимости поддержки длительного контакта с участниками проектов научного биобанкирования, больших затрат и потери ресурсов, в первую очередь ассоциированные с отказом доноров от продолжения участия в проекте. Тем не менее по сравнению со стратегией «единовременное биобанкирование», предполагающее однократное получение биоматериала, может давать значимое преимущество – возможность разрабатывать инструменты раннего моделирования акушерских рисков. В рамках проекта научного биобанкирования нами была создана коллекция образцов беременных, полученных в динамике у одной женщины в трех «точках» – в каждом триместре гестации. Характеристики коллекции были представлены в публикации О.В. Пачулия с соавт. (2022) [3]. С целью оценки эффективности созданной биоколлекции в качестве платформы было проведено настоящее исследование по разработке технологии моделирования раннего риска преждевременных родов (ПР).
Преждевременные роды / Preterm birth
Преждевременные роды выбраны в качестве патологии для моделирования ввиду того, что они являются одной из наиболее значимых проблем акушерства, которая в настоящее время не имеет тенденции к снижению. ПР обозначены в 2018 г. на Конгрессе Международной федерации акушерства и гинекологии (англ. International Federation of Gynecology and Obstetrics, FIGO) как не только нерешенная, но и не решаемая современными методами проблема, так как отсутствие научных основ не только этиологии, но и патогенеза ПР не позволяет достичь практических результатов ни в профилактике, ни в лечении этого осложнения беременности [4].
Значимость проблемы ПР обусловлена тем, что они обусловливают до 70 % перинатальной смертности: риск смерти недоношенных детей в 25–35 раз выше, чем доношенных. И на сегодняшний день ПР являются главной причиной детской заболеваемости и инвалидности, в то время как тяжесть осложнений, связанных с недоношенностью, обратно пропорциональна гестационному сроку. Таким образом, поиск новых подходов к раннему прогнозированию ПР с целью принятия своевременных мер по их профилактике является важной и актуальной задачей.
Прогнозирование риска / Risk prediction
Для разработки инструмента прогнозирования ПР в работе был применен неклассический подход: за первичную конечную точку принят не исход беременности (преждевременные или срочные роды), а истмико-цервикальная недостаточность (ИЦН), осложнившая течение беременности у пациенток основной группы. Применение такого подхода обусловлено несколькими наиболее важными аспектами: мультифакторной этиологией ПР; патогенезом, определяющим, как минимум, 2 клинических сценария реализации ПР; проведением сохраняющей терапии с разной эффективностью применяемых современных методов.
Согласно концепции, предложенной в 2009 г. G.С. Di Renzo, ПР являются большими акушерскими синдромами, которые в первую очередь характеризуются полиэтиологичностью [5]. Как известно, ИЦН является ведущим фактором риска реализации спонтанных ПР.
Другим значимым аспектом является то, что ПР клинически развиваются как минимум по двум сценариям: со схваток или с преждевременного излития околоплодных вод. Второй клинический фенотип ПР в подавляющем большинстве реализуется у бессимптомных пациенток с ИЦН. Согласно данным, представленным Н.Ю. Катковой с соавт. (2017), на долю ПР, начавшихся с преждевременного разрыва плодных оболочек, при отсутствии родовой деятельности приходится около 50–60 % всех случаев ПР [6].
И третьим важным аспектом является то, что при наличии у беременной каких-либо признаков угрожающих ПР по этическим соображениям всегда проводится сохраняющая терапия или коррекция шейки матки при ИЦН для профилактики ПР, применение которых в ряде случаев демонстрирует значимую эффективность. Согласно данным О.Н. Беспаловой и Г.С. Саргсян (2017), установка акушерского пессария в сроки гестации 18–22 недели позволяет снизить частоту ПР в 3 раза. Авторы продемонстрировали, что максимальное пролонгирование беременности после установки акушерского пессария было в группе срочных родов и составило 18,4 недели [7].
Так, при проведении научного исследования по типу «случай-контроль», основанного на определении исхода родов как «случай», в одной группе срочных родов могут быть как женщины с физиологическим течением беременности и срочными родами, так и женщины, чью беременность удалось сохранить до доношенной благодаря колоссальным усилиям команды врачей. В связи со значимостью такого конфаундера, при выборе факта реализации ПР в качестве конечной точки адекватно оценить факторы риска их реализации не представляется возможным. Таким образом, нами поставлена цель по поиску подходов к раннему моделированию риска реализации ИЦН – выбора контингентной модели пациенток для профилактики одного из клинических фенотипов ПР.
Потенциальные биомаркеры / Potential biomarkers
Ряд исследователей сходятся во мнении, что этиология ИЦН на сегодняшний день остается неуточненной, и это определяет дискуссионный характер подходов к диагностике и лечению данного осложнения беременности. В настоящее время прогнозирование ИЦН в основном основано на данных репродуктивного анамнеза женщины и результатах ультразвукового исследования (ширины раскрытия шейки матки, длины шейки матки). R.F. Lamont с соавт. (2020) высказали консолидированную точку зрения, что для дальнейшего поиска инструментов прогнозирования ПР может потребоваться сочетание биофизических, биохимических, иммунологических, микробиологических данных, данных фетальных клеток, экзосом или внеклеточной РНК на разных сроках беременности, интегрированное в многофакторную предикторную модель [8].
Клинико-анамнестические предикторы / Clinical and anamnestic predictors
В то же время, несмотря на расширяющиеся возможности современной науки, многофакторные исследования демонстрируют, что анамнестические данные остаются одним из ключевых аспектов в стратификации риска ПР. На сегодняшний день сформирована убедительная доказательная база в отношении ассоциации таких клинико-анамнестических факторов, как поздние выкидыши или ПР в анамнезе с реализацией риска ИЦН, и следовательно, данные предикторы включены в протоколы скрининга. Однако исследователи расходятся во мнении относительно важности ряда других анамнестических факторов, особенно в отношении факторов, ассоциированных с реализацией ИЦН у первородящих и повторнородящих женщин [9]. Тем не менее для прогнозирования раннего риска реализации осложнений значимо большую эффективность демонстрируют комплексные прогностические модели, включающие клинико-анамнестические предикторы.
Протеомные предикторы / Proteomic predictors
Исследования последних лет, посвященные поиску предикторов ПР, позволили выделить ряд протеомных биомаркеров с высоким прогностическим потенциалом, среди которых интерес представляют релаксин и эластин [10]. Внимание к данным белкам обусловлено наличием данных о их роли в ремоделировании шейки матки при беременности.
Релаксин – это полипептидный гормон, расслабляющий связки, размягчающий фиброзную ткань и эластические волокна. Согласно имеющимся данным, при ИЦН экспрессируются высокие уровни релаксина, что приводит к патологическому раскрытию и расслаблению шейки матки. Эластин – важнейший тканевой белок эластичных волокон соединительной ткани. Снижение его содержания может способствовать разрыву фиброзной ткани, что приводит к нарушению гомеостаза тканей шейки матки. Результаты единичных исследований демонстрируют, что у беременных с ИЦН экспрессия сывороточного релаксина повышена, в то время как экспрессия эластина снижена, однако эти данные требуют дополнительного уточнения. Анализ отечественной и зарубежной литературы показал, что на сегодняшний день существует ограниченное количество исследований, посвященных анализу связи между уровнями релаксина и эластина с реализацией ИЦН.
МикроРНК / miRNA
Исследования последних лет показали, что некодирующие РНК могут быть перспективными биомаркерами различных осложнений беременности. Данные по профилированию микроРНК (англ. microRNA, miRNA) при ПР продемонстрировали многообещающие результаты. В одной из первых работ M.A. Elovitz с соавт. (2014) определили профиль экспрессии микроРНК в клетках шейки матки у беременных с ПР [11]. В другой работе E.E. Winger с соавт. (2020) показали различия в профиле микроРНК периферической крови беременных в I триместре гестации [12]. Тем не менее ряд исследований по изучению микроРНК демонстрируют противоречивые результаты и требуют дальнейшего изучения возможности их применения для прогнозирования риска ПР.
Цель: на платформе биоколлекции образцов беременных, созданной согласно стратегии «лонгитюдное биобанкирование», разработать алгоритм раннего моделирования высокого риска ПР на основе клинических, протеомных и транскриптомных данных.
Материалы и методы / Materials and Methods
Дизайн исследования / Study design
Биоколлекция образцов / Specimen biocollection
Уникальная пополняемая биоколлекция образцов беременных создана на базе биобанка «Генофонд» ФГБНУ НИИ АГиР им. Д.О. Отта (начало формирования – 2019 г.). По состоянию на 01.09.2025 в коллекцию включено 22497 образцов (аликвот) от 542 беременных. Сбор биоматериала для коллекции осуществлялся у беременных в динамике в каждом триметре гестации, в подавляющем большинстве на сроках проводимого пренатального скрининга: I триместр (11–14 недель), II триместр (19–21 недель), III триместр (30–34 недели). Особенности создания и алгоритм формирования биоколлекции представлены в публикации Р.А. Илларионова с соавт. (2020) [13].
Отбор образцов для исследования / Selection of specimens for study
Для исследования из биоколлекции были отобраны образцы сыворотки и плазмы крови, полученные в динамике в I и II триместрах гестации от 18 беременных с высоким риском преждевременных родов (врПР), реализовавших ИЦН во II триместре беременности (основная группа), и 18 женщин, течение беременности которых не было осложнено ИЦН на любом сроке гестации (контрольная группа).
Диагноз ИЦН у беременных был установлен во II триместре в соответствии клиническими рекомендациями Минздрава России «Истмико-цервикальная недостаточность» (пересмотр 2024 г.): укорочение длины шейки матки ≤ 25 мм и/или дилатация цервикального канала ≥ 10 ранее 37 недель беременности без клинической картины угрожающего выкидыша/ПР [14].
Критерии включения: возраст 18–39 лет; одноплодная беременность; информированное согласие.
Критерии исключения: многоплодная беременность; гемоконтактные инфекции (гепатиты, ВИЧ); отказ от участия.
Клиническая характеристика коллекции / Clinically profiled collection
На основании медицинских данных, полученных при включении беременных в исследование, была дана клинико-анамнестическая характеристика биоресурсной коллекции по следующим основным параметрам: общие и анамнестические данные, гинекологические и экстрагенитальные заболевания, материнские и фетальные осложнения беременности, родов, часть из которых может быть отнесена к потенциальным рискам ПР [3].
Проведен сравнительный анализ групп по ряду клинико-анамнестических параметров; однако, учитывая низкую эффективность поиска прогностических факторов при малых выборках, нами проведен анализ публикаций, оценивающих предиктивность клинико-анамнестических факторов риска ПР. Для включения в комплексную прогностическую модель нами были выбраны факторы, значимость которых была показана в метаанализах, крупных когортных исследованиях или популяционных исследованиях по типу «случай-контроль» (табл. 1). Определение статистической значимости по выбранным параметрам между контрольной и основной группами было осуществлено с использованием теста Уилкоксона с помощью программы RStudio и языка программирования R v.4.4.2.
Таблица 1. Предикторы преждевременных родов (ПР) по данным литературы.
Table 1. Predictors of preterm birth (PВ) according to literature data.
|
Фактор риска Risk factor |
Источник References |
Тип исследования Study type |
Выборка Samples |
Риск ПР PВ risk ОШ [ 95 % ДИ] OR [ 95 % Cl] |
|
Индекс массы тела > 25 Body mass index > 25 |
Cnattingius S. et al., 2013 [15] |
Популяционное когортное исследование Population-based cohort study |
n = 77034 |
1,26 [ 1,15–1,37] |
|
Гипотиреоз Hypothyroidism |
Maraka S. et al., 2016 [16] |
Систематический обзор и метаанализ Systematic review and meta-analysis |
n = 3995 |
1,43 [ 1,04–1,95] |
|
Аутоиммунный тиреоидит Autoimmune thyroiditis |
Korevaar T. et al., 2019 [17] |
Систематический обзор и метаанализ Systematic review and meta-analysis |
n = 47045 |
1,33 [ 1,2–1,56] |
|
Наследственная тромбофилия (FV Leiden) Hereditary thrombophilia (FV Leiden) |
Hiltunen L. et al., 2011 [18] |
Популяционное исследование «случай-контроль» Population-based case-control study |
n = 1402 |
2,4 [ 1,3–4,6] |
|
Антифосфолипидный синдром Antiphospholipid syndrome |
Iordache O. et al., 2019 [19] |
Систематический обзор Systematic review |
n = 2935 |
1,29 [ 1,18–6,20] |
|
Инфекция мочевых путей Urinary tract infection |
Wang E. et al., 2024 [20] |
Систематический обзор и метаанализ Systematic review and meta-analysis |
n = 249810 |
1,92 [ 1,62–2,27] |
|
Беременность в результате ЭКО Pregnancy resulting from IVF |
Qin J. et al., 2016 [21] |
Метаанализ когортных исследований Meta-analysis of cohort studies |
n = 161370 |
2,12 [ 1,73–2,59] |
|
Невынашивание беременности в анамнезе History of miscarriage |
Wu C. et al., 2022 [22] |
Систематический обзор и метаанализ Systematic review and meta-analysis |
n = 58766 |
1,60 [ 1,45-1,78] |
|
Аборты в анамнезе History of abortion |
Yu J. et al., 2023 [23] |
Ретроспективное когортное исследование Retrospective cohort study |
n = 2985 |
1,65 [ 1,23–2,21] |
|
Преждевременные роды в анамнезе History of preterm birth |
Lin D. et al., 2024 [24] |
Систематический обзор и метаанализ Systematic review and meta-analysis |
n = 18174 |
5,72 [ 3,44–9,50] |
|
Внутриматочные вмешательства в анамнезе History of intrauterine interventions |
Lemmers M. et al., 2016 [25] |
Систематический обзор и метаанализ Systematic review and meta-analysis |
n = 71231 |
1,29 [ 1,2 –1,42] |
|
Ретрохориальная гематома Retrochorial hematoma |
Qin Z. et al., 2022 [26] |
Систематический обзор и метаанализ Systematic review and meta-analysis |
n = 1132 |
1,83 [ 1,37–2,43] |
Примечание: ЭКО – экстракорпоральное оплодотворение; ОШ – отношение шансов; ДИ – доверительный интервал.
Note: IVF – in vitro fertilization; OR – odds ratio; CI – confidence interval.
Оценка уровня релаксина и эластина / Relaxin and elastin level assessment
Количественное определение концентраций релаксина 1 (англ. relaxin 1, RLN1) и эластина (англ. elastin, ELN) в материнской сыворотке крови проводилось методом твердофазного иммуноферментного анализа (ELISA) с использованием коммерчески доступных наборов в соответствии с инструкциями производителей. Для определения релаксина 1 использован набор Human Relaxin ELISA Kit (Cat. No. CEB216Hu, Cloud-Clone Corp.), преимущественно распознающий изоформу RLN1. Концентрация эластина определялась с помощью набора Human Elastin ELISA Kit (Cat. No. E-EL-H1163, Elabscience®). Для оценки различий в уровне релаксина и эластина между исследуемыми группами был проведен статистический анализ (тест Уилкоксона) и построены графики с использованием языка программирования R v.4.4.2 и пакета для визуализации данных ggplot2 v.3.5.2.
Оценка уровня экспрессии микроРНК / MicroRNA expression assessment
Ранее на платформе биоколлекции было проведено исследование, в результате которого с применением секвенирования нового поколения (англ. next generation sequencing, NGS) у пациенток с врПР было обнаружено 1499 микроРНК в I триместре и 1556 микроРНК во II триместре. В I триместре 15 микроРНК имели дифференциальную экспрессию (3 с повышенным уровнем экспрессии – hsa-miR-122-5p, hsa-miR-34a-5p, hsa-miR-34c-5p и 12 с пониженной регуляцией – hsa-miR-487b-3p, hsa-miR-493-3p, hsa-miR-432-5p, hsa-miR-323b-3p, hsa-miR-369-3p, hsa-miR-134-5p, hsa-miR-431-5p, hsa-miR-485-5p, hsa-miR-382-5p, hsa-miR-369-5p, hsa-miR-485-3p, hsa-miR-127-3p; log2 Fold Change (логарифмированное изменение кратности уровня экспрессии) ≥ 1,5; рскорр ≤ 0,05) в основной группе с врПР по сравнению с контрольной группой. Для дальнейшего анализа в рамках настоящего исследования были выбраны микроРНК, которые показали дифференциальную экспрессию, имели большее число прочтений в I триместре между исследуемыми группами при проведении РНК-секвенирования и были выделены методом количественной полимеразной цепной реакции с обратной транскрипцией (ОТ-ПЦР) (табл. 2).
Таблица 2. Дифференциально экспрессируемые микроРНК в плазме крови в I триместре.
Table 2. Differentially expressed blood plasma microRNAs in the first trimester.
|
МикроРНК MicroRNA |
Логарифмированное изменение кратности уровня экспрессии log2 Fold Change |
Скорректированное р-значение Adjusted p-value (FDR) |
Возможная роль в патогенезе преждевременных родов Potential role in preterm birth |
|
hsa-miR-432-5p |
–1,91 |
0,012 |
МикроРНК относятся к C14MC – «плаценто-специфичному» кластеру микроРНК, который осуществляет контроль пролиферации, дифференцировки и инвазии трофобласта: таргетирует гены, участвующие в клеточном цикле, апоптозе и миграции [27][28] Belong to C14MC, a "placenta-specific" microRNA cluster that controls trophoblast proliferation, differentiation, and invasion by targeting the genes involved in the cell cycle, apoptosis, and migration [27][28] |
|
hsa-miR-134-5p |
–1,67 |
0,02 |
|
|
hsa-miR-431-5p |
–1,63 |
0,02 |
|
|
hsa-miR-122-5p |
1,81 |
0,046 |
miR-122-5p регулирует апоптоз, секрецию воспалительных факторов и цитотоксичность NK-клеток, может способствовать иммунной толерантности в системе «мать-плод», воздействуя на фактор транскрипции T-bet. У пациенток с привычным невынашиванием беременности установлено снижение экспрессии miR-122-5p в натуральных киллерах децидуальной оболочки (dNK-клетках) [29] miR-122-5p regulates apoptosis, secretion of inflammatory factors, and NK cell cytotoxicity, and may promote immune tolerance in the maternal-fetal interface by affecting the transcription factor T-bet. Lowered miR-122-5p expression in decidual natural killer cells (dNK cells) was found in patients with recurrent miscarriage [29] |
|
hsa-miR-34a-5p |
1,94 |
0,004 |
Сверхэкспрессия miR-34a в клетках трофобласта JEG-3 ингибировала пролиферацию, миграцию и инвазию клеток. Вероятно, miR-34a подавляет инвазию трофобласта, напрямую воздействуя на MYC [30] Overexpressed miR-34a in JEG-3 trophoblast cells inhibited cell proliferation, migration, and invasion. miR-34a likely suppresses trophoblast invasion by directly targeting MYC [30] |
Примечание: log2 Fold Change (логарифмированное изменение кратности уровня экспрессии) – способ оценки дифференциальной экспрессии генов или транскриптов; FDR (коэффициент ложных открытий) – контроль ожидаемой доли ложных отклонений нулевой гипотезы; C14MC – микроРНК-кластер, представляющий собой группу генов, кодирующих микроРНК и расположенных близко друг к другу в геноме; NK-клетки (натуральные киллеры) – тип цитотоксических лимфоцитов, участвующих в функционировании врожденного иммунитета; JEG-3 – линия раковых клеток человека, которая происходит из хориокарциномы плаценты; MYC – фактор транскрипции, который у человека кодируется геном MYC и регулирует экспрессию до 15 % всех генов.
Note: log2 Fold Change – denotes differential gene or transcript expression assessment; FDR (False Discovery Rate) – сontrol of the expected proportion of false rejections of the null hypothesis; C14MC – microRNA cluster that represents a group of microRNA-encoding genes, located close to each other in the genome; NK cells (Natural Killer cells) – type of cytotoxic lymphocyte involved in innate immune response; JEG-3 – human cancer cell line derived from placental choriocarcinoma; MYC – transcription factor encoded in human by the MYC gene and regulating the expression of up to 15 % of all genes.
Количественная полимеразная цепная реакция с обратной транскрипцией / Quantitative reverse transcription polymerase chain reaction
Для выделения микроРНК из плазмы использовали набор miRNeasy Serum/Plasma Advanced Kit (Qiagen, Германия) согласно стандартному протоколу производителя. Синтез комплементарной ДНК осуществляли с помощью набора TaqMan™ Advanced miRNA cDNA Synthesis Kit (Applied Biosystems, США). Условия реакции соответствовали рекомендациям производителя. Для реакции обратной транскрипции использовали 2 мкл образца РНК. Измерение уровня экспрессии микроРНК проводили методом количественной ОТ-ПЦР в реальном времени с использованием коммерческих праймеров TaqMan Advanced miRNA Assay (Applied Biosystems, США), набора реагентов TaqMan Fast Advanced Master Mix (Applied Biosystems, США). ПЦР-амплификация проводилась в формате 96-луночного планшета в двух повторах на приборе Applied Biosystems 7500 (Applied Biosystems, США). Для расчета значений количественной оценки экспрессии использовалось значение относительного изменения экспресии гена ΔΔCt (англ. Delta-Delta Ct). В качестве эндогенного контроля использовалась микроРНК hsa-miR-26a-5p.
Построение прогностической модели / Predictive model development
Возможность использования клинико-лабораторных параметров для прогнозирования риска ПР была протестирована с использованием модели опорных векторов (англ. support vector machine, SVM). В модель были включены 5 микроРНК, полученные с помощью метода количественной ОТ-ПЦР в I триместре; значения уровня релаксина в I триместре; клинико-анамнестические предикторы. Образцы (18 врПР/18 контрольных) были случайным образом распределены на обучающий (n = 28) и тестовый (n = 8) набор данных. Площадь под кривой ROC/AUC (англ. receiver operating characteristic/area under curve) использовалась для оценки производительности модели. Модель была построена и оценена с использованием пакета scikit-learn языка программирования Python (v.3.12). Для поиска лучших параметров в фиксированной сетке возможных значений гиперпараметров модели был использован GridSearchCV. Для оценки информативности выбранных параметров был применен метод SelectKBest.
Результаты / Results
Клиническая характеристика групп / Group clinical characteristics
Средний возраст беременных, образцы которых были включены в исследование, составил 33,4 ± 2,7 лет в основной группе (врПР) и 32,7 ± 5,0 лет в контрольной группе, различия статистически незначимы (p = 0,7989). Возраст, индекс массы тела (ИМТ) и число родов также не показали статистически значимых различий между группами. В таблице 3 приведено сравнение групп по основным клинико-анамнестическим факторам, ассоциированными с риском ПР по данным литературы.
Таблица 3. Клинико-анамнестические предикторы преждевременных родов (ПР).
Table 3. Clinical and anamnestic predictors of preterm birth (PВ).
|
Параметр Parameter |
Высокий риск ПР High risk of PВ n (%) |
Контрольная группа Control group n (%) |
p |
|
Индекс массы тела > 25 Body mass index > 25 |
3 (16,7) |
4 (22,2) |
0,6949 |
|
Субклинический гипотиреоз Subclinical hypothyroidism |
2 (11,1) |
2 (11,1) |
1,0 |
|
Аутоиммунный тиреоидит Autoimmune thyroiditis |
2 (11,1) |
1 (5,6) |
0,5744 |
|
Высокий риск наследственной тромбофилии High risk of hereditary thrombophilia |
1 (5,6) |
0 |
0,3449 |
|
Умеренный риск наследственной тромбофилии Moderate risk of hereditary thrombophilia |
2 (11,1) |
1 (5,6) |
0,5744 |
|
Антифосфолипидный синдром Antiphospholipid syndrome |
3 (16,7) |
0 |
0,0799 |
|
Инфекция нижних мочевых путей Lower urinary tract infection |
3 (16,7) |
1 (5,6) |
0,1618 |
|
Беременность в результате ЭКО Pregnancy resulting from IVF |
5 (27,8) |
0 |
0,0188 |
|
Неудачные попытки ЭКО Failed IVF attempts |
3 (16,7) |
0 |
0,0803 |
|
Невынашивание в анамнезе (неразвивающиеся беременности) History of miscarriage (non-viable pregnancies) |
12 (66,7) |
6 (33,3) |
0,0072 |
|
Невынашивание в анамнезе (выкидыши на раннем сроке) History of miscarriage (early miscarriages) |
7 (38,9) |
3 (16,7) |
0,1478 |
|
Аборты в анамнезе History of abortions |
4 (22,2) |
0 |
0,0395 |
|
Спонтанные ПР в анамнезе History of spontaneous PВ |
2 (11,1) |
0 |
0,163 |
|
Внутриматочные вмешательства Intrauterine interventions |
6 (33,3) |
3 (16,7) |
0,2638 |
|
Ретрохориальная отслойка Retrochorial abruption |
8 (44,4) |
1 (5,6) |
0,0084 |
Примечание: ЭКО – экстракорпоральное оплодотворение; выделены значимые различия.
Note: IVF – in vitro fertilization; significant differences are highlighted in bold.
Анализ клинико-анамнестических данных выявил значимые различия между исследуемыми группами как по факторам риска ПР, так и по исходам беременности и родов. В основной группе количество беременностей было статистически значимо выше по сравнению с контрольной группой: 3,5 [ 2,0; 4,0] против 2,0 [ 1,0; 3,0] (p = 0,034). Выявлены различия по срокам и структуре родов: в основной группе средний срок родоразрешения был ниже по сравнению с группой контроля – 38 [ 36,5; 39,0] недель против 40 [ 39; 40] недель (p = 0,002), при этом спонтанные ПР встречались исключительно в основной группе у 5 женщин с высоким риском ПР (27,8 % против 0 %; p = 0,045). В основной группе частота оперативного родоразрешения была в половине всех случаев родов (55,6 % против 11,1 %; p = 0,012). Новорожденные от женщин в исследуемых группах не различались по массе тела на момент рождения, однако в основной группе был достоверно меньший рост (50,0 [ 48,25; 51,75] см против 52,0 [ 50,25; 53,0] см; p = 0,014) и более низкие баллы по шкале Апгар (8,0 [ 7,0; 8,0] баллов против 8,0 [ 8,0; 8,0] баллов; p = 0,022) по сравнению с контрольной группой.
Исследуемые группы отличались по 4 клинико-анамнестическим параметрам, которые могут выступать предикторами ПР. В основной группе (врПР) значимо чаще были случаи невынашивания беременности в анамнезе по типу неразвивающийся беременности (66,7 % против 33,3 %; p = 0,007), аборты в анамнезе (22,2 % против 0 %; p = 0,039); также случаи зачатия в результате экстракорпорального оплодотворения (ЭКО) (27,8 % против 0 %; p = 0,045) были только в основной группе. Достоверно чаще в основной группе беременность осложнялась угрожающим выкидышем – ретрохориальной отслойкой (44,4 % против 5,6 %; p = 0,018).
Также было отмечено, что имели тенденцию к большей частоте в основной группе, но не достигли статистической значимости, вероятно, в виду недостаточности выборки, такие факторы риска ПР, как антифосфолипидный синдром (16,7 % против 0 %; p = 0,08) и неудачные попытки ЭКО (16,7 % против 0 %; p = 0,08).
Протеомные предикторы / Proteomic predictors
Анализ динамики протеомных маркеров продемонстрировал их различное поведение в течение беременности (рис. 1). Релаксин демонстрирует более стабильные тренды показателей в I и II триместрах гестации в обеих группах. В основной группе (врПР) в I триместре отмечены статистически значимо более высокие уровни релаксина по сравнению с контролем; при этом ко II триместру концентрация релаксина у большинства пациенток с высоким риском ПР снижалась и приближалась к значениям контрольной группы.

Рисунок 1. Тренды динамики уровня релаксина (А) и эластина (В) в I и II триместрах беременности в группе высокого риска преждевременных родов (врПР) и в контрольной группе (контроль).
Figure 1. Trends in the dynamics of relaxin (А) and elastin (В) levels in high-risk preterm birth (hrPВ) group and in control group (control).
В обеих группах эластин демонстрировал выраженный рост концентрации ко II триместру беременности. При этом в контрольной группе динамика была более равномерной, значения оставались в умеренном диапазоне, лишь у отдельных пациенток фиксировались более высокие показатели. В основной группе наблюдалась значительно большая вариабельность: у части женщин прирост эластина был выражен минимально, у других достигал очень высоких значений. Несмотря на общий тренд к увеличению, межгрупповые различия оставались статистически незначимыми.
Проведен анализ различий в уровнях релаксина и эластина между исследуемыми группами. В I триместре уровень релаксина у женщин, беременность которых в последующем осложнилась ИЦН (основная группа с врПР), был статистически значимо выше (p = 0,034) по сравнению с женщинами контрольной группы: 69,12 ± 132,23 пг/мл и 36,67 ± 18,58 пг/мл, соответственно (рис. 2). Во II триместре уровни релаксина оставались сопоставимыми: 36,54 ± 15,87 пг/мл в контрольной группе против 53,02 ± 61,33 пг/мл у пациенток основной группы с врПР (p = 0,134).
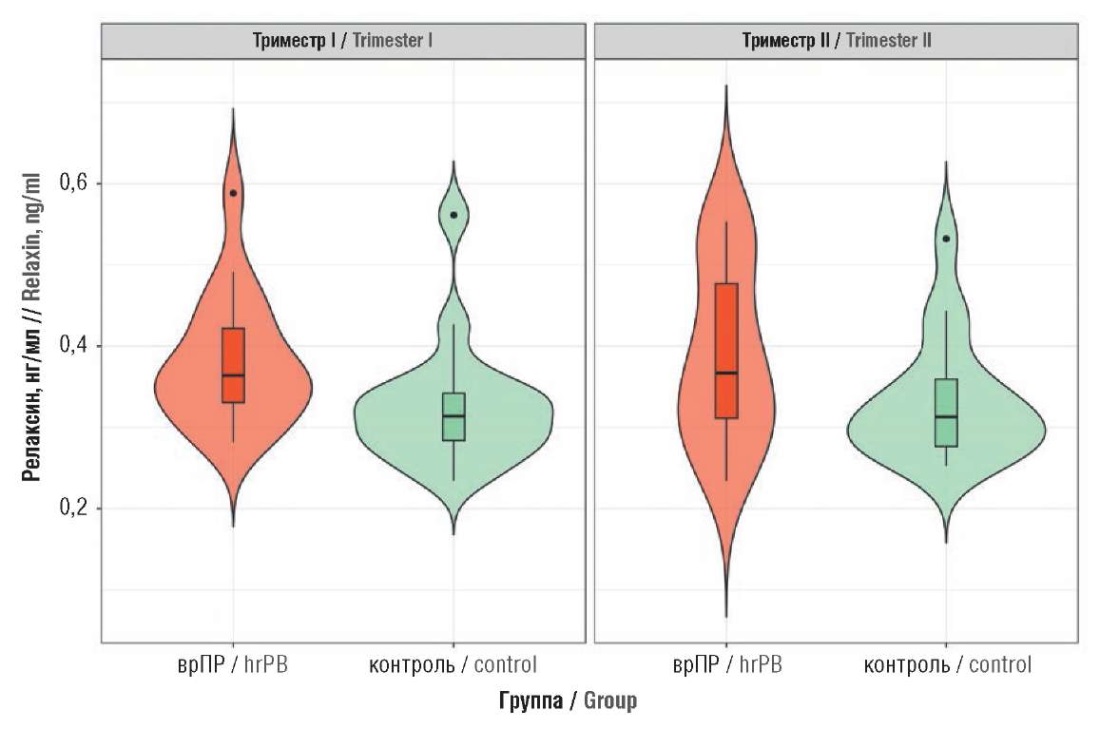
Рисунок 2. Уровни сывороточного релаксина в группе высокого риска преждевременных родов (врПР) и в контрольной группе (контроль).
Примечание: на скрипичном графике, представляющем сочетание диаграммы размаха и графика плотности, боксы в центре – межквартильные размахи, исходящие из них тонкие черные линии – доверительные интервалы с 95%-ной вероятностью, поперечные линии – медианы, точками обозначены выбросы.
Figure 2. Serum relaxin levels in high-risk preterm birth (hrPВ) group and in control group (control).
Note: in a violin plot, which combines a box plot and a density plot, the boxes represent the interquartile range, the thin black lines extending from the boxes show the 95 % confidence intervals; the horizontal lines show the median, and the dots represent the outliers.
Содержание эластина в I триместре достоверно не различалось между группами: 5,87 ± 5,92 нг/мл в контрольной группе и 5,75 ± 4,24 нг/мл в основной (p > 0,05). Во II триместре концентрация эластина увеличивалась как у женщин контрольной группы (28,62 ± 16,40 нг/мл), так и у пациенток с врПР (34,33 ± 37,30 нг/мл), однако различия также не достигли статистической значимости (p > 0,05).
Соотношение уровней релаксин/эластин не демонстрировало значимых межгрупповых различий (p = 0,6837 и 0,4812 для I и II триместра соответственно), несмотря на выраженные индивидуальные колебания. При дополнительном корреляционном анализе выявлены умеренные связи: концентрация эластина в I триместре отрицательно коррелировала с уровнем релаксина в I триместре (ρ = –0,324; p = 0,05) и во II триместре (ρ = –0,352; p = 0,039).
Таким образом, полученные данные указывают, что повышение уровня релаксина в I триместре может рассматриваться как потенциальный прогностический маркер риска формирования ИЦН, тогда как во II триместре различия нивелируются. Эластин демонстрирует выраженные изменения между триместрами в обеих группах, что отражает его чувствительность к фазам ремоделирования шейки матки при беременности, однако полученные результаты не позволяют использовать его в качестве предиктора. В связи с этим в комплексную прогностическую модель были включены значения релаксина в I триместре беременности.
Транскриптомные предикторы / Transcriptomic predictors
На платформе биоколлекции ранее был проведен I этап исследования, в результате которого у пациенток с высоким риском ПР с применением NGS было обнаружено 15 дифференциально экспрессируемых микроРНК в I триместре. Для дальнейшего анализа в рамках настоящего исследования было выбрано 5 маркерных микроРНК (табл. 4).
Таблица 4. Нормализованные показатели уровня экспрессии микроРНК (ΔΔCt), полученные методом полимеразной цепной реакции с обратной транскрипцией.
Table 4. Normalized microRNA expression levels (ΔΔCt) obtained by reverse transcription polymerase chain reaction.
|
Группа / Group |
hsa-miR-432-5p |
hsa-miR-134-5p |
hsa-miR-431-5p |
hsa-miR-122-5p |
hsa-miR-34a-5p |
|
Основная / Main |
0,97 ± 0,88 |
1,06 ± 1,27 |
0,68 ± 0,62 |
16,9 ± 54,30 |
3,00 ± 5,90 |
|
Контрольная / Control |
4,80 ± 10,10 |
2,31 ± 3,65 |
0,81 ± 0,80 |
1,98 ± 3,00 |
1,06 ± 0,97 |
При дополнительном корреляционном анализе в основной группе с врПР выявлены сильные положительные связи между изученными транскриптомными и протеомными маркерами: между miR-432 и miR-134 (r = 0,877; p < 0,001), miR-122 и miR-431 (r = 0,596; p = 0,009), между miR-134 и эластином (r = 0,719; p < 0,001), между miR-432 и эластином (r = 0,725; p < 0,001), что может указывать на тесную взаимосвязь молекулярных маркеров ремоделирования внеклеточного матрикса и микроРНК-регуляторов.
Модель оценки риска преждевременных родов / A model for assessing the preterm birth risk
Мы проанализировали возможность создания комплексной модели раннего прогнозирования высокого риска ПР. На основе наиболее значимых клинико-анамнестических предикторов, протеомного предиктора (уровень сывороточного релаксина), транскриптомных предикторов (экспрессия 5 маркерных микроРНК) мы обучили классификатор с использованием метода опорных векторов (SVM). Рисунок 3 демонстрирует высокую эффективность прогностической модели, которая подтверждается ROC-кривой (AUC = 0,83 при обучении и 0,67 в кросс-валидации), что потенциально позволяет использовать разработанный классификатор в составе совокупного инструмента оценки риска ПР.

Рисунок 3. ROC-кривые, показывающие эффективность комплексной модели в прогнозировании высокого риска преждевременных родов: A – обучение, B – кросс-валидация.
Figure 3. ROC curves depicting the effectiveness of the integrated model for predicting high risk preterm birth: A – training, B – cross-validation.
Обсуждение / Discussion
На современном этапе успешное ведение беременности определяется корректным выбором стратегии риск-менеджмента, основанной на предикции реализации акушерских осложнений. Такой подход не только позволяет дифференцировать частоту антенатального наблюдения, объем медицинских исследований, своевременно выявлять клинические проявления, но и профилактировать их развитие. Для выбора персонифицированной стратегии необходимо применение инструментов прогнозирования осложнений, в первую очередь, предиктивных шкал и моделей.
На сегодняшний день большинство применяемых инструментов прогнозирования ПР являются недостаточно эффективными, так как основываются на изолированном применении клинических, инструментальных или лабораторных предикторов. Большинство экспертов сходятся во мнении, что дальнейшие успехи в прогнозировании ПР могут быть достигнуты внедрением в практику консолидированных методов, основанных на сочетанном применении биофизических, биохимических, иммунологических, микробиологических данных, данных фетальных клеток, экзосом или внеклеточной РНК, интегрированных в многофакторную предикторную модель.
Для разработки таких сложных прогностических инструментов требуются современные платформы, обеспечивающие доступ к высококачественному биоматериалу, стандартизованному на всех этапах получения образцов. Биоколлекции различных типов образцов, формируемые в рамках проектов биобанкирования, могут выступать в качестве такой платформы, однако их эффективность требует изучения. Таким образом, целью настоящего исследования стала разработка алгоритма раннего моделирования высокого риска ПР на основе клинико-лабораторных данных на платформе уникальной биоколлекции образцов беременных, созданной согласно стратегии «лонгитюдное биобанкирование».
Результаты настоящего исследования показали, что достаточность наполнения сформированной биоколлекции позволила отобрать образцы женщин, реализовавших осложнение беременности (ИЦН), ассоциированное с ПР, частота которого не превышает 1,0 % в популяции. Коллекционирование биообразцов, полученных как на ранних сроках гестации, так и в контрольных «точках» на протяжении беременности, позволило не только оценить динамику показателей, но и, что наиболее значимо, оценить уровни предикторов на ранних сроках гестации до реализации осложнения. Включение в структуру коллекции различных типов биообразцов позволило оценить уровни транскриптомных и протеомных предикторов в разных биологических средах: сыворотке и плазме крови. Возможность оценки молекулярных маркеров с применением наиболее современных лабораторных методов, таких как секвенирование нового поколения (NGS), в частности РНК-секвенирование, и ОТ-ПЦР, говорит о высоком качестве хранимых образцов, получаемых с соблюдением требований стандартных операционных процедур на преаналитическом этапе, в первую очередь при пробоподготовке. Сохранение широкого спектра клинических данных, ассоциированных с образцами коллекции, позволило в исследуемых группах оценить факторы риска ПР, включенных в разработанный классификатор.
Заключение / Conclusion
Анализ клинико-анамнестических, протеомных и транскриптомных данных, полученных на платформе коллекции с применением современных статистических и биоинформатических методов, позволил разработать комплексную модель раннего прогнозирования высокого риска ПР. Результаты исследования позволяют заключить, что коллекции биообразцов беременных, сформированные согласно стратегии «лонгитюдное биобанкирование», могут являться эффективной платформой для разработки инструментов раннего прогнозирования риска акушерских осложнений.
Список литературы
1. Покровская М.С., Борисова А.Л., Киселева А.В. и др. Роль биобанкирования в развитии персонализированной медицины в России и в мире. Кардиоваскулярная терапия и профилактика. 2024;23(11):6–16. https://doi.org/10.15829/1728-8800-2024-4214.
2. Пачулия О.В., Илларионов Р.А., Вашукова Е.С. и др. Стратегии создания биоресурсных коллекций в акушерстве: опыт Биобанка "Генофонд". Кардиоваскулярная терапия и профилактика. 2024;23(11):4193. https://doi.org/10.15829/1728-8800-2024-4193.
3. Пачулия О.В., Илларионов Р.А., Вашукова Е.С. и др. Характеристика биоресурсной коллекции биообразцов от беременных женщин на разных сроках гестации для поиска ранних биомаркеров осложнений беременности и перспективы ее научного использования. Кардиоваскулярная терапия и профилактика. 2022;21(11):51–9. https://doi.org/10.15829/1728-8800-2022-3399.
4. Радзинский В.Е., Оразмурадов А.А., Савенкова И.В. и др. Преждевременные роды – нерешенная проблема XXI века. Кубанский научный медицинский вестник. 2020;27(4):27–37. https://doi.org/10.25207/1608-6228-2020-27-4-27-37.
5. Di Renzo G.C. The great obstetrical syndromes. J Matern Fetal Neonatal Med. 2009;22(8):633–5. https://doi.org/10.1080/14767050902866804.
6. Каткова Н.Ю., Бодрикова О.И., Безрукова И.М. и др. Клинико-анамнестические особенности различных типов преждевременных родов (ретроспективный обзор). Эффективная фармакотерапия. 2017;26(3):70–6. https://doi.org/10.17116/rosakush20202001154.
7. Беспалова О.Н., Саргсян Г.С. Эффективность применения акушерского пессария при угрожающих преждевременных родах и короткой шейке матки. Медицинский cовет. 2017;(13):118–26. https://doi.org/10.21518/2079-701X-2017-13-118-126.
8. Lamont F., Richardson L.S., Boniface J.J. et al. Commentary on a combined approach to the problem of developing biomarkers for the prediction of spontaneous preterm labor that leads to preterm birth. Placenta. 2020;98:13–23. https://doi.org/10.1016/j.placenta.2020.05.007.
9. Meng L., Öberg S., Sandström A. et al. Identification of risk factors for incident cervical insufficiency in nulliparous and parous women: a population-based case-control study. BMC Med. 2022;20(1):348. https://doi.org/10.1186/s12916-022-02542-7.
10. Shao M., Wang Sh., Ji T. et al. Study on the significance of serum relaxin and elastin expression in pregnant women with cervical insufficiency and its value in evaluating pregnancy outcomes. Progress in Modern Biomedicine. 2023:23(23):4596–600. https://doi.org/10.13241/j.cnki.pmb.2023.23.039.
11. Elovitz M.A., Anton L., Bastek J., Brown A.G. Can microRNA profiling in maternal blood identify women at risk for preterm birth? Am J Obstet Gynecol. 2015;212(6):782.e1–5. https://doi.org/10.1016/j.ajog.2015.01.023.
12. Winger E.E., Reed J.L., Ji X. et al. MicroRNAs isolated from peripheral blood in the first trimester predict spontaneous preterm birth. PLoS One. 2020;15(8):e0236805. https://doi.org/10.1371/journal.pone.0236805.
13. Илларионов Р.А., Косякова О.В., Вашукова Е.С. и др. Особенности создания коллекции образцов беременных женщин на разных сроках гестации для поиска ранних биомаркеров преждевременных родов. Кардиоваскулярная терапия и профилактика. 2020;19(6):2708. https://doi.org/10.15829/1728-8800-2020-2708.
14. Клинические рекомендации – Истмико-цервикальная недостаточность – 2024-2025-2026 (03.09.2024). М.: Министерство здравоохранения Российской Федерации, 2024. 26 с. Режим доступа: https://base.garant.ru/409612135. [Дата обращения: 05.09.2025].
15. Cnattingius S., Villamor E., Johansson S. et al. Maternal obesity and risk of preterm delivery. JAMA. 2013;309(22):2362–70. https://doi.org/10.1001/jama.2013.6295.
16. Maraka S., Ospina N.M.S., O'Keeffe D.T. et al. Subclinical hypothyroidism in pregnancy: a systematic review and meta-analysis. Thyroid. 2016;26(4):580–90. https://doi.org/10.1089/thy.2015.0418.
17. Consortium on Thyroid and Pregnancy – Study Group on Preterm Birth; Korevaar T.I.M., Derakhshan A., Taylor P.N. et al. Association of thyroid function test abnormalities and thyroid autoimmunity with preterm birth: a systematic review and meta-analysis. JAMA. 2019;322(7):632–41. https://doi.org/10.1001/jama.2019.10931.
18. Hiltunen L.M., Laivuori H., Rautanen A. et al. Factor V Leiden as a risk factor for preterm birth: a population-based nested case-control study. J Thromb Haemost. 2011;9(1):71–8. https://doi.org/10.1111/j.1538-7836.2010.04104.x.
19. Iordache O., Anastasiu D.M., Kakarla M. et al. Influence of antiphospholipid antibody-associated thrombophilia on the risk of preterm birth: a systematic review. J Clin Med. 2023;12(16):5316. https://doi.org/10.3390/jcm12165316.
20. Wang E., Tang P., Chen C. Urinary tract infections and risk of preterm birth: a systematic review and meta-analysis. Rev Inst Med Trop Sao Paulo. 2024;66:e54. https://doi.org/10.1590/S1678-9946202466054.
21. Qin J., Liu X., Sheng X. et al. Assisted reproductive technology and the risk of pregnancy-related complications and adverse pregnancy outcomes in singleton pregnancies: a meta-analysis of cohort studies. Fertil Steril. 2016;105(1):73–85.e1–6. https://doi.org/10.1016/j.fertnstert.2015.09.007.
22. Wu C.Q., Nichols K., Carwana M. et al. Preterm birth after recurrent pregnancy loss: a systematic review and meta-analysis. Fertil Steril. 2022;117(4):811–9. https://doi.org/10.1016/j.fertnstert.2022.01.004.
23. Yu J.Y., Jiang B., Zhang X.J. et al. History of induced abortion and the risk of preterm birth: a retrospective cohort study. J Matern Fetal Neonatal Med. 2023;36(1):2207114. https://doi.org/10.1080/14767058.2023.2207114.
24. Lin D., Fan D., Wu S. et al. Risk factors for premature rupture of membranes in pregnant women: a systematic review and meta-analysis. BMJ Open. 2024;14(3):e077727. https://doi.org/10.1136/bmjopen-2023-077727.
25. Saccone G., Perriera L., Berghella V. Prior uterine evacuation of pregnancy as independent risk factor for preterm birth: a systematic review and metaanalysis. Am J Obstet Gynecol. 2016;214(5):572–91. https://doi.org/10.1016/j.ajog.2015.12.044.
26. Qin Z.J., Xu Y., Du Y. et al. Intrauterine hematoma in the first trimester and pregnancy complications: a systematic review and meta-analysis. Front Med. 2022;9:892146. https://doi.org/10.3389/fmed.2022.892146.
27. Morales-Prieto D.M., Chaiwangyen W., Ospina-Prieto S. et al. MicroRNA expression profiles of trophoblastic cells. Placenta. 2012;33(9):725–34. https://doi.org/10.1016/j.placenta.2012.06.007.
28. Murrieta-Coxca J.M., Barth E., Fuentes-Zacarias P. et al. Identification of altered miRNAs and their targets in placenta accreta. Front Endocrinol. 2023;14:1021640. https://doi.org/10.3389/fendo.2023.1021640.
29. Liu Y., Li L., Feng T. et al. Abnormal miR-122-5p expression in decidual NK cells and its impact on trophoblast behavior: insights into unexplained recurrent pregnancy loss. Int J Med Sci. 2024;21(14):2824–36. https://doi.org/10.7150/ijms.101865.
30. Sun M., Chen H., Liu J. et al. MicroRNA-34a inhibits human trophoblast cell invasion by targeting MYC. BMC Cell Biol. 2015;16:21. https://doi.org/10.1186/s12860-015-0068-2.
Об авторах
О. В. ПачулияRussian Federation
Пачулия Ольга Владимировна - к.м.н. Scopus Author ID: 57299197900. WoS ResearcherID: Q-7819-2018.
199034 Санкт-Петербург, Менделеевская линия, д. 3
Т. Е. Лазарева
Russian Federation
Лазарева Татьяна Евгеньевна - Scopus Author ID: 58027876600. WoS ResearcherID: JED-3900-2023.
199034 Санкт-Петербург, Менделеевская линия, д. 3
В. В. Халенко
Russian Federation
Халенко Владислава Валерьевна - Scopus Author ID: 57225139689. WoS ResearcherID: JQW-2024-2023.
199034 Санкт-Петербург, Менделеевская линия, д. 3
Р. А. Илларионов
Russian Federation
Илларионов Роман Арионович - Scopus Author ID: 57222092111. WoS ResearcherID: ABC-7970-2020.
199034 Санкт-Петербург, Менделеевская линия, д. 3
Е. С. Вашукова
Russian Federation
Вашукова Елена Сергеевна - к.б.н. Scopus Author ID: 56140637500. WoS ResearcherID: D-3422-2017.
199034 Санкт-Петербург, Менделеевская линия, д. 3
Т. Б. Постникова
Russian Federation
Постникова Татьяна Борисовна - Scopus Author ID: 57299011900. WoS ResearcherID: AGO-5589-2022.
199034 Санкт-Петербург, Менделеевская линия, д. 3
А. Р. Мальцева
Russian Federation
Мальцева Анастасия Романовна
199034 Санкт-Петербург, Менделеевская линия, д. 3
Ю. П. Милютина
Russian Federation
Милютина Юлия Павловна - д.б.н. Scopus Author ID: 24824836300. WoS ResearcherID: AAE-6182-2019.
199034 Санкт-Петербург, Менделеевская линия, д. 3
Е. А. Корнюшина
Russian Federation
Корнюшина Екатерина Амировна - к.м.н. Scopus Author ID: 57209398656. WoS ResearcherID: K-4891-2018.
199034 Санкт-Петербург, Менделеевская линия, д. 3
О. Н. Беспалова
Russian Federation
Беспалова Олеся Николаевна - д.м.н. Scopus Author ID: 57189999252. WoS ResearcherID: D-3880-2018.
199034 Санкт-Петербург, Менделеевская линия, д. 3
А. С. Глотов
Russian Federation
Глотов Андрей Сергеевич - д.б.н. Scopus Author ID: 7004340255. WoS ResearcherID: E-8525-2015.
199034 Санкт-Петербург, Менделеевская линия, д. 3
Что уже известно об этой теме?
► Становление «Биобанкирования», нового направления биомедицины, обуславливает смену парадигмы в подходах и методологиях проведения научных исследований, которые могут быть проведены на платформе биоколлекций. Биоколлекции представляют собой систематизированное собрание высококачественных образцов различного типа биоматериалов пациентов для долговременного хранения.
► Во всех областях медицинской науки подходы к созданию исследовательских биоколлекций только формируются, и их эффективность предстоит только оценить. В работе авторами оценивается возможность применения биоколлекции, созданной авторами согласно стратегии «лонгитюдное биобанкирование», в качестве платформы для раннего моделирования риска акушерских осложнений.
Что нового дает статья?
► Несмотря на сложность «лонгитюдного» подхода, коллекционирование биообразцов как на ранних сроках гестации, так и в контрольных «точках» на протяжении беременности позволяет оценивать динамику показателей, а также, что наиболее значимо, определять уровни предикторов на ранних сроках гестации до реализации осложнений.
► Включение в структуру коллекции различных типов высококачественных биообразцов позволяет оценивать различные биомаркеры в разных биологических средах с применением наиболее современных лабораторных методов, таких как секвенирование нового поколения. Сохранение широкого спектра клинических данных, ассоциированных с биообразцами, позволяет выявлять клинико-анамнестические предикторы осложнений.
► Разработка алгоритма раннего моделирования высокого риска преждевременных родов с учетом клинических, транскриптомных и протеомных данных на основе биоколлекции, созданной согласно стратегии «лонгитюдное биобанкирование», позволяет заключить об эффективности применения биоколлекции как платформы для поиска инструментов раннего прогнозирования риска акушерских осложнений.
Как это может повлиять на клиническую практику в обозримом будущем?
► Появление новых инструментов раннего прогнозирования риска акушерских осложнений позволит клиницистам при ведении беременности выбирать наилучшие стратегии риск-менеджмента и определять наиболее эффективные подходы к профилактике реализации тяжелых акушерских осложнений.
Рецензия
Для цитирования:
Пачулия О.В., Лазарева Т.Е., Халенко В.В., Илларионов Р.А., Вашукова Е.С., Постникова Т.Б., Мальцева А.Р., Милютина Ю.П., Корнюшина Е.А., Беспалова О.Н., Глотов А.С. Раннее моделирование риска преждевременных родов на платформе биоколлекции образцов беременных, созданной на разных сроках гестации согласно стратегии «лонгитюдное биобанкирование». Акушерство, Гинекология и Репродукция. 2025;19(5):691-704. https://doi.org/10.17749/2313-7347/ob.gyn.rep.2025.686
For citation:
Pachuliya O.V., Lazareva T.E., Khalenko V.V., Illarionov R.A., Vashukova E.S., Postnikova T.B., Maltseva A.R., Milyutina Yu.P., Kornushina E.A., Bespalova O.N., Glotov A.S. Early modeling of preterm birth risk using a biocollection of pregnancy samples created at different gestational stages according to the "longitudinal biobanking" strategy. Obstetrics, Gynecology and Reproduction. 2025;19(5):691-704. (In Russ.) https://doi.org/10.17749/2313-7347/ob.gyn.rep.2025.686
JATS XML

Контент доступен под лицензией Creative Commons Attribution-NonCommercial-ShareAlike 4.0 International License.










































