Перейти к:
Блокада верхнего гипогастрального сплетения в сочетании с превентивной инфильтрационной анестезией операционных ран – новый взгляд на периоперационную анальгезию при лапароскопической миомэктомии
https://doi.org/10.17749/2313-7347/ob.gyn.rep.2025.682
Аннотация
Цель: оценить влияние блокады верхнего гипогастрального сплетения в сочетании с превентивной инфильтрационной анестезией операционных ран на интенсивность болевого синдрома после лапароскопической миомэктомии.
Материалы и методы. В проспективное рандомизированное плацебо-контролируемое двойное слепое исследование включены 207 пациенток, которым была выполнена лапароскопическая миомэктомия. Пациентки, рандомизированные в 3 группы с целевым соотношением 1:1:1, включались в исследование постепенно, некоторые (n = 9) исключались из исследования интраоперационно. Таким образом, в исследование вошли 198 пациенток: группа 1 (n = 66) получала стандартную анальгезию в сочетании с инфильтрацией троакарных ран и блокадой верхнего гипогастрального сплетения, группа 2 (n = 65) – инфильтрацию троакарных ран без блокады сплетения, контрольная группа 3 (n = 67) получала только стандартную анальгезию. Первичной конечной точкой исследования была выраженность болевого синдрома по цифровой рейтинговой шкале (ЦРШ) через 4 часа после операции. Вторичными конечными точками являлись динамика болевого синдрома в другие контрольные точки (2, 6, 8, 12 и 24 часа после операции), сроки мобилизации, частота применения опиоидных анальгетиков, а также характер боли.
Результаты. Выраженность болевого синдрома была достоверно ниже в группе комбинированной анальгезии (группа 1) по сравнению с остальными группами в контрольных точках через 2, 4, 6, 8, 12 часов и на момент выписки (p < 0,05). Использование опиоидных анальгетиков в группе 1 составило 4,5 % против 32,8 % в группе 3 (p = 0,001). Время до первой мобилизации в группе 1 было достоверно короче по сравнению с группами 2 и 3 (медиана – 5 часов против 7 часов; p = 0,017). Висцеральный характер боли (ощущение глубокой тазовой боли) значительно чаще отмечался в группах 2 и 3, чем в группе 1 (p = 0,021).
Заключение. Комбинированная превентивная анальгезия с использованием инфильтрации операционных ран раствором анестетика и блокады гипогастрального нервного сплетения позволяет эффективно снижать выраженность послеоперационного болевого синдрома, минимизировать потребность в опиоидах и ускорять мобилизацию пациенток после лапароскопической миомэктомии.
Ключевые слова
Для цитирования:
Харлов Н.С., Шаповалова Е.А., Басос А.С., Карамян Р.А., Бабина У.Ф., Белоусов А.М. Блокада верхнего гипогастрального сплетения в сочетании с превентивной инфильтрационной анестезией операционных ран – новый взгляд на периоперационную анальгезию при лапароскопической миомэктомии. Акушерство, Гинекология и Репродукция. 2025;19(5):717-726. https://doi.org/10.17749/2313-7347/ob.gyn.rep.2025.682
For citation:
Kharlov N.S., Shapovalova E.A., Basos A.S., Karamyan R.A., Babina U.F., Belousov A.M. Superior hypogastric plexus block along with preemptive troacar site infiltration: a novel multimodal strategy for pain control following laparoscopic myomectomy. Obstetrics, Gynecology and Reproduction. 2025;19(5):717-726. (In Russ.) https://doi.org/10.17749/2313-7347/ob.gyn.rep.2025.682
Введение / Introduction
Лапароскопическая миомэктомия (ЛМ) является золотым стандартом органосохраняющего хирургического лечения миомы матки (ММ) [1]. Минимально инвазивный доступ позволяет реализовать принципы ускоренного послеоперационного восстановления (англ. Enhanced Recovery After Surgery, ERAS) [2], обеспечивая снижение интраоперационной травмы, выраженности послеоперационной боли и, как следствие, сокращение сроков мобилизации [3].
Именно адекватное периоперационное обезболивание представляется одним из важнейших условий для скорейшего возвращения пациенток к повседневной активности после хирургического вмешательства и, что немаловажно, обеспечения высокого качества жизни в раннем послеоперационном периоде [4].
Согласно национальным клиническим рекомендациям, периоперационное обезболивание при гинекологических операциях может включать в себя превентивную инфильтрацию ран раствором местного анестетика и системную терапию нестероидными противовоспалительными средствами (НПВС), парацетамолом и опиоидными анальгетиками [5]. Опиоидная анальгезия по-прежнему считается наиболее действенным «средством спасения» при выраженном болевом синдроме. Тем не менее все больше авторов приходят к мнению, что применение наркотических препаратов препятствует реализации протокола ERAS, и призывают к внедрению методик безопиоидной анальгезии [6]. Помимо всем известных побочных эффектов этих препаратов (угнетение сознания, избыточная седация, тошнота и рвота), обсуждается их иммуносупрессивное действие, снижение эффективности местных анестетиков и даже способность формировать опиоид-индуцированную гиперальгезию [7].
Согласно данным литературы, до 41 % пациенток после лапароскопических гинекологических операций испытывают выраженный послеоперационный болевой синдром [8], а среди пациенток, перенесших ЛМ, эта цифра достигает 52 % [4]. Это обусловлено особенностями иннервации матки, включающей как соматические волокна, идущие в составе тазового нервного сплетения, так и вегетативные (преимущественно симпатические и парасимпатические), проходящие через верхнее и нижнее гипогастральные сплетения. В связи с этим болевой синдром после ЛМ носит многокомпонентный характер, сочетая соматическую и висцеральную боль [9]. Неудовлетворительные результаты обезболивания, описываемые в литературе, вероятно обусловлены отсутствием влияния используемого подхода на висцеральный компонент болевого синдрома [10].
Блокада гипогастрального нервного сплетения (БГНС) – главного узла тазовой иннервации – неоднократно исследовалась у пациентов с хроническим болевым синдромом на фоне злокачественных новообразований органов малого таза, дисменореи, эндометриоза и других заболеваний [11]. Ранее также было показано, что она успешно справляется с послеоперационной болью у пациенток, перенесших абдоминальную гистерэктомию [12] и кесарево сечение [13]; однако исследований, направленных на изучение влияния превентивной БГНС на послеоперационный синдром у пациенток, перенесших ЛМ, не проводилось.
Цель: оценить влияние блокады верхнего гипогастрального сплетения в сочетании с превентивной инфильтрационной анестезией операционных ран на интенсивность болевого синдрома после лапароскопической миомэктомии.
Материалы и методы / Materials and Methods
Дизайн исследования / Study design
В проспективное рандомизированное плацебо-контролируемое двойное слепое исследование включены 198 пациенток, госпитализированные в гинекологическое отделение в период с мая 2024 г. по январь 2025 г. для выполнения ЛМ.
Критерии включения и исключения / Inclusion and exclusion criteria
Критерии включения: наличие крупноузловой (≥ 6 cм) и/или множественной ММ в репродуктивном возрасте (с 18 до 49 лет).
Критерии исключения: наличие субсерозной ММ «на ножке» – тип 7 по классификации Международной федерации акушеров и гинекологов (англ. International Federation of Gynecology and Obstetrics, FIGO); интраоперационная конверсия на лапаротомию; выраженный спаечный процесс в области крестца, не позволяющий безопасно произвести БГНС; симультанное хирургическое лечение на других органах малого таза и брюшной полости.
Группы обследованных / Study groups
Соответствовавшие критериям включения 207 пациенток, вошедшие в исследование, были разделены на 3 группы посредством случайной рандомизации с помощью программы Sealed Envelope (Sealed Envelope Ltd, Великобритания) с целевым соотношением 1:1:1. Пациентки включались в исследование постепенно, некоторые пациентки (n = 9) исключались из исследования интраоперационно. Таким образом, в исследование вошли 198 пациенток.
Всем женщинам интраоперационно выполнялась прединцизионная инфильтрация передней брюшной стенки в области троакарных ран и инфильтрация пресакральной клетчатки. В группе 1 (n = 66) с целью блокады передачи болевых импульсов от передней брюшной стенки и области верхнего гипогастрального сплетения инфильтрация производилась 0,2 % раствором ропивакаина. В группе 2 (n = 65) проводилась анестезия области троакарных ран, а для введения в пресакральную клетчатку использовали плацебо – 0,9 % раствор хлорида натрия. Пациенткам контрольной группы 3 (n = 67) в обоих случаях вводили плацебо (рис. 1).
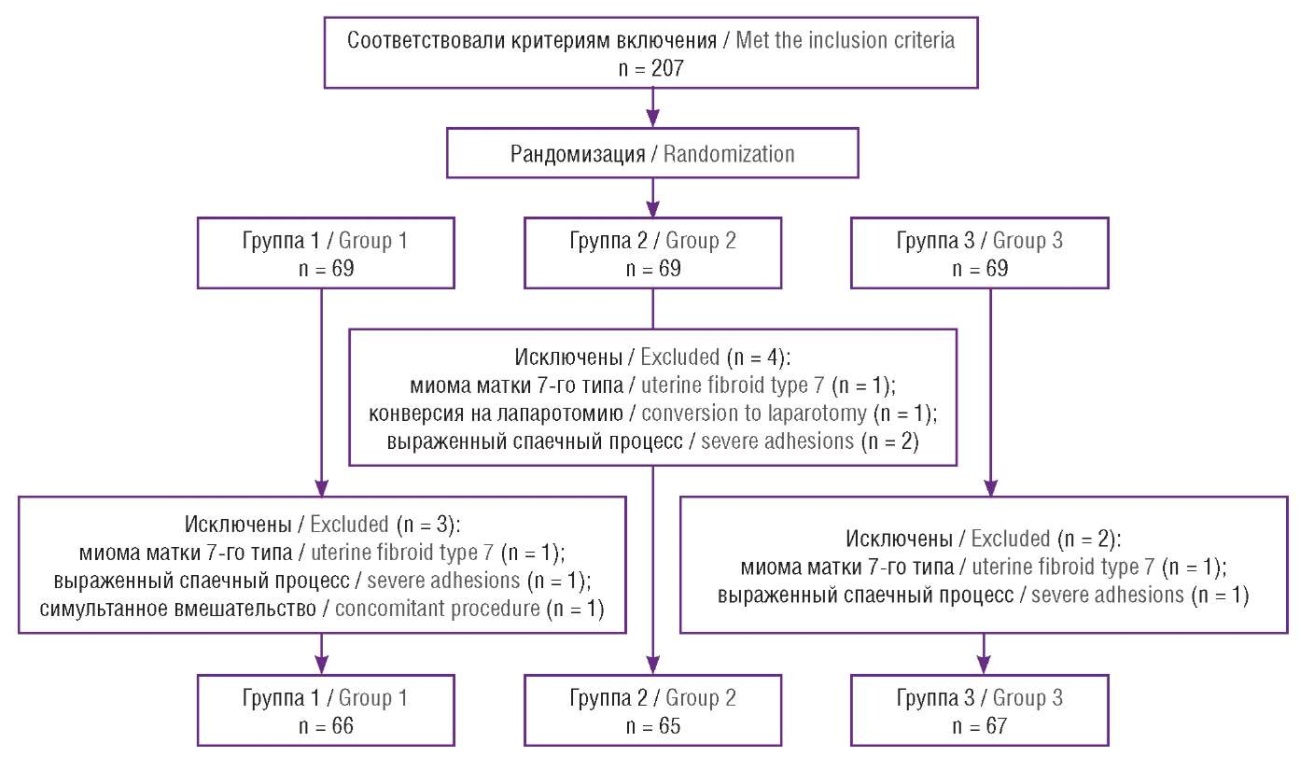
Рисунок 1. Распределение пациенток: группа 1 – комбинированное введение анестетика, группа 2 – анестезия троакарных ран + плацебо, группа 3 – плацебо в обоих случаях.
Figure 1. Patient distribution: Group 1 – combined anesthetic administration, Group 2 – trocar wound anesthesia + placebo, Group 3 – placebo in both cases.
Техника проведения превентивной анальгезии / Preventive analgesia technique
Всем пациенткам выполнялась стандартизированная ЛМ из 4 доступов (троакары 12 мм, 2×10 мм, 5 мм). Превентивная анальгезия в области троакарных ран и пресакрального пространства выполнялась в соответствии с запатентованной методикой [14]: объем раствора для инфильтрации передней брюшной стенки рассчитывали по формуле: количество вещества (мл) = длине разреза (мм). Необходимый объем раствора анестетика/плацебо вводили в переднюю брюшную стенку до произведения разрезов. После введения троакаров в брюшную полость и визуализации области промонториума лапароскопическим зажимом приподнимали брюшину над ним, формируя «тентообразную» структуру. В верхнюю часть сформированного купола погружалась лапароскопическая пункционная игла сечением 1 мм, после чего в пресакральное пространство медленно вводилось 10 мл раствора – анестетика или плацебо в соответствии с протоколом исследования (рис. 2).
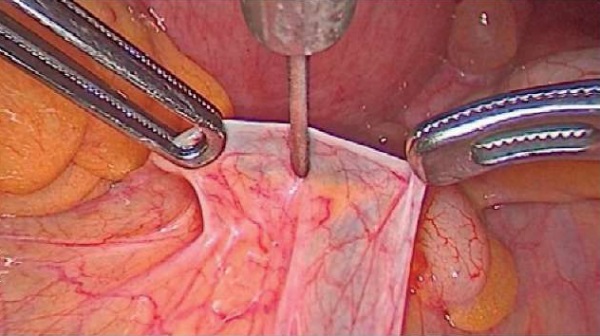
Рисунок 2. Проведение блокады гипогастрального нервного сплетения.
Figure 2. Hypogastric plexus block in process.
Лапароскопическая миомэктомия выполнялась типично. Энуклеацию миоматозных узлов производили с использованием гармонического скальпеля Ultracision (Ethicon, США), дефект миометрия ушивали синтетической рассасывающейся полигликолидной нитью (ПГА 2–0) отдельными эндошвами в несколько рядов в соответствии с типом удаляемых миоматозных узлов. Миоматозные узлы удалялись из брюшной полости путем морцелляции в контейнере через рану в надлобковой области. Рану в надлобковой области ушивали по Берси, остальные троакарные раны – только наложением внутрикожного шва.
Послеоперационное ведение пациенток / Postoperative management
Протокол послеоперационного обезболивания для всех женщин был стандартизованным: внутривенное введение кеторолака в дозировке 1,0 мл и парацетамола в дозировке 100,0 мл через каждые 8 часов в первые сутки, на 2-е сутки – каждые 12 часов, чаще – по требованию. В послеоперационном периоде оценивалась степень выраженности болевого синдрома в соответствии с цифровой рейтинговой шкалой (ЦРШ) через 2, 4, 6, 8, 12 и 24 часа. При развитии/сохранении болевого синдрома > 4 баллов по ЦРШ пациентке предлагали введение опиоидного анальгетика (промедол в дозировке 1,0 мг, внутримышечно). Помимо регистрации степени выраженности боли, через 4 часа после операции производилось анкетирование пациенток на предмет характеристики болевого синдрома. Для этого путем устного опроса выясняли, какая боль больше беспокоит: глубокая – «как при менструации» или поверхностная – «как после физической нагрузки». Ответы пациенток отмечались в специальном листке послеоперационного наблюдения вместе с уровнем болевого синдрома.
Мобилизация пациенток (вертикализация с последующим удалением мочевого катетера) производилась вечером в день операции, периодом мобилизации считалось время от завершения оперативного вмешательства до подъема пациентки и удаления катетера с возможностью самостоятельного передвижения в палате.
Первичной конечной точкой исследования была степень выраженности болевого синдрома по ЦРШ через 4 часа после операции. Вторичными конечными точками являлись динамика болевого синдрома по ЦРШ в других контрольных точках (2, 6, 8, 12 и 24 часа после операции), сроки мобилизации, частота применения опиоидных анальгетиков, а также характер болевого синдрома, который определялся также через 4 часа.
Статистический анализ / Statistical analysis
Статистический анализ выполнялся с использованием IBM SPSS Statistics, версия 29.0 (IBM Corp., США). Нормальность распределения количественных данных оценивали критерием Колмогорова–Смирнова. При отсутствии нормального распределения данные описывались как медиана и межквартильный интервал (Ме [Q1–Q3]), и для их сравнения применялись непараметрические методы. Сравнение количественных переменных между 3 группами проводили с помощью критерия Краскела–Уоллиса с пост-хок тестом Данна. Категориальные переменные анализировали критерием χ² Пирсона или точным тестом Фишера (при ожидаемой частоте < 5). Динамику болевого синдрома по ЦРШ оценивали с использованием критерия Фридмана для связанных выборок. Статистически значимыми считали различия при p < 0,05 (двусторонний критерий).
Результаты / Results
Сравнительный анализ показателей обследованных 198 пациенток, включающий возраст, индекс массы тела (ИМТ), размеры наибольшего миоматозного узла, объем интраоперационной кровопотери и длительность хирургического вмешательства, не выявил статистически значимых различий (p > 0,05 для всех параметров) между группами (табл. 1).
Таблица 1. Клинико-анамнестическая характеристика обследованных женщин.
Table 1. Clinical and anamnestic characteristics of the examined women.
|
Показатель Parameter Me [Q1–Q3] |
Группа 1 Group 1 n = 66 |
Группа 2 Group 2 n = 65 |
Группа 3 Group 3 n = 67 |
p |
|
Возраст, лет Age, years |
44,4 [ 39,1–46,9] |
44,1 [ 40,1–46,7] |
42,7 [ 38,9–44,8] |
0,145 |
|
Длительность операции, мин. Operative time, min |
97,5 [ 75,0–130,0] |
95,0 [ 68,0–120,0] |
95,0 [ 75,0–137,5] |
0,669 |
|
Кровопотеря, мл Blood loss, ml |
115,0 [ 50,0–200,0] |
100,0 [ 50,0–150,0] |
100,0 [ 50,0–200,0] |
0,170 |
|
Индекс массы тела, кг/м² Body mass index, kg/m² |
24,43 [ 21,88–28,37] |
24,97 [ 21,45–28,34] |
24,03 [ 20,89–27,52] |
0,593 |
|
Размеры наибольшего миоматозного узла, мм Size of the largest myomatous node, mm |
68,0 [ 55,0–80,0] |
69,0 [ 56,0–84,0] |
70,0 [ 62,0–80,0] |
0,650 |
Продолжительность госпитализации во всех случаях составила 3 койко-дня. Ни в одном случае не было осложнений, связанных с проведением инфильтрации пресакрального пространства.
Через 4 часа после операции медиана уровня болевого синдрома в соответствии с ЦРШ в группе 1 с комбинированной превентивной анестезией с применением блокады гипогастрального сплетения составила 2,0 [ 2,0–3,0] балла, в группе 2 с прединцизионной инфильтрационной анестезией операционных ран – 2,0 [ 2,0–4,0] балла, в контрольной группе 3 (плацебо) – 4,0 [ 3,0–4,0] балла. Межгрупповой анализ выявил статистически значимые различия между группами 1 и 3 (p < 0,001) и между группами 1 и 2 (p = 0,048) при общем уровне значимости p < 0,001.
Значимые различия между группами отмечались также в более ранние сроки: через 2 часа после операции медиана ЦРШ в группе 1 была достоверно ниже по сравнению с группами 2 и 3 (p1-3 < 0,001; p1–2 = 0,046). Через 6, 8 и 12 часов после операции значения ЦРШ в группе с выполненной блокадой гипогастрального сплетения (группа 1) оставались значимо ниже, чем в группе 3 системной анальгезии (p1-3 < 0,01), при этом различия между группами 1 и 2 на этих временных точках статистической значимости не достигали. Через 24 часа после операции различий в уровне болевого синдрома между группами не зафиксировано (p = 0,179); однако к моменту выписки показатели боли вновь были достоверно ниже в группе 1 по сравнению с группой 3 (p1-3 = 0,011) (рис. 3).
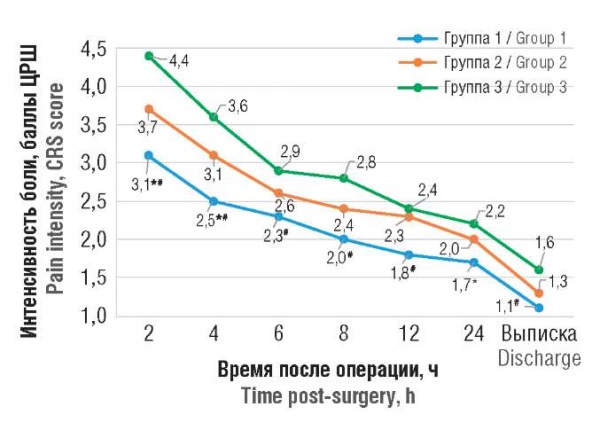
Рисунок 3. Оценка боли в послеоперационном периоде с помощью цифровой рейтинговой шкалы (ЦРШ) в группах исследования (значения ЦРШ на графике представлены как среднее).
Примечание: *p < 0,05 – различия статистически значимы по сравнению с группой 2; #p < 0,05 – различия статистически значимы по сравнению с контрольной группой 3.
Figure 3. Postoperative pain assessment using the Numeric Rating Scale (NRS) in the study groups (NRS values are presented as mean).
Note: *p < 0.05 – significant differences compared to group 2; #p < 0.05 – significant differences compared to control group 3.
В отношении сроков мобилизации после операции также отмечены статистически значимые различия в группах. Самая ранняя мобилизация наблюдалась в группе 1 – через 5,0 [ 4,0–7,0] часов; в группах 2 и 3 мобилизация после операции была значимо позже – через 7,0 [ 4,0–13,0] часов и 7,0 [ 5,0–11,5] часов, соответственно (p1-3 = 0,017; p1-2 = 0,018) (рис. 4).
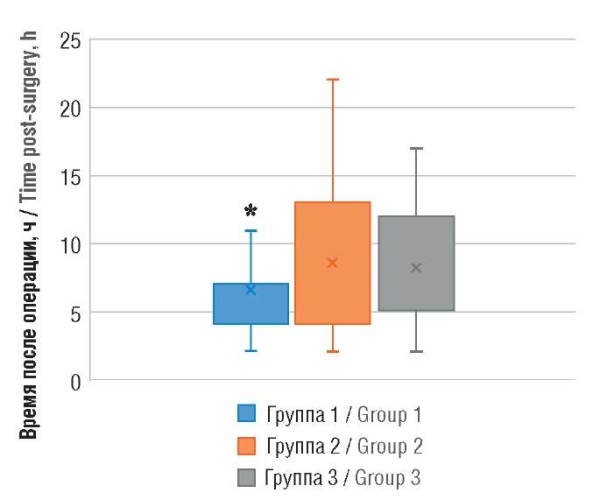
Рисунок 4. Сроки мобилизации пациенток в группах.
Примечание: *p < 0,05 – различия статистически значимы по сравнению с группами 2 и 3.
Figure 4. Timeframes for female patient mobilization.
Note: *p < 0.05 – significant differences compared to groups 2 and 3.
В отношении частоты применения опиоидных анальгетиков (табл. 2) также были выявлены статистически значимые различия между 3 группами (χ² = 17,91; p < 0,001). Опиоиды использовались у 3 из 67 (4,5 %) пациенток в группе 1, у 14 из 65 (21,5 %) в группе 2 и у 22 из 67 (32,8 %) в группе 3. Попарный анализ показал, что потребность в опиоидах была значительно ниже в группе 1 по сравнению с группой 3 (p < 0,001) и группой 2 (p = 0,009); различий между группами 2 и 3 не выявлено (p = 0,159).
Таблица 2. Частота использования опиоидных анальгетиков.
Table 2. Frequency of opioid analgesics use.
|
Показатель Parameter Me [ Q1–Q3] |
Группа 1 Group 1 n = 66 |
Группа 2 Group 2 n = 65 |
Группа 3 Group 3 n = 67 |
p |
|
Использование опиоидной анальгезии, n (%) Opioid analgetic use, n (%) |
3 (4,5) |
14 (21,5) |
22 (32,8) |
р1-3 < 0,001 р1-2 = 0,009 |
При оценке характера болевого синдрома через 4 часа после оперативного лечения наблюдалось достоверное уменьшение встречаемости «глубокой» (менструальноподобной) боли в проекции матки у пациенток группы 1 по сравнению пациентами групп 2 и 3. В то же время ощущение поверхностной боли у женщин группы 1 отмечалось чаще (p < 0,05), чем у пациенток групп 2 и 3 (табл. 3).
Таблица 3. Локализация боли через 4 часа после операции.
Table 3. Pain localization 4 hours post-surgery.
|
Локализация боли Pain localization |
Группа 1 Group 1 n = 66 n (%) |
Группа 2 Group 2 n = 65 n (%) |
Группа 3 Group 3 n = 67 n (%) |
p |
|
Поверхностная боль / Superficial pain |
30 (45,5) |
15 (23,1) |
21 (31,3) |
0,023 |
|
Внутренняя боль / Deep pain |
41 (62,1) |
53 (81,5) |
53 (79,1) |
0,021 |
Обсуждение / Discussion
Борьба за качество жизни пациентов в послеоперационном периоде, необходимость обеспечения низкого уровня болевого синдрома в рамках ERAS протокола в сочетании с направленностью на минимизацию использования опиоидных анальгетиков требуют разработки новых подходов к терапии послеоперационной боли. В то время как методика превентивной анестезии операционных ран уже широко изучена, вопрос воздействия на висцеральный компонент болевого синдрома после операций, в том числе лапароскопических, в течение последнего десятилетия является актуальным поводом для исследований [15].
Так, в работе H.G. Aytuluk с соавт., опубликованной в 2019 г., были представлены результаты выполнения блокады верхнего гипогастрального сплетения при лапароскопической гистерэктомии [16]. Методика продемонстрировала свою эффективность по всем ключевым параметрам, включая достоверное снижение интенсивности болевого синдрома по визуальной аналоговой шкале (ВАШ) на всех контрольных точках наблюдения (в отделении пробуждения, через 1, 6, 24 и 48 часов после операции; p < 0,05), а также уменьшение потребности в анальгетиках. В отделении пробуждения лишь 46 % пациенток в группе с БГНС нуждались в применении НПВС и 6 % – в опиоидах, тогда как в контрольной группе НПВС требовались 93 % пациенток, а опиоиды – 13 %. В хирургическом отделении медианное потребление НПВС составило 2 [ 0–4] флакона в группе с блокадой и 5 [ 1–9] флаконов в контрольной группе; потребность в опиоидах в группе с блокадой отсутствовала, тогда как в контрольной группе 4 пациентки потребовали опиоидную анальгезию. Различия между группами были статистически значимыми по всем бинарным сравнениям (p < 0,0033).
При этом в аналогичном исследовании N.V. Clark с соавт. не была достигнута статистически значимая разница в количестве пациентов с уровнем боли < 4 см по ВАШ между группой блокады и группой контроля [17]. Р. De Silva с соавт. изучали эффективность БГНС, выполняемой во время лапароскопических или робот-ассистированных гистерэктомий и миомэктомий, в отношении послеоперационного болевого синдрома. В данном исследовании введение анестетика производилось в конце операции, что потенциально может снижать эффективность методики в связи с нарушением принципа превентивности. Несмотря на это, в группе блокады отмечено снижение потребления опиоидов на 38 %, а также выявлено уменьшение среднего уровня боли согласно ВАШ: 1,8 см в группе блокады против 2,6 см в контрольной группе, различия в показателях боли отмечались во всех временных точках – 1, 2, 6, 12 и 24 часа после операции [18].
В нашем исследовании впервые была изучена эффективность комбинированного подхода к превентивному обезболиванию при ЛМ, включающего инфильтрацию передней брюшной стенки и блокаду верхнего гипогастрального нервного сплетения. Данный метод позволил значимо снизить выраженность болевого синдрома в первые 4 часа послеоперационного периода и сохранять эту тенденцию во всех последующих контрольных точках. При этом наибольшие различия отмечались между группой 1 и группой 3 (плацебо), в которой применялась стандартная системная анальгезия (p < 0,001 через 2 и 4 часа; p < 0,01 через 6, 8 и 12 часов). Применение данной методики положительно сказалось на необходимости применения опиоидных анальгетиков: в группе с комбинированной анестезией (группа 1) они использовались в 7 раз реже, чем в группе стандартного обезболивания (группа 3) – 4,5 % против 32,8 % (p < 0,001).
Эффективное обезболивание является ключевым условием для реализации протокола ERAS, поскольку выраженный болевой синдром затрудняет раннюю мобилизацию пациенток. В нашем исследовании применение комбинированной анальгезии позволило достичь значимого сокращения времени мобилизации, которая наступала у пациенток группы 1 в среднем на 2 часа раньше, чем в группах 2 и 3 (5 часов против 7 часов; p = 0,017).
При изучении характеристики болевого синдрома через 4 часа после операции были выявлены статистически значимые различия в отношении ощущения глубокой, менструальноподобной боли: она встречалась реже (p = 0,021) в группе с БГНС (группа 1) в сравнении с группами с инфильтрационной анестезией ран (группа 2) или введением плацебо (группа 3). Интересным стал тот факт, что на фоне сниженного восприятия «внутренней» боли именно в группе 1 поверхностная локализация болевых ощущений отмечалась чаще (p = 0,023), что вероятно можно объяснить смещением «фокуса внимания» женщин на область операционных ран.
Важно отметить, что предложенный подход к интраоперационному введению анестетика не был ассоциирован с какими-либо интра- или послеоперационными осложнениями. Применение раствора ропивакаина в предложенной дозировке (0,2 %) и в соответствии с предложенной методикой введения не отразилось негативно на системных показателях организма во время операции.
Ограничения исследования / Study limitations
Ограничениями данного исследования являются его одноцентровой дизайн, а также отсутствие детализации структуры болевого синдрома в последующие часы послеоперационного контроля.
Заключение / Conclusion
Комбинация прединцизионной инфильтрационной анестезии троакарных ран и блокады верхнего гипогастрального нервного сплетения представляет собой эффективную и безопасную методику, направленную на снижение болевого синдрома после ЛМ, с минимизацией применения опиоидной анальгезии и сокращением сроков мобилизации пациентов. Полученные данные могут служить основой для разработки обновленного протокола периоперационного обезболивания в гинекологической хирургии.
Список литературы
1. Dumitrașcu M.C., Nenciu C.-G., Nenciu A.-E. et al. Laparoscopic myomectomy – the importance of surgical techniques. Front Med. 2023;10:1158264. https://doi.org/10.3389/fmed.2023.1158264.
2. Bisch S.P., Jago C.A., Kalogera E. et al. Outcomes of enhanced recovery after surgery (ERAS) in gynecologic oncology – a systematic review and meta-analysis. Gynecol Oncol. 2021;161(1):46–55. https://doi.org/10.1016/j.ygyno.2020.12.035.
3. Cezar C., Becker S., di Spiezio Sardo A. et al. Laparoscopy or laparotomy as the way of entrance in myoma enucleation. Arch Gynecol Obstet. 2017;296(4):709–20. https://doi.org/10.1007/s00404-017-4490-x.
4. Харлов Н.С., Карамян Р.А., Басос А.С. и др. Лапароскопическая миомэктомия: качество жизни пациенток при «fast-track»-хирургии. Вопросы гинекологии, акушерства и перинатологии. 2025;24(2):168–74. https://doi.org/10.20953/1726-1678-2025-2-168-174.
5. Овечкин А.М., Баялиева А.Ж., Ежевская А.А. и др. Послеоперационное обезболивание. Клинические рекомендации. Вестник интенсивной терапии имени А.И. Салтанова. 2019;(4):9–33. https://doi.org/10.21320/1818-474X-2019-4-9-33.
6. Овечкин А.М., Сокологорский С.В., Политов М.Е. Безопиоидная анестезия и анальгезия – дань моде или веление времени? Новости хирургии. 2019;27(6):700–15. https://doi.org/10.18484/2305-0047.2019.6.700.
7. Yiu C.H., Gnjidic D., Patanwala A. et al. Opioid-related adverse drug events in surgical patients: risk factors and association with clinical outcomes. Expert Opin Drug Saf. 2022;21(9):1211–23. https://doi.org/10.1080/14740338.2022.2049230.
8. Joo J., Moon H.K., Moon Y.E. Identification of predictors for acute postoperative pain after gynecological laparoscopy (STROBE-compliant article). Medicine. 2019;98(42):e17621. https://doi.org/10.1097/MD.0000000000017621.
9. Astruc A., Roux L., Robin F. et al. Advanced insights into human uterine innervation: implications for endometriosis and pelvic pain. J Clin Med. 2024;13(5):1433. https://doi.org/10.3390/jcm13051433.
10. Gebhart G.F., Bielefeldt K. Physiology of visceral pain. Compr Physiol. 2016;6(4):1609–33. https://doi.org/10.1002/cphy.c150049.
11. Urits I., Schwartz R., Herman J. et al. A comprehensive update of the superior hypogastric block for the management of chronic pelvic pain. Curr Pain Headache Rep. 2021;25(3):13. https://doi.org/10.1007/s11916-020-00933-0.
12. Alomar O., Abuzaid M., Abu-Zaid A. et al. Superior hypogastric plexus (SHP) block during minimally invasive hysterectomy: a systematic review. Turk J Obstet Gynecol. 2022;19(2):170–7. https://doi.org/10.4274/tjod.galenos.2022.49696.
13. Peker H., Atasayan K., Peker B.H., Kilicci C. Intraoperative superior hypogastric plexus block for pain relief after a cesarean section: a case-control study. Croat Med J. 2021;62(5):472–9. https://doi.org/10.3325/cmj.2021.62.472.
14. Басос А.С., Харлов Н.С., Шаповалова Е.А., Бабина У.Ф. Способ превентивной анальгезии при выполнении лапароскопической миомэктомии с использованием местной анестезии троакарныхран и забрюшинного пространства в проекции мыса крестца. Патент РФ на изобретение RU 2838875 C1 от 22.04.2025. Бюл. № 12. 8 с.
15. Любашина О.А., Сиваченко И.Б., Бусыгина И.И. Особенности нейрофизиологических механизмов висцеральной и соматической боли. Успехи физиологических наук. 2022;53(2):3–14. https://doi.org/10.31857/S0301179822020072.
16. Aytuluk H.G., Kale A., Basol G. Laparoscopic superior hypogastric blocks for postoperative pain management in hysterectomies: a new technique for superior hypogastric blocks. J Minim Invasive Gynecol. 2019;26(4):740–7. https://doi.org/10.1016/j.jmig.2018.08.008.
17. Clark N.V., Moore K., Maghsoudlou P. et al. Superior hypogastric plexus block to reduce pain after laparoscopic hysterectomy: a randomized controlled trial. Obstet Gynecol. 2021;137(4):648–56. https://doi.org/10.1097/AOG.0000000000004329.
18. De Silva P., Daniels S., Bukhari M.E. et al. Superior hypogastric plexus nerve block in minimally invasive gynecology: a randomized controlled trial. J Minim Invasive Gynecol. 2022;29(1):94–102. https://doi.org/10.1016/j.jmig.2021.06.017.
Об авторах
Н. С. ХарловРоссия
Харлов Никита Сергеевич
190103 Санкт-Петербург, набережная реки Фонтанки, д. 154
Е. А. Шаповалова
Россия
Шаповалова Екатерина Андреевна - к.м.н.
190103 Санкт-Петербург, набережная реки Фонтанки, д. 154
А. С. Басос
Россия
Басос Александр Сергеевич - к.м.н.
190103 Санкт-Петербург, набережная реки Фонтанки, д. 154
Р. А. Карамян
Россия
Карамян Ромелла Артуровна
190103 Санкт-Петербург, набережная реки Фонтанки, д. 154
У. Ф. Бабина
Россия
Бабина Ульяна Федоровна
190103 Санкт-Петербург, набережная реки Фонтанки, д. 154
А. М. Белоусов
Россия
Белоусов Александр Михайлович - д.м.н.
190103 Санкт-Петербург, набережная реки Фонтанки, д. 154
Что уже известно об этой теме?
► Послеоперационный болевой синдром остается актуальной клинической проблемой даже при минимально инвазивных вмешательствах. Лапароскопическая миомэктомия нередко сопровождается выраженной болью за счет висцерального компонента.
► Протокол ускоренного послеоперационного восстановления (ERAS) при лапароскопической миомэктомии предполагает применение мультимодальной анальгезии. Важным ее элементом считается превентивное использование местных анестетиков.
► Блокада гипогастрального сплетения ранее доказала эффективность при лечении хронической тазовой боли, что делает ее перспективной в хирургической гинекологии.
Что нового дает статья?
► Впервые описана методика комбинированного превентивного обезболивания при лапароскопической миомэктомии, включающая лапароскопическую блокаду верхнего гипогастрального сплетения и подкожную инфильтрацию области троакаров местным анестетиком.
► Использование данной методики снижает потребность в опиоидах и ускоряет мобилизацию пациенток в раннем послеоперационном периоде.
► Подтверждено, что послеоперационная боль при лапароскопической миомэктомии обусловлена преимущественно висцеральным компонентом, о чем свидетельствует преобладание глубокой тазовой боли у пациенток без блокады гипогастрального сплетения.
Как это может повлиять на клиническую практику в обозримом будущем?
► Применение комбинированной методики превентивного обезболивания позволяет снизить интенсивность боли в раннем послеоперационном периоде, уменьшить потребность в опиоидах и повысить безопасность анальгезии.
► Использование локальных методов анальгезии облегчает раннюю мобилизацию и способствует сокращению сроков госпитализации, что соответствует современным принципам ERAS протоколов.
► Включение лапароскопической блокады гипогастрального сплетения в рутинную практику может улучшить качество жизни пациенток и повысить удовлетворенность результатами хирургического лечения.
Рецензия
Для цитирования:
Харлов Н.С., Шаповалова Е.А., Басос А.С., Карамян Р.А., Бабина У.Ф., Белоусов А.М. Блокада верхнего гипогастрального сплетения в сочетании с превентивной инфильтрационной анестезией операционных ран – новый взгляд на периоперационную анальгезию при лапароскопической миомэктомии. Акушерство, Гинекология и Репродукция. 2025;19(5):717-726. https://doi.org/10.17749/2313-7347/ob.gyn.rep.2025.682
For citation:
Kharlov N.S., Shapovalova E.A., Basos A.S., Karamyan R.A., Babina U.F., Belousov A.M. Superior hypogastric plexus block along with preemptive troacar site infiltration: a novel multimodal strategy for pain control following laparoscopic myomectomy. Obstetrics, Gynecology and Reproduction. 2025;19(5):717-726. (In Russ.) https://doi.org/10.17749/2313-7347/ob.gyn.rep.2025.682

Контент доступен под лицензией Creative Commons Attribution-NonCommercial-ShareAlike 4.0 International License.











































