Перейти к:
К вопросу о рецидивирующих тромбозах у онкологических больных
https://doi.org/10.17749/2313-7347/ob.gyn.rep.2025.667
Аннотация
Цель: выявить ключевые патогенетические факторы и триггеры, ассоциированные с рецидивирующими венозными тромбоэмболическими осложнениями (ВТЭО) у онкогинекологических пациенток.
Материалы и методы. Проведено ретроспективное когортное исследование, включившее 3 группы онкогинекологических пациенток: 155 женщин с эпизодами тромбозов в анамнезе (группа I), 66 пациенток с рецидивирующими тромбозами при раке яичников III–IV стадии (группа II) и 72 пациентки с опухолями женских половых органов, перенесшие COVID-19 (группа III). Всем пациенткам выполнена комплексная оценка врожденных тромбофилий (FV Leiden, протромбин G20210A, MTHFR C677T, PAI-1, тромбоцитарные гликопротеины), приобретенных тромбофилий (антитела к β2-GP1, аннексину V, протромбину), а также маркеров эндотелиальной дисфункции – фактора фон Виллебранда (англ. von Willebrand factor vWF) и металлопротеазы ADAMTS-13 и тромбовоспалительного синдрома (D-димер). Статистический анализ проведен с использованием непараметрических тестов при уровне значимости p < 0,05.
Результаты. Установлено, что рецидивирующие ВТЭО у онкогинекологических пациенток формируются на фоне высокой распространенности врожденных и приобретенных тромбофилий, нарушений оси vWF/ADAMTS-13 и активации тромбовоспалительного синдрома. В группе I генетические формы тромбофилии выявлены у 145 (93,6 %) пациенток, причем мультигенные варианты встречались у 113 (72,9 %), циркуляция антифосфолипидных антител (АФА) обнаружена у 87 (55,8 %) больных. В группе II генетическая тромбофилия выявлена у 44 (66,7 %) женщин, циркуляция АФА – у 31 (47,0 %); медианный уровень vWF составил 1513 МЕ/л (p < 0,05), содержание D-димера превышало 1500 нг/мл у 48 (72,7 %) пациенток (медиана 2700 нг/мл). В группе III рецидивы ВТЭО зарегистрированы у 39 (54,2 %) пациенток; медианный уровень vWF достигал 3450 МЕ/л, содержание ADAMTS-13 было снижено до 220 МЕ/л по сравнению с группами I и II (p < 0,01). Уровень D-димера превышал 1500 нг/мл у 33 (84,6 %) пациенток (медиана 2900 нг/мл). Циркуляция АФА выявлена у 28 (71,8 %) пациенток с рецидивами. Риск рецидива при перенесенном COVID-19 был выше на 70 % (относительный риск (ОР) = 1,7; 95 % доверительный интервал (ДИ) = 1,1–2,8; p < 0,05).
Заключение. Рецидивирующие ВТЭО у онкогинекологических пациенток имеют многофакторную природу, обусловленную совокупностью врожденных и приобретенных тромбофилических состояний, эндотелиальной дисфункцией и тромбовоспалительного синдрома, а перенесенный COVID-19 значительно усугубляет эти нарушения. Полученные данные подчеркивают необходимость комплексной оценки факторов риска и индивидуализированного подхода к профилактике рецидивов ВТЭО в данной популяции пациентов.
Ключевые слова
Для цитирования:
Григорьева К.Н., Бицадзе В.О., Воробьев А.В., Солопова А.Г., Хизроева Д.Х., Якубов А.З., Унгиадзе Д.Ю., Калашникова И.С., Уткин Д.О., Блинов Д.В., Гри Ж., Элалами И., Геротзиафас Г., Макацария A.Д. К вопросу о рецидивирующих тромбозах у онкологических больных. Акушерство, Гинекология и Репродукция. 2025;19(4):514-523. https://doi.org/10.17749/2313-7347/ob.gyn.rep.2025.667
For citation:
Grigoreva K.N., Bitsadze V.O., Vorobev A.V., Solopova A.G., Khizroeva J.Kh., Iakubov A.Z., Ungiadze J.Yu., Kalashnikova I.S., Utkin D.O., Blinov D.V., Gris J., Elalamy I., Gerotziafas G., Makatsariya A.D. On the issue of recurrent thrombosis in cancer patients. Obstetrics, Gynecology and Reproduction. 2025;19(4):514-523. (In Russ.) https://doi.org/10.17749/2313-7347/ob.gyn.rep.2025.667
Введение / Introduction
Венозные тромбоэмболические осложнения (ВТЭО) остаются одной из ведущих причин заболеваемости и смертности у онкологических больных. По данным различных исследований, тромбозы венозного русла встречаются у 10–20 % пациентов со злокачественными новообразованиями (ЗНО) и значительно ухудшают прогноз заболевания, снижая как общую, так и безрецидивную выживаемость [1–3]. Эти осложнения особенно актуальны при злокачественных опухолях женской репродуктивной системы, характеризующихся высокой тромбогенностью и частым вовлечением сосудистого эндотелия в патологический процесс [4][5].
Несмотря на внедрение профилактических стратегий, направленных на снижение тромботического риска у онкологических пациентов, частота рецидивирующих ВТЭО остается высокой, достигая, по данным ряда авторов, 20–30 % даже на фоне антикоагулянтной терапии [6][7]. Рецидивы тромбозов не только ухудшают качество жизни больных и препятствуют проведению противоопухолевого лечения, но и повышают риск фатальных осложнений, таких как тромбоэмболия легочной артерии (ТЭЛА).
До настоящего времени вопросы частоты, клинических особенностей и факторов риска рецидивирующих ВТЭО у онкогинекологических пациенток остаются предметом обсуждения. Особое значение придается таким потенциальным триггерам рецидивов, как врожденные формы тромбофилии (мутации FV Leiden, протромбина G20210A и др.), приобретенные тромбофилии (циркуляция антифосфолипидных антител – АФА), а также феномен тромбовоспаления, отражающий эндотелиальную дисфункцию и системный воспалительный ответ на опухолевый процесс и сопутствующие инфекции. Недостаточно изучено влияние этих механизмов в зависимости от нозологической формы опухоли, стадии заболевания и таких факторов, как сопутствующая инфекция (в частности, COVID-19), дополнительно усиливающая эндотелиальное повреждение и гиперкоагуляцию.
Цель: выявить ключевые патогенетические факторы и триггеры, ассоциированные с рецидивирующими ВТЭО у онкогинекологических пациенток.
Материалы и методы / Materials and Methods
Дизайн исследования / Study design
Проведено ретроспективное когортное исследование, направленное на изучение факторов риска и триггеров рецидивирующих ВТЭО у онкогинекологических пациенток. В исследование включены 3 независимые группы пациенток, отобранных из общей когорты женщин с ЗНО органов репродуктивной системы, которые наблюдались в Онкологическом центре № 1 ГБУЗ ГКБ им. С.С. Юдина ДЗМ.
Критерии включения и исключения / Inclusion and exclusion criteria
Критерии включения: женщины старше 18 лет с гистологически подтвержденными ЗНО органов репродуктивной системы – рак яичников (РЯ), рак шейки матки (РШМ), рак тела матки (РТМ) и рак вульвы (РВ); наличие документированного эпизода венозного тромбоза – тромбоза глубоких вен (ТГВ), ТЭЛА или тромбоза редкой локализации в анамнезе или в процессе лечения; наличие информированного согласия на использование клинических данных, отсутствие письменного отказа от обработки медицинской информации.
Критерии исключения: отсутствие документального подтверждения тромбоза (неверифицированные эпизоды); пациентки с неполными данными медицинской документации, не позволяющими оценить наличие рецидивов.
Группы пациенток / Patient groups
В исследование включены 3 независимые группы онкогинекологических пациенток, у которых изучались причины и триггеры рецидивирующих ВТЭО.
Группа I: 155 пациенток с различными формами злокачественных опухолей (РЯ, РШМ, РТМ, РВ), у которых в анамнезе были зарегистрированы эпизоды тромбозов различной локализации, включая рецидивирующие.
Группа II: 66 пациенток с РЯ III–IV стадии, у которых в процессе противоопухолевого лечения были рецидивирующие эпизоды ВТЭО.
Группа III: 72 пациентки со злокачественными опухолями женских половых органов, перенесшие инфекцию COVID-19 в период противоопухолевого лечения.
В составе группы I наибольшую долю пациенток составили женщины с РЯ – 65 (41,9 %) и РТМ – 50 (32,3 %), пациенток с РШМ было 35 (22,6 %) и только 5 (3,2 %) с РВ. Среди пациенток с РЯ акушерские тромбоэмболические осложнения в анамнезе были отмечены у 29 (44,6 %), эпизоды ТГВ – у 20 (30,8 %), ТЭЛА – у 5 (7,7 %) и тромбозы атипичных локализаций – у 8 (12,3 %). У пациенток с РТМ акушерские ВТЭО встречались у 22 (44,0 %), ТГВ – у 18 (36,0 %), ТЭЛА – у 5 (10,0 %) и тромбозы атипичных локализаций – у 5 (10,0 %). В группе больных РШМ акушерские ВТЭО зафиксированы у 17 (48,6 %), ТГВ – у 13 (37,1 %), ТЭЛА – у 4 (11,4 %) и тромбозы атипичных локализаций – у 4 (11,4 %). Среди женщин с РВ акушерские ВТЭО выявлены у 3 (60,0 %), ТГВ – у 2 (40,0 %), ТЭЛА и тромбозы атипичных локализаций не зарегистрированы.
В состав группы II вошли 66 пациенток с РЯ III–IV стадии, у которых в процессе противоопухолевого лечения развились рецидивирующие эпизоды ВТЭО. Все пациентки находились в стабильном клиническом состоянии, которое по Шкале оценки тяжести состояния (англ. Eastern Cooperative Oncology Group, ECOG) соответствовало 0–2 баллам. Преобладающим гистологическим типом опухоли была серозная аденокарцинома.
В группу III вошли 72 пациентки с онкогинекологическими ЗНО, перенесшие тяжелое течение COVID-19: с РЯ – 24 (33,3 %), с РТМ – 22 (30,6 %), с РШМ – 19 (26,4 %) и с РВ – 7 (9,7 %).
Методы исследования / Study methods
У всех пациенток проводилось комплексное лабораторное обследование с оценкой показателей системы гемостаза. В качестве маркера гиперкоагуляционного состояния и эндотелиальной дисфункции анализировали содержание D-димера, фактора фон Виллебранда (англ. von Willebrand factor, vWF) и металлопротеазы ADАMTS-13 (англ. a disintegrin and metalloprotease with thrombospondin type 1 motif, member 13) методом иммуноферментного анализа (ИФА, ELISA) с использованием наборов TECHNOZYM® (Technoclone, Австрия). Измерение уровня АФА классов IgG и IgM к β2-гликопротеину-1 (β2-GP1), аннексину V и протромбину (порог положительного результата > 10 МЕ/мл для IgG и > 7 МЕ/мл для IgM) осуществляли методом ИФА с использованием тест-систем Orgentec Diagnostica GmbH (Германия) и генотипирование методом полимеразной цепной реакции (ПЦР) мутаций FV Leiden, MTHFR C677T, протромбина G20210A, полиморфизма ингибитора активатора плазминогена-1 (англ. plasminogen activator inhibitor-1, PAI-1) G4/G5 и тромбоцитарных гликопротеинов (GPIIb/IIIa, GPIa/IIa, GPIb, GP ADP) с наборами реагентов (ООО «НПФ Литех», Россия) на амплификаторах C1000™ Thermal Cycler (Bio-Rad, США).
Статистический анализ / Statistical analysis
Категориальные переменные, такие как частота тромбозов и распространенность маркеров тромбофилии, представлены в виде абсолютных значений (n) и процентов (%), межквартильный интервал (IQR) рассчитан для показателей эндотелиальной дисфункции. Сравнение количественных показателей между группами проводили с использованием непараметрического критерия Манна–Уитни. Двусторонний уровень значимости считался достигнутым при p < 0,05. Данные пациенток вносились в электронную таблицу Microsoft Office Excel 2013 (Microsoft, США), все статистические вычисления выполнены с применением программного пакета Statistica 10 (StatSoft Inc., США).
Результаты / Results
Рецидивирующие ВТЭО у онкогинекологических пациенток формировались на фоне сочетания врожденных и приобретенных тромбофилических состояний, эндотелиальной дисфункции и тромбовоспалительных механизмов, усугубляемых сопутствующими инфекциями. Клинико-анамнестическая характеристика пациенток представлена в таблице 1.
Таблица 1. Клинико-анамнестическая характеристика пациенток.
Table 1. Clinical and anamnestic characteristics of patients.
|
Показатель Parameter |
Группа I / Group I n = 155 |
Группа II / Group II n = 66 |
Группа III / Group III n = 72 |
|
Возраст, лет, М ± σ / Age, years, М ± σ |
56,0 ± 12,7 |
59,0 ± 9,2 |
57,0 ± 7,55 |
|
Локализация опухоли, n (%) / Tumor localization, n (%): рак яичников / оvarian cancer рак тела матки / uterine body cancer рак шейки матки / сervical cancer рак вульвы / vulvar cancer |
65 (41,9) 50 (32,3) 35 (22,6) 5 (3,2) |
66 (100,0) – – – |
24 (33,3) 22 (30,6) 19 (26,4) 7 (9,7) |
|
Стадия опухолевого процесса, n (%) / Tumor stage, n (%): II стадия / stage II III стадия / stage III IV стадия / stage IV |
42 (27,1) 83 (53,5) 30 (19,4) |
– 31 (47,0) 35 (53,0) |
18 (25,0) 37 (51,4) 17 (23,6) |
В группе I, включавшей 155 пациенток с эпизодами тромбозов в анамнезе, наибольшая частота рецидивирующих ВТЭО наблюдалась у женщин с РЯ (n = 65; 41,9 %) и РТМ (n = 50; 32,3 %), доля пациенток с РШМ – 35 (22,6 %) и с РВ – 5 (3,2 %). Генетические формы тромбофилии были выявлены у 145 (93,6 %) пациенток, причем у 64 (41,3 %) из них в гомозиготной форме и у 113 (72,9 %) в виде мультигенных вариантов. Наиболее распространенными мутациями были FV Leiden – у 32 (20,6 %), мутация протромбина G20210A – у 26 (16,8 %), полиморфизм MTHFR C677T – у 64 (41,3 %) в гомозиготной форме и у 81 (52,3 %) в гетерозиготной. Полиморфизм PAI-1 4G/5G был обнаружен у 44 (28,4 %) пациенток, а различные варианты тромбоцитарных гликопротеинов (GPIIb/IIIa, GPIa/IIa, GPIb, GP ADP) – у 69 (44,5 %). Приобретенные формы тромбофилии, включающие циркулирующие АФА, определялись у 87 (55,8 %) пациенток: антитела к β2-GP1 – у 87 (55,8 %), к протромбину – у 61 (39,5 %), к аннексину V – у 18 (11,6 %). Сочетанные формы тромбофилии, отражающие наличие одновременно как генетических, так и приобретенных нарушений гемостаза, были зарегистрированы у 87 (55,8 %) пациенток (рис. 1).
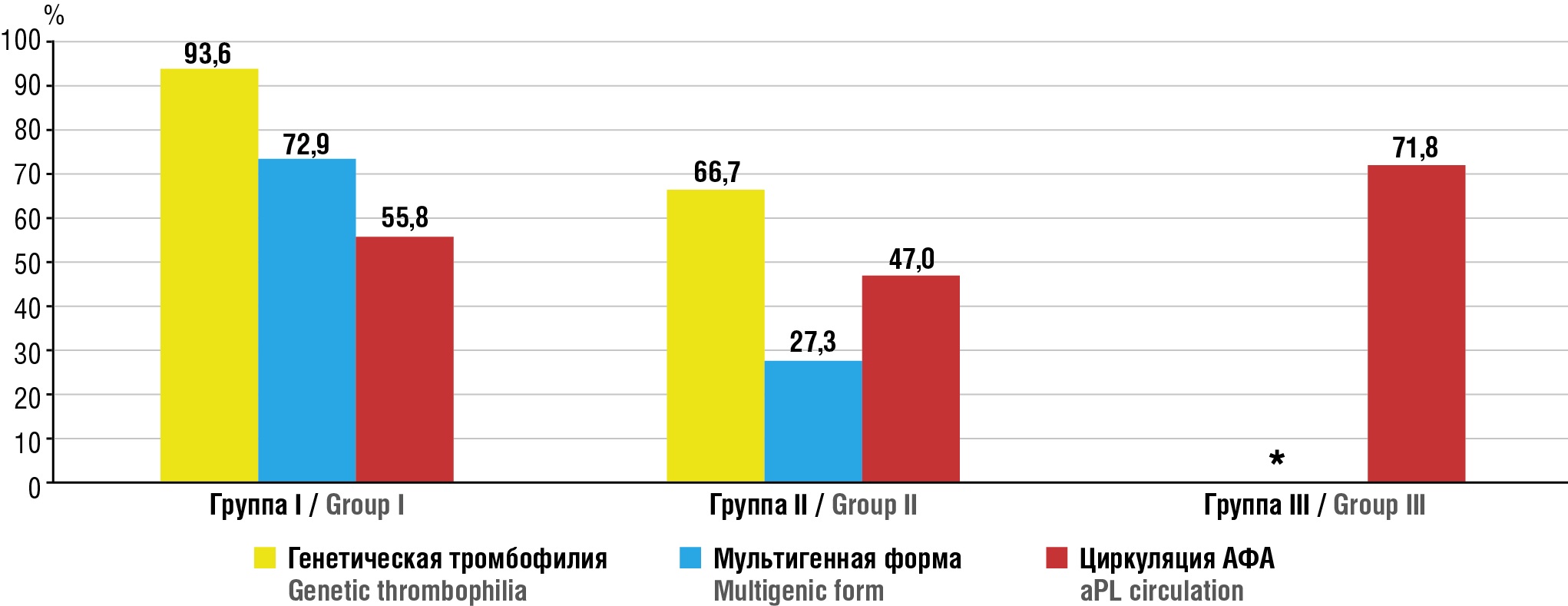
Рисунок 1. Частота генетической и приобретенной тромбофилии.
Примечание: * – анализ на наличие генетических форм тромбофилии не проводился; АФА – антифосфолипидные антитела.
Figure 1. Frequency of genetic and acquired thrombophilia.
Note: * – analysis to assess genetic forms of thrombophilia not performed; aPL – antiphospholipid antibodies.
В группе II, включавшей 66 пациенток с рецидивирующими тромбозами с РЯ III–IV стадии, основными предикторами повторных эпизодов ВТЭО явились как врожденные, так и приобретенные тромбофилии, а также выраженные признаки тромбовоспалительного синдрома и эндотелиальной дисфункции. Генетические формы тромбофилии были выявлены у 44 (66,7 %) пациенток, среди которых мутация FV Leiden регистрировалась у 27 (40,9 %), протромбина G20210A – у 15 (22,7 %), полиморфизм MTHFR C677T (включая гомо- и гетерозиготные варианты) – у 34 (51,5 %), полиморфизм PAI-1 4G/5G – у 28 (42,4 %), а полиморфизмы тромбоцитарных гликопротеинов – у 30 (45,5 %). Приобретенные формы тромбофилии выявлены у 31 (47,0 %) пациентки, при этом у 14 (21,2 %) из них отмечались высокие титры АФА (более 20 МЕ/мл). Среди приобретенных маркеров наиболее часто определялись антитела к β2-GP1 – у 25 (37,9 %) и антитела к протромбину – у 19 (28,8 %). У большинства пациенток с рецидивирующими ВТЭО были выявлены биохимические признаки эндотелиальной дисфункции и активации тромбовоспалительного каскада. Уровень vWF у этих пациенток составил в среднем 1513 (IQR [ 1126–2114]) МЕ/л при референсных значениях 500–1500 МЕ/л, что превышало норму у 41 (62,1 %) пациентки. Средний уровень ADAMTS-13 был 1337 [ 1154–1761] МЕ/л, оставаясь в пределах нормы (> 400 МЕ/л). У 48 (72,7 %) женщин уровень D-димера превышал 1500 нг/мл (медиана 2700 [ 2560–2840] нг/мл). Эти данные подтверждают ключевую роль нарушений оси vWF/ADAMTS-13 и активации тромбовоспалительного синдрома в формировании рецидивирующих тромбозов у пациенток с РЯ III–IV стадии. Таким образом, данные лабораторного обследования подтверждают, что у пациенток группы II рецидивирующие эпизоды ВТЭО ассоциировались с наличием выраженных признаков эндотелиальной дисфункции (гиперэкспрессия vWF, относительное снижение ADAMTS-13) и активацией тромбовоспалительного каскада (значительное повышение D-димера), что свидетельствует о роли этих нарушений как потенциальных триггеров рецидивов.
В группе III, состоявшей из 72 пациенток с онкогинекологическими опухолями и перенесенной коронавирусной инфекцией, рецидивирующие эпизоды ВТЭО зарегистрированы у 39 (54,2 %) пациенток. Наибольшая частота рецидивов отмечена у пациенток с РЯ – у 16 из 24 (66,7 %) и с РТМ – у 13 из 22 (59,1 %), в то время как у пациенток с РШМ и РВ рецидивы встречались реже – у 7 из 19 (36,8 %) и у 3 из 7 (42,9 %) соответственно. Все 39 пациенток с рецидивами демонстрировали выраженные признаки тромбовоспалительного синдрома: уровень vWF в среднем составил 3450 (IQR [ 3120–3770]) МЕ/л, что значительно превышает норму (500–1500 МЕ/л). Уровень ADAMTS-13 у этих пациенток был достоверно снижен и составил 220 (IQR [ 180–290]) МЕ/л при норме > 400 МЕ/л. Концентрация D-димера у пациенток с рецидивами превышала 1500 нг/мл у 33 (84,6 %) женщин, медианное значение – 2900 (IQR [ 2600–3300]) нг/мл, что более чем в 2 раза превышает норму. АФА были выявлены у 28 из 39 (71,8 %) пациенток с рецидивами: антитела к β2-GP1 – у 21 (53,8 %), к протромбину – у 17 (43,6 %), к аннексину V – у 10 (25,6 %). Эти данные подтверждают значительное вовлечение приобретенных иммунных механизмов в патогенез рецидивирующих тромбозов на фоне перенесенной коронавирусной инфекции. Риск рецидивов ВТЭО у пациенток, перенесших COVID-19, был выше на 70 % по сравнению с пациентками без COVID-19 (относительный риск (OР) = 1,7; 95 % доверительный интервал (ДИ) = 1,1–2,8).
Обсуждение / Discussion
Полученные данные позволяют расширить представления о патогенезе рецидивирующих ВТЭО у онкогинекологических пациенток. Наша работа подтвердила ключевую роль врожденных и приобретенных тромбофилических состояний, эндотелиальной дисфункции и тромбовоспалительных механизмов, которые в совокупности создают крайне высокий риск рецидивов.
Генетические тромбофилии встречались у подавляющего большинства обследованных женщин: в группе I – у 93,6 %, в группе II – у 66,7 %. Чаще всего диагностировались мутации FV Leiden и MTHFR C677T, а также полиморфизмы PAI-1 и тромбоцитарных гликопротеинов. Эти данные перекликаются с результатами других исследований, где носительство FV Leiden и других мутаций было ассоциировано с ВТЭО [8–10]. В исследованиях W.M. Lijfering с соавт. (2010) [11] и А. Marchiori с соавт. (2007) [12] наличие мутаций FV Leiden или протромбина G20210A увеличивало риск рецидивов ВТЭО более чем в 2 раза, что согласуется с нашим наблюдением увеличенной частоты этих мутаций у женщин с повторными тромбозами. Отдельно следует подчеркнуть высокую распространенность мультигенных вариантов тромбофилии (72,9 % в группе I), поскольку ранее R.Y. Zee с соавт. [13] и Р. Ivanov с соавт. [14] показали, что комбинация полиморфизмов повышает риск рецидивов более чем в 3 раза по сравнению с изолированными дефектами.
Приобретенные тромбофилии, в частности циркуляция АФА, выявлялись в нашей когорте с высокой частотой: в группе I – в 55,8 %, в группе II – в 47,0 %. Эти показатели превышают данные исследования А.В. Dicks с соавт. (2024), в котором средняя частота циркулирующих АФА у онкологических больных составляла 28–35 % [15]. Наличие высоких титров АФА в нашем исследовании (21,2 % в группе II) также подтверждает роль приобретенных механизмов в формировании тромбозов и согласуется с выводами J.S. Knight и Y. Kanthi (2022), описавших их как характерную особенность пациентов с тяжелым течением ВТЭО [16].
Отдельный интерес представляют показатели оси vWF/ADAMTS-13 как маркера эндотелиальной дисфункции. В нашем исследовании медианный уровень vWF у женщин с рецидивами ВТЭО в группе II достигал 1513 МЕ/л при норме < 1500 МЕ/л. Эти данные важны, поскольку, как показали G.C. Poolen с соавт. (2024), смещение соотношения vWF/ADAMTS-13 в пользу vWF значительно увеличивает риск рецидивов ВТЭО [17].
Важной особенностью нашего исследования стало выделение пациенток с перенесенным COVID-19 (группа III), где частота рецидивов ВТЭО достигала 54,2 %. Это выше, чем данные крупного регистра L. Jara-Palomares с соавт. (2024), где частота ВТЭО у онкологических пациентов с COVID-19 составила 34 % [18], и в целом, согласуется с данными Р. Demelo-Rodriguez с соавт. (2023), которые также отмечали значение тромбовоспаления при COVID-19 как триггера тромбозов, в том числе рецидивирующих [19]. В нашей выборке медианный уровень vWF превышал 3400 МЕ/л, значения ADAMTS-13 снижались до 220 МЕ/л, что подтверждает тяжелую эндотелиальную дисфункцию на фоне вирус-индуцированного воспаления. Эти результаты подчеркивают, что COVID-19 усиливает приобретенные механизмы тромбовоспаления у онкогинекологических больных, создавая предпосылки для рецидивов ВТЭО [20][21].
Проведенное нами исследование позволяет говорить о том, что у онкогинекологических пациенток может формироваться уникальный патогенетический фенотип, включающий сочетание врожденных и приобретенных форм тромбофилии, эндотелиальной дисфункции, активации тромбовоспалительного синдрома и иммунных нарушений, что требует особого внимания к оценке риска рецидивов и индивидуализации антикоагулянтной профилактики.
Заключение / Conclusion
Проведенное исследование показало, что рецидивирующие ВТЭО у онкогинекологических пациенток формируются на фоне комплексного взаимодействия врожденных и приобретенных тромбофилических состояний, эндотелиальной дисфункции и активации тромбовоспалительных механизмов. Наиболее значимыми врожденными предикторами рецидивов являются мутации FV Leiden, протромбина G20210A, MTHFR C677T, полиморфизмы PAI-1 и тромбоцитарных гликопротеинов. Существенный вклад вносят также приобретенные формы тромбофилии, в частности, циркуляция АФА, а также нарушения соотношения vWF/ADAMTS-13 как маркера эндотелиальной дисфункции. Отдельную группу высокого риска составляют пациентки с перенесенной коронавирусной инфекцией, у которых выявлено более выраженное тромбовоспалительное состояние и более высокая частота иммунных нарушений. Полученные данные подтверждают необходимость комплексной оценки врожденных и приобретенных факторов риска при стратификации риска рецидивов ВТЭО у онкогинекологических больных и подчеркивают целесообразность индивидуализации антикоагулянтной профилактики в данной группе больных.
Список литературы
1. Khorana A.A., Connolly G.C. Assessing risk of venous thromboembolism in the patient with cancer. J Clin Oncol. 2009;27(29):4839–47. https://doi.org/10.1200/JCO.2009.22.3271.
2. Sørensen H.T., Pedersen L., van Es N. et al. Impact of venous thromboembolism on the mortality in patients with cancer: a population-based cohort study. Lancet Reg Health Eur. 2023;34:100739. https://doi.org/10.1016/j.lanepe.2023.100739.
3. Bertoletti L., Madridano O., Jiménez D. et al. Cancer-associated thrombosis: trends in clinical features, treatment, and outcomes from 2001 to 2020. JACC Cardio Oncol. 2023;5(6):758–72. https://doi.org/10.1016/j.jaccao.2023.09.003.
4. Abu Saadeh F., Norris L., O'Toole S., Gleeson N. Venous thromboembolism in ovarian cancer: incidence, risk factors and impact on survival. Eur J Obstet Gynecol Reprod Biol. 2013;170(1):214–8. https://doi.org/10.1016/j.ejogrb.2013.06.004.
5. Trugilho I.A., Renni M.J.P., Medeiros G.C. et al. Incidence and factors associated with venous thromboembolism in women with gynecologic cancer. Thromb Res. 2020;185:49–54. https://doi.org/10.1016/j.thromres.2019.11.009.
6. Lanting V.R., Takada T., Bosch F.T.M. et al. Risk of recurrent venous thromboembolism in patients with cancer: an individual patient data meta-analysis and development of a prediction model. Thromb Haemost. 2025;125(6):589–96. https://doi.org/10.1055/a-2418-3960.
7. van Hylckama Vlieg M.A.M., Nasserinejad K., Visser C. et al. The risk of recurrent venous thromboembolism after discontinuation of anticoagulant therapy in patients with cancer-associated thrombosis: a systematic review and meta-analysis. EClinicalMedicine. 2023;64:102194. https://doi.org/10.1016/j.eclinm.2023.102194.
8. Цветовская Г.А., Чикова Е.Д., Лифшиц Г.И. Генетические факторы риска тромбофилии у женщин репродуктивного возраста в Западно-Сибирском регионе. Фундаментальные исследования. 2010;(10):72–9.
9. Hamidpour M., Ghorbani M., Rezaei-Tavirani M. et al. Factor V Leiden, MTHFR C677T and prothrombin gene mutation G20210A in Iranian patients with venous thrombosis. IJBC. 2019;11(3):91–5.
10. Costa J., Araújo A. The contribution of inherited thrombophilia to venous thromboembolism in cancer patients. Clin Appl Thromb Hemost. 2024;30:10760296241232864. https://doi.org/10.1177/10760296241232864.
11. Lijfering W.M., Middeldorp S., Veeger N.J. et al. Risk of recurrent venous thrombosis in homozygous carriers and double heterozygous carriers of factor V Leiden and prothrombin G20210A. Circulation. 2010;121(15):1706–12. https://doi.org/10.1161/ CIRCULATIONAHA.109.906347.
12. Marchiori A., Mosena L., Prins M.H., Prandoni P. The risk of recurrent venous thromboembolism among heterozygous carriers of factor V Leiden or prothrombin G20210A mutation. A systematic review of prospective studies. Haematologica. 2007;92(8):1107–14. https://doi.org/10.3324/haematol.10234.
13. Zee R.Y., Bubes V., Shrivastava S. et al. Genetic risk factors in recurrent venous thromboembolism: A multilocus, population-based, prospective approach. Clin Chim Acta. 2009;402(1–2):189–92. https://doi.org/10.1016/j.cca.2009.01.011.
14. Ivanov P., Komsa-Penkova R., Kovacheva K. et al. Impact of thrombophilic genetic factors on pulmonary embolism: early onset and recurrent incidences. Lung. 2008;186(1):27–36. https://doi.org/10.1007/s00408-007-9061-7.
15. Dicks A.B., Moussallem E., Stanbro M. et al. A comprehensive review of risk factors and thrombophilia evaluation in venous thromboembolism. J Clin Med. 2024;13(2):362. https://doi.org/10.3390/jcm13020362.
16. Knight J.S., Kanthi Y. Mechanisms of immunothrombosis and vasculopathy in antiphospholipid syndrome. Semin Immunopathol. 2022;44(3):347–62. https://doi.org/10.1007/s00281-022-00916-w.
17. Poolen G.C., Urbanus R.T., Roest M. et al. Elevated levels of (active) von Willebrand factor during anticoagulation are associated with early recurrence of venous thromboembolism. J Thromb Haemost. 2025 May 13:S1538-7836(25)00313-7. https://doi.org/10.1016/j.jtha.2025.04.030.
18. Jara-Palomares L., Bikdeli B., Jiménez D. et al.; RIETE Investigators. Risk of recurrence after discontinuing anticoagulation in patients with COVID-19-associated venous thromboembolism: a prospective multicentre cohort study. EClinicalMedicine. 2024;73:102659. https://doi.org/10.1016/j.eclinm.2024.102659.
19. Demelo-Rodriguez P., Alonso-Beato R., Jara-Palomares L. et al.; RIETE Investigators. COVID-19-associated venous thromboembolism: risk of recurrence and major bleeding. Res Pract Thromb Haemost. 2023;7(7):102206. https://doi.org/10.1016/j.rpth.2023.102206.
20. Макацария А.Д. COVID-19 и системные тромботические синдромы. Акушерство, Гинекология и Репродукция. 2024;18(6):908–18. https://doi.org/10.17749/2313-7347/ob.gyn.rep.2024.590.
21. Воробьев А.В., Эйнуллаева С.Э., Бородулин А.С. и др. Влияние COVID-19 на тромботические осложнения у онкологических больных. Акушерство, Гинекология и Репродукция. 2024;18(3):286–99. https://doi.org/10.17749/2313-7347/ob.gyn.rep.2024.519.
Об авторах
К. Н. ГригорьеваRussian Federation
Григорьева Кристина Николаевна - к.м.н.
119048 Москва, Трубецкая ул., д. 8, стр. 2
В. О. Бицадзе
Russian Federation
Бицадзе Виктория Омаровна - д.м.н., проф., профессор РАН.
119048 Москва, Трубецкая ул., д. 8, стр. 2
Scopus Author ID 6506003478, WoS ResearcherID F-8409-2017
А. В. Воробьев
Russian Federation
Воробьев Александр Викторович - к.м.н.
119048 Москва, Трубецкая ул., д. 8, стр. 2
Scopus Author ID 59454666500, Wos ResearcherID F-8804-2017
А. Г. Солопова
Russian Federation
Солопова Антонина Григорьевна - д.м.н., проф.
119048 Москва, Трубецкая ул., д. 8, стр. 2
Scopus Author ID 6505479504, WoS ResearcherID Q-1385-2015
Д. Х. Хизроева
Russian Federation
Хизроева Джамиля Хизриевна - д.м.н., проф.
119048 Москва, Трубецкая ул., д. 8, стр. 2
Scopus Author ID 57194547147, WoS ResearcherID F-8384-2017
А. З. Якубов
Russian Federation
Якубов Амрам Заурович.
119048 Москва, Трубецкая ул., д. 8, стр. 2
Д. Ю. Унгиадзе
Georgia
Унгиадзе Джумбер Юрьевич - д.м.н., проф.
6010 Батуми, ул. Ниношвили, д. 35
И. С. Калашникова
Russian Federation
Калашникова Ирина Сергеевна - к.м.н.
119048 Москва, Трубецкая ул., д. 8, стр. 2
Д. О. Уткин
Russian Federation
Уткин Дмитрий Олегович - к.м.н.
115446 Москва, Коломенский проезд, д. 4
Д. В. Блинов
Russian Federation
Блинов Дмитрий Владиславович - к.м.н.
101000 Москва, Лялин переулок, д. 11–13/1; 123056 Москва, 2-я Брестская ул., д. 5, с. 1–1а; Московская область, деревня Голубое, ул. Родниковая, стр. 6, к. 1
Scopus Author ID 6701744871, WoS ResearcherID E-8906-2017
Ж.-К. Гри
Russian Federation
Гри Жан-Кристоф - д.м.н., проф.
119048 Москва, Трубецкая ул., д. 8, стр. 2; Франция, 34090 Монпелье, ул. Огюста Бруссоне, д. 163
Scopus Author ID 7005114260, WoS ResearcherID AAA-2923-2019
И. Элалами
Russian Federation
Элалами Исмаил - д.м.н., проф.
119048 Москва, Трубецкая ул., д. 8, стр. 2; Франция, 75006 Париж, Улица медицинского факультета, д. 12; Франция, 75020 Париж, Китайская улица, д. 4
Scopus Author ID 7003652413, WoS ResearcherID AAC-9695-2019
Г. Геротзиафас
Russian Federation
Геротзиафас Григориос - д.м.н., проф.
119048 Москва, Трубецкая ул., д. 8, стр. 2; Франция, 75006 Париж, Улица медицинского факультета, д. 12; Франция, 75020 Париж, Китайская улица, д. 4
A. Д. Макацария
Russian Federation
Макацария Александр Давидович - д.м.н., проф., академик РАН.
119048 Москва, Трубецкая ул., д. 8, стр. 2
Scopus Author ID 57222220144, WoS ResearcherID M-5660-2016
Что уже известно об этой теме?
► Онкогинекологические пациентки имеют высокий риск венозных тромбоэмболических осложнений (ВТЭО) из-за сочетания злокачественного процесса и агрессивного противоопухолевого лечения.
► Врожденные тромбофилии, такие как мутации FV Leiden и протромбина G20210A, ассоциированы с повышенным риском тромбозов.
► Циркуляция антифосфолипидных антител (АФА) часто выявляется у онкологических пациентов и способствует рецидивам ВТЭО.
Что нового дает статья?
► Установлена высокая частота мультигенной и сочетанной тромбофилии как предиктора рецидивирующих ВТЭО у онкогинекологических пациенток.
► Показана значимость нарушений оси vWF/ADAMTS-13 как маркера эндотелиальной дисфункции при рецидивирующих тромбозах.
► Обоснована необходимость комплексной оценки врожденных, приобретенных и воспалительных факторов для стратификации риска рецидивов ВТЭО.
Как это может повлиять на клиническую практику в обозримом будущем?
► В практику может быть внедрен мониторинг показателей vWF и ADAMTS-13 для оценки риска рецидивов ВТЭО и коррекции антикоагулянтной терапии.
► Планирование профилактики ВТЭО у онкогинекологических больных будет учитывать наличие генетической тромбофилии, а также АФА и их титр, что позволит индивидуализировать длительность и интенсивность терапии.
► У пациенток, перенесших COVID-19, могут быть применены более агрессивные стратегии антикоагулянтной профилактики с учетом повышенного риска рецидивов ВТЭО.
Рецензия
Для цитирования:
Григорьева К.Н., Бицадзе В.О., Воробьев А.В., Солопова А.Г., Хизроева Д.Х., Якубов А.З., Унгиадзе Д.Ю., Калашникова И.С., Уткин Д.О., Блинов Д.В., Гри Ж., Элалами И., Геротзиафас Г., Макацария A.Д. К вопросу о рецидивирующих тромбозах у онкологических больных. Акушерство, Гинекология и Репродукция. 2025;19(4):514-523. https://doi.org/10.17749/2313-7347/ob.gyn.rep.2025.667
For citation:
Grigoreva K.N., Bitsadze V.O., Vorobev A.V., Solopova A.G., Khizroeva J.Kh., Iakubov A.Z., Ungiadze J.Yu., Kalashnikova I.S., Utkin D.O., Blinov D.V., Gris J., Elalamy I., Gerotziafas G., Makatsariya A.D. On the issue of recurrent thrombosis in cancer patients. Obstetrics, Gynecology and Reproduction. 2025;19(4):514-523. (In Russ.) https://doi.org/10.17749/2313-7347/ob.gyn.rep.2025.667
JATS XML

Контент доступен под лицензией Creative Commons Attribution-NonCommercial-ShareAlike 4.0 International License.










































