Перейти к:
Прогностическая роль оси vWF/ADAMTS-13 в стратификации риска тромбозов у онкогинекологических больных
https://doi.org/10.17749/2313-7347/ob.gyn.rep.2025.664
Аннотация
Цель: оценить прогностическую значимость соотношения vWF/ADAMTS-13 (англ. von Willebrand factor/a disintegrin and metalloprotease with thrombospondin type 1 motif, member 13) как интегрального биомаркера для стратификации риска венозных тромбоэмболических осложнений и мониторинга эффективности профилактической антикоагулянтной терапии (АКТ) у онкогинекологических пациенток, получающих химиотерапию.
Материалы и методы. В проспективное когортное интервенционное сравнительное исследование включены 74 пациентки с раком яичников (РЯ) и аденокарциномой цервикального канала, проходящие химиотерапию, разделенные на группы в зависимости от наличия тромботических осложнений в анамнезе. Оценивались уровни vWF и металлопротеазы ADAMTS-13 и их соотношение, а также содержание D-димера. Лабораторные параметры анализировались до начала химиотерапии, после 1–2 курсов и на фоне профилактической АКТ. Использовались методы вариационной статистики, ROC-анализ и критерий Юдена для определения пороговых значений.
Результаты. У пациенток с тромботическим анамнезом до начала химиотерапии выявлены значительные нарушения показателей оси vWF/ADAMTS-13 по сравнению с контрольной группой: соотношение достигало 1,59–1,65 при уровне в контрольной группе 0,65 (p < 0,05). На фоне химиотерапии нарушения усугублялись (до 2,04 при РЯ), что сопровождалось ростом содержания D-димера. Назначение профилактической АКТ на основе низкомолекулярного гепарина приводило к нормализации значений оси vWF/ADAMTS-13 и снижению уровня D-димера, что отражало снижение протромботического потенциала. Частота тромботических осложнений на фоне антикоагулянтной профилактики была в 2 раза ниже, чем без профилактики (13 % против 25 %). ROC-анализ подтвердил высокую диагностическую значимость соотношения vWF/ADAMTS-13 (AUC = 0,87) с оптимальным пороговым значением ≥ 1,6 для выделения группы высокого риска.
Заключение. Соотношение vWF/ADAMTS-13 является чувствительным интегральным маркером гиперкоагуляционного состояния, позволяющим объективно стратифицировать риск тромботических осложнений и мониторировать эффективность антикоагулянтной профилактики у онкогинекологических пациенток, получающих химиотерапию. Его включение в клинические алгоритмы может повысить точность отбора пациенток для антикоагулянтной профилактики и способствует индивидуализации лечения.
Ключевые слова
Для цитирования:
Воробьев А.В., Бицадзе В.О., Солопова А.Г., Хизроева Д.Х., Уткин Д.О., Остриков Д.О., Блинов Д.В., Гри Ж., Элалами И., Геротзиафас Г., Макацария А.Д. Прогностическая роль оси vWF/ADAMTS-13 в стратификации риска тромбозов у онкогинекологических больных. Акушерство, Гинекология и Репродукция. 2025;19(4):476-487. https://doi.org/10.17749/2313-7347/ob.gyn.rep.2025.664
For citation:
Vorobev A.V., Bitsadze V.O., Solopova A.G., Khizroeva J.Kh., Utkin D.O., Ostrikov D.О., Blinov D.V., Gris J., Elalamy I., Gerotziafas G., Makatsariya A.D. Prognostic role of the vWF/ADAMTS-13 axis in thrombosis risk stratification in gynecologic oncology patients. Obstetrics, Gynecology and Reproduction. 2025;19(4):476-487. (In Russ.) https://doi.org/10.17749/2313-7347/ob.gyn.rep.2025.664
Введение / Introduction
Одним из ключевых направлений современной гемостазиологии является поиск маркеров, позволяющих объективно оценивать не только риск тромботических осложнений, но и степень активации эндотелиальной дисфункции, сопровождающей злокачественные новообразования (ЗНО). Фактор фон Виллебранда (англ. von Willebrand factor, vWF), синтезируемый эндотелием и мегакариоцитами, участвует в обеспечении адгезии тромбоцитов к повреждeнной сосудистой стенке и стабилизации циркулирующего фактора VIII, выступая одним из центральных медиаторов первичного гемостаза [1][2]. В то же время металлопротеаза ADAMTS-13 (англ. a disintegrin and metalloprotease with thrombospondin type 1 motif, member 13) регулирует активность vWF, расщепляя его ультра-большие мультимеры (англ. ultra-large vWF, UL-vWF) и тем самым предотвращая чрезмерную агрегацию тромбоцитов и формирование микротромбов [3][4].
Изменения содержания и активности этих молекул рассматриваются как отражение патологических сдвигов в системе гемостаза при ряде состояний, сопровождающихся активацией эндотелия и нарушением антикоагулянтных механизмов. У онкологических пациентов повышенный уровень vWF свидетельствует о выраженной эндотелиальной активации, тогда как снижение активности ADAMTS-13 может указывать на развитие воспалительно-индуцированной дисфункции регуляторного звена гемостаза [5–7]. В совокупности эти изменения способствуют усилению тромбогенного потенциала и могут быть ассоциированы с худшими клиническими исходами. Поэтому определение уровней vWF и ADAMTS-13 все чаще рассматривается как перспективный инструмент стратификации риска тромбозов и оценки эффективности проводимой антикоагулянтной терапии (АКТ) у пациентов с онкогинекологическими заболеваниями и другими протромботическими состояниями.
Показатель соотношения vWF и его регулятора ADAMTS-13 может рассматриваться как перспективный биомаркер тромботического риска у онкологических пациентов [8]. Такая роль обусловлена центральным значением этих молекул в поддержании физиологического гемостаза: в нормальных условиях эндотелиальные клетки высвобождают vWF в форме UL-vWF, обладающих высокой тромбогенной потенцией, которые затем протеолитически укорачиваются ADAMTS-13 до менее активных форм [9]. При дефиците или функциональной недостаточности ADAMTS-13 мультимеры vWF накапливаются, вызывая избыточную адгезию и агрегацию тромбоцитов и повышая риск тромботических событий [10]. В крайних случаях выраженное снижение активности ADAMTS-13 (ниже 10 % от нормы) приводит к развитию тромботической микроангиопатии (ТМА) с формированием клинической картины тромботической тромбоцитопенической пурпуры, представляющей собой тяжелое, потенциально жизнеугрожающее состояние [10].
Таким образом, соотношение vWF/ADAMTS-13 отражает состояние равновесия между прокоагулянтной активностью и механизмами, ограничивающими тромбообразование, и представляет собой информативный маркер нарушения гемостатического баланса [5][11]. Дисбаланс между этими компонентами сопровождается накоплением высокомолекулярных форм vWF при снижении активности ADAMTS-13 и избыточной тромбогенной активностью, ассоциированной с более неблагоприятными исходами, такими как рецидивирующие тромбозы, прогрессирование злокачественного процесса и повышение смертности. В свою очередь, сохранение активности ADAMTS-13 на адекватном уровне способствует ограничению агрегации тромбоцитов и связано с более благоприятным течением заболевания [12].
Цель: оценить прогностическую значимость соотношения vWF/ADAMTS-13 как интегрального биомаркера для стратификации риска венозных тромбоэмболических осложнений (ВТЭО) и мониторинга эффективности профилактической АКТ у онкогинекологических пациенток, получающих химиотерапию.
Материалы и методы / Materials and Methods
Дизайн исследования / Study design
Для анализа значения оси vWF/ADAMTS-13 проведено проспективное когортное интервенционное сравнительное исследование с участием 74 онкогинекологических пациенток с ЗНО репродуктивной системы, которым после хирургического лечения показана полихимиотерапия (ПХТ), и 25 здоровых женщин без онкологических заболеваний и нарушений гемостаза.
Критерии включения и исключения / Inclusion and exclusion criteria
Критерии включения: возраст 18 лет и старше; подтвержденный диагноз рака яичников (РЯ) или рака шейки матки (РШМ); потребность в ПХТ; добровольное информированное согласие пациентки на участие в исследовании.
Критерии исключения: тяжелый соматический статус, тромбоцитопения < 50×10⁹/л; активные кровотечения; септические осложнения; прогрессирование заболевания или отказ от ПХТ.
Группы пациенток / Patient groups
Пациентки были разделены на 3 группы: группу I (n = 34) составили женщины с эпизодами ВТЭО в анамнезе, из них 23 с РЯ, 11 – с аденокарциномой цервикального канала (РШМ). Группа II (n = 40) состояла из женщин без тромботических осложнений в анамнезе, из них 20 с РЯ и 20 с РШМ. Пациентки групп I и II были сопоставимы по возрасту, гинекологическому и акушерскому анамнезу, частоте экстрагенитальной патологии и стадиям заболевания. Контрольная группа (n = 25) была представлена здоровыми женщинами без онкологических заболеваний и нарушений гемостаза.
Все пациентки групп I и II получали ПХТ по стандартным схемам на основе препаратов платины, паклитаксела, гемцитабина. Больным группы I с высоким риском ВТЭО проводилась профилактическая АКТ низкомолекулярным гепарином (НМГ) – надропарином кальция в стандартной дозировке, корректируемой по массе тела и уровню тромбоцитов.
Методы исследования / Study methods
Лабораторные исследования включали определение уровней vWF и ADAMTS-13, расчет соотношения vWF/ADAMTS-13 и измерение содержания D-димера. Исследования проводились в 3 контрольных точках: до начала ПХТ; после 1–2 курсов ПХТ; на 2–3-е сутки после завершения очередного курса ПХТ и профилактической АКТ.
Определение уровней vWF (vWF:Ag), ADAMTS-13 (ADAMTS-13:Ag) и D-димера проводили методом иммуноферментного анализа (ИФА, ELISA) с использованием коммерческих наборов TECHNOZYM® (Technoclone, Австрия) и D-Dimer ELISA.
Статистический анализ / Statistical analysis
Данные пациенток вносились в электронную таблицу Microsoft Office Excel 2013 (Microsoft, США). Статистическая обработка результатов осуществлялась с помощью программы Statistica 10 (StatSoft Inc., США). Для описания количественных данных использовали абсолютные и относительные частоты (n, %), среднее арифметическое (M), стандартное отклонение (σ) и минимальное–максимальное значение (min–max). Для проверки статистической значимости факторов с учетом небольшого объема выборки использовали U-критерий Манна–Уитни с проверкой нормальности распределения по критерию Шапиро–Уилка; диагностическая эффективность соотношения vWF/ADAMTS-13 оценивалась с помощью анализа ROC-кривой с расчетом площади под кривой (англ. area under curve, AUC) и построением индекса Юдена для определения оптимального порогового значения показателя, обеспечивающего максимальный баланс чувствительности и специфичности; значение p ≤ 0,05 свидетельствовало о наличии статистически значимых различий, р > 0,05 – об отсутствии статистических различий.
Результаты / Results
До начала ПХТ у пациенток группы I были выявлены выраженные изменения показателей оси vWF/ADAMTS-13 по сравнению как с пациентками группы II, так и с контрольной группой (табл. 1). В группе I у пациенток с РЯ средний уровень ADAMTS-13 составил 1188 МЕ/л (803–1650 МЕ/л), уровень vWF был повышен, составляя в среднем 1892 МЕ/л (1239–2369 МЕ/л), а соотношение vWF/ADAMTS-13 достигало 1,59, что значимо (p < 0,05) превышало значения в группах II и контрольной. В группе II у пациенток с РЯ уровень ADAMTS-13 был выше, в среднем составляя 1402 МЕ/л (1201–1824 МЕ/л), vWF оставался в нормальных пределах – 1428 МЕ/л (902–1681 МЕ/л), соотношение составило 1,02. В контрольной группе средний уровень ADAMTS-13 составил 1572 МЕ/л (1397–2239 МЕ/л), vWF – 1014 МЕ/л (726–1486 МЕ/л), соотношение – 0,65.
Таблица 1. Лабораторные показатели в группах I и II до проведения полихимиотерапии и в контрольной группе.
Table 1. Laboratory parameters in group I and group II before polychemotherapy, and in control group.
|
Показатель Parameter |
Группа I / Group I |
Группа II / Group II |
Контрольная группа Control group |
Нормальные значения Normal values |
||
|
Пациентки с РЯ OC patients |
Пациентки с РШМ CC patients n = 11 |
Пациентки с РЯ OC patients |
Пациентки с РШМ CC patients n = 20 |
|||
|
ADAMTS-13, M min–max |
1188*# 803–1650 |
1317*# 1012–1723 |
1402# 1201–1824 |
1511 1257–2032 |
1572 1397–2239 |
> 400 МЕ/л > 400 IU/L |
|
vWF, M min–max |
1892*# 1239–2369 |
1763*# 1013–2092 |
1428# 902–1681# |
1272# 1087–1648# |
1014 726–1486 |
500–1500 МЕ/л 500–1500 IU/L |
|
vWF/ADAMTS-13 |
1,59*# |
1,34*# |
1,02# |
0,84# |
0,65 |
|
Примечание: *р < 0,05 – различия статистически значимы по сравнению с группой II; #р < 0,05 – различия статистически значимы по сравнению с контрольной группой; М – среднее арифметическое; РЯ – рак яичников; РШМ – рак шейки матки; vWF – фактор фон Виллебранда; ADAMTS-13 – металлопротеаза.
Note: *р < 0.05 – significant differences compared with group II; #р < 0.05 – significant differences compared with control group; М – arithmetic mean; OC – ovarian cancer; CC – cervical cancer; vWF – von Willebrand factor; ADAMTS-13 – metalloprotease.
У пациенток с РШМ в группе I уровень ADAMTS-13 был в среднем 1317 МЕ/л (1012-1723 МЕ/л), vWF – 1763 МЕ/л (1013–2092 МЕ/л), соотношение – 1,34, что также значимо (p < 0,05) превышало значения групп II и контрольной. У пациенток с РШМ в группе II уровень ADAMTS-13 составлял 1511 МЕ/л (1257–2032 МЕ/л), vWF – 1272 МЕ/л (1087–1648 МЕ/л), соотношение – 0,84.
Проведение ПХТ сопровождалось усугублением дисбаланса между vWF и ADAMTS-13, наиболее выраженным у пациенток группы I. После 1–2 курсов ПХТ у пациенток с РЯ уровень ADAMTS-13 снижался в среднем до 943 МЕ/л (756–1532 МЕ/л), уровень vWF повышался до 1923 МЕ/л (1321–2517 МЕ/л), соотношение vWF/ADAMTS-13 увеличивалось до 2,04, что отражало прогрессирующую эндотелиальную дисфункцию и гиперкоагуляцию. В группе II у пациенток с РЯ изменения были менее выражены: ADAMTS-13 – 1337 МЕ/л (1154–1761 МЕ/л), vWF – 1513 МЕ/л (1126–2114 МЕ/л), соотношение – 1,13 (табл. 2).
Таблица 2. Лабораторные показатели в группах I и II на фоне проведения полихимиотерапии и в контрольной группе.
Table 2. Laboratory parameters in group I and group II during polychemotherapy, and in control group.
|
Показатель Parameter |
Группа I / Group I |
Группа II / Group II |
Контрольная группа Control group |
Нормальные значения Normal values |
||
|
Пациентки с РЯ OC patients |
Пациентки с РШМ CC patients n = 11 |
Пациентки с РЯ OC patients |
Пациентки с РШМ CC patients n = 20 |
|||
|
ADAMTS-13, M min–max |
943*# 756–1532 |
1084*# 813–1627 |
1337# 1154–1761 |
1371# 1265–1803 |
1572 1397–2239 |
> 400 МЕ/л > 400 IU/L |
|
vWF, M min–max |
1923*# 1321–2517 |
1791*# 1178–2259 |
1513*# 1126–2141 |
1396*# 1027–2064 |
1014 726–1486 |
500–1500 МЕ/л 500–1500 IU/L |
|
vWF/ADAMTS-13 |
2,04*# |
1,65*# |
1,13*# |
1,02*# |
0,65 |
|
Примечание: *р < 0,05 – различия статистически значимы по сравнению с группой II; #р < 0,05 – различия статистически значимы по сравнению с контрольной группой; М – среднее арифметическое; РЯ – рак яичников; РШМ – рак шейки матки; vWF – фактор фон Виллебранда; ADAMTS-13 – металлопротеаза.
Note: *р < 0.05 – significant differences compared with group II; #р < 0.05 – significant differences compared with control group; М – arithmetic mean; OC – ovarian cancer; CC – cervical cancer; vWF – von Willebrand factor; ADAMTS-13 – metalloprotease.
Назначение профилактической АКТ пациенткам группы I позволило стабилизировать показатели гемостаза. По завершении ПХТ с одновременной АКТ средний уровень ADAMTS-13 у больных РЯ повысился с 943 до 1325 МЕ/л (1278–1641 МЕ/л), а у пациенток с РШМ – с 1084 до 1426 МЕ/л (1212–1842 МЕ/л). Параллельно отмечалось снижение уровня vWF с 1923 до 1684 МЕ/л (1252–1845 МЕ/л) у больных РЯ и с 1791 до 1567 МЕ/л (1234–1623 МЕ/л) у пациенток с РШМ, что приводило к нормализации соотношения vWF/ADAMTS-13 до 1,30 и 1,14 соответственно (табл. 3).
Таблица 3. Динамика лабораторных показателей у пациенток группы I при полихимиотерапии на фоне профилактической антикоагулянтной терапии (АКТ).
Table 3. Dynamics of laboratory parameters in group I during polychemotherapy under prophylactic anticoagulant therapy (АСТ).
|
Показатель Parameter |
До АКТ / Before ACT |
После АКТ / After ACT |
||
|
Пациентки с РЯ OC patients |
Пациентки с РШМ CC patients n = 11 |
Пациентки с РЯ OC patients |
Пациентки с РШМ CC patients n = 11 |
|
|
ADAMTS-13, M min–max |
943* 756–1532 |
1084* 813–1627 |
1325 1278–1641 |
1426 1212–1842 |
|
vWF, M min–max |
1923* 1321–2517 |
1791* 1178–2259 |
1684 1252–1845 |
1567 1234–1623 |
|
vWF/ADAMTS-13 |
2,04* |
1,65* |
1,30 |
1,14 |
|
D-димер / D-dimer, М ± σ |
2783 ± 953* |
2613 ± 1021* |
512 ± 73 |
497 ± 98 |
Примечание: *р < 0,05 – различия статистически значимы по сравнению с показателями после антикоагулянтной терапии; М – среднее арифметическое; РЯ – рак яичников; РШМ – рак шейки матки; vWF – фактор фон Виллебранда; ADAMTS-13 – металлопротеаза.
Note: *р < 0.05 – significant differences compared with parameters after anticoagulant therapy; М – arithmetic mean; OC – ovarian cancer; CC – cervical cancer; vWF – von Willebrand factor; ADAMTS-13 – metalloprotease.
D-димер служил дополнительным лабораторным маркером, использованным для контроля эффективности АКТ у пациенток, получавших НМГ, что подтверждало снижение выраженности гиперкоагуляционного состояния, индуцированного опухолевым процессом и ПХТ. Так, у больных РЯ отмечено снижение уровня D-димера с 2783 ± 953 нг/мл до 512 ± 73 нг/мл, у пациенток с РШМ – с 2613 ± 1021 нг/мл до 497 ± 98 нг/мл (табл. 3).
Таким образом, проведенное исследование показало, что у онкогинекологических пациенток с тромботическим анамнезом уже до проведения ПХТ регистрируются выраженные нарушения показателей оси vWF/ADAMTS-13, отражающие активацию эндотелия и повышенную тромбогенность. Химиотерапия усугубляет эти изменения, усиливая дисбаланс между vWF и ADAMTS-13. При этом назначение профилактической АКТ на основе НМГ позволяет частично нивелировать эти эффекты, способствуя восстановлению параметров гемостаза и снижению частоты тромботических осложнений. Данные результаты подчеркивают клиническую значимость мониторинга оси vWF/ADAMTS-13 как прогностического маркера и критерия эффективности антикоагулянтной профилактики у онкогинекологических больных.
Несмотря на проводимую АКТ, в группе I у пациенток с РЯ на фоне ПХТ зарегистрировано 2 случая (8,7 %) тромбоза глубоких вен (ТГВ) нижних конечностей и 1 случай (4,3 %) ТМА. В когорте больных с РШМ зафиксирован 1 (9,1 %) эпизод ТГВ (рис. 1).
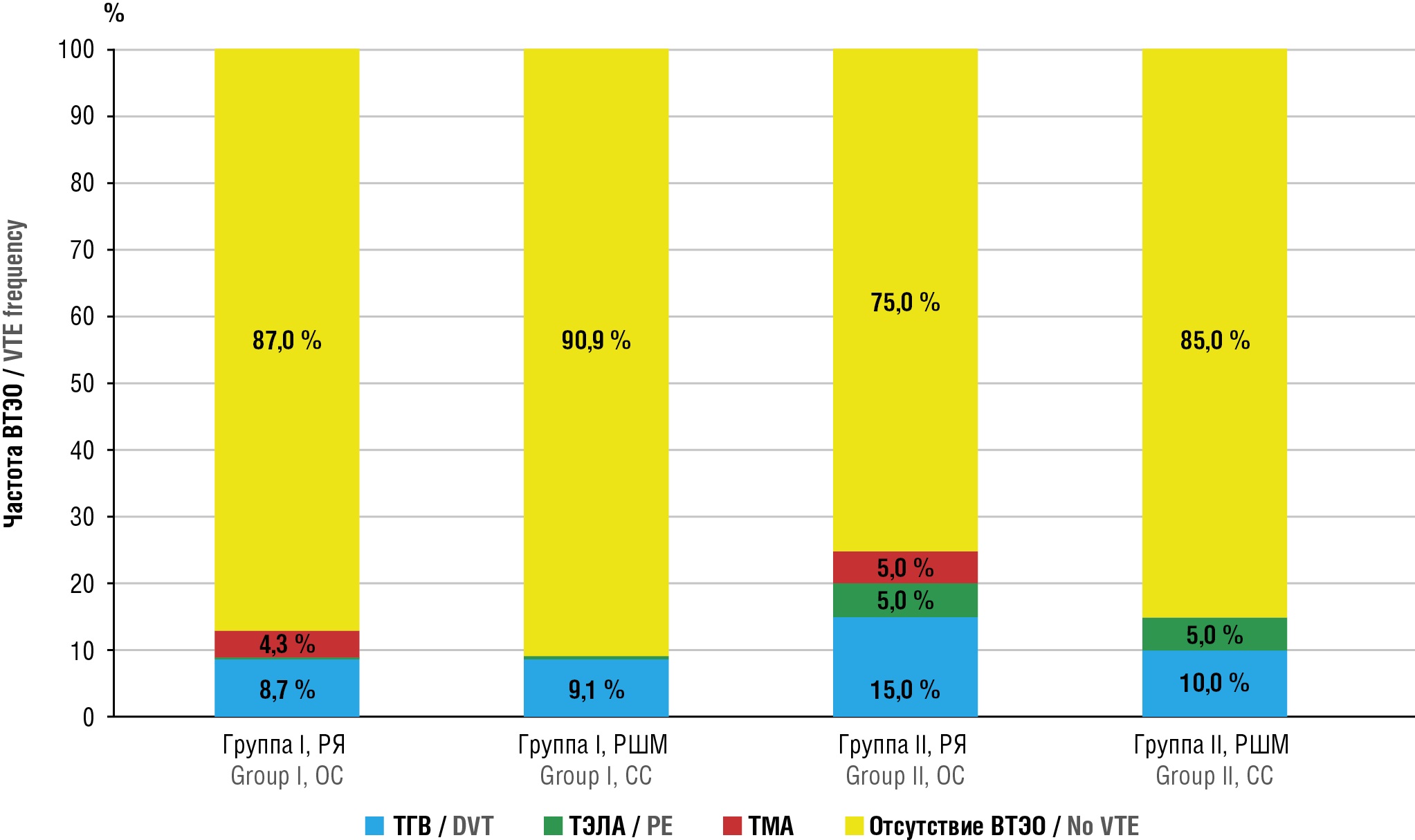
Рисунок 1. Частота венозных тромбоэмболических осложнений (ВТЭО) у пациенток групп I и II на фоне проведения полихимиотерапии.
Примечание: РЯ – рак яичников; РШМ – рак шейки матки; ТГВ – тромбоз глубоких вен; ТЭЛА – тромбоэмболия легочной артерии; ТМА – тромботическая микроангиопатия.
Figure 1. Frequency of venous thromboembolic events (VTE) in group I and group II during polychemotherapy.
Note: OC – ovarian cancer; CC – cervical cancer; DVT – deep vein thrombosis; PE – pulmonary embolism; TMA – thrombotic microangiopathy.
В то же время среди пациенток группы II, получавших ПХТ без назначения профилактической АКТ, у больных с РЯ зарегистрировано 3 случая (15,0 %) ТГВ, 1 эпизод (5,0 %) тромбоэмболии легочной артерии (ТЭЛА) и 1 случай (5,0 %) ТМА; в сумме частота тромботических осложнений достигла 25,0 %. Среди пациенток с РШМ, не получавших антикоагулянтную профилактику, выявлено 2 случая (10,0 %) ТГВ и 1 случай (5,0 %) ТЭЛА; совокупная частота осложнений составила 15,0 %.
Полученные результаты подчеркивают, что даже при умеренном повышении соотношения vWF/ADAMTS-13 сохраняется значительный риск развития ВТЭО у онкогинекологических пациенток. Эти данные подтверждают необходимость раннего назначения антикоагулянтной профилактики при проведении системной химиотерапии, ориентируясь не только на клинические шкалы риска, но и на лабораторные маркеры эндотелиальной дисфункции.
Обсуждение / Discussion
В клинической практике значимость оценки оси vWF/ADAMTS-13 как маркера тромбогенности у пациентов с ЗНО может иметь большой диагностический потенциал. Наше исследование продемонстрировало, что превышение определенных пороговых значений соотношения vWF/ADAMTS-13 достоверно ассоциировано с повышенной частотой ВТЭО, что особенно выражено у пациенток с РЯ – нозологии, традиционно характеризующейся высоким тромботическим риском [13–15]. Наблюдалась и обратная динамика: снижение соотношения vWF/ADAMTS-13 в ответ на проведение профилактической АКТ сопровождалось улучшением параметров эндотелиальной функции и снижением протромботического потенциала [6].
Параметры системы vWF/ADAMTS-13, таким образом, могут быть включены в схемы обследования онкологических пациентов с высоким риском тромбозов. Увеличение уровня vWF как маркера повреждения эндотелия и системного воспаления в сочетании со сниженной активностью ADAMTS-13, что нарушает регуляцию мультимеров vWF и усиливает их адгезивные свойства, приводит к формированию микрососудистых тромбов [5, 6, 8]. Это подтверждает значение изучаемого соотношения как чувствительного интегрального показателя дисбаланса между прокоагулянтными и антикоагулянтными механизмами гемостаза. Его повышение можно рассматривать как признак активации тромбовоспалительного каскада, эндотелиальной дисфункции и, соответственно, высокого риска тромботических событий в условиях опухолевого процесса и противоопухолевого лечения.
Введение измерения соотношения vWF/ADAMTS-13 в клиническую практику позволит своевременно выявлять пациентов с высоким риском ВТЭО, даже в ситуациях, когда уровень D-димера находится в промежуточных значениях, затрудняющих интерпретацию. Кроме того, динамическое наблюдение за соотношением vWF/ADAMTS-13 позволяет оценивать эффективность проводимой тромбопрофилактики, фиксируя улучшение гемостатического гомеостаза на фоне терапии.
Достоверность применения этого показателя подтверждается литературными данными. В ряде работ было показано, что у онкологических пациентов, у которых в течение 6 месяцев развивались тромбозы, уровни vWF достоверно превышали таковые у больных без тромботических событий, тогда как активность ADAMTS-13, напротив, снижалась [8][11][16]. Это подтверждает обратную взаимосвязь между данными параметрами и подчеркивает их ключевую роль в механизмах опухолеассоциированной гиперкоагуляции.
На основании полученных результатов можно заключить, что соотношение vWF/ADAMTS-13 представляет собой комплексный биомаркер, который в отличие от стандартных клинических шкал, базирующихся на неспецифических признаках (таких как тромбоцитоз, низкий гемоглобин, индекс массы тела), более точно отражает реальные патофизиологические процессы, происходящие в сосудистом русле под влиянием опухоли и ПХТ. Превышение уровня vWF само по себе свидетельствует о повышенной протромботической активности, учитывая его ключевую роль в адгезии тромбоцитов и формировании первичного тромба. Однако клиническое значение этого феномена становится очевидным при параллельном снижении активности ADAMTS-13. Дефицит или функциональная недостаточность ADAMTS-13 приводит к накоплению высокоактивных мультимеров и способствует микрососудистому тромбообразованию.
Наши данные показали, что именно динамика соотношения vWF/ADAMTS-13 наиболее достоверно отражает клиническую реализацию тромбозов. Так, превышение порогового значения (1,5–1,6 и выше) после первых курсов ПХТ достоверно коррелировало с развитием ВТЭО, что указывает на высокую чувствительность показателя к сдвигам в сторону гиперкоагуляции на фоне цитостатического повреждения эндотелия. В то время как классические клинические шкалы (Khorana, TiC-Onco) часто не отражают текущий гемостатический статус пациента в силу своей ориентированности на косвенные или генетические факторы, дисбаланс оси vWF/ADAMTS-13 демонстрирует прямую связь с нарушением регуляции коагуляционного каскада [17–19].
Стратификация риска ВТЭО на основе значений соотношения vWF/ADAMTS-13 показала высокую диагностическую ценность (табл. 4). Среди пациенток группы I в подавляющем большинстве (70,6 %) индекс превышал 1,6, еще у 17,6 % находился в пограничной зоне (1,5–1,6), и лишь у 11,8 % был < 1,5. В группе II показатель ≥ 1,6 встречался лишь у 10 % пациенток, что свидетельствует о высокой специфичности критерия.
Таблица 4. Стратификация рисков венозных тромбоэмболических осложнений (ВТЭО) в зависимости от соотношения vWF/ADAMTS-13.
Table 4. Stratification of venous thromboembolic events (VTE) risks based on vWF/ADAMTS-13 ratio.
|
Группа Group |
Соотношение vWF/ADAMTS-13 // vWF/ADAMTS-13 ratio |
|||||
|
≥ 1,6 |
1,5–1,6 |
< 1,5 |
||||
|
n |
% |
n |
% |
n |
% |
|
|
Группа I, пациентки с ВТЭО / Group I, patients with VTE |
24 |
70,59 |
6 |
17,65 |
4 |
11,76 |
|
Группа II, пациентки без ВТЭО / Group II, patients without VTE |
4 |
10,00 |
14 |
35,00 |
22 |
55,00 |
Проведенный ROC-анализ подтвердил высокую дискриминационную способность показателя соотношения vWF/ADAMTS-13 при оценке риска ВТЭО у онкогинекологических пациенток. Площадь под ROC-кривой (AUC) составила 0,87 (рис. 2), что существенно превосходит диагностическую эффективность общепринятых клинико-лабораторных шкал для оценки тромботического риска, таких как Khorana и Vienna CATS, для которых по данным литературы характерны значения AUC в диапазоне 0,6–0,7 [20]. Эти данные позволяют рассматривать соотношение vWF/ADAMTS-13 как перспективный и более чувствительный критерий стратификации риска ВТЭО в онкологической практике по сравнению с традиционными инструментами оценки.
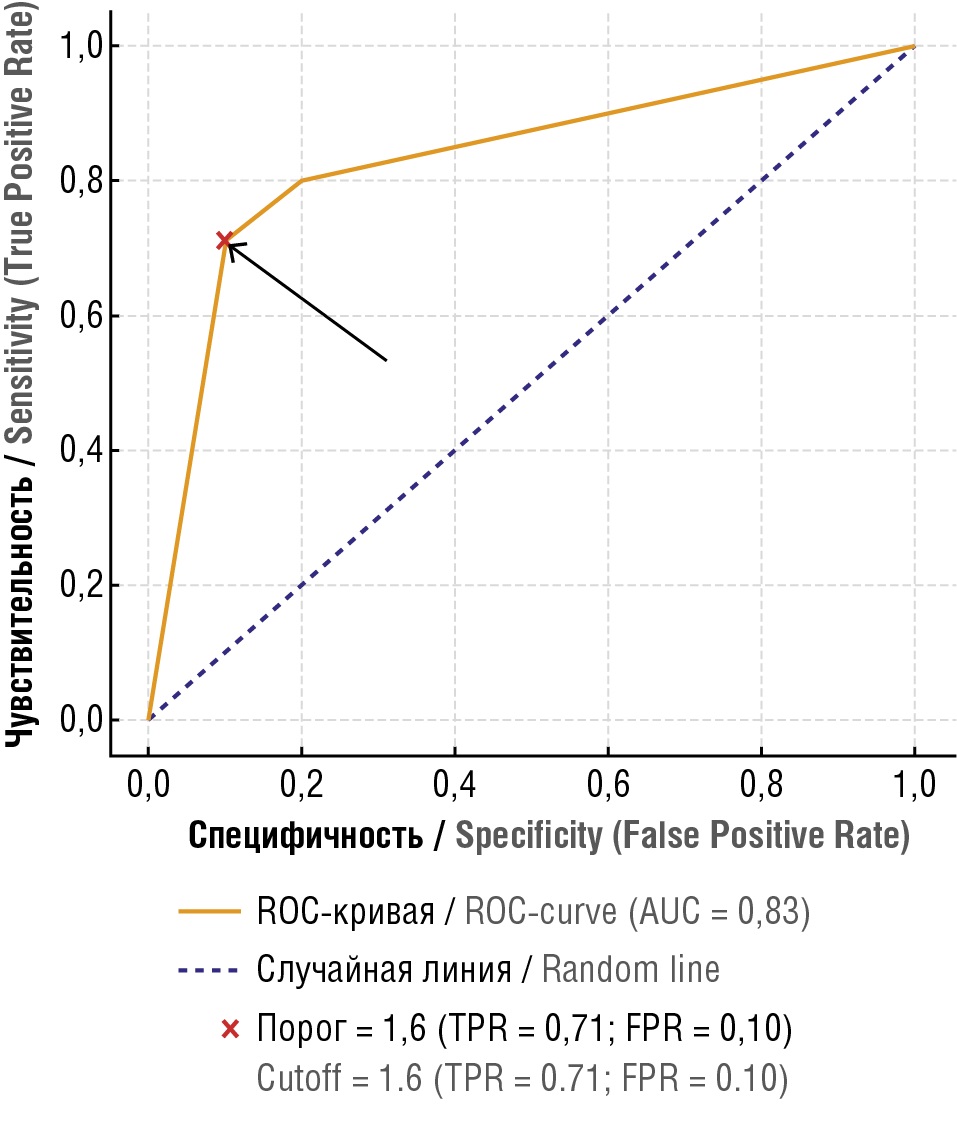
Рисунок 2. ROC-кривая для определения прогностической значимости соотношения vWF/ADAMTS-13 в предсказании тромбозов у онкогинекологических больных.
Примечание: AUC – площадь под кривой.
Figure 2. ROC curve for determining prognostic significance of the vWF/ADAMTS-13 ratio to predict thrombosis in gynecologic oncology patients.
Note: AUC – area under curve.
Детальный анализ индекса Юдена позволил определить оптимальное пороговое значение соотношения vWF/ADAMTS-13, при котором достигается наилучший баланс между чувствительностью и специфичностью теста. Максимальное значение индекса Юдена (0,61) наблюдалось при пороговом значении соотношения 1,6, что обосновывает клиническую целесообразность именно этого показателя в качестве границы, разделяющей группы высокого и низкого риска. При значении vWF/ADAMTS-13 ≥ 1,6 чувствительность метода составила 71 %, а специфичность достигла 90 %. Таким образом, выбранный порог позволяет корректно идентифицировать подавляющее большинство пациенток, у которых впоследствии действительно развиваются тромботические осложнения, и при этом минимизировать риск гипердиагностики и необоснованного назначения антикоагулянтов.
Результаты нашего исследования подтверждают, что соотношение vWF/ADAMTS-13 не только отражает функциональное состояние эндотелия и систему гемостатического баланса, но и обладает высокой практической значимостью как количественный биомаркер, характеризующий протромботический потенциал. Полученные данные позволяют рекомендовать включение порогового значения ≥ 1,6 в клинические алгоритмы оценки тромботического риска как надежный и патогенетически обоснованный критерий. Такой подход позволит оптимизировать отбор пациенток для назначения антикоагулянтной профилактики, что особенно актуально в условиях отсутствия единых унифицированных рекомендаций по профилактике ВТЭО у онкологических больных. Важно отметить, что полученные нами результаты согласуются с данными международных исследований (Vienna CATS, ONKOTEV), подчеркивающих необходимость персонализированного подхода к оценке тромботического риска в онкологии [20].
Выводы нашего исследования подтверждаются также данными ряда независимых наблюдательных и клинических работ, посвященных роли гемостатических биомаркеров в стратификации тромботического риска у онкологических пациентов. Так, в рамках крупного многоцентрового когортного исследования CATS, охватившего 795 пациентов, получающих противоопухолевое лечение, было показано, что повышение уровня vWF выше 75-го перцентиля сопровождалось троекратным увеличением риска ВТЭО по сравнению с пациентами, значения у которых находились ниже 25-го перцентиля [5]. Еще более выраженный рост относительного риска почти в 4 раза наблюдался при снижении соотношения ADAMTS-13/vWF ниже 25-го перцентиля: частота ВТЭО в этой группе составила 10,7 % против 2,6 % у пациентов, у которых данный показатель превышал 75-й перцентиль. Примечательно, что сам по себе уровень активности ADAMTS-13 не продемонстрировал статистически значимой ассоциации с риском тромботических осложнений (относительный риск (ОР) = 1,09; 95 % доверительный интервал (ДИ) = 0,88–1,35). В то же время уровень vWF и особенно соотношение ADAMTS-13/vWF продемонстрировали значимые связи с частотой ВТЭО (ОР = 1,56; 95 % ДИ = 1,13–2,16 и ОР = 0,79; 95 % ДИ = 0,65–0,96 соответственно) [21]. Эти данные дополнительно подтверждают высокую клиническую значимость и прогностическую ценность соотношения vWF/ADAMTS-13 как интегрального биомаркера для стратификации риска тромбозов в онкологической практике.
Аналогичные данные были получены в независимом клиническом исследовании, в которое были включены 160 онкологических пациентов, из которых 20 имели подтвержденные эпизоды тромбозов, а 140 наблюдались без признаков ВТЭО, при этом группы были сопоставимы по полу, возрасту, морфологическому типу и стадии опухолевого заболевания [20]. Целью работы являлось сравнение прогностической значимости уровней vWF, активности ADAMTS-13, а также оценка эффективности общепринятых клинических шкал Khorana и Vienna CATS для предсказания тромботических событий. Согласно результатам, шкала Khorana продемонстрировала крайне низкую диагностическую чувствительность: высокие значения этого индекса встречались лишь у 10,5 % пациентов с ВТЭО и у 10,9 % из группы контроля, при этом подавляющее большинство тромбозов (63,1 %) были зафиксированы у больных, отнесенных к категории промежуточного риска, что фактически сводит ее клиническую ценность в индивидуальном прогнозировании к минимуму. Шкала Vienna CATS показала несколько более высокие показатели дискриминации (высокий риск зафиксирован у 53 % больных с ВТЭО против 35,2 % без тромбозов), однако и здесь значение AUC не превышало 0,56 (95 % ДИ = 0,39–0,72), что свидетельствует об отсутствии статистически значимой прогностической мощности данного инструмента [20].
В нашем исследовании назначение профилактической АКТ позволяло существенно снизить частоту ВТЭО на фоне проводимой ПХТ. Так, в группе пациенток с РЯ, получавших НМГ в профилактическом режиме, частота ТГВ составила 8,7 % (2 случая из 23), а ТМА – 4,3 % (1 случай), тогда как в группе II частота тромботических осложнений достигала 25 %, включая 3 случая ТГВ, 1 эпизод ТЭЛА и 1 случай ТМА из 20. Похожие данные получены и в подгруппе пациенток с РШМ: на фоне профилактической АКТ зарегистрирован 1 эпизод (9,1 %) ТГВ, тогда как при отсутствии профилактики частота осложнений достигала 15 % (2 случая ТГВ и 1 случай ТЭЛА).
Следует отметить, что полное устранение тромботического риска достигнуто не было даже при применении профилактической НМГ, что, вероятно, связано с наличием дополнительных протромботических механизмов, таких как повреждения микрососудистого эндотелия вследствие химиотерапии, повышенная экспрессия тканевого фактора опухолевыми клетками и системный воспалительный ответ. Тем не менее зафиксированное снижение совокупной частоты ВТЭО с 25 % до 13 % (по данным суммарного анализа подгрупп РЯ и РШМ) на фоне применения НМГ подчеркивает клиническую значимость ранней антикоагулянтной профилактики даже при умеренном повышении индекса vWF/ADAMTS-13 как маркера тромбовоспалительной активации. Важно, что в подгруппах без профилактики НМГ соотношение vWF/ADAMTS-13 также оставалось статистически значимо выше контрольных значений (1,13 при РЯ и 1,02 при РШМ против 0,65; p < 0,01), что дополнительно подтверждает роль этого показателя в стратификации риска и выборе объема АКТ.
Таким образом, даже умеренные отклонения лабораторных показателей гемостаза свидетельствуют о повышенном риске тромбозов, и отказ от профилактической АКТ в подобных случаях сопряжен с более высокой вероятностью развития тромботических осложнений. Это позволяет рассматривать соотношение vWF/ADAMTS-13 как перспективный индикатор для персонализированного принятия решения о начале АКТ, особенно в тех ситуациях, когда стандартные клинические шкалы риска (Khorana, Vienna CATS) не дают однозначного прогноза.
Заключение / Conclusion
Проведенное исследование продемонстрировало клиническую значимость показателей оси vWF/ADAMTS-13 как интегрального маркера нарушений гемостаза и предиктора тромботических осложнений у онкогинекологических пациенток, получающих химиотерапию. Уже на дооперационном этапе у пациенток с онкогинекологическими заболеваниями, особенно с отягощенным тромботическим анамнезом, отмечались выраженные изменения коагуляционного и эндотелиального звеньев гемостаза, проявлявшиеся повышением уровня vWF с одновременным снижением ADAMTS-13 и, соответственно, увеличением их соотношения по сравнению с контрольной группой. Эти изменения усугублялись на фоне проведения химиотерапии, что сопровождалось нарастанием протромботического потенциала и ростом частоты ВТЭО.
Показано, что соотношение vWF/ADAMTS-13 обладает высокой чувствительностью и специфичностью при стратификации риска тромбозов. Превышение порогового значения соотношения ≥ 1,6 достоверно ассоциировалось с повышенной частотой ВТЭО и отражало несостоятельность компенсаторных механизмов гемостатического баланса. Включение оценки этого параметра в клинические алгоритмы позволило дифференцировать пациенток с высоким тромботическим риском и своевременно назначить антикоагулянтную профилактику.
Назначение профилактической АКТ на основе НМГ продемонстрировало эффективность в снижении показателей активации коагуляционного каскада и частоты тромботических осложнений. На фоне АКТ отмечалось достоверное снижение уровня D-димера и нормализация соотношения vWF/ADAMTS-13, что сопровождалось снижением частоты ВТЭО более чем в 2 раза по сравнению с группой пациентов, не получавших антикоагулянтов.
Полученные данные обосновывают необходимость включения показателя vWF/ADAMTS-13 в стандартные схемы лабораторного мониторинга и риск стратификации у онкогинекологических больных. Его применение как чувствительного и патогенетически обоснованного биомаркера позволит персонализировать профилактику тромботических осложнений, повысить ее эффективность и снизить риск гипердиагностики и избыточного назначения антикоагулянтов. Результаты настоящего исследования согласуются с современными представлениями о роли эндотелиальной дисфункции и дисбаланса оси vWF/ADAMTS-13 в патогенезе опухолеассоциированной гиперкоагуляции и могут служить основой для разработки индивидуализированных стратегий ведения пациенток с онкогинекологической патологией.
Список литературы
1. Xu W., Tan X., Li M.L. et al. Von Willebrand factor and hematogenous cancer metastasis under flow. Front Cell Dev Biol. 2024;12:1435718. https://doi.org/10.3389/fcell.2024.1435718.
2. Rayner S.G., Scholl Z., Mandrycky C.J. et al. Endothelial-derived von Willebrand factor accelerates fibrin clotting within engineered microvessels. J Thromb Haemost. 2022;20(7):1627–37. https://doi.org/10.1111/jth.15714.
3. Dong J.F., Moake J.L., Nolasco L. et al. ADAMTS-13 rapidly cleaves newly secreted ultralarge von Willebrand factor multimers on the endothelial surface under flowing conditions. Blood. 20021;100(12):4033–9. https://doi.org/10.1182/blood-2002-05-1401.
4. Muia J., Zhu J., Gupta G. et al. Allosteric activation of ADAMTS13 by von Willebrand factor. Proc Natl Acad Sci U S A. 2014;111(52):18584–9. https://doi.org/10.1073/pnas.1413282112.
5. Obermeier H.L., Riedl J., Ay C. et al. The role of ADAMTS-13 and von Willebrand factor in cancer patients: Results from the Vienna Cancer and Thrombosis Study. Res Pract Thromb Haemost. 2019;3(3):503–14. https://doi.org/10.1002/rth2.12197.
6. Colonne C.K., Favaloro E.J., Pasalic L. The intriguing connections between von Willebrand factor, ADAMTS13 and cancer. Healthcare (Basel). 2022;10(3):557. https://doi.org/10.3390/healthcare10030557.
7. Ayan D., Bozkurt Polat Ş.B., Bayram E. et al. A comparative analysis of the roles of von Willebrand factor and ADAMTS13 in hepatocellular carcinoma: a bioinformatics and microarray-based study. Curr Issues Mol Biol. 202547(4):270. https://doi.org/10.3390/cimb47040270.
8. Guo R., Yang J., Liu X. et al. Increased von Willebrand factor over decreased ADAMTS-13 activity is associated with poor prognosis in patients with advanced non-small-cell lung cancer. J Clin Lab Anal. 2018;32(1):e22219. https://doi.org/10.1002/jcla.22219.
9. Turner N.A., Nolasco L., Ruggeri Z.M., Moake J.L. Endothelial cell ADAMTS-13 and VWF: production, release, and VWF string cleavage. Blood. 2009;114(24):5102–11. https://doi.org/10.1182/blood-2009-07-231597.
10. Setiawan B., Permatadewi C.O., de Samakto B. et al. Von Willebrand factor:antigen and ADAMTS-13 level, but not soluble P-selectin, are risk factors for the first asymptomatic deep vein thrombosis in cancer patients undergoing chemotherapy. Thromb J. 2020;18(1):33. https://doi.org/10.1186/s12959-020-00247-6.
11. Pépin M., Kleinjan A., Hajage D. et al. ADAMTS-13 and von Willebrand factor predict venous thromboembolism in patients with cancer. J Thromb Haemost. 2016;14(2):306–15. https://doi.org/10.1111/jth.13205.
12. Feng Y., Li X., Xiao J. et al. ADAMTS13: more than a regulator of thrombosis. Int J Hematol. 2016;104(5):534–9. https://doi.org/10.1007/s12185-016-2091-2.
13. Comerford C., Glavey S., Quinn J., O'Sullivan J.M. The role of VWF/FVIII in thrombosis and cancer progression in multiple myeloma and other hematological malignancies. J Thromb Haemost. 2022;20(8):1766–77. https://doi.org/10.1111/jth.15773.
14. Shahidi M. Thrombosis and von Willebrand Factor. Adv Exp Med Biol. 2017;906:285–306. https://doi.org/10.1007/5584_2016_122.
15. Sasano T., Gonzalez-Delgado R., Muñoz N.M. et al. Podoplanin promotes tumor growth, platelet aggregation, and venous thrombosis in murine models of ovarian cancer. J Thromb Haemost. 2022;20(1):104–14. https://doi.org/10.1111/jth.15544.
16. Vorobev A., Bitsadze V., Yagubova F. et al. The phenomenon of thrombotic microangiopathy in cancer patients. Int J Mol Sci. 2024;25(16):9055. https://doi.org/10.3390/ijms25169055.
17. Karampinis I., Nowak K., Koett J. et al. Von Willebrand factor in the plasma and in the tumor tissue predicts cancer-associated thrombosis and mortality. Haematologica. 2023;108(1):261–6. https://doi.org/10.3324/haematol.2022.281315.
18. Mulder F.I., Candeloro M., Kamphuisen P.W. et al.; CAT-prediction collaborators. The Khorana score for prediction of venous thromboembolism in cancer patients: a systematic review and meta-analysis. Haematologica. 2019;104(6):1277–87. https://doi.org/10.3324/haematol.2018.209114.
19. Muñoz Martín A.J., Ortega I., Font C. et al. Multivariable clinical-genetic risk model for predicting venous thromboembolic events in patients with cancer. Br J Cancer. 2018;118(8):1056–61. https://doi.org/10.1038/s41416-018-0027-8.
20. van Es N., Di Nisio M., Cesarman G. et al. Comparison of risk prediction scores for venous thromboembolism in cancer patients: a prospective cohort study. Haematologica. 2017;102(9):1494–501. https://doi.org/10.3324/haematol.2017.169060.
21. Dickson K., Koom-Dadzie K., Brito-Dellan N., Escalante C. Risks, diagnosis, and management of recurrent cancer-associated thrombosis (CAT): a narrative review. Support Care Cancer. 2022;30(10):8539–45. https://doi.org/10.1007/s00520-022-07160-w.
Об авторах
А. В. ВоробьевRussian Federation
Воробьев Александр Викторович - к.м.н.
119048 Москва, ул. Трубецкая, д. 8, стр. 2
Scopus Author ID 59454666500, Wos ResearcherID F-8804-2017
В. О. Бицадзе
Russian Federation
Бицадзе Виктория Омаровна - д.м.н., проф., профессор РАН.
119048 Москва, ул. Трубецкая, д. 8, стр. 2
Scopus Author ID 6506003478, WoS ResearcherID F-8409-2017
А. Г. Солопова
Russian Federation
Солопова Антонина Григорьевна - д.м.н., проф.
119048 Москва, ул. Трубецкая, д. 8, стр. 2
Scopus Author ID 6505479504, WoS ResearcherID Q-1385-2015
Д. Х. Хизроева
Russian Federation
Хизроева Джамиля Хизриевна - д.м.н., проф.
119048 Москва, ул. Трубецкая, д. 8, стр. 2
Scopus Author ID 57194547147, WoS ResearcherID F-8384-2017
Д. О. Уткин
Russian Federation
Уткин Дмитрий Олегович - к.м.н.
115446 Москва, Коломенский проезд, д. 4
Д. О. Остриков
Russian Federation
Остриков Даниил Олегович.
119048 Москва, ул. Трубецкая, д. 8, стр. 2
Д. В. Блинов
Russian Federation
Блинов Дмитрий Владиславович - к.м.н.
101000 Москва, Лялин переулок, д. 11–13/1; 123056 Москва, 2-я Брестская ул., д. 5, с. 1–1а; Московская область, деревня Голубое, ул. Родниковая, стр. 6, к. 1
Scopus Author ID 6701744871, WoS ResearcherID E-8906-2017
Ж.-К. Гри
Russian Federation
Гри Жан-Кристоф - д.м.н., проф.
119048 Москва, ул. Трубецкая, д. 8, стр. 2; Франция, 34090 Монпелье, ул. Огюста Бруссоне, д. 163
Scopus Author ID 7005114260, WoS ResearcherID AAA-2923-2019
И. Элалами
Russian Federation
Элалами Исмаил - д.м.н., проф.
119048 Москва, ул. Трубецкая, д. 8, стр. 2; Франция, 75006 Париж, Улица медицинского факультета, д. 12; Франция, 75020 Париж, Китайская улица, д. 4
Scopus Author ID 7003652413, WoS ResearcherID AAC-9695-2019
Г. Геротзиафас
Russian Federation
Геротзиафас Григориос - д.м.н., проф.
119048 Москва, ул. Трубецкая, д. 8, стр. 2; Франция, 75006 Париж, Улица медицинского факультета, д. 12; Франция, 75020 Париж, Китайская улица, д. 4
А. Д. Макацария
Russian Federation
Макацария Александр Давидович - д.м.н., проф., академик РАН.
119048 Москва, ул. Трубецкая, д. 8, стр. 2
Scopus Author ID 57222220144, WoS ResearcherID M-5660-2016
► У онкологических пациенток повышение уровня фактора фон Виллебранда (vWF) и снижение активности металлопротеазы ADAMTS-13 отражают эндотелиальную дисфункцию и усиление тромботического потенциала, что ассоциируется с повышенным риском венозных тромбоэмболических осложнений (ВТЭО).
► Дефицит активности ADAMTS-13 приводит к накоплению ультра-длинных мультимеров vWF, усиливающих тромбообразование и предрасполагающих к микроангиопатии.
► Химиотерапия у онкогинекологических пациенток усугубляет дисбаланс vWF/ADAMTS-13, усиливая гиперкоагуляционное состояние и эндотелиальное повреждение.
Что нового дает статья?
► Показана высокая прогностическая значимость соотношения vWF/ADAMTS-13 у онкогинекологических пациенток для ранней стратификации риска ВТЭО на фоне химиотерапии.
► Определен оптимальный порог ≥ 1,6 для соотношения vWF/ADAMTS-13 с наилучшим балансом чувствительности и специфичности при прогнозировании высокого риска ВТЭО.
► Доказана роль динамического мониторинга vWF/ADAMTS-13 для оценки эффективности антикоагулянтной профилактики и коррекции терапии.
Как это может повлиять на клиническую практику в обозримом будущем?
► Включение мониторинга соотношения vWF/ADAMTS-13 в алгоритмы стратификации риска ВТЭО у онкогинекологических пациенток позволит индивидуализировать назначение антикоагулянтной профилактики.
► Применение интегрального показателя vWF/ADAMTS-13 повысит точность прогнозирования ВТЭО по сравнению с традиционными клиническими шкалами риска.
► Использование соотношения vWF/ADAMTS-13 в динамике лечения позволит объективно оценивать эффективность проводимой антикоагулянтной профилактики и своевременно корректировать терапию.
Рецензия
Для цитирования:
Воробьев А.В., Бицадзе В.О., Солопова А.Г., Хизроева Д.Х., Уткин Д.О., Остриков Д.О., Блинов Д.В., Гри Ж., Элалами И., Геротзиафас Г., Макацария А.Д. Прогностическая роль оси vWF/ADAMTS-13 в стратификации риска тромбозов у онкогинекологических больных. Акушерство, Гинекология и Репродукция. 2025;19(4):476-487. https://doi.org/10.17749/2313-7347/ob.gyn.rep.2025.664
For citation:
Vorobev A.V., Bitsadze V.O., Solopova A.G., Khizroeva J.Kh., Utkin D.O., Ostrikov D.О., Blinov D.V., Gris J., Elalamy I., Gerotziafas G., Makatsariya A.D. Prognostic role of the vWF/ADAMTS-13 axis in thrombosis risk stratification in gynecologic oncology patients. Obstetrics, Gynecology and Reproduction. 2025;19(4):476-487. (In Russ.) https://doi.org/10.17749/2313-7347/ob.gyn.rep.2025.664
JATS XML

Контент доступен под лицензией Creative Commons Attribution-NonCommercial-ShareAlike 4.0 International License.










































