Перейти к:
Влияние прогестерона на заболевания предстательной железы и перспективы его использования для профилактики и лечения доброкачественной гиперплазии предстательной железы
https://doi.org/10.17749/2313-7347/ob.gyn.rep.2025.662
Аннотация
Распространенность заболеваний предстательной железы, прежде всего доброкачественной гиперплазии (ДГПЖ) и рака предстательной железы (РПЖ), прогрессивно увеличивается с возрастом, когда баланс гормонов существенно меняется. Ученые и клиницисты придерживаются традиционных позиций в аспекте патогенеза развития ДГПЖ, и существенных достижений в профилактике и лечении этого заболевания нет. Продолжающиеся поиски в понимании механизмов развития данных патологий не затрагивают один из ключевых гормонов, играющих важную роль в функционировании предстательной железы – прогестерон, который никоим образом не исследовался долгие годы в этой взаимосвязи. До сих пор бытует мнение, что прогестерон – это исключительно «женский гормон», несмотря на то, что первой линией терапии при ДГПЖ являются препараты, снижающие активность фермента 5α-редуктазы, трансформирующих тестостерон в дигидротестостерон, а в условиях нормальной работы организма эту функцию в мужском организме как раз выполняет прогестерон. И указанные препараты, по сути, являются химическими аналогами прогестерона с небольшими изменениями в структуре молекулы. Иначе говоря, чтобы исправить патофизиологические аспекты, нужно исходить из физиологических аспектов. Учитывая эти предпосылки, проведен анализ имеющихся в мировой научной литературе данных, посвященных патогенезу ДГПЖ и РПЖ и эффективности различных патогномоничных терапевтических подходов в профилактике данных заболеваний.
Ключевые слова
Для цитирования:
Павлова З.Ш., Орлова Я.А., Камалов А.А. Влияние прогестерона на заболевания предстательной железы и перспективы его использования для профилактики и лечения доброкачественной гиперплазии предстательной железы. Акушерство, Гинекология и Репродукция. 2025;19(5):776-787. https://doi.org/10.17749/2313-7347/ob.gyn.rep.2025.662
For citation:
Pavlova Z.Sh., Orlova I.A., Kamalov A.A. Progesterone influence on prostate diseases and prospects in preventing and treating benign prostatic hyperplasia. Obstetrics, Gynecology and Reproduction. 2025;19(5):776-787. (In Russ.) https://doi.org/10.17749/2313-7347/ob.gyn.rep.2025.662
Введение / Introduction
Наиболее распространенными патологиями предстательной железы у мужчин после 40 лет являются доброкачественная гиперплазия предстательной железы (ДГПЖ) и рак предстательной железы (РПЖ) [1]. И действительно, если в среднем возрасте около 40 лет распространенность ДГПЖ не выходит за 10 %, то после 70 лет она встречается у подавляющего большинства мужчин в не менее 80 % случаев [2]. Кроме того, что ДГПЖ прогрессивно увеличивается в своей распространенности, она стремительно повышает риски малигнизации предстательной железы, а РПЖ является наиболее часто встречающимся раком в мужской популяции и второй причиной смерти от злокачественных неоплазий [3]. Важно отметить еще один существенный аспект в повышении риска развития РПЖ, кроме возраста – это этническая принадлежность. Достаточно много работ, демонстрирующих бóльшую предрасположенность к РПЖ темнокожих представителей мужской популяции в сравнении с белыми мужчинами, в том числе называется одна из возможных причин – более высокий уровень эстрадиола у представителей негроидной расы и латиноамериканцев [4–6]; хотя достаточно долго основным этническим различием считалась разница в уровне тестостерона, и предполагалось, что он существенно выше у представителей негроидной расы или стран юга. И несмотря на то что заболевания предстательной железы прогрессивно увеличиваются во всем мире, прорывных открытий в лечении или профилактике пока нет, как нет и новых данных о патогенезе и роли разных гормонов в механизме развития ДГПЖ или РПЖ, в том числе о роли прогестерона.
Несколько важных определений и эпидемиологических данных.
Доброкачественная гиперплазия предстательной железы – это увеличение объема простаты, в основе которого лежит преимущественно клеточная пролиферация переходной зоны.
Рак предстательной железы – это злокачественное перерождение эпителиальных клеток ткани предстательной железы, и это онкозаболевание является одним из наиболее распространенных заболеваний у мужчин. Ежегодно в мире диагностируют около 1,6 млн случаев РПЖ и фиксируют около 366 тыс. летальных исходов от этого заболевания [7, 8]. Среди злокачественных новообразований в мужской популяции нашей страны РПЖ занимает второе место, что соответствует 14,5 % от всех выявленных новообразований после опухолей трахеи, бронхов, легкого (17,4 %) [9]. В 2017 г. было впервые выявлено 40785 новых случаев РПЖ, стандартизованный показатель был 40,47 на 100 тыс. населения. Прирост заболеваемости с 2007 по 2017 гг. – 70,61 % при среднем темпе прироста за 2017 г. 5,09 %. Смертность от РПЖ в Российской Федерации неуклонно растет, и прирост показателя смертности составил 13,85 % при среднегодовом темпе прироста 1,29 % с 2007 по 2017 [7], несмотря на все предпринимаемые меры и усилия, что демонстрирует актуальность проблемы.
Нет цели рассматривать патогенез развития ДГПЖ и РПЖ в аспекте всех гормонов. Но то, что гормоны играют ключевую роль в развитии этих заболеваний, нет сомнений, и осветить действие того гормона, который незаслуженно долго остается в тени, а именно, прогестерона, необходимо.
В ткани предстательной железы представлены рецепторы разных гормонов: андрогенов, эстрогенов, инсулина, тиреотропного гормона, в том числе и прогестерона, влиянию которого на предстательную железу пока уделено значительно меньше внимания, чем другим гормонам (рис. 1) [1].

Рисунок 1. Рецепторы к гормонам в тканях предстательной железы и их основное действие на клетки предстательной железы [1].
Примечание: THs – тиреотропный гормон; THR – рецептор тиреотропного гормона; ERα – α-рецептор эстрогенового рецептора; ERβ – β-рецептор эстрогенового рецептора; АR – андрогеновый рецептор; IR – рецептор инсулина; IGF-1 – инсулинподобный фактор роста-1; IGF-1R – рецептор инсулиноподобного фактора роста-1.
Figure 1. Hormone receptors in prostate tissue and related major effects on prostate cells [1].
Note: THs – thyroid-stimulating hormone; THR – thyroid stimulating hormone receptor; ERα – estrogen receptor α-receptor; ERβ – estrogen receptor β-receptor; AR – androgen receptor; IR – insulin receptor; IGF-1 – insulin-like growth factor-1; IGF-1R – insulin-like growth factor receptor-1.
Несмотря на то, что схема стероидогенеза (рис. 2) [10] не имеет половых различий, у многих клиницистов гормон прогестерон стойко ассоциируется с функционированием женской половой системы, причем только в репродуктивном аспекте.
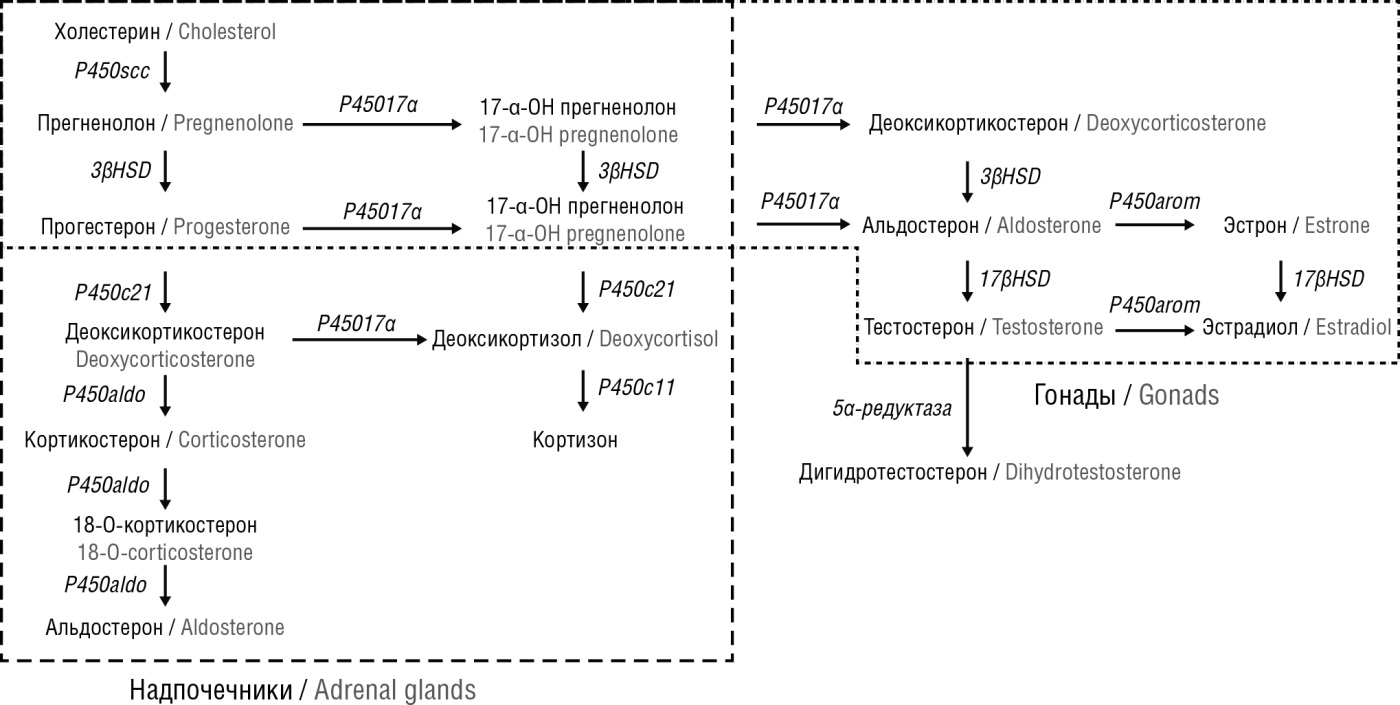
Рисунок 2. Схема стероидогенеза [адаптировано из [10] – добавлены дигидротестостерон и фермент 5α-редуктаза].
Примечание: P450scc – фермент семейства цитохром Р450, расщепляющий боковую цепь; 3βHSD – 3β-гидроксистероиддегидрогеназа; 17βHSD – 17β-гидроксистероиддегидрогеназа; P45017α – фермент семейства цитохром P45017α; P450c21 – фермент семейства цитохром Р450с21; P450c11 – фермент семейства цитохром Р450с11; P450aldo – фермент семейства цитохром P450aldo; P450arom – фермент семейства цитохром P450arom (ароматаза); 5α-редуктаза – фермент семейства оксидоредуктаз.
Figure 2. Steroidogenesis pathway [adapted from [10] – dihydrotestosterone and the enzyme 5α-reductase have been added].
Note: P450scc – enzyme of cytochrome R450 family cleaving side chain; 3βHSD – 3β-hydroxysteroid dehydrogenase; 17βHSD – 17β-hydroxysteroid dehydrogenase; P45017α – enzyme of cytochrome P45017α family; P450c21 – enzyme of cytochrome P450c21 family; P450c11 – enzyme of cytochrome P450c11 family; P450aldo – enzyme of cytochrome P450aldo family; P450arom – enzyme of cytochrome P450arom family (aromatase); 5α reductase – enzyme of oxidoreductase family.
Но действие прогестерона, как и любого другого гормона, многолико. Например, стимулирующее дыхательный центр действие прогестерона и повышающее его чувствительность к уровням СО2 и О2 достаточно долгое время поддерживало надежду у ученых на использование прогестерона в качестве лечебного средства у пациентов с обструктивным апноэ сна [11]. Или известно, что прогестерон оказывает ингибирующее действие на гладкомышечные клетки сосудистой стенки и не только, например, кишечника, отчасти за счет повышения синтеза оксида азота (NO), который в свою очередь вызывает образование циклического гуанозинмонофосфата (цГМФ), который активирует протеинкиназу G (англ. protein kinase G, PKG), которая играет ключевую роль при релаксации гладкой мускулатуры [12][13] (рис. 3). А воздействие на индукцию синтеза азота мы можем проецировать на всю сердечно-сосудистую систему, и здесь также сложно провести разделение по половому признаку или переоценить важность этого свойства как у мужчин (тот же сосудистый механизм эрекции основан на действии оксида азота), так и у женщин.
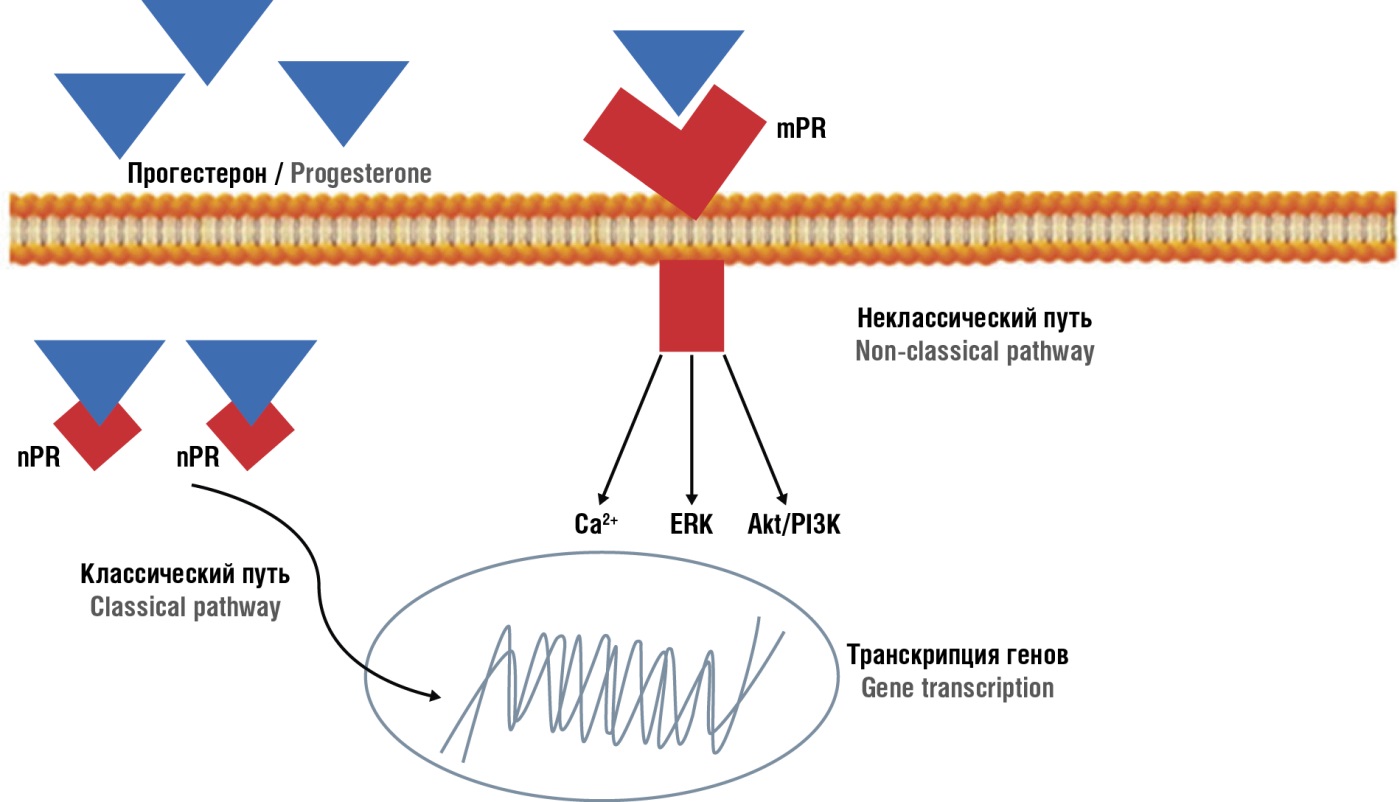
Рисунок 3. Влияние прогестерона на сокращение гладких мышц кишечника [13].
Примечание: mPR – мембранный рецептор прогестерона; nPR – ядерный рецептор прогестерона; ERK – киназы, регулируемые внеклеточными сигналами; Akt/PI3K – протеинкиназа В/фосфоинозитол-3 киназы; Са²⁺ – ионизированный кальций.
Figure 3. Progesterone-related effect on intestinal smooth muscle contraction [13].
Note: mPR – membrane progesterone receptor; nPR – nuclear progesterone receptor; ERK – extracellular signal regulated kinases; Akt/PI3K – protein kinaseB/phosphoinositol-3 kinase; Са²⁺ – ionized calcium.
Прогестерон активирует рецепторы на поверхности клеточной мембраны – мембранный рецептор прогестерона (англ. membrane progesterone receptor, mPR), что приводит к синтезу NO; производство NO приводит к образованию цГМФ и к активации протеинкинзы G; PKG ингибирует сигнальные пути, стимулирующие сокращение, такие как Rho-киназа (англ. Rho-kinase, RhoK), и активирует передачу сигналов, которые приводят к расслаблению мышц, например, фосфатаза легкой цепи миозина (англ. myosin light chain phosphatase, MLCP).
Немного физиологии / Some physiology-related aspects
Прогестерон – стероидный гормон, вырабатываемый в небольшом количестве в тканях яичек и в надпочечниках из холестерина в организме у мужчин, а также в других органах, включая центральную нервную систему (ЦНС); химическая формула – С21Н30О2. В сутки в мужском организме вырабатывается от 1,5 до 3,0 мг; после менопаузы у женщин и после 60 лет у мужчин уровень прогестерона прогрессивно снижается и составляет 0,38–0,13 нг/мл [14][15]. Именно со снижением количества прогестерона в крови и протективным иммунологическим эффектом связывают более тяжелое течение аутоиммунных и инфекционных заболеваний у лиц старшего возраста. Прогестерон является предшественником половых, нейростероидных, минералкортикоидных гормонов и прежде всего кортизола, как видно из схемы стероидогенеза (рис. 2) [10].
Натуральный прогестерон поддерживает низкий уровень сывороточного эстрадиола, увеличивая скорость конверсии эстрадиола в менее активный эстрон (в свете постоянно растущего количества мужчин с ожирением, соответственно, с развитием воспаления жировой ткани и гиперэстрогенией это свойство приобретает особое значение); в том числе оказывает кардиопротективный эффект; способствует синтезу фолликулостимулирующего гормона (ФСГ), повышает качество сперматогенеза; в малых дозах стимулирует, а в больших подавляет синтез лютеинизирующего гормона (ЛГ); способствует снижению повышенного уровня дигидротестостерона за счет снижения активности 5α-редуктазы, что принципиально важно в аспекте развития ДГПЖ и РПЖ. Метаболит прогестерона – 5α-прегнанолон обладает антидисфорической активностью, участвует в регулировании процессов сна и бодрствования и, возможно, оказывает нейропротекторный эффект после повреждения мозговой ткани [16–21]. Нельзя упустить еще один важный аспект действия прогестерона – иммунологический: прогестерон модулирует процесс дифференцировки Т-лимфоцитов в направлении Th2 (субпопуляция Т-лимфоцитов), контролирует цитотоксичность клеток – естественных киллеров (англ. natural killer cells, NK cells) и синтез провоспалительных цитокинов – интерлейкинов (англ. interleukin, IL) IL-4, IL-6 и др. [21]. Несмотря на то что интерес к роли прогестерона у мужчин эпизодически проявлялся в разных научных школах, он не имел широкого резонанса. Последним пиком этого интереса был период пандемии коронавирусной инфекции, когда в период лечения мужчин с COVID-19 были продемонстрированы противовоспалительные и иммуномодулирующие эффекты прогестерона: период лечения был короче и потребность в кислороде сокращалась на 3 дня [22]. Также было отмечено, что у пациентов с атипичной пневмонией уровень прогестерона в крови был снижен [23]. В другом исследовании было показано, что прогестерон снижает синтез IL-1β, IL-6, фактора некроза опухоли альфа (англ. tumor necrosis factor-alpha, TNF-α), IL-12, хемокинов – моноцитарного хемотаксического протеина-1 (англ. monocyte chemoattractant protein-1, MCP-1 or CCL2) [24].
Отдельно важно сделать акцент на том, что прогестерон оказывает на эндотелий сосудов защитное действие, которое реализуется только при физиологических уровнях прогестерона и его гомологичной структуре натуральному прогестерону. Усиленная стимуляция рецепторов эндотелия в процессе лечения синтетическими прогестинами приводит к изменению его функции путем влияния на вазодилатацию, транспорт липидов, адгезию белков и, как следствие, к изменению морфологического состояния сосудистой стенки. Следует отметить, что синтетические гестагены хорошо переносятся пациентами, но их прием противопоказан во время беременности, у пациенток с нарушением функции печени, у больных с раком молочной железы, заболеваниями сосудов головного мозга и дисфункцией коронарных артерий, у женщин с отягощенным анамнезом по возникновению тромбоэмболии, а также у курящих женщин [25]. Все синтетические прогестины создавались по принципу их высокой аффинности и длительности взаимодействия с прогестероновыми рецепторами; в результате оказалось, что слишком сильная связь синтетических прогестинов с рецепторами эндотелия увеличивает риск развития сердечно-сосудистых заболеваний у приматов и людей [19]. Несмотря на то что представленные данные относятся к женской части популяции, мы можем экстраполировать эти результаты и на мужскую популяцию, но для подтверждения данных тезисов необходимо проведение исследований.
Механизм действия прогестерона / Mechanism of progesterone action
Действие прогестерона определяется за счет активации классических и неклассических сигнальных путей [26]. Приоритетным является классический путь, когда прогестерон связывается со своим рецептором из суперсемейства ядерных рецепторов факторов транскрипции [26]. Существуют 2 основные изоформы рецепторов прогестерона (англ. progesterone receptor, PR): PR-A и PR-B. Соединение молекулы прогестерона с его рецептором в гормон-рецепторный комплекс индуцирует его транслокацию в ядро, где инициируется транскрипция широкого спектра белков через димеризацию и транслокацию ядерного рецептора прогестерона (англ. nuclear progesterone receptor, nPR) в ядро [27]. Существует и неклассический путь, который производит более быстрые действия путем активации рецепторов на клеточной мембране, которые напоминают рецепторы, связанные с G-белком, и мембранный рецептор прогестерона (mPR) с последующей активацией нескольких вторичных мессенджеров, таких как повышение внутриклеточного кальция (Ca²⁺) (с этим же связывают воздействие прогестерона на сперматогенез: стимулирующее капацитацию сперматозоидов/акросомную реакцию [28–32]), киназ, регулируемых внеклеточными сигналами (англ. extracellular signal regulated kinases, ERK) и митоген-активируемой протеинкиназы (англ. mitogen-activated protein kinase, MAPК) или протеинкиназыB/фосфатидилинозитол-3-киназы (англ. protein kinase B/phosphoinositol-3 kinase, Akt/PI3K) [13][33] (рис. 4) [13].
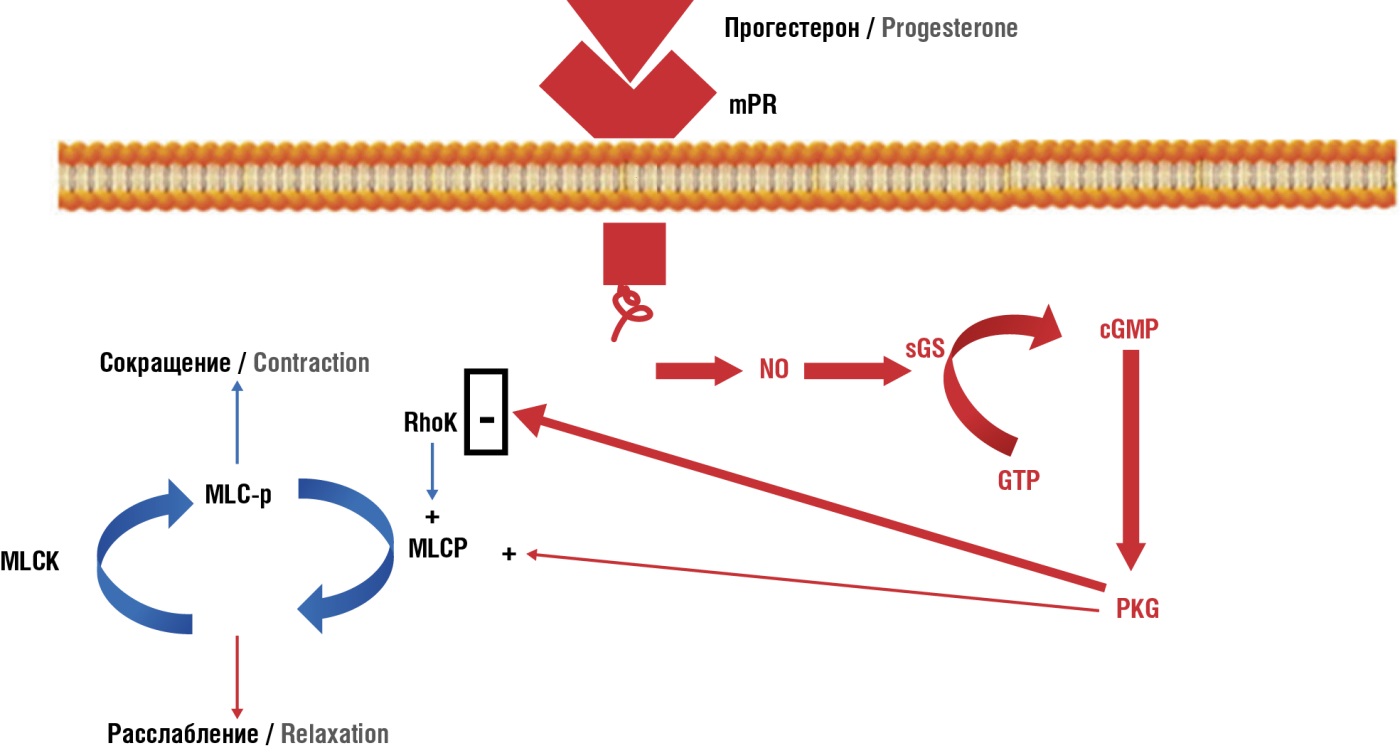
Рисунок 4. Механизм действия прогестерона [13].
Примечание: mPR – мембранный рецептор прогестерона; NO – оксид азота; сGМP – циклический гуанозинмонофосфат; GTP – гуанозинтрифосфат; PKG – протеинкиназа G; RhoK – Rho-киназа; MLCР – фосфатаза легкой цепи миозина; sGS – растворимая гуанилатциклаза; MLC – легкая цепь миозина; MLC-р – фосфорилирование легкой цепи миозина; MLCК – киназа легкой цепи миозина.
Figure 4. Mechanism of progesterone action [13].
Note: mPR – membrane progesterone receptor; NO – nitric oxide; сGМP – cyclic guanosine monophosphate; GTP – guanosine triphosphate; PKG – proteinkinase G; RhoK – Rho-kinase; MLCР – myosin light chain phosphatase; sGS – soluble guanylate cyclase; MLC – myosin light chain; MLC-р – myosin light chain phosphorylation; MLCК – myosin light chain kinase.
Прогестерон имеет родственную связь не только с прогестероновыми рецепторами, но также и с рецепторами эстрадиола, кортизола, тестостерона и альдостерона. Прогестерон способен конкурировать с альдостероном за рецепторы, расположенные в почках и в большей степени в стенках артерий [34].
А есть ли какие-то интересные результаты исследований с использованием прогестерона в мировой литературе? Достаточно много ученых и врачей андрологов возлагают надежды на использование прогестерона в борьбе с мужским бесплодием. В исследовании, проведенном в 2022 г., в 20 образцов спермы с астенозооспермией добавляли синтезированные твердые наночастицы прогестерона и оценивали их влияние на ряд показателей [20]. Были получены следующие результаты:
– прогестерон повышал целостность мембран сперматозоидов (p < 0,05);
– прогестерон усиливал акросомальную реакцию и в целом капацитацию (p < 0,05);
– повышался уровень общей антиоксидантной способности (p < 0,05);
– усиливалась экспрессия генов протеинкиназы (англ. protein kinase, PTK), PKA протеинеиназы А (англ. proteinkinase A), белка 1, ассоциированного с акросомой сперматозоида (англ. sperm acrosome associated protein 1, SPACA1) и митоген-активируемой протеинкиназы (англ. mitogen-activated proteinkine, P38MAPK) (p < 0,001).
Иначе говоря, оказывалось очевидное положительное влияние на показатели сперматогенеза, что повышает заинтересованность ученых в проведении дальнейших исследований в аспекте использования препаратов прогестерона для улучшения сперматогенеза у мужчин с бесплодием.
Так как одна из ведущих ролей в патогенезе ДГПЖ принадлежит дигидротестостерону, то и поиски эффективных средств, способных привести к балансу этого гормона, являются приоритетными. Результаты одного из экспериментальных исследований [35], проведенного уже более 30 лет назад, но не теряющего своей ценности, помогают оценить эффективность прогестерона и других гормонов и лекарственных средств, в отношении изменения активности фермента 5α-редуктазы и соответственно, уровня дигидротестостерона. Протокол исследования предполагал смешивание клеток нормальной кожи половых органов и лобка с физиологическими концентрациями тестостерона для оценки активности 5α-редуктазы по его превращению в дигидротестостерон, используя уровень дигидротестостерона как индикатор степени ингибирования 5α-редуктазы. В отдельных экспериментах активность 5α-редуктазы оценивали до и после добавления натурального прогестерона, медроксипрогестерона ацетата, левоноргестрела, норэтиндрона, 17βа-эстрадиола и этинилэстрадиола. Каковы же результаты? (табл. 1).
Таблица 1. Эффективность различных вариантов прогестерона и эстрадиола как ингибиторов фермента 5α-редуктазы [35].
Table 1. The effectiveness of various progesterone and estradiol variants as 5α-reductase inhibitors [35].
|
Действующее вещество Active substance |
Эффект на 5α-редуктазу Effect on 5α-reductase activity |
Результат Result |
|
Прогестерон (Прегн-4-ен-3,20-дион) Progesterone (Pregn-4-ene-3,20-dione) |
Ингибирующий эффект Inhibitory effect |
97,0 ± 5,3 % |
|
Медроксипрогестерона ацетат 6-альфа-17-гидрокси-6-метилпрегн-4-ен-3,20-дион (в виде ацетата) Medroxyprogesterone acetate 6-alpha-17-hydroxy-6-methylpregn-4-ene-3,20-dionemedroxyprogesterone (as acetate) |
Агонист прогестероновых, андрогенных и глюкокортикоидных рецепторов, синтетический вариант гормона прогестерона – ингибирующий эффект Agonist for progesterone, androgen and glucocorticoid receptors, a synthetic progesterone analogue – inhibitory effect |
0 |
|
Левоноргестрел 17-альфа-13-этил-17-гидрокси-18,19-динопрегн-4-ен-20-ин-3-он, (синтетический прогестаген) Levonorgestrel 17-alpha-13-ethyl-17-hydroxy-18,19-dinopregn-4-en-20-yn-3-one (synthetic progestogen) |
Ингибирующий эффект Inhibitory effect |
47,9 ± 6,3 % |
|
Норэтистерон 17-альфа-17-гидрокси-19-норпрегн-4-ен-20-ин-3-он (и в виде ацетата или энантата, синтетический прогестаген) Norethisterone 17-alpha-17-hydroxy-19-norpregn-4-en-20-yn-3-one(including acetate or enanthate, synthetic progestogen) |
Ингибирующий эффект Inhibitory effect |
59,0 ± 4,6 % |
|
17-бета-эстрадиол 17-бета-эстра-1,3,5(10)-триен-3,17-диол 17-beta-estradiol 17-beta-estra-1,3,5(10)-triene-3,17-diol |
Ингибирующий эффект только в высоких концентрациях! Inhibitory effect only at high concentration! |
40,8 ± 14,2 % |
|
Этинилэстрадиол 17-альфа-19-норпрегна-1,3,5(10)-триен-20-ин-3,17-диол (синтетический эстрадиол) Ethinylestradiol 17-alpha-19-norpregna-1,3,5(10)-triene-20-yne-3,17-diol (synthetic estradiol) |
Ингибирующий эффект Inhibitory effect |
0 |
Из чего следует, что эффективность натурального прогестерона в ингибировании активности 5α-редуктазы неоспоримо выше других гормонов, которые связывали с подавлением активности фермента 5α-редуктазы.
Почему же мало исследований, посвященных использованию прогестерона в лечении ДГПЖ или РПЖ? Или же они демонстрируют негативное влияние на эти заболевания. Например, в одном из исследований, посвященных раку предстательной железы, прогестерон рассматривается как один из онкомаркеров и онкометаболитов, и его депривация потенциально может улучшить прогнозы лечения [36]. Накопленные данные также демонстрируют, что происходит мутация рецепторов в клетках предстательной железы при раке, и эти клетки могут реагировать и активироваться, в том числе и кортикостероидами, кроме андрогенов или прогестерона. При этом сложно отрицать провоспалительную основу любого онкопроцесса. А из данных физиологии и множества исследований прогестерон демонстрирует способность снижать синтез провоспалительных цитокинов, например, IL-1β и TNF-α, в том числе и при воспалительных заболеваниях желудочно-кишечного тракта (ЖКТ) [35–39], что можно экстраполировать на другие органы и системы. Отмечено повышение экспрессии классических рецепторов прогестерона в простате при ДГПЖ, а также при РПЖ [29–32], что может быть следствием патологических процессов или одним из их триггеров. Пока это остается вопросом. Также отмечено повышение количества андрогеновых рецепторов в целом и их накопление в ядре под воздействием прогестерона [36].
Очень важно понимать, что одни и те же гормоны в физиологических и патологических условиях могут оказывать противоположные эффекты, и когда с целью профилактики онкологических процессов подавляют синтез прогестерона или андрогенов, это может не дать ожидаемого положительного эффекта и вызвать негативные последствия. При этом если онкологическое заболевание развилось, то терапевтические подходы к использованию любых гормонов в лечении меняются. Чаще всего использование гормонов противопоказано.
Таким образом, складывается понимание о системности действия прогестерона в организме как женщин, так и мужчин, и это вполне характерно для действия гормонов в целом. Важно понять, каково же действие прогестерона относительно предстательной железы, и может ли нормализация баланса не только андрогенов, эстрогенов, но и прогестерона способствовать профилактике развития ДГПЖ и РПЖ или использоваться в качестве лечебного средства.
Может возникнуть логичный вопрос: зачем нужно исследовать эффективность прогестерона, если широко используемые препараты финастерид или дутастерид достаточно эффективны? Финастерид снижает уровень дигидротестостерона (ДГТ) в сыворотке или простате на 71 % или 85 % соответственно, в то время как дутастерид снижает ДГТ как в сыворотке, так и в простате на 95 % и более [40–44]. Это очень высокая эффективность! Но, андрогеновый рецептор (АР) может функционировать по-разному в зависимости от баланса тестостерона и ДГТ, и использование лекарственных средств, влияющих на чувствительность и другие свойства рецепторов и ферментов, могут привести к появлению самых разных эффектов и побочных реакций. Финастерид и дутастерид могут иметь нецелевые эффекты, которые напрямую ингибируют АР [44–46]. Дутастерид снижает уровень внутриклеточного тестостерона практически до неопределяемого уровня. Финастерид одинаково хорошо блокировал накопление тестостерона в каждой клеточной линии. Доза 0,5 мкМ финастерида устраняла любые следы тестостерона внутри клеток. Результаты применения дутастерида и финастерида позволяют предположить, что эти ингибиторы 5α-редуктазы также могут блокировать поглощение тестостерона клетками [43]. Именно поэтому, возможно, мы часто фиксируем те самые побочные эффекты – снижение либидо, эректильную дисфункцию, преждевременную эякуляцию и гинекомастию, когда назначаем эти препараты.
Проведение исследования с использованием натуральных форм прогестерона может обеспечить не только снижение уровня ДГТ, относительно или абсолютно увеличенного, уменьшение объема предстательной железы, но и, возможно, улучшить эректильную функцию, либидо и другие важные функции мужского организма.
Заключение / Conclusion
При прогрессирующем развитии любого заболевания наиболее эффективным способом остановить его распространение является полное понимание механизма развития болезни и воздействие на причину. Наиболее ценным видом терапии является профилактика заболеваний, и здесь также невозможно обойтись без знаний патогенеза. В понимании механизма развития доброкачественной гиперплазии и рака предстательной железы, который часто развивается на фоне гиперплазии, очень много «белых пятен», и одним из них является значение прогестерона в предупреждении и лечении ДГПЖ и РПЖ. Исходя из знаний физиологии, где прогестерон регулирует активность фермента 5α-редуктазы и уменьшает избыточную конвертацию тестостерона в ДГТ, сложно переоценить его значение в аспекте избыточного роста объема предстательной железы. Также нельзя забывать, что первой линией терапии ДГПЖ являются препараты – блокаторы фермента 5α-редуктазы, которые имеют небольшие отличия от прогестерона в структуре химической формулы. Имеющиеся данные, представленные в статье, демонстрируют самую высокую ингибирующую эффективность фермента 5α-редуктазы натурального прогестерона в сравнении с синтетическими вариантами прогестерона или эстрогенов и ингибиторов фермента 5α-редуктазы – финастерида или дутастерида. Надо отметить, что оба препарата достаточно эффективны, но существенно снижают качество жизни мужчин, ухудшая или лишая их сексуальной составляющей жизни. Прежде всего, такие негативные последствия могут быть связаны с тем, что и финастерид и дутастерид не только снижают конвертацию тестостерона в ДГТ, но и препятствуют проникновению тестостерона в клетку, а это действие может иметь более тяжелые последствия для всего организма. Вероятность того, что натуральный прогестерон будет иметь меньшее количество побочных эффектов при большей эффективности, делает перспективу его использования в практике обоснованной. Кроме того, любой гормон не имеет одной точки приложения и его действие системно, что может иметь и потенциально положительные действия в отношение ЦНС или сердечно-сосудистой системы и не только.
Таким образом, использование натуральных форм прогестерона в аспекте прежде всего ДГПЖ потенциально может быть более эффективным и безопасным, для чего следует провести клинические исследования и оценить эффективность не только нормализации активности фермента 5α-редуктазы, но и снижения объема гиперплазированной предстательной железы.
Список литературы
1. Cannarella R., Condorelli R.A., Barbagallo F. et al. Endocrinology of the aging prostate: current concepts. Front Endocrinol (Laussane). 2021;12:554078. https://doi.org/10.3389/fendo.2021.554078.
2. Vuichoud C., Loughlin K.R. Benign prostatic hyperplasia: epidemiology, economics and evaluation. Can J Urol. 2015;22(Suppl 1):1–6.
3. Siegel R.L., Miller K.D., Jemal A. Cancer statistics, 2016. CA Cancer J Clin. 2016;66(1):7–30. https://doi.org/10.3322/caac.21332.
4. De Santis C.E., Siegel R.L., Sauer A.G. et al. Cancer statistics for African Americans, 2016: progress and opportunities in reducing racial disparities. CA Cancer J Clin. 2016;66(4):290–308. https://doi.org/10.3322/caac.21340.
5. Rohrmann S., Nelson W.G., Rifai N. et al. Serum estrogen, but not testosterone, levels differ between black and white men in a nationally representative sample of Americans. J Clin Endocrinol Metab. 2007;92(7):2519–25. https://doi.org/10.1210/jc.2007-0028.
6. Williams V.L., Awasthi S., Fink A.K. et al. African-American men and prostate cancer-specific mortality: a competing risk analysis of a large institutional cohort, 1989-2015. Cancer Med. 2018;7(5):2160–71. https://doi.org/10.1002/cam4.1451.
7. Каприн А.Д., Алексеев Б.Я., Матвеев В.Б. и др. Рак предстательной железы. Клинические рекомендации. Современная oнкология. 2021;23(2):211–47. https://doi.org/10.26442/18151434.2021.2.200959.
8. Rider J.R., Wilson K.W., Sinnott J.A. et al. Ejaculation frequency and risk of prostate cancer: updated results with an additional decade of follow-up. Eur Urol. 2016;70(6):974–82. https://doi.org/10.1016/j.eururo.2016.03.027.
9. Pernar C.H., Ebot E.M., Wilson K.M., Mucci L.A. The epidemiology of prostate cancer. Cold Spring Harb Perspect Med. 2018;8(12):a030361. https://doi.org/10.1101/cshperspect.a030361.
10. Дедов И.И., Мельниченко Г.А., Фадеев В.Ф. Руководство по эндокринологии. M.: ГЭОТАР-Медиа, 2007. 432 с.
11. Зильбер А.П. Синдромы сонного апноэ: клиническая физиология, лечение, профилактика. Петрозаводск: Изд-во Петрозаводского университета, 1994. 184 с.
12. Al-Shboul O.A., Mustafa A.G., Omar A.A. et al. Effect of progesterone on nitric oxide/cyclic guanosine monophosphate signaling and contraction in gastric smooth muscle cells. Biomed Rep. 2018;9(6):511–6. https://doi.org/10.3892/br.2019.1251.
13. Alqudah M., Al-Shboul O., Al Dwairi A. et al. Progesterone inhibitory role on gastrointestinal motility. Physiol Res. 2022;71(2):193–8. https://doi.org/10.33549/physiolres.934824.
14. Shackleton C., Malunowicz E. Apparent pregnene hydroxylation deficiency (APDH): seekingthe parentage of an orphan metabolome. Steroids. 2003;68(9):707–17. https://doi.org/10.1016/s0039-128x(03)00115-6.
15. Oettel M., Mukhopadhyay A.K. Progesterone: the forgotten hormone in man. Aging Male. 2004;7(3):236–57. https://doi.org/10.1080/13685530400004199.
16. Федотчева Т.А. Клиническое применение прогестинов и механизмы их действия: настоящее и будущее (обзор). Современные технологии в медицине. 2021;13(1):93–108. https://doi.org/10.17691/stm2021.13.1.11.
17. Graham J.D., Clarcke C.L. Physiological action of progesterone in target tissues. Endocr Rev. 1997;18(4):502–19. https://doi.org/10.1210/edrv.18.4.0308.
18. Kuhl H. Pharmacology of estrogens and progestogens: influence of different routes of administration. Climacteric. 2005;8 Suppl 1:3–63. https://doi.org/10.1080/13697130500148875.
19. Якушевская О.В. Современные подходы к назначению прогестерона в практике акушера-гинеколога. Эффективная фармакотерапия. Акушерство и гинекология. 2012;(4):12–6.
20. Baranizadeh K., Mahboobian M.M., Amiri I. et al. Effects of progesterone nanoparticles on the sperm capacitation and acrosome reaction in asthenozoospermia men. Andrologia. 2022;54(1):e14258. https://doi.org/10.1111/and.14258.
21. Sutter-Dub M. Rapid non-genomic and genomic responses to progestogens, estrogens, and glucocorticoids in the endocrine pancreatic B cell, the adipocyte and other cell types. Steroids. 2002;67(2):77–93. https://doi.org/10.1016/s0039-128x(01)00142-8.
22. Ghandehari S., Matusov Y., Pepkowitz S. et al. Progesterone in addition to standard of care vs standard of care alone in the treatment of men hospitalized with moderate to severe COVID-19: a randomized, controlled pilot trial. Chest. 2021;160(1):74–84. https://doi.org/10.1016/j.chest.2021.02.024.
23. Beltrame A., Salguero P., Rossi E. et al. Immunometabolic mechanisms underlying the severity of COVID-19. Viral Immunol. 2022;13:1–10. https://doi.org/10.3389/fimmu.2022.834851.
24. Mauvais-Jarvis F., Klein S.L., Levin E.R. Estradiol, progesterone, immunomodulation, and COVID-19 outcomes. Endocrinology. 2020;161(9):bqaa127. https://doi.org/10.1210/endocr/bqaa127.
25. Physicians desk reference. Montvale N.J.: Thomson P.D.R., 2006. 60th ed. 3529 p.
26. Garg D., Ng S.S.M., Baig K.M. et al. Progesterone-mediated non-classical signaling. Trends Endocrinol Metab. 2017;28(9):656–68. https://doi.org/10.1016/j.tem.2017.05.006.
27. Wetendorf M., DeMayo F.J. Progesterone receptor signaling in the initiation of pregnancy and preservation of a healthy uterus. Int J Dev Biol. 2014;58(2–4):95–106. https://doi.org/10.1387/ijdb.140069mw.
28. Valadez-Cosmes P., Vázquez-Martínez E.R., Cerbon M., Camacho-Arroyo I. Membrane progesterone receptors in reproduction and cancer. Mol Cell Endocrinol. 2016;434:166–75. https://doi.org/10.1016/j.mce.2016.06.027.
29. Kolatorova L., Vitku J., Suchopar J. et al. Progesterone: a steroid with wide range of effects in physiology as well as human medicine. Int J Mol Sci. 2022;23(14):7989. https://doi.org/10.3390/ijms23147989.
30. Haseroth K., Christ M., Falkenstein E., Wehling M. Aldosterone- and progesterone-membrane-binding proteins: new concepts of nongenomic steroid action. Curr Protein Pept Sci. 2000;1(4):385–401. https://doi.org/10.2174/1389203003381270.
31. Falkenstein E., Heck M., Gerdes D. et al. Specific progesterone binding to a membrane protein and related nongenomic effects on Ca2+-fluxes in sperm. Endocrinology. 1999;140(12):5999–6002. https://doi.org/10.1210/endo.140.12.7304.
32. Falkenstein E., Tillmann H.C., Christ M. et al. Multiple actions of steroid hormones-a focus on rapid, nongenomic effects. Pharmacol Rev. 2000;52(4):513–56. https://doi.org/10.1016/S0031-6997(24)01468-6.
33. Simoncini T., Genazzani A.R. Non-genomic actions of sex steroid hormones. Eur J Endocrinol. 2003;148(3):281–92. https://doi.org/10.1530/eje.0.1480281.
34. Conneely O.M., Lydon J.P. Progesterone receptors in reproduction: functional impact of the A and B isoforms. Steroids. 2000;65(10–11):571–7. https://doi.org/10.1016/s0039-128x(00)00115-x.
35. Cassidenti D.L., Paulson R.J., Serafini P. et al. Effects of sex steroids on skin 5 alpha-reductase activity in vitro. Obstet Gynecol. 1991;78(1):103–7.
36. Hou Z., Huang S., Mei Z. et al. Inhibiting 3βHSD1 to eliminate the oncogenic effects of progesterone in prostate cancer. Cell Rep Med. 2022;3(3):100561. https://doi.org/10.1016/j.xcrm.2022.100561.
37. Chen G., Shi J.-X., Qi M. et al. Effects of progesterone on intestinal inflammatory response, mucosa structure alterations, and apoptosis following traumatic brain injury in male rats. J Surg Res. 2008;147(1):92–8. https://doi.org/10.1016/j.jss.2007.05.029.
38. Nalli A.D., Kumar D.P., Mahavadi S. et al. Hypercontractility of intestinal longitudinal smooth muscle induced by cytokines is mediated by the nuclear factor-κB/AMP-activated kinase/myosin light chain kinase pathway. J Pharmacol Exp Therap. 2014;350(1):89–98. https://doi.org/10.1124/jpet.113.212522.
39. Pang Y., Dong J., Thomas P. Progesterone increases nitric oxide synthesis in human vascular endothelial cells through activation of membrane progesterone receptor-α. Am J Physiol Endocrinol Metab. 2015;308(10):E899–E911. https://doi.org/10.1152/ajpendo.00527.2014.
40. Andriole G.L., Humphrey P., Ray P. et al. Effect of the dual 5alpha-reductase inhibitor dutasteride on markers of tumor regression in prostate cancer. J Urol. 2004;172(3):915–9. https://doi.org/10.1097/01.ju.0000136430.37245.b9.
41. Clark R.V., Hermann D.J., Cunningham G.R. et al. Marked suppression of dihydrotestosterone in men with benign prostatic hyperplasia by dutasteride, a dual 5alpha-reductase inhibitor. J Clin Endocrinol Metab. 2004;89(5):2179–84. https://doi.org/10.1210/jc.2003-030330.
42. McConnell J.D., Wilson J.D., George F.W. et al. Finasteride, an inhibitor of 5 alpha-reductase, suppresses prostatic dihydrotestosterone in men with benign prostatic hyperplasia. J Clin Endocrinol Metab. 1992;74(3):505–8. https://doi.org/10.1210/jcem.74.3.1371291.
43. Span P.N., Voller M.C., Smals A.G. et al Selectivity of finasteride as an in vivo inhibitor of 5alpha-reductase isozyme enzymatic activity in the human prostate. J Urol. 1999;161(1):332–7.
44. Wu Y., Godoy A., Azzouni F. et al. Prostate cancer cells differ in testosterone accumulation, dihydrotestosterone conversion, and androgen receptor signaling response to steroid 5α-reductase inhibitors. Prostate. 2013;73(13):1470–82. https://doi.org/10.1002/pros.22694.
45. Lazier C.B., Thomas L.N., Douglas R.C. et al. Dutasteride, the dual 5alpha-reductase inhibitor, inhibits androgen action and promotes cell death in the LNCaP prostate cancer cell line. Prostate. 2004;58(2):130–44. https://doi.org/10.1002/pros.10340.
46. Wu Y., Chhipa R.R., Zhang H., Ip C. The antiandrogenic effect of finasteride against a mutant androgen receptor. Cancer Biol Ther. 2011;11(10):902–9. https://doi.org/10.4161/cbt.11.10.15187.
Об авторах
З. Ш. ПавловаРоссия
Павлова Зухра Шариповна - д.м.н. Scopus Author ID: 57208630829.
119234 Москва, Ломоносовский проспект, д. 27, корп. 10
Я. А. Орлова
Россия
Орлова Яна Артуровна - д.м.н., проф. Scopus Author ID: 24503460300. WoS ResearcherID: O-3105-2017.
119234 Москва, Ломоносовский проспект, д. 27, корп. 10
А. А. Камалов
Россия
Камалов Армаис Альбертович - д.м.н., проф., академик РАН. WoS ResearcherID: AAO-1396-2020.
119234 Москва, Ломоносовский проспект, д. 27, корп. 10
Что уже известно об этой теме?
► Полного понимания патогенеза развития доброкачественной гиперплазии предстательной железы (ДГПЖ) и рака предстательной железы (РПЖ) на данный момент нет.
► Как ДГПЖ, так и РПЖ прогрессируют, и применяемые средства достаточно эффективны, но способствуют развитию побочных эффектов, ухудшающих качество жизни, таких как ухудшение сексуальной функции, вплоть до полного ее отсутствия.
► ДГПЖ и РПЖ имеют выраженную возрастную взаимосвязь, развиваясь крайне редко в молодом и среднем возрасте и стремительно увеличиваясь в своей частоте у возрастных мужчин, возникая в подавляющем количестве случаев.
Что нового дает статья?
► Данная статья освещает влияние прогестерона на механизм развития заболеваний предстательной железы и демонстрирует важность системного подхода не только к физиологии и патофизиологии, но и к профилактике и лечению.
► Натуральные и синтетические формы гормонов оказывают существенно различный эффект, что должно учитываться при использовании препаратов в практической медицине.
► Представлены результаты влияния эстрогенов на фермент 5α-редуктазу, что также подчеркивает многофакторность развития таких сложных заболеваний, как ДГПЖ и РПЖ.
Как это может повлиять на клиническую практику в обозримом будущем?
► Привлекая внимание ученых и клиницистов, можно инициировать проведение клинических исследований, которые дадут возможность ответить на вопрос: эффективно и безопасно ли использование прогестерона в клинической практике для профилактики и лечения ДГПЖ и РПЖ.
► Также важно оценить, будет ли использование прогестерона более эффективным, чем применение широко используемых сейчас препаратов из класса блокаторов 5α-редуктазы.
► Можно ли избежать таких побочных явлений, как нарушение эректильной функции и снижение либидо, которые возникают при использовании препаратов из класса блокаторов 5α-редуктазы, если будет применяться прогестерон.
Рецензия
Для цитирования:
Павлова З.Ш., Орлова Я.А., Камалов А.А. Влияние прогестерона на заболевания предстательной железы и перспективы его использования для профилактики и лечения доброкачественной гиперплазии предстательной железы. Акушерство, Гинекология и Репродукция. 2025;19(5):776-787. https://doi.org/10.17749/2313-7347/ob.gyn.rep.2025.662
For citation:
Pavlova Z.Sh., Orlova I.A., Kamalov A.A. Progesterone influence on prostate diseases and prospects in preventing and treating benign prostatic hyperplasia. Obstetrics, Gynecology and Reproduction. 2025;19(5):776-787. (In Russ.) https://doi.org/10.17749/2313-7347/ob.gyn.rep.2025.662

Контент доступен под лицензией Creative Commons Attribution-NonCommercial-ShareAlike 4.0 International License.











































