Перейти к:
Молекулярно-генетические маркеры рака молочной железы: современные достижения в понимании этиологии, прогностической ценности и терапевтических возможностей
https://doi.org/10.17749/2313-7347/ob.gyn.rep.2025.631
Аннотация
Введение. Рак молочной железы (РМЖ) – наиболее распространенное онкологическое заболевание, занимающее лидирующую позицию среди причин смерти от рака. Ранняя диагностика критически важна для успешного лечения. Современные молекулярно-генетические исследования произвели революцию в онкологии, позволив классифицировать РМЖ на различные подтипы, тем самым кардинально изменив подход к терапии.
Цель: проанализировать литературные данные, посвященные актуальной информации о молекулярно-генетических маркерах РМЖ и перспективам их использования для диагностики и лечения РМЖ.
Материалы и методы. Поиск информации проводился в соответствии с рекомендациями PRISMA в базах данных PubMed/MEDLINE, eLibrary и Google Scholar с использованием ключевых слов на русском и английском языках: «рак молочной железы», «ранний рак молочной железы», «молекулярные маркеры опухолевых клеток», «химиотерапия», «гормонотерапия», «рецепторы эстрогенов и прогестерона», «трижды негативный рак молочной железы», «неоадъювантная химиотерапия», «полный патоморфологический ответ», «иммуногистохимия», «breast cancer», «early breast cancer», «molecular markers of tumor cells», «chemotherapy», «hormone therapy», «estrogen and progesterone receptors», «triple-negative breast cancer», «neoadjuvant chemotherapy», «complete pathological response», «immunohistochemistry». В обзор включались статьи, опубликованные в рецензируемых изданиях, содержащие оригинальные данные по молекулярной диагностике РМЖ. Всего отобрано 39 публикаций.
Результаты. Установлена высокая диагностическая и прогностическая значимость мутаций в генах BRCA1/2, PIK3CA, TP53, CHEK2, PALB2 и ESR1, а также экспрессии маркеров PD-L1, TIL и Foxp3+ Treg. Современные технологии, включая жидкостную биопсию, анализ циркулирующих опухолевых клеток и циркулирующей опухолевой ДНК, позволяют формировать молекулярный профиль опухоли в реальном времени. Это существенно расширяет возможности персонализированного подхода к терапии. HER2-low подтип и мутации ESR1 требуют индивидуальных стратегий лечения.
Заключение. Современные молекулярные маркеры РМЖ становятся основой точной диагностики, стратификации риска и персонализированной терапии. Несмотря на значительный научный прогресс, остаются актуальными вопросы доступности молекулярной диагностики, стандартизации процедур и внедрения новых технологий в клиническую практику. Необходима системная поддержка для интеграции молекулярных методов в стандартные протоколы лечения.
Ключевые слова
Для цитирования:
Омаров М.М., Трусова В.В., Агабекян Л.М., Газиев И.Р., Алибекова З.М., Айвазян Л.А., Сафарова Э.А., Аджигулова А.М., Дармилова А.А., Ханмухометова Э.К., Иванова И.Р., Пигарева В.И. Молекулярно-генетические маркеры рака молочной железы: современные достижения в понимании этиологии, прогностической ценности и терапевтических возможностей. Акушерство, Гинекология и Репродукция. 2025;19(4):575-589. https://doi.org/10.17749/2313-7347/ob.gyn.rep.2025.631
For citation:
Omarov M.M., Trusova V.V., Agabekyan L.M., Gaziev I.R., Alibekova Z.M., Aivazyan L.A., Safarova E.A., Adzhigulova A.M., Darmilova A.A., Khanmukhometova E.K., Ivanova I.R., Pigareva V.I. Molecular genetic markers of breast cancer: current advances in understanding the etiology, prognostic value, and therapeutic opportunities. Obstetrics, Gynecology and Reproduction. 2025;19(4):575-589. (In Russ.) https://doi.org/10.17749/2313-7347/ob.gyn.rep.2025.631
Введение / Introduction
Рак молочной железы (РМЖ) – злокачественное новообразование, образующееся из эпителиальных клеток молочной железы. РМЖ занимает лидирующую позицию в структуре онкологических заболеваний в Российской Федерации. В период 2023–2024 гг.число новых случаев РМЖ в России в год составило около 60000–65000. За последние 10–15 лет наблюдается стабильный рост заболеваемости РМЖ в России на уровне примерно 1–2 % в год. Смертность от РМЖ в России составляет примерно 15–20 % от общего числа случаев. Помимо этого, данное заболевание занимает первое место среди причин смертности от онкологических заболеваний –10–12 % [1].
В последние годы увеличивается количество пациентов, у которых заболевание диагностировано на 1–2 стадиях. В 2018 г. данный показатель составил 71,2 %, тогда как в 2008 г. показатель составлял 62,7 % [1]. Глобальная инициатива по борьбе с РМЖ (англ. Global Breast Cancer Initiative, GBCI) стремится к достижению снижения показателя смертности от РМЖ на 2,5 % в год.
За период 2010–2020 гг. заболеваемость медленно, но неуклонно росла, хотя все больше случаев выявляется на ранних стадиях, что значительно повышает шансы на выздоровление. Ранняя диагностика критически важна, поскольку эффективность лечения напрямую зависит от стадии заболевания: чем раньше обнаружен рак, тем выше вероятность полного излечения [1]. Эффективность излечения напрямую зависит от стадии: первая дает шансы на выздоровление почти в 96 % случаев, вторая – в 80–90 %, третья – в 60–80 %.
Понимание РМЖ претерпело революционные изменения благодаря молекулярно-генетическим исследованиям, которые позволили выделить основные подтипы РМЖ на основе анализа экспрессии генов, а также программных процессов в развитии. Классификация РМЖ основана на изучении рецептора эстрогена (англ. estrogen receptor, ER), рецептора прогестерона (англ. progesterone receptor, PR) и рецептора эпидермального фактора роста 2-го типа (англ. human epidermal growth factor receptor 2, HER2), действующих на поверхности или внутри опухолевых клеток. При углубленном изучении характеристику подтипов РМЖ дополнили молекулярными маркерами – иммуногистохимическими (маркер пролиферации Киль 67; англ. marker of proliferation Kiel 67, Ki-67), геномными (гены РМЖ BRCA1 и BRCA2; англ. breast cancer 1, breast cancer 2; ген фосфоинозитид-3-киназы; англ. phosphoinositide 3-kinase, PIK3CA) и иммунологическими (инфильтрирующие опухоль лимфоциты; англ. tumor infiltrating lymphocytes, TIL; лиганд 1 рецептора программируемой клеточной гибели; англ. рrogrammed death-ligand 1, PD-L1) [2].
Перед исследователями стоит ряд сложных задач:
- выявление рака на ранней стадии, разработка более специфичных методов скрининга, а также выделение групп пациенток, имеющих генетическую предрасположенность к возникновению РМЖ [3][4];
- разработка более специфичных генетических тестов и методов гистологического исследования опухоли для выявления подтипов, мутаций, степени злокачественности РМЖ, разработка персонализированного лечения [5][6];
- снижение количества диагностических ошибок, ассоциированных с субъективным мнением конкретного специалиста и нарушением методики проведения исследований [7][8];
- мониторинг лечения и прогрессирования заболевания, прогнозирование вероятности рецидива и метастазирования [9][10].
Цель: проанализировать литературные данные, посвященные актуальной информации о молекулярно-генетических маркерах РМЖ и перспективам их использования для диагностики и лечения РМЖ.
Материалы и методы / Materials and Methods
Поиск информации осуществлялся в электронных базах данных PubMed/MEDLINE, еLibrary и Google Scholar с использованием ключевых слов на русском и английском языках: «рак молочной железы», «ранний рак молочной железы», «молекулярные маркеры опухолевых клеток», «химиотерапия», «гормонотерапия», «рецепторы эстрогенов и прогестерона», «трижды негативный рак молочной железы», «неоадъювантная химиотерапия», «полный патоморфологический ответ», «иммуногистохимия», «breast cancer», «early breast cancer», «molecular markers of tumor cells», «chemotherapy», «hormone therapy», «estrogen and progesterone receptors», «triple-negative breast cancer», «neoadjuvant chemotherapy», «complete pathological response», «immunohistochemistry». Поиск публикаций проводился согласно рекомендациям PRISMA. Авторы независимо друг от друга занимались поиском публикаций, при возникновении разногласий решение принималось путем консенсуса. Временной интервал поиска: с момента основания соответствующей базы данных по ноябрь 2024 г. В результате поиска было найдено 55122 публикаций. Проводился анализ результатов исследований, а также анализ литературы в отобранных исследованиях.
На этапе идентификации исключали дубликаты. На этапе скрининга анализировали названия, аннотации статей, ключевые слова, соответствующие исследуемой теме.
На приемлемость оценивали 361 полнотекстовую статью. Критерии включения источников в обзор: публикации на русском или английском языке, опубликованные в рецензируемом научном издании; источник представляет собой оригинальное исследование с участием людей, описание клинического случая, обзор литературы; исследование включает в себя вышеуказанные ключевые слова; в исследовании изучаются молекулярные маркеры опухолевых клеток РМЖ; статья описывает возможности жидкостной биопсии при диагностике РМЖ; в исследовании описываются возможности эндокринной терапии и химиотерапии РМЖ, а также методы преодоления устойчивости к ним. В итоге в обзор были включены 39 публикаций. Алгоритм отбора проиллюстрирован на рисунке 1.
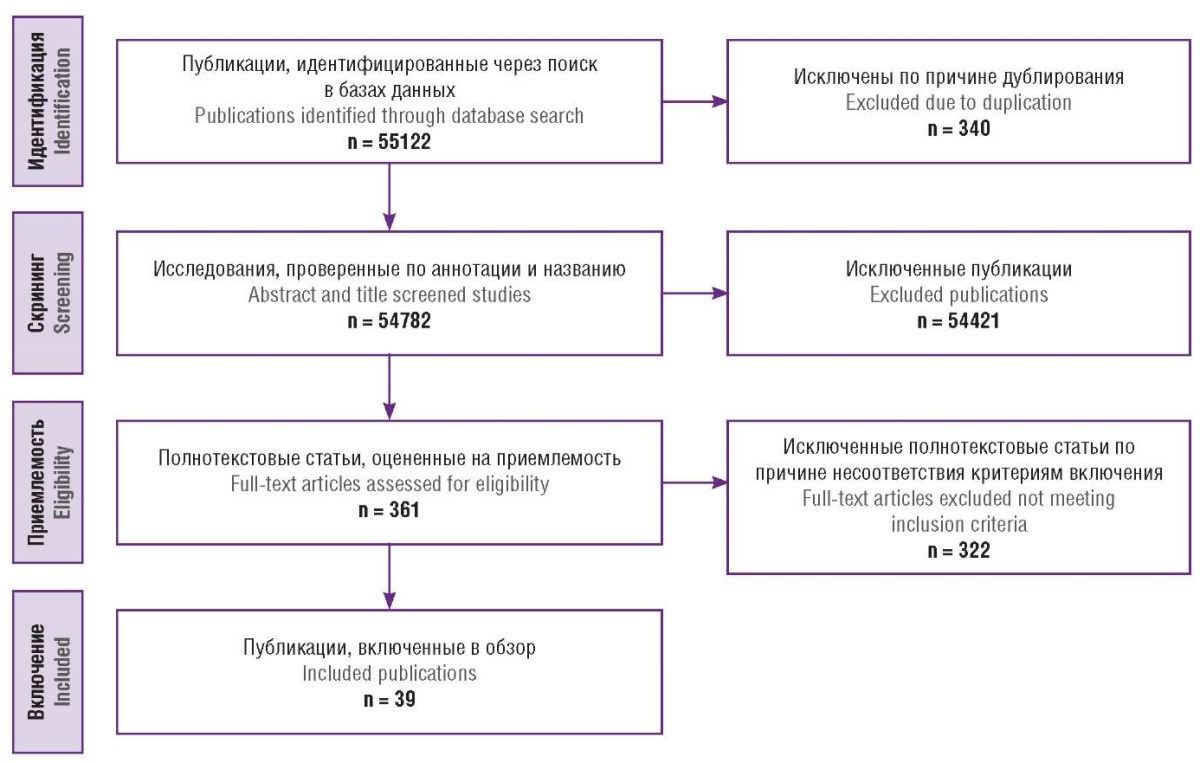
Рисунок 1. Алгоритм поиска исследований.
Figure 1. Publications search algorithm.
Результаты / Results
Подтипы рака молочной железы / Breast сancer types
Молекулярные подтипы РМЖ были определены в соответствии с классификацией, представленной в Клинических рекомендациях «Рак молочной железы» Минздрава России [11]:
- люминальный A подтип, эстрогензависимый, неагрессивный, характеризуется отсутствием избыточной экспрессии рецепторов белка HER2 (HER2–), статус ER положительный (ER+), PR положительный (PR+), низкая пролиферативная активность (экспрессия Ki-67 менее 20 %);
- люминальный B подтип, эстрогензависимый, агрессивный, характеризуется выраженной экспрессией рецепторов белка HER2 (HER2+), ER+ и/или PR+, высокая пролиферативная активность Ki-67 (более 20 %);
- HER2+ подтип, эстрогеннезависимый, агрессивный, HER2+, статус ER отрицательный (ER–), PR отрицательный (PR–), Ki-67 более 20 %;
- трижды негативный рак молочной железы (ТНРМЖ) подтип – эстрогеннезависимый, агрессивный, HER2–, ER–, PR–, Ki-67 более 20 %.
Генетические мутации рака молочной железы / Genetic mutations in breast cancer
Одним из современных методов обследования при подозрении на РМЖ является выполнение генетического исследования на наличие мутаций, увеличивающих риски развития заболевания. На данный момент изучено большое количество генов, ассоциированных с повышенным риском развития РМЖ, включая BRCA1, BRCA2, CHEK2 (англ. Check point Kinase 2; Контрольная точка Киназа 2), TP53 (англ. p53 protein; белок p53), STK-11 (англ. serine/threonin kinase 11; серин/треонин киназа 11) [3].
Исследования по открытию опухолевых биомаркеров, основанные на анализе больших данных, активно продолжаются. Собранные наборы данных РМЖ в Программе «Атлас генома рака» (англ. The Cancer Genome Atlas, TCGA) выявляют основополагающие данные для идентификации новых биомаркеров РМЖ. Профили матричной РНК (мРНК) из наборов данных TCGA были проанализированы с помощью Multi Experiment Viewer и GraphPad Prism [3].
По последним данным, с помощью анализа профиля дифференциально экспрессируемых (англ. differentially expressed, DE) мРНК были выявлены 14 мРНК с пониженной экспрессией: HADH (англ. hydroxyacyl-coenzyme A dehydrogenase; гидроксиацил-коэнзим А дегидрогеназа), CPN2 (англ. сarboxypeptidase N subunit 2; субъединица 2 карбоксипептидазы N), ADAM33 (англ. disintegrin and metalloproteinase domain-containing protein 33; белок 33, содержащий домен дезинтегрина и металлопротеиназы), TDRD10 (англ. tudor domain containing 10; tudor домен-содержащий белок 10), SNF1LK29 (англ. serine/threonine-proteinkinase SIK2; серин/треонин-протеинкиназа SIK2), HBA2 (англ. hemoglobin A2; гемоглобин А2), KCNIP2 (англ. Kv channel-interacting protein 2; белок 2, взаимодействующий с каналом Kv), EPB42 (англ. еrythrocyte membrane protein band 4.2; белок мембраны эритроцитов полосы 4.2,), PYGM (англ. glycogen phosphorylase, muscle associated; гликогенфосфорилаза, связанная с мышцами), CEP68 (англ. сentrosomal protein of 68 kDa; центросомный белок 68 кДа), ING3 (англ. inhibitor of growth protein 3; ингибитор роста белка 3), EMCN (англ. еndomucin; эндомуцин), SYF2 (англ. pre-mRNA splicing factor; фактор сплайсинга пре-мРНК) и DTWD1 (англ. domain containing 1; домен, содержащий 1) [3].
Выявлены 6 мРНК с повышенной экспрессией: ZNF8 (англ. zinc finger protein 8; белок цинкового пальца 8), TOMM40 (англ. mitochondrial import receptor subunit TOM40 homolog; субъединица рецептора митохондриального импорта гомолог TOM40), EVPL (англ. еnvoplakin; энвоплакин), EPN3 (англ. еpsin 3; эпсин 3), AP1M2 (англ. adaptor related protein complex 1 subunit Мu 2; адаптерный белковый комплекс 1 субъединица Mu 2) и SPINT2 (англ. serine peptidase inhibitor Kunitz type 2; ингибитор протеазы типа Кунитца). В общей сложности 20 мРНК DE демонстрируют высокую диагностическую эффективность при РМЖ [3].
Наиболее известные мутации в зародышевых клетках, которые связаны с РМЖ, происходят в генах BRCA1 и BRCA2, увеличивают общий риск заболевания на протяжении жизни до 70 %. Современные генетические исследования РМЖ включают использование геномных панелей, которые сосредоточены не только на генах BRCA, но также включают PALB2 (англ. partner andlocalizer of BRCA2; партнер и локализатор BRCA2), ATM (англ. аtaxiatel angiectasia mutated; мутантный при атаксии-телеангиэктазии белок), CHEK2, RAD51C (англ. RAD51 homolog C; гомолог С гена RAD51); BARD1 (англ. BRCA1-associated RING domain protein 1; белок, ассоциированный с BRCA1), TDRD10 (англ. Tudor domain containing 10; белок, содержащий тюдор-домен 10) и TP53. Белок-партнер BRCA2 – PALB2 обеспечивает его локализацию и стабильность. Мутации в одном из аллелей PALB2 увеличивают риск РМЖ на 53 % [12].
Кумулятивный риск развития РМЖ у носителей мутации в гене BRCA1 к 80 годам составляет 72 %, при этом риск развития рака яичников составляет 44 % и 40 % риск развития рака контралатеральной молочной железы. Для носителей мутации в гене BRCA2 кумулятивный риск развития РМЖ составляет 69 %, риск развития рака яичников – 17 %, 26 % – риск развития рака контралатеральной молочной железы [13].
Учитывая значительное повышение рисков развития РМЖ при носительстве мутации в том или ином гене, рассматривается вопрос о внедрении в широкую практику профилактических операций, которые позволяют значительно снизить риски развития РМЖ [13].
Благодаря комплексному подходу к изучению мутаций генов стало возможным охарактеризовать сопутствующие изменения, взаимоисключающие события, терапевтический потенциал. Так, была выявлена взаимосвязь между TP5-AURKA (англ. Aurora kinase A; Аврора киназа А) и резистентностью к эндокринной терапии (ЭТ), связь между BRCA1-MYC (англ. proto-oncogene protein Myc; протоонкогенный белок Myc) зародышевой линии и повышенной чувствительностью к ингибиторам ферментов поли-АДФ-рибозополимеразы. Также обнаружена связь между TP53-MYB (англ. Myb-related protein B; связывающий Myb белок В) и устойчивостью к иммунотерапии. Эти данные позволят разработать стратегии таргетного лечения, а также улучшить результаты лечения пациенток с учетом генетических взаимодействий [14].
Определение герминальных мутаций BRCA при ТНРМЖ может обеспечить улучшение выживаемости [15].
Инвазивная дуктальная карцинома и инвазивный лобулярный РМЖ характеризуются мутациями эпителиального кадгерина (англ. сadherin-1, CDH1) и диссоциированным паттерном роста. При ТНРМЖ и HER2+ РМЖ идентифицируемые в опухоли и строме TIL имеют прогностическую ценность для ответа на химиотерапию [16].
Соматические мутации PIK3CA прогнозируют ответ на ингибиторы PI3K (англ. phosphatidylinositol-3-kinase; фосфатидилинозитол-3-киназа) при метастатическом РМЖ (мРМЖ) ER+ и HER2– [17].
Воздействие на ER с помощью ЭТ является современным стандартом лечения ER+ РМЖ и позволяет снизить смертность на 40 % [18]. Устойчивость к ЭТ остается серьезной проблемой при ER+ РМЖ. Приобретенная мутация ESR1 индуцируется в процессе химиотерапевтичекого лечения в 20–30 % случаев мРМЖ ER+, при раннем РМЖ (рРМЖ) ER+ встречается реже (менее 1 % случаев). Около 15–20 % всех случаев ТНРМЖ связаны с герминальными мутациями в BRCA1 или BRCA2. Мутации PALB2 распространены примерно в 0,6–3,9 % случаев семейного РМЖ [19].
Одной из основных причин устойчивости к ЭТ являются мутации в гене ESR1, приводящие к постоянной транскрипционной активности и снижению чувствительности к ЭТ. Приобретенные мутации в лиганд-связывающем домене ERα рецептора альфа-эстрогена – LBD ERα (англ. еstrogen alpha receptor ligand-binding domain ERα), называемые мутациями ESR1, могут быть вызваны самой ЭТ, что приводит к устойчивости в ходе дальнейшей терапии. Доклинические модели и мультиомные подходы могут внести вклад в разработку новых терапевтических стратегий для преодоления ESR1 мутаций и резистентности к ЭТ [20].
Общая частота встречаемости мутации ESR1 составила 24 %, наиболее распространенная мутация – D538G. Предшествующая ЭТ ингибиторами ароматазы (ИА), тамоксифеном (ТАМ), фулвестрантом (ФУЛ) может привести к мутации ESR1 и резистентности к терапии, что ведет к прогрессированию или рецидиву заболевания. Частота мутаций ESR1 значительно выше у пациенток, получавших ранее схемы лечения, содержащие ИА, по сравнению с теми, кто получал схемы, не содержащие ИА. Мутации ESR1 могут привести к развитию полной эндокринной резистентности к ИА, в то время как в случае TAM или ФУЛ наблюдается лишь частичная резистентность [20].
Также активирующие мутации часто становятся причиной резистентности к ЭТ при HR+ (англ. hormone receptor positive; положительный гормональный рецептор) и HER2– мРМЖ. Новые исследования показывают, что как старое, так и новое поколение селективных ингибиторов деградации эстрогена (англ. selective drugs to destroy estrogen receptors, SERD) демонстрируют лучшую эффективность у пациенток с HR+ и HER2– мРМЖ с наличием мутаций в гене ERα в отличие от традиционной терапии ингибиторами ароматазы. Жидкостная биопсия, в частности, позволяет через анализ циркулирующей опухолевой ДНК (цДНК) минимально инвазивно выявлять мутации ESR1. В ходе исследований PADA-1 и EMERALD применялись различные молекулярные техники, такие как цифровая капельная полимеразная цепная реакция (англ. digital droplet polymerase chain reaction, ddPCR) и секвенирование нового поколения (англ. next-generation sequencing, NGS) для оценки мутационного статуса ESR1 в цДНК. Каждый метод имеет свои преимущества и ограничения: ddPCR обладает высокой чувствительностью при выявлении специфичных мутаций, в то время как NGS позволяет охватить весь спектр мутаций ESR1. Важна аккуратная обработка образцов, так как стабильность цДНК может меняться. Также важно выявлять субклональные мутации ESR1, так как они могут существенно влиять на резистентность к терапии и чувствительности к SERD [3].
Существует острая необходимость в оптимизации стратегий тестирования ESR1 в образцах жидкостной биопсии при HR+/HER2– мРМЖ, а также во внедрении четко установленного технического процесса обнаружения мутаций в ESR1 и стандартизации описания обнаруженной молекулярной патологии. Это позволит актуализировать имеющиеся руководства для представления результатов тестирования ESR1 на цДНК в образцах жидкостной биопсии при HR+/HER2– мРМЖ [4].
Анализ жидкостной биопсии, основанный на изучении циркулирующих опухолевых клеток (англ. сirculating tumor cells, CTC) и цДНК, представляет собой инструмент для динамического молекулярного профилирования пациенток с РМЖ. Было проведено прямое сравнение мутаций PIK3CA (E545K – замена глутаминовой кислоты (E) на лизин (K) в позиции 545), H1047R – миссенс-мутация, аминокислота гистидин (H) заменяется на аргинин (R) на позиции 1047, missense mutation 1047) в EpCAM (англ. epithelial cell adhesion molecule; молекула клеточной адгезии эпителия) в CTC и парной цДНК из плазмы у пациенток с РМЖ. Авторы использовали высокочувствительный и специфичный анализ для выявления мутаций PIK3CA у 77 пациенток с рРМЖ и 73 пациенток с мРМЖ, а также у 40 здоровых доноров. Мутации PIK3CA в CTC и цДНК из плазмы сравнивались с ДНК, выделенной из CTC базы данных системы CellSearch® [21]. Результаты показали, что мутации PIK3CA в цДНК были обнаружены у 39 % пациенток с ранними стадиями и у 47,9 % пациенток с мРМЖ, тогда как у здоровых доноров мутации выявлены не были. Сравнение ДНК из системы CellSearch® и соответствующих плазменных образцов показало низкую согласованность при рРМЖ (около 48 %), но более высокую при мРМЖ (66,6 %). В некоторых случаях мутации PIK3CA были обнаружены в образцах, отрицательных по CTC в системе CellSearch®. Таким образом, обнаружение высокораспространенных мутаций PIK3CA в CTC и плазме цДНК при рРМЖ и мРМЖ обеспечивает дополнительную информацию для понимания заболевания [21].
Резистентность РМЖ к ЭТ, помимо мутаций в гормон-связывающем участке ERα, может наступить из-за характера взаимодействий между клетками рака и окружающей средой опухоли (англ. tumor microenvironment, TME). Исследователи провели эксперименты, где сочетали нормальные фибробласты (англ. normal fibroblasts, NF) и фибробласты из образцов РМЖ (англ. cancer-associated fibroblasts, CAF; опухоль-ассоциированные фибробласты) с клетками РМЖ MCF-7 (англ. Michigan Cancer Foundation; линия клеток рака молочной железы человека, полученная в Фонде по изучению рака штата Мичиган), которые прошли CRISPR (англ. clustered regularly interspaced short palindromic repeats; сгруппированные короткие палиндромные повторы с регулярными промежутками) – редактирование для выявления мутации Y537S (замена в лиганд-связывающем домене эстрогенового рецептора аминокислоты тирозин (Y) на серин (S) в позиции 537; replacement of the aminoacid tyrosine (Y) with serine (S) at position 537 in the ligand-binding domain of estrogen receptors). Использовались методы масс-спектрометрии и анализ Metacore. Кондиционированная среда (англ. conditioned medium, CM), содержащая мутантные клетки (англ. mutant cells, МС), повлияла на поведение NF и CAF. В общей сложности 198 белков оказались дерегулированными, среди них главная роль принадлежит белку YAP1 (англ. yes-associated protein 1; yes-ассоциированный белок 1), который стал центральным элементом в сети взаимодействий. Увеличение активности и количества белка YAP1 подтверждено в NF, обработанных CM с Y537S. Активация YAP1 перекрестно взаимодействует с рецептором фактора роста инсулина-1. Иммунодеплеция рецептора фактора роста инсулина уменьшает повышенную экспрессию YAP1. MС показали значительный рост и увеличение жизнеспособности при взаимодействии с NF и CAF-CM. В экспериментах на MС, связанных с CAF-CM, наблюдалось быстрое увеличение объема опухоли по сравнению с другими клетками. Влияние МС на превращение фибробластов в CAF обусловлено активностью YAP, которая может стать новым направлением лечения, особенно для пациенток с мРМЖ, у которых часто встречается мутация Y537S [22].
С целью изучения экспрессии и функции circRNA_000166 (англ. circular RNA inwhichthe 3' and 5' ends form a closed structure; кольцевая РНК, в которой 3'- и 5'-концы образуют замкнутую структуру) при РМЖ, а также понимания молекулярных механизмов действия и клинической значимости, были проанализированы уровни экспрессии circRNA_000166, miR-326 (англ. microRNA precursor family 326; семейство предшественников микроРНК 326), miR-330-5p (англ. microRNA precursor family 330-5p; семейство предшественников микроРНК 330-5p), мРНК и ELK1 (англ. ETS Like-1 белок Elk-1; транскрипционный фактор ETS E26). Результаты показали, что circRNA_000166 обладает высокой экспрессией в тканях молочной железы и продемонстрировала обратную корреляцию с уровнями miR-326/miR-330-5p, но положительную с уровнем мРНК ELK1. Чем выше экспрессия мРНК ELK1 в тканях, тем меньше уровень miR-326/miR-330-5p. Существенным оказалось то, что circRNA_000166 является мишенью miR-326 и miR-330-5p, а ELK1 – мишенью miR-326 и miR-330-5p в раковых клетках. Высокий уровень circRNA_000166 ассоциировался с увеличением размера опухоли, стадией по международной классификации стадий злокачественных новообразований TNM (англ. tumor, nodus, metastasis), с гистологическими характеристиками опухоли и наличием метастазов в лимфатических узлах, а низкие уровни – с ухудшением показателей выживаемости без прогрессирования и общей выживаемости у пациенток с РМЖ. В клетках РМЖ также выявлено высокое содержание circRNA_000166, при ее подавлении уменьшалась пролиферация и миграция клеток, а апоптоз усиливался через miR-326/ELK1 и miR-330-5p/ELK1 пути в лабораторных условиях [23].
При диагностике мРМЖ большую ценность имеет оценка PD-L1 для прогнозирования ответа на ингибиторы контрольных точек. TIL и PD-L1 могут быть оценены в соответствии с международными стандартами [24].
Примерно у 40–50 % пациенток с ТНРМЖ наблюдается полный патоморфологический ответ (ППО) после неоадъювантной химиотерапии (НАХТ). Определение биомаркеров, прогнозирующих ответ на НАХТ, может быть полезным для персонализации лечения. Высокая экспрессия Ki-67, PD-L1, TIL, особенно CD8+ Т-клеток, могут прогнозировать полную ремиссию РМЖ. Прогностическая модель, включающая совокупность опухолевых и иммунных маркеров, сможет улучшить стратификацию пациенток с ТНРМЖ по их ответу на НАХТ [25].
Согласно данным комплексного молекулярного исследования опухолей молочной железы человека TCGA, определены наиболее распространенные мутации генов в зависимости от подтипов РМЖ [26] (табл. 1).
Таблица 1. Подтипы рака молочной железы (РМЖ) и наиболее часто встречающиеся мутации генов [адаптировано из 26].
Table 1. Breast cancer (BC) subtypes and the most common gene mutations [adapted from 26].
|
Подтип РМЖ BC subtype |
Подтипы Subtypes |
Мутации в генах Gene mutations |
|
Люминальный А Luminal A |
ER+ и/или PR+, HER2– ER+ and/or PR+, HER2– |
PIK3CA (45 %), GATA-3 (14 %), MAP3KI (13 %), TP53 (12 %) |
|
Люминальный В Luminal B |
ER+ и/или PR+, HER2+ ER+ and/or PR+, HER2+ |
TP53 (29 %), PIK3CA (29 %), GATA-3 (15 %), CDH1 (5 %), MAP3KI (5 %), TBX3 (4 %), PTEN (4 %) |
|
HER2+ |
ER–, PR–, HER2+ |
TP53 (72 %), PIK3CA (39 %), CDH1 (5 %), PTEN (4 %) |
|
Базальноподобный Basal-like |
ER–, PR–, HER2– |
Мутации в генах TP53 (80 %), PIK3CA (9 %), GATA-3 (2 %) Mutations in genes TP53 (80 %), PIK3CA (9 %), GATA-3 (2 %) |
Примечание: MAP3KI – митоген-активируемая протеинкиназа киназы киназы (триплет протеинкиназ, участвующих в передаче сигнала клеточного ответа на стресс); GATA-3 – транскрипционный фактор, кодируемый геном GATA3, регулирует дифференцировку клеток; TBX3 – транскрипционный фактор T-box 3, играет роль в развитии молочной железы и эмбриогенезе; PTEN – фосфатаза и гомолог тенсина, утраченного на хромосоме 10 (продукт гена-супрессора опухолей PTEN), обладающая двойной субстратной специфичностью.
Note: MAP3KI – mitogen-activated protein kinase kinase kinases (a triple-kinase signaling cascade activated by stress); GATA-3 – transcription factor encoded by GATA3 gene, involved in cell differentiation; TBX3 – T-box transcription factor 3, implicated in breast development and embryogenesis; PTEN – phosphatase and tensin homolog deleted on chromosome 10, a tumor suppressor gene product with dual-specificity phosphatase activity.
Диагностика рака молочной железы / Breast cancer diagnosis
Золотым стандартом диагностики РМЖ является гистологическое исследование, но в некоторых случаях необходимо проводить иммуногистохимическое исследование. Оно особенно важно при дифференциальной диагностике протоковых и дольковых карцином, карциномы in situ и инвазивной, а также при оценке различных гиперплазий, метастазов, прогностических и терапевтических маркеров [27].
Стандартизованная диагностическая оценка гормональных рецепторов и HER2 на основе международных рекомендаций имеет решающее значение для определения подтипов РМЖ. Гистохимическая окраска для определения маркера пролиферации белка Ki-67 – MKI67 (англ. marker of proliferation Ki-6) может быть использована для различения между люминальными A и B-подобными РМЖ без профилирования генов [7].
Иммуногистохимическое исследование позволяет точно оценивать молекулярные подтипы, HER2, гормональные рецепторы, маркеры пролиферации Ki-67 и лимфоваскулярную инвазию, используя ERG (англ. Erythroblast Transformation-Specific Related Gene; ген, связанный с ETS), CD31 (англ. platelet/endothelial cell adhesion molecule 1; тромбоцитарная/эндотелиальная мишень, прикрепленная к молекуле 1), CD34 (англ. membrane protein, intercellular adhesion molecules; мембранный белок, молекула межклеточной адгезии), фактор VIII (англ. аntihemophilic globulin; антигемофильный глобулин) и подопланин. Диагностика зависит от конкретной ситуации, включая цитологическую характеристику и ее корреляцию с результатами гистологического исследования, что подчеркивает важность индивидуального подхода при оценке поражений молочной железы [7].
Системы, способные предоставить информацию о характеристике опухоли при исследовании венозной крови, представляют большой интерес в связи с простотой забора необходимого материала. Разнообразие растворимых индикаторов может предложить возможность не только оценить отдельные биомаркеры, но и их комбинации [8].
Среди преимуществ жидкостной биопсии перед обычной биопсией исследователи выделяют более точные данные при определении молекулярного профиля опухоли. Высокая специфичность материала позволяет определить прогноз и проводить мониторинг в реальном времени. Из недостатков отмечается высокая значимость правильного проведения процедуры забора материала, отсутствие четко определенных биопанелей, относительно низкая общая специфичность/чувствительность, особенно если рассматривать по отдельности. Количественная оценка на основе данных системы CellSearch® на сегодняшний день обладает самым высоким уровнем клинической валидации, так как она представляет собой надежный источник информации о текущих метастатических явлениях в отношении подсчета клеток и молекулярной характеристики [8].
Циркулирующие опухолевые клетки (CTC) характеризуются значительной гетерогенностью, их исследование на уровне отдельных клеток может предложить уникальные знания в отношении мутационного профиля и разнообразия субклонов, связанных с развитием опухоли. Одиночные клетки CTC, выделенные из образцов пациентки с ER+/HER2+ мРМЖ из системы CellSearch®, были подвергнуты амплификации всего генома с последующим обогащением минорных аллелей с помощью нуклеаз и перекрывающихся зондов (англ. minor alleles using nucleases and overlapping probes, NaME-PrO). Проведен анализ на аналитическую чувствительность и специфичность для одновременного обнаружения ряда мутаций: мутаций PIK3CA (E545K, E542K, H1047R, H1047L) и ESR1 (Y537S, Y537C, Y537N, D538G, L536H). Разработанный новый многомаркерный анализ с жидкой матрицей показал свою высокую специфичность и чувствительность, высокую производительность, заключающуюся в одновременном обнаружении мутаций с горячей точкой PIK3CA и ESR1 в единичных CTC. В перспективе возможно расширение одновременного обнаружения до 100 мутаций во многих генах, что позволит использовать данную методику для массового анализа CTC и цДНК [9].
Система DEPАrray для выделения одиночных клеток предлагает возможность получения растворов отдельных клеток. Технология использует принцип диэлектрофореза для создания электрического поля, которое захватывает взвешенные клетки в диэлектрофоретических клетках. Микроэлектродный массив затем заставляет захваченные клетки двигаться в запрограммированном направлении [28].
Стволовые клетки РМЖ (англ. breast cancer stem cells, BCSC) играют важную роль в образовании и рецидиве опухолей. Эти клетки выделяются своей способностью к самовоспроизведению и превращению в различные типы клеток, что делает их основной причиной неблагоприятных клинических результатов и низкой эффективности лечения. Существует несколько теорий о том, как возникают BCSC, одна из которых описывает в качестве причин генетические мутации в стволовых клетках, изменения клеточной пластичности посредством эпителиально-мезенхимального перехода и TME. Важно отметить, что не только клетки, но и сигнальные молекулы в TME могут воздействовать на способность BCSC к обновлению и их стойкость к терапии. Были созданы различные средства, такие как малые молекулы, антитела и Т-клетки с химерным антигенным рецептором, нацеленные на BCSC. Полученные результаты в сочетании с традиционными методами лечения в настоящее время оцениваются в рамках клинических испытаний. Информация о характеристиках BCSC, основных факторах и TME позволит изучить новые методы воздействия на механизмы превращения стволовой клетки в опухолевую и разработать методы лечения [29].
Иммунотерапия, ориентированная на блокаду белков PD-1/PD-L1, на данный момент считается основным методом лечения различных видов рака, включая ТНРМЖ. У пациенток с распространенным ТНРМЖ при выявлении более 1 % клеток с экспрессией PD-L1 добавление атезолизумаба к наб-паклитакселу может улучшить выживаемость. Наблюдается также корреляция между высоким уровнем TIL и реакцией на ингибиторы PD-1/PD-L1 у пациенток с РМЖ. Исследование TIL путем окрашивания гематоксилином и эозином демонстрируют специфичные диагностические результаты. TIL признаются значимым прогностическим фактором на ранних стадиях ТНРМЖ, их определение может стать стандартным параметром. Учитывая, что TIL и PD-L1 являются составляющими иммунного ответа при РМЖ, предлагается проводить комплексный анализ этих показателей для выделения групп пациентов, которым может быть проведена терапия с применением ингибиторов PD-1/PD-L1 [30].
В 2014 г. группа исследователей разработала метод для количественной оценки процента TIL в образцах РМЖ, окрашенных гематоксилином и эозином, используя световую микроскопию. Этот метод был детально описан, чтобы помочь другим исследователям воспроизвести их прогностические результаты, используя количество TIL при рРМЖ. На основе данного исследования была сформирована международная рабочая группа из специалистов по патологии молочной железы. Их задача состояла в стандартизации, проверке воспроизводимости и разработке методов улучшения количественной оценки процента TIL в образцах РМЖ. Благодаря их работе были собраны данные о TIL более чем из 20 тыс. первичных образцов РМЖ. Эти данные подтвердили связь между высоким уровнем TIL и более благоприятным прогнозом, особенно при HER2+ ТНРМЖ. В результате биомаркер TIL включен в несколько международных клинических рекомендаций по лечению. Это делает TIL первым биологическим прогностическим биомаркером для ранней стадии ТНРМЖ. Его прогностический эффект выражается линейно, уровни от 30 до 50 % рекомендуются для исследований по возможному снижению интенсивности химиотерапии [31].
Проведено исследование TME, включая PD-L1, Foxp3+ Treg (англ. forkhead box P3 positive regulatory T cells; регуляторные T-клетки, экспрессирующие транскрипционный фактор Foxp3) и количество TIL у пациентов с ТНРМЖ на ранних стадиях T1, T2 по международной системе классификации злокачественных опухолей TNM (англ. tumor, nodes, metastasis; опухоль, узел, метастазы). Количество TIL, Foxp3+ Treg и иммуногистохимическая экспрессия PD-L1 были исследованы во всех случаях до НАХТ, далее была проведена оценка в остаточных опухолях после операции. Высокая экспрессия TIL с одновременным снижением экспрессии PD-L1 и низким содержанием Foxp3+ Treg связана с благоприятным эффектом воздействия на опухоль. Комбинированные терапевтические подходы, направленные на блокаду PD-L1 и истощение регуляторных T-клеток, могут повысить эффективность лечения при ТНРМЖ [32].
При исследовании образцов первичной опухоли у пациенток с ранним ТНРМЖ анализировались TIL, PD-L1, CD8 (англ. сluster of differentiation 8; кластер дифференцировки 8) и Foxp3+ Treg. TIL были подтверждены как независимый прогностический фактор, PD-L1 предоставил наибольшую дополнительную прогностическую информацию в многомерных моделях, включая факторы возраста, стадии, морфологическую характеристику и TIL. В подгруппе пациенток с неоадъювантной химиотерапией Foxp3+ Treg также предоставил дополнительную прогностическую ценность. У пациенток, не достигших ППО после терапии, наблюдалось значительное повышение экспрессии CD8 и PD-L1. Таким образом, помимо классических факторов и TIL, иммунные биомаркеры PD-L1 и Foxp3+ Treg имеют ценность в прогностических моделях для раннего ТНРМЖ. Повышение PD-L1 после НАХТ поддерживает целесообразность тестирования ингибиторов иммунных контрольных точек [10].
Рекомендации Российского общества клинической онкологии указывают на обязательную оценку экспрессии рецепторов ER, PR, HER2, Ki-67 с приоритетом использования метода иммуногистохимии в рамках проведения диагностики опухолей молочной железы. Когда речь идет об оценке рецепторного статуса, предпочтительна оценка по шкале Allred, которая учитывает не только процент клеток ER+ и PR+, но и интенсивность их окрашивания. Итоговый балл для каждого рецептора определяется суммой пунктов за процент окрашенных клеток и интенсивность окраски. Если в опухоли меньше 10 % ядер окрашено по ER, такие опухоли считаются слабоположительными и могут иметь низкую чувствительность к гормональной терапии. Определение PR помогает получить полную информацию о рецепторном статусе, так как определение ER может быть ложноотрицательным. Если PR+, а ER–, рекомендуется повторное тестирование RP для исключения ложноположительных результатов при окрашивании [33].
Рекомендуется включение в патоморфологический анализ оценки совпадения результатов иммуногистохимии и гистологии. При расхождении результатов данных исследований рекомендуется пересмотреть результаты и при необходимости провести дополнительное тестирование или запросить мнение другого специалиста для уточнения иммунологического профиля опухоли. В случаях, когда результаты иммуногистохимического анализа HER2 оцениваются как сомнительные, рекомендуется использовать исследования типа in situ гибридизации – флуоресцентную гибридизацию, (англ. fluorescence in situ hybridization, FISH), хромогенную гибридизацию (англ. сhromogenic in situ hybridization, CISH) для подтверждения амплификации гена HER2 [33].
Введенная тройная классификация статуса HER2 – HER2–, HER2-low (низкая экспрессия) и HER2+ отражает новые подходы в терапии, так как точное определение уровня экспрессии HER2 важно для персонализации лечения пациентов. Последние рекомендации и достижения в области стандартизации тестирования на HER2-low направлены на повышение точности патоморфологических тестов, что важно для улучшения результатов лечения пациенток с HER2-low РМЖ. Искусственный интеллект может стать перспективным направлением для улучшения точности и согласованности определения HER2 патологоанатомами, что актуализировало обсуждения по вопросам качества контроля, новых достижений в понимании гетерогенности опухолей и роли искусственного интеллекта [34].
Лечение рака молочной железы / Breast cancer treatment
В Российской Федерации диагностика и лечение регламентируются клиническими рекомендациями «Рак молочной железы» 2023 г. [11].
В многоцентровом исследовании 3 фазы DESTINY-Breast04 оценивалась эффективность схемы трастузумаб+дерукстекан (T-DxD) при РМЖ с HER2– и HER2+. Исследование направлено на определение частоты HER2-low и сравнение прогноза с HER2–. В ретроспективном анализе 4918 пациенток с первичным РМЖ HER2– наблюдался у 64,4 %: из них были 58,1 % HR+ и 6,3 % HR–. Среди HER2– 13,9% были HR+ и 3,2 % HR. Группа HER2– подтипов демонстрировала больше неблагоприятных прогностических факторов по сравнению с HER2-low, независимо от HR-статуса. Хотя статистически значимых различий в прогнозе между HER2-low и HER2– не было, у пациенток с HER2-low прогноз был благоприятнее. Исследователи предполагают, что при выборе терапии для рРМЖ с HER2-low следует учитывать HR-статус пациенток [35].
Отдельное исследование было посвящено анализу взаимосвязи между выживаемостью без инвазивной опухоли и экспрессией белка HER2, амплификацией гена HER2, уровнями PD-L1, CD8 и наличием мутаций PIK3CA. Экспрессия HER2 в парных образцах была исследована до и после НАХТ. Отмечается, что адъювантный трастузумаб эмтанзин (T-DM1) снижал риск рецидива заболевания или смерти на 50 % по сравнению с трастузумабом у пациенток с резидуальным инвазивным РМЖ после неоадъювантной терапии, включавшей HER2-таргетную терапию и химиотерапию. Устойчивость к HER2 преодолевается с помощью T-DM1, при этом его эффективность не зависит от активации иммунной системы, однако влияние TME на степень ответа не исключено. Мутации PIK3CA не имели прогностического значения. После НАХТ в образцах наблюдалась повышенная вариабельность экспрессии HER2 по сравнению с парными образцами до НАХТ [36].
Добавление трастузумаба к НАХТ в 2,5 раза увеличивает долю пациенток с HER2+ РМЖ, у которых достигается ППО. У пациенток с ППО прогноз оценивается положительнее, чем у пациенток с остаточным заболеванием после неоадъювантной терапии. Воздействие трастузумаба и пертузумабана на путь HER2 может повысить частоту ППО. НАХТ трастузумабом в сочетании с пертузумабом повышает частоту полной ремиссии по сравнению с монотерапией трастузумабом и приводит к частоте полной ремиссии около 50–70 %. Трансляционные исследования являются многообещающими для дальнейшего отбора пациентов для HER2-таргетной терапии и разработки новой стратегии лечения, включая терапию, нацеленную на PI3K, и ингибиторы иммунных контрольных точек [37].
Исследования по оценке способности игольной биопсии предсказывать ППО после неоадъювантной терапии показали, что стандартизация и уточнения в процедуре биопсии (т. е. размер иглы, количество образцов и т. д.) имеют важное значение для разработки дальнейшей тактики у пациентов с ППО [37].
Стандартом лечения при мРМЖ/HER2– является ЭТ в сочетании с ингибитором циклин-зависимой киназы CDK4/6 (CDK4/6i). Мутации ESR1 могут ухудшить клиническую эффективность CDK4/6i, в то время как мутации PIK3CA могут служить негативным прогностическим маркером. Метастатический РМЖ трудно поддается лечению, несмотря на одобрение новых препаратов. Были описаны случаи, когда пациент получал несколько линий ЭТ + CDK4/6i и химиотерапию, но после каждой из них опухоль неуклонно прогрессировала, или лечение было прекращено из-за развития нежелательных явлений. На практике было проверено, что полностью пероральная комбинация элацестрант+алпелизиб в сочетании с предварительным лечением возможна, переносима и клинически эффективна у пациентов с мутациями ESR1 и PIK3CA. При использовании данной схемы удалось достигнуть значительного положительного эффекта в лечении метастатических поражений [7].
Изучалась эффективность неоадъювантной терапии трастузумаб эмтанзин + пертузумаб (P) после доцетаксела + карбоплатина + трастузумаба + пертузумаба (TCbHP) по сравнению со стандартной схемой TCbHP. Ранее сообщалось, что частота ППО после неоадъювантной терапии была выше при TCbHP с последующим T-DM1 + P. В исследовании был сделан акцент на оценку 5-летней безрецидивной выживаемости (англ. disease-free survival, DFS), отдаленной безрецидивной выживаемости (англ. distant disease-free survival, DDFS) и общей выживаемости (англ. overall survival, OS). В результате значимых межгрупповых различий для DFS, DDFS или OS не было обнаружено. Одинаково долгосрочный положительный прогноз показали TCbHP с последующим T-DM1 + P и T-DM1 + P с добавлением терапии антрациклинами в зависимости от ответа и изолировано TCbHP [38].
При введении трастузумаба эмтанзина в схему лечения после операции у пациенток с HER2+ РМЖ наблюдалось остаточное увеличение выживаемости без инвазивного заболевания. Были сделаны выводы, что показания к неоадъювантной терапии у пациенток с HER2+ РМЖ могут быть изменены, если сначала будет выполнено хирургическое лечение. В таких случаях данная схема может не дать положительных результатов [38].
Остро стоит вопрос о необходимости минимизировать токсичность, связанную с неоадъювантным лечением у пациенток с первичным РМЖ HER2+, а также улучшить показатели ППО, особенно при люминальном HER2+ заболевании. В рандомизированном исследовании фазы 2 Neopeaks сравнивались схемы TCbHP в разных группах пациенток. Группа А получала 6 циклов TCbHP, группа В – 4 цикла TCbHP с последующим проведением T-DM1 + P, группа С – 4 цикла T-DM1 + P. Одновременная гормональная терапия с T-DM1 + P назначалась в случае ER+. При отсутствии эффекта на терапию пациенты группы С были переведены на 5-фторурацил + эпирубицин + циклофосфамид (FEC; 4 цикла). Данные показали, что при неоадъювантном лечении частота ППО со стандартным режимом TCbHP → T-DM1+P была численно лучше, чем режим TCbHP в отдельности и значительно лучше у пациентов с ER+. Можно сделать вывод, что персонализация режима T-DM1+P может стать одним из подходов для минимизации токсичности при сохранении эффективности у пациентов с ER+ [39].
Заключение / Conclusion
Изучение молекулярно-генетических маркеров становится ключевым звеном для поиска и внедрения новых маркеров в ежедневную практику. Современные комбинации биомаркеров становятся основой для все более сложных диагностических алгоритмов.
Знание специфических генетических мутаций и полиморфизмов позволяет выделять пациентов с повышенной предрасположенностью к развитию РМЖ. Разработанные методы на основе молекулярных маркеров могут усовершенствовать скрининг, позволяя обнаружить рак на более ранних стадиях, когда лечение наиболее эффективно. Использование нескольких биомаркеров в комбинации предоставляет полную картину молекулярного профиля опухоли и позволяет выбрать оптимальную терапевтическую стратегию. Также генетические данные помогут врачу предположить, как пациент отреагирует на тот или иной вид лечения, включая химиотерапию и ЭТ, что также позволит разработать персонализированные схемы лечения.
Остро стоит вопрос о доступности исследований, расходных материалов и систем, необходимых для проведения углубленной диагностики РМЖ. При отсутствии аппаратуры и расходных материалов процесс ранней диагностики и лечения в сложных клинических случаях, а также разработка персонализированного подхода становится невозможной. По данной причине так необходимое снижение смертности от РМЖ не может быть достигнуто.
Персонализированный режим с практической точки зрения сложно выполним в связи с увеличением объема необходимых диагностических тестов, некоторые из которых могут быть не регламентированы в клинических рекомендациях. Ранее сформированные протоколы диагностики и лечения РМЖ должны периодически дорабатываться с учетом новейших исследований. Создание и внедрение персонализированной лечебной программы, несмотря на все плюсы, может занять много времени, и в результате лечение могло бы начаться позже, чем следовало. Необходимо разработать строгие стандарты и нормативные акты для проведения диагностических процедур, а также внедрить эффективные механизмы контроля их выполнения. Для повышения доступности проведения диагностических и лечебных манипуляций необходимо государственное финансирование и международное взаимодействие для обмена новейшей информации.
Список литературы
1. Злокачественные новообразования в России в 2023 году (заболеваемость и смертность). Под ред. А.Д. Каприна, В.В. Старинского, А.О. Шахзадовой. М.: МНИОИ им. П.А. Герцена – филиал ФГБУ «НМИЦ радиологии» Минздрава России, 2024. 276 с.
2. Kim D.H., Lee K.E. Discovering breast cancer biomarkers candidates through mRNA expression analysis based on The Cancer Genome Atlas Database. J Pers Med. 2022;12(10):1753. https://doi.org/10.3390/jpm12101753.
3. Venetis K., Pepe F., Pescia C. et al. ESR1 mutations in HR+/HER2-metastatic breast cancer: enhancing the accuracy of ctDNA testing. Cancer Treat Rev. 2023:121:102642. https://doi.org/10.1016/j.ctrv.2023.102642.
4. Guerini-Rocco E., Venetis K., Cursano G. et al. Standardized molecular pathology workflow for ctDNA-based ESR1 testing in HR+/HER2-metastatic breast cancer. Review Crit Rev Oncol Hematol. 2024:201:104427. https://doi.org/10.1016/j.critrevonc.2024.104427.
5. Мехтиева Н.И. Современные тенденции в диагностике и лечении первично операбельного рака молочной железы (обзор литературы). Опухоли женской репродуктивной системы. 2018;14(4):24–34. https://doi.org/10.17650/1994-4098-2018-14-4-24-34.
6. Tzanikou E., Markou A., Politaki E. et al. PIK3CA hotspot mutations in circulating tumor cells and paired circulating tumor DNA in breast cancer: a direct comparison study. Mol Oncol. 2019;13(12):2515–30. https://doi.org/10.1002/1878-0261.12540.
7. Bonacho T., Rodrigues F., J Liberal J. Immunohistochemistry for diagnosis and prognosis of breast cancer: a review. Biotech Histochem. 2020;95(2):71–91. https://doi.org/10.1080/10520295.2019.1651901.
8. Ravelli A., Reuben J.M., Lanza F. et al. Breast cancer circulating biomarkers: advantages, drawbacks, and new insights. Tumour Biol. 2015;36(9):6653–65. https://doi.org/10.1007/s13277-015-3944-7.
9. Stergiopoulou D., Georgoulias V., Markou A. et al. Development and validation of a multi-marker liquid bead array assay for the simultaneous detection of PIK3CA and ESR1 hotspot mutations in single circulating tumor cells (CTCs). Heliyon. 2024;10(19):e37873. https://doi.org/10.1016/j.heliyon.2024.e37873.
10. Dieci M.V., Tsvetkova V., Gaia Griguolo G. et al. Integration of tumour infiltrating lymphocytes, programmed cell-death ligand-1, CD8 and FOXP3 in prognostic models for triple-negative breast cancer: Analysis of 244 stage I-III patients treated with standard therapy. Eur J Cancer. 2020:136:7–15. https://doi.org/10.1016/j.ejca.2020.05.014.
11. Клинические рекомендации – Рак молочной железы – 2021-2022-2023 (20.01.2023). М.: Министерство здравоохранения Российской Федерации, 2023. 94 с. Режим доступа: https://cr.minzdrav.gov.ru/preview-cr/379_4. [Дата обращения: 15.01.2025].
12. Loibl S., Poortmans P., Morrow M. et al. Breast cancer. Lancet. 2021;397(10286):1750–69. https://doi.org/10.1016/S0140-6736(20)32381-3.
13. Зикиряходжаев А.Д., Сарибекян Э.К., Сухотько А.С., Трегубова А.В. Генетически-ассоциированный рак молочной железы. Профилактика и лечение. Медицинская генетика. 2019;18(10):3–9. https://doi.org/10.25557/2073-7998.2019.10.3-9.
14. Lin C.-L., Jin X., Ma D. et al. Genetic interactions reveal distinct biological and therapeutic implications in breast cancer. Cancer Cell. 2024;42(4):701–719.e12. https://doi.org/10.1016/j.ccell.2024.03.006.
15. De Talhouet S., Peron J., Vuilleumier A. et al. Clinical outcome of breast cancer in carriers of BRCA1 and BRCA2 mutations according to molecular subtypes. Sci Rep. 2020;10(1):7073. https://doi.org/10.1038/s41598-020-63759-1.
16. Loi S., Drubay D., Adams S. et al. Tumor-infiltrating lymphocytes and prognosis: a pooled individual patient analysis of early-stage triple-negative breast cancers. J Clin Oncol. 2019;37(7):559–69. https://doi.org/10.1200/JCO.18.01010.
17. André F., Ciruelos E., Rubovszky G. et al. Alpelisib for PIK3CA-mutated, hormone receptor-positive advanced breast cancer. N Engl J Med. 2019;380(20):1929–40. https://doi.org/10.1056/NEJMoa1813904.
18. Pohl-Rescigno E., Hauke J., Loibl S. et al. Association of germline variant status with therapy response in high-risk early-stage breast cancer: a secondary analysis of the GeparOcto Randomized Clinical Trial. JAMA Oncol. 2020;6(5):744–8. https://doi.org/10.1001/jamaoncol.2020.0007.
19. Herzog S.K., Fuqua S.A.W. ESR1 mutations and therapeutic resistance in metastatic breast cancer: progress and remaining challenges. Br J Cancer. 2022;126(2):174–86. https://doi.org/10.1038/s41416-021-01564-x.
20. Najim O., Seghers S., Sergoynne L. et al. The association between type of endocrine therapy and development of estrogen receptor-1 mutation(s) in patients with hormone-sensitive advanced breast cancer: a systematic review and meta-analysis of randomized and non-randomized trials. Biochim Biophys Acta Rev Cancer. 2019;1872(2):188315. https://doi.org/10.1016/j.bbcan.2019.188315.
21. Tokat U.M., Bilgiç S.N., Aydın E. et al. Elacestrant plus alpelisib in an ESR1 and PIK3CA co-mutated and heavily pretreated metastatic breast cancer: the first case report for combination efficacy and safety. Ther Adv Med Oncol. 2024:16:17588359241297101. https://doi.org/10.1177/17588359241297101.
22. Gelsomino L., Caruso A., Tasan E. et al. Evidence that CRISPR-Cas9 Y537S-mutant expressing breast cancer cells activate Yes-associated protein 1 to driving the conversion of normal fibroblasts into cancer-associated fibroblasts. Cell Commun Signal. 2024;22(1):545. https://doi.org/10.1186/s12964-024-01918-x.
23. Wang M.-H., Liu Z.-H., Zhang H.-X. et al. Hsa_circRNA_000166 accelerates breast cancer progression via the regulation of the miR-326/ ELK1 and miR-330-5p/ELK1 axes. Ann Med. 2024;56(1):2424515. https://doi.org/10.1080/07853890.2024.2424515.
24. Angelico G., Broggi G., Tinnirello G. et al. Tumor infiltrating lymphocytes (TILS) and PD-L1 expression in breast cancer: a review of current evidence and prognostic implications from pathologist's perspective. Cancers (Basel). 2023;15(18):4479. https://doi.org/10.3390/cancers15184479.
25. van den Ende N.S., Nguyen A.H., Jager A. et al. Triple-negative breast cancer and predictive markers of response to neoadjuvant chemotherapy: a systematic review. Int J Mol Sci. 2023;24(3):2969. https://doi.org/10.3390/ijms24032969.
26. The Cancer Genome Atlas Network. Comprehensive molecular portraits of human breast tumours. Nature. 2012;490(7418):61–70. https://doi.org/10.1038/nature11412.
27. Barzaman K., Karami J., Zarei Z. et al. Breast cancer: biology, biomarkers, and treatments. Int Immunopharmacol. 2020:84:106535. https://doi.org/10.1016/j.2020.106535.
28. Grüntkemeier L., Khurana A., Bischoff F.Z. et al. Single HER2-positive tumor cells are detected in initially HER2-negative breast carcinomas using the DEPArray™-HER2-FISH workflow. Breast Cancer. 2022;29(3):487–97. https://doi.org/10.1007/s12282-022-01330-8.
29. Zhang L., Chen W., Liu S. et al. Targeting breast cancer stem cells. Int J Biol Sci. 2023;19(2):552–70. https://doi.org/10.7150/ijbs.76187.
30. Gonzalez-Ericsson P.I., Stovgaard E.S., Sua L.F. et al. The path to a better biomarker: application of a risk management framework for the implementation of PD-L1 and TILs as immuno-oncology biomarkers in breast cancer clinical trials and daily practice. J Pathol. 2020;250(5):667–84. https://doi.org/10.1002/path.5406.
31. Loi S., Michiels S., Adams S. et al. The journey of tumor-infiltrating lymphocytes as a biomarker in breast cancer: clinical utility in an era of checkpoint inhibition. Ann Oncol. 2021;32(10):1236–44. https://doi.org/10.1016/j.annonc.2021.07.007.
32. Abdelrahman A.E., Rashed H.E., Toam M. et al. Clinicopathological significance of the immunologic signature (PDL1, FOXP3+ Tregs, TILs) in early stage triple-negative breast cancer treated with neoadjuvant chemotherapy. Ann Diagn Pathol. 2021:51:151676. https://doi.org/10.1016/j.anndiagpath.2020.151676.
33. Тюляндин С.А., Артамонова Е.В., Жукова Л.Г. и др. Практические рекомендации по лекарственному лечению рака молочной железы. Злокачественные опухоли. 2022;12(3s2–1):155–197. https://doi.org/10.18027/2224-5057-2022-12-3s2-155-197.
34. Liu Y. HER2-low breast cancer: insights on pathological testing. Transl Breast Cancer Res. 2023:4:15. https://doi.org/10.21037/tbcr-23-15.
35. Horisawa N., Adachi Y., Takatsuka D. et al. The frequency of low HER2 expression in breast cancer and a comparison of prognosis between patients with HER2-low and HER2-negative breast cancer by HR status. Breast Cancer. 2022;29(2):234–41. https://doi.org/10.1007/s12282-021-01303-3.
36. Denkert C., Lambertini C., Fasching P.A. et al. Biomarker data from the phase III KATHERINE study of adjuvant T-DM1 versus trastuzumab for residual invasive disease after neoadjuvant therapy for HER2-positive breast cancer. Clin Cancer Res. 2023;29(8):1569–81. https://doi.org/10.1158/1078-0432.CCR-22-1989.
37. Takada M., Toi M. Neoadjuvant treatment for HER2-positive breast cancer. Chin Clin Oncol. 2020;9(3):32. https://doi.org/10.21037/cco-20-123.
38. Takano T., Masuda N., Ito M. et al. Long-term outcomes of neoadjuvant trastuzumab emtansine + pertuzumab (T-DM1 + P) and docetaxel + carboplatin + trastuzumab + pertuzumab (TCbHP) for HER2-positive primary breast cancer: results of the randomized phase 2 JBCRG20 study (Neo-peaks). Breast Cancer Res Treat. 2024;207(1):33–48. https://doi.org/10.1007/s10549-024-07333-7.
39. Masuda N., Ohtani S., Takano T. et al. A randomized, 3-arm, neoadjuvant, phase 2 study comparing docetaxel + carboplatin + trastuzumab + pertuzumab (TCbHP), TCbHP followed by trastuzumab emtansine and pertuzumab (T-DM1+P), and T-DM1+P in HER2-positive primary breast cancer. Breast Cancer Res Treat. 2020;180(1):135–46. https://doi.org/10.1007/s10549-020-05524-6.
Об авторах
М. М. ОмаровРоссия
Омаров Махмуд Магомедович.
355017 Ставрополь, ул. Мира, д. 310
В. В. Трусова
Россия
Трусова Владислава Вячеславовна.
355017 Ставрополь, ул. Мира, д. 310
Л. М. Агабекян
Россия
Агабекян Лусине Масисовна.
355017 Ставрополь, ул. Мира, д. 310
И. Р. Газиев
Россия
Газиев Исмаил Рамазанович.
355017 Ставрополь, ул. Мира, д. 310
З. М. Алибекова
Россия
Алибекова Заира Магомедкаримовна.
355017 Ставрополь, ул. Мира, д. 310
Л. А. Айвазян
Россия
Айвазян Луиза Агабековна.
355017 Ставрополь, ул. Мира, д. 310
Э. А. Сафарова
Россия
Сафарова Элла Арамовна.
355017 Ставрополь, ул. Мира, д. 310
А. М. Аджигулова
Россия
Аджигулова Аина Махмудовна.
355017 Ставрополь, ул. Мира, д. 310
А. А. Дармилова
Россия
Дармилова Азарина Анзоровна.
355017 Ставрополь, ул. Мира, д. 310
Э. К. Ханмухометова
Россия
Ханмухометова Эльза Кельдимуратовна.
355017 Ставрополь, ул. Мира, д. 310
И. Р. Иванова
Россия
Иванова Инна Романовна.
355017 Ставрополь, ул. Мира, д. 310
В. И. Пигарева
Россия
Пигарева Валерия Игоревна.
355017 Ставрополь, ул. Мира, д. 310
Что уже известно об этой теме?
► Собранные наборы данных в Атласе генома рака выявляют основополагающие данные для идентификации новых биомаркеров рака молочной железы (РМЖ). По последним данным были выявлены 14 матричных РНК (мРНК) с пониженной экспрессией и 6 мРНК с повышенной экспрессией. Современные генетические исследования РМЖ сосредоточенны на генах BRCA, PALB2, ATM, CHEK2, RAD51C, RAD51, BARD1 и TP53.
► Введенная тройная классификация статуса рецептора эпидермального фактора роста 2-го типа (HER2) – HER2-low (низкая экспрессия) и положительный HER2+ отражает новые подходы в терапии, так как точное определение уровня экспрессии HER2 важно для персонализации лечения пациентов.
► Опухоль-инфильтрирующие лимфоциты (TIL) признаются значимым прогностическим фактором на ранних стадиях трижды негативного РМЖ (ТНРМЖ); их определение может стать стандартным параметром.
Что нового дает статья?
► Количественная оценка циркулирующих опухолевых клеток (CTC) на основе баз данных системы CellSearch® обладает самым высоким уровнем клинической валидации и является надежным источником информации о текущих метастатических поражениях в отношении подсчета клеток и молекулярной характеристики. Использование подобных систем позволяется проводить мониторинг в реальном времени, определять отдельные биомаркеры и их комбинации.
► TIL, PD-L1, и Foxp3+ Treg были подтверждены как независимые прогностические факторы РМЖ. Соматические мутации PIK3CA являются предиктором ответа на ингибиторы PI3K при метастатическом РМЖ ER+ и HER2–. TIL является первым биологическим прогностическим биомаркером для ранней стадии ТНРМЖ. Определяется связь между высоким уровнем TIL и более благоприятным прогнозом.
► Предшествующая эндокринная терапия ингибиторами ароматазы, тамоксифеном, фулвестрантом может привести к мутации ESR1 и резистентности к терапии. Полностью пероральная комбинация элацестранта + алпелизиб в сочетании с предварительным лечением клинически эффективна у пациентов с мутациями ESR1 и PIK3CA.
Как это может повлиять на клиническую практику в обозримом будущем?
► В перспективе возможно расширение одновременного обнаружения до 100 мутаций во многих генах и может применяться для массового анализа CTC и циркулирующей опухолевой ДНК.
► Информация о характеристиках стволовых клеток РМЖ, основных факторах и опухолевого микроокружения позволит изучить новые методы воздействия на механизмы превращения стволовой клетки в опухолевую и разработать методы лечения.
► Комплексный анализ TIL и PD-L1 может быть применен для выявления показаний к терапии с применением ингибиторов PD-1/PD-L1.
Рецензия
Для цитирования:
Омаров М.М., Трусова В.В., Агабекян Л.М., Газиев И.Р., Алибекова З.М., Айвазян Л.А., Сафарова Э.А., Аджигулова А.М., Дармилова А.А., Ханмухометова Э.К., Иванова И.Р., Пигарева В.И. Молекулярно-генетические маркеры рака молочной железы: современные достижения в понимании этиологии, прогностической ценности и терапевтических возможностей. Акушерство, Гинекология и Репродукция. 2025;19(4):575-589. https://doi.org/10.17749/2313-7347/ob.gyn.rep.2025.631
For citation:
Omarov M.M., Trusova V.V., Agabekyan L.M., Gaziev I.R., Alibekova Z.M., Aivazyan L.A., Safarova E.A., Adzhigulova A.M., Darmilova A.A., Khanmukhometova E.K., Ivanova I.R., Pigareva V.I. Molecular genetic markers of breast cancer: current advances in understanding the etiology, prognostic value, and therapeutic opportunities. Obstetrics, Gynecology and Reproduction. 2025;19(4):575-589. (In Russ.) https://doi.org/10.17749/2313-7347/ob.gyn.rep.2025.631

Контент доступен под лицензией Creative Commons Attribution-NonCommercial-ShareAlike 4.0 International License.











































