Перейти к:
Систематический компьютерный анализ фармакологии фумарата железа в контексте лечения дефицита железа и железодефицитной анемии
https://doi.org/10.17749/2313-7347/ob.gyn.rep.2025.632
Аннотация
Введение. Современная терапия железодефицитной анемии (ЖДА) предполагает использование наиболее безопасных и эффективных способов компенсации дефицита железа (ДЖ). Важным направлением терапии и профилактики ЖДА является пероральный прием солей железа с анионами органических кислот. Фумарат железа, будучи солью двухвалентного железа и аниона фумаровой кислоты (метаболит цикла Кребса), усваивается в организме посредством кодируемых генами молекулярных механизмов, специализированных для взаимодействий именно с фумарат-анионом.
Цель: систематизация фундаментальных и клинических исследований о фармакологии фумарата железа для лечения ДЖ с использованием тополого-метрических методов интеллектуального анализа данных.
Результаты. Представлены результаты систематизации исследований по фармакологии фумарата железа (более 500 статей), проведена рубрикация всех имеющихся публикаций. Детально описаны результаты наиболее важных направлений исследований фармакологии фумарата железа: (1) сравнительная фармакология фумарата железа и других форм железа; (2) влияние различных солей железа на гемосидероз тканей; (3) синергизм фумарата железа с фолатами и другими микронутриентами; (4) влияние состояние микробиома и улучшение всасывания фумарата железа пребиотиками; (5) клиническая практика применения фумарата железа в терапии ЖДА у женщин всех возрастных групп.
Заключение. Фумарат-содержащие препараты показаны в тех условиях, когда требуется весомая субстратная поддержка ключевых звеньев аэробного и анаэробного энергетического обмена на разных уровнях от митохондрий и клеток до целого организма и имеется потребность в мобилизации сигнально-регуляторных адаптивных реакций. Прием препаратов солей фумарата внутрь может оказывать мягкое и более безопасное воздействие. При аэробном и гипоксическом течении энергетического обмена, что характерно для ДЖ, соли фумарата могут проявить себя как эффективные противострессовые и противогипоксические средства.
Ключевые слова
Для цитирования:
Громова О.А., Торшин И.Ю., Тетруашвили Н.К. Систематический компьютерный анализ фармакологии фумарата железа в контексте лечения дефицита железа и железодефицитной анемии. Акушерство, Гинекология и Репродукция. 2025;19(2):230-249. https://doi.org/10.17749/2313-7347/ob.gyn.rep.2025.632
For citation:
Gromova O.A., Torshin I.Yu., Tetruashvili N.K. Systematic computer analysis of iron fumarate pharmacology in the treatment of iron deficiency and iron deficiency anemia. Obstetrics, Gynecology and Reproduction. 2025;19(2):230-249. (In Russ.) https://doi.org/10.17749/2313-7347/ob.gyn.rep.2025.632
Введение / Introduction
Железодефицитная анемия (ЖДА) встречается у 20–80 % беременных (в разных популяциях) и подразумевает снижение концентрации гемоглобина в крови на фоне уменьшения числа и размера эритроцитов. Наиболее важным биохимическим показателем дефицита железа (ДЖ) и ЖДА является уровень гемоглобина. Легкая степень ЖДА у беременных характеризуется снижением гемоглобина до 90–110 г/л, средняя – от 89 до 70 г/л, тяжелая – 69 г/л и менее [1]. Для терапии ЖДА необходимо использовать эффективные и безопасные препараты железа, которые отличаются низкой токсичностью, хорошим всасыванием внутрь клеток, нейтральными органолептическими свойствами, замедленным высвобождением железа из лекарственной формы, что обеспечивает оптимальное усвоение железа, возможность использования препарата железа в малых дозах и доказанной клинической эффективностью. Исходя из вышесказанного, органические соли железа с наименьшей токсичностью представляют наибольший интерес для широкой клинической практики [2][3]. Однако в медицинской литературе наблюдается дефицит сведений о фармакокинетике и фармакодинамике таких лекарственных субстанций и лекарственных препаратах на их основе. Данная работа призвана сократить разрыв между теоретическими знаниями и реальной клинической практикой при использовании органической соли железа – фумарата железа.
Интерес к фумарату как к лиганду для переноса ионов железа обусловлен тем, что фумарат-анион (фумаровая кислота) является неотъемлемой частью метаболома каждой клетки. Фумарат вырабатывается из сукцината в комплексе цепи переноса электронов с помощью фермента сукцинатдегидрогеназы и является обязательным промежуточным продуктом цикла Кребса, в котором синтезируется аденозинтрифосфат (АТФ) (рис. 1).
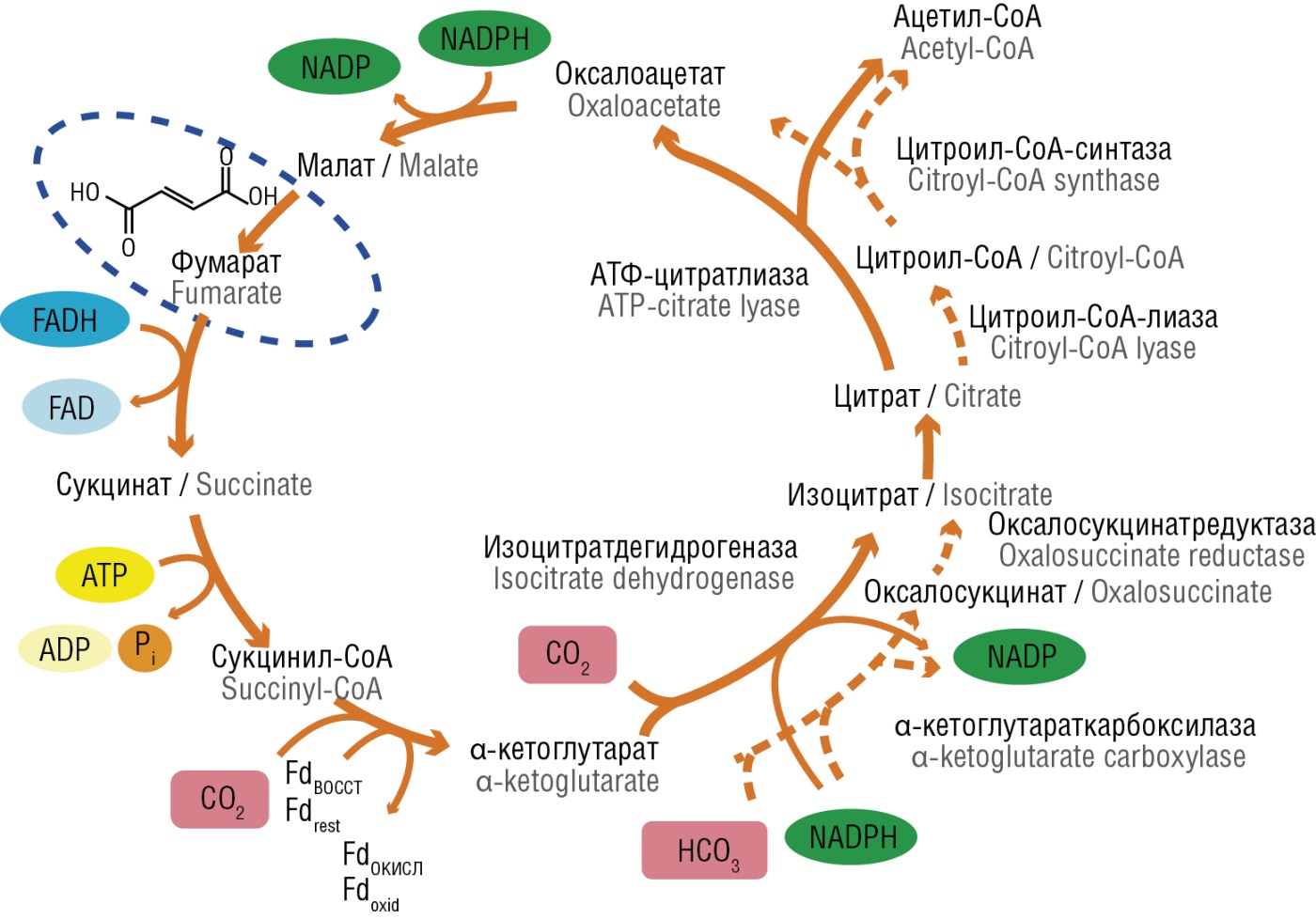
Рисунок 1. Цикл Кребса и участие в нем фумарата [рисунок авторов].
Примечание: NADP – никотинамидадениндинуклеотидфосфат; NADPH – никотинамидадениндинуклеотидфосфат восстановленный; FAD – флавин-адениндинуклеотид; FADH – флавинадениндинуклеотид восстановленный; ATP – аденозинтрифосфат; ADP – аденозиндифосфат; Pi – фосфат-анион; Fdвосст – ферредоксин восстановленный; Fdокисл – ферредоксин окисленный; CO2 – углекислый газ; HCO3 – гидрокарбонат анион.
Figure 1. Tricarboxylic acid cycle and fumarate role therein [drawn by authors].
Note: NADP – nicotinamide adenine dinucleotide phosphate; NADPH – reduced nicotinamide adenine dinucleotide phosphate; FAD – flavin adenine dinucleotide; FADH – reduced flavin adenine dinucleotide; ATP – adenosine triphosphate; ADP – adenosine diphosphate; Pi – phosphate anion; Fdrest – reduced ferredoxin; Fdoxid – oxidized ferredoxin; CO2 – carbon dioxide; HCO3 – bicarbonate anion.
Фумаровая кислота также является продуктом цикла мочевины, отличается крайне низкой токсичностью – доза препарата, летальная для 50 % животных в группе при однократном приеме, измеряется в мг/кг массы тела (lethal dose 50 %, LD50), составляет 10000 мг/кг per os для крыс, проявляет противовоспалительные и антиоксидантные эффекты [4]. Поскольку фумарат-анион – часть метаболома, то в протеоме человека и других организмов имеются специальные транспортные системы для переноса фумарата, способствующие ускоренному и контролируемому всасыванию в клетки фумарата железа. Фумарат железа, особенно в сочетании с витаминами (в частности, с фолиевой кислотой), является важной формой железа для использования в терапии и профилактике ЖДА.
Цель: систематизация фундаментальных и клинических исследований о фармакологии фумарата железа для лечения ДЖ с использованием тополого-метрических методов интеллектуального анализа данных.
Материалы и методы / Materials and Methods
Методами топологического анализа данных был изучен массив из имеющихся к настоящему времени публикаций по фумарату железа, проведена алгоритмическая систематизация 553 публикаций по фундаментальным и клиническим исследованиям фумарата железа, найденных и отобранных в соответствии с запросом «"ferrous fumarate" OR "iron fumarate" OR (iron AND fumarate AND supplement)» в базу биомедицинских публикаций PubMed/MEDLINE, и 33 публикации по ключевому слову «фумарат железа», найденные в eLibrary. Для нахождения наиболее информативных ключевых слов было проведено сравнение с контрольной выборкой из 586 текстов, случайно выбранных из 731 публикаций, найденных по запросу, включающему типичные ключевые слова, не имеющие отношения к фумарату железа: запрос «Humans [MeSH Terms] AND Drug Combinations [MeSH Terms] AND (Administration, Oral [MeSH Terms] OR Dietary Supplements [MeSH Terms] OR Diet [MeSH Terms] OR Food, Fortified [MeSH Terms]) AND (Treatment Outcome [MeSH Terms] Double-Blind Method [MeSH Terms] OR Prospective Studies [MeSH Terms] OR Risk Factors [MeSH Terms] OR Patient Compliance [MeSH Terms] OR Follow-Up Studies [MeSH Terms])». Эти массивы публикаций анализировались с использованием тополого-метрических методов интеллектуального анализа данных [5][6].
Для исключения текстов, носящих выражено манипулятивный характер (см. работу [7], в которой математически точно определено данное научное понятие), массив публикаций был проверен системой AntiFake (www.antifake-news.ru). В результате было идентифицировано только 25 публикаций с выраженно отрицательными значениями бета-балла (менее 0, см. описание процедуры расчета в работе [7]), т. е. публикаций, в которых манипулятивный контент преобладал над содержательным. Типичным примером таких публикаций являлись отдельные «метаанализы», содержащие десятки грубых ошибок и основанные на полном непонимании основ фармакологии, математической статистики и анализа данных; публикации иноагентов наподобие USAID, в которых представители якобы «развитых» англосаксонских стран описывают положение дел с анемией в развивающихся странах; исследования, направленные на агрессивную коммерциализацию устаревших и токсичных форм железа и др. Данные «исследования» отличались многочисленными нарушениями основ фармакологии, клинической медицины, биохимии и анализа данных и поэтому, вследствие очевидно низкого научного качества, были исключены из дальнейшего рассмотрения.
В ходе систематического анализа массива публикаций были выделены 52 информативных биомедицинских термина, отличающих публикации по фармакологии фумарата железа от контрольной выборки публикаций (см. выше). Аннотация полученных терминов в соответствии с международной номенклатурой молекулярно-биологических процессов (англ. Gene Ontology, GO) позволила рубрицировать исследования фармакологии фумарата железа следующим образом. Экспертный анализ полученных терминов позволил выделить наиболее интересные, на наш взгляд, направления исследований фармакологии фумарата железа:
- сравнительная фармакология фумарата железа и других форм железа;
- влияние различных солей железа на гемосидероз тканей;
- синергизм фумарата железа с фолатами и другими микронутриентами;
- состояние микробиома и улучшение всасывания фумарата железа пребиотиками;
- практика применения фумарата железа в терапии ЖДА у беременных.
Результаты / Results
Фармакология фумарата и других солей железа / Pharmacology of iron fumarate and other iron salts
Фумарат железа хорошо переносится и отличается благоприятными значениями показателя LD50 острой токсичности у различных животных. Например, при пероральном однократном приме LD50 фумарата железа у мышей равно 1570 мг/кг, у крыс – 3850 мг/кг. Сравнение LD50 различных солей железа при введении per os белым мышам показало, что фумарат железа характеризуется наиболее низкой токсичностью: LD50 фумарата железа – 630 мг/кг, сульфата железа – 230 мг/кг, глюконата железа – 430 мг/кг [2][8]. Напомним также, что LD50 < 500 мг/кг указывает на высокую токсичность, LD50 500–1000 мг/кг – на умеренную, а LD50 1000–2000 мг/кг – на низкую токсичность.
Умеренная токсичность (ближе к низкой), согласно классификации, приведенной выше, позволяет использовать данную соль даже в высоких дозах без каких-либо существенных побочных эффектов. Прием фумарата железа per os оказывал благоприятное действие на анемию, увеличивая запасы железа в организме 150 пациентов, перенесших острое неварикозное кровотечение из верхних отделов желудочно-кишечного тракта (ЖКТ). Использование фумарата железа у пациентов не оказывало значительного влияния на частоту побочных эффектов и не снижало приверженность пациентов к терапии. Пациент считался ответившим на лечение (респондер), если повышение гемоглобина превышало 20 г/л, или если к концу лечения у пациента отсутствовала ЖДА. Доля респондеров была выше в группе принимавших фумарат железа (73 %), чем в контроле (без приема препаратов железа – 46 %; отношение рисков (ОР) = 2,98; р = 0,004) [9].
В реальной клинической практике фумарат железа не уступает другим органическим солям железа по степени повышения уровня гемоглобина у пациентов с анемическими состояниями. Сравнительная оценка различных органических солей железа per os при лечении ЖДА была проведена как наблюдательное клиническое исследование у участников с исходным уровнем гемоглобина 70–100 г/л (n = 260). Пациенты получали фумарат железа, аскорбат железа или бисглицинат железа. Уровень гемоглобина был значительно повышен во всех группах: аскорбат железа (118,6 ± 0,9 г/л; р < 0,0001), фумарат железа (117,2 ± 0,8 г/л; р < 0,0001), бисглицинат железа (116,9 ± 1,1 г/л; р = 0,0003) по сравнению с исходным уровнем наряду с хорошим профилем переносимости [10].
Сравнение с другими формами железа: полимальтозные смеси / Comparison with other iron forms: polymaltose mixtures
Так называемое «полимальтозное железо», несмотря на повсеместное применение, не имеет четкого фармакологического описания. С химической точки зрения, полисахариды сами по себе проявляют слишком слабые кислотные свойства, чтобы образовывать комплексы с железом, характеризующиеся долговременной стабильностью. В случае пероральных форм, скорее всего, подразумевается смесь оксидов и гидроксидов железа с полимальтозным полимером или (что маловероятно) метастабильные комплексы ионов железа с фрагментами полимальтозы.
С экспертной точки зрения, так называемый «железа сахаринат», как и другие схожие субстанции [11], представляет собой полимер сахарозы и гидроксида железа (III). В растворе эти 2 компонента находятся вместе, но ковалентно (т. е. посредством химических связей) не связаны друг с другом. Более того, не найдено исследований, однозначно подтверждающих комплексообразование между ионом железа и остатками сахаров. Поэтому не вполне очевидно, является ли так называемый «железа сахаринат» реальным веществом или просто смесью двух веществ – полимеров сахарозы и гидроксида железа. Кроме того, «сахарированный гидроксид железа» может вызывать остеомаляцию при длительном применении вследствие нефропатии, приводящей к дисфункции костной ткани [12].
У здоровых добровольцев (n = 49) было проведено сравнение показателей пероральной абсорбции 200 мг элементарного железа из двухвалентного фумарата железа или 200 мг железа из полимальтозной формы трехвалентного железа. При приеме фумарата железа натощак наблюдалось значительное и статистически значимое увеличение концентраций железа в плазме крови (рис. 2) как у женщин (исходно: 17 ± 4 мкмоль/л, через 4 часа: 35 ± 12 мкмоль/л), так и у мужчин (исходно: 21 ± 7 мкмоль/л, через 4 часа: до 33 ± 11 мкмоль/л). При приеме полимальтозной формы не было установлено никакого значимого увеличения содержания железа в плазме крови [13].
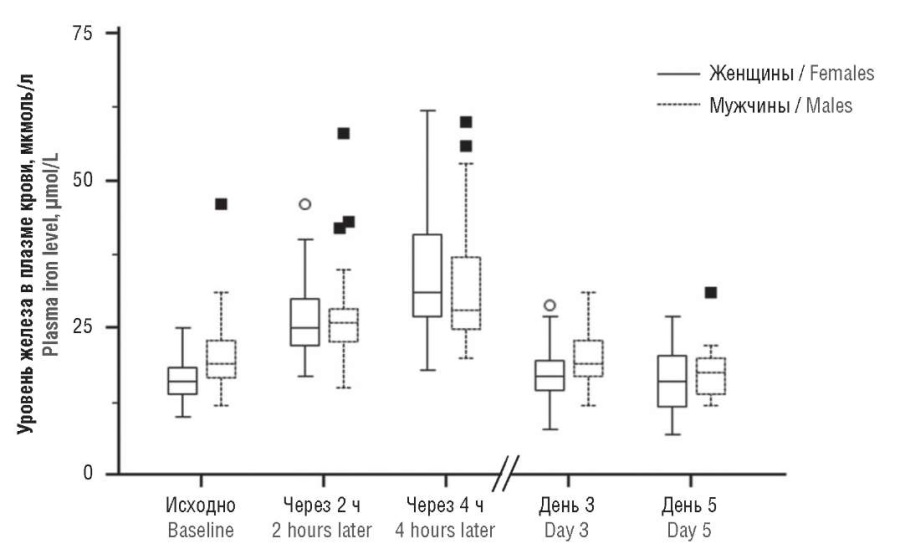
Рисунок 2. Динамика концентраций железа в плазме крови после приема двухвалентного фумарата железа [адаптировано из 13].
Примечание:  и
и  – выбросы.
– выбросы.
Figure 2. Dynamics of plasma iron level changes after divalent iron fumarate administration [adapted from 13].
Note:  and
and  – outliers.
– outliers.
Пероральный прием фумарата железа (50 мг/сут, 8 недель) у пациентов с легкой формой ЖДА (содержание гемоглобина < 120 г/л и ферритина < 100 нг/мл), находящихся на гемодиализе (ГД) и получавших лечение активатором эритропоэтина (n = 51), привел к достоверному повышению уровня биоактивной формы гормона-регулятора обмена железа гепсидина (гепсидин-25), значений ферритина и среднего корпускулярного объема эритроцитов (англ. mean corpuscular volume, MCV). Сравнение групп респондентов и нереспондентов показало, что гепсидин-25, MCV, ферритин и насыщение трансферрина были изначально ниже у респондентов, чем у не-респондентов [14].
Анализ 4 клинических случаев беременных с ЖДА показал, что пероральный прием гидроксида железа в химической смеси с полимальтозой не только не повысил концентрацию железа в крови, но и был причиной стойкой ЖДА при родах [15]. Клинические случаи, подобные данному исследованию, наглядно иллюстрируют опасность использования неорганических форм железа. Несмотря на соблюдение пациентками режима лечения полимальтозного железа в течение достаточно длительного времени, уровень гемоглобина не повышался. К тому времени, когда это заметили, беременность была уже на поздней стадии, и до родов оставалось всего несколько недель. Пациенток перевели на фумарат/сукцинат железа, что увеличило содержание гемоглобина, хотя на момент родов у женщин все еще наблюдался дефицит железа [15].
Неэффективность перорального приема полимальтозного железа была показана в исследовании 241 пациента с ЖДА, из них 75 были с устойчивой ЖДА. Пациенты получали полимальтозное железо в течение 4–14 месяцев в дозах 178–356 мг в расчете на элементное железо. В результате ЖДА сохранилась у большинства пациентов (медианные уровни гемоглобина в группе составили 103 г/л). После этого пациентам был назначен пероральный прием фумарата железа (1–14 месяцев), в результате которого медианный уровень гемоглобина в группе пациентов возрос до 125 г/л (p = 0,01) [16].
Сравнение с сульфатом железа / Comparison with iron sulfate
К сожалению, большинство врачей предполагает, что если некоторый препарат зарегистрирован как лекарственное средство (ЛС), то он автоматически «высокого качества», «эффективен и безопасен». Глубина заблуждения, возникающего вследствие подобного мышления, особенно ярко видна в случае железосодержащих комплексов, зарегистрированных как ЛС. В то же время некоторые химические смеси, зарегистрированные как ЛС, могут содержать высокотоксичный сульфат железа (FeSO4).
Сульфат железа, также известный как железный купорос, является одной из самых старых форм железа, которые нашли применение в фармакотерапии ЖДА. Для этой и для других неорганических форм железа характерны общие недостатки, создающие проблемы при клиническом применении: отталкивающие органолептические свойства, низкая биодоступность, раздражение слизистой ЖКТ, что может не только вызвать прекращение терапии, но и приводить к долговременным повреждениям ЖКТ [17][18].
Сульфат железа характеризуется выраженными прооксидантными свойствами. В эксперименте прием сульфата железа per os беременными крысами с анемией приводил к повреждению печени и к повышению показателей окислительного стресса в системе «мать-плацента-плод» [19]. Сравнение прооксидантной активности водорастворимого FeSO4, маслорастворимого фумарата железа и нерастворимого оксида железа (Fe3O4) in vitro показало, что сульфат железа проявлял наиболее сильный прооксидантный эффект. Образующиеся под воздействием FeSO4 активные формы кислорода (АФК) запускают цепную реакцию образования свободных радикалов, способствуя окислению липидов [20].
В исследовании 2010 г. представлен детальный анализ безопасности применения устаревших фармацевтических препаратов на основе сульфата железа: среди различных форм железа сульфат железа отличался максимальной токсичностью [21]. Например, в 1991 г. Академия токсикологии США сообщила о 3578 случаях отравления сульфатом железа у детей до 6 лет. При этом летальность составила 25 % (конечно же, в данном случае речь идет о сверхвысоких дозах сульфата железа – граммах) [21].
Сульфат железа является жестким раздражителем ЖКТ, вызывающим интенсивное слущивание и некроз эпителия кишечника. Вследствие того, что сульфат железа вызывает сильное раздражение и в некоторых случаях ожог ЖКТ, такая «терапия» может приводить к усилению кровоточивости слизистой ЖКТ и к дальнейшим потерям железа через микрокровоизлияния. Особенно опасны такие кровоизлияния у лиц пожилого возраста, так как провоцируют тяжелую анемию [21]. Побочные эффекты от приема сульфата железа наблюдались в очень широком диапазоне клинических проявлений: от диареи, тошноты и рвоты до аллергии, нейротоксичности и анафилактического шока [21]. Известно, что при приеме внутрь сульфат железа может вызывать повреждения пищевода, сфинктеров, выраженную ульцерацию ротовой полости, провокацию инфекционных заболеваний, осложнения со стороны кожи (сыпь, раздражение) [21].
Наблюдение за 453 женщинами, принимавшими препараты железа во II–III триместрах беременности, показала, что сульфат железа обладал наибольшим количеством побочных эффектов; из-за побочных эффектов, включивших запоры и тошноту, 83 женщины прекратили прием препарата [22]. В свете результатов многочисленных исследований, цитированных в работе [21] (и еще более многочисленных исследований, которые не были процитированы), весьма странно выглядят самоуверенные заявления вроде «железа сульфат представляет собой эталонное по эффективности и безопасности средство, предназначенное для профилактики как латентно протекающей, так и явной железодефицитной анемии», или вроде «сульфат железа – наилучшая форма двухвалентного железа».
Приведем пример очевидно ошибочного анализа переносимости различных пероральных дотаций железа, проведенного под видом «систематического обзора» и показавшего аномальные результаты, противоречащие основам школьной химии. Согласно тексту публикации, сульфат железа «с мукопротеозой» имел самую низкую частоту побочных эффектов (ПЭ) [23]. В данной публикации ошибочно утверждается, что частота ПЭ составила 7 % для протеинсукцинилата железа, 24 % для сульфата железа глицината, 31 % для глюконата железа, 32 % для сульфата железа без мукопротеозы и 47 % для фумарата железа. Данная публикация, названная авторами «систематическим обзором», содержит такое множество методологических, фармакологических, диагностических и логических ошибок (подмены понятий, манипуляция данными с целью получения желаемого результата, игнорирование прерывания терапии и различий в тяжести побочных эффектов и т. п.), что подробный анализ всех этих ошибок явно заслуживает отдельной статьи.
Приведем лишь некоторые данные. В данный обзор, как утверждают авторы, было включено 111 исследований с данными по 10695 пациентам. В их выводах обращает на себя внимание, что сульфат железа с мукопротеозой имел самую низкую частоту ПЭ – 4,1 % для всех ПЭ и 3,7 % для желудочно-кишечных ПЭ; сукцинилат протеина железа – 7,3 % для всех ПЭ и 7,0 % для желудочно-кишечных ПЭ; сульфат глицина железа – 23,5 % для всех ПЭ и 18,5 % со стороны ЖКТ; глюконат железа – 30,9 % для всех ПЭ и 29,9 % со стороны ЖКТ; сульфат железа без мукопротеозы – 32,3 % для всех ПЭ и 30,2 % со стороны ЖКТ; фумарат железа – 47,0 % для всех ПЭ и 43,4 % со стороны ЖКТ [23].
При анализе текста публикации, ошибочно называемой «систематическим обзором», обнаружилось, что, во-первых, из всех 111 исследований с участием фумарата железа было только 11, и они содержали информацию лишь о 757 пациентах, что в разы меньше по сравнению с количеством проанализированных пациентов на сульфате железа [23].
Напомним, что систематический обзор, согласно принятым критерия качества, это тщательный и структурированный анализ всех доступных исследований по конкретной теме с использованием заранее определенных критериев, а в рассматриваемой публикации были отобраны не все исследования. Поскольку настоящий обзор представляет весьма однобокую информацию, то, таким образом, все материалы публикации [23], включая таблицы, являются, очевидно, ложными данными из разновидности «fake news» [7].
Во-вторых, бóльшая часть данных по фумарату железа, которые аккумулирует этот обзор, относится к середине прошлого столетия (60–90-е годы XX века), когда использовались высокие дозы препаратов, и на рынке не были широко распространены современные лекарственные формы с технологией пролонгированного высвобождения. Заметим также, что в одном из исследований обычные таблетки фумарата железа сравнивались с препаратом сульфата глицина железа – ferrous glycine sulphate ('Ferrocontin' Continus) с контролируемым высвобождением, что, конечно, не выдерживает критики [24]; при этом исследователи исключили из анализа все публикации, в которых добавки железа были cкомбинированы с фолиевой кислотой, были частью поливитаминов или применялись вместе с другими методами лечения (например, эритропоэтином), «чтобы избежать неправильного результата по ПЭ» [23].
Мы проанализировали все исследования, вошедшие в обзор; общий вывод большинства из них, в которых изучался фумарат железа, звучит следующим образом: «…не было существенных различий в частоте побочных эффектов между группами препаратов железа (р > 0,05)» [23], что делает вывод авторов обзора тем более не заслуживающим доверия специалистов. Авторы одного из исследований делают следующее заключение: «различные соединения железа имеют одинаковую частоту и одинаковый тип ПЭ при введении одинакового количества элементарного железа. Эти наблюдения делают маловероятным, что существуют соединения железа, которые переносятся лучше, чем сульфат железа» [23], что на настоящий момент выглядит казуистично и еще раз подчеркивает низкое качество публикации.
Важно отметить, что применение технологии модифицированного высвобождения при производстве лекарственных средств обеспечивает их хорошую переносимость, что подтверждается тестом сравнительной кинетики растворения, который позволяет прогнозировать скорость высвобождения действующего вещества как in vitro, так и in vivo. Особо подчеркнем, что результаты данного некорректно выполненного и не актуального на сегодня анализа не могут быть применимы для современных комбинированных лекарственных препаратов фумарата железа с синергидными компонентами, например, фолиевой кислотой в лекарственной форме с замедленным высвобождением [24].
Органолептическая оценка 3 различных форм железа проводилась в группе матерей и их новорожденных. Прикорм с лучшим принятием детьми и их матерями был обогащен фумаратом железа (61–80 %) либо малоэффективным восстановленным железом (63–68 %). Прикорм с сульфатом железа показал наихудшие результаты с точки зрения органолептики и у детей и у матерей (рис. 3) [25].

Рисунок 3. Процент участников, оценивших детское питание или напитки как «очень понравившиеся» с добавлением различных источников железа: восстановленного железа (Fe), сульфата железа (С) и фумарата железа (F) [25].
Примечание: А, B – результаты тестирования продуктов питания со вкусовой добавкой «ваниль» или «банан»; тестирование проводилось на продуктах детского питания у детей (А1, В1), у матерей (А2, В2) и напитков у матерей (А3, В3).
Figure 3. Percentage of participants rating baby foods or beverages as 'like very much' fortified with reduced iron (Fe), iron sulfate (С), and iron fumarate (F) [25].
Note: A, B – results of rating baby food products flavored with vanilla or banana, respectively; testing was conducted assessing baby food products by children (A1, B1) and/or beverages by paired mothers (A2, B2 or A3, B3, respectively).
Приверженность к лечению у пациентов, получавших per os капли, содержащие сульфат железа, была ниже (64 %), чем у пациентов, получавших порошкообразную смесь фумарата железа с витаминами в саше (84 %; р = 0,001) [25].
Сравнительное клиническое исследование эффективности и комплаентности пациентов к приему препаратов железа беременными (n = 204) было проведено для фумарата железа и сульфата железа. В течение 3 месяцев вне зависимости от формы железа (фумарат или сульфат) женщинам с уровнем гемоглобина более 110 г/л назначали 100 мг/сут элементного железа; женщинам с уровнем гемоглобина менее 110 г/л назначали 200 мг/сут элементного железа. Прием фумарата железа показал более высокую приверженность пациенток к лечению, чем прием сульфата железа. Также для фумарата железа установлено значимо большее увеличение уровня гемоглобина (+7,9 г/л в среднем по группе), чем для сульфата железа (+4,4 г/л; р < 0,05) [26].
Проведено сравнительное исследование эффективности фумарата железа (150 мг/сут элементного железа в сочетании с 1,5 мг/сут фолиевой кислоты, курс 21–42 дня) и сульфата железа (200 мг/сут элементного железа) для лечения и профилактики ЖДА у 60 женщин репродуктивного возраста (18–47 лет). У большинства пациенток, получавших фумарат железа с фолиевой кислотой, отмечено в 1,7 раз более эффективное купирование анемии по сравнению с сульфатом железа: повышение уровня гемоглобина на 32 % (сульфат железа: +19 %), значений ферритина в среднем на +35 % (сульфат железа: +21 %) [27].
Влияние различных солей железа на отложения гемосидерина / Effect of various iron salts on hemosiderin deposits
В норме железо внутри клеток и тканей хранится посредством специальных гранул ферритина. Процесс накопления и перераспределения железа контролируется активностью более чем 200 белков протеома человека, вовлеченных в гомеостаз железа. При нарушениях обмена железа (при дефиците или при перегрузке железом, вызванной приемом низкоусвояемых и токсичных неорганических форм железа) интенсифицируется процесс гемосидероза тканей (нерегулируемое, но постоянное отложение нанодисперсных окислов железа).
Гемосидероз тканей проявляется как нежелательное «прокрашивание» тканей, вызванное приемом тех или иных соединений железа. Для теста на железо в тканях в гистологии используется реакция Перльса. В некоторых случаях гемосидероз может наблюдаться визуально напрямую, без использования гистологических реактивов. Например, прокрашивание тканей зуба под воздействием растворов солей железа наглядно иллюстрирует гемосидероз тканей без весьма сложных гистологических процедур.
Рандомизированное исследование in vitro показало, что фумарат железа вызывает меньшее повреждение эмали зубов, чем сульфат железа, когда зубы подвергаются воздействию напитков, дополненных либо фумаратом железа, либо сульфатом железа. В данном исследовании 120 блоков эмали каждого из молочных или постоянных зубов были однородно подготовлены и поровну разделены (n = 60) для соответствующей обработки напитками на группу 1 (2 ммоль/л сульфата железа) и группу 2 (2 ммоль/л фумарата железа). Каждая группа была далее разделена на 3 подгруппы: кока-кола, спрайт и минеральная вода (n = 10). Образцы подвергались трем повторяющимся циклам соответствующей обработки в течение 5-минутного периода инкубации, равномерно разделенных 5-минутным хранением в искусственной слюне. Спектрофотометрическая оценка вывода кальция и фосфата обнаружила бóльшую потерю при добавлении 2 ммоль/л сульфата железа, чем фумарата железа (р < 0,005). Среднее снижение микротвердости поверхности зуба было меньше при использовании фумарата железа, чем при использовании сульфата железа (р < 0,005). Статистические сравнения выявили максимальную поверхностную микротвердость и потерю минералов при использовании первичной эмали и максимальную потерю во всех группах при использовании кока-колы, содержащей существенные количества фосфорной кислоты (р < 0,005) [28].
В другом исследовании зубов in vitro оценивалось влияние различных солей железа на деминерализацию и изменение цвета эмали молочных резцов. Исследованы здоровые молочные центральные резцы, удаленные в течение месяца из-за чрезмерной подвижности. Сульфат железа, фумарат железа, цитрат аммония железа и глюконат железа (пищевой фиксатор окраски E579, используется для имитации цвета «черных» оливок) добавлялись как в солевой раствор, так и в кариесогенные растворы. Растворы обновлялись каждые 2 дня в течение 14 дней. Изменение цвета образцов, подвергнутых тестированию, было больше, чем изменение цвета зубов в контроле (солевой раствор), особенно в случае сульфата железа. Зубы, подвергнутые воздействию солей железа, также характеризовались многочисленными трещинами и другими дефектами, которые были максимальны в группе сульфате железа (рис. 4) [29].
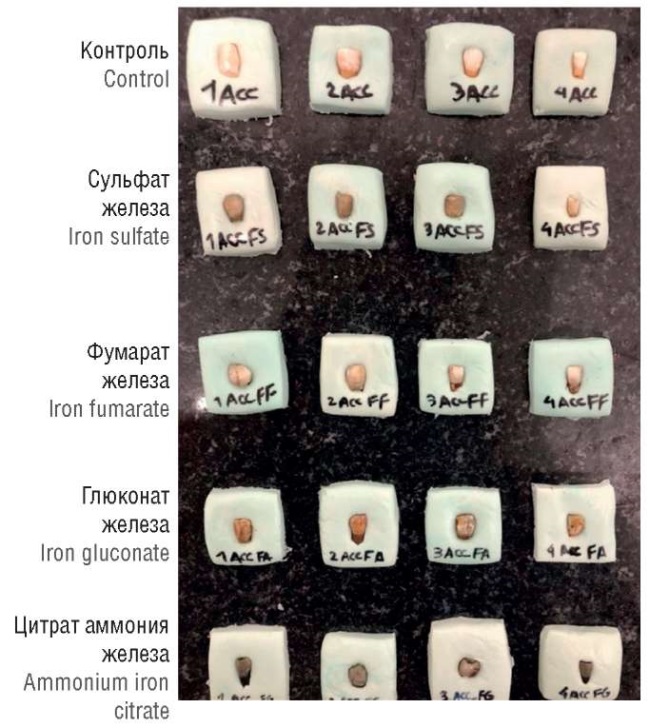
Рисунок 4. Примеры изменения цвета зубов под воздействие органических и неорганических солей железа в условиях добавления кариесогенного раствора. В качестве контроля использовался только кариесогенный раствор без добавления каких-либо форм железа [29].
Figure 4. Representative tooth color change after exposure to organic and inorganic iron salts added in cariogenic solution. Control group: exposure to cariogenic solution lacking any iron forms [29].
Электронно-микроскопические фотографии показали, что количество и глубина трещин во всех 4 группах солей железа, подвергнутых воздействию кариесогенного раствора, были больше, чем в группах с солевым раствором (рис. 5). Количество трещин было наибольшим в группе сульфата железа, за которой следовали цитрат аммония железа, фумарат железа и глюконат железа, в порядке убывания частоты в обеих средах [29].

Рисунок 5. Микрофотографии, полученные с помощью сканирующей электронной микроскопии образцов, подвергшихся воздействию различных солей железа и кариесогенного раствора [29].
Figure 5. Scanning electron microimaging of specimens exposed to various iron salts and cariogenic solution [29].
Синергизм фумарата железа с фолатами / Iron fumarate-folates synergism
Систематический анализ фундаментальных и клинических исследований показал, что осуществление биологических функций железа в организме человека невозможно без синергидных железу факторов, таких как фолаты, ионы меди, цинка, кальция, марганца, кобальта и магния, витамины В2, РР, А, С, В6, В12, тетрагидробиоптерин. Прием многокомпонентных витаминно-минеральных комплексов (ВМК) в течение всей беременности является важным фактором профилактики ЖДА. Такие ВМК должны содержать адекватную форму и дозировку органических форм железа (прежде всего, в фумарата железа) [30].
Фолаты (витамин В9) являются, пожалуй, одним из наиболее важных синергистов железа, так как проявляют и фармакокинетический синергизм (усиление всасывания железа клетками и тканями) и фармакодинамический синергизм (совместное участие в кроветворении и в других физиологических процессах). В работе [31] представлены результаты системно-биологического анализа синергизма между железом и фолатами. И фолаты и железо необходимы для биосинтеза и осуществления биологических эффектов глутатиона. Анализ симптоматики и молекулярной патофизиологии ЖДА показал, что фолаты являются несомненным синергистом железа в осуществлении эритропоэза. Дефициты фолатов и железа характерны для дисфункции щитовидной железы и для гипергликемии.
Экспериментальное исследование крыс с дефицитом железа показало, что добавление фолиевой кислоты к фумарату железа повышало уровень железа в сыворотке крови и MCV [32]. Дотации фумарата железа, фолиевой кислоты, цинка и витаминов A, C и D3 повышали биосинтез линолевой кислоты и α-линоленовой кислоты у младенцев по сравнению с плацебо [33].
Дотации железа в виде фумарата железа (100 мг элементарного железа) в сочетании с фолиевой кислотой, витамином B12 и с аскорбиновой кислотой в течение 6 недель улучшали значения гемоглобина, гематокрита, объема и ширины распределения эритроцитов, ферритина и трансферрина с достижением контрольных уровней гемоглобина, приемлемых для донорской сдачи крови [34].
Рандомизированное клиническое исследование показало, что микрокапсулированный фумарат железа в низких дозах (12,5, 20 или 30 мг/сут, 8 недель) в сочетании с 160 мкг фолиевой кислоты, 30 мг аскорбиновой кислоты, 300 ЭР* витамина А, 5 мг глюконата цинка, 7,5 мкг витамина D3 (в виде холекальциферола) достоверно улучшает гематологические показатели у детей 6–18 месяцев с анемией (n = 133) по сравнению с применением препарата на основе сульфата железа (12,5 мг/сут). Через 8 недель встречаемость ЖДА существенно снизилась во всех группах, кроме группы получавших сульфат железа. Приверженность терапии была значительно ниже в группе сульфата железа даже при самых низких дозах этой неорганической соли (64 %) по сравнению с группами «фумарат железа + витамины» (84 %; р < 0,05). Более сильное окрашивание зубов и бóльшая частота отказов от терапии были зарегистрированы в группе сульфата железа по сравнению со всеми остальными группами. Самая низкая доза фумарата железа (12,5 мг элементного железа) была тем не менее достоверно эффективна у детей с анемией [35].
Следует также отметить, что сочетание ионов железа с антиоксидантами (фолиевая кислота или другие витамины, органические анионы наподобие фумарата и др.) естественным образом ингибирует окисление железа (II) до железа (III). Анализ состояний железа в железосодержащих фармацевтических продуктах с использованием Мессбауэровской спектроскопии ⁵⁷Fe показал, что соединения железа в препаратах не однородны и не всегда точно соответствуют заявленным производителем. В частности, в ряде продуктов наблюдалось присутствие соединений железа (II) и железа (III), тогда как производители заявляют только о содержании Fe(II) [36], что указывает либо на недостаточное техническое качество процесса производства, либо на начавшееся окисление соли железа (прежде всего, прооксидантного сульфата железа).
Синергизм фумарата железа с другими микронутриентами / Synergism between iron fumarate and other micronutrients
Аскорбиновая кислота усиливает всасывание железа из фумарата железа. Аскорбиновая кислота, проявляющая восстанавливающие и хелатирующие свойства, эффективна для усиления всасывания негемового железа. Стимулирование всасывания железа в присутствии аскорбат-аниона более выражено в пище, содержащей ингибиторы всасывания железа (фитаты, жиры и др.). Пищевые продукты, содержащие низкие и средние уровни таких ингибиторов, требуют добавления аскорбата в молярном соотношении 2:1 (например, 20 мг аскорбата + 3 мг железа) [37].
Рандомизированное 12-недельное исследование пациентов с неосложненной ЖДА (n = 12) показало, что фумарат железа per os в сочетании с фолиевой кислотой, аскорбиновой кислотой и цианокобаламином более эффективен, чем полисахаридная форма железа с аскорбиновой кислотой [38].
Витамин А и β-каротин улучшают усвоение железа из фумарата железа, особенно на фоне фитатов и полифенолов, которые ингибируют усвоение железа. Группа добровольцев (n = 174) была обследована для выяснения взаимодействий витамина А и/или β-каротина с ингибиторами усвоения железа из базового завтрака, содержащего хлеб, либо из 100 г предварительно приготовленной кукурузной муки, либо из 100 г белой пшеничной муки, 50 г сыра и 10 г маргарина. Хлеб, приготовленный из коммерческой муки, обогащенной железом в виде фумарата железа и витаминов, был помечен либо посредством изотопа ⁵⁵Fe, либо изотопа ⁵⁹Fe. Установлено, что процент усвоения железа из завтрака, приготовленного из предварительно приготовленной кукурузной муки (обогащенной витамином А), подаваемой отдельно и с различными концентрациями кофе, был практически одинаковым. В то же время усвоение железа из завтрака, приготовленного из пшеничной муки, снизилось с 6 %, когда завтрак давался отдельно, и до 2 % и ниже, когда завтрак давался с различными концентрациями кофе [39]. Таким образом, для лучшего усвоения железа кофе следует пить через некоторое время (30–40 мин) после приема железосодержащих продуктов.
Дальнейшие эксперименты с использованием предварительно приготовленной кукурузной и пшеничной муки, обогащенной только фумаратом железа, продемонстрировали, что витамин А подавляет действие полифенола и частично подавляет действие фитатов на усвоение железа. Дотации витамина А (ретинола) увеличили усвоение железа в 3 раза из рисовой муки, в 2,4 раза из пшеничной муки и в 1,8 раза из кукурузной муки. Бета-каротин также увеличил усвоение железа в 3 раза из муки этих 3 злаков, обогащенной фумаратом железа [39].
Витаминно-минеральные комплексы, содержащие фумарат железа, характеризуются меньшим количеством побочных эффектов и лучшей приверженностью к терапии ЖДА у женщин в послеродовом периоде (n = 453). В исследовании N. Melamed с соавт. наиболее часто для лечения ЖДА использовался ВМК с фумаратом железа (46,8 %; р < 0,01), реже использовались ВМК с сульфатом железа (31,8 %), полимальтозной формой железа (12,4 %) и с бисглицинатом железа (7,3 %). Почти половина участниц (45 %) сообщили по крайней мере об одном неблагоприятном эффекте, особенно о запоре (27 %; р < 0,01) и тошноте (11 %). ВМК с фумаратом железа характеризовались наименьшим количеством побочных эффектов по сравнению с другими формами железа (23,7 %; р < 0,01) [22].
В двойном слепом рандомизированном перекрестном исследовании показано, что при приеме одинаковых количеств фумарата железа (180 мг элементарного железа) в сочетании с другими микронутриентами (300 мг витамина С, 3 мг фолиевой кислоты, 10 мкг витамина В12, 5 мг витамина В6, 0,2 мг сульфата меди, 6 мг молибдата натрия, 1 мг магния сульфата) площадь под фармакокинетической кривой «концентрация–время» железа в сыворотке крови достоверно повышалась на 29 % (3564 мкг×ч/100 мл, только фумарат железа: 2764 мкг×ч/100 мл; р < 0,05) [40], что свидетельствует об отсутствии негативного влияния на фармакокинетический профиль фумарата железа.
Комбинации с другими препаратами / Combinations with other medications
Производители отдельных гормональных препаратов включают соли железа в контрацептивы. Обзор железосодержащих оральных контрацептивов (англ. iron-containing oral contraceptives, ICOC) и их влияние на гемоглобин и биомаркеры статуса железа утверждает, что в 21 такой комбинированный препарат чаще всего включали 25 мг элементарного железа в виде фумарата железа [41].
Фумарат железа и микробиом кишечника / Iron fumarate and intestinal microbiome
Одним из важных аспектов фармакологического действия любых фармацевтических препаратов является их воздействие на микробиом (микрофлору) кишечника – совокупность бактерий-симбионтов и бактерий-комменсалов. Токсичный сульфат железа, вызывающий ожоги слизистой кишечника, также токсичен и для микробиома. Например, микробиомное профилирование нескольких солей железа показало, что FeSO4 достоверно снижал индекс разнообразия микробиоты по сравнению с органической солью железа. Более того, FeSO4 способствовал повышению уровней патогенных Fusobacteria, коррелирующих с триглицеридами и с формированием атеросклеротических изменений сосудов [42]. В то же время прием фумарата железа (65,7 мг/сут, 21 сут) не оказывал отрицательного влияния на микробиом женщин репродуктивного возраста (18–45 лет; n = 80) [43].
Нарушения микробиома могут отрицательно сказываться на всасывании железа из соли с фумаровой кислотой. Гематологический ответ на дотации железа снижен у детей в возрасте 1–10 лет (n = 86) с бессимптомной инфекцией Helicobacter pylori. Половина пациентов принимала фумарат железа (20 мг/сут), другая половина – плацебо. В начале исследования не было различий между группами в значениях гемоглобина (112,0 ± 12,6 и 113,0 ± 12,0 г/л), гематокрита (34,0 ± 3,5 и 35,0 ± 3,2 %) и ферритина (23,8 ± 21,0 мкг/л). После 8 недель дотаций железа у H. pylori-отрицательных детей средний уровень гемоглобина был на 5,3 г/л выше (95 % доверительный интервал (ДИ) = 1,59–9,00), как и значения гематокрита (+1,4 %; 95 % ДИ = 0,2–2,6) по сравнению с детьми с положительным результатом теста на H. pylori, хотя средний уровень ферритина статистически значимо улучшился как у детей с положительным результатом теста на H. pylori, так и у детей с отрицательным результатом теста на H. pylori [44].
Поэтому важным способом повышения всасывания железа из фумарата железа является совместный прием препарата железа с пребиотиками – соединениями, которые способствуют росту нормофизиологической, полезной микробиоты, тормозя рост бактериальных патогенов.
Об улучшении всасывания фумарата железа пребиотиками / Regarding improving prebiotics-related iron fumarate absorption
Пребиотики галактоолигосахариды (ГОС) и фруктоолигосахариды (ФОС) улучшают всасывание железа из фумарата железа, особенно в исследованиях женщин с низкими запасами железа и у младенцев с ЖДА. Усиливающий эффект пребиотиков на всасывание железа зависит от типа пребиотика, дозы, частоты и регулярности приема пребиотика и соединений железа, а также возраста и воспалительного статуса пациента [45].
Галактоолигосахариды и олигосахариды материнского молока (ОГМ) по-разному влияют на усвоение железа из фумарата железа у младенцев из Кении (n = 55; 8–12 мес). В рандомизированном исследовании когорта обследованных была разделена на следующие группы: 1) 5,0 мг железа в виде ⁵⁴Fe-меченого фумарата железа; 2) 5 мг железа в виде ⁵⁸Fe-фумарата и 3,0 г ГОС (Fe-фумарат+ГОС); 3) 5 мг железа (Fe-фумарат+ОГМ). Фракционное всасывание железа в группе Fe-фумарат+ГОС (22,2 %) было выше, чем в группе Fe-фумарат (12,5 %; р = 0,005). В то же время всасывание железа в группе Fe-фумарат+ОГМ составило 13,3 % (95 % ДИ = 7,1–24,4 %) и не отличался от группы Fe-фумарат (р = 0,9) [46].
Исследования стабильного изотопа железа у женщин с дефицитом железа (n = 46; средний возраст 22 года, средний индекс массы тела – 21,3 кг/м²) показали, что потребление пребиотика ГОС увеличивает усвоение железа из фумарата железа, но не из сульфата железа и не из пирофосфата железа. Фракционное всасывание железа (ФВА) измерялось из 14 мг элементарного железа, меченого стабильными изотопами. Прием 7000 мг ГОС значительно увеличил ФВА фумарата железа (+26 %; р = 0,039), тогда как прием 3500 мг ГОС не увеличил (р = 0,130). ГОС не увеличил ФВА FeSO4 (р = 0,998) или Fe-пирофосфата (р = 0,059). ФВА фумарата железа, данного с ГОС и с аскорбиновой кислотой, было значительно выше по сравнению с фумаратом железа, данным только с ГОС (+30 %; р < 0,001) [47].
Спирулина в сочетании с фумаратом железа улучшает состояние кишечной микробиоты. Геномный анализ (секвенирование генов 16S рибосомальной РНК) показал, что спирулина и фумарат железа изменяют состав, разнообразие и богатство кишечных микробных сообществ кишечника. Относительное обилие преобладающих типов Firmicutes и Verrucomicrobia показало значительные изменения. Преобладающими полезными родами с выраженными различиями в обилии были Flavobacterium, Aeromonas и Brevinema [48].
Наиболее распространенные филумы включали Bacteroidetes, Proteobacteria, Actinobacteria и Verrucomicrobia в группе спирулины. Однако Proteobacteria, Bacteroidetes, Firmicutes и Fusobacterium были наиболее доминирующими в группе смеси спирулины и фумарата железа. Обилие Firmicutes в группе смеси спирулины и фумарата железа было значительно выше (максимально к концу эксперимента через 6 нед), чем в группе спирулины. Обилие Verrucomicrobia в группе спирулины было значительно выше, чем в контрольной группе и в группе смеси спирулины и фумарата железа (рис. 6). Эти изменения профиля микробиома соответствуют торможению роста патогенных бактерий родов Pseudomonas и Aeromonas на 3-й неделе применения диеты и особенно к концу эксперимента через 6 нед (столбцы диаграммы «2» и «3» на рис. 6А).
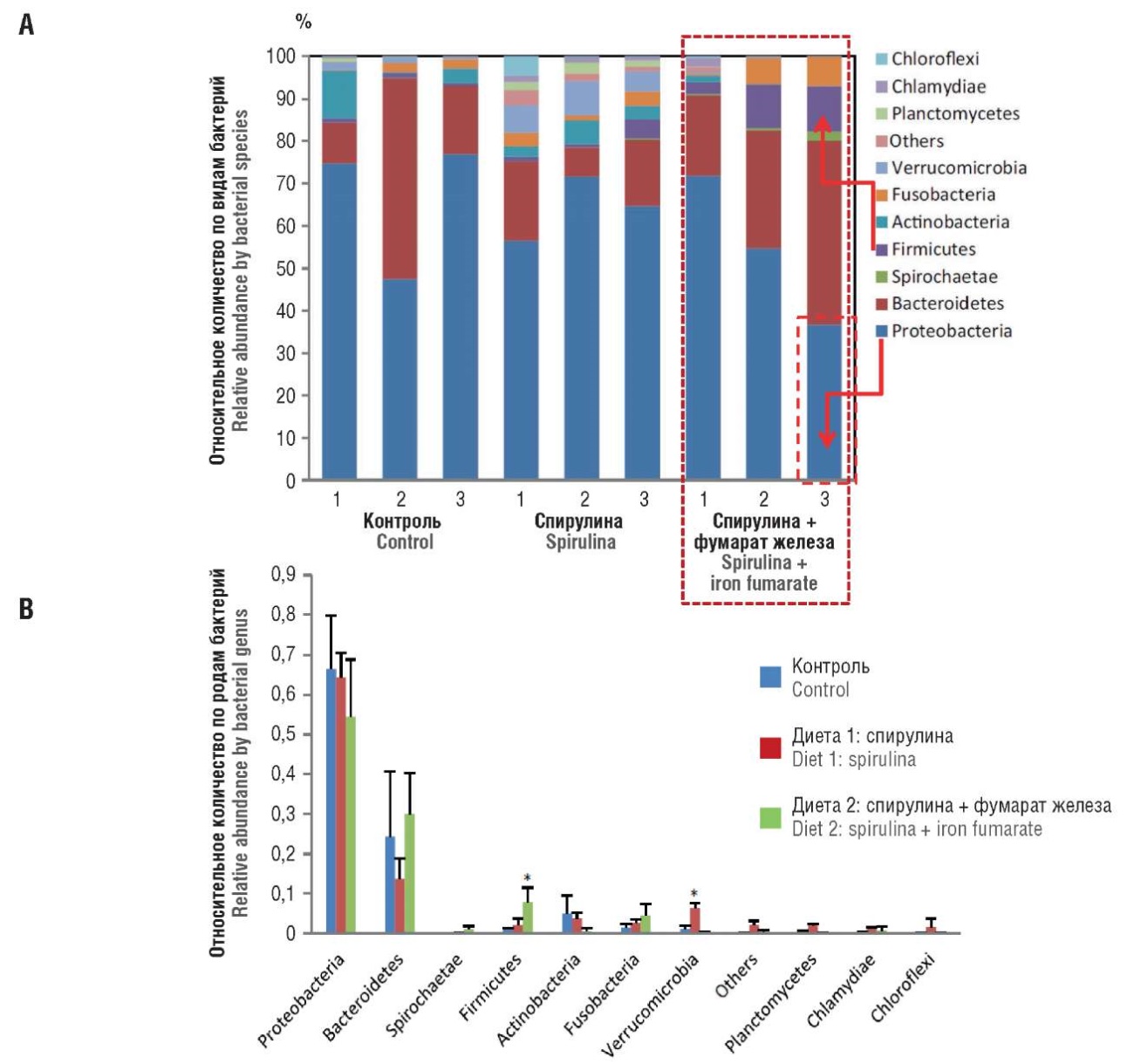
Рисунок 6. Относительное обилие 10 основных типов в фекальной микробиоте между контрольной и экспериментальной обработанной рыбой; анализ различных типов в фекальной микробиоте в динамике – исходно (1), в середине (2) и в конце (3) эксперимента: А – анализ по видам бактерий, В – анализ по родам бактерий [48].
Примечание: *р < 0,05 статистическая значимость различий между этапами эксперимента.
Figure 6. Temporal relative abundance of 10 major faecal microbiota phylum composition in control and experimental treated fish at baseline, (1), intermediate (2) and final (3) stage: A – assessed by bacterial species, B – assessed by bacterial genus [48].
Note: *p < 0.05 – significance of differences between experiment stages.
Клиническая практика применения фумарата железа в терапии ЖДА у беременных / Clinical practice of using iron fumarate for IDA treatment in pregnant women
Рандомизированное двойное слепое исследование 404 здоровых беременных показало, что дотации 20–80 мг фумарата железа, принимаемого между приемами пищи, не имели значимых побочных эффектов со стороны ЖКТ. Участницы были распределены на 4 группы, принимавшие фумарат железа в дозах 20 мг/сут (n = 99), 40 мг/сут (n = 100), 60 мг/сут (n = 102) и 80 мг/сут (n = 103) ежедневно с 18 недель беременности до родов. Дотации железа участницы принимали преимущественно перед сном. Желудочно-кишечные симптомы (тошнота, рвота, боли в эпигастрии, отрыжка, изжога, метеоризм, урчание в животе, колики, метеоризм, запор, жидкий стул, диарея), черный стул и использование слабительных средств регистрировались в ходе интервью на 18-й, 32-й и 39-й неделях беременности. Частота этих симптомов существенно не различалась в четырех группах приема дотаций железа ни в начале исследования, ни на 32-ю, ни на 39-ю неделю беременности. Следовательно, внедрение профилактики дефицита железа у беременных посредством фумарата железа не должно быть скомпрометировано излишней обеспокоенностью несуществующими побочными эффектами (которые связаны, стоит отметить, с морально и технически устаревшими продуктами на основе сульфата железа) [49].
Дотации фумарата железа (66 мг/сут элементарного железа), начиная с 14–18 недель беременности, оказали положительное влияние на уровень железа и гемоглобина у 119 женщин как во время беременности, так и в послеродовой период, и также положительное влияли на обеспеченность железом новорожденных. В группе участниц, принимавших фумарат железа с 24-й недели беременности и до 8-й недели после родов, наблюдался более высокий уровень гемоглобина, S-ферритина и процент насыщения трансферрина, чем в группе плацебо. В группе принимавших фумарат железа до родов у 11 % участниц был установлен ДЖ и у 0 % – ЖДА в группе железа; в группе плацебо ДЖ установлен у 60 %, а ЖДА – у 18 % участниц. Через 8 недель после родов в группе принимавших фумарат железа ДЖ найден только у 1,6 %, а ЖДА – также у 1,6 % (в группе плацебо – 14 и 7 %, соответственно). У новорожденных от матерей, получавших фумарат железа, установлены более высокие уровни S-ферритина в пуповинной крови, чем у матерей, получавших плацебо (p = 0,02). Не выявлено отрицательного влияния дотаций фумарата железа на продолжительность беременности, массу плаценты или на массу тела ребенка при рождении [50].
Рандомизированное исследование показало, что у матерей с ДЖ (n = 433) и их новорожденных (n = 414) прием фумарата железа (60 мг/сут элементарного железа, с 13–23 недель беременности до 1 месяца после родов) устранял повышенную продукцию фактора роста фибробластов FGF-23 (англ. fibroblast growth factor), вызванную ЖДА (уровень гемоглобина < 90 г/л), тем самым предотвращая гипофосфатемическую FGF-23-опосредованную остеомаляцию. Таким образом, фумарат железа не проявляет гиперпролиферативной активности и улучшает состояние соединительной и костной ткани женщин после родов. Кроме того, фумарат железа увеличил концентрацию гепсидина у матери на 136 % (95 % ДИ = 86–200 %) [51], что свидетельствует о существенном усвоении железа эритроцитами.
Прием фумарата железа через день так же эффективен для лечения ЖДА, как и ежедневный прием. При этом прием фумарата железа через день характеризуется меньшими проявлениями всех типов побочных эффектов со стороны ЖКТ. Выборка беременных с ЖДА была рандомизирована на 2 группы: ежедневный прием 100 мг (элементное железо) фумарата железа (n = 111) или прием через день (n = 106). Уровень ферритина увеличился до 4,9 ± 4,2 нг/мл в группе ежедневного приема и до 3,9 ± 2,9 нг/мл в группе приема через день (p = 0,2). Уровень гемоглобина увеличился на 14 ± 7 г/л в группе ежедневного приема и на 16 ± 6 г/л в другой группе (p = 0,02). В то же время частота желудочно-кишечных побочных эффектов (хоть и незначительных, наподобие окрашивания кала в черный цвет) была достоверно ниже в группе, принимавшей препарат через день (15 %), чем при приеме каждый день (41 %; p = 0,0057) [52].
Проведен метаанализ 11 клинических исследований эффективности применения фумарата железа (Ферретаб®, «Алцея», Г.Л. Фарма ГмбХ, Австрия) для профилактики и терапии ЖДА у беременных (n = 943; в возрасте 30 ± 5 лет). Средняя доза элементного железа составила 58 ± 21 мг/сут, принимаемая в течение 41 ± 25 дней. Терапия фумаратом железа приводила к статистически достоверным снижениям риска развития ЖДА (на 71 %), микроцитоза (на 68 %), уровня гемоглобина < 110 г/л (на 62 %), содержания ферритина < 20 мкг/л (на 63 %) и сывороточного железа < 20 мкмоль/л (на 71 %). Снижение встречаемости ЖДА достигалось при длительности лечения не менее 21 суток при условии, что курсовая доза железа в составе препарата Ферретаб® составляла 1900 ± 650 мг. Минимальная длительность терапии, необходимая для повышения уровня ферритина > 20 мкг/л, составила 23 суток, сывороточного железа > 20 мкмоль/л – 27 суток, гемоглобина > 110 г/л – 10 суток, а для подавления микроцитоза – 12 суток [53].
Этот же метаанализ фумарата железа (Ферретаб®) показал развитие ПЭ со стороны ЖКТ у 3,4 %: тошнота – 1,2 %, однократная рвота – 0,84 %, диарея – 0,42 %, запор – 0,84 %. На фоне приема сульфата железа постоянную тошноту отмечали 41 % участниц, рвоту – 30 %, запор – 16 % [53]. Очевидно несоответствие с ошибочными исследованиями (см. выше раздел про сульфат железа), утверждающими существование ПЭ якобы у половины пациентов, принимавших фумарат железа [54][55].
Другие клинически подтвержденные эффекты фумарата железа / Other clinically verified iron fumarate effects
Три месяца терапии фумаратом железа (200 мг/сут) у пациентов с ДЖ и цианотичным врожденным пороком сердца и/или синдромом Эйзенменгера (n = 25; в возрасте 39,9 ± 10,9 лет; 80 % женщин) были безопасными и привели к значительному улучшению переносимости физических нагрузок и качества жизни. Лечение значительно увеличило содержание гемоглобина (с 190 ± 29 г/л до 204 ± 27 г/л; p < 0,001), ферритина (с 13,3 ± 4,7 мкг/л до 54,1 ± 24,2 мкг/л; p < 0,001) и насыщение трансферрина (с 17,8 ± 9,6 % до 34,8 ± 23,4 %; p < 0,001). Значительные улучшения были выявлены в общем качестве опросника CAMPHOR (с 20,7 ± 10,9 до 16,2 ± 10,4 баллов; p = 0,001) и расстояния в тесте 6-минутной ходьбы (с 37,2 ± 8,5 м до 40,3 ± 7,5 м; p = 0,001). Для фумарата железа не установлено никаких побочных эффектов, требующих прекращения лечения [56].
Метаанализ 16 рандомизированных исследований показал, что внутривенные дотации железа (полимальтозная форма) с ДЖ у пациентов с сердечной недостаточностью улучшают качество жизни. В то же время пероральные дотации фумарата железа снижают смертность от всех причин и госпитализации по поводу сердечной недостаточности. По сравнению с плацебо/контрольными группами внутривенные дотации железа не снизили смертность от всех причин (ОР = 0,69; 95 % ДИ = 0,39–1,23) или смертность от сердечно-сосудистых заболеваний (ОР = 0,89; 95 % ДИ = 0,66–1,20). Через 12 недель снижение госпитализации из-за сердечной недостаточности было связано с введением внутривенных дотаций железа (ОР = 0,58; 95 % ДИ = 0,34–0,97). Пероральные дотации фумарата железа достоверно снизили госпитализацию из-за сердечной недостаточности (ОР = 0,36; 95 % ДИ = 0,14–0,96) и смертность от всех причин (ОР = 0,34; 95 % ДИ = 0,12–0,95) [57].
Фумарат железа в сочетании с основным синергистом, фолиевой кислотой, представлен в препарате Ферретаб®.
Обоснование применения препаратов железа с замедленным высвобождением / Rationale for using slow-release iron supplements
Препараты железа с замедленным высвобождением имеют важные преимущества по сравнению с препаратами стандартного высвобождения по нескольким причинам. Во-первых, абсорбция железа обратно связана с количеством железа, присутствующего в двенадцатиперстной кишке, в то время как частота побочных эффектов со стороны ЖКТ прямо пропорциональна этому количеству; во-вторых, препараты с замедленным высвобождением позволяют только небольшому количеству железа в любой момент времени вступать в контакт со слизистой оболочкой двенадцатиперстной кишки, тем самым улучшая как всасывание, так и переносимость препарата, исключая при этом риск развития гемосидероза. Как следствие, тот же терапевтический эффект можно получить с меньшей дозой железа (по сравнению с простыми таблетками), при этом улучшается соблюдение режима лечения, поскольку меньше побочных эффектов, что чрезвычайно важно при длительной терапии препаратами железа.
Лекарственная форма препарата Ферретаб® (капсулы с пролонгированным высвобождением, включающие микротаблетки фумарата железа и фолиевой кислоты), повышает стабильность компонентов, пролонгирует высвобождение железа и существенно ослабляет возможность повреждений ЖКТ. Тест сравнительной кинетики растворения с препаратом Ферретаб® продемонстрировал, что профиль высвобождения железа из данного лекарственного средства соответствует международным требованиям согласно Рекомендациям Коллегии Евразийской экономической комиссии от № 216.01.2018 [58], предъявляемым к лекарственным препаратам замедленного высвобождения: через 1 час высвобождается 30 % вещества, через 2 часа – 50 %, через 8 часов – более 80 % [59].
Заключение / Conclusion
В настоящее время используются разные формы железа для терапии и профилактики ДЖ и ЖДА, в том числе у беременных и у пациенток с дисменореей. Важным направлением терапии и профилактики ЖДА является пероральный прием органических солей железа (прежде всего, фумарата железа) в сочетании с витаминами (прежде всего, фолиевой кислотой).
В настоящей работе мы рубрицировали все имеющиеся исследования по фумарату железа и описали результаты наиболее интересных направлений исследований фармакологии фумарата железа:
(1) сравнительная фармакология фумарата железа и других форм железа;
(2) влияние различных солей железа на гемосидероз тканей;
(3) синергизм фумарата железа с фолатами и с другими микронутриентами;
(4) состояние микробиома и улучшение всасывания фумарата железа пребиотиками;
(5) практика применения фумарата железа в терапии ЖДА у беременных.
Фумарат-содержащие препараты показаны в тех условиях, когда требуется весомая субстратная поддержка ключевых звеньев аэробного и анаэробного энергетического обмена на разных уровнях от митохондрий и клеток до целого организма и имеется потребность в мобилизации сигнально-регуляторных адаптивных реакций. Прием препаратов солей фумарата внутрь может оказывать мягкое и более безопасное воздействие. При аэробном и гипоксическом течении энергетического обмена, что характерно для дефицита железа, соли фумарата могут проявить себя как эффективные противострессовые и противогипоксические средства.
Результаты клинических исследований, описанных в релевантной научной литературе, позволяют заключить, что лекарственный препарат Ферретаб® является эффективным и безопасным лекарственным средством. Комбинация железа фумарат 163,56 мг (эквивалентно 50 мг железа) + фолиевая кислота 0,5 мг включена в клинические рекомендации Минздрава России «Железодефицитная анемия» и может использоваться врачом любой специальности в реальной клинической практике.
Список литературы
1. Клинические рекомендации – Железодефицитная анемия – 2024-2025-2026. М.: Министерство здравоохранения Российской Федерации, 2024. 36 с. Режим доступа: http://disuria.ru/_ld/14/1489_kr24D50D62MZ.pdf. [Дата обращения: 14.02.2025].
2. Geisser P., Baer M., Schaub E. Structure/histotoxicity relationship of parenteral iron preparations. Arzneimittelforschung. 1992;42(12):1439–52.
3. Громова О.А., Торшин И.Ю. Микронутриенты и репродуктивное здоровье. Руководство. M.: ГЭОТАР-Медиа, 2022. 832 c.
4. Gold R., Kappos L., Arnold D.L. et al.; DEFINE Study Investigators. Placebo-controlled phase 3 study of oral BG-12 for relapsing multiple sclerosis. N Engl J Med. 2012;367(12):1098–107. https://doi.org/10.1056/NEJMoa1114287.
5. Torshin I.Yu. On solvability, regularity, and locality of the problem of genome annotation. Pattern Recognit Image Anal. 2010;20(3):386–95. https://doi.org/10.1134/S1054661810030156.
6. Торшин И.Ю. О задачах оптимизации, возникающих при применении топологического анализа данных к поиску алгоритмов прогнозирования с фиксированными корректорами. Информатика и ее применения. 2023;17(2):2–10. https://doi.org/10.14357/19922264230201.
7. Торшин И.Ю., Громова О.А., Стаховская Л.В. и др. Анализ 19,9 млн публикаций базы данных PubMed/MEDLINE методами искусственного интеллекта: подходы к обобщению накопленных данных и феномен “fake news”. ФАРМАКОЭКОНОМИКА. Современная фармакоэкономика и фармакоэпидемиология. 2020;13(2):146–63. https://doi.org/10.17749/2070-4909/farmakoekonomika.
8. PubChem. Iron fumarate. Режим доступа: https://pubchem.ncbi.nlm.nih.gov/compound/6451272. [Дата обращения: 14.02.2025].
9. Chang A., Rugivarodom M., Pungpipattrakul N. et al. Role of oral iron supplementation for anemia secondary to acute nonvariceal upper gastrointestinal bleeding: a randomized controlled trial. J Gastroenterol Hepatol. 2023;38(8):1283–91. https://doi.org/10.1111/jgh.16185.
10. Suva M.A., Tirgar P.R. Comparative evaluation of different oral iron salts in the management of iron deficiency anemia. Daru. 2024;32(2):485–94. https://doi.org/10.1007/s40199-024-00517-y.
11. PubChem. Ferrous polymaltose. Режим доступа: https://pubchem.ncbi.nlm.nih.gov/compound/11377634. [Дата обращения: 14.02.2025].
12. Iron salts. In: Meyler’s Side Effects of Drugs: The International Encyclopedia of Adverse Drug Reactions and Interactions. Ed. J.A. Aronson. Elsevier, 2015. 323–33. https://doi.org/10.1016/b978-0-444-53717-1.00920-3.
13. Kloepfer K., Schmid P., Wuillemin W.A., R?fer A. Reference values for oral iron absorption of bivalent iron in healthy volunteers. Swiss Med Wkly. 2015;145:w14063. https://doi.org/10.4414/smw.2015.14063.
14. Takasawa K., Takaeda C., Maeda T., Ueda N. Hepcidin-25, mean corpuscular volume, and ferritin as predictors of response to oral iron supplementation in hemodialysis patients. Nutrients. 2014;7(1):103–18. https://doi.org/10.3390/nu7010103.
15. Mehta B.C. Iron hydroxide polymaltose – cause of persistent iron deficiency anemia at delivery. Indian J Med Sci. 2001;55(11):616–20.
16. Ruiz-Arg?elles G.J., D?az-Hern?ndez A., Manzano C., Ruiz-Delgado G.J. Ineffectiveness of oral iron hydroxide polymaltose in iron-deficiency anemia. Hematology. 2007;12(3):255–6. https://doi.org/10.1080/10245330701214160.
17. Drexler C., Macher S., Lindenau I. et al. High-dose intravenous versus oral iron in blood donors with iron deficiency: the IronWoMan randomized, controlled clinical trial. Clin Nutr. 2020;39(3):737–45. https://doi.org/10.1016/j.clnu.2019.03.025.
18. Tolkien Z., Stecher L., Mander A.P. et al. Ferrous sulfate supplementation causes significant gastrointestinal side-effects in adults: a systematic review and meta-analysis. PLoS One. 2015;10(2):e0117383. https://doi.org/10.1371/journal.pone.0117383.
19. Toblli J.E., Cao G., Oliveri L., Angerosa M. Evaluation of toxicity and oxidative stress induced by intravenous iron isomaltoside 1000 in a nonclinical model. Arzneimittelforschung. 2011;61(10):553–65. https://doi.org/10.1055/s-0031-1300553.
20. Wang X., Zhou D., Liu F. et al. Distribution of different forms of metal ions in Antarctic krill (Euphausia superba) oil: A mechanism of their pro-oxidant effects relating to association colloids. Food Chem. 2025;472:142944. https://doi.org/10.1016/j.foodchem.2025.
21. Громова О.А., Торшин И.Ю. Витамины и минералы между Сциллой и Харибдой: о мисконцепциях и других чудовищах. М.: Издательство МЦНМО, 2013. 693 с.
22. Melamed N., Ben-Haroush A., Kaplan B., Yogev Y. Iron supplementation in pregnancy – does the preparation matter? Arch Gynecol Obstet. 2007;276(6):601–4. https://doi.org/10.1007/s00404-007-0388-3.
23. Cancelo-Hidalgo M.J., Castelo-Branco C., Palacios S. et al. Tolerability of different oral iron supplements: a systematic review. Curr Med Res Opin. 2013;29(4):291–303. https://doi.org/10.1185/03007995.2012.761599.
24. Aronstam A., Aston D.L. A comparative trial of a controlled-release iron tablet preparation (’Ferrocontin’ Continus) and ferrous fumarate tablets. Pharmatherapeutica. 1982;3(4):263–7.
25. Morales J., Vargas F., Cass?s L. et al. Sensorial evaluation of nutritional supplements (PROGRESA) enriched with 3 different forms of iron in a rural Mexican community. J Food Sci. 2008;73(1):S1–5. https://doi.org/10.1111/j.1750-3841.2007.00581.x.
26. Srivastava R., Kant S., Singh A.K. et al. Effect of iron and folic acid tablet versus capsule formulation on treatment compliance and iron status among pregnant women: a randomized controlled trial. J Family Med Prim Care. 2019;8(2):378–84. https://doi.org/10.4103/jfmpc.jfmpc_339_18.
27. Стуров В.Г., Мельченко Н.И., Балышева А.С. Анемический синдром у женщин репродуктивного возраста в современных клинических реалиях и оценка эффективности фумарата железа в сочетании с фолатами. Гинекология. 2023;25(1):72–6. https://doi.org/10.26442/20795696.2023.1.202119.
28. Xavier A.M., Rai K., Hegde A.M., Shetty S. A spectroscopic and surface microhardness study on enamel exposed to beverages supplemented with lower iron concentrations. J Clin Pediatr Dent. 2015;39(2):161–7. https://doi.org/10.17796/jcpd.39.2.g52v661835527526.
29. Nazemisalman B., Mohseni M., Darvish S. et al. Effects of iron salts on demineralization and discoloration of primary incisor enamel subjected to artificial cariogenic challenge versus saline immersion. Healthcare (Basel). 2023;11(4):569. https://doi.org/10.3390/healthcare11040569.
30. Громова О.А., Торшин И.Ю., Тетруашвили Н.К. и др. Об использовании многокомпонентных витаминно-минеральных комплексов для профилактики железодефицитной анемии у беременных. Медицинский алфавит. 2018;2(13):6–19.
31. Громова О.А., Торшин И.Ю., Тетруашвили Н.К., Павлович С.В. Систематический анализ молекулярного синергизма фолиевой кислоты и фумарата железа при железодефицитной анемии. Акушерство и гинекология. 2022;(12):178–86. https://doi.org/10.18565/aig.2022.301.
32. Suliburska J., Skrypnik K., Chmurzy?ska A. Folic acid affects iron status in female rats with deficiency of these micronutrients. Biol Trace Elem Res. 2020;195(2):551–8. https://doi.org/10.1007/s12011-019-01888-z.
33. Agostoni C., Giovannini M., Sala D. et al. Double-blind, placebo-controlled trial comparing effects of supplementation of two micronutrient sprinkles on fatty acid status in Cambodian infants. J Pediatr Gastroenterol Nutr. 2007;44(1):136–42. https://doi.org/10.1097/01.mpg.0000243429.24463.2f.
34. Nwagha T.U., Ugwu A.O., Nwaekpe C.N. Iron supplementation and blood donation in Nigeria: effect on hemoglobin, red cell indices, and iron stores – the Ranferon™ study. Ann Afr Med. 2023;22(1):70–6. https://doi.org/10.4103/aam.aam_248_21.
35. Christofides A., Asante K.P., Schauer C. et al. Multi-micronutrient sprinkles including a low dose of iron provided as microencapsulated ferrous fumarate improves haematologic indices in anaemic children: a randomized clinical trial. Matern Child Nutr. 2006;2(3):169–80. https://doi.org/10.1111/j.1740-8709.2006.00060.x.
36. Alenkina I.V., Chukin A.V., Leitus G. et al. Analysis of the iron states in iron-containing pharmaceutical products using M?ssbauer spectroscopy. J Pharm Biomed Anal. 2024;237:115745. https://doi.org/10.1016/j.jpba.2023.115745.
37. Teucher B., Olivares M., Cori H. Enhancers of iron absorption: ascorbic acid and other organic acids. Int J Vitam Nutr Res. 2004;74(6):403–19. https://doi.org/10.1024/0300-9831.74.6.403.
38. Liu T.C., Lin S.F., Chang C.S. et al. Comparison of a combination ferrous fumarate product and a polysaccharide iron complex as oral treatments of iron deficiency anemia: a Taiwanese study. Int J Hematol. 2004;80(5):416–20. https://doi.org/10.1532/ijh97.a10409.
39. Layrisse M., Garc?a-Casal M.N., Solano L. et al. New property of vitamin A and beta-carotene on human iron absorption: effect on phytate and polyphenols as inhibitors of iron absorption. Arch Latinoam Nutr. 2000;50(3):243–8.
40. Gupta K.C., Paul T., Mehta J.M. et al. Study of bioavailability of oral iron preparations. J Postgrad Med. 1976;22(2):94–9.
41. Fischer J.A.J., Sasai C.S., Karakochuk C.D. Iron-containing oral contraceptives and their effect on hemoglobin and biomarkers of iron status: a narrative review. Nutrients. 2021;13(7):2340. https://doi.org/10.3390/nu13072340.
42. Dong Z., Zhang D., Wu X. et al. Ferrous bisglycinate supplementation modulates intestinal antioxidant capacity via the AMPK/FOXO pathway and reconstitutes gut microbiota and bile acid profiles in pigs. J Agric Food Chem. 2022;70(16):4942–51. https://doi.org/10.1021/acs.jafc.2c00138.
43. Elms L., Hand B., Skubisz M. et al. The effect of iron supplements on the gut microbiome of females of reproductive age: a randomized controlled trial. J Nutr. 2024;154(5):1582–7. https://doi.org/10.1016/j.tjnut.2024.03.014.
44. Mahalanabis D., Islam M.A., Shaikh S. et al. Haematological response to iron supplementation is reduced in children with asymptomatic Helicobacter pylori infection. Br J Nutr. 2005;94(6):969–75. https://doi.org/10.1079/bjn20051586.
45. Husmann F.M.D., Zimmermann M.B., Herter-Aeberli I. The effect of prebiotics on human iron absorption: a review. Adv Nutr. 2022;13(6):2296–304. https://doi.org/10.1093/advances/nmac079.
46. Giorgetti A., Paganini D., Nyilima S. et al. The effects of 2'-fucosyllactose and lacto-N-neotetraose, galacto-oligosaccharides, and maternal human milk oligosaccharide profile on iron absorption in Kenyan infants. Am J Clin Nutr. 2023;117(1):64–72. https://doi.org/10.1016/j.ajcnut.2022.10.005.
47. Jeroense F.M.D., Zeder C., Zimmermann M.B., Herter-Aeberli I. Acute consumption of prebiotic galacto-oligosaccharides increases iron absorption from ferrous fumarate, but not from ferrous sulfate and ferric pyrophosphate: stable iron isotope studies in iron-depleted young women. J Nutr. 2020;150(9):2391–7. https://doi.org/10.1093/jn/nxaa199.
48. Ren H.T., Du M.X., Zhou J., An H.Y. Effect of spirulina and ferrous fumarate on intestinal morphology and the diversity of gut microbiota of yellow river carp. Biol Trace Elem Res. 2022;200(9):4142–9. https://doi.org/10.1007/s12011-021-02993-8.
49. Milman N., Byg K.E., Bergholt T., Eriksen L. Side effects of oral iron prophylaxis in pregnancy – myth or reality? Acta Haematol. 2006;115(1–2):53–7. https://doi.org/10.1159/000089466.
50. Milman N.T. Iron supplementation in pregnant Danish women revisited: Effects on prepartum and postpartum iron deficiency, anemia, serum erythropoietin; including iron status, erythropoietin and anthropometrics in newborns. A randomized, placebo-controlled study. J Neonatal Perinatal Med. 2022;15(4):731–44. https://doi.org/10.3233/NPM-221014.
51. Braithwaite V.S., Mwangi M.N., Jones K.S. et al. Antenatal iron supplementation, FGF23, and bone metabolism in Kenyan women and their offspring: secondary analysis of a randomized controlled trial. Am J Clin Nutr. 2021;113(5):1104–14. https://doi.org/10.1093/ajcn/nqaa417.
52. Karakoc G., Orgul G., Sahin D., Yucel A. Is every other day iron supplementation effective for the treatment of the iron deficiency anemia in pregnancy? J Matern Fetal Neonatal Med. 2022;35(5):832–6. https://doi.org/10.1080/14767058.2021.1910666.
53. Торшин И.Ю., Громова О.А., Лиманова О.А. и др. Метаанализ клинических исследований по применению фумарата железа с целью профилактики и терапии железодефицитной анемии у беременных. Гинекология. 2015;17(5):24–31.
54. Kivivuori S.M., Virtanen M., Raivio K.O. et al. Oral iron is sufficient for erythropoietin treatment of very low birth-weight infants. Eur J Pediatr. 1999;158(2):147–51. https://doi.org/10.1007/s004310051036.
55. Liyanage C., Zlotkin S. Bioavailability of iron from micro-encapsulated iron sprinkle supplement. Food Nutr Bull. 2002;23(3 Suppl):133–7.
56. Tay E.L., Peset A., Papaphylactou M. et al. Replacement therapy for iron deficiency improves exercise capacity and quality of life in patients with cyanotic congenital heart disease and/or the Eisenmenger syndrome. Int J Cardiol. 2011;151(3):307–12. https://doi.org/10.1016/j.ijcard.2010.05.066.
57. Mei Z., Chen J., Luo S. et al. Comparative efficacy of intravenous and oral iron supplements for the treatment of iron deficiency in patients with heart failure: A network meta-analysis of randomized controlled trials. Pharmacol Res. 2022;182:106345. https://doi.org/10.1016/j.phrs.2022.106345.
58. Рекомендация Коллегии евразийской экономической комиссии N 2 от 16 января 2018 г. «О Руководстве по качеству лекарственных препаратов с модифицированным высвобождением для приема внутрь». Режим доступа: https://www.alta.ru/tamdoc/18rk0002. [Дата обращения: 14.02.2025].
59. Ших Е.В., Еременко Н.Н., Пахомова А.Е., Поздняков А.В. Соответствие профиля растворения Ферретаб комп. требованиям, предъявляемым лекарственным препаратам модифицированного высвобождения: оптимизация биофармацевтических, фармакокинетических и фармакодинамических свойств. Фармакология & Фармакотерапия. 2024;(4):19–29.
Об авторах
О. А. ГромоваРоссия
Громова Ольга Алексеевна, д.м.н., проф.
Scopus Author ID: 7003589812
WoS ResearcherID: J-4946-2017
119333 Москва, ул. Вавилова, д. 44, корп. 2
И. Ю. Торшин
Россия
Торшин Иван Юрьевич, к.ф-м.н., к.х.н.
Scopus Author ID: 7003300274
WoS ResearcherID: C-7683-2018
119333 Москва, ул. Вавилова, д. 44, корп. 2
Н. К. Тетруашвили
Россия
Тетруашвили Нана Картлосовна, д.м.н., проф.
117997 Москва, ул. Академика Опарина, д. 4
Что уже известно об этой теме?
► Органические соли железа наименее токсичны и представляют наибольший интерес для профилактики и терапии железодефицитной анемии (ЖДА).
► В научной литературе достаточно мало сведений о фармакокинетике и фармакодинамике органических солей железа.
► Имеются фундаментальные и клинические данные, указывающие на эффективность и безопасность применения фумарата железа.
Что нового дает статья?
► Рубрицированы все имеющиеся исследования по фумарату железа, в том числе сравнительная фармакология фумарата и других форм железа, влияние на гемосидероз, синергизм фумарата железа с другими микронутриентами и микробиомом и клинические применения фумарата железа в терапии ЖДА беременных.
Как это может повлиять на клиническую практику в обозримом будущем?
► Фумарат железа вызывает меньшее повреждение эмали зубов, чем сульфат железа.
► Витаминно-минеральные комплексы, содержащие фумарат железа, характеризуются меньшим количеством побочных эффектов и лучшей приверженностью к терапии ЖДА женщин в послеродовом периоде.
Рецензия
Для цитирования:
Громова О.А., Торшин И.Ю., Тетруашвили Н.К. Систематический компьютерный анализ фармакологии фумарата железа в контексте лечения дефицита железа и железодефицитной анемии. Акушерство, Гинекология и Репродукция. 2025;19(2):230-249. https://doi.org/10.17749/2313-7347/ob.gyn.rep.2025.632
For citation:
Gromova O.A., Torshin I.Yu., Tetruashvili N.K. Systematic computer analysis of iron fumarate pharmacology in the treatment of iron deficiency and iron deficiency anemia. Obstetrics, Gynecology and Reproduction. 2025;19(2):230-249. (In Russ.) https://doi.org/10.17749/2313-7347/ob.gyn.rep.2025.632

Контент доступен под лицензией Creative Commons Attribution-NonCommercial-ShareAlike 4.0 International License.











































