Перейти к:
Минимально инвазивные и робот-ассистированные вмешательства в лечении гинекологических злокачественных опухолей: возможности сохранения репродуктивной функции
https://doi.org/10.17749/2313-7347/ob.gyn.rep.2025.628
Аннотация
Цель: систематизировать и проанализировать современные данные по применению минимально инвазивных и робот-ассистированных вмешательств в лечении гинекологических злокачественных опухолей у женщин репродуктивного возраста, заинтересованных в сохранении фертильности.
Материалы и методы. Поиск проводился в базах данных PubMed/MEDLINE, Scopus, Web of Science и eLibrary среди первоисточников, опубликованных в период с 01.01.2000 по 28.02.2025. Использовались ключевые слова и термины MeSH (англ. Medical Subject Headings; медицинские предметные заголовки) на русском и английском языках: «роботизированная хирургия», ««робот-ассистированная хирургия», «сохранение фертильности», «гинекологический рак», «рак шейки матки», «рак эндометрия», «рак яичников», «репродуктивный возраст», «малоинвазивная хирургия», «трансплантация матки», «robotic surgery», «robot-assisted surgery», «fertility preservation», «gynecologic cancer», «cervical cancer», «endometrial cancer», «ovarian cancer», «reproductive age», «minimally invasive surgery», «uterus transplantation». В анализ включались оригинальные исследования, в которых рассматривались онкологические и репродуктивные исходы у женщин до 45 лет. Методология соответствовала рекомендациям PRISMA. В итоговый анализ было включено 53 публикации.
Результаты. Данные свидетельствуют о высокой эффективности и онкологической безопасности органосохраняющих подходов у пациенток с ранними стадиями рака шейки матки, эндометрия и яичников. Роботизированные вмешательства продемонстрировали сопоставимые или превосходящие результаты по сравнению с традиционными методами в отношении сохранения фертильности, при этом снижая частоту осложнений и ускоряя восстановление. Представлены данные по транспозиции яичников, трансплантации матки и альтернативным методам сохранения фертильности.
Заключение. Робот-ассистированная хирургия расширяет возможности органосохраняющего лечения гинекологических злокачественных опухолей у женщин репродуктивного возраста. Подобные вмешательства должны проводиться в условиях специализированных центров с участием мультидисциплинарной команды. Дальнейшие исследования необходимы для стандартизации подходов и оценки долгосрочных репродуктивных и онкологических исходов.
Ключевые слова
Для цитирования:
Хамадьянова А.У., Гаев Т.Т., Гацоев Д.О., Андреев В.В., Пажитнова А.С., Тихонова Э.О., Ким В.Г., Талалаева Д.А., Агапова В.Е., Ботина Р.С., Яковлева А.К., Васильева С.Д., Бакулин Д.Ю. Минимально инвазивные и робот-ассистированные вмешательства в лечении гинекологических злокачественных опухолей: возможности сохранения репродуктивной функции. Акушерство, Гинекология и Репродукция. 2025;19(4):545-560. https://doi.org/10.17749/2313-7347/ob.gyn.rep.2025.628
For citation:
Khamadyanova A.U., Gaev T.T., Gatsoev D.O., Andreev V.V., Pazhitnova A.S., Tikhonova E.O., Kim V.G., Talalaeva D.A., Agapova V.V., Botina R.S., Yakovleva A.K., Vasilieva S.D., Bakulin D.Yu. Minimally invasive and robot-assisted interventions in the treatment of gynecological malignant tumors: opportunities for preserving reproductive function. Obstetrics, Gynecology and Reproduction. 2025;19(4):545-560. (In Russ.) https://doi.org/10.17749/2313-7347/ob.gyn.rep.2025.628
Введение / Introduction
Несмотря на то что большинство злокачественных новообразований (ЗНО) женской репродуктивной системы традиционно диагностируются у пациенток старше 50 лет, в последние десятилетия отмечается устойчивая тенденция к выявлению гинекологических онкологических заболеваний у женщин репродуктивного возраста. В частности, речь идет о таких формах злокачественных опухолей, как рак эндометрия (РЭ), рак яичников (РЯ) и рак шейки матки (РШМ) [1].
Эпидемиологические показатели заболеваемости злокачественными новообразованиями варьируют в зависимости от географического региона, что обусловлено совокупностью климатогеографических, социально-экономических, этнокультурных факторов, а также различиями в распространенности факторов риска. Эти особенности играют ключевую роль в формировании региональной специфики онкологической заболеваемости, в том числе в отношении злокачественных опухолей репродуктивной системы у женщин.
Согласно статистическим данным, в Российской Федерации (РФ) в 2021 г. доля ЗНО женской репродуктивной системы составила 40,1 %, а среди причин смертности от онкологических заболеваний – 32,3 %. Для сравнения, в 2012 г. эти показатели составляли 38,8 и 33,7 % соответственно, что свидетельствует о сохраняющейся высокой онкологической нагрузке на репродуктивное здоровье женщин. В структуре заболеваемости ЗНО у женщин на первое место стабильно выходит рак молочной железы (РМЖ), доля которого в 2021 г. составила 22,1 % (в 2012 г. – 20,7 %), РЭ занял четвертую позицию – 8,1 % (в 2012 г. – 7,5 %), РШМ – пятую позицию с показателем 4,9 % (в 2012 г. – 5,3 %), РЯ – восьмую позицию с долей 4,2 % (в 2012 г. – 4,5 %). Аналогичная динамика наблюдается и в структуре смертности от ЗНО. В 2021 г. на первом месте по смертности среди онкогинекологических заболеваний находился РМЖ – 15,8 % (в 2012 г. – 17,1 %), РЯ занимал шестое место – 5,6 % (в 2012 г. – 5,8 %), РЭ – седьмое место – 5,2 % (в 2012 г. – 4,9 %), а РШМ – девятое место – 4,5 % (в 2012 г. – 4,7 %) [2][3].
Кумулятивный риск развития инвазивного РШМ у женщин моложе 49 лет составляет 0,3 % [4]. Более того, в соответствии с результатами предыдущих эпидемиологических исследований, свыше 10 % впервые диагностированных случаев РЯ и более одной трети случаев РШМ приходятся на женщин в возрасте до 45 лет [5].
Параллельно с эпидемиологическими изменениями в структуре онкологических заболеваний наблюдается и демографический сдвиг: возраст первородящих женщин стабильно увеличивается. Установлено, что средний возраст сначала снижался с 24,4 лет в 1960 г. до 22,5 в 1994 г., а затем начал расти, достигнув 25,9 лет в 2019 г. Зафиксированы существенные региональные различия: минимальные значения – в Республиках Тыва, Дагестан и Чечня (около 23,5 лет), максимальные – в Москве и Санкт-Петербурге (27,7–28,0 лет) [6].
С момента первой успешно выполненной роботизированной гистерэктомии, описанной С. Diaz-Arrastia с соавт. в 2002 г. [7], наблюдается экспоненциальный рост числа операций, выполняемых с использованием роботизированной техники, в том числе в гинекологической онкологии.
Цель: систематизировать и проанализировать современные данные по применению минимально инвазивных и робот-ассистированных вмешательств в лечении гинекологических злокачественных опухолей у женщин репродуктивного возраста, заинтересованных в сохранении фертильности.
Материалы и методы / Materials and Мethods
Методология поиска была разработана в соответствии с рекомендациями PRISMA 2020 (Preferred Reporting Items for Systematic Reviews and Meta-Analyses).
Поиск литературы проводился в электронных базах данных PubMed/MEDLINE, Scopus, Web of Science и eLibrary (РИНЦ). Временной диапазон включал публикации, опубликованные с 01.01.2000 по 28.02.2025, поскольку именно с начала 2000-х годов появились первые сообщения о применении роботизированных технологий в онкогинекологии и трансплантации матки. Поиск ограничивался статьями на английском и русском языках.
Стратегия поиска включала как свободные ключевые слова, так и термины MeSH (англ. Medical Subject Headings; медицинские предметные заголовки) на русском и английском языках: «роботизированная хирургия», ««робот-ассистированная хирургия», «сохранение фертильности», «гинекологический рак», «рак шейки матки», «рак эндометрия», «рак яичников», «репродуктивный возраст», «малоинвазивная хирургия», «трансплантация матки», «robotic surgery», «robot-assisted surgery», «fertility preservation», «gynecologic cancer», «cervical cancer», «endometrial cancer», «ovarian cancer», «reproductive age», «minimally invasive surgery», «uterus transplantation». Были использованы логические операторы AND, OR и NOT.
Критерии включения: оригинальные научные статьи (рандомизированные контролируемые исследования, когортные и ретроспективные исследования, серии клинических случаев); исследования с участием женщин репродуктивного возраста (до 45 лет) с диагнозом ЗНО репродуктивной системы (рак шейки матки, эндометрия, яичников); данные о применении методов органосохраняющего лечения и/или роботизированной хирургии; указание онкологических (рецидив, выживаемость) и/или репродуктивных (наступление беременности, живорождение) исходов.
Критерии исключения: статьи без систематической методологии (описательные обзоры, письма в редакцию, экспертные мнения); публикации, не содержащие клинических данных; повторяющиеся публикации и дубликаты; исследования, включавшие женщин старше 45 лет; отсутствие информации об онкологических и репродуктивных результатах.
При подготовке введения использовались эпидемиологические источники, не входившие в пул систематического анализа, но обладающие высокой информативностью для описания структуры заболеваемости и актуальности проблемы. Эти публикации не оценивались по критериям PRISMA, поскольку не содержали клинических данных, но использовались для иллюстрации демографического и эпидемиологического фона.
Первоначально было идентифицировано 532 публикации. После удаления 88 дубликатов к скринингу по заголовкам и аннотациям было допущено 444 статьи. Из них 319 были исключены в связи с несоответствием критериям включения. На следующем этапе был проведен полный анализ текста оставшихся 125 статей, в результате чего были исключены еще 72 публикации по методологическим причинам. В итоговый качественный анализ было включено 53 публикации. Алгоритм поиска представлен на рисунке 1.
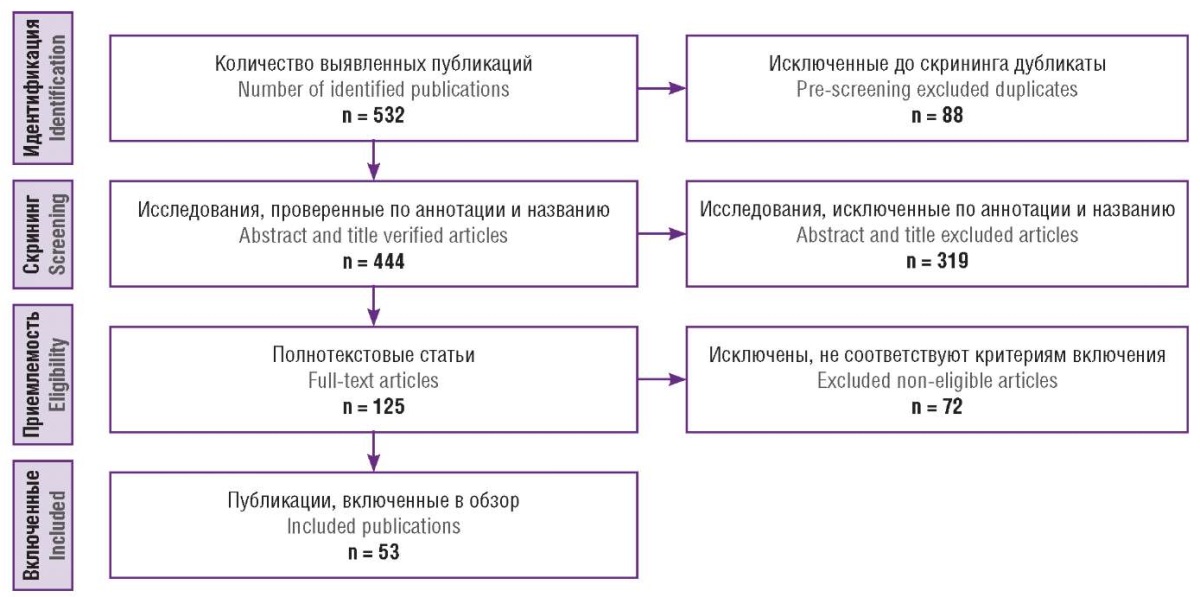
Рисунок 1. Алгоритм поиска исследований.
Figure 1. Publications search algorithm.
Результаты и обсуждение / Results and Discussion
Рак эндометрия / Endometrial cancer
Хотя РЭ считается заболеванием, типичным для постменопаузального периода, он может встречаться и у женщин в пременопаузе, включая репродуктивный возраст. Стандартной терапевтической тактикой при карциноме эндометрия является тотальная гистерэктомия с двусторонней сальпингоофорэктомией. В отдельных клинических ситуациях к объему вмешательства может добавляться картирование сторожевых лимфатических узлов, тазовая и/или парааортальная лимфаденэктомия. Однако проведение радикального хирургического лечения у молодых женщин нередко сопряжено с существенными последствиями, влияющими на качество жизни, включая утрату репродуктивной функции, сексуальную дисфункцию и психологические последствия, связанные с утратой детородного органа [8].
В связи с этим пациенткам репродуктивного возраста, заинтересованным в сохранении фертильности, следует предлагать органосохраняющие методы лечения, соответствующие современным онкологическим стандартам и протоколам. Подобная терапия направлена на временное ингибирование прогрессирования опухолевого процесса с возможностью наступления беременности до выполнения радикального вмешательства.
Оптимальное ведение пациенток требует участия мультидисциплинарной команды, включающей гинеколога-онколога, специалиста по репродуктивным технологиям, патоморфолога и специалиста по визуализационной диагностике. Строгий отбор кандидатов для проведения органосохраняющей терапии является обязательным и возможен только при наличии ранней стадии неметастатического заболевания. В соответствии с рекомендациями Европейского общества гинекологической онкологии (англ. European Society of Gynaecological Oncology, ESGO), Европейского общества по репродукции человека и эмбриологии (англ. European Society of Human Reproduction and Embryology, ESHRE), а также Европейского общества гинекологической эндоскопии (англ. European Society of Gastrointestinal Endoscopy, ESGE), органосохраняющее лечение может быть рассмотрено исключительно у пациенток с высокодифференцированным (G1) эндометриоидным РЭ стадии IA, без инвазии в миометрий и признаков лимфоваскулярной инвазии (англ. lymphovascular space invasion, LVSI) [9].
На сегодняшний день отсутствуют убедительные данные в пользу органосохраняющего лечения при опухолях второй степени злокачественности. При выборе терапии необходимо учитывать индивидуальные характеристики пациентки, включая возраст, индекс массы тела, наличие синдрома поликистозных яичников, инсулинорезистентность и другие факторы, ассоциированные с неблагоприятными репродуктивными исходами. В случае наличия синдрома Линча решение о сохранении фертильности должно приниматься персонализировано при обязательном информировании пациентки о повышенном риске рецидива заболевания [9].
Наиболее эффективной формой консервативной терапии признана комбинация гистероскопической резекции опухоли с последующим назначением прогестинов (пероральных или внутриматочной системы с левоноргестрелом). Согласно метаанализу 54 исследований, частота живорождений при использовании только прогестиновой терапии составляла 33 %, тогда как при сочетании с гистероскопической резекцией достигала 53 % [10].
Методика гистероскопической резекции очагового поражения впервые была описана I. Mazzon с соавт. и включает трехэтапную процедуру: иссечение новообразования, резекцию окружающего эндометрия (на 4–5 мм за пределами опухоли) и удаление подлежащего миометрия (на глубину 3–4 мм). Прогестиновая терапия назначается после верификации диагноза G1 рака без инвазии миометрия [11]. В модификации, предложенной P. Giampaolino с соавт., дополнительно проводится случайная биопсия эндометрия после основной резекции, а затем устанавливается внутриматочная система, высвобождающая прогестерон [12].
Мониторинг включает регулярное выполнение гистероскопической биопсии каждые 3–6 месяцев в зависимости от ультразвуковых данных. После завершения репродуктивной функции при отсутствии ответа на терапию либо в случае прогрессирования заболевания рекомендовано проведение радикального хирургического вмешательства с удалением матки как основного источника возможного рецидива. При этом выполнение двусторонней овариоэктомии не является обязательным, так как согласно данным ряда исследований ее выполнение при ранней стадии заболевания не оказывает значимого влияния на общую выживаемость [13]. Решение об удалении яичников должно приниматься индивидуально с учетом возраста пациентки, вероятности поражения яичников и генетических факторов риска. Сохранение яичников может быть целесообразным, поскольку оно способствует поддержанию гормонального фона, предотвращает развитие состояний, связанных с преждевременной менопаузой, и позволяет использовать экстракорпоральное оплодотворение с последующим переносом эмбриона суррогатной матери.
Применение роботизированных технологий в лечении РЭ с сохранением фертильности ограничивается, в основном, визуализацией и удалением сторожевого лимфатического узла перед выполнением гистероскопической резекции и гормонального лечения. Однако, согласно обновленным рекомендациям ESGO/ESHRE/ESGE, биопсия лимфатических узлов при РЭ низкого риска не является обязательной процедурой, учитывая крайне низкую вероятность лимфогенного метастазирования [9].
Кроме того, перспективным направлением в лечении пациенток, утративших возможность вынашивания беременности вследствие онкологического заболевания, является трансплантация матки. Эта инновационная технология в последние годы продемонстрировала значимые успехи, приведя к рождению здоровых детей и расширив возможности репродуктивной медицины в онкогинекологии [14].
В таблице 1 суммирована информация по лечению РЭ с сохранением фертильности.
Таблица 1. Сводная таблица по лечению рака эндометрия с сохранением фертильности.
Table 1. Summary table on fertility preservation treatment for endometrial cancer.
|
Параметр Parameter |
Критерии отбора Selection criteria |
Методы лечения Treatment methods |
Частота ремиссии, % Remission rate, % |
Частота беременности, % Pregnancy rate, % |
Источник Reference |
|
Классический профиль пациентки Classic patient profile |
Возраст < 40 лет, G1, стадия IA, отсутствие инвазии миометрия и LVSI Age < 40 years, G1, stage IA, no myometrial invasion or LVSI |
Пероральные прогестины или ВМС с левонор-гестрелом Oral progestins or levonorgestrel-releasing IUD |
70–80 |
35–40 |
ESGO/ESHRE/ESGE 9][15] |
|
Расширенный профиль пациентки Extended patient profile |
G1 стадия IA с фокальной инвазией миометрия G1 stage IA with focal myometrial invasion |
Комбинированное лечение: гистероскопическая резекция + прогестины Combination treatment: hysteroscopic resection + progestins |
78–90 |
40–50 |
Mazzon I. et al., 2010 [11] |
|
Сложные случаи Complex cases |
Синдром Линча, мутация MMR, повышенный индекс массы тела, СПКЯ Lynch syndrome, MMR mutation, high body mass index, PCOS |
Индивидуализированный подход, частое наблюдение, возможное ЭКО Individualized approach, close monitoring, possible IVF |
Зависит от профиля Depends on the profile |
< 30 |
ESGO/ESHRE/ESGE [11][15] |
|
Рекомендации по завершению лечения Recommendations for treatment completion |
После реализации репродуктивной функции или при неэффективности терапии After completion of reproductive function or in case of therapy failure |
Тотальная гистерэктомия с БСО (по показаниям) Total hysterectomy with BSO (if indicated) |
– |
– |
ESGO/ESHRE/ESGE [11][15] |
|
Противопоказания к сохранению фертильности Contraindications to fertility preservation |
G2–G3, стадия IB и выше, наличие инвазии миометрия и/или LVSI, метастазы G2–G3, ≥ stage IB, presence of myometrial invasion and/or LVSI, metastases |
Стандартное хирургическое лечение Standard surgical treatment |
Низкая Low |
Низкая Low |
ESGO/ESHRE/ESGE [11][15] |
Примечание: G1/G2/G3 – G1–G3 – степень злокачественности опухоли (степень: G1 – высокая, G2 – средняя, G3 – низкая); LVSI – лимфоваскулярная инвазия; IA, IB – стадии заболевания по классификации FIGO (Международная федерация гинекологии и акушерства); ВМС – внутриматочная спираль; СПКЯ – синдром поликистозных яичников; MMR – гены репарации; БСО – двусторонняя сальпингоофорэктомия; ЭКО – экстракорпоральное оплодотворение.
Note: G1/G2/G3 – tumor malignancy degree (Grade: G1 – high, G2 – medium, G3 – low); LVSI – lymphovascular space invasion; IA, IB – disease stages according to the FIGO (International Federation of Gynecology and Obstetrics) classification; IUS – intrauterine device; PCOS – polycystic ovary syndrome; MMR – mismatch repair genes; BSO – bilateral salpingo-oophorectomy; IVF – in vitro fertilization.
Рак шейки матки / Cervical cancer
В последние десятилетия значительно возросла потребность в разработке и применении стратегий лечения, направленных на сохранение фертильности у молодых нерожавших пациенток с ранними стадиями заболевания.
Современные органосохраняющие методы лечения РШМ включают конизацию, простую трахелэктомию и радикальную трахелэктомию. В соответствии с обновленными клиническими рекомендациями ESGO/ESTRO/ESP (2023), возможность сохранения репродуктивной функции может рассматриваться у пациенток с опухолями размером менее 2 см (стадия FIGO IB1 или ниже) при отсутствии метастатического поражения тазовых лимфатических узлов. Наличие отрицательного лимфогенного статуса (верифицированного посредством биопсии сторожевых лимфатических узлов и/или систематической тазовой лимфодиссекции) является обязательным условием перед выбором тактики фертильносохраняющего вмешательства. При стадии FIGO IA1 без LVSI лимфодиссекция не требуется [15].
Показания к органосохраняющему лечению при РШМ включают:
- репродуктивный возраст и выраженное желание сохранить фертильность;
- опухоль ≤ 2 см (FIGO IB1 или менее);
- плоскоклеточный рак или аденокарцинома, ассоциированная с вирусом папилломы человека (ВПЧ);
- отрицательный лимфатический статус.
В зависимости от стадии и патоморфологических характеристик опухоли тип вмешательства варьирует. При FIGO IA1–IA2, а также IB1 с отсутствием LVSI возможно проведение конизации шейки матки или простой трахелэктомии. В случае положительной LVSI показана радикальная трахелэктомия [15].
Согласно систематическому обзору, включающему 4118 пациенток с клинически ранней стадией РШМ, попытки сохранить фертильность оказались успешными в 91 % случаев [18]. Авторы подчеркивают, что при опухолях менее 2 см параметрэктомия может быть избыточной, учитывая крайне низкую частоту поражения параметрия. В дополнение, в проспективном наблюдательном исследовании, посвященном лечению стадии IB1 методом большой петлевой эксцизией зоны трансформации (англ. Large Loop Excision of the Transformation Zone, LLETZ), при среднем сроке наблюдения 8,5 лет была зафиксирована только одна рецидивная опухоль, и ни одного случая онкологической смерти [16].
Варианты хирургического доступа при выполнении трахелэктомии включают вагинальный, абдоминальный, лапароскопический и роботизированный. Впервые робот-ассистированная радикальная трахелэктомия была описана в 2008 г. [17]. С тех пор опубликован ряд работ, подтвердивших онкологическую безопасность и репродуктивные перспективы данного подхода [17–19].
Однако данные рандомизированного исследования LACC (2018) вызвали обеспокоенность в отношении онкологических исходов после малоинвазивных вмешательств при РШМ: выявлено снижение показателей безрецидивной и общей выживаемости по сравнению с открытыми вмешательствами [20]. Эти результаты вызвали активные научные дебаты. Критики исследования указали на вариабельность хирургической техники, квалификацию специалистов, а также особенности отбора центров и пациенток [21][22].
В ответ на это Международная исследовательская группа опубликовала ретроспективный анализ, охватывающий 646 пациенток с опухолями менее 2 см, пролеченных в 18 центрах 12 стран. Частота рецидивов составила 4,8 % в группе открытых вмешательств и 6,3 % в группе минимально инвазивных без статистически значимых различий (р = 0,4). Общая выживаемость и выживаемость без прогрессирования также не различались [23].
Исследования ROCC и RACC, в настоящее время продолжающиеся, направлены на изучение онкологической безопасности роботизированных вмешательств и восполняют методологические ограничения LACC [24][25]. Кроме того, результаты многоцентрового исследования III фазы SHAPE показали, что у пациенток с РШМ низкого риска проведение простой гистерэктомии с лимфодиссекцией с использованием минимально инвазивного подхода обеспечивает онкологическую безопасность и снижает частоту послеоперационных осложнений [26][27].
Что касается сохранения фертильности после роботизированной радикальной трахелэктомии, международное исследование, охватившее 149 пациенток, продемонстрировало вероятность наступления беременности на уровне 47 % с итогом в 103 беременности и 76 живорождений. Причем 72 % женщин, активно стремившихся к беременности, достигли положительного результата, а 86 % всех беременностей завершились родами после 32 недель гестации [28]. Эти показатели значительно превосходят средние значения (23,9 %), зафиксированные в систематическом обзоре [29].
Роль малоинвазивной хирургии проявляется также в транспозиции яичников у женщин, подлежащих лучевой терапии. Овариальная транспозиция может быть выполнена лапароскопически или роботизированным методом. Сохранение функции яичников достигается в среднем у 65 % пациенток, получивших последующую лучевую терапию [30–32]. Лучшие результаты наблюдаются при транспозиции за пределы области облучения – к селезеночному или печеночному изгибу. Однако даже при успешном сохранении гормональной функции вероятность наступления беременности после облучения остается крайне низкой из-за структурных изменений матки, включая фиброз, снижение васкуляризации и нарушение имплантации. Это связано с рисками самопроизвольных абортов, задержки внутриутробного развития и преждевременных родов.
В этой связи интерес вызывает транспозиция матки – инновационная методика, призванная защитить орган от облучения. Систематический обзор показал, что данный метод позволяет значительно снизить дозу облучения, получаемую маткой, по сравнению с вентрофиксацией [33]. В проспективном многоцентровом исследовании транспозиция матки была успешно выполнена у 8 пациенток, из которых у 2 впоследствии наступила доношенная беременность [34]. Отметим, что пока ни одна из этих процедур не проводилась с применением роботизированных технологий, что представляет перспективное направление для дальнейших исследований.
В таблице 2 суммируется информация по лечению РШМ с сохранением фертильности.
Таблица 2. Сводная таблица по лечению рака шейки матки с сохранением фертильности.
Table 2. Summary table of fertility-preserving treatment for cervical cancer.
|
Параметр Parameter |
Критерии отбора Selection criteria |
Методы лечения Treatment methods |
Частота ремиссии, % Remission rate, % |
Частота беременности, % Pregnancy rate, % |
Источник Reference |
|
Пациентки FIGO IA1 LVSI– Patients with FIGO IA1 LVSI– |
Опухоль ≤ 5 мм без сосудистой инвазии Tumor ≤ 5 mm without vascular invasion |
Конизация/простая трахелэктомия без лимфодиссекции Conization/simple trachelectomy without lymph node dissection |
> 95 |
60–70 |
ESGO/ESHRE/ESGE [9][15] |
|
Пациентки FIGO IA2–IB1 < 2 см, LVSI– Patients FIGO IA2–IB1 < 2 cm, LVSI– |
Инвазивный рак, опухоль < 2 см, отрицательные лимфоузлы Invasive cancer, tumor < 2 cm, negative lymph nodes |
Простая или радикальная трахелэктомия с лимфодиссекцией Simple or radical trachelectomy with lymph node dissection |
85–95 |
50–65 |
ESGO/ESHRE/ESGE [9][15] |
|
Пациентки FIGO IB1 и LVSI+ Patients FIGO IB1 and LVSI+ |
Опухоль < 2 см, сосудистая инвазия, отрицательные лимфоузлы Tumor < 2 cm, vascular invasion, negative lymph nodes |
Радикальная трахелэктомия + лимфодиссекция Radical trachelectomy + lymph node dissection |
~85 |
40–50 |
ESGO/ESHRE/ESGE [9][15] |
|
Большие опухоли (> 2 см) Large tumors (> 2 cm) |
IB2 стадия и выше Stage IB2 and above |
Не рекомендовано, возможна НAХT с последующей трахелэктомией в исследованиях Not recommended, NACT followed by trachelectomy may be considered in studies |
< 80 |
< 30 |
Ramirez P.T. et al., 2018 [20] |
|
Противопоказания Contraindications |
Редкие гистологические подтипы, метастазы, поражение параметрия Rare histological subtypes, metastases, parametrial involvement |
Радикальная гистерэктомия, химиолучевая терапия Radical hysterectomy, chemoradiotherapy |
Низкая Low |
Минималь-ная / Отсутствует Minimal / Absent |
ESGO/ESHRE/ESGE [9][15] |
Примечание: FIGO – Международная федерация акушеров и гинекологов; IA1, IA2, IB1, IB2 – подстадии рака шейки матки по FIGO (система стадирования опухолей); LVSI – лимфоваскулярная инвазия; НAХT – неоадъювантная химиотерапия.
Note: FIGO – International Federation of Gynecology and Obstetrics; IA1, IA2, IB1, IB2 – FIGO substages of cervical cancer (tumor staging system); LVSI – lymphovascular invasion; NACT – neoadjuvant chemotherapy.
Рак яичников / Ovarian cancer
Классический онкологический подход при РЯ включает выполнение тотальной абдоминальной гистерэктомии с двусторонней аднексэктомией, оментэктомии, тазовой и парааортальной лимфаденэктомии. Однако у молодых женщин с заболеванием на ранних стадиях и выраженным репродуктивным интересом все чаще применяется органосохраняющий подход, включающий сохранение матки и контралатеральной придаточной системы [35].
Согласно рекомендациям ESGO, показаниями к выполнению органосохраняющего вмешательства являются: одностороннее поражение яичника, низкая степень злокачественности (G1–G2), стадия IA или IC (по классификации FIGO), благоприятный гистологический подтип (серозный, муцинозный, эндометриоидный или смешанный), а также возраст моложе 40 лет [36].
Первые клинические сообщения о применении органосохраняющего лечения при РЯ у женщин репродуктивного возраста датируются 1997 г. Исследования подтвердили допустимость и онкологическую безопасность подобной тактики на ранних стадиях заболевания [37]. В ретроспективном многоцентровом исследовании J.M. Schilder с соавт. (2002), в которое были включены 42 пациентки с эпителиальным раком I стадии, 24 женщины планировали беременность, из них 17 смогли ее достичь, при этом сообщалось о 26 родах. Пятилетняя общая выживаемость составила 98 % [38].
В публикации Т. Satoh с соавт. (2010) подчеркивается необходимость тщательного отбора пациенток для органосохраняющего лечения. Было показано, что при ранней стадии и благоприятной гистологической картине (серозная, эндометриоидная, муцинозная опухоли низкой степени) органосохраняющее лечение без адъювантной химиотерапии является оправданным. Однако при светлоклеточном раке даже на стадии IA рекомендуется проведение химиотерапии, как и при стадии IC с односторонним поражением [39].
H. Kajiyama с соавт. (2014) в многоцентровом исследовании, включившем 96 пациенток с РЯ I стадии, выявили 14 рецидивов и 11 летальных исходов. Безрецидивная 5-летняя выживаемость составила 84,3 %. Частота рецидивов составила 100 % при светлоклеточном раке, 10 % при муцинозной карциноме и 37,5 % при других гистологических типах. Таким образом, гистологический подтип опухоли, степень злокачественности и стадия заболевания являются ключевыми прогностическими факторами при выборе тактики лечения [40].
Особое внимание уделяется светлоклеточному раку – этот подтип ассоциируется с неблагоприятным прогнозом и устойчивостью к стандартной химиотерапии на основе препаратов платины. Несмотря на это, при IA и IC1 стадиях возможно рассмотрение органосохраняющего подхода под строгим динамическим наблюдением [41].
Муцинозная карцинома яичников – редкий подтип, характеризующийся локализацией на ранней стадии, преимущественно у молодых женщин. Эти опухоли редко метастазируют лимфогенным путем. При инфильтративном росте в стандарт хирургического вмешательства включаются двусторонняя сальпингоофорэктомия, гистерэктомия, биопсия брюшины и лимфатических узлов, исследование аппендикса. Однако при одностороннем поражении возможно выполнение органосохраняющего вмешательства при сохранном контралатеральном яичнике [42].
Данные по применению органосохраняющей хирургии при эпителиальном раке II стадии ограничены. При двусторонних пограничных опухолях стандартом является односторонняя овариоэктомия с контралатеральной цистэктомией. Исследование Y. Yokoyama с соавт. (2006) показало лучшие показатели фертильности при двусторонней цистэктомии без увеличения риска рецидива [43].
Пограничные опухоли яичников составляют до 15 % всех опухолей данного органа и чаще диагностируются случайно во время лапароскопии по поводу доброкачественных новообразований. Обычно они серозного или муцинозного типа и выявляются у женщин моложе 40 лет [44].
G. Zanetta с соавт. наблюдали пациенток с I стадией пограничных опухолей, перенесших цистэктомию или одностороннюю овариоэктомию, в течение 3 лет. Отмечена частота рецидивов – 13 %, риск инвазивного рецидива – 1,6 %, смертность – 0,5 %, безрецидивная выживаемость – 89 % [45]. В исследовании M.D. Marchette с соавт. (средний срок наблюдения – 14 лет) частота наступления беременности составила 82,5 %, несмотря на 33,5 % рецидивов [46].
Отдельную категорию составляют герминогенные опухоли яичников, возникающие из половых клеток и преимущественно поражающие молодых женщин и девочек. К ним относятся незрелые тератомы, опухоли желточного мешка, эмбриональные карциномы, хориокарциномы, дисгерминомы. Ранее единственным методом лечения было радикальное удаление органов малого таза. Однако в настоящее время, благодаря высокой чувствительности этих опухолей к химиотерапии, стало возможным выполнение органосохраняющих операций (односторонняя аднексэктомия с сохранением матки) с последующим химиотерапевтическим лечением, при этом показатели излечения достигают 95 % [47]. Согласно обзору R.N Eskander. с соавт., рецидив заболевания наблюдался только у 9 из 515 женщин с герминогенными опухолями, получивших органосохраняющее лечение. Из них 185 женщин забеременели, и в 148 случаях беременности завершились живорождением [48].
В последние годы растет интерес к применению минимально инвазивных технологий в лечении РЯ, включая как лапароскопические, так и робот-ассистированные вмешательства. Ряд авторов выдвинули гипотезу, что такие подходы не только технически осуществимы, но и онкологически безопасны при ранних стадиях заболевания, в частности, в сравнении с традиционной лапаротомией. При этом подчеркиваются такие преимущества, как сокращение продолжительности госпитализации, ускоренное восстановление после операции и быстрое возвращение к повседневной жизни без ущерба для онкологических исходов [49].
Роботизированная хирургия на сегодняшний день рассматривается как логическое развитие лапароскопической технологии. Этот метод демонстрирует высокую воспроизводимость, особенно в сложных клинических случаях, таких как выполнение тазовой и парааортальной лимфодиссекции у пациенток с ожирением или в условиях ограниченной анатомической визуализации при распространенном опухолевом процессе [50]. Дополнительным преимуществом роботизированных систем является снижение физической нагрузки на хирурга за счет возможности сидячего положения во время операции и эргономичности инструментов.
Роботизированный подход позволяет более точно визуализировать внутрибрюшные структуры и таким образом повышает точность оценки распространенности заболевания, особенно в диагностически сложных случаях. Это может играть ключевую роль в стадировании опухолевого процесса, отборе пациентов для циторедуктивного лечения и принятии решения о дальнейшем ведении. Повышенная маневренность и визуальная четкость инструментов позволяют выполнять прицельную биопсию, особенно в труднодоступных анатомических зонах.
А. Fagotti с соавт. предложили использовать лапароскопический прогностический индекс (англ. Predictive Index Value, PIV), включающий такие критерии, как наличие сальниковой пробки, перитонеальный и диафрагмальный карциноматоз, ретракция брыжейки, инфильтрация желудочно-кишечного тракта и метастазы в печень, для оценки вероятности успешной циторедукции [51].
Первые сообщения о робот-ассистированных операциях при ранней стадии РЯ были опубликованы J.F. Magrina. с соавт. в 2011 г. В их исследовании 25 пациенток, перенесших роботизированное вмешательство, были сопоставлены с 119 пациентками после лапаротомии и 27 после лапароскопии. Безрецидивная и общая выживаемость были сопоставимы между всеми тремя группами [52].
J.V. Brown с соавт. в ретроспективном исследовании на 26 пациентках с ранней стадией РЯ, ограниченного областью малого таза, пришли к выводу, что роботизированная хирургия может быть безопасной альтернативой при низком риске интра- и послеоперационных осложнений [53]. В целом, хирургические и онкологические исходы после лапароскопических и роботизированных вмешательств оказались сопоставимыми. При этом обучение роботизированной технике занимает существенно меньше времени, чем освоение лапароскопической хирургии, что способствует более широкому применению данной технологии [54].
Однако применение роботизированной хирургии при распространенных формах РЯ остается предметом дискуссий. Существуют опасения, что тщательное исследование брюшной полости при перитонеальном канцероматозе может быть ограничено в рамках роботизированного доступа, особенно при отсутствии хорошо разработанной тактики этапной ревизии.
Альтернативные репродуктивные стратегии у пациенток с раком яичников / Alternative reproductive strategies for patients with ovarian cancer
Для женщин, нуждающихся в радикальном онкологическом лечении, но заинтересованных в сохранении фертильности, существуют альтернативные методы репродуктивного сохранения:
- криоконсервация эмбрионов без стимуляции овуляции может рассматриваться у пациенток с неадекватной овариальной реакцией или при противопоказаниях к гормональной стимуляции;
- криоконсервация ооцитов является допустимым вариантом у женщин с эпителиальным РЯ стадии IA, перенесших одностороннюю аднексэктомию, при условии стабильного состояния и отсутствия признаков прогрессирования заболевания;
- криоконсервация ткани яичника не рекомендуется при эпителиальных опухолях или у пациенток с высоким риском BRCA1/2-ассоциированного РЯ в силу возможного переноса опухолевых клеток при реимплантации;
- стимуляция суперовуляции для получения ооцитов может быть потенциально связана с риском рецидива, особенно при гормонозависимых опухолях, поэтому число стимуляционных циклов должно быть строго ограничено [55];
- применение агонистов и антагонистов гонадотропин-рилизинг-гормона (ГнРГ) рассматривается как мера защиты овариального резерва от гонадотоксического действия химиотерапии, хотя эффективность данной стратегии остается предметом обсуждения.
В таблице 3 суммируется информация по лечению РЯ с сохранением фертильности.
Таблица 3. Сводная таблица по лечению рака яичников с сохранением фертильности.
Table 3. Summary table of ovarian cancer treatment with fertility preservation.
|
Параметр Parameter |
Критерии отбора Selection criteria |
Методы лечения Treatment methods |
Частота ремиссии, % Remission rate, % |
Частота беременности, % Pregnancy rate, % |
Источник Reference |
|
Эпителиальный рак IА–IС1 стадии по FIGO Epithelial cancer FIGO stage IA–IC1 |
Возраст < 40 лет, односторонняя опухоль, G1–G2, благоприятный гистотип Age < 40 years, unilateral tumor, G1–G2, favorable histology |
Односторонняя аднексэктомия, сохранение матки и контралатерального яичника Unilateral adnexectomy with uterus and contralateral ovary preservation |
85–95 |
50–60 |
Schilder J.M. et al., 2002 [38]; ESGO/ESHRE/ESGE [9][15] |
|
IC2–IC3 стадия по FIGO или G3 FIGO stage IC2–IC3 or G3 |
Более агрессивное течение, капсулярная инвазия, асцит More aggressive course, capsular invasion, ascites |
Рассматривается при строгом контроле, ХТ обязательна Considered under strict monitoring, CT is mandatory |
65–80 |
30–40 |
Sato S. et al., 2010 [39] |
|
Светлоклеточный и серозный G3 Clear cell and serous G3 |
Высокий риск рецидива High risk of recurrence |
Органосохраняющее лечение не рекомендуется Fertility-sparing treatment is not recommended |
< 60 |
< 20 |
Satoh T. et al., 2011 [39] |
|
Пограничные опухоли яичников Borderline ovarian tumors |
Молодой возраст, стадия I, без инвазии Young age, stage I, no invasion |
Цистэктомия или односторонняя овариэктомия, возможно двустороннее щадящее вмешательство Cystectomy or unilateral oophorectomy, possible bilateral conservative surgery |
> 95 |
80–85 |
Zanetta G. et al., 2001 [45]; Marchette М.D. et al., 2020 [46] |
|
Герминогенные опухоли Germ cell tumors |
Подростки и молодые женщины, одностороннее поражение Adolescents and young women, unilateral involvement |
Односторонняя аднексэктомия, системная ХТ (BEP) Unilateral adnexectomy with systemic chemotherapy (BEC) |
> 90 |
70–80 |
Eskander R.N. et al., 2011 [48] |
Примечание: FIGO – Международная федерация акушеров и гинекологов; IA–IC3 – стадии заболевания по классификации FIGO; G1–G3 – степень злокачественности опухоли (степень: G1 – высокая, G3 – низкая); ХТ – химиотерапия; BEP – химиотерапевтический режим (блеомицин, этопозид, цисплатин).
Note: FIGO – International Federation of Gynecology and Obstetrics; IA–IC3 – disease stages according to FIGO; G1–G3 – tumor malignancy degree (Grade: G1 – high, G3 – low); CT – chemotherapy; BEP – chemotherapeutic regimen (bleomycin, etoposide, cisplatin).
Роботизированная трансплантация матки: современное состояние и перспективы / Robotic uterine transplantation: current status and prospects
Трансплантация матки представляет собой инновационное направление в области репродуктивной медицины и трансплантологии, предлагающее решение для женщин с абсолютной формой маточного бесплодия. Первая попытка трансплантации матки от живого донора была предпринята в 2000 г. Однако данное вмешательство завершилось неудачей из-за развития некроза трансплантированного органа в течение 3 месяцев после операции [56].
Значительный прогресс был достигнут в 2011 г., когда в Турции успешно была выполнена первая трансплантация матки от посмертного донора [57]. Впоследствии в Швеции было проведено первое клиническое исследование с участием живых доноров, в рамках которого осуществлено 9 трансплантаций, что привело к 5 успешным случаям живорождения [58].
С 2015 г. в практике трансплантации матки стали применяться методы минимально инвазивной хирургии, в частности робот-ассистированная хирургия. В Китае была проведена первая роботизированная гистерэктомия у живого донора с целью последующей трансплантации матки [59]. Как описано M. Brännström с соавт., данная процедура осуществляется через 5 портов: 3 роботизированных и 2 лапароскопических. Ход операции аналогичен радикальной гистерэктомии, включая мобилизацию и пересечение мочеточников. Однако наиболее технически сложным этапом является выделение сосудистых ножек (артерий и вен) достаточной длины, которые необходимы для последующего создания сосудистых анастомозов при трансплантации [58].
Традиционно операция у реципиента проводится лапаротомическим доступом. Однако недавние публикации свидетельствуют о возможности выполнения роботизированной трансплантации матки и у реципиентов. В частности, в одном из последних обзоров, опубликованных M. Brännström с соавт., описан успешный случай роботизированной трансплантации матки пациентке-реципиенту, что открывает перспективы расширения применения робототехники в этой высокотехнологичной области хирургии [58].
Использование роботизированных систем при трансплантации матки представляет собой значительное достижение, способное минимизировать интраоперационную травму, сократить кровопотерю, снизить болевой синдром в послеоперационном периоде и ускорить реабилитацию пациенток. Учитывая сложность сосудистой анатомии и необходимость точной координации движений при диссекции сосудов и формировании анастомозов, робототехника позволяет повысить безопасность и эффективность вмешательств как у доноров, так и у реципиентов.
Таким образом, роботизированная трансплантация матки представляет собой перспективное направление, находящееся на этапе активного развития, с высоким потенциалом интеграции в клиническую практику трансплантологии и репродуктивной медицины.
Заключение / Conclusion
Лечение женщин с гинекологическими злокачественными новообразованиями, заинтересованных в сохранении репродуктивной функции, представляет собой одну из наиболее сложных задач современной онкогинекологии. Подобный клинический сценарий требует строго индивидуализированного подхода и участия мультидисциплинарной команды, включающей гинеколога-онколога, репродуктолога, патоморфолога, радиолога и, при необходимости, психолога.
Развитие технологий роботизированной хирургии открывает новые возможности для таких пациенток, предлагая высокоточную, минимально инвазивную альтернативу традиционным методам лечения. Благодаря улучшенной визуализации, повышенной маневренности инструментов и эргономике, робот-ассистированные вмешательства могут способствовать максимально щадящему удалению опухоли с сохранением репродуктивных органов и тканей. Эти технологии позволяют достичь онкологической радикальности, не снижая при этом шансов на реализацию репродуктивной функции в будущем.
Таким образом, роботизированная хирургия может рассматриваться как перспективный и эффективный компонент комплексного лечения гинекологических онкологических заболеваний у женщин репродуктивного возраста, стремящихся к сохранению фертильности.
Список литературы
1. Гордиенко В.П., Леонтьева С.Н., Коробкова Т.Н. Рак репродуктивных органов у женщин Дальневосточного федерального округа. Сибирский онкологический журнал. 2020;19(3):23–37. https://doi.org/10.21294/1814-4861-2020-19-2-23-37.
2. Злокачественные новообразования в России в 2021 году (заболеваемость и смертность). Под ред. А.Д. Каприна, В.В. Старинского, А.О. Шахзадовой. М., 2022. 252 с.
3. Кононова Г.А., Жуйкова Л.Д., Ананина О.А. и др. Рак репродуктивной системы у женщин Республики Тыва. Эпидемиологические особенности. Сибирский онкологический журнал. 2024;23(3):5–14. https://doi.org/10.21294/1814-4861-2024-23-3-5-14.
4. Siegel R.L., Miller K.D., Wagle N.S., Jemal A. Cancer statistics, 2023. CA Cancer J Clin. 2023;73(1):17–48. https://doi.org/10.3322/caac.21763.
5. Howlader N., Noone A.M., Krapcho M. et al. SEER Cancer Statistics Review, 1975–2016. National Cancer Institute, Bethesda, 2019. Available at: https://seer.cancer.gov/csr/1975_2016/.
6. Архангельский В.Н., Калачикова О.Н. Возраст матери при рождении первого ребенка: динамика, региональные различия, детерминация. Экономические и социальные перемены: факты, тенденции, прогноз. 2020;13(5):200–17. https://doi.org/10.15838/esc.2020.5.71.12.
7. Diaz-Arrastia C., Jurnalov C., Gomez G., Townsend C. Laparoscopic hysterectomy using a computer-enhanced surgical robot. Surg Endosc. 2002;16(9):1271–3. https://doi.org/10.1007/s00464-002-8523-5.
8. Бабаева Н.А., Антонова И.Б., Ивашина С.В. и др. Рак эндометрия у молодых: возможности органосохраняющего лечения при рецидивах. Акушерство и гинекология. 2020;(S1):130–6. https://doi.org/10.18565/aig.2020.1suppl.130-136.
9. Rodolakis A., Scambia G., Planchamp F. et al. ESGO/ESHRE/ESGE Guidelines for the fertility-sparing treatment of patients with endometrial carcinoma. Hum Reprod Open. 2023;2023(1):hoac057. https://doi.org/10.1093/hropen/hoac057.
10. Zhang Q., Qi G., Kanis M.J. et al. Comparison among fertility-sparing therapies for well differentiated early-stage endometrial carcinoma and complex atypical hyperplasia. Oncotarget. 2017;8(34):57642–53. https://doi.org/10.18632/oncotarget.17588.
11. Mazzon I., Corrado G., Morricone D., Scambia G. Reproductive preservation for treatment of stage IA endometrial cancer in a young woman: hysteroscopic resection. Int J Gynecol Cancer. 2005;15(5):974–8. https://doi.org/10.1111/j.1525-1438.2005.00162.x.
12. Giampaolino P., Di Spiezio Sardo A., Mollo A. et al. Hysteroscopic endometrial focal resection followed by levonorgestrel intrauterine device insertion as a fertility-sparing treatment of atypical endometrial hyperplasia and early endometrial cancer: a retrospective study. J Minim Invasive Gynecol. 2019;26(4):648-656. https://doi.org/10.1016/j.jmig.2018.07.001.
13. Gu H., Li J., Gu Y. et al. Survival impact of ovarian preservation on women with early-stage endometrial cancer: a systematic review and meta-analysis. Int J Gynecol Cancer. 2017;27(1):77–84. https://doi.org/10.1097/IGC.0000000000000857.
14. Jones B.P., Kasaven L., Vali S. et al. Uterine transplantation: review of livebirths and reproductive implications. Transplantation. 2021;105(8):1695–707. https://doi.org/10.1097/TP.0000000000003578.
15. Cibula D., Raspollini M.R., Planchamp F. et al. ESGO/ESTRO/ESP Guidelines for the management of patients with cervical cancer – Update 2023. Int J Gynecol Cancer. 2023;33(5):649–66. https://doi.org/10.1136/ijgc-2023-004429.
16. Wolswinkel J.T., Eikelder M.L.G.T., Verhoef C.G., Zusterzeel P.L.M. High- or intermediate-risk histologic features in patients with clinical early-stage cervical cancer planned for fertility-sparing surgery: a systematic review. Cancers (Basel). 2023;15(15):3920. https://doi.org/10.3390/cancers15153920.
17. Persson J., Kannisto P., Bossmar T. Robot-assisted abdominal laparoscopic radical trachelectomy. Gynecol Oncol. 2008;111(3):564–7. https://doi.org/10.1016/j.ygyno.2008.05.034.
18. Ekdahl L., Crusensvärd M., Reynisson P. et al. Quality of life and long-term clinical outcome following robot-assisted radical trachelectomy. Eur J Obstet Gynecol Reprod Biol. 2021;267:234–40. https://doi.org/10.1016/j.ejogrb.2021.11.018.
19. Api M., Boza A., Ceyhan M. Robotic versus laparoscopic radical trachelectomy for early-stage cervical cancer: case report and review of literature. J Minim Invasive Gynecol. 2016;23(5):677–83. https://doi.org/10.1016/j.jmig.2015.11.009.
20. Ramirez P.T., Frumovitz M., Pareja R. et al. Minimally invasive versus abdominal radical hysterectomy for cervical cancer. N Engl J Med. 2018;379(20):1895–904. https://doi.org/10.1056/NEJMoa1806395.
21. Lewicki P.J., Basourakos S.P., Qiu Y. et al. Effect of a randomized, controlled trial on surgery for cervical cancer. N Engl J Med. 2021;384(17):1669–71. https://doi.org/10.1056/NEJMc2035819.
22. Shekhar S., Jeyaseelan L. Laparoscopic or open radical hysterectomy for early stage cancer cervix: data inconsistency of LACC Trial. Asian Pac J Cancer Prev. 2019;20(10):2881. https://doi.org/10.31557/APJCP.2019.20.10.2881.
23. Salvo G., Ramirez P.T., Leitao M.M. et al. Open vs minimally invasive radical trachelectomy in early-stage cervical cancer: International Radical Trachelectomy Assessment Study. Am J Obstet Gynecol. 2022;226(1):97. e1–97.e16. https://doi.org/10.1016/j.ajog.2021.08.029.
24. Leitao M.M., Bixel K.L., Chase D.M. et al. ROCC/GOG-3043: a randomized controlled trial of robotic versus open surgery for early-stage cervical cancer. Int J Gynecol Cancer. 2025 Feb 28:101760. https://doi.org/10.1016/j.ijgc.2025.101760.
25. Falconer H., Palsdottir K., Stalberg K. et al. Robot-assisted approach to cervical cancer (RACC): an international multi-center, open-label randomized controlled trial. Int J Gynecol Cancer. 2019;29(6):1072–6. https://doi.org/10.1136/ijgc-2019-000558.
26. Schmeler K.M., Pareja R., Blanco A.L. et al. ConCerv: a prospective trial of conservative surgery for low-risk early-stage cervical cancer. Int J Gynecol Cancer. 2021;31(10):1317–25. https://doi.org/10.1136/ijgc-2021-002921.
27. Carneiro V.C.G., Batista T.P., Andrade M.R. et al. Proof-of-concept randomized phase II non-inferiority trial of simple versus type B2 hysterectomy in early-stage cervical cancer ≤ 2 cm (LESSER). Int J Gynecol Cancer. 2023;33(4):498–503. https://doi.org/10.1136/ijgc-2022-004092.
28. Ekdahl L., Paraghamian S., Eoh K.J. et al. Long term oncologic and reproductive outcomes after robot-assisted radical trachelectomy for early-stage cervical cancer. An international multicenter study. Gynecol Oncol. 2022;164(3):529–34. https://doi.org/10.1016/j.ygyno.2021.12.029.
29. Smith E.S., Moon A.S., O'Hanlon R. et al. Radical trachelectomy for the treatment of early-stage cervical cancer: a systematic review. Obstet Gynecol. 2020;136(3):533–42. https://doi.org/10.1097/AOG.0000000000003952.
30. Gubbala K., Laios A., Gallos I. et al. Outcomes of ovarian transposition in gynaecological cancers; a systematic review and meta-analysis. J Ovarian Res. 2014;7:69. https://doi.org/10.1186/1757-2215-7-69.
31. Swift B.E., Leung E., Vicus D., Covens A. Laparoscopic ovarian transposition prior to pelvic radiation for gynecologic cancer. Gynecol Oncol Rep. 2018;24:78–82. https://doi.org/10.1016/j.gore.2018.04.005.
32. Iavazzo C., Darlas F.M., Gkegkes I.D. The role of robotics in ovarian transposition. Acta Inform Med. 2013;21(2):135–7. https://doi.org/10.5455/aim.2013.21.135-137.
33. Pavone M., Autorino R., Bizzarri N. et al. Uterine transposition versus uterine ventrofixation before radiotherapy as a fertility sparing option in young women with pelvic malignancies: Systematic review of the literature and dose simulation. Eur J Surg Oncol. 2024;50(1):107270. https://doi.org/10.1016/j.ejso.2023.107270.
34. Ribeiro R., Baiocchi G., Moretti-Marques R. et al. Uterine transposition for fertility and ovarian function preservation after radiotherapy. Int J Gynecol Cancer. 2023;33(12):1837–42. https://doi.org/10.1136/ijgc-2023-004723.
35. Vitobello D., Siesto G., Bulletti C. et al. Gynecological fertility-sparing surgery. Placenta. 2011;32 Suppl 3:S224–31. https://doi.org/10.1016/j.placenta.2011.06.017.
36. Morice P., Denschlag D., Rodolakis A. et al. Fertility Task Force of the European Society of Gynecologic Oncology. Recommendations of the Fertility Task Force of the European Society of Gynecologic Oncology about the conservative management of ovarian malignant tumors. Int J Gynecol Cancer. 2011;21(5):951–63. https://doi.org/10.1097/IGC.0b013e31821bec6b.
37. Zanetta G., Chiari S., Rota S. et al. Conservative surgery for stage I ovarian carcinoma in women of childbearing age. Br J Obstet Gynaecol. 1997;104(9):1030–5. https://doi.org/10.1111/j.1471-0528.1997.tb12062.x.
38. Schilder J.M., Thompson A.M., DePriest P.D. et al. Outcome of reproductive age women with stage IA or IC invasive epithelial ovarian cancer treated with fertility-sparing therapy. Gynecol Oncol. 2002;87(1):1–7. https://doi.org/10.1006/gyno.2002.6805.
39. Satoh T., Hatae M., Watanabe Y. et al. Outcomes of fertility-sparing surgery for stage I epithelial ovarian cancer: a proposal for patient selection. J Clin Oncol. 2010;28(10):1727–32. https://doi.org/10.1200/JCO.2009.24.8617.
40. Kajiyama H., Mizuno M., Shibata K. et al. Recurrence-predicting prognostic factors for patients with early-stage epithelial ovarian cancer undergoing fertility-sparing surgery: a multi-institutional study. Eur J Obstet Gynecol Reprod Biol. 2014;175:97–102. https://doi.org/10.1016/j.ejogrb.2014.01.014.
41. Yoshihara M., Kajiyama H., Tamauchi S. et al. Prognostic factors and effects of fertility-sparing surgery in women of reproductive age with ovarian clear-cell carcinoma: a propensity score analysis. J Gynecol Oncol. 2019;30(6):e102. https://doi.org/10.3802/jgo.2019.30.e102.
42. Kurnit K.C., Frumovitz M. Primary mucinous ovarian cancer: options for surgery and chemotherapy. Int J Gynecol Cancer. 2022;32(11):1455–62. https://doi.org/10.1136/ijgc-2022-003806.
43. Yokoyama Y., Moriya T., Takano T. et al. Clinical outcome and risk factors for recurrence in borderline ovarian tumours. Br J Cancer. 2006;94(11):1586–91. https://doi.org/10.1038/sj.bjc.6603139.
44. Sonigo C., Sermondade N., Benard J. et al. Past, present and future of fertility preservation in cancer patients. Future Oncol. 2015;11(19):2667–80. https://doi.org/10.2217/fon.15.152.
45. Zanetta G., Rota S., Chiari S. et al. Behavior of borderline tumors with particular interest to persistence, recurrence, and progression to invasive carcinoma: a prospective study. J Clin Oncol. 2001;19(10):2658–64. https://doi.org/10.1200/JCO.2001.19.10.2658.
46. Marchette M.D., Ceppi L., Andreano A. et al. Oncologic and fertility impact of surgical approach for borderline ovarian tumours treated with fertility sparing surgery. Eur J Cancer. 2019;111:61–68. https://doi.org/10.1016/j.ejca.2019.01.021.
47. Perrin L.C., Low J., Nicklin J.L. et al. Fertility and ovarian function after conservative surgery for germ cell tumours of the ovary. Aust N Z J Obstet Gynaecol. 1999;39(2):243–5. https://doi.org/10.1111/j.1479-828x.1999.tb03382.x.
48. Eskander R.N., Randall L.M., Berman M.L. et al. Fertility preserving options in patients with gynecologic malignancies. Am J Obstet Gynecol. 2011;205(2):103–10. https://doi.org/10.1016/j.ajog.2011.01.025.
49. Nezhat F.R., DeNoble S.M., Liu C.S. et al. The safety and efficacy of laparoscopic surgical staging and debulking of apparent advanced stage ovarian, fallopian tube, and primary peritoneal cancers. JSLS. 2010;14(2):155–68. https://doi.org/10.4293/108680810X12785289143990.
50. Pérez-Quintanilla M., Del Real-Ordoñez S., Gallardo-Alvarado L., Cantu-de L.D. Fertility-sparing treatment for epithelial ovarian cancer: a literature review. Chin Clin Oncol. 2020;9(4):48. https://doi.org/10.21037/cco-20-38.
51. Fagotti A., Perelli F., Pedone L., Scambia G. Current recommendations for minimally invasive surgical staging in ovarian cancer. Curr Treat Options Oncol. 2016;17(1):3. https://doi.org/10.1007/s11864-015-0379-8.
52. Magrina J.F., Cetta R.L., Chang Y.H. et al. Analysis of secondary cytoreduction for recurrent ovarian cancer by robotics, laparoscopy and laparotomy. Gynecol Oncol. 2013;129(2):336–40. https://doi.org/10.1016/j.ygyno.2013.01.015.
53. Brown J.V., Mendivil A.A., Abaid L.N. et al. The safety and feasibility of robotic-assisted lymph node staging in early-stage ovarian cancer. Int J Gynecol Cancer. 2014;24(8):1493–8. https://doi.org/10.1097/IGC.0000000000000224.
54. Minig L., Padilla Iserte P., Zorrero C., Zanagnolo V. Robotic surgery in women with ovarian cancer: surgical technique and evidence of clinical outcomes. J Minim Invasive Gynecol. 2016;23(3):309–16. https://doi.org/10.1016/j.jmig.2015.10.014.
55. Schüring A.N., Fehm T., Behringer K. et al. Practical recommendations for fertility preservation in women by the FertiPROTEKT network. Part I: Indications for fertility preservation. Arch Gynecol Obstet. 2018;297(1):241–55. https://doi.org/10.1007/s00404-017-4594-3.
56. Fageeh W., Raffa H., Jabbad H., Marzouki A. Transplantation of the human uterus. Int J Gynaecol Obstet. 2002;76(3):245–51. https://doi.org/10.1016/s0020-7292(01)00597-5.
57. Ozkan O., Ozkan O., Dogan N.U. et al. Birth of a healthy baby 9 years after a surgically successful deceased donor uterus transplant. Ann Surg. 2022;275(5):825–32. https://doi.org/10.1097/SLA.0000000000005346.
58. Brännström M., Johannesson L., Bokström H. et al. Livebirth after uterus transplantation. Lancet. 2015;385(9968):607–16. https://doi.org/10.1016/S0140-6736(14)61728-1.
59. Wei L., Xue T., Tao K.S. et al. Modified human uterus transplantation using ovarian veins for venous drainage: the first report of surgically successful robotic-assisted uterus procurement and follow-up for 12 months. Fertil Steril. 2017;108(2):346–356.e1. https://doi.org/10.1016/j.fertnstert.2017.05.039.
Об авторах
А. У. ХамадьяноваRussian Federation
Хамадьянова Аида Ульфатовна - к.м.н.
450008 Уфа, ул. Ленина, д. 3
Т. Т. Гаев
Russian Federation
Гаев Тамерлан Толикович.
362019 Республика Северная Осетия–Алания, Владикавказ, ул. Пушкинская, д. 40
Д. О. Гацоев
Russian Federation
Гацоев Дзамболат Олегович.
362019 Республика Северная Осетия–Алания, Владикавказ, ул. Пушкинская, д. 40
В. В. Андреев
Russian Federation
Андреев Вадим Валерьевич.
603000 Нижний Новгород, площадь Минина и Пожарского, д. 10/1
А. С. Пажитнова
Russian Federation
Пажитнова Ангелина Сергеевна.
117513 Москва, ул. Островитянова, д. 1
Э. О. Тихонова
Russian Federation
Тихонова Эльвира Олеговна.
350063 Краснодар, ул. Митрофана Седина, д. 4
В. Г. Ким
Russian Federation
Ким Владимир Георгиевич.
630091 Новосибирск, ул. Красный проспект, д. 52
Д. А. Талалаева
Russian Federation
Талалаева Дарья Андреевна.
450008 Уфа, ул. Ленина, д. 3
В. Е. Агапова
Russian Federation
Агапова Виктория Евгеньевна.
117513 Москва, ул. Островитянова, д. 1
Р. С. Ботина
Russian Federation
Ботина Регина Сергеевна.
420008 Казань, ул. Кремлевская, д. 18
А. К. Яковлева
Russian Federation
Яковлева Арина Константиновна.
420008 Казань, ул. Кремлевская, д. 18
С. Д. Васильева
Russian Federation
Васильева София Дмитриевна.
450008 Уфа, ул. Ленина, д. 3
Д. Ю. Бакулин
Russian Federation
Бакулин Дмитрий Юрьевич.
117513 Москва, ул. Островитянова, д. 1
Что уже известно об этой теме?
► Около 30 % случаев рака шейки матки (РШМ) и 12 % рака яичников (РЯ) диагностируются у женщин моложе 45 лет, что делает вопросы сохранения фертильности клинически значимыми.
► Органосохраняющее лечение возможно при стадиях IA-IB1 РШМ, IA-IC1 эпителиального РЯ и высокодифференцированном эндометриоидном раке I стадии.
► Робот-ассистированная хирургия используется в онкогинекологии с 2005 г.; доказана ее сопоставимая онкологическая эффективность по сравнению с лапаротомией при опухолях < 2 см.
Что нового дает статья?
► Частота наступления беременности после роботизированной радикальной трахелэктомии составляет до 72 %, а живорождения – более 86 % при сроке ≥ 32 недель.
► При органоосохраняющем лечении рака эндометрия с использованием гистероскопии и прогестинов полная ремиссия достигается у 79 % пациенток, беременность – у 35–53 %.
► У женщин с пограничными опухолями яичников 5-летняя выживаемость достигает 99 %, частота рецидивов после органосохраняющего лечения – до 30 %, беременность наступает в 82–85 % случаев.
Как это может повлиять на клиническую практику в обозримом будущем?
► Интеграция роботизированных технологий в органосохраняющее лечение может расширить показания за счет повышения точности и снижения осложнений.
► Успешные случаи роботизированной трансплантации матки открывают перспективу лечения абсолютного маточного бесплодия онкологического генеза.
Рецензия
Для цитирования:
Хамадьянова А.У., Гаев Т.Т., Гацоев Д.О., Андреев В.В., Пажитнова А.С., Тихонова Э.О., Ким В.Г., Талалаева Д.А., Агапова В.Е., Ботина Р.С., Яковлева А.К., Васильева С.Д., Бакулин Д.Ю. Минимально инвазивные и робот-ассистированные вмешательства в лечении гинекологических злокачественных опухолей: возможности сохранения репродуктивной функции. Акушерство, Гинекология и Репродукция. 2025;19(4):545-560. https://doi.org/10.17749/2313-7347/ob.gyn.rep.2025.628
For citation:
Khamadyanova A.U., Gaev T.T., Gatsoev D.O., Andreev V.V., Pazhitnova A.S., Tikhonova E.O., Kim V.G., Talalaeva D.A., Agapova V.V., Botina R.S., Yakovleva A.K., Vasilieva S.D., Bakulin D.Yu. Minimally invasive and robot-assisted interventions in the treatment of gynecological malignant tumors: opportunities for preserving reproductive function. Obstetrics, Gynecology and Reproduction. 2025;19(4):545-560. (In Russ.) https://doi.org/10.17749/2313-7347/ob.gyn.rep.2025.628
JATS XML

Контент доступен под лицензией Creative Commons Attribution-NonCommercial-ShareAlike 4.0 International License.










































