Перейти к:
Роль нанотехнологий в диагностике и лечении злокачественных новообразований женской репродуктивной системы
https://doi.org/10.17749/2313-7347/ob.gyn.rep.2025.617
Аннотация
Введение. Благодаря повышению точности обнаружения, эффективности лечения и минимизации побочных эффектов, нанотехнологии могут способствовать улучшению диагностики и лечения пациентов со злокачественными новообразованиями (ЗНО) женской репродуктивной системы.
Цель: обобщить современные литературные данные и оценить роль нанотехнологий в лечении рака шейки матки (РШМ), рака яичников (РЯ), рака эндометрия (РЭ) и выявить пробелы, требующие проведения дальнейших исследований.
Материалы и методы. Поиск проводился в электронных базах данных PubMed/MEDLINE, Google Scholar и еLibrary по следующим ключевым словам: «гинекологический рак», «таргетная терапия», «рак шейки матки», «рак яичников», «рак эндометрия», «нанотехнологии», «наночастицы», «gynecologic cancer», «targeted therapy», «cervical cancer», «ovarian cancer», «endometrial cancer», «nanotechnology», «nanoparticles». Все работы были опубликованы в период с 2011 по 2024 гг.
Результаты. Системы доставки лекарств на базе наноносителей представляют собой перспективный подход в лечении онкозаболеваний женской репродуктивной системы, обеспечивая точную доставку препаратов непосредственно к опухолевым клеткам. Такие системы, включащие липосомы, наночастицы, мицеллы и дендримеры, характеризуются повышенной эффективностью, уменьшенной токсичностью и возможностью контролируемого высвобождения активных компонентов. Нанотехнологии повышают эффективность вакцин, увеличивая период их полураспада, оказывают влияние на микроокружение РШМ и усиливают противоопухолевый иммунный ответ при минимальной токсичности. Нановакцины способны осуществлять доставку антигенов и адъювантов непосредственно к иммунным клеткам, усиливая иммунный ответ и улучшая результаты лечения РЯ. Нанотехнологии демонстрируют значительный потенциал в улучшении терапии РЭ, несмотря на то, что их роль в этом контексте пока менее исследована по сравнению с другими видами ЗНО женской репродуктивной системы.
Заключение. Наночастицы способны переносить как обычные лекарственные вещества, так и системы на базе белков и нуклеиновых кислот непосредственно к раковым клеткам. Однако лишь немногие методы лечения ЗНО женской репродуктивной системы, основанные на применении наночастиц, получили одобрение для использования. Данная область добивается значительных успехов, продвигаясь к появлению более эффективных и широкодоступных методов лечения.
Ключевые слова
Для цитирования:
Файзуллина З.Р., Жиленко А.А., Исламгулов А.Х., Черная Е.А., Точиева А.И., Санова А.А., Дряева Д.А., Хакназаров С.Ш., Газизов Т.Р., Отаджонов М.М., Мержоева Х.А., Маликова Е.В., Глазепа В.А., Матвиец А.К. Роль нанотехнологий в диагностике и лечении злокачественных новообразований женской репродуктивной системы. Акушерство, Гинекология и Репродукция. 2025;19(4):590-607. https://doi.org/10.17749/2313-7347/ob.gyn.rep.2025.617
For citation:
Faizullina Z.R., Zhilenko A.A., Islamgulov A.Kh., Chernaya E.A., Tochieva A.I., Sanova A.A., Dryaeva D.A., Khaknazarov S.Sh., Gazizov T.R., Otadzhonov M.M., Merzhoeva Kh.A., Malikova E.V., Glazepa V.A., Matviets A.K. The role of nanotechnologies in diagnostics and treatment of female reproductive system cancer. Obstetrics, Gynecology and Reproduction. 2025;19(4):590-607. (In Russ.) https://doi.org/10.17749/2313-7347/ob.gyn.rep.2025.617
Введение / Introduction
Гинекологический рак – группа злокачественных новообразований (ЗНО), поражающих органы женской репродуктивной системы, представленные опухолями шейки матки, тела матки, яичников, фаллопиевых труб, вульвы и влагалища. Данные виды ЗНО являются одними из основных причин высокой смертности от рака во всем мире, что подчеркивает их существенное влияние на здоровье женщин [1][2]. В недавнем докладе Всемирной организации здравоохранения подчеркивается, что рак шейки матки (РШМ) является четвертым по распространенности онкологическим заболеванием среди женщин во всем мире: в 2022 г. зарегистрировано около 660 тыс. новых случаев заболевания и 350 тыс. смертей [3]. Распространенность рака эндометрия (РЭ), который занимает лишь 15-е место среди ЗНО женской репродуктивной системы, в 2022 г. составила 420 368 случаев [4]. Заболеваемость раком яичников (РЯ), отличающимся высоким уровнем смертности (207 252 во всем мире в 2020 г.) и занимающим 18-е место в мире и 8-е место среди женщин, в 2022 г. составила более 324 603 новых случаев [5]. В совокупности 3 данные патологии вносят значительный вклад в онкологическую заболеваемость и смертность, уступая лишь раку молочной железы (РМЖ) [1][6]. Несмотря на успехи в лечении ЗНО женской репродуктивной системы, проблемы, связанные с высоким уровнем их распространенности и смертности, сохраняются и продолжают расти, подчеркивая необходимость дальнейшего совершенствования стратегий профилактики, раннего выявления и лечения [7]. В настоящее время нанотехнологии являются перспективным подходом к решению этих проблем. Благодаря повышению точности диагностики, эффективности лечения и минимизации побочных эффектов, нанотехнологии могут способствовать улучшению клинических результатов [8].
Стандартные методы лечения, включающие хирургическое вмешательство, радиотерапию и химиотерапию, применяются по отношению к большинству пациентов с ЗНО как в виде монотерапии, так и в виде комбинаций. Хоть и оперативное лечение является основополагающим методом вмешательства при большинстве солидных локализованных опухолей, при появлении метастазов оно требует применения дополнительных методов терапии [9][10]. Лучевая терапия применяется более чем у половины пациентов с ЗНО и является одним из наиболее эффективных методов лечения, однако ее применение ассоциировано с развитием токсичности [11]. Традиционная химиотерапия также сопряжена с ограничениями, связанными с развитием побочных эффектов, биодоступностью лекарственных веществ и ограничениями в уничтожении субпопуляций раковых стволовых клеток, что может привести к рецидиву заболевания [12]. Заключение лекарственных препаратов в специальные среды для обеспечения относительно стабильного микроокружения и повышения биодоступности способно уменьшить выраженность проявления нежелательных явлений, связанных с лечением онкологических заболеваний, и избежать негативных последствий химиотерапии.
Технологии наномедицины применяются при большом количестве заболеваний и способны улучшить транспортировку противоопухолевых препаратов [13][14]. За прошедшие годы наномедицина прошла определенный период становления от использования нецелевой доставки веществ к таргетной, от применения простых материалов к созданию сложных систем, что способствовало эффективной транспортировке противоопухолевых лекарственных средств, а также повышению точности диагностики новообразований. Сочетание нанотехнологий и традиционной терапии онкологических заболеваний может не только улучшить свойства химиорадиотерапевтических препаратов, но и снизить частоту возникновения побочных эффектов [15]. Агентство Министерства здравоохранения и социальных служб США допустило к использованию для лечения онкопатологий такие терапевтические наночастицы как липосомы, альбумин и полимерные мицеллы, так как они способны быстро и целенаправленно преодолевать биологические барьеры, непрерывно высвобождая содержимое для поддержания соответствующей концентрации препарата в организме человека [16]. Растущий интерес к производству новых форм доставки позволяет избежать недостатков, связанных с применением традиционных методов лечения и повысить доклиническую и клиническую эффективность лечения заболеваний [17].
Цель: обобщить современные литературные данные и оценить роль нанотехнологий в лечении РШМ, РЯ, РЭ и выявить пробелы, требующие проведения дальнейших исследований.
Материалы и методы / Materials and Methods
Выполнен поиск публикаций в электронных базах данных PubMed/MEDLINE, Google Scholar и еLibrary. Поиск проводился по следующим ключевым словам на русском и английском языках: «гинекологический рак», «таргетная терапия», «рак шейки матки», «рак яичников», «рак эндометрия», «нанотехнологии», «наночастицы», «gynecological cancer», «targeted therapy», «cervical cancer», «ovarian cancer», «endometrial cancer», «nanotechnology», «nanoparticles». Все работы были опубликованы в период с 2011 по 2024 гг Авторы независимо друг от друга провели анализ заголовков и аннотаций статей. В процессе подготовки обзора был использован следующий алгоритм для отбора источников: до начала скрининга исключались дубликаты; в процессе скрининга авторы анализировали названия и аннотации отобранных статей, проверяя их соответствие теме обзора и наличие полного текста, на данном этапе исключали тезисы и статьи, не имеющие полного текста. Критериями включения явились: полнотекстовая публикация литературного обзора, метаанализа, систематического обзора, рандомизированного контролируемого исследования или экспериментального исследования in vitro, in vivo на русском или английском языках; оригинальные, опубликованные в рецензируемых научных журналах статьи, содержащие вышеуказанные ключевые слова. В конечном итоге в настоящий обзор были включены 103 источника. Алгоритм отбора продемонстрирован на рисунке 1.
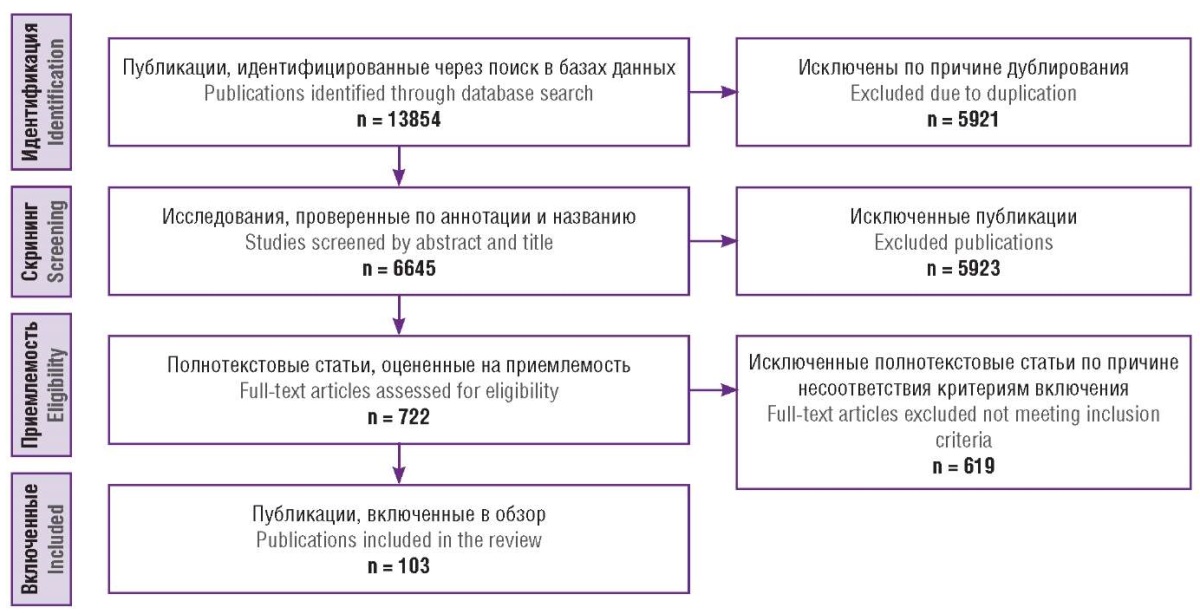
Рисунок 1. Алгоритм поиска исследований.
Figure 1. Publications search algorithm.
Результаты и обсуждение / Results and Discussion
Роль нанотехнологий в онкологии: механизмы воздействия и терапевтический потенциал / The role of nanotechnology in oncology: mechanisms of action and therapeutic potential
Возможности нанотехнологий нацелены на управление с помощью наноматериалов и наночастиц физическими, химическими и биологическими процессами, протекающими в живых организмах на молекулярном уровне. Данная концепция была впервые представлена физиком Ричардом Фейнманом в 1959 г. и с тех пор стала передовой темой для исследований, особенно в контексте лечения онкологических заболеваний [18]. Сегодня нанотехнологии предлагают революционные решения, способствующие обнаружению и лечению онкопатологий, тем самым повышая эффективность оказания помощи пациентам данной группы [18–20].
Основной принцип действия нанотехнологий заключается в том, что уменьшение размера частиц существенно изменяет их механические, физические, оптические и химические характеристики [21]. Такие методы, как нанофабрикация, автоматическая сборка и управление наночастицами, позволяют создавать и контролировать некоторые материалы с исключительной точностью [21]. Типы наноматериалов и их свойства определяются размером, который не должен превышать 100 нм. Их можно разделить на различные группы, включая наночастицы, нанокомпозиты и нанотрубки. Эти материалы обладают повышенной прочностью, проводимостью, каталитической активностью, а также улучшенными оптическими свойствами, что обусловлено большей площадью поверхности и квантовыми эффектами [21][22].
Полимерные наночастицы (ПНЧ) используются для адресной доставки лекарств, обеспечивая высокую точность попадания действующих веществ в раковые клетки, являющиеся терапевтической мишенью [22]. Дендримеры могут использоваться в рамках таргетной терапии ввиду наличия высокоразветвленной структуры, позволяющей присоединять несколько молекул лекарственного вещества. Мицеллы и липосомы улучшают растворимость препаратов, повышая эффективность лечения. Белковые и клеточные мембранные наночастицы способны воздействовать на определенные раковые клетки, повышая селективность терапии [23][24]. Наночастицы мезопористого кремнезема используются для контролируемого высвобождения лекарственного вещества, позволяя пролонгировать эффект вводимых веществ. Наночастицы золота (AuNPs), известные своими оптическими свойствами, применяются в фототермической терапии для избирательного уничтожения раковых клеток с помощью излучения. Наночастицы оксида железа используются в магнитно-резонансной томографии (МРТ) и таргетной терапии, обеспечивая достижение как диагностических, так и лечебных целей. Квантовые точки способны поглощать свет в широком диапазоне, а излучать в узком интервале длин волн, обеспечивая флуоресценцию при визуализации [23][25]. Черный фосфор продемонстрировал перспективность в рамках фототермической терапии благодаря своей способности поглощать свет и преобразовывать его в тепло. Наночастицы на основе металлоорганического каркаса обеспечивают эффективную доставку лекарственного вещества и визуализацию, способствуя диагностике и лечению онкопатологий [23][25].
Действие наночастиц в рамках лечения ЗНО основано на принципах, включающих индукцию апоптоза в раковых клетках, достигаемую посредством таких процессов, как генерация активных форм кислорода (АФК), вызывающих гибель клеток, модуляция экспрессии белков, связанных с апоптозом, и функционирование в качестве радиосенсибилизаторов или фотосенсибилизаторов для усиления эффекта лучевой терапии или фототерапии [26, 27]. Кроме того, наночастицы могут участвовать в иммунологических процессах, ингибировать транскрипцию и оказывать специфическое цитотоксическое влияние. Данные механизмы могут способствовать эффективной индукции апоптоза и целенаправленному уничтожению опухолевых клеток [28].
Роль нанотехнологий в диагностике и лечении рака шейки матки / The role of nanotechnology in cervical cancer diagnostics and treatment
Современные методы диагностики рака шейки матки / Modern methods for cervical cancer diagnostics
Рак шейки матки является одним из наиболее распространенных ЗНО женской репродуктивной системы [29]. Традиционные методы скрининга, такие как мазок Папаниколау (ПАП-тест), визуальный осмотр и анализ ДНК вируса папилломы человека (ВПЧ) имеют свои ограничения, причем чувствительность только ПАП-теста в развитых странах с высокими стандартными экспериментальными условиями и техническим уровнем достигает 80–90 %; в отличие от этого, в регионах с ограниченными ресурсами она может составлять всего 30–40 % [30]. Нанотехнологии изменили диагностику РШМ, повысив ее чувствительность и точность, что позволило увеличить эффективность лечения данной патологии.
Биосенсоры на основе нанотехнологий играют ведущую роль в обнаружении ВПЧ [31]. Так, электрохимический биосенсор на основе полианилина с добавлением AuNPs позволяет обнаруживать несколько штаммов ВПЧ путем иммобилизации ДНК-зондов, специфичных для вируса, что обеспечивает высокую чувствительность для выявления типов, отличающихся высокой онкогенностью [32]. Другой биосенсор, основанный на использовании полипиррольных пленок и AuNPs на гибких электродах, продемонстрировал высокую специфичность и чувствительность для обнаружения ВПЧ [33]. Кроме того, электрохимические биосенсоры на основе ДНК, модифицированные оксидом графена, покрытые серебром и AuNPs, оказались эффективными для быстрого обнаружения ВПЧ-16 – основного штамма, вызывающего РШМ [34].
Обнаружение биомаркеров также претерпело значительные изменения. Для быстрого и эффективного анализа таких биомаркеров РШМ, как антиген плоскоклеточной карциномы (англ. Squamous Cell Carcinoma Antigen, SCCA) и раковый антиген (англ. cancer antigen 125, CA-125), был разработан метод латерального проточного анализа (англ. lateral flow assay, LFA), основанный на поверхностно-усиленном комбинационном рассеянии (англ. surface-enhanced Raman scattering, SERS), обеспечивающий высокую специфичность и получение результатов в течение нескольких минут [35]. Другая платформа иммуноанализа на базе SERS с использованием золото-серебряных наноматериалов предлагает высокочувствительный метод одновременного определения SCCA и остеопонтина [36]. Аналогичным образом, сверхчувствительная SERS-платформа с золото-серебряными нанооболочками показала перспективность в обнаружении биомаркеров, включая SCCA и сурвивин [37]. Кроме того, для количественного определения SCCA и раково-эмбрионального антигена (англ. carcinoembryonic antigen, CEA) был разработан микрофлюидный чип с AuNPs, покрытый массивами аморфного оксида кремния (AuSiO2), усиливающего сигнал за счет создания многочисленных «горячих точек» [38].
Лечение РШМ предусматривает целый ряд мероприятий, включая хирургическое вмешательство, являющееся наиболее эффективным на ранних стадиях заболевания (IA–IIB), химиорадиотерапию и лучевую терапию, которые активно применяются на более поздних стадиях заболевания (IIB–IVA) [39]. По результатам исследования Gynecologic Oncology Group 240, при наличии метастатических поражений в качестве первой линии лечения применяются комбинации химиотерапии с такими препаратами, как паклитаксел, цисплатин и сосудистыми таргетными средствами (бевацизумаб) [40]. Однако отмечается, что курсы, основывающиеся на применении цисплатина, часто приводят к лекарственной резистентности, а новые стратегии, включающие использование иммунотерапии и таргетной терапии фактором роста эндотелия сосудов (англ. vascular endothelial growth factor, VEGF), показали незначительную эффективность [41]. В связи с этим разработка инновационных стратегий, направленных на повышение эффективности лечения РШМ, приобретает первостепенное значение, а в качестве эффективного средства адресной доставки терапевтических агентов с улучшенным эффектом удержания/проницаемости и низкой токсичностью выступают наноносители.
Системы доставки лекарств на базе наноносителей при раке шейки матки / Nanocarrier-based drug delivery systems for cervical cancer
Системы доставки лекарств на базе наноносителей разработаны с целью точной доставки лекарственных веществ в клеточные, субклеточные и тканевые участки для повышения биодоступности и эффективности их действия. Данные системы, включая липосомы, наночастицы, мицеллы и дендримеры, широко изучаются в контексте лечения РШМ [42]. К преимуществам такой терапии относятся повышенная активность препарата, адресная доставка, снижение токсичности, контролируемое или устойчивое высвобождение действующих веществ [43]. Липосомы могут являться перспективным решением, способным преодолевать мембранные барьеры, благодаря регулируемому дзета-потенциалу, настраиваемому диаметру частиц и возможности контролируемого высвобождения. Липидные носители способствуют проникновению лекарств и сокращают время системного введения благодаря липофильности, гидрофильности и эффекту повышенной проницаемости и удержания (англ. enhanced permeability and retention, EPR) [43][44]. В частности, одним из последних достижений в данной области является разработка липосом с цисплатином и сополимер полимолочной и гликолевой кислот (англ. lactic-co-glycolic acid, PLGA), в состав которых входит антиангиогенный препарат авастин (L-PLGA Cis-Avastin). В трехмерных моделях сфероидов и ксенотрансплантатов эта система продемонстрировала повышенное клеточное поглощение и способность к связыванию [45]. Конъюгат, сочетающий CD59, митохондриальную РНК (miRNA)-1284 и цисплатин, помещенный в липосому (CD/LP-miCDDP), также показал повышенную противоопухолевую эффективность на клетках РШМ, значительно увеличив количество апоптозов по сравнению с отдельным применением цисплатина или miRNA-1284, что подчеркивает высокий потенциал систем доставки лекарств на основе липосом [46][47].
Фотодинамическая терапия (ФДТ), использующая фотосенсибилизаторы, активируемые определенными длинами волн излучения для воздействия на опухолевые клетки, становится все более актуальной ввиду недавних достижений в области модернизации фотосенсибилизаторов [48]. Сочетание ФДТ с наноматериалами продемонстрировало повышенную эффективность, являясь одновременно и системой доставки лекарств и фотосенсибилизатором [44]. P. Singh с соавт., изучающие липидные наночастицы, загруженные дигидроиндолизином (DHI), который является фотохромным соединением, изменяющим свою структуру под воздействием света, выявили, что включение аммониевой соли 8-анилино-1-нафталинсульфоновой кислоты в липидные носители приводит к увеличению стабильности липосомальной мембраны в ответ на переход DHI из закрытого в открытый изомер, что значительно улучшает поглощение доксорубицина, детерминируя снижение жизнеспособности клеток РШМ на 40 % [49]. Данные результаты подчеркивают высокий потенциал фоточувствительных носителей на основе липосом для повышения эффективности таргетной доставки лекарственных веществ при лечении РШМ.
Использование ПНЧ, изготовленных с применением полисульфид-эфира, полиакрилата и желатина, имеющих диаметр от десятков до сотен нанометров, направлены на контролируемое высвобождение и повышение растворимости нерастворимых противоопухолевых препаратов, способствуя повышению их биодоступности при РШМ [43]. Одним из наиболее важных достижений в данной области является разработка биореактивной системы совместной доставки с использованием сополимеров Poly(DEA)-b-Poly(ABMA-co-OEGMA) (PDPAO), синтезированных путем обратимой полимеризации с переносом цепи присоединения-фрагментации. В этой системе в мицеллы помещены чувствительные к рН пролекарства 6-меркаптопурина и доксорубицина. Эти мицеллы демонстрируют стабильную структуру, pH-опосредованное высвобождение доксорубицина и улучшенное клеточное поглощение, что приводит к более эффективному уничтожению раковых клеток in vitro [50]. В другом исследовании были разработаны амфифильные полимерные пролекарства (азидо-функционализированный гиалуронан-триазол-иминедоксорубицин, HAimine-DOX) с использованием «Click Chemistry», продемонстрировавшие высокую стабильность и рН-опосредованное высвобождение веществ. Эти наночастицы показали более низкую цитотоксичность для нормальных клеток и более высокую степень уничтожения клеток РШМ, что обусловлено рецепторным поглощением, опосредованным через CD44 [51].
Конъюгаты дендримеров являются наноносителями, которые благодаря высокоразветвленной структуре и поверхностным функциональным группам могут проводить точные молекулярные модификации [43]. С целью устранения ограничений, связанных с токсичностью, было разработано новое покрытие, состоящее из 6-гидроксигексаноил/окси-гексанамида и фосфорил-холин-гексанамида. Применение данных дендримеров показало значительное уменьшение токсичности по сравнению с обычными Poly(amidoamine) (PAMAM) дендримерами в клетках РШМ [52].
Неорганические наноносители, изготовленные из таких материалов, как оксид графена, диоксид кремния и углерод, а также золота и меди, способны обеспечивать улучшенное клеточное поглощение и дисперсность в качестве векторов генов или лекарств [43].
Системы доставки лекарств на базе наноносителей представляют собой перспективный подход в лечении онкозаболеваний женской репродуктивной системы, обеспечивая точную доставку препаратов непосредственно к опухолевым клеткам. Такие системы, включающие липосомы, наночастицы, мицеллы и дендримеры, характеризуются повышенной эффективностью, уменьшенной токсичностью и возможностью контролируемого высвобождения активных компонентов. Эти достижения указывают на значительные перспективы дальнейшего развития нанотехнологий как метода улучшения результатов лечения данных заболеваний.
Вакцины и нанотехнологии в рамках иммунотерапии рака шейки матки / Vaccines and nanotechnology in cervical cancer immunotherapy
Вирус папилломы человека является одним из основных факторов риска РШМ [53][54]. Несмотря на эффективность существующих вакцин по отношению к ВПЧ, они предназначены для профилактики и не направлены на лечение уже сформировавшейся инфекции, что подчеркивает необходимость создания терапевтических вакцин, способных воздействовать на ВПЧ, устраняя его. Ранняя область, включающая гены E6 и E7, находящиеся на кодирующей цепи вирусного ДНК, являются перспективными мишенями воздействия на вирус, что обусловлено их ролью в клеточном цикле и присутствием как в группе высокого, так и в группе низкого онкогенного риска [55]. Несмотря на наличие вакцин против ВПЧ, во всем мире продолжает расти заболеваемость РШМ, что подчеркивает важность понимания иммунного микроокружения РШМ с целью разработки эффективных вакцин и иммунотерапии на основе иммунных клеток [56].
Нановакцины привлекают значительное внимание ввиду своей способности вызывать специфический противоопухолевый иммунный ответ. Данные вакцины улучшают презентацию антигена и могут модулировать иммуносупрессию в микроокружении РШМ, а различия их размера, формы, заряда, структуры, физико-химических свойств и таргетных лигандов позволяют эффективно накапливаться в лимфатических узлах, активируя иммунные клетки [57]. В недавних исследованиях была представлена новая нановакцина против ВПЧ, сочетающая нанотехнологии и ФДТ. Данная вакцина, созданная путем соединения бычьего сывороточного альбумина с антигеном E7 и инкапсуляции фотосенсибилизатора и адъюванта, имеет стабильную биосовместимую структуру. Благодаря медленному высвобождению вещества и адресной доставке в лимфатические узлы в сочетании с инфракрасным лазерным облучением фотосенсибилизаторов, обеспечивается эффективное созревание дендритных клеток и усиление Т-клеточного ответа, что положительно сказывается на повышении противоопухолевого иммунитета [58]. J. Zhang с соавт. в обзорном исследовании вакцин на основе пептидов, известных своим сильным клеточным иммунным ответом, подчеркивают, что в сочетании с наноразмерными адъювантами и системами доставки эти вакцины способны эффективно поражать и уничтожать опухолевые клетки [59]. Например, новая вакцина на основе белка E7 с использованием технологии Accum™ (Канада) продемонстрировала многообещающие результаты, что, по мнению авторов, обусловлено более эффективным выходом вещества из эндосом в цитозоль и увеличенным накоплением белка в клетках-мишенях. Профилактическая вакцинация обеспечила полную защиту иммунокомпетентных мышей и эффективно сочеталась с ингибиторами контрольных точек иммунного ответа для контроля роста опухоли, продемонстрировав большой потенциал для дальнейшей клинической разработки [60]. Наночастицы на основе археосом, которые производятся из липосом, также показали свою эффективность. Исследование, в котором гены ВПЧ 16-го типа (усеченные L1, E6 и E7) сочетались с археосомами, выявило усиление иммунного ответа на ДНК-вакцины. Такой метод комбинированной терапии проявил сильную цитолитическую активность по отношению к опухолевым клеткам и оказал как профилактический, так и терапевтический эффект на животных моделях [61].
Стоит отметить, что нанотехнологии повышают эффективность вакцин, увеличивая период их полураспада, оказывают влияние на микроокружение РШМ и усиливают противоопухолевый иммунный ответ при минимальной токсичности [62]. Доклинические исследования показали, что ПНЧ и нанодиски, имитирующие липопротеины высокой плотности, могут значительно повысить эффективность вакцин. Кроме того, интеграция нанотехнологий с протеолиз-направленными химерами (англ. PROteolysis Targeting Chimera, PROTACs), предлагает новый подход к улучшению персонализированного лечения онкопатологий. PROTACs избирательно разрушают белки, вызывающие заболевание, усиливая воздействие терапевтических инструментов на основе нанотехнологий [63]. Решение этих вопросов и использование потенциала нанотехнологий, PROTACs и антител, нацеленных на протеолиз, открывает большие перспективы для разработки новых и эффективных терапевтических подходов для лечения онкологических заболеваний, вызванных ВПЧ [64].
Роль нанотехнологий в лечении рака яичников / The role of nanotechnology in ovarian cancer treatment
Диагностика рака яичников, основанная на применении наноматериалов / Nanomaterial-based ovarian cancer diagnostics
Рак яичников, известный высокими показателями заболеваемости и смертности, зачастую диагностируется лишь на поздних стадиях из-за отсутствия эффективных методов скрининга. Традиционный подход к лечению обычно включает оперативное вмешательство с последующей химиотерапией на основе препаратов платины. Однако ограничения этих традиционных методов лечения подтолкнули исследователей к поиску альтернативных стратегий, основанных на нанотехнологиях [2][65]. Около 70 % случаев РЯ диагностируются на поздних стадиях (III или IV), значительно влияя на 5-летнюю выживаемость, что подчеркивает острую необходимость в создании новых биомаркеров, имеющих высокую чувствительность и специфичность [66]. Методы, направленные на выявление РЯ, включают применение биомаркеров CA-125, HE-4 (человеческий эпидидимальный секреторный белок 4; англ. Human Epididymis Protein 4), муцина 1 и CEA, а также компьютерной томографии (КТ) и трансвагинального ультразвукового исследования (УЗИ), которые зачастую недостаточно чувствительны и специфичны, что может привести к поздней диагностике данной патологии [67].
В рамках исследования нанотехнологий был разработан флуоресцентный иммуносенсор, использующий полимеры с магнитным молекулярным отпечатком (англ. magnetic molecularly imprinted polymers, MMIPs) и флуоресцентную детекцию, целью которого являлось обнаружение опухолевых маркеров CA-125 и CA-15-3. Данный сенсор, включающий нанокластеры никеля (Ni) и кадмия (Cd) в качестве излучателей и магнитный оксид графена (GO-Fe3O4) в качестве основы, обладает широким линейным диапазоном, высокой воспроизводимостью и простотой использования, что делает его перспективным инструментом для клинической диагностики и скрининга РЯ [68]. Еще одной инновацией является использование высокоаффинных лигандов одноцепочечной ДНК (англ. single stranded deoxyribonucleic acid, ssDNA), которые были отобраны с помощью мембранной технологии SELEX (англ. Systematic Evolution of Ligands by EXponential enrichment; систематическая эволюция лигандов экспоненциальным обогащением) и аптаинформатики для захвата биомаркера CA-125. Данный лиганд демонстрирует большие перспективы в рамках специфического обнаружения и направленного действия на CA-125 [69]. В недавнем исследовании были разработаны высокоаффинные ДНК-аптамеры, способные обнаруживать в моче опухолевый биомаркер HE-4, экспрессия которого повышается при РЯ, открывая новые возможности для неинвазивной диагностики ЗНО. С помощью Hi-Fi SELEX (англ. High-Fidelity Systematic Evolution of Ligands by EXponential enrichment; высокоточная систематическая эволюция лигандов экспоненциальным обогащением) и цифровой капельной полимеразной цепной реакции были идентифицированы два аптамера – антитело к эозинофильной пероксидазе (англ. Anti-Eosinophil Peroxidase Antibody, АНЕ) AHE1 и AHE3, которые специфически связываются с HE-4, что может использоваться в диагностических тестах на основе мочи и биосенсорах, направленных на выявление РЯ [70].
Наноматериалы на основе аптамеров являются новым инструментом, способным эффективно обнаруживать ключевые биомаркеры в сыворотке крови или на поверхности опухолевых клеток для диагностики РЯ [67]. Помимо диагностического применения, аптамеры способны блокировать белки на опухолевых клетках или осуществлять доставку веществ [67]. В паре с наноматериалами аптамеры – последовательности ssDNA или РНК – служат высокоточными химическими антителами, а их сложные трехмерные структуры повышают точность доставки и специфичность [71]. ДНК-аптамеры, нацеленные на рецептор эпидермального фактора роста человека 2-го типа (англ. human epidermal growth factor receptor-2, HER-2), или гераптамеры, меченые 18-фтордезоксиглюкозой, использующиеся в позитронно-эмиссионной томографии (ПЭТ), показали высокие коэффициенты поглощения опухолью, что подчеркивает их потенциал в точной визуализации [72].
Нанотехнологии в лечении рака яичников / Nanotechnology in ovarian cancer treatment
Рак яичников часто демонстрирует выраженную устойчивость к химиотерапии и приводит к более высокой смертности по сравнению с другими ЗНО женской репродуктивной системы [67]. Нанотехнологии могут способствовать улучшению лечения РЯ за счет усовершенствований таргетной терапии [73]. Так, например, ингибиторы иммунных контрольных точек, несмотря на свою эффективность при некоторых видах рака, имеют ограниченный эффект при РЯ ввиду наличия в опухоли иммуносупрессивной среды. Нанопрепараты из полимерных, липосомальных и липидно-полимерных гибридных наночастиц способны воздействовать на опухоль-ассоциированные иммунные клетки [73]. К числу недавних достижений в данной области относится разработка биспецифических РНК-аптамеров, направленных на CD44 и молекулу адгезии эпителиальных клеток (англ. еpithelial cell adhesion molecule, EpCAM), являющихся ключевыми маркерами РЯ. Благодаря соединению отдельных аптамеров с двухцепочечной РНК, этот подход позволяет повысить эффективность блокирования клеточного роста и индуцирования апоптоза, значительно снижая рост опухоли, не проявляя токсических свойств и иммуногенности [74]. Химически модифицированный аптамер AXL (AXL-APTAMER) тирозинкиназы рецептора AXL (англ. receptors tyrosine kinase, RTK), ингибирует миграцию и инвазию клеток, усиливая эффективность паклитаксела, что позволяет использовать его в качестве лечения метастатического РЯ [75].
Наночастицы золота являются универсальным инструментом, сочетающим как терапевтические, так и диагностические возможности. Благодаря стабильности структуры и простоте изготовления, AuNPs идеально подходят для таргетной доставки лекарственных веществ без проявлений токсичности. Также одним из перспективных направлений является использование магнитоэлектрических наночастиц с целью создания локализованных электрических полей для избирательного поглощения лекарств и уничтожения опухолевых клеток, достигаемого за счет различий в электрических свойствах мембран пораженных и здоровых клеток. [76]. Нанокапли, содержащие альгинат/перфторгексановые частицы, были разработаны для совместной доставки доксорубицина и куркумина. В сочетании с ультразвуковым облучением они способны значительно уменьшить размеры опухоли, способствуя преодолению лекарственной устойчивости при РЯ [77]. Наноносители способы снизить лекарственную устойчивость РЯ посредством преодоления эффлюксных насосов и ингибирования транспортеров АТФ-связывающих кассет (англ. ATP-binding cassette (ABC) transporters). Интегрируя хемосенсибилизаторы, апоптотические факторы, эти системы повышают эффективность лечения и обеспечивают более высокую концентрацию препаратов в ЗНО, улучшая результаты терапевтического воздействия и минимизируя вред для здоровых тканей [78].
Отмечается, что наночастицы показывают большую эффективность при доставке нескольких веществ ввиду способности инкапсулировать гидрофобные элементы и защищать гидрофильные вещества, обеспечивая их эффективное поглощение клетками, а их таргетное использование может значительно усовершенствовать эффективность существующих стратегий лечения [79]. Недавние исследования подчеркивают преимущества двухфункциональных наночастиц. Например, загруженные паклитакселом наночастицы бычьего сывороточного альбумина с AMD3100 (AMD-NP-PTX) демонстрируют превосходное ингибирование роста и метастазирования опухоли, воздействуя на специфические пути и сохраняя оптимальный профиль безопасности [80]. PLGA-наночастицы, совместно доставляющие 4,4′-бис(N-карбазолил)-1,1′-бифенил и ингибитор сфингозин-киназы 1 PF543, показывают перспективность в преодолении резистентности к платине за счет повышения концентрации препарата [81]. Поли-ε-капролактоновые (англ. poly-ε-caprolactone, PCL) наночастицы с IR-780 и паклитакселом, воздействующие на лекарственно-устойчивые ЗНО с помощью лазера ближнего инфракрасного диапазона, еще раз иллюстрируют потенциал многофункциональных наночастиц в терапии РЯ [82]. Кроме того, все большее значение в лечении данной патологии приобретает ФДТ. Нанотехнологии повышают стабильность и тонность воздействия фоточувствительных агентов, снижая неспецифическую токсичность [83][84]. Аптамеры также являются перспективными инструментами в лечении РЯ благодаря ингибированию опухоли, тем самым открывая широкие возможности для клинического применения [83]. J.L. Henri с соавт. сообщают, что исследования аптамеров in vivo и in vitro несут ценность не только для диагностики РЯ, но и для таргетной терапии данного заболевания [85]. Достижения в области наномедицины способны решить проблемы несвоевременной диагностики и иммунотерапии РЯ, обусловленной дебютом клинических проявлений лишь на поздних стадиях заболевания, за счет более эффективного распределения в тканях и поглощения препаратов опухолевыми клетками, что повышает эффективность проводимого лечения [86].
Нановакцины способны осуществлять доставку антигенов и адъювантов непосредственно к иммунным клеткам, усиливая иммунный ответ, а их небольшой размер, стабильность и высокая способность к загрузке антигеном в сочетании с повышенной степенью фиксации в лимфатических узлах может улучшить результаты лечения РЯ [87][88]. Вакцины на основе дендритных клеток (ДК) показали многообещающие результаты, однако их клиническое применение ограничено. Новая биомиметическая нановакцина «mini-DC» использует технологию покрытия клеточных мембран для усиления презентации антигена и активации Т-клеток. В доклинических моделях мышей данный препарат продемонстрировал существенный терапевтический и профилактический эффект, проявляющийся в виде замедления роста опухоли и уменьшения метастазирования [89]. Кроме того, наночастицы в нановакцинах выполняют несколько функций: являются адъювантами, иммуногенами или носителями для более эффективной доставки антигена. Нановакцины, включающие различные опухолевые антигены и иммуностимуляторы, эффективно усиливают иммунный ответ против раковых клеток [90]. Последние достижения в данной области включают разработку наночастиц и нанодисков, способных обеспечить оптимальное взаимодействие с ДК, контролируемое высвобождение антигена и имитацию липопротеинов высокой плотности, способных еще больше усиливать презентацию антигена и активацию иммунитета [90].
Роль нанотехнологий в лечении рака эндометрия / The role of nanotechnology in endometrial cancer treatment
Возможности таргетной доставки препаратов при раке эндометрия / Potential for targeted drug delivery in endometrial cancer
Благодаря использованию нанотехнологий удалось добиться значительных успехов в лечении ЗНО, однако их влияние на РЭ остается малоизученным по сравнению с РШМ и РЯ. Несмотря на это, потенциал применения нанотехнологий в рамках терапии РЭ весьма значителен. РЭ возникает в результате сложных генных мутаций, которые нарушают нормальные клеточные процессы [91]. Традиционные методы доставки лекарственных веществ хотя и хорошо изучены, однако зачастую не обладают достаточной специфичностью, приводя к неэффективности лечения и токсическому поражению здоровых клеток [91]. В отличие от традиционных методов, наноносители способны с высокой точностью воздействовать на раковые клетки, тем самым повышая эффективность лечения и сводя к минимуму повреждение окружающих тканей [92].
Роль miRNA и экзосом в противоопухолевой терапии / The role of miRNA and exosomes in antitumor therapy
Недавнее исследование показало, что G-белок-связанный рецептор 91 (GPR91)/сигнальный белок и активатор транскрипции 3 (англ. signal transducer and activator of transcription 3, STAT3)/VEGF повышен в CD44+/CD133+ стволовых клетках карциномы эндометрия человека (HuECSCs). GPR91 был идентифицирован как мишень для miR-326. Суперпарамагнитные наночастицы оксида железа (англ. superparamagnetic iron oxide nanoparticles, SPIONs) успешно доставляли miR-326 в клетки, снижая пролиферацию, инвазию и ангиогенез HuECSCs in vitro и подавляя рост опухоли и неоваскуляризацию у мышей. Повышенная экспрессия miR-326 также влияла на ключевые компоненты GPR91/STAT3/VEGF-пути, что говорит об эффективности SPIONs в рамках снижения активности стволовых клеток в карциноме эндометрия [93].
Аналогичным образом, в одном из исследований было отмечено значительное снижение экспрессии miR-499 в тканях РЭ по сравнению с нормальными клетками. Экзосомальная miR-499 ингибировала пролиферацию раковых клеток и формирование трубок эндотелиальных клеток in vitro, а также снижала рост опухоли и ангиогенез in vivo. Было обнаружено, что она напрямую воздействует на 3 нетранслируемых участка гена фактора обмена гуанин-нуклеотидов 3 (англ. vav guanine nucleotide exchange factor 3, VAV3), оказывая супрессивное действие на развитие опухоли [94]. Куркумин, доставляемый через липосомальную систему (КЛС), продемонстрировал перспективность в лечении РЭ. Эксперименты in vitro показали, что КЛС дозозависимо подавлял клеточную пролиферацию, индуцировал апоптоз и снижал подвижность клеток. КЛС также снижал активацию ядерного фактора каппа-лайт-цепи-энхансера активированных B-клеток (англ. nuclear factor κB, NF-κB), каспазы-3 и матричной металлопротеиназы-9. Исследуемые модели не показали токсичности и эффективно подавляли рост опухолевых клеток, подчеркивая потенциал КЛС в модуляции NF-κB [95]. Инкапсулирование субероиланилидгидроксамовой кислоты (англ. Suberoylanilide Hydroxamic Acid, SAHA) в поли(этиленгликоль)-b-поли(пропиленгликоль)-b-поли(этиленгликоль) (F127) мицеллах, модифицированных гиалуроновой кислотой для воздействия на CD44-сверхэкспрессирующие раковые клетки эндометрия, значительно усилило цитотоксическое действие SAHA, повысив эффективность лечения за счет лучшей адресной доставки и проникновения в опухолевые клетки [96].
Многофункциональные наночастицы: комбинированные стратегии терапии / Multifunctional nanoparticles: combination therapy strategies
Наночастицы из полилактид-со-гликолид-полиэтиленгликоля (FOLPEG- PLGA NPs) с паклитакселом (PTX), содержащие фолат, продемонстрировали повышенную цитотоксичность против раковых клеток HEC-1 A in vitro и in vivo ввиду индукции апоптоза. Наночастицы с PTX, нацеленные на фолат (англ. folat, FOL), могут являться эффективной системой доставки лекарственных веществ для воздействия на клетки РЭ [97]. Другое исследование было посвящено повышению терапевтической эффективности PTX благодаря использованию полимерных наночастиц в опухолях с мутированным р53. Нагруженные PTX наночастицы превосходили по эффективности использование PTX в растворе, а сочетание данных наночастиц с антиангиогенным ингибитором BIBF 1120 (нинтеданиб) способствовало синтетической летальности в р53-дефицитных клетках. Было зарегистрировано значительное замедление прогрессирования опухоли и рост выживаемости [98].
Новые подходы к созданию противоопухолевых наноагентов / New approaches to creation of antitumor nanoagents
К последним инновациям также относятся изготовление pH-чувствительных наночастиц из полиэтиленгликоль-поли(диизопропиламино)этилметакрилата (PEG-PDPA), в которых совместно инкапсулированы доксорубицин и навитоклакс. Данная система использует EPR с целью накопления лекарственного средства в опухоли и эндоцитоза для проникновения в клетки. Кислая лизосомальная среда запускает быстрое высвобождение препарата, сочетая действие доксорубицина с ингибитором Bcl-2 (англ. B-Cell Leukemia/Lymphoma 2; белок, связанный с B-клеточным лейкозом/лимфомой 2) для более эффективного уничтожения опухоли [99]. Наноматериалы на основе железа, представленные Material Institute of Lavoisier (nMIL)-100 (Fe), показали эффективность для создания АФК в химиотерапии. nMIL-100 (Fe) катализирует образование гидроксильных радикалов из перекиси водорода и разрушает внутриклеточный глутатион, усиливая цитотоксичность по отношению к клеткам РЭ. Сочетание nMIL-100 (Fe) с перекисью водорода и ингибированием митофагии с помощью siRNA (англ. small interfering RNA; малые интерферирующие РНК) или Mdivi-1 (англ. mitochondrial division inhibitor; ингибитор митохондриального деления 1) улучшает окислительное повреждение [100]. CRZ@GEM-NPs, сочетающие кризотиниб (CRZ) и гемцитабин (GEM), значительно усиливают цитотоксичность против клеток РЭ. Данная комбинация препаратов приводит к выраженному апоптозу и нарушению мембранного потенциала митохондрий, при этом в исследованиях in vivo не выявлено системной токсичности и гистологических изменений, что подчеркивает ее потенциал при лечении РЭ [101]. Перечисленные достижения демонстрируют значительные перспективы нанотехнологий в повышении специфичности, эффективности и безопасности лечения РЭ, открывая путь к созданию более персонализированных и эффективных терапевтических стратегий. Однако лишь немногие из них одобрены для использования [102][103].
Нанотехнологии демонстрируют значительный потенциал в улучшении терапии РЭ, несмотря на то, что их роль в этом контексте пока менее исследована по сравнению с другими видами ЗНО женской репродуктивной системы. Наночастицы позволяют повысить точность доставки лекарств к раковым клеткам, минимизируя побочные эффекты и увеличивая эффективность лечения. Эти данные свидетельствуют о том, что дальнейшее изучение и разработка высокотехнологичных подходов могут существенно улучшить лечение пациентов из данной группы.
Заключение / Conclusion
Нанотехнологии представляют собой многообещающий подход в области доставки лекарств и лечении ЗНО, что обусловлено их возможностью таргетной терапии без побочных эффектов. Наночастицы способны переносить как обычные лекарственные вещества, так и системы на базе белков и нуклеиновых кислот непосредственно к раковым клеткам. Однако лишь немногие методы лечения ЗНО женской репродуктивной системы, основанные на применении наночастиц, получили одобрение для использования: Genexol-PM (Samyang Biopharmaceuticals, Южная Корея), утвержденный в Южной Корее (2007 г.); Doxil (Johnson & Johnson, США), Caelyx (MSD, США), Myocet (Teva UK, Великобритания) и Lipo-Dox (TTY Biopharm, Китай).
Медленный прогресс в этой области во многом объясняется сложностью изготовления наноматериалов, которые требуют тщательной разработки и последующего тестирования. Данные материалы должны быть разработаны с высокой точностью и учитывать такие факторы, как размер, заряд и химический состав поверхности наночастиц. Несмотря на эти препятствия, данная область добивается значительных успехов, продвигаясь к появлению более эффективных и широкодоступных методов лечения.
Список литературы
1. Piechocki M., Koziołek W., Sroka D. et al. Trends in incidence and mortality of gynecological and breast cancers in Poland (1980–2018). Clin Epidemiol. 2022;14:95–114. https://doi.org/10.2147/CLEP.S330081.
2. Котова Е.Г., Папанова Е.К., Адамян Л.В. Своевременное выявление и лечение злокачественных новообразований репродуктивных органов у женщин как резерв роста ожидаемой продолжительности жизни в Российской Федерации. Проблемы репродукции. 2023;29(6):6–11. https://doi.org/10.17116/repro2023290616.
3. Keyvani V., Mollazadeh S., Riahi E. et al. Nanotechnological advances in the diagnosis of gynecological cancers and nanotheranostics. Curr Pharm Des. 2024;30(33):2619–30. https://doi.org/10.2174/0113816128317605240628063731.
4. Bogani G., Monk B.J., Powell M.A. et al. Adding immunotherapy to first-line treatment of advanced and metastatic endometrial cancer. Ann Oncol. 2024;35(5):414–28. https://doi.org/10.1016/j.annonc.2024.02.006.
5. St Laurent J., Liu J.F. Treatment approaches for platinum-resistant ovarian cancer. J Clin Oncol. 2024;42(2):127–33. https://doi.org/10.1200/JCO.23.01771.
6. Bray F., Ferlay J., Soerjomataram I. et al. Global cancer statistics 2018: GLOBOCAN estimates of incidence and mortality worldwide for 36 cancers in 185 countries. CA Cancer J Clin. 2018;68(6):394–424. https://doi.org/10.3322/caac.21492.
7. Priyadarshini S., Swain P.K., Agarwal K. et al. Trends in gynecological cancer incidence, mortality, and survival among elderly women: а SEER study. Aging Med (Milton). 2024;7(2):179–88. https://doi.org/10.1002/agm2.12297.
8. Rehan F., Zhang M., Fang .J, Greish K. Therapeutic applications of nanomedicine: recent developments and future perspectives. Molecules. 2024;29(9):2073. https://doi.org/10.3390/molecules29092073.
9. Crosbie E.J., Kitson S.J., McAlpine J.N. et al. Endometrial cancer. Lancet. 2022;399(10333):1412–28. https://doi.org/10.1016/S0140-6736(22)00323-3.
10. Leon-Ferre R.A., Goetz M.P. Advances in systemic therapies for triple negative breast cancer. BMJ. 2023;381:e071674. https://doi.org/10.1136/bmj-2022-071674.
11. De Ruysscher D., Niedermann G., Burnet N.G. et al. Radiotherapy toxicity. Nat Rev Dis Primers. 2019;5(1):13. https://doi.org/10.1038/s41572-019-0064-5.
12. Kuderer N.M., Desai A., Lustberg M.B., Lyman G.H. Mitigating acute chemotherapy-associated adverse events in patients with cancer. Nat Rev Clin Oncol. 2022;19(11):681–97. https://doi.org/10.1038/s41571-022-00685-3.
13. Kemp J.A., Kwon Y.J. Cancer nanotechnology: current status and perspectives. Nano Converg. 2021;8(1):34. https://doi.org/10.1186/s40580-021-00282-7.
14. Yang Z., Gao D., Zhao J. et al. Thermal immuno-nanomedicine in cancer. Nat Rev Clin Oncol. 2023;20(2):116–34. https://doi.org/10.1038/s41571-022-00717-y.
15. Su X., Zhang X., Liu W. et al. Advances in the application of nanotechnology in reducing cardiotoxicity induced by cancer chemotherapy. Semin Cancer Biol. 2022;86(Pt 2):929–42. https://doi.org/10.1016/j.semcancer.2021.08.003.
16. Handa M., Beg S., Shukla R. et al. Recent advances in lipid-engineered multifunctional nanophytomedicines for cancer targeting. J Control Release. 2021;340:48–59. https://doi.org/10.1016/j.jconrel.2021.10.025.
17. Klochkov S.G., Neganova M.E., Nikolenko V.N. et al. Implications of nanotechnology for the treatment of cancer: recent advances. Semin Cancer Biol. 2021;69:190–9. https://doi.org/10.1016/j.semcancer.2019.08.028.
18. Hulla J.E., Sahu S.C., Hayes A.W. Nanotechnology: history and future. Hum Exp Toxicol. 2015;34(12):1318–21. https://doi.org/10.1177/0960327115603588.
19. Malik S., Muhammad K., Waheed Y. Emerging applications of nanotechnology in healthcare and medicine. Molecules. 2023;28(18):6624. https://doi.org/10.3390/molecules28186624.
20. Дураиди А.Д., Цибизова О.В. Нанотехнологии в лечении рака. Биомедицина. 2021;17(S3):26–7. https://doi.org/10.33647/2713-0428-17-3E-26-27.
21. Tongi J. Nanotechnology principles and applications for innovative material development. J Basic Clin Pharma. 2023;14(3):260–1.
22. Sun L., Liu H., Ye Y. et al. Smart nanoparticles for cancer therapy. Signal Transduct Target Ther. 2023;8(1):418. https://doi.org/10.1038/s41392-023-01642-x.
23. Gavas S., Quazi S., Karpiński T.M. Nanoparticles for cancer therapy: current progress and challenges. Nanoscale Res Lett. 2021;16(1):173. https://doi.org/10.1186/s11671-021-03628-6.
24. Гареев И.Ф., Бейлерли О.А., Павлов В.Н. и др. Наночастицы: новый подход в диагностике и терапии глиальных опухолей головного мозга. Креативная хирургия и онкология. 2019;9(1):66–74. https://doi.org/10.24060/2076-3093-2019-9-1-66-74.
25. Sell M., Lopes A.R., Escudeiro M. et al. Application of nanoparticles in cancer treatment: a concise review. Nanomaterials (Basel). 2023;13(21):2887. https://doi.org/10.3390/nano13212887.
26. Raj S., Khurana S., Choudhari R. et al. Specific targeting cancer cells with nanoparticles and drug delivery in cancer therapy. Semin Cancer Biol. 2021;69:166–77. https://doi.org/10.1016/j.semcancer.2019.11.002.
27. López Grueso M.J., Tarradas Valero R.M., Carmona-Hidalgo B. et al. Peroxiredoxin 6 down-regulation induces metabolic remodeling and cell cycle arrest in HepG2 cells. Antioxidants (Basel). 2019;8(11):505. https://doi.org/10.3390/antiox8110505.
28. Mundekkad D., Cho W.C. Nanoparticles in clinical translation for cancer therapy. Int J Mol Sci. 2022;23(3):1685. https://doi.org/10.3390/ijms23031685.
29. Габуева Я.О., Кулакова Ю.А., Буралкина Н.А. и др. Рак шейки матки: эпидемиология, лечение, осложнения, реабилитация. Consilium Medicum. 2024;26(6):372–6. https://doi.org/10.26442/20751753.2024.6.202836.
30. Zhang S., Xu H., Zhang L., Qiao Y. Cervical cancer: epidemiology, risk factors and screening. Chin J Cancer Res. 2020;32(6):720–8. https://doi.org/10.21147/j.issn.1000-9604.2020.06.05.
31. Song X., Li X., Tan Z., Zhang L. Recent status and trends of nanotechnology in cervical cancer: a systematic review and bibliometric analysis. Front Oncol. 2024;14:1327851. https://doi.org/10.3389/fonc.2024.1327851.
32. Avelino K.Y.P.S., Oliveira L.S., Lucena-Silva N. et al. Metal-polymer hybrid nanomaterial for impedimetric detection of human papillomavirus in cervical specimens. J Pharm Biomed Anal. 2020;185:113249. https://doi.org/10.1016/j.jpba.2020.113249.
33. Avelino K.Y.P.S., Oliveira L.S., Lucena-Silva N. et al. Flexible sensor based on conducting polymer and gold nanoparticles for electrochemical screening of HPV families in cervical specimens. Talanta. 2021;226:122118. https://doi.org/10.1016/j.talanta.2021.122118.
34. Pareek S., Jain U., Bharadwaj M. et al. An ultrasensitive electrochemical DNA biosensor for monitoring Human papillomavirus-16 (HPV-16) using graphene oxide/Ag/Au nano-biohybrids. Anal Biochem. 2023;663:115015. https://doi.org/10.1016/j.ab.2022.115015.
35. Xia J., Liu Y., Ran M. et al. The simultaneous detection of the squamous cell carcinoma antigen and cancer antigen 125 in the cervical cancer serum using nano-Ag polydopamine nanospheres in an SERS-based lateral flow immunoassay. RSC Adv. 2020;10(49):29156–70. https://doi.org/10.1039/d0ra05207h.
36. Lu D., Ran M., Liu Y. et al. SERS spectroscopy using Au-Ag nanoshuttles and hydrophobic paper-based Au nanoflower substrate for simultaneous detection of dual cervical cancer-associated serum biomarkers. Anal Bioanal Chem. 2020;412(26):7099–112. https://doi.org/10.1007/s00216-020-02843-x.
37. Liu Y., Ran M., Sun Y. et al. A sandwich SERS immunoassay platform based on a single-layer Au-Ag nanobox array substrate for simultaneous detection of SCCA and survivin in serum of patients with cervical lesions. RSC Adv. 2021;11(58):36734–47. https://doi.org/10.1039/d1ra03082e.
38. Gu Y., Li Z., Ge S. et al. A microfluidic chip using Au@SiO2 array-based highly SERS-active substrates for ultrasensitive detection of dual cervical cancer-related biomarkers. Anal Bioanal Chem. 2022;414(26):7659–73. https://doi.org/10.1007/s00216-022-04296-w.
39. Cohen P.A., Jhingran A., Oaknin A., Denny L. Cervical cancer. Lancet. 2019;393(10167):169–82. https://doi.org/10.1016/S0140-6736(18)32470-X.
40. Čerina D., Matković V., Katić K. et al. Real-world efficacy and safety of bevacizumab in the first-line treatment of metastatic cervical cancer: a cohort study in the total population of Croatian patients. J Oncol. 2021;2021:2815623. https://doi.org/10.1155/2021/2815623.
41. Kumar N., Mangla M. Nanotechnology and nanobots unleashed: pioneering a new era in gynecological cancer management – a comprehensive review. Cancer Chemother Pharmacol. 2025;95(1):18. https://doi.org/10.1007/s00280-024-04747-4.
42. Pathak K., Akhtar N. Nanocarriers for the effective treatment of cervical cancer: research advancements and patent analysis. Recent Pat Drug Deliv Formul. 2018;12(2):93–109. https://doi.org/10.2174/1872211312666180403102019.
43. Zhou P., Liu W., Cheng Y., Qian D. Nanoparticle-based applications for cervical cancer treatment in drug delivery, gene editing, and therapeutic cancer vaccines. Wiley Interdiscip Rev Nanomed Nanobiotechnol. 2021;13(5):e1718. https://doi.org/10.1002/wnan.1718.
44. Guo W., Sun C., Jiang G., Xin Y. Recent developments of nanoparticles in the treatment of photodynamic therapy for cervical cancer. Anticancer Agents Med Chem. 2019;19(15):1809–19. https://doi.org/10.2174/1871520619666190411121953.
45. Dana P., Bunthot S., Suktham K. et al. Active targeting liposome-PLGA composite for cisplatin delivery against cervical cancer. Colloids Surf B Biointerfaces. 2020;196:111270. https://doi.org/10.1.016/j.colsurfb.2020.111270.
46. Wang L., Liang TT. CD59 receptor targeted delivery of miRNA-1284 and cisplatin-loaded liposomes for effective therapeutic efficacy against cervical cancer cells. AMB Express. 2020;10(1):54. https://doi.org/10.1186/s13568-020-00990-z.
47. Сорокоумова М.В., Компанцев Д.В., Щербакова Л.И. и др. Поли-D,L-лактид-ко-гликолид – перспективный полимер для разработки наносистем доставки лекарственных средст (обзор). Медико-фармацевтический журнал «Пульс». 2022;24(8):42–52. https://doi.org/10.26787/nydha-2686-6838-2022-24-8-42-52.
48. Fang X., Xie A., Song H. et al. A novel α-(8-quinolinyloxy) monosubstituted zinc phthalocyanine nanosuspension for potential enhanced photodynamic therapy. Drug Dev Ind Pharm. 2020;46(11):1881–8. https://doi.org/10.1080/03639045.2020.1825474.
49. Singh P., Choudhury S., Kulanthaivel S. et al. Photo-triggered destabilization of nanoscopic vehicles by dihydroindolizine for enhanced anticancer drug delivery in cervical carcinoma. Colloids Surf B Biointerfaces. 2018;162:202–11. https://doi.org/10.1016/j.colsurfb.2017.11.035.
50. Liao J., Peng H., Wei X. et al. A bio-responsive 6-mercaptopurine/ doxorubicin based "Click Chemistry" polymeric prodrug for cancer therapy. Mater Sci Eng C Mater Biol Appl. 2020;108:110461. https://doi.org/10.1016/j.msec.2019.110461.
51. Liao J., Zheng H., Hu R. et al. Hyaluronan based tumor-targeting and pH-responsive shell cross-linkable nanoparticles for the controlled release of doxorubicin. J Biomed Nanotechnol. 2018;14(3):496–509. https://doi.org/10.1166/jbn.2018.2510.
52. Svenningsen S.W., Janaszewska A., Ficker M. et al. Two for the price of one: PAMAM-dendrimers with mixed phosphoryl choline and oligomeric poly(caprolactone) surfaces. Bioconjug Chem. 2016;27(6):1547–57. https://doi.org/10.1021/acs.bioconjchem.6b00213.
53. Кравцова Е.А., Цыганов М.М., Литвяков Н.В., Ибрагимова М.К. ВПЧ-ассоциированный рак шейки матки: современное состояние и перспективы. Acta Biomedica Scientifica. 2023;8(3):42–54. https://doi.org/10.29413/ABS.2023-8.3.4.
54. Ящук А.Г., Зайнуллина Р.М., Лялина Г.З. ВПЧ-ассоциированные заболевания шейки матки. Обзор диагностических мероприятий и лечебной коррекции. Медицинский вестник Башкортостана. 2020;15(6):127–32.
55. Gildiz S., Minko T. Nanotechnology-based nucleic acid vaccines for treatment of ovarian cancer. Pharm Res. 2023;40(1):123–44. https://doi.org/10.1007/s11095-022-03434-4.
56. Kumar V., Bauer C., Stewart J.H. TIME is ticking for cervical cancer. Biology (Basel). 2023;12(7):941. https://doi.org/10.3390/biology12070941.
57. Guo J., Liu C., Qi Z. et al. Engineering customized nanovaccines for enhanced cancer immunotherapy. Bioact Mater. 2024;36:330–57. https://doi.org/10.1016/j.bioactmat.2024.02.028.
58. Zhang L., Wang K., Huang Y. et al. Photosensitizer-induced HPV16 E7 nanovaccines for cervical cancer immunotherapy. Biomaterials. 2022;282:121411. https://doi.org/10.1016/j.biomaterials.2022.121411.
59. Zhang J., Fan J., Skwarczynski M. et al. Peptide-based nanovaccines in the treatment of cervical cancer: a review of recent advances. Int J Nanomedicine. 2022;17:869–900. https://doi.org/10.2147/IJN.S269986.
60. Bikorimana J.P., Abusarah J., Gonçalves M. et al. An engineered Accum-E7 protein-based vaccine with dual anti-cervical cancer activity. Cancer Sci. 2024;115(4):1102–13. https://doi.org/10.1111/cas.16096.
61. Karimi H., Soleimanjahi H., Abdoli A., Banijamali R.S. Combination therapy using human papillomavirus L1/E6/E7 genes and archaeosome: a nanovaccine confer immuneadjuvanting effects to fight cervical cancer. Sci Rep. 2020;10(1):5787. https://doi.org/10.1038/s41598-020-62448-3.
62. Fang X., Lan H., Jin K. et al. Nanovaccines for cancer prevention and Immunotherapy: an update review. Cancers (Basel). 2022;14(16):3842. https://doi.org/10.3390/cancers14163842.
63. Li X., Pu W., Zheng Q. et al. Proteolysis-targeting chimeras (PROTACs) in cancer therapy. Mol Cancer. 2022;21(1):99. https://doi.org/10.1186/s12943-021-01434-3.
64. Mukerjee N., Maitra S., Gorai S. et al. Revolutionizing Human papillomavirus (HPV)-related cancer therapies: unveiling the promise of Proteolysis Targeting Chimeras (PROTACs) and Proteolysis Targeting Antibodies (PROTABs) in cancer nano-vaccines. J Med Virol. 2023;95(10):e29135. https://doi.org/10.1002/jmv.29135.
65. Mulisya O., Sikakulya F.K., Mastaki M. et al. The challenges of managing ovarian cancer in the developing world. Case Rep Oncol Med. 2020;2020:8379628. https://doi.org/10.1155/2020/8379628.
66. Ghose A., McCann L., Makker S. et al. Diagnostic biomarkers in ovarian cancer: advances beyond CA125 and HE4. Ther Adv Med Oncol. 2024;16:17588359241233225. https://doi.org/10.1177/17588359241233225.
67. Zhao J., Tan W., Zheng J. et al. Aptamer nanomaterials for ovarian cancer target theranostics. Front Bioeng Biotechnol. 2022;10:884405. https://doi.org/10.3389/fbioe.2022.884405.
68. Bahari D., Babamiri B., Salimi A. Ultrasensitive molecularly imprinted fluorescence sensor for simultaneous determination of CA125 and CA15-3 in human serum and OVCAR-3 and MCF-7 cells lines using Cd and Ni nanoclusters as new emitters. Anal Bioanal Chem. 2021;413(15):4049–61. https://doi.org/10.1007/s00216-021-03362-z.
69. Tripathi P., Sachan M., Nara S. Novel ssDNA ligand against ovarian cancer biomarker CA125 with promising diagnostic potential. Front Chem. 2020;8:400. https://doi.org/10.3389/fchem.2020.00400.
70. Hanžek A., Ducongé F.., Siatka C., Duc A.E. Identification and characterization of aptamers targeting ovarian cancer biomarker human epididymis protein 4 for the application in urine. Cancers (Basel). 2023;15(2):452. https://doi.org/10.3390/cancers15020452.
71. Hosseinzadeh L., Mazloum-Ardakani M. Advances in aptasensor technology. Adv Clin Chem. 2020;99:237–79. https://doi.org/10.1016/bs.acc.2020.02.010.
72. Zhu G., Zhang H., Jacobson O. et al. Combinatorial screening of DNA aptamers for molecular imaging of HER2 in cancer. Bioconjug Chem. 2017;28(4):1068–75. https://doi.org/10.1021/acs.bioconjchem.6b00746.
73. Corradetti B., Pisano S., Conlan R.S., Ferrari M. Nanotechnology and immunotherapy in ovarian cancer: tracing new landscapes. J Pharmacol Exp Ther. 2019;370(3):636–46. https://doi.org/10.1124/jpet.118.254979.
74. Zheng J., Zhao S., Yu X. et al. Simultaneous targeting of CD44 and EpCAM with a bispecific aptamer effectively inhibits intraperitoneal ovarian cancer growth. Theranostics. 2017;7(5):1373–88. https://doi.org/10.7150/thno.17826.
75. Kanlikilicer P., Ozpolat B., Aslan B. et al. Therapeutic targeting of AXL receptor tyrosine kinase Inhibits tumor growth and intraperitoneal metastasis in ovarian cancer models. Mol Ther Nucleic Acids. 2017;9:251–62. https://doi.org/10.1016/j.omtn.2017.06.023.
76. Guduru R., Liang P., Runowicz C. et al. Magneto-electric nanoparticles to enable field-controlled high-specificity drug delivery to eradicate ovarian cancer cells. Sci Rep. 2013;3:2953. https://doi.org/10.1038/srep02953.
77. Baghbani F., Moztarzadeh F. Bypassing multidrug resistant ovarian cancer using ultrasound responsive doxorubicin/curcumin co-deliver alginate nanodroplets. Colloids Surf B Biointerfaces. 2017;153:132–40. https://doi.org/10.1016/j.colsurfb.2017.01.051.
78. Khan I.U., Khan R.U., Asif H. et al. Co-delivery strategies to overcome multidrug resistance in ovarian cancer. Int J Pharm. 2017;533(1):111–24. https://doi.org/10.1016/j.ijpharm.2017.09.060.
79. Wu Y., Yang Y., Lv X. et al. Nanoparticle-based combination therapy for ovarian cancer. Int J Nanomedicine. 2023;18:1965–87. https://doi.org/10.2147/IJN.S394383.
80. Xue J., Li R., Gao D. et al. CXCL12/CXCR4 axis-targeted dual-functional nano-drug delivery system against ovarian cancer. Int J Nanomedicine. 2020;15:5701–18. https://doi.org/10.2147/IJN.S257527.
81. Wang C., Li Q., Song K. et al. Nanoparticle co-delivery of carboplatin and PF543 restores platinum sensitivity in ovarian cancer models through inhibiting platinum-induced pro-survival pathway activation. Nanoscale Adv. 2024;6(16):4082–93. https://doi.org/10.1039/d4na00227j.
82. Pan Q., Tian J., Zhu H. et al. Tumor-targeting polycaprolactone nanoparticles with codelivery of paclitaxel and IR780 for combinational therapy of drug-resistant ovarian cancer. ACS Biomater Sci Eng. 2020;6(4):2175–85. https://doi.org/10.1021/acsbiomaterials.0c00163.
83. Liu R., Gao Y., Liu N., Suo Y. Nanoparticles loading porphyrin sensitizers in improvement of photodynamic therapy for ovarian cancer. Photodiagnosis Photodyn Ther. 2021;33:102156. https://doi.org/10.1016/j.pdpdt.2020.102156.
84. Рудаков Д.А., Суров Д.А., Соловьев И.А. и др. Флуоресцентная диагностика и фотодинамическая терапия в циторедуктивном хирургическом лечении больной перитонеальным канцероматозом. Креативная хирургия и онкология. 2024;14(2):186–93. https://doi.org/10.24060/2076-3093-2024-14-2-186-193.
85. Henri J.L., Macdonald J., Strom M. et al. Aptamers as potential therapeutic agents for ovarian cancer. Biochimie. 2018;145:34–44. https://doi.org/10.1016/j.biochi.2017.12.001.
86. Yang Y., Zhao T., Chen Q. et al. Nanomedicine strategies for heating "cold" ovarian cancer (OC): next evolution in immunotherapy of OC. Adv Sci (Weinh). 2022;9(28):e2202797. https://doi.org/10.1002/advs.202202797.
87. Yao M., Liu X., Qian Z. et al. Research progress of nanovaccine in anti-tumor immunotherapy. Front Oncol. 2023;13:1211262. https://doi.org/10.3389/fonc.2023.1211262.
88. Gurunathan S., Thangaraj P., Wang L. et al. Nanovaccines: an effective therapeutic approach for cancer therapy. Biomed Pharmacother. 2024;170:115992. https://doi.org/10.1016/j.biopha.2023.115992.
89. Cheng S., Xu C., Jin Y. et al. Artificial mini dendritic cells boost T cell-based immunotherapy for ovarian cancer. Adv Sci (Weinh). 2020;7(7):1903301. https://doi.org/10.1002/advs.201903301.
90. Jahanafrooz Z., Oroojalian F., Mokhtarzadeh A. et al. Nanovaccines: immunogenic tumor antigens, targeted delivery, and combination therapy to enhance cancer immunotherapy. Drug Dev Res. 2024;85(5):e22244. https://doi.org/10.1002/ddr.22244.
91. Chehelgerdi M., Chehelgerdi M., Allela O.Q.B. et al. Progressing nanotechnology to improve targeted cancer treatment: overcoming hurdles in its clinical implementation. Mol Cancer. 2023;22(1):169. https://doi.org/10.1186/s12943-023-01865-0.
92. Wang Y., Chen S., Wang C., Guo F. Nanocarrier-based targeting of metabolic pathways for endometrial cancer: Status and future perspectives. Biomed Pharmacother. 2023;166:115348. https://doi.org/10.1016/j.biopha.2023.115348.
93. Gao Y., Qian H., Tang X. et al. Superparamagnetic iron oxide nanoparticle-mediated expression of miR-326 inhibits human endometrial carcinoma stem cell growth. Int J Nanomedicine. 2019;14:2719–31. https://doi.org/10.2147/IJN.S200480.
94. Jing L., Hua X., Yuanna D. et al. Exosomal miR-499a-5p inhibits endometrial cancer growth and metastasis via targeting VAV3. Cancer Manag Res. 2020;12:13541–52. https://doi.org/10.2147/CMAR.S283747.
95. Xu H., Gong Z., Zhou S. et al. Liposomal curcumin targeting endometrial cancer through the NF-κB pathway. Cell Physiol Biochem. 2018;48(2):569–82. https://doi.org/10.1159/000491886.
96. Edwards K., Yao S., Pisano S. et al. Hyaluronic acid-functionalized nanomicelles enhance SAHA efficacy in 3D endometrial cancer models. Cancers (Basel). 2021;13(16):4032. https://doi.org/10.3390/cancers13164032.
97. Liang C., Yang Y., Ling Y. et al. Improved therapeutic effect of folate-decorated PLGA-PEG nanoparticles for endometrial carcinoma. Bioorg Med Chem. 2011;19(13):4057–66. https://doi.org/10.1016/j.bmc.2011.05.016.
98. Ebeid K., Meng X., Thiel K.W. et al. Synthetically lethal nanoparticles for treatment of endometrial cancer. Nat Nanotechnol. 2018;13(1):72–81. https://doi.org/10.1038/s41565-017-0009-7.
99. Ding J., Zhang X., Chen C. et al. Ultra pH-sensitive polymeric nanovesicles co-deliver doxorubicin and navitoclax for synergetic therapy of endometrial carcinoma. Biomater Sci. 2020;8(8):2264–73. https://doi.org/10.1039/d0bm00112k.
100. Gong X., Pu X., Wang J. et al. Enhancing of nanocatalyst-driven chemodynaminc therapy for endometrial cancer cells through inhibition of PINK1/Parkin-mediated mitophagy. Int J Nanomedicine. 2021;16:6661–79. https://doi.org/10.2147/IJN.S329341.
101. Yang J., Guo H., Lei J. et al. Fabrication of polymer-based self-assembly nanocarriers loaded with a crizotinib and gemcitabine: potential therapeutics for the treatment of endometrial cancer. J Biomater Sci Polym Ed. 2022;33(1):20–34. https://doi.org/10.1080/09205063.2021.1974149.
102. Cancer Nano-Therapies in the Clinic and Clinical Trials. National Cancer Institute Nanodelivery Systems and Devices, 2023. Режим доступа: https://www.cancer.gov/nano/. [Дата обращения: 10.01.2025].
103. Crist R., McNeil S. Nanotechnology for Treating Cancer: Pitfalls and Bridges on the Path to Nanomedicines. National Cancer Institute, 2015. Режим доступа: https://www.cancer.gov/research/key-initiatives/ras/news-events/dialogue-blog/2015/nanomedicines. [Дата обращения: 10.01.2025].
Об авторах
З. Р. ФайзуллинаRussian Federation
Файзуллина Залина Ринатовна.
450008 Уфа, ул. Ленина, д. 3
А. А. Жиленко
Russian Federation
Жиленко Андрей Александрович.
295007 Симферополь, проспект Академика Вернадского, д. 4
А. Х. Исламгулов
Russian Federation
Исламгулов Алмаз Ханифович.
450008 Уфа, ул. Ленина, д. 3
WoS ResearcherID IRZ-0022-2023
Е. А. Черная
Russian Federation
Черная Екатерина Андреевна.
362019 Республика Северная Осетия-Алания, Владикавказ, Пушкинская ул., д. 40
А. И. Точиева
Russian Federation
Точиева Анастасия Израиловна.
362019 Республика Северная Осетия-Алания, Владикавказ, Пушкинская ул., д. 40
А. А. Санова
Russian Federation
Санова Алина Алимбековна.
362019 Республика Северная Осетия-Алания, Владикавказ, Пушкинская ул., д. 40
Д. А. Дряева
Russian Federation
Дряева Диана Алановна.
362019 Республика Северная Осетия-Алания, Владикавказ, Пушкинская ул., д. 40
С. Ш. Хакназаров
Russian Federation
Хакназаров Салмон Шералиевич.
450008 Уфа, ул. Ленина, д. 3
Т. Р. Газизов
Russian Federation
Газизов Тимур Раисович.
450008 Уфа, ул. Ленина, д. 3
М. М. Отаджонов
Russian Federation
Отаджонов Музаффарджон Махкамджонович.
450008 Уфа, ул. Ленина, д. 3
Х. А. Мержоева
Russian Federation
Мержоева Хава Аюповна.
450008 Уфа, ул. Ленина, д. 3
Е. В. Маликова
Russian Federation
Маликова Елизавета Владимировна.
344022 Ростов-на-Дону, Нахичеванский переулок, д. 29
В. А. Глазепа
Russian Federation
Глазепа Валерия Александровна.
344022 Ростов-на-Дону, Нахичеванский переулок, д. 29
А. К. Матвиец
Russian Federation
Матвиец Александра Константиновна.
443099 Самара, ул. Чапаевская, д. 89
Что уже известно об этой теме?
► Нанотехнологии играют важную роль в медицине, улучшая диагностику и лечение злокачественных новообразований женской репродуктивной системы за счет таргетной доставки препаратов.
► Современные методы лечения гинекологических опухолей (хирургия, химиотерапия, радиотерапия) имеют ограничения, включая высокую токсичность и побочные эффекты.
► Наночастицы применяются для повышения селективности воздействия на опухолевые клетки и снижения системной токсичности традиционных методов лечения.
Что нового дает статья?
► Использование липосом, полимерных и белковых наночастиц повышает эффективность химиотерапии, обеспечивая таргетное воздействие на опухолевые клетки при минимальном влиянии на здоровые ткани.
► Применение золото-серебряных наночастиц, квантовых точек и магнитных наночастиц позволяет раньше выявлять онкологические заболевания, особенно рак шейки матки, за счет высокой чувствительности к биомаркерам и ДНК вируса папилломы человека (ВПЧ).
► Использование нановакцин, включающих антигены и адъюванты на основе наночастиц, усиливает противоопухолевый иммунный ответ и открывает перспективы для более эффективного лечения ВПЧ-ассоциированных опухолей.
Как это может повлиять на клиническую практику в обозримом будущем?
► Внедрение нанотехнологий в онкологию может повысить эффективность лечения и снизить токсические эффекты стандартных методов терапии.
► Использование наночастиц в диагностике позволит раньше выявлять опухолевые процессы, повышая шансы на успешное лечение.
► Развитие персонализированной медицины с использованием нанотехнологий позволит адаптировать лечение к индивидуальным особенностям пациентов, снижая риск рецидивов.
Рецензия
Для цитирования:
Файзуллина З.Р., Жиленко А.А., Исламгулов А.Х., Черная Е.А., Точиева А.И., Санова А.А., Дряева Д.А., Хакназаров С.Ш., Газизов Т.Р., Отаджонов М.М., Мержоева Х.А., Маликова Е.В., Глазепа В.А., Матвиец А.К. Роль нанотехнологий в диагностике и лечении злокачественных новообразований женской репродуктивной системы. Акушерство, Гинекология и Репродукция. 2025;19(4):590-607. https://doi.org/10.17749/2313-7347/ob.gyn.rep.2025.617
For citation:
Faizullina Z.R., Zhilenko A.A., Islamgulov A.Kh., Chernaya E.A., Tochieva A.I., Sanova A.A., Dryaeva D.A., Khaknazarov S.Sh., Gazizov T.R., Otadzhonov M.M., Merzhoeva Kh.A., Malikova E.V., Glazepa V.A., Matviets A.K. The role of nanotechnologies in diagnostics and treatment of female reproductive system cancer. Obstetrics, Gynecology and Reproduction. 2025;19(4):590-607. (In Russ.) https://doi.org/10.17749/2313-7347/ob.gyn.rep.2025.617
JATS XML

Контент доступен под лицензией Creative Commons Attribution-NonCommercial-ShareAlike 4.0 International License.










































