Перейти к:
Синдром активации макрофагов во время беременности как фатальное осложнение системного идиопатического артрита
https://doi.org/10.17749/2313-7347/ob.gyn.rep.2024.498
Аннотация
Согласно современной концепции, юношеский артрит с системным началом (системный ювенильный идиопатический артрит, сЮИА) и болезнь Стилла взрослых (БСВ) рассматриваются как редкие аутовоспалительные заболевания, в иммунопатогенезе которых лежат объединяющие оба данных заболевания механизмы. Несмотря на развитие заболеваний в детском и молодом возрасте, вопросы репродукции при этих заболеваниях остаются практически не изученными. В статье представлен клинический случай материнской смертности 22-летней первородящей женщины, проведен анализ тактики ведения сЮИА, осложнившийся синдромом активации макрофагов во время беременности.
Ключевые слова
Для цитирования:
Шестерня П.А., Цхай В.Б., Базина М.И., Матвеева И.В. Синдром активации макрофагов во время беременности как фатальное осложнение системного идиопатического артрита. Акушерство, Гинекология и Репродукция. 2024;18(6):898-907. https://doi.org/10.17749/2313-7347/ob.gyn.rep.2024.498
For citation:
Shesternya P.A., Tskhay V.B., Bazina M.I., Matveeva I.V. Macrophage activation syndrome during pregnancy as a fatal complication of systemic idiopathic arthritis. Obstetrics, Gynecology and Reproduction. 2024;18(6):898-907. (In Russ.) https://doi.org/10.17749/2313-7347/ob.gyn.rep.2024.498
Введение / Introduction
В 1897 г. Джордж Фредерик Стилл описал 22 ребенка с тем, что сейчас называется системный ювенильный идиопатический артрит (сЮИА) [1]. Впервые болезнь Стилла взрослых (БСВ) была описана в 1971 г. Эриком Байуотерсом, который определил заболевание на основе клинического и лабораторного сходства с болезнью Стилла у подростков [2]. Вопрос о том, относятся ли БСВ и сЮИА к одному и тому же заболеванию, все еще обсуждается, но имеющиеся научные данные убедительно свидетельствуют о том, что БСВ и сЮИА являются одним и тем же заболеванием [3][4].
До сих пор мало что известно о взаимодействии между БСВ и беременностью [5][6]. Хотя известно, что начало БСВ, хотя и редко, может впервые отмечаться во время беременности [7]. L. Plaçais с соавт. (2018) предполагают, что БСВ, дебютирующий во время беременности, по-видимому, является специфическим подтипом заболевания с системными проявлениями, угрожающими жизни обострениями в I и II триместрах и развитием таких акушерских осложнений, как недоношенность и синдром задержки роста плода [8]. В исследовании М. Gerfaud-Valentin с соавт. (2014) рассмотрели связь между БСВ и беременностью. Среди женщин, не имевших диагностированной ранее БСВ, манифестация заболевания приходилась на I или II триместр. В значительной части случаев беременности отмечались маловодие и недоношенность, но без опасных для жизни осложнений. При наличии диагностированной БСВ всплески активности были менее частыми и возникали преимущественно во II триместре и послеродовом периоде [5]. В многоцентровом проспективном исследовании, проведенном в Норвегии, подтвержден высокий риск рецидива активности ЮИА после родоразрешения. Было установлено, что у женщин с ЮИА (135 беременностей у 114 женщин) активность заболевания была самой высокой через 6 нед после родов, но в целом низкой и стабильной в период беременности [9].
Хорошо известно, что во многом исходы беременности зависят от степени контроля активности заболевания в прегравидарный период, продолжения лечения в течение гестации. Ретроспективный анализ 22 случаев беременности у 16 пациенток с ЮИА за период 2010–2018 гг., проведенный A. García-Fernández с соавт. (2021), убедительно подтверждает данный постулат. Все случаи обострения заболевания во время беременности и 75 % случаев обострения в послеродовом периоде наблюдались у пациенток, которые отменили противоревматические и биологические препараты в начале беременности. Преждевременные роды произошли в 20 % случаев; у всех этих пациенток отмечено обострение заболевания во время беременности [10].
Согласно литературным данным, наиболее частыми и жизнеугрожающими осложнениями БСВ являются гемофагоцитарный лимфогистиоцитоз, включая синдром активации макрофагов (САМ), острый респираторный дистресс-синдром, миокардит/перикардит, фульминантный гепатит [3][4][11][12]. Частота развития САМ, являющегося одним из наиболее грозных осложнений БСВ, достигает 15,0–23,5 % [4][12].
Однако в доступной литературе нами найдены единичные публикации о развитии САМ у пациенток с БСВ во время беременности. Верификация САМ во время беременности вызывает большие сложности. Перечень патологических состояний, требующих проведения дифференциальной диагностики, включает HELLP-синдромом, атипичный гемолитико-уремический синдром (АГУС), тромботическую микроангиопатию (ТМА), гепатит беременных и др.
В 2021 г. A. Peters с соавт. представили первое сообщение о дебюте БСВ в III триместре беременности, которая проявилась как САМ. У ранее здоровой 26-летней женщины на 35-й неделе беременности появились лихорадка, тахикардия и гипотензия, характерные лабораторные сдвиги – анемия, тромбоцитопения, гипофибриногенемия, повышение уровня ферритина и печеночных ферментов [13]. Имеются описания двух случаев обострения имевшейся ранее БСВ в III триместре беременности, которые также требовали сложной дифференциальной диагностики [14][15]. В обоих случаях одним из ключевых диагностических параметров было значительное повышение уровня ферритина.
В течение двух последних десятилетий отрабатывались диагностические критерии САМ, которые в своей финальной версии были представлены Американской коллегией ревматологов (англ. American College of Rheumatology, ACR) и Европейской антиревматической лигой (англ. European League Against Rheumatism, EULAR) в 2016 г. [16]. Обязательными признаками САМ у больного сЮИА являются лихорадка и гиперферритинемия > 684 нг/мл в сочетании, как минимум, с двумя из четырех критериев: тромбоцитопения (≤ 181×10⁹/л), повышение уровня аспартатаминотрансферазы (АСТ > 48 ЕД/л), повышение уровня триглицеридов (> 156 мг/дл), гипофибриногенемия (≤ 3,6 г/л).
Если посмотреть на все предшествующие диагностические критерии, то наиболее значимым лабораторным маркером САМ является ферритин – основной внутриклеточный белок, ответственный за аккумуляцию железа в клетке. При САМ его уровень повышается и служит маркером системной воспалительной реакции. При этом пороговое значение ферритина, используемое в качестве диагностического, интерпретировалось в широком диапазоне – от 400 до 10000 нг/мл. Важным обстоятельством является изменение соотношения между фракциями ферритина в сыворотке; при массивном высвобождении внутриклеточного белка вследствие цитолиза резко возрастает доля негликозилированного ферритина [17].
Сложность диагностики САМ связана со многими факторами – неизвестной частотой, наличием субклинических и хронических форм, схожестью клинических проявлений с сепсисом, а нередко и ассоциацией двух этих патологических состояний. Однако особое значение имеет осведомленность и настороженность врачебного сообщества, междисциплинарное взаимодействие и маршрутизация пациентов, позволяющие сократить период до диагноза и начала адекватного лечения. Именно поэтому мы решили опубликовать представленный ниже клинический случай.
Клинический случай / Clinical case
Клиническая характеристика / Clinical characteristics
Данные анамнеза пациента А. представлены фрагментарно из имевшихся в наличии разрозненных документов, анализ представленного клинического случая проведен ретроспективно. В возрасте 9 лет у девочки дебютировал ювенильный идиопатический артрит с системным началом в виде суставного синдрома – полиартрита крупных и мелких суставов, полисерозитов, лимфаденопатии, лихорадки до 38 °С. Диагноз верифицирован в НИИ педиатрии (в настоящее время ФГАУ НМИЦ здоровья детей Минздрава России), где была инициирована биологическая терапия препаратом тоцилизумаб (ТЦЗ) внутривенно, изначально каждые 2 недели, затем ежемесячно. В течение последующих многих лет на фоне регулярной терапии поддерживалась ремиссия заболевания. С 2019 г., учитывая наличие стойкой медикаментозной ремиссии, доза ТЦЗ была снижена до 280 мг внутривенно 1 раз в месяц (4 мг/кг массы тела), которая успешно продолжалась еще в течение нескольких лет. За 1 год до наступления беременности пациентка отказалась от лечения, мотивируя это своим хорошим самочувствием и планируемой беременностью. Любую информацию о необходимости продолжения лечения и тщательного мониторинга воспринимала негативно.
Анамнез беременности / History of pregnancy
Беременность наступила спонтанно, с 8-й недели гестации пациентка А. наблюдалась в женской консультации. На сроке 14 нед беременности впервые отмечено ухудшение самочувствия – появление слабости, артралгии, миалгии, эпизодов лихорадки до 40 °С, головной боли, тошноты, рвоты; лабораторные данные – лейкоцитоз до 17×10⁹/л, снижение уровня гемоглобина (Hb) до 95 г/л, увеличение скорости оседания эритроцитов до 65 мм/час.
Пациентка была госпитализирована в межрайонную больницу, где находилась в течение 10 дней с клиническим диагнозом «Болезнь Стилла взрослых с высокой степенью активности». От прерывания беременности по медицинским показаниям пациентка категорически отказывалась. На фоне назначения глюкокортикоидов (ГК – преднизолон внутривенно 120 мг/сут), сульфасалазина (2 г/сут) нормализовалась температура тела, купирован суставной синдром, боли в мышцах. Пациентка была выписана с рекомендациями продолжить прием ГК (преднизолон per os 50 мг/сут с постепенным снижением дозы до 10 мг/сут) и сульфасалазина 2 г/сут.
Через неделю после выписки из стационара вновь возвращается симптоматика – вновь появляются лихорадка до 40 °С, суставной синдром, мышечные и головные боли. Пациентка повторно была госпитализирована в межрайонную больницу. Тогда же пациентка впервые была консультирована в КГБУЗ «Красноярский краевой клинический центр охраны материнства и детства», рекомендован перевод в многопрофильное учреждение III уровня – КГБУЗ «Краевая клиническая больница» (КГБУЗ ККБ).
Данные лабораторных и инструментальных методов исследования / Laboratory and instrumental data
В приемном отделении КГБУЗ ККБ лабораторные изменения были расценены как проявления инфекционного бактериального процесса: нейтрофильный лейкоцитоз (19×10⁹/л, нейтрофилов до 97,5 %, в том числе палочкоядерных 20 %), умеренная анемия (Hb = 85 г/л), значительное увеличение С-реактивного белка (СРБ = 104,7 мг/л) и печеночных трансаминаз – аланинаминотрансфераза (АЛТ) = 93,4 ЕД/л при норме до 34 ЕД/л, АСТ = 308,4 ЕД/л при норме до 31 ЕД/л, прокальцитонин = 13,2 нг/мл. На рисунке 1 представлена динамика ключевых лабораторных показателей в течение всего периода госпитализации. Данные биохимического анализа крови, результаты коагулограммы – без значимых отклонений.
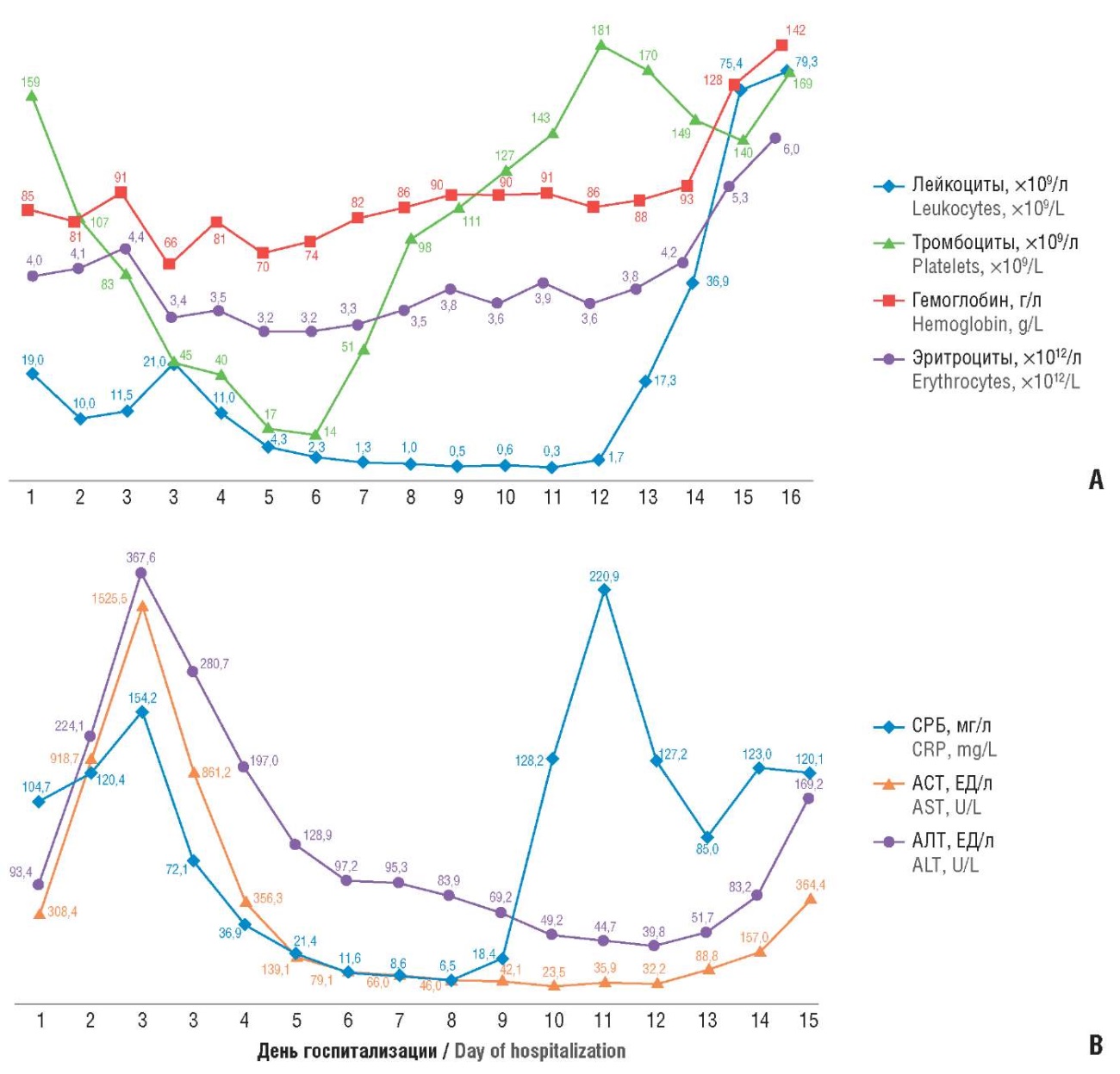
Рисунок 1. Пациент А. Динамика ключевых гематологических (А) и биохимических (В) лабораторных показателей в течение периода госпитализации.
Примечание: СРБ – С-реактивный белок; АСТ – аспартатаминотрансфераза; АЛТ – аланинаминотрансфераза.
Figure 1. Patient A. Dynamics of key hematological (A) and biochemical (В) laboratory parameters during hospitalization period.
Note: CRP – C-reactive protein; AST – aspartate aminotransferase; ALT – alanine aminotransferase.
При поступлении по данным мультиспиральной компьютерной томографии (МСКТ) органов грудной полости: картина правосторонней нижнедолевой пневмонии, малый гидроторакс справа, признаки легочной гипертензии. По данным эхокардиографии (Эхо-КГ): сократительная способность миокарда левого желудочка удовлетворительная, легочной гипертензии не выявлено. По данным ультразвукового исследования (УЗИ) органов брюшной полости: выраженные диффузные изменения в поджелудочной железе, состояние после холецистэктомии, нормальных размеров без значимых изменений печень, селезенка, почки. По данным УЗИ органов малого таза: одноплодная беременность в сроке 17–18 нед. Дуплексное сканирование сосудов порто-печеночного бассейна, вен ног: без патологии. Назначенное лечение включало антибактериальную (меропенем+линезолид) и антимикотическую (флуконазол) терапию, инфузии альбумина, низкомолекулярный гепарин, гепатопротекторы, доза преднизолона была увеличена до 90 мг 2 раза в сутки.
На 3-и сутки пребывания больной в КГБУЗ ККБ на фоне проводимой терапии отмечена отрицательная динамика заболевания: нарастала дыхательная недостаточность, требующая кислородной поддержки, появилась геморрагическая сыпь на верхних конечностях, присоединился болевой симптом в правом подреберье, жидкий стул, появилась боль в горле, усилилась боль в суставах. При аускультации легких появились хрипы в отлогих местах на фоне ослабленного везикулярного дыхания. Лабораторно отмечено пиковое нарастание трансаминаз (АСТ = 1525,5 ЕД/л, АЛТ = 367,6 ЕД/л), гипербилирубинемия (35 мкмоль/л), СРБ до 154,2 мг/л. Исследование ферритина проведено в течение госпитализации дважды – на 3-и сутки (652,6 нг/мл) и 12-е сутки (599,7 нг/мл), референсные значения = 10–120 нг/мл.
По УЗИ органов брюшной полости появилась гепатомегалия (толщина правой доли печени 15 см, левой доли 5,6 см, увеличена хвостатая доля 6,5×2,8 см, эхогенность печени повышена), лимфаденопатия (группы лимфоузлов в области ворот печени размером до 1,2×0,8 см, парапанкреатические – до 1,1×0,6 см, в области головки поджелудочной железы – до 2,3×0,9 см). По данным МСКТ также была отмечена отрицательная динамика за счет увеличения уплотнения легочной ткани по типу консолидации в базальных отделах нижней доли правого легкого, появление очаговой перибронховазальной инфильтрации по всем полям правого легкого, появление жидкости в обеих плевральных полостях – справа до 600 мл, слева – до 180 мл (рис. 2). В динамике по Эхо-КГ появился небольшой выпот в перикарде без признаков сдавления сердца (эхо-свободное пространство в области правого предсердия – 0,5–0,6 см, в области правого желудочка – 0,4 см), регургитация на трикуспидальном клапане 1–2 степени, повышение систолического давления в легочной артерии до 30–35 мм рт. ст.
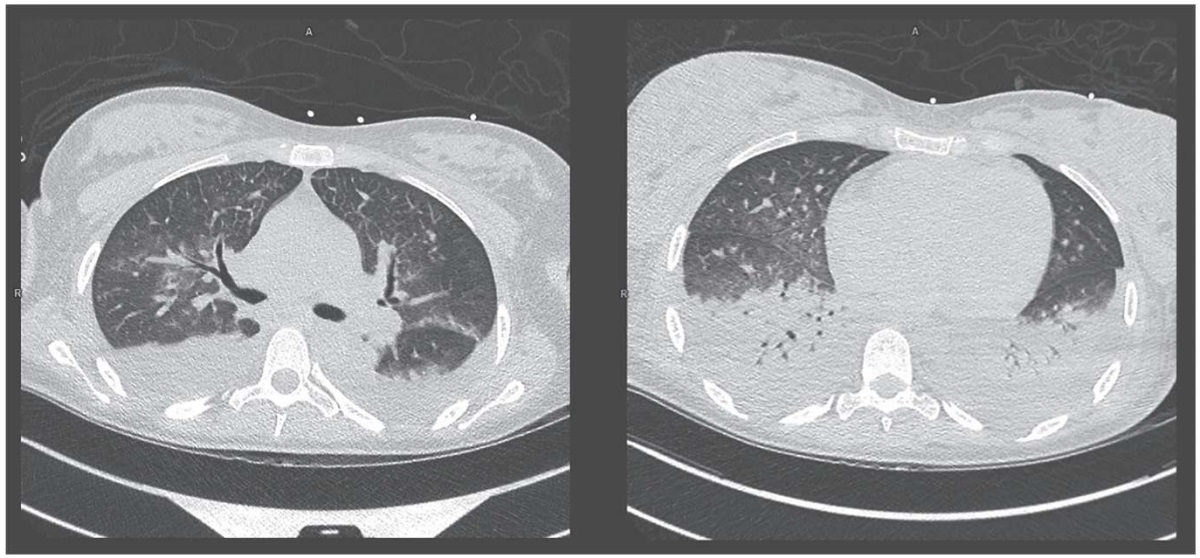
Рисунок 2. Пациент А. Мультиспиральная компьютерная томография органов грудной полости.
Figure 2. Patient A. Chest organs multispiral computed tomography.
С учетом критического состояния пациентки и неэффективности проводимой терапии была проведена телемедицинская консультация с профильными специалистами ФГБУ НМИЦ АГП им. акад. В.И. Кулакова. Согласован диагноз: «Болезнь Стилла взрослых, хроническое течение, высокая степень активности. Беременность 18 недель. Вторичный иммунодефицит. Нозокомиальная двусторонняя пневмония, тяжелое течение. Дыхательная недостаточность 2-й степени. Сепсис. Синдром полиорганной недостаточности». Рекомендовано прерывание беременности путем операции малого кесарева сечения. Только на 5-й день госпитализации удалось получить согласие пациентки, тогда же незамедлительно была произведена операция малого кесарева сечения.
Результаты лечения / Treatment results
В послеоперационном периоде состояние больной несколько улучшилось, пациентка была переведена из реанимации в отделение нефрологии. Ведущими клиническими симптомами оставались лихорадка до фебрильных цифр, кашель с мокротой светлого цвета, выраженная слабость. В этот период произошло снижение трансаминаз печени до 2–3 кратного уровня выше верхней границы нормы, нормализация уровня СРБ и прокальцитонина. Динамика прокальцитонинового теста в течение первой недели отражала поставленную цель антибактериальной терапии: 13,2 – 12,2 – 12,3 – 0,5 нм/мл. Однако появился агранулоцитоз с минимальным количеством лейкоцитов 0,3×10⁹/л и тромбоцитопения до 14×10⁹/л (рис. 1). Обращает внимание также значительное снижение уровня фибриногена как проявление нарастающей печеночно-клеточной недостаточности до 0,9–1,1 г/л по серии тестов при исходно нормальном уровне (3–6 г/л). В отделении была проведена смена антибактериальной (пиперациллина тазобактам + фосфомицин + ванкомицин) и антимикотической (вориконазол) терапии, добавлен к лечению синтетический аналог соматостатина (октреотид).
Телемедицинская консультация с Клиникой «НИИ детской онкологии, гематологии и трансплантологии имени Р.М. Горбачевой» (Санкт-Петербург): рекомендовано назначение колониестимулирующих факторов – Нейпомакс 300 мкг подкожно 1 раз в сутки под контролем числа гранулоцитов. На 12-й день госпитализации препарат был введен в рекомендованной дозе однократно. В последующие дни состояние пациентки ухудшилось: сохранялись кашель, лихорадка, появилась рвота съеденной пищей, присоединился жидкий стул до 2 раз в день. Лабораторно отмечен гиперлейкоцитоз (36,9×10⁹/л) с палочкоядерным сдвигом до 37 %, нейрофилов 97 %, вновь повышение прокальцитонина до 25,4 нг/мл. В связи с отрицательной клинико-лабораторной динамикой пациентка была повторно переведена в отделение реанимации на самостоятельном дыхании. Через двое суток ввиду нарастания дыхательной недостаточности пациентка была переведена на искусственную вентиляцию легких. В дальнейшем состояние больной прогрессивно ухудшалось, прогрессировала гипотония, рефрактерная к инотропной поддержке, что в совокупности с другими симптомами было расценено как проявление септического шока. На 16-е сутки госпитализации развилась асистолия, реанимационные мероприятия в полном объеме без эффекта, диагностирована биологическая смерть.
Микробиологические и гистологические данные / Microbiological and histological data
В посевах мокроты, мочи, отделяемого миндалин выявлен рост синегнойной палочки в высоком титре, резистентной к большинству антибиотиков (табл. 1). Гемокультура, бактериологическое исследование на грибы – результат отрицательный. Однако эти исследования были получены из лаборатории уже после летального исхода.
Таблица 1. Результаты бактериологического исследования.
Table 1. Bacteriological examination results.
|
Антибиотик Antibiotic |
Мокрота Sputum |
Миндалины / глотка Tonsils / pharynx |
Моча Urine |
|
|
Acinetobacter baumannii, ×10⁹ КОЕ/мл ×10⁹ CFU/ml |
Pseudomonas aeruginosa, ×10⁹ КОЕ/мл ×10⁹ CFU/ml |
Pseudomonas aeruginosa, ×10⁶ КОЕ/мл ×10⁹ CFU/ml |
Pseudomonas aeruginosa, ×10⁶ КОЕ/мл ×10⁹ CFU/ml |
|
|
Amp/Sulbactam |
R |
|||
|
Amikacin |
R |
R |
R |
R |
|
Ceftazidime |
R |
R |
R |
|
|
Ciprofloxacin |
R |
R |
R |
R |
|
Cefepime |
R |
R |
R |
|
|
Imipenem |
R |
R |
R |
R |
|
Levofloxacin |
R |
R |
R |
R |
|
Meropenem |
R |
R |
R |
R |
|
Netilmicin |
R |
R |
R |
|
|
Piperacillin/tazobactam |
R |
R |
R |
|
|
Tobramycin |
R |
R |
R |
|
|
Ticarcilline/clavulanic acid |
R |
R |
R |
|
|
Металло-β-лактамазы Metallo-β-lactamases |
R |
R |
R |
|
|
Рост грибов не выявлен / No fungal growth detected |
||||
Примечание: R – резистентный.
Note: R – resistant.
По данным судебно-медицинского исследования подтверждено наличие двусторонней субтотальной серозно-гнойно-геморрагической пневмонии (в просветах альвеол экссудат с полиморфноядерными лейкоцитами и мононуклеарами, альвеолярный и стромальный отек, дистелектазы, диффузные кровоизлияния в альвеолы, десквамация бронхиального эпителия с лейкоцитарной инфильтрацией, инфильтрация стенок бронхов лимфоидными клетками и зернистыми лейкоцитами), осложненной септическим шоком (клинически).
Вместе с тем выявленная в костном мозге выраженная гиперплазия макрофагов с проявлениями гемофагоцитоза подтверждает наличие у пациентки гемофагоцитарного лимфогистиоцитоза.
На рисунке 3А визуализируются костные балки неравномерной толщины, встречаются «висячие» балки, поверхность балок неровная с участками остеокластической резорбции (окраска азур-2-эозином). Миелоидная ткань занимает 80 % объема межбалочных пространств, из него примерно 50% занимают многочисленные крупные гистиоциты (макрофаги). При иммуногистохимическом исследовании (рис. 3Б, 3В) гистиоциты экспрессируют CD68, CD163 в цитоплазме, слабо – протеин S100 и CD4, циклин D1 в ядрах и не экспрессируют CD1a и лангерин. Гранулоцитарный росток декорирован экспрессией миелопероксидазы, эритроидный – гликофорина А/GATA1, мегакариоцитарный – CD31/CD42b/GATA1/FVIII. CD34 позитивные клетки и TdT позитивные клетки в миелоидной ткани единичны. В миелоидной ткани обнаружены малочисленные рассеянные CD20 позитивные В-лимфоциты и в несколько большем количестве CD3 позитивные Т-лимфоциты.
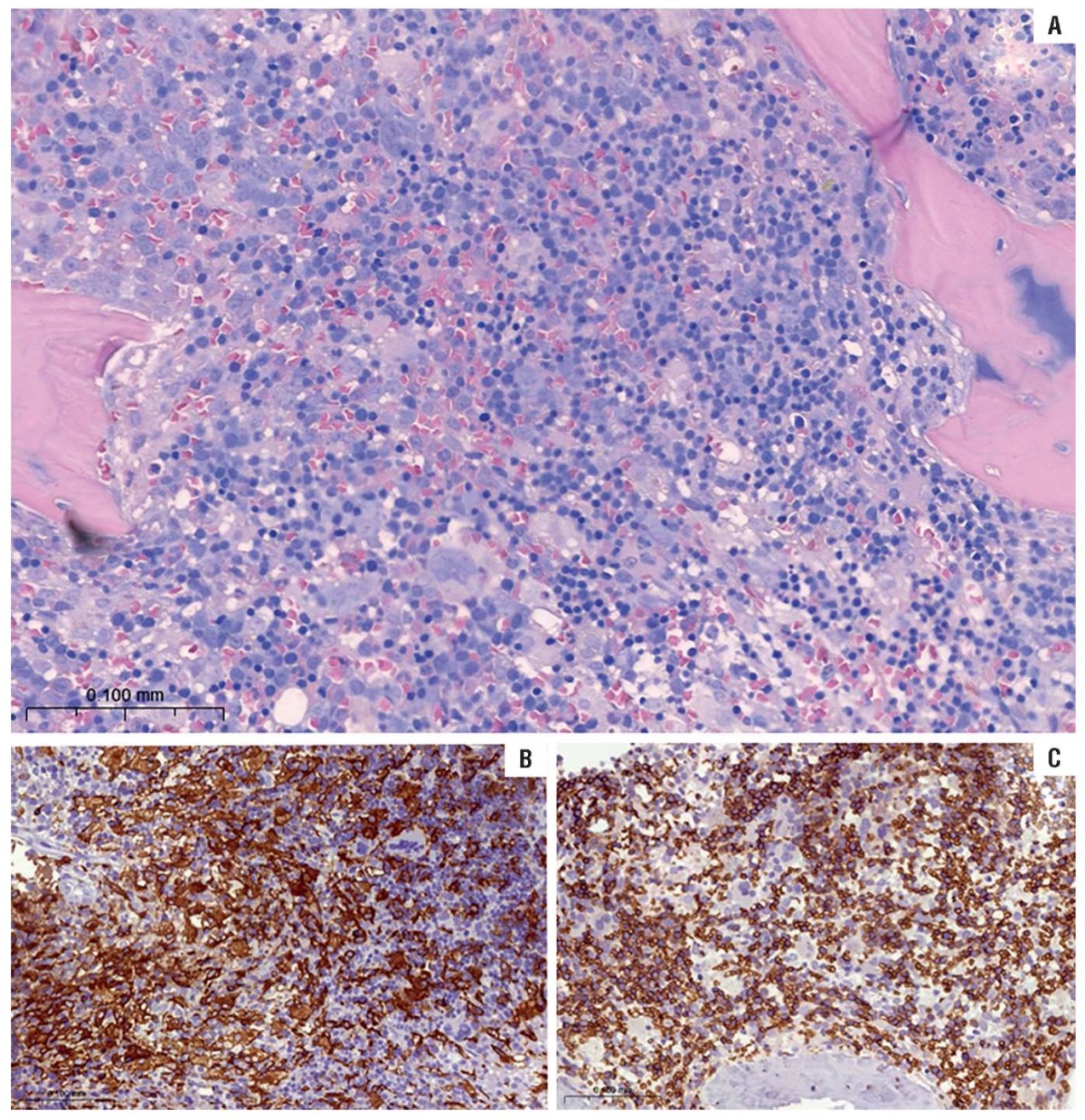
Рисунок 3. Пациент А. Гистологическое и иммуногистохимическое исследование костного мозга (1:300). А – окраска азур-2-эозином; B – иммуногистохимическая реакция с антителами к CD163 A; C – иммуногистохимическая реакция с антителами к Glycophorin-A.
Figure 3. Patient A. Bone marrow histological and immunohistochemical examination (1:300). A – stained with azure-2-eosin; B – immunohistochemical staining with anti-CD163 A antibodies; C – immunohistochemical staining with anti-Glycophorin-A antibodies.
Обсуждение / Discussion
Согласно общепринятому индексу оценки системного счета активности (ССА) при БСВ из 12 возможных баллов, за исключением перикардита и спленомегалии у пациентки имелись 10 остальных – лихорадка, сыпь, плеврит, пневмония, гепатомегалия или увеличение концентрации печеночных ферментов, лимфаденопатия, боль в горле, миалгии, боль в животе, лейкоцитоз более 15×10⁹/л [18]. Каждый признак оценивается в один балл, а значение индекса ≥ 7 баллов является прогностически крайне неблагоприятным. M. Rau с соавт. в 2010 г. разработан модифицированный индекс ССА, включающий сывороточный уровень ферритина > 3000 нг/мл. Модифицированный ССА ≥ 4 баллов обладает 92 % чувствительностью и 93 % специфичностью для диагностики активной БСВ и дифференциальной диагностики с сепсисом [19]. Помимо гиперферритинемии, к предикторам развития САМ при БСВ относят также поражение печени с синдромом цитолиза, спленомегалию, тромбоцитопению, увеличение концентрации триглицеридов и выявление гемофагоцитоза в миелограмме [20].
Однако согласно современным подходам, диагноз сЮИА не пересматривается и сопровождает пациента после перехода во взрослую сеть. Льготное лекарственное обеспечение пациентов с сЮИА проводится в рамках федеральной программы лечения высокозатратных нозологий, в которую юношеский артрит с системным началом (М08.2) включен с 2019 г., хорошо организовано и не вызывает трудностей. Таким образом, использование диагноза БСВ в данном контексте является неверным, несмотря на общность патогенеза и несомненное «родство» сЮИА и БСВ.
Одним из наиболее грозных и потенциально фатальным осложнением сЮИА является синдром активации макрофагов, представляющий особый вариант цитокинового шторма в рамках гемофагоцитарного лимфогистиоцитоза с частотой развития до 10 % [16]. В представленном клиническом случае присутствовали все диагностические критерии САМ за исключением гипертриглицеридемии, уровень триглицеридов не исследовали [16]. В дифференциально-диагностический ряд, безусловно, включался HELLP-синдром, характеризующийся гемолизом, тромбоцитопенией и повышением трансаминаз.
На наш взгляд, всплеск активности сЮИА и развитие САМ были обусловлены совокупностью взаимно отягчающих факторов. Прекращение лечения ингибитором интерлейкина-6 у больных аутовоспалительным заболеванием в связи с хорошим самочувствием и зачастую многолетней медикаментозной ремиссией потенциально чревато развитием мощнейшего всплеска активности заболевания. Самовольное прекращение лечения и беременность, выступившая триггером, запустили именно этот сценарий.
Ограничения в использовании лабораторных маркеров и лекарственных препаратов при беременности также сыграли свою роль. Именно этим, по всей видимости, был обусловлен выбор сульфасалазина и достаточно быстрое снижение дозировки ГК при первом обращении за медицинской помощью. Другим лимитирующим фактором явилась ассоциация тяжелой неконтролируемой гипервоспалительной реакции при САМ с инфекцией.
В лечении гемофагоцитарного синдрома при сЮИА необходимо рассмотреть назначение ГК в высоких дозировках 1–2 мг/сут преднизолона, циклоспорина, внутривенного иммуноглобулина, свежезамороженной плазмы в соответствии с клиническими рекомендациями [21].
Заключение / Conclusion
Акцентирование внимания врачей различных специальностей на особенностях прегравидарной подготовки пациентов сЮИА является основной целью публикации представленного клинического случая. Своевременная диагностика и эффективность лечения САМ напрямую зависят от осведомленности врачей широкого круга специальностей и настороженности в отношении возможного развития этого грозного осложнения.
Список литературы
1. Still G.F. On a form of chronic joint disease in children. Med Chir Trans. 1897;80:47-60.9.
2. Bywaters E.G. Still's disease in the adult. Ann Rheum Dis. 1971;30(2):121-33. https://doi.Org/10.1136/ard.30.2.121.
3. Насонов Е.Л., Файст Е. Болезнь Стилла взрослых: новые горизонты. Научно-практическая ревматология. 2021;59(6):645-65. https://doi.org/10.47360/1995-4484-2021-643-663.
4. Efthimiou P., Kontzias A., Hur P. et al. Adult-onset Still's disease in focus: Clinical manifestations, diagnosis, treatment, and unmet needs in the era of targeted therapies. Semin Arthritis Rheum. 2021;51(4):858-74. https://doi.org/10.1016/j.semarthrit.2021.06.004.
5. Gerfaud-Valentin M., Hot A., Huissoud C. et al. Adult-onset Still disease and pregnancy: about ten cases and review of the literature. Rheumatol Int. 2014;34(6):867-71. https://doi.org/10.1007/s00296-013-2765-5.
6. De Carolis S., Cianci F., Del Sordo G. et al. Adult onset Still' and pregnancy. Autoimmun Rev. 2019;18(9):102356. https://doi.org/10.1016/j.autrev.2019.102356.
7. Abdulkarim S., Otieno F., Ali S.K. Adult-onset Still's disease triggered by pregnancy. Proc (Bayl Univ Med Cent). 2019;32(2):229-30. https://doi.org/10.1080/08998280.2018.1562292.
8. Plapais L., Mekinian A., Bornes M. et al. Adult onset Still's disease occurring during pregnancy: Case-report and literature review. Semin Arthritis Rheum. 2018;47(4):575-7. https://doi.org/10.1016/j.semarthrit.2017.07.003.
9. Ursin K., Lydersen S., Skomsvoll J.F., Wallenius M. Disease juvenile idiopathic arthritis during and after pregnancy: A prospective multicenter study. J Rheumatol. 2018;45(2):257-65. https://doi.org/10.3899/jrheum.161410.
10. Garda-Fernandez A., Gerardi M.C., Crisafulli F. et al. Disease course and obstetric outcomes of pregnancies in juvenile idiopathic arthritis: are there any differences among disease? A single-center retrospective study of prospectively followed pregnancies in a dedicated pregnancy clinic. Clin Rheumatol. 2021;40(1):239-44. https://doi.org/10.1007/s10067-020-05404-w.
11. Lenert A., Yao Q. Macrophage activation syndrome complicating adult onset Still's disease: A single center case series and comparison with literature. Semin Arthritis Rheum. 2016;45(6):711-6. https://doi.org/10.1016/j.semarthrit.2015.11.002.
12. Wang C.R., Tsai Y.S., Ma I.C. Macrophage activation syndrome with lung involvement complicating adult-onset Still's disease. Neth J Med. 2018;76(10):442-4.
13. Peters A.T., Prickett M.H. Adult-onset Still's disease presenting as macrophage-activation syndrome with critical illness in the third trimester of pregnancy: A case report. Crit Care Explor. 2021;3(5):e0440. https://doi.org/10.1097/CCE.0000000000000440.
14. Hosoya S., Sadatsuki M., Izuka S. et al. A case of recurrence of adult-onset Still's disease in the third trimester: a case report and literature review. BMC Pregnancy Childbirth. 2021;21(1):163. https://doi.org/10.1186/s12884-021-03648-1.
15. Артишевская Н.И., Раевнева Т.Г., Алексейчик С.Е. и др. Болезнь Стилла взрослых у беременной, осложненная синдромом активации макрофагов. Неотложная кардиология и кардиоваскулярные риски. 2020;4(1):877-81.
16. Ravelli A., Minoia F., Davi S. et al.; Paediatric Rheumatology International Trials Organisation; Childhood Arthritis and Rheumatology Research Alliance; Pediatric Rheumatology Collaborative Study Group; Histiocyte Society. 2016 Classification criteria for macrophage activation syndrome complicating systemic juvenile idiopathic arthritis: A European League Against Rheumatism/American College of Rheumatology/Paediatric Rheumatology International Trials Organisation Collaborative Initiative. Arthritis Rheumatol. 2016;68(3):566-76. https://doi.org/10.1002/art.39332.
17. Костик М.М., Дубко М.Ф., Масалова В.В. и др. Современные подходы к диагностике и лечению синдрома активации макрофагов у детей с ревматическими заболеваниями. Современная ревматология. 2015;(1):55-9. https://doi.org/10.14412/1996-7012-2015-1-55-59.
18. Pouchot J., Sampalis J.S., Beaudet F. et al. Adult Still's disease: Manifestations, disease course, and outcome in 62 patients. Medicine. 1991;70(2):118-36.
19. Rau M., Schiller M., Krienke S. et al. Clinical manifestations but not cytokine profiles differentiate adult-onset Still's disease and sepsis. J Rheumatol. 2010;37(11):2369-76. https://doi.org/10.14412/1996-7012-2015-1-55-5910.3899/jrheum.100247.
20. Wang R., Li T., Ye S. et al. Macrophage activation syndrome associated with adult-onset Still's disease: a multicenter retrospective analysis. Clin Rheumatol. 2020;39(8):2379-86. https://doi.org/10.14412/1996-7012-2015-1-55-5910.1007/s10067-020-04949-0.
21. Клинические рекомендации - Юношеский артрит с системным началом - 2021-2022-2023 (29.06.2021). М.: Министерство здраво¬охранения Российской Федерации, 2021. 192 с. Режим доступа: https://cr.minzdrav.gov.ru/recomend/26_2. [Дата обращения: 01.02.2024].
Об авторах
П. А. ШестерняРоссия
Шестерня Павел Анатольевич, д.м.н., проф.
660022 Красноярск, ул. Партизана Железняка, д. 1
WoS ResearcherID: M-3898-2014
В. Б. Цхай
Россия
Цхай Виталий Борисович, д.м.н., проф.
660022 Красноярск, ул. Партизана Железняка, д. 1
WoS ResearcherID: C-4869-2014
М. И. Базина
Россия
Базина Марина Ивановна, д.м.н.
660022 Красноярск, ул. Партизана Железняка, д. 1
И. В. Матвеева
Россия
Матвеева Ирина Владимировна
660022 Красноярск, ул. Партизана Железняка, д. 3
Что уже известно об этой теме?
► Длительное время преемственность терапии пациентов с системным ювенильным идиопатическим артритом (сЮИА) при переходе во взрослую сеть оставалась серьезной проблемой, поскольку чаще всего сопровождалась сменой диагноза.
► Вопросы репродукции при сЮИА остаются крайне мало изученными.
► Широкое внедрение в клиническую практику антицитокиновой биологической терапии сопровождается новыми междисциплинарными задачами.
Что нового дает статья?
► Развитие синдрома активации макрофагов (САМ) на фоне беременности является одним из наиболее грозных и потенциально фатальным осложнением.
► Лечение САМ требует активного и тщательного контроля со стороны всей междисциплинарной команды.
Как это может повлиять на клиническую практику в обозримом будущем?
► Необходимо акцентирование внимания врачей различных специальностей на особенностях диагностики и ведения сЮИА и САМ при планировании прегравидарной подготовки.
Рецензия
Для цитирования:
Шестерня П.А., Цхай В.Б., Базина М.И., Матвеева И.В. Синдром активации макрофагов во время беременности как фатальное осложнение системного идиопатического артрита. Акушерство, Гинекология и Репродукция. 2024;18(6):898-907. https://doi.org/10.17749/2313-7347/ob.gyn.rep.2024.498
For citation:
Shesternya P.A., Tskhay V.B., Bazina M.I., Matveeva I.V. Macrophage activation syndrome during pregnancy as a fatal complication of systemic idiopathic arthritis. Obstetrics, Gynecology and Reproduction. 2024;18(6):898-907. (In Russ.) https://doi.org/10.17749/2313-7347/ob.gyn.rep.2024.498

Контент доступен под лицензией Creative Commons Attribution-NonCommercial-ShareAlike 4.0 International License.











































