Перейти к:
Поверхностно-усиленная рамановская спектроскопия как метод диагностики доброкачественных образований яичников у беременных
https://doi.org/10.17749/2313-7347/ob.gyn.rep.2025.516
Аннотация
Цель: изучить спектральные особенности плазмы крови у беременных с доброкачественными образованиями яичников (ОЯ).
Материалы и методы. В ретроспективное исследование, проведенное в период с 2021 по 2023 гг., были включены 100 беременных во II и III триместрах беременности в возрасте от 18 до 45 лет. Выделены 2 группы: в основную группу вошли 50 беременных с ОЯ, в контрольную группу – 50 беременных с нормально протекающей беременностью. Методом поверхностно-усиленной рамановской спектроскопии (англ. surface-enhanced Raman spectroscopy, SERS) проведены определение и оценка спектральных особенностей, характерных для ОЯ, необходимые для дифференцированной диагностики данной патологии во время беременности.
Результаты. Выявлены значительные различия в спектральных интенсивностях между группами обследованных. При наличии ОЯ наблюдали значимое в сравнении с контрольной группой усиление интенсивности спектральных пиков в областях 491 нм, 596 нм, 632 нм, 808 нм, 886 нм и 1132 нм и сниженная интенсивность спектральных пиков в областях 725 нм и 1440 нм. После удаления ОЯ спектральная картина восстанавливалась до практически полного соответствия спектральной картине, наблюдаемой в контрольной группе беременных.
Заключение. Выделенные и проанализированные спектральные особенности показали возможность использования SERS в диагностике опухолевидных ОЯ у беременных.
Ключевые слова
Для цитирования:
Фаткуллина Д.А., Мусин И.И., Ящук А.Г., Гареев Е.М. Поверхностно-усиленная рамановская спектроскопия как метод диагностики доброкачественных образований яичников у беременных. Акушерство, Гинекология и Репродукция. 2025;19(1):59-67. https://doi.org/10.17749/2313-7347/ob.gyn.rep.2025.516
For citation:
Fatkullina D.A., Musin I.I., Yashchuk A.G., Gareev E.M. Surface-enhanced Raman spectroscopy as a method for diagnosing benign ovarian formations in pregnant women. Obstetrics, Gynecology and Reproduction. 2025;19(1):59-67. (In Russ.) https://doi.org/10.17749/2313-7347/ob.gyn.rep.2025.516
Введение / Introduction
Выявление доброкачественных образований яичников (ОЯ) в последние годы имеет тенденцию роста, чаще встречается у женщин репродуктивного возраста [1]. Частота сочетания беременности с ОЯ составляет от 2 до 20 на 1000, что примерно в 2–20 раз выше, чем в общей популяции того же возраста [2]. Данная патология относится к числу «случайных находок» при проведении планового ультразвукового исследования (УЗИ) в I триместре [3]. Наиболее распространенными типами ОЯ во время беременности являются дермоидные кисты (32 %), эндометриомы (15 %), функциональные кисты (12 %), серозные цистаденомы (11 %) и муцинозные цистаденомы (8 %). Примерно 2 % ОЯ во время беременности являются злокачественными. Хотя большинство ОЯ во время беременности можно безопасно наблюдать, и примерно в 70 % случаев они разрешаются спонтанно, в меньшинстве случаев требуется хирургическое вмешательство из-за симптомов, риска перекрута или подозрения на злокачественное новообразование. УЗИ является основой оценки ОЯ во время беременности из-за точности, безопасности и доступности. Данный метод увеличивает частоту выявления опухолей яичников в I триместре беременности, но в тоже время на больших сроках увеличенная матка с околоплодными водами создает ограничение для диагностики ОЯ, что влияет на тактику ведения и лечения пациенток [2]. Следующим методом исследования и диагностики ОЯ является определение содержания специфических и неспецифических опухолевых маркеров [4]. Однако у беременных данные показатели могут иметь ложноположительный результат, что приводит к диагностическим ошибкам и свидетельствует о нецелесообразности их использования [5][6]. При сложных клинических случаях по показаниям возможно использование дополнительных методов исследования, таких как компьютерная томография (КТ) и магнитно-резонансная томография (MPT) без контрастирования [7][8]. Однако данные методы исследования во время беременности не дают полной картины и могут даже оказаться ошибочными, что в свою очередь повышает риск, неблагоприятно влияющий на течение беременности и ее исход [3][9].
В связи с этим возрастает актуальность поиска новых диагностических маркеров для определения ОЯ. В последние годы появились данные об использовании поверхностно-усиленной рамановской спектроскопии (англ. surface-enhanced Raman spectroscopy, SERS) в медицине, биологии, фармации, криминалистике и других областях науки, которая позволяет быстро идентифицировать объекты исследования путем изучения рассеянного света [10]. Основными достоинствами SERS являются отсутствие пробоподготовки и малые количества объекта исследования. Уникальность данного метода заключается в том, что можно получить необходимую информацию о конформации и микроокружении молекул живых клеток бесконтактно. Выявление различий спектральных характеристик тканей органов малого таза у женщин с патологией по сравнению с нормальной тканью показывает перспективы применения SERS в гинекологической практике [11].
Цель: изучить спектральные особенности плазмы крови у беременных с доброкачественными ОЯ.
Материалы и методы / Materials and Methods
Дизайн исследования / Study design
В ретроспективное исследование, проведенное в период с 2021 по 2023 гг., были включены 100 беременных во II и III триместрах беременности. Все беременные были обследованы в соответствии с приказом Минздрава России от 20.10.2020 N 1130н «Об утверждении Порядка оказания медицинской помощи по профилю "акушерство и гинекология"» [12].
Выделены 2 группы: в основную группу вошли 50 беременных с ОЯ, в контрольную группу – 50 беременных с нормально протекающей беременностью.
Критерии включения и исключения / Inclusion and exclusion criteria
Критерии включения в основную группу: возраст от 18 до 45 лет включительно; наличие доброкачественных ОЯ; информированное согласие на участие в исследовании.
Критерии включения в контрольную группу: возраст от 18 до 45 лет включительно; отсутствие патологических изменений и объемных образований в проекции матки и маточных придатков по результатам УЗИ органов малого таза (ОМТ); информированное согласие на участие в исследовании.
Критерии исключения: возраст моложе 18 и старше 45 лет; наличие в анамнезе злокачественных новообразований любых других локализаций; наличие острых воспалительных заболеваний ОМТ; беременность, наступившая в результате вспомогательных репродуктивных технологий (ВРТ); состояние беременной, которое, по мнению врача, может угрожать ее безопасности при выполнении любой процедуры, предусмотренной в рамках исследования; отказ от участия или отсутствие информированного согласия.
Методы исследования / Study methods
Проведен анализ спектров SERS плазмы беременных с ОЯ и с нормально протекающей беременностью. Отбор проб венозной крови осуществляли в сроке от 15 до 36,6 нед в обеих группах однократно и повторно у беременных основной группы после удаления ОЯ в сроке от 15,3 до 28,5 недель.
Метод SERS в клинической практике является малоинвазивным, безболезненным и не представляет угрозу осложнений, основан на взаимодействии света с легкодоступными биожидкостями, включая кровь, мочу или слюну [13]. Для исследования спектральных характеристик биологической жидкости с помощью SERS был использован экспериментальный стенд, состоящий из спектрометрической системы Raman Life RL785 (ООО «ФОТОН-БИО», Россия) на основе ПЗС-детектора и микроскопа ADF U300 (ADF, Китай).
Исследование проводили на рамановском микроскопе в режиме SERS-сигнала (капля исследуемой пробы 5 мкм наносится на поверхность специальной наноостровковой SERS-подложки). Технология получения SERS-подложки, используемой в нашем исследовании, подробно изложена в работе М.В. Зуева [14]. С помощью программы EnSpectr для регистрации спектров использовали объектив LMPlan, замер осуществляли при длине волны 785 нм в области от 300 до 1700 нм со спектральным разрешением 6–8 нм при увеличении 50×6 и мощностью излучения 20 мВт, при этом время экспозиции составило 2000 мс, а количество усреднений – 10. Предварительно проводили запись окружающего фонового сигнала, позднее автоматически вычитая его из последующих регистрируемых спектров исследуемых образцов плазмы.
Для спектрального анализа были допущены образцы плазмы беременных с подтвержденным как клинически, так и гистологически диагнозом «доброкачественное образование яичников». В общей сложности было получено 50 образцов плазмы крови беременных с ОЯ (основная группа) и 50 образцов нормальной плазмы от здоровых женщин (контрольная группа).
Отдельно исследовали плазму женщин с ОЯ во время беременности и плазму крови тех же беременных уже после удаления ОЯ (группа сравнения). В эту группу вошли 8 женщин.
Подготовка образцов
Кровь отбирали в вакуумные пробирки с ЭДТА-К2. Плазму получали путем центрифугирования крови продолжительностью 5 мин при 3000 оборотов в минуту. Полученную плазму переливали в пустую стерильную пробирку без дополнительных компонентов и замораживали при температуре –18 °С для дальнейшего исследования. Образцы плазмы были нанесены на гладкую, фольгированную, твердую поверхность путем капельного нанесения для дальнейшего высыхания на воздухе. После высыхания для каждого продукта были выбраны 3 точки фокусировки, откуда были собраны рамановские спектры. Окончательный спектр получен путем усреднения трех регистрируемых спектров. Все данные были собраны в одних и тех же условиях.
Статистический анализ / Statistical analysis
Пиковые значения рамановских спектров были оцифрованы и введены в таблицу типа «объект-признак» в среде программного пакета Statistica 10 (StatSoft Inc., СШA) [15] в виде «профилей описания» спектрограмм (длина волны в нм – амплитуда в относительных единицах) для всех женщин. При этом в такой профиль были включены только те пики, для которых по литературным данным [16–21] было известно, что они соответствуют определенным веществам: 491 нм, 596 нм, 632 нм, 725 нм, 808 нм, 886 нм, 1004 нм, 1055 нм, 1132 нм, 1202 нм, 1328 нм, 1440 нм, 1567 нм и 1655 нм. Далее в каждой группе массивы данных по каждому пику спектрограммы при помощи критерия Колмогорова–Смирнова были проверены на «нормальность». Поскольку ни в одном случае их нельзя было рассматривать в качестве модификации «нормального распределения», при формировании групповых профилей спектрограмм вместо усреднения использовался расчет медиан, квартилей [Q25; Q75] и границ вариации (Мin–Мax). Для наглядности медианные значения были соединены линией, полученной путем сплайн-экстраполяции в графическом редакторе Statistica 10. Полученные данные и обследования вносились в специально сформированную карту и в электронные таблицы Statistica 10. Статистический анализ данных также проводили с помощью программного обеспечения Statistica 10. Для оценки значимости межгрупповых различий использовали тест Манна–Уитни. Различия считали статистически значимыми при р < 0,05. Расчет рангового коэффициента осуществляли методом корреляции Кендала [22].
Результаты и обсуждение / Results and Discussion
Сравнение паттернов рамановских спектров образцов плазмы беременных основной и контрольной групп приведено на рисунке 1. Как видно, в обеих группах наиболее представительными по степени выраженности являются пики, соответствующие L-аргинину (491 нм), L-тирозину (632 нм) и D-маннозе (1132 нм). При этом практически по всем пикам границы вариации амплитуд не пересекаются, т. е. межгрупповые различия являются значимыми и без проверки специальными критериями. Почти совпадающие значения имели место только для длин волн 1567 нм (валин) и 1655 нм (тимин), однако проверка по критерию Манна–Уитни показала, что и в этих двух случаях различия оказались хотя и малосущественными, но значимыми (Z = 7,2 и Z = 6,1; p < 0,0001).
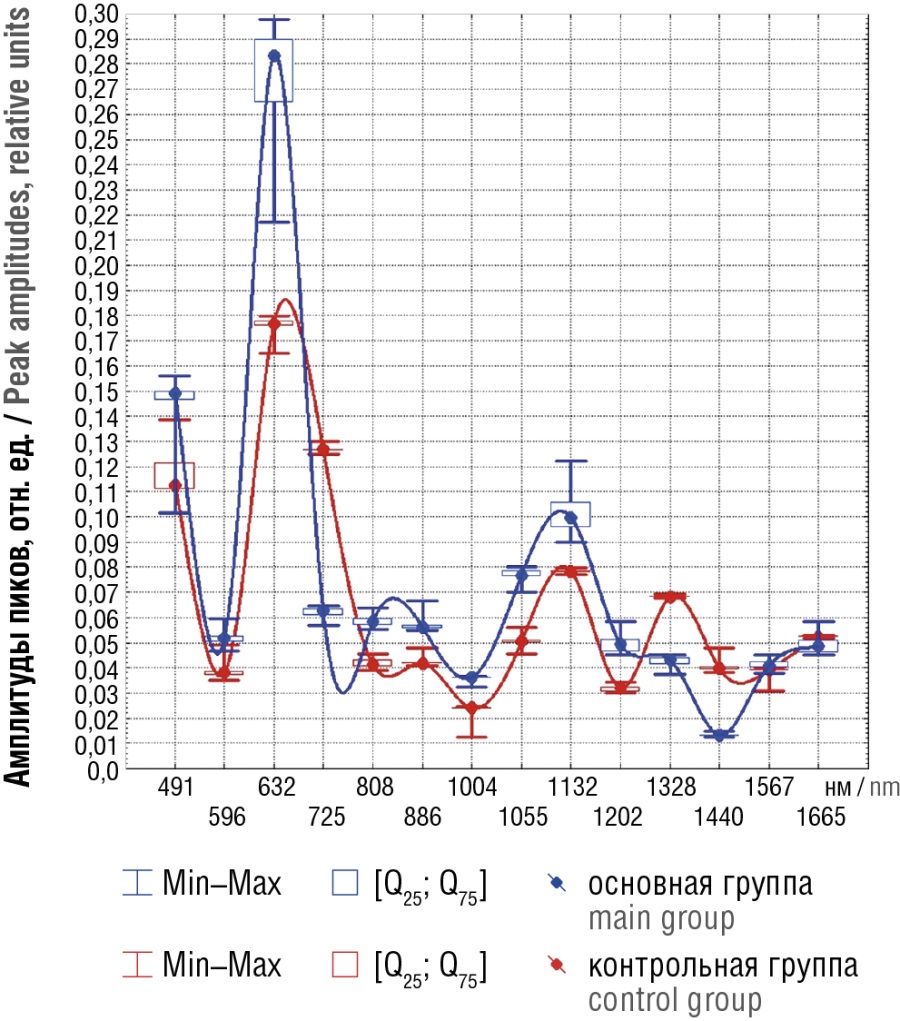
Рисунок 1. Медианные значения спектров поверхностно-усиленного рамановского рассеяния плазмы крови беременных с доброкачественными образованиями яичников (основная группа) и беременных с нормально протекающей беременностью (контрольная группа).
Figure 1. Median magnitude of blood plasma surface-enhanced Raman scattering spectra in pregnant women with benign ovarian formations (main group) and pregnant women with normal pregnancy (control group).
Для удобства сравнительного анализа различия по всем пикам сведены в таблицу 1, где знаком «+» отмечены случаи, когда интенсивность пика, соответствующего данному веществу, в одной группе значимо выше, чем в другой. Хорошо видно, что в основной группе с новообразованиями яичников содержание L-аргинина, фосфатидилинозитола, L-тирозина, глутамата, D-галактозамина, фенилаланина и D-маннозы выше, чем в контрольной группе, причем для L-тирозина это превышение очень рельефное и в относительном и абсолютном смысле. В контрольной группе значимо больше присутствие аденина, триптофана, коллагена, валина и тимина, причем для аденина это превышение также носит достаточно резкий характер.
Таблица 1. Схематическое отображение различий пиковых значений рамановского спектра в группах.
Table 1. Schematic representation of inter-group differences in Raman peak magnitude.
|
Вещество Substance |
Пиковое положение, нм Peak position, nm |
Основная группа Main group |
Контрольная группа Control group |
|
L-аргинин / L-arginine |
491 |
+ |
|
|
Фосфатидилинозитол / Phosphatidylinositol |
596 |
+ |
|
|
L-тирозин / L-tyrosine |
632 |
+ |
|
|
Аденин, коэнзим А / Adenine, coenzyme A |
725 |
+ |
|
|
Глутамат / Glutamate |
808 |
+ |
|
|
Сахарид, глутатион, D-галактозамин / Saccharide, glutathione, D-galactosamine |
886 |
+ |
|
|
Фенилаланин, пик 1 / Phenylalanine, peak 1 |
1004 |
+ |
|
|
Липиды / Lipids |
1055 |
+ |
|
|
D-манноза / D-mannose |
1132 |
+ |
|
|
Фенилаланин, пик 2 / Phenylalanine, peak 2 |
1202 |
+ |
|
|
Триптофан / Tryptophan |
1328 |
+ |
|
|
Коллаген / Collagen |
1440 |
+ |
|
|
Валин / Valin |
1567 |
+ |
|
|
Тимин / Timin |
1655 |
+ |
Такое же сравнение было произведено для группы женщин до и после удаления ОЯ (рис. 2). Как можно видеть, между состояниями «до» и «после» удаления ОЯ различия интенсивности пиковых значений в принципе аналогичны тем, что имели место при сравнении основной и контрольной групп. После удаления ОЯ пиковые значения спектра оказались значимо и существенно ниже для L-аргинина (491 нм), фосфатидилинозитола (596 нм), L-тирозина (632 нм), глутамата (808 нм), D-галактозамина (886 нм) и D-маннозы (1132 нм), а для аденина (725 нм) и коллагена (1440 нм) выше, чем до удаления. Следовательно, имело место практически такое же соотношение, как между основной и контрольной группами.
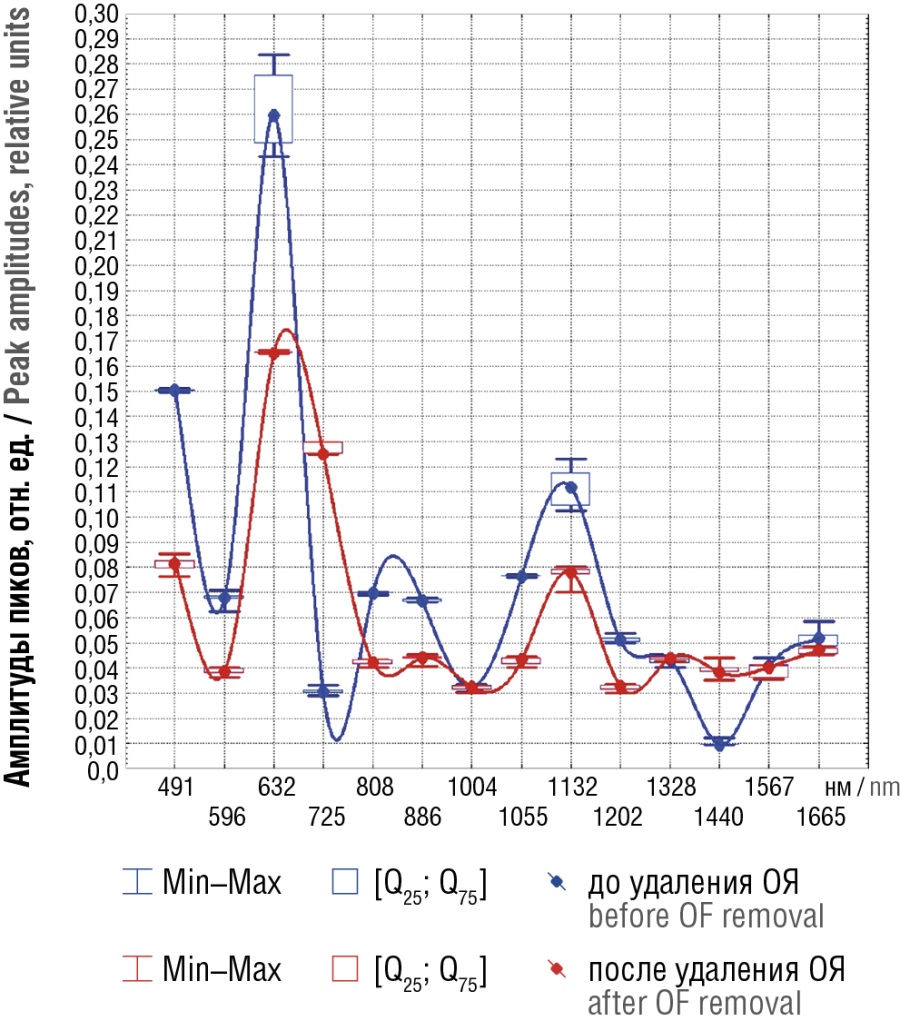
Рисунок 2. Медианные значения спектров поверхностно-усиленного рамановского рассеяния плазмы крови беременных до и после удаления доброкачественных образований яичников (ОЯ).
Figure 2. Median magnitude of blood plasma surface-enhanced Raman scattering spectra in pregnant women before and after benign ovarian formations (OF) removal.
В этой связи мы решили сравнить спектральные паттерны в группе после удаления ОЯ и в контрольной группе (рис. 3). Как видно, паттерны спектров этих групп практически совпадают, хотя в контрольной группе имело место существенное превышение по L-аргинину (491 нм) и триптофану (1328 нм). Расчет рангового коэффициента корреляции Кендала [22], не требующего допущения о «нормальности» сравниваемых числовых рядов, показал, что по профилю и величине пиковых значений эти паттерны практически идентичны (τ = 0,91; p < 0,0001).
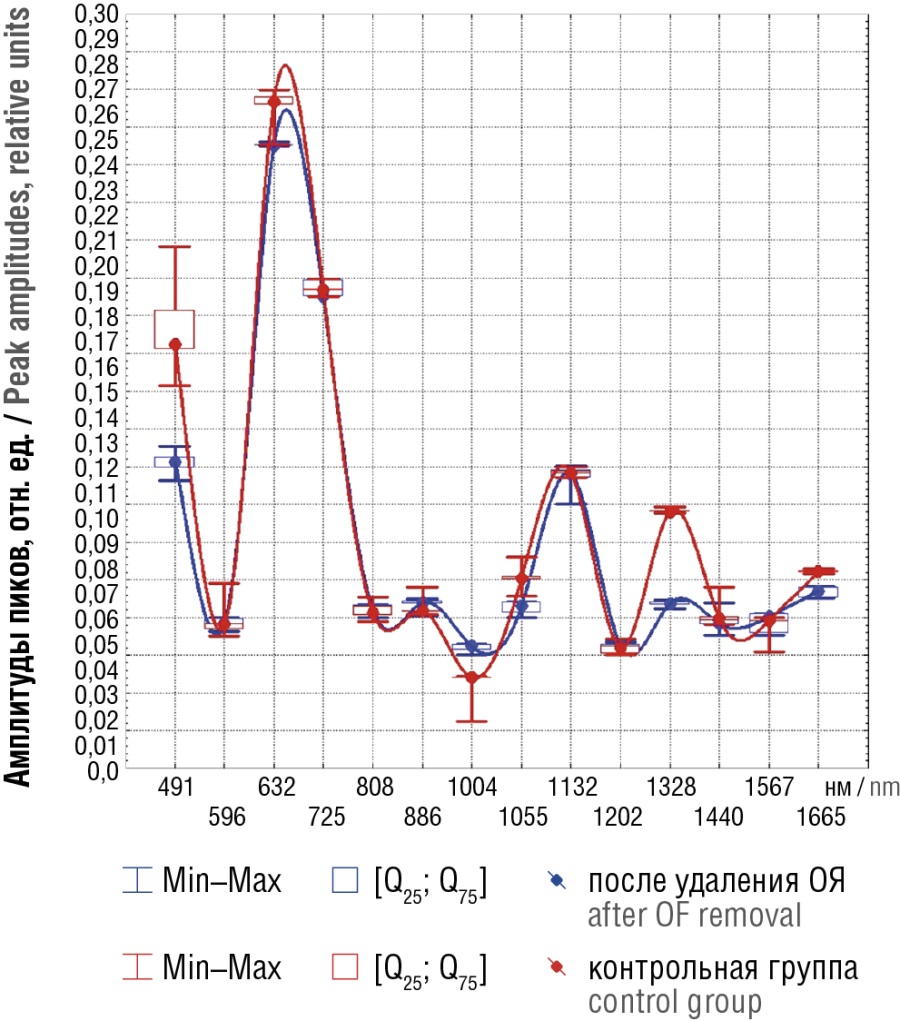
Рисунок 3. Медианные значения спектров поверхностно-усиленного рамановского рассеяния плазмы крови беременных после удаления доброкачественных образований яичников (ОЯ) и в контрольной группе.
Figure 3. Median magnitude of blood plasma surface-enhanced Raman scattering spectra in pregnant women after benign ovarian formations (OF) removal and in control group.
Различия между спектральными паттернами до удаления ОЯ и контрольной группой (рис. 4) оказались фактически такими же, что и между основной и контрольной группами. Соответственно, корреляция паттерна пиковых значений спектров, полученных до удаления ОЯ и в контрольной группе, кратно слабее и незначима (τ = 0,36; p > 0,07), причем столь же слабая корреляция (τ = 0,36) имела место между паттернами, полученными до и после удаления ОЯ. Отметим также, что корреляция паттерна пиковых значений спектров основной и контрольной групп также существенно слабее, чем между состоянием после удаления ОЯ и контрольной группой (τ = 0,56; p < 0,006 против τ = 0,91; p < 0,0001). Напротив, корреляция паттернов спектров до удаления ОЯ и в основной группе оказалась очень тесной (τ = 0,80; p < 0,0001), т. е. это идентичные по проявлениям спектра состояния. Это позволяет предположить, что удаление ОЯ приводит к восстановлению картины рамановского спектра до вида и уровня, характерного для женщин с нормально протекающей беременностью.
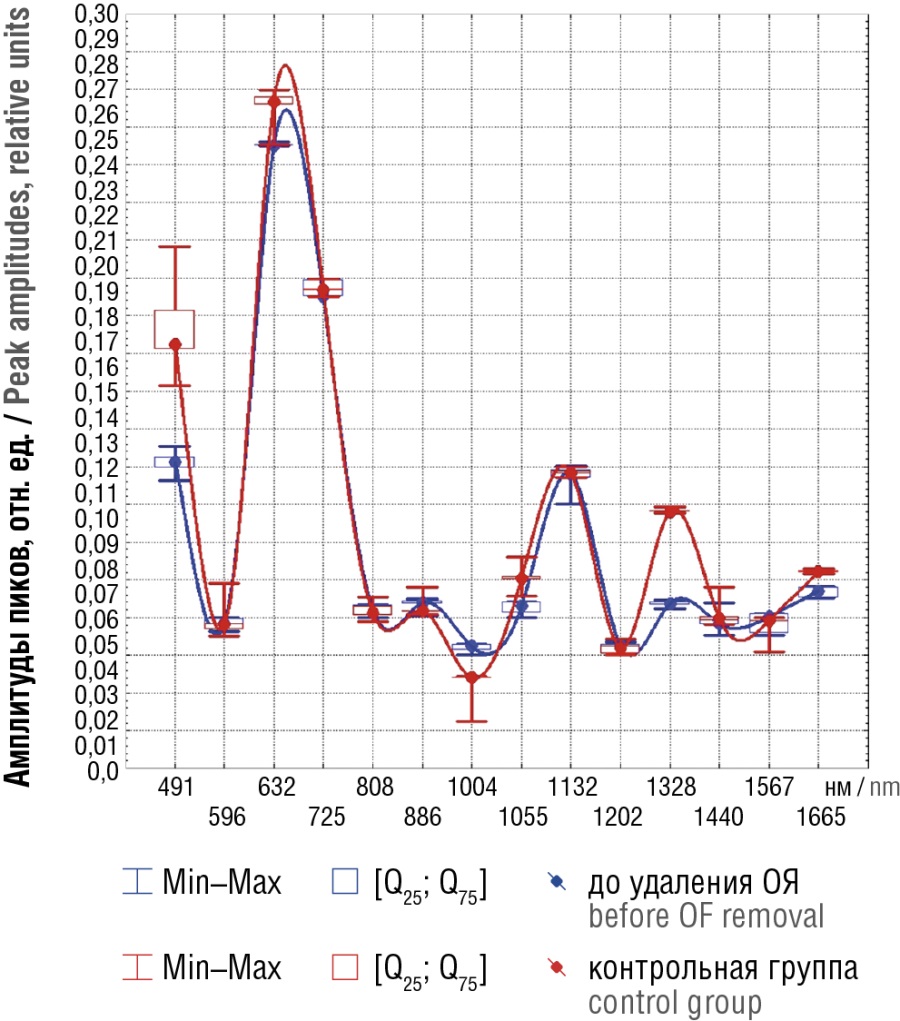
Рисунок 4. Медианные значения спектров поверхностно-усиленного рамановского рассеяния плазмы крови беременных до удаления доброкачественных образований яичников (ОЯ) и в контрольной группе.
Figure 4. Median magnitude of blood plasma surface-enhanced Raman scattering spectra in pregnant women before benign ovarian formations (OF) removal and in control group.
Сравнение спектров плазмы основной группы по отношению к контрольной выявило значительные различия в спектральных интенсивностях. По полученным результатам можно сделать вывод, что небольшое отличие пика одного спектра от другого значительно влияет на состав и концентрацию различных компонентов в жидкостях, что в свою очередь позволяет определить принадлежность плазмы к одной из групп. Повышенный сигнал в пиках 725 нм (δ(C–H)–аденин, коэнзим А), 1328 нм (триптофан), 1567 нм (валин) и 1655 нм (тимин) у контрольной группы по сравнению с основной группой указывает на относительно сниженное количество оснований нуклеиновых кислот в плазме у беременных с ОЯ.
В основной группе наиболее представительными по степени выраженности были пики, соответствующие L-аргинину (491 нм), фосфатидилинозитолу (596 нм), L-тирозину (632 нм), глутамату, D-галактозамину, фенилаланину и D-маннозе, это объясняет повышенное содержание аминокислот и сахаридов у женщин с ОЯ, что связано с аномальным метаболизмом [23] и свидетельствует о специальных биохимических изменениях количества или структуры образцов плазмы. Имеет смысл отметить, что пик D-маннозы (1132 нм) в основной группе имеет более высокую интенсивность из-за нарушения процесса гликолиза и окисления пировиноградной кислоты (цикл Кребса) [24]. Показательно, что исследователи отмечают более низкое содержание коллагена в группе женщин, которые имеют ОЯ, по сравнению с контрольной группой, что объясняется истощением резерва цитоплазматического муцина и повышенной концентрацией матриксных металлопротеиназ (англ. matrix metalloproteinases, ММРs) ММР-1, ММР-8, ММР-13, которые участвуют в расщеплении коллагена [23]. Стоить также отметить, что по нашим результатам гистологического исследования, ОЯ были представлены муцинозной цистоаденомой, серозной и эндометриоидной кистами, кистой желтого тела, т. е. носили доброкачественный характер. В мировой и отечественной литературе встречаются работы, в результате которых было установлено, что рамановские спектры новообразований яичников указывают на большее содержание в исследуемой плазме белков и более низкое содержание ДНК и липидов [24], а большинство исследований направлено на выявление злокачественных образований [25]. В нашей работе мы показали диагностическую ценность метода SERS и возможность его использования во время беременности. Тем не менее для получения более точных и прогностически значимых результатов требуется дальнейшее исследование в данной области.
Заключение / Conclusion
Различия в интенсивности пиков у беременных с ОЯ и без патологии отражают серьезные различия в составе и концентрации различных компонентов в тканевых жидкостях, что в свою очередь потенциально позволяет определить принадлежность плазмы к одной из этих групп. Выявлены изменения в биохимическом составе плазмы крови у беременных с доброкачественными ОЯ в виде наличия повышенной интенсивности в 6 пиках и восстановление картины рамановского спектра до характерного для женщин с нормально протекающей беременностью после удаления ОЯ. Данный метод исследования может быть использован в качестве дополнительного диагностического критерия для неинвазивной диагностики ОЯ у беременных.
Список литературы
1. Адамян Л.В., Попов А.А., Козаченко А.В. Беременность и доброкачественные опухоли яичников. Акушерство и гинекология: новости, мнения, обучение. 2015;1(4):58–62.
2. Cathcart A.M., Nezhat F.R., Emerson J. et al. Adnexal masses during pregnancy: diagnosis, treatment, and prognosis. Am J Obstet Gynecol. 2023;228(6):601–12. https://doi.org/10.1016/j.ajog.2022.11.1291.
3. Oprescu N., Ionescu C., Dragan I. et al. Adnexal masses in pregnancy: perinatal impact. Rom J Morphol Embryol. 2018;59(1):153–8.
4. Vara J., Manzour N., Chacón E. et al. Ovarian Adnexal Reporting Data System (O-RADS) for classifying adnexal masses: a systematic review and meta-analysis. Cancers. 2022;14(13):3151. https://doi.org/10.3390/cancers14133151.
5. Мартынов C.A. Хирургическая тактика при лечении беременных с опухолевидными образованиями и опухолями яичников: Автореф. дис… докт. мед. наук. М., 2015. 35 с.
6. Recent advances in diagnosis and management of ovarian cancer – First Edition. Eds. S.E. Jensen, S.A. Farghaly. USA: Springer, 2014. 20 p.
7. Peccatori F.A., Azim H.A, Orecchia R. et al. Cancer, pregnancy and fertility: ESMO Clinical Practice Guidelines for diagnosis, treatment and follow-up. Ann Oncol. 2013;24 Suppl 6:vi160–70. https://doi.org/10.1093/annonc/mdt199.
8. Pearl J.P, Price R.R., Tonkin A.E. et al. SAGES guidelines for the use of laparoscopy during pregnancy. Surg Endosc. 2017;31(10):3767–82. https://doi.org/10.1007/s00464-017-5637-3.
9. Rocha R.M., Barcelos I.D.E.S. Practical recommendations for the management of benign adnexal masses. Rev Bras Ginecol Obstet. 2020;42(9):569–76. https://doi.org/10.1055/s-0040-1714049.
10. Тихонова В.В., Саушкин А.С. Обзор возможностей применения Рамановской спектроскопии в процессно-аналитической технологии (РАТ). Вопросы биологической, медицинской и фармацевтической химии. 2020;(10):35–9. https://doi.org/10.29296/25877313-2020-10-05.
11. Александров М.Т., Зуев В.М., Кукушкин В.В. и др. Исследование спектральных характеристик органов малого таза у женщин и их клиническое значение. Онкогинекология. 2013;(3):61–7.
12. Приказ Минздрава России от 20.10.2020 N 1130н «Об утверждении Порядка оказания медицинской помощи по профилю "акушерство и гинекология"». М.: Министерство здравоохранения Российской Федерации, 2020. 829 с. Режим доступа: https://helper.gosuslugi.ru/netcat_files/8/9/prikaz_20102020_1130_akusherstvo.pdf. [Дата обращения: 25.03.2024].
13. Bonifacio A., Cervo S., Sergo V. Label-free surface-enhanced Raman spectroscopy of biofluids: fundamental aspects and diagnostic applications. Anal Bioanal Chem. 2015;407(27):8265–77. https://doi.org/10.1007/s00216-015-8697-z.
14. Зуев В.М., Лысцев Д.В., Артемьев Д.Н. и др. Оценка результатов поверхностно-усиленной рамановской спектроскопии у женщин с доброкачественными и злокачественными заболеваниями эндометрия. Архив акушерства и гинекологии имени В.Ф. Снегирева. 2023;10(4):299–310. https://doi.org/10.17816/2313-8726-2023-10-4-299-310.
15. Боев В.М., Борщук Е.Л., Екимов А.К., Бегун Д.Н. Руководство по обеспечению решения медико-биологических задач с применением программы Statistica 10. Оренбург: ОАО «ИПК «Южный Урал», 2014. 208 c.
16. Rubina S., Krishna C.M. Raman spectroscopy in cervical cancers: an update. J Cancer Res Ther. 2015;11(1):10–7. https://doi.org/10.4103/0973-1482.154065.
17. Parlatan U., Inanc M.T., Ozgor B. Yu. et al. Raman spectroscopy as a non-invasive diagnostic technique for endometriosis. Sci Rep. 2019;9(1):19795. https://doi.org/10.1038/s41598-019-56308-y.
18. Barnas E., Skret-Magierlo J., Skret A. et al. Simultaneous FTIR and Raman spectroscopy in endometrial atypical hyperplasia and cancer. Int J Mol Sci. 2020;21(14):4828. https://doi.org/10.3390/ijms21144828.
19. Feng S., Wang W., Tai I.T. et al. Label-free surface-enhanced Raman spectroscopy for detection of colorectal cancer and precursor lesions using blood plasma. Biomed Opt Express. 2015;6(9):3494–502. https://doi.org/10.1364/BOE.6.003494.
20. Song H., Peng J.-S., Dong-Sheng Y. et al. Serum metabolic profiling of human gastric cancer based on gas chromatography/mass spectrometry. Braz J Med Biol Res. 2012;45(1):78–85. https://doi.org/10.1590/S0100-879X2011007500158.
21. Atkins C.G., Buckley K., Blades M.W., Turner R.F.B. Raman spectroscopy of blood and blood components. Appl Spectrosc. 2017;71(5):767–93. https://doi.org/10.1177/0003702816686593.
22. Кендэл М. Ранговые корреляции. М.: Статистика, 1975. 214 c.
23. Lin D., Feng S., Pan J. et al. Colorectal cancer detection by gold nanoparticle based surface-enhanced Raman spectroscopy of blood serum and statistical analysis. OptЕxpress. 2011;19(14):13565–77. https://doi.org/10.1364/OE.19.013565.
24. Krishna C.M., Sockalingum G.D., Bhat R.A. et al. FTIR and Raman microspectroscopy of normal, benign, and malignant formalin-fixed ovarian tissues. Anal Bioanal Chem. 2007;387(5):1649–56. https://doi.org/10.1007/s00216-006-0827-1.
25. Paraskevaidi M., Ashton K.M., Stringfellow H.F. et al. Raman spectroscopic techniques to detect ovarian cancer biomarkers in blood plasma. Talanta. 2018;189:281–8. https://doi.org/10.1016/j.talanta.2018.06.084.
Об авторах
Д. А. ФаткуллинаРоссия
Фаткуллина Динара Акрамджановна
450008 Уфа, ул. Ленина, д. 3
И. И. Мусин
Россия
Мусин Ильнур Ирекович, д.м.н.
450008 Уфа, ул. Ленина, д. 3
А. Г. Ящук
Россия
Ящук Альфия Галимовна, д.м.н., проф.
450008 Уфа, ул. Ленина, д. 3
Е. М. Гареев
Россия
Гареев Евгений Мусинович, к.б.н.
450008 Уфа, ул. Ленина, д. 3
Что уже известно об этой теме?
► Метод, основанный на изучении рассеянного света и взаимодействия его с веществом, создает особенный «биохимический отпечаток».
► Метод поверхностно-усиленной рамановской спектроскопии (SERS) применяется не только в медицине, но и в других областях, таких как биология, фармация, криминалистика и др.
Что нового дает статья?
► Представлен неинвазивный метод диагностики доброкачественных образований яичников (ОЯ) у беременных.
Как это может повлиять на клиническую практику в обозримом будущем?
► Метод SERS можно рассматривать как потенциальный метод исследования у беременных с новообразованиями яичников.
► Данный метод снизит частоту гипердиагностики ОЯ, а также поможет принять правильное решения в вопросе об удалении ОЯ во время беременности.
Рецензия
Для цитирования:
Фаткуллина Д.А., Мусин И.И., Ящук А.Г., Гареев Е.М. Поверхностно-усиленная рамановская спектроскопия как метод диагностики доброкачественных образований яичников у беременных. Акушерство, Гинекология и Репродукция. 2025;19(1):59-67. https://doi.org/10.17749/2313-7347/ob.gyn.rep.2025.516
For citation:
Fatkullina D.A., Musin I.I., Yashchuk A.G., Gareev E.M. Surface-enhanced Raman spectroscopy as a method for diagnosing benign ovarian formations in pregnant women. Obstetrics, Gynecology and Reproduction. 2025;19(1):59-67. (In Russ.) https://doi.org/10.17749/2313-7347/ob.gyn.rep.2025.516

Контент доступен под лицензией Creative Commons Attribution-NonCommercial-ShareAlike 4.0 International License.











































