Перейти к:
Рак молочной железы, ассоциированный с беременностью: особенности течения, диагностики и лечения
https://doi.org/10.17749/2313-7347/ob.gyn.rep.2024.563
Аннотация
Ассоциированный с беременностью рак молочной железы (РМЖ) – редкая патология в практике акушера-гинеколога и онколога, диагностика которой сопряжена с определенными трудностями. Совместные усилия специалистов по решению данной проблемы с учетом современных возможностей в диагностике и лечении призваны достичь положительного результата. Представленный клинический случай инвазивного гормонозависимого РМЖ T4bN3aM0, IIIC, ассоциированного с беременностью, – демонстрация типичного сценария течения заболевания: манифестация опухоли во II триместре, маститоподобная форма, поздняя диагностика. Причиной последней является низкая онкологическая настороженность в отношении беременных в возрасте до 40 лет, что обусловлено редкостью данной патологии. Правильный выбор алгоритма лекарственной терапии, согласно установленному гистологическому варианту и иммуногистохимическому статусу опухоли в комбинации с оперативным лечением, позволили не только добиться регрессии опухоли, родить здорового доношенного ребенка, но дали шанс на выживаемость, несмотря на позднее начало лечения. Во избежание запущенных случаев заболевания целесообразно рекомендовать проведение ультразвукового исследования молочных желез в I триместре у беременных старше 35 лет.
Для цитирования:
Салов И.А., Басова Т.А., Михайлова Ю.В., Фролова Я.И. Рак молочной железы, ассоциированный с беременностью: особенности течения, диагностики и лечения. Акушерство, Гинекология и Репродукция. 2024;18(5):754–760. https://doi.org/10.17749/2313-7347/ob.gyn.rep.2024.563
For citation:
Salov I.A., Basova T.A., Mikhailova Yu.V., Frolova I.I. Pregnancy-associated breast cancer: course, diagnosis and treatment. Obstetrics, Gynecology and Reproduction. 2024;18(5):754–760. (In Russ.) https://doi.org/10.17749/2313-7347/ob.gyn.rep.2024.563
Введение / Introduction
Рак молочной железы (РМЖ), ассоциированный с беременностью, развивается во время беременности, на фоне лактации или в течение последующего года после родов, составляя 0,2–2,6 % всех случаев РМЖ [1]. Средний возраст на момент постановки диагноза составляет 33 (24–43) года, срок гестации – 21–24 недели [2–4]. При оценке потенциальных факторов риска РМЖ среди беременных, связь заболевания с отягощенным семейным онкоанамнезом (РМЖ у родственниц 1–2 линии родства) отмечена только в 12 % случаев, с хронической никотиновой зависимостью – в 8 % [4]. Связь с количеством беременностей в анамнезе, нарушениями менструальной функции, производственными профвредностями не установлена [4].
Среди клинических форм наиболее часто наблюдается инвазивно протоковый рак (75–90 %), реже встречаются инфильтрирующий дольковый (14 %), слизистый (6 %) раки, маститоподобная форма (2–4% случаев) [2][4]. Поражаются преимущественно (70 %) верхненаружные части молочной железы [4]. Преобладание среди беременных агрессивных форм РМЖ объяснено преимущественно низкой дифференцировкой опухоли (74 %) и быстрой инвазией лимфатических сосудов (88 %) [2]. В большинстве случаев (84 %) опухоль выявляется пациенткой самостоятельно, реже (в 16 %) заболевание подозревается при выполнении ультразвукового исследования (УЗИ) молочных желез [4]. Нечеткое начало заболевания, завуалированное физиологической гиперплазией желез под действием повышенной секреции эстрогенов и прогестинов, низкая онконастороженность со стороны беременной и врача (пик заболеваемостью РМЖ приходится на 50 лет [2]), позднее обращение и неоднозначность трактовки результатов физикального осмотра и инструментального исследований, ограниченность диагностических возможностей приводят к тому, что данный вид рака выявляется, как правило, уже в крайне запущенных стадиях, когда к моменту установления диагноза метастазы в регионарные лимфатические узлы обнаруживаются у 72–85% больных, а отдаленные метастазы – у 22,6% [1][2]. Запоздалая диагностика также обусловлена психологической неготовностью пациентки к принятию такого грозного диагноза ввиду доминанты беременности. В результате, поздняя диагностика отдаляет начало лечения на несколько месяцев, но адекватное ее проведение обеспечивает процент 5-летней выживаемости, сопоставимый со своевременным началом лечения у пациенток с РМЖ без беременности [1].
Ранее искусственный аборт считался единственным вариантом лечения РМЖ, выявленного при беременности, так как агрессивный рост опухоли связывали с гормональной перестройкой женского организма и иммуносупрессией. Однако рядом исследователей доказано, что прерывание беременности у женщины с РМЖ не является эффективной стратегией в борьбе с раком и не улучшает показатели выживаемости [1][2], а лишь усугубляет психологическую травму больной, приводя к общей дезадаптации. Так, накопленный опыт по ведению пациенток с данным видом рака, алгоритмы диагностических мероприятий и схем лечения, допустимых при беременности, подробно изложены в ряде регламентирующих документов [1][5–9], которые активно используются в онкологической практике.
Выявление РМЖ в I триместре беременности дает право женщине на ее прерывание по желанию, так как РМЖ не входит в перечень противопоказаний для пролонгирования беременности [10]. При желании сохранения беременности пациентка направляется в онкологическое учреждение с опытом лечения данной категории больных. Выбор тактики подлежит обсуждению на консилиуме врачей совместно с акушерами-гинекологами [5]. Выбор стратегии лечения зависит от срока гестации, акушерской ситуации, патоморфологической стадии заболевания и иммуногистохимических (ИГХ) характеристик опухоли, необходимости достичь максимального положительного противоопухолевого эффекта и минимизировать риск осложнений у плода на фоне проводимой лекарственной терапии [1][2][5].
При подозрении на РМЖ после проведения УЗИ молочных желез и регионарных лимфоузлов онкологом выполняется УЗИ-биопсия – тонкоигольная аспирационная биопсия (ТАБ) и трепанобиопсия (ТБ). Последующие патоморфологическое и ИГХ исследования позволяют определить биологические свойства опухоли: уровень экспрессии рецепторов эстрогена (estrogen receptors, ER) и прогестерона (progesterone receptors, PR), эпидермального фактора роста 2-го типа (англ. human epidermal growth factor receptor 2, HER2) и маркера пролиферации Ki-67. Нужно учитывать, что ТАБ по сравнению с ТБ может при беременности дать ложноположительный результат в 1,6% случаев, поэтому для окончательной гистологической верификации раковой опухоли наиболее значимой является ТБ. Балльная оценка процентного содержания ER и PR (от 0 до 5 баллов) и интенсивности окрашивания (от 0 до 3 баллов) антителами клеток по шкале Allred позволяет установить рецепторный статус опухоли. Так, позитивность опухоли определяется суммой двух показателей: 0–2 балла – негативная, 3–8 баллов – позитивная. Опухоли с позитивным рецепторным статусом (ER+ и PR+) чувствительны к гормональной терапии. Удельный вес таких беременных пациенток составляет 40,5–58,0 % [1][2]. Известно, что опухоли из наименее зрелых и дифференцированных клеток обладают наибольшей пролиферативной активностью, поэтому обнаружение HER2 и Ki-67 в биоптате (маркеров данного признака опухоли) позволяет выстроить прогноз и предопределить лечебную тактику. Критерием низкого уровня пролиферативной активности опухоли принят порог обнаружения Ki-67 менее 15 %, среднего уровня – 16–30 % и высокого – более 30 %. Повышенная выработка в опухоли HER2 совместно с естественным фактором роста инициирует в опухолевой клетке митотический процесс, поэтому пациенткам с HER2+ статусом опухоли показано назначение (после родов) таргентных лекарственных препаратов – моноклональных антител к HER2, блокирующих выработку данного белка.
У некоторых пациенток с РМЖ (возраст ≤ 45 лет, отягощенный семейный онкоанамнез и др.) с целью прогноза и выбора тактики лечения целесообразно определение в лимфоцитах крови мутации в генах BRCA1/2 (англ. Breast cancer) [5]. Доля таких мутаций среди пациенток с РМЖ по разным данным может достигать 10,0 %, среди беременных пациенток – 17,5 % [1].
Проведение маммографии при беременности ввиду общей высокой рентгеновской плотности ткани молочной железы часто затрудняет интерпретацию результатов (15,3 %) и может дать ложноотрицательный результат в 11,6 % случаев. Компьютерную и магнитно-резонансную томографию рекомендуется проводить после родов ввиду тератогенных рисков. Для оценки метастазирования опухоли показано проведение УЗИ органов малого таза, брюшной полости и забрюшинного пространства, а также рентгенография грудной клетки с абдоминальной защитой.
Основным методом лечения РМЖ у беременных на ранних стадиях (I, IIA, IIB) является модифицированная радикальная мастэктомия или секторальная резекция в I или II тримеcтре с последующей адъювантной химиотерапией (АХТ) во II триместре и адъювантной лучевой и гормонотерапией после родоразрешения. Воспалительно-инфильтративная форма рака или III–IV стадия заболевания, выявленные во II–III тримеcтрах, являются показанием к проведению неоадъювантной химиотерапии (НАХТ) во II–III тримеcтрах с последующей мастэктомией, АХТ и адъювантной лучевой терапией после родоразрешения.
Проведение химиотерапии на сроках менее 13 недель гестации противопоказано в связи с влиянием цитостатиков на органогенез эмбриона (плода) и плацентогенез, выраженными побочными эффектами для пациентки и риском невынашивания. Противопоказаны на любых сроках гестации ввиду высокого тератогенного риска лучевая терапия и гормонотерапия тамоксифеном, широко применяемых в составе комбинированного/комплексного лечения после родоразрешения. Также после родов у пациенток с HER2+ статусом РМЖ проводится адъювантная таргентная (молекулярно-нацеленная или анти-HER2) терапия на основе трастузумаба, представляющего собой рекомбинантные ДНК-производные гуманизированные моноклональные антитела, которые избирательно взаимодействуют с внеклеточным доменом рецептора HER2, блокируя молекулы, участвующие в процессе канцерогенеза, прогрессирования и метастазирования опухоли. Сочетание адъювантной анти-HER2-терапии и адъювантной гормонотерапии в послеродовом периоде в значительной степени повышает безрецидивную выживаемость больных [1].
Клиническое наблюдение / Clinical case
Представляем клинический случай РМЖ, ассоциированный с беременностью, у пациентки О., 37 лет. Пациентка дала добровольное информированное согласие на представление фото, персональной медицинской информации в обезличенном варианте.
Повторнобеременная встала на учет по беременности в апреле 2022 г. в женскую консультацию ГУЗ Саратовская ГКБ № 1 на сроке 12 недель. Предстояли вторые роды. В 2018 г.: своевременные роды путем операции кесарева сечения в плановом порядке по поводу офтальмопатологии – врожденное недоразвитие зрительного анализатора, нистагм, вторичная катаракта (замена обоих хрусталиков в 1994 г.), атрофия зрительного нерва обоих глаз. Вредных привычек, профвредностей не имеет. Семейный анамнез отягощен РМЖ у обеих бабушек по линиям матери и отца. Менструальная функция без особенностей, гинекологический анамнез не отягощен, преимущественный метод контрацепции – барьерный. При первичном общеклиническом обследовании, кроме врожденной офтальмопатологии, каких-либо отклонений выявлено не было.
На сроке 17 недель беременная пожаловалась на возникший в течение нескольких дней очаг уплотнения в левой молочной железе в сочетании с отеком и покраснением кожи. При физикальном осмотре симптомов интоксикации не обнаружено. Правая молочная железа без патологических изменений. Левая молочная железа увеличена в объеме за счет лимфостатического отека, инфильтрата без четких контуров, пальпируемого в верхненаружном квадранте; кожа в проекции инфильтрата гиперемирована; отделяемого из соска нет. С учетом подостро возникшего маститоподобного состояния была назначена антибактериальная терапия, консультации хирурга. Ввиду отсутствия ожидаемого положительного эффекта от проводимой терапии, пациентка с подозрением на злокачественное новообразование была направлена на консультацию к онкологу в ГУЗ «Областной клинический онкодиспансер» (ГУЗ ОКОД, Саратов).
После проведенного комплексного обследования, включая ТАБ опухоли и левого подмышечного лимфоузла, на сроке 19 недель беременности поставлен диагноз: протоковый рак левой молочной железы. По результатам ТБ опухоли и левого подмышечного лимфоузла на сроке 20 недель беременности получено гистологическое заключение: инвазивный рак неспецифического типа G1 молочной железы, ИГХ: ER = 4 балла, PR = 7 баллов, Ki-67 = 15 %. Окончательный диагноз: «Рак левой молочной железы с T4bN3aM0, IIIC, метастазы в левые надключичный и подмышечный лимфоузлы». Для исключения метастазов в ткань легкого произведена рентгенография легких с экранированием живота. Онкоконсилиумом врачей в составе онкологов и акушеров-гинекологов на 21-й неделе гестации по согласованию посредством телемедицинской консультации с сотрудниками отделения противоопухолевой лекарственной терапии ФГБОУ НМИЦ АГП им. акад. В.И. Кулакова Минздрава России (Москва) принято решение о необходимости проведения НАХТ при условии пролонгирования беременности на первом этапе по схеме: 4 однодневных курса НАХТ в режиме АС (Adriamycinum + Cyclophosphamide) – доксорубицин 60 мг/м² + циклофосфамид 600 мг/м², внутривенно, капельно, с интервалом 3 недели; далее 12 еженедельных введений паклитаксела – 80 мг/м² с последующей операцией. НАХТ планировалось проводить до 36 недель беременности с последующим родоразрешением, подавлением лактации, полным обследованием на предмет отдаленного метастазирования и продолжением лечения.
Все 4 курса АС на фоне премедикации и антиэметогенной терапии [7] пациентка провела в условиях отделения противоопухолевой лекарственной терапии ФГБОУ НМИЦ АГП им. акад. В.И. Кулакова согласно установленной схеме в 24, 27, 30 и 34 недели гестации (рис. 1). В условиях Центра параллельно с проведением первого курса химиотерапии у пациентки выполнен анализ на наличие мутаций в генах BRCA1/2 (результат отрицательный), осуществлен пересмотр гистологических материалов с определением статуса HER2/neu для решения вопроса о добавлении анти-HER2-терапии после родоразрешения. Патологогистологический пересмотр биоптата опухоли показал: микроинвазивная неспецифическая карцинома молочной железы, люминальный, В-подобный, HER2/neu-позитивный суррогатный подтип. При анализе ИГХ-реакций: ER (слабая чувствительность) – (40 %) 6 баллов по Allred, PR – (70 %) 7 баллов по Allred, Ki-67 = 20 %. При исследовании экспрессии белка HER2/neu выявлено интенсивное полное мембранное окрашивание в опухолевых клетках более 10 % (3+). Учитывая HER2/neu-позитивный суррогатный молекулярный подтип опухоли, рекомендовано к АХТ после родоразрешения добавить анти-HER2-терапию.
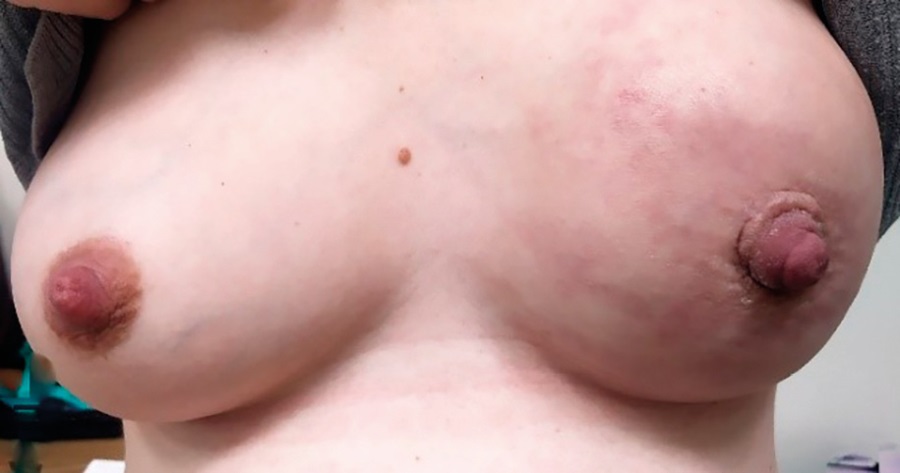
Рисунок 1. Пациентка О. Левая молочная железа на сроке 35 недель беременности после 4 курсов неоадъювантной химиотерапии.
Figure 1. Patient O. Left breast at gestational age of 35 weeks after 4 neoadjuvant chemotherapy courses.
Переносила пациентка лечение удовлетворительно. Динамика опухоли на фоне проводимой терапии положительная. В интервале лечения имели место астения I–II степени, нейтропения II–III степени с быстрым восстановлением крови, анемия легкой степени тяжести. Перед четвертым курсом АС по поводу фебрильной нейтропении (нейтрофилы 0,24×10⁹/л) проведена терапия колониестимулирующим фактором филграстимом [8].
С начала противоопухолевой терапии до родов и в послеродовом периоде проводилась профилактика возможных тромбоэмболических осложнений (риск ВТЭО – 4 балла = 1 балл возраст 37 лет + 3 балла РМЖ) низкомолекулярными гепаринами [10]. Акушерское течение беременности: без особенностей. УЗИ фетоплацентарного комплекса, осуществляемое каждые 2–3 недели на протяжении всей беременности, отклонений не выявило.
В сентябре 2022 г. на сроке 37–38 недель гестации в акушерском отделении Федерального перинатального центра ФГБОУ НМИЦ АГП им. акад. В.И. Кулакова беременная родоразрешена путем операции кесарева сечения в плановом порядке по поводу рубца на матке от 2018 г. и врожденной офтальмопатологии. Родился ребенок мужского пола массой 3200 г и ростом 49 см, 8–9 баллов по шкале Апгар. Данных по алопеции и другим токсическим явлениям, вызываемым химиотерапией, у новорожденного отмечено не было, выписан на 8-е сутки. В дальнейшем физическое развитие ребенка соответствовало возрасту.
После подавления лактации, начиная с 10-х суток после родов, возобновлена НАХТ: доцетаксел – 75 мг/м² + карбоплатин-AUC6 + трастузумаб (первая нагрузочная доза – 8 мг/кг, последующая поддерживающая доза – 6 мг/кг) + пертузумаб (первая нагрузочная доза – 840 мг, затем поддерживающая доза – 420 мг), всего 4 курса с интервалом 21 день, 3 из них проводились в ГУЗ ОКОД (Саратов). С 28-х суток послеродового периода начата овариальная супрессия агонистами гонадотропин-рилизинг-факторов в дозе 3,6 мг 1 раз в 28 дней. Переносимость терапии удовлетворительная. Со стороны опухолевого процесса отмечена положительная динамика (рис. 2).
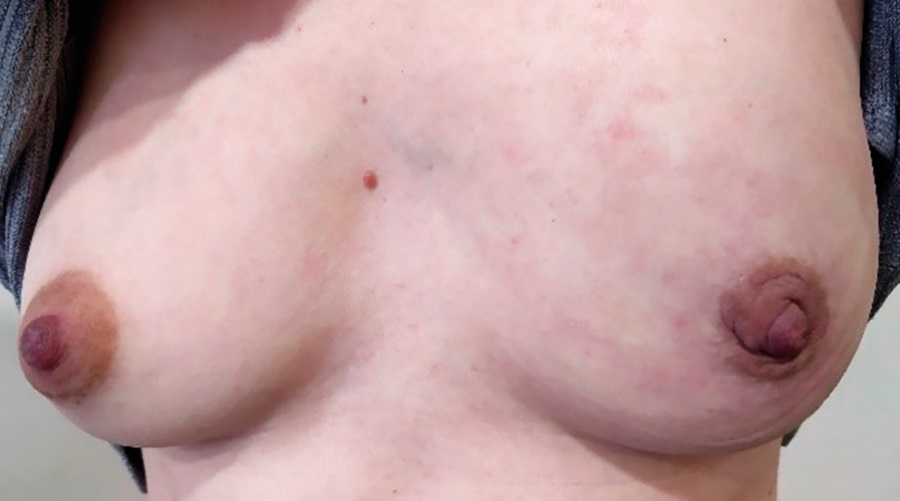
Рисунок 2. Пациентка О. Левая молочная железа после подавления лактации и первого курса неоадъювантной химиотерапии.
Figure 2. Patient O. Left breast after lactation suppression and neoadjuvant chemotherapy course 1.
Спустя 1 месяц от последнего курса химиотерапии (4 месяца после родов) в январе 2023 г. в условиях отделения патологии молочной железы ФГБОУ НМИЦ АГП им. акад. В.И. Кулакова произведена левосторонняя радикальная мастэктомия по Маддену с одномоментной пластикой кожно-мышечным лоскутом в комбинации с эспандером (рис. 3), после удаления которого в дальнейшем планировалось введение силиконового эндопротеза. Но спустя 2 месяца в марте 2023 г. эспандер удален ввиду отторжения. В июне проведена лучевая терапия.
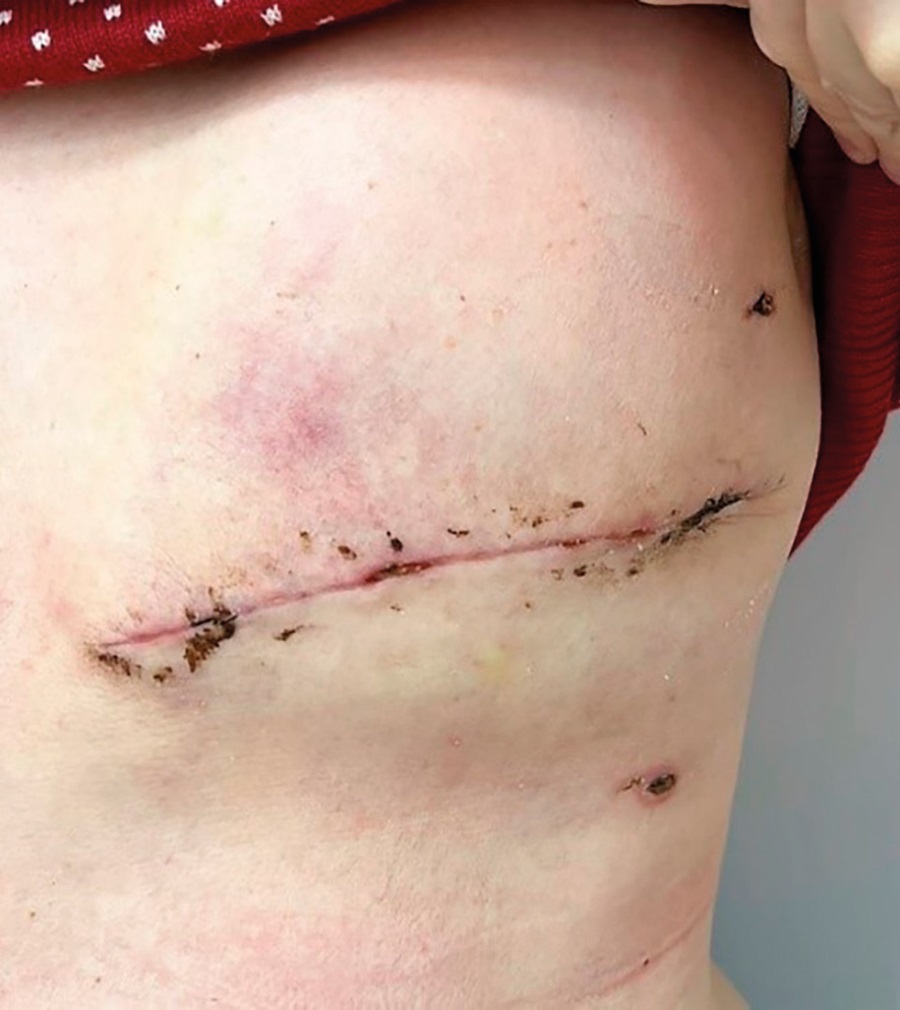
Рисунок 3. Пациентка О. на 21-е сутки после радикальной мастэктомии по Маддену с одномоментной установкой эспандера.
Figure 3. Patient O. Day 21 after Madden radical mastectomy with concomitant expander installation.
На момент публикации статьи на протяжении 2 лет пациентка продолжает ежемесячные инъекции агонистов гонадотропин-рилизинг гормонов в сочетании с антиэстрогенной терапией под наблюдением онколога и акушера-гинеколога по месту жительства. Профилактика остеопороза проводится при помощи препаратов кальция и холекальциферола. Чувствует себя хорошо, активна. Ребенку 2 года, развивается соответственно возрасту.
В дальнейшем с целью раннего выявления рака контралатеральной молочной железы пациентка подлежит диспансерному наблюдению с ежегодным выполнением контралатеральной маммографии в сочетании с УЗИ регионарных зон и области послеоперационного рубца [5][11][12].
Заключение / Conclusion
Представленный клинический случай инвазивного гормонозависимого РМЖ T4bN3aM0, IIIC, ассоциированного с беременностью, – демонстрация типичного сценария течения заболевания: манифестация опухоли во II триместре (20–21 неделя), маститоподобная форма, возраст пациентки 37 лет, поздняя диагностика. Причиной последнего является низкая онкологическая настороженность в отношении беременных в возрасте до 40 лет, что обусловлено редкостью данной патологии – 0,07 % от всех впервые выявленных случаев РМЖ в Саратовской области [13]. Точная верификация гистологического типа опухоли, адекватная НАХТ с 24 недель гестации на фоне профилактики ВТЭО позволили не только добиться регрессии опухоли, но и родить здорового доношенного ребенка. Комбинированная терапия (мастэктомия в сочетании с адъювантной химио-, гормоно- и таргентной терапией) повысили шанс на выживаемость. Учитывая спорадичность и отсутствие объективных маркеров данного вида рака на доклинической стадии во избежание запущенных случаев в виду агрессивного течения заболевания целесообразно рекомендовать проведение УЗИ молочных желез в I триместре беременности у всех пациенток старше 35 лет.
Список литературы
1. Дашян Г.А., Пароконная А.А., Семиглазова Т.Ю. Клинические рекомендации Российского общества онкомаммологов. Рак молочной железы и беременность. М., 2016. Режим доступа: http://www.breastcancersociety.ru/rek/view/173. [Дата обращения: 30.08.2024].
2. Никулина Л.Р., Кузьмичев Д.Е., Скребов Р.В., Чекашина Д.В. Рак молочной железы, ассоциированный с беременностью. Здравоохранение Югры: опыт и инновации. 2016;(3):56–61.
3. Ясенко Д.М., Шелкович С.Е. Рак молочной железы, ассоциированный с беременностью. Инновации в медицине и фармации-2018: сборник материалов дистанционной научно-практической конференции студентов и молодых ученых. Минск, 2018. 531–33.
4. Надвикова А.Д., Важенин А.В., Терешин О.С. и др. Рак молочной железы, ассоциированный с беременностью. Человек. Спорт. Медицина. 2016;16(4):27–31. https://doi.org/10.14529/hsm160403.
5. Клинические рекомендации – Рак молочной железы – 2021-2022-2023 (20.01.2023). М.: Министерство здравоохранения Российской Федерации, 2023. 94 c. Режим доступа: http://disuria.ru/_ld/12/1279_kr21D05C50MZ.pdf. [Дата обращения: 30.08.2024].
6. Тюляндин С.А., Артамонова Е.В., Жукова Л.Г. и др. Практические рекомендации по лекарственному лечению рака молочной железы. Злокачественные опухоли. 2022;12(3S2–1):155–97. https://doi.org/10.18027/2224-5057-2022-12-3s2-155-197.
7. Владимирова Л.Ю., Гладков О.А., Королева И.А. и др. Практические рекомендации по профилактике и лечению тошноты и рвоты у онкологических больных. Злокачественные опухоли. 2021;11(3s2–2):25–38. https://doi.org/10.18027/2224-5057-2021-11-3s2-37.
8. Сакаева Д.Д., Борисов К.Е., Булавина И.С. и др. Практические рекомендации по диагностике и лечению фебрильной нейтропении. Злокачественные опухоли. 2022;12(3s2–2):55–63. https://doi.org/10.18027/2224-5057-2022-12-3s2-55-63.
9. Клинические рекомендации – Венозные осложнения во время беременности и послеродовом периоде. Акушерская тромбоэмболия – 2022-2023-2024 (14.02.2022). М.: Министерство здравоохранения Российской Федерации, 2022. 66 c. Режим доступа: https://phlebology-sro.ru/upload/iblock/72a/vteo-vo-vremya-beremennosti-i-poslerodovom-periode-2022.pdf. [Дата обращения: 30.08.2024].
10. Приказ Минздравсоцразвития РФ от 03.12.2007 N 736 «Об утверждении перечня медицинских показаний для искусственного прерывания беременности». M., 2007. Режим доступа: https://legalacts.ru/doc/prikaz-minzdravsotsrazvitija-rf-ot-03122007-n-736/. [Дата обращения: 30.08.2024].
11. Coates A.S., Winer E.P., Goldhirsch A. et al. Tailoring therapies–improving the management of early breast cancer: St Gallen International Expert Consensus on the Primary Therapy of Early Breast Cancer 2015. Ann Oncol. 2015;26(8):1533–46. https://doi.org/10.1093/annonc/mdv221
12. Gradishar W.J., Anderson B.O., Abraham J. et al. Breast Cancer, Version 3.2020, NCCN Clinical Practice Guidelines in Oncology. J Natl Compr Canc Netw. 2020;18(4):452–78. https://doi.org/10.6004/jnccn.2020.0016.
13. Состояние онкологической помощи населению России в 2022 году. Под ред. А.Д. Каприна, В.В. Старинского, А.О. Шахзадовой. M., 2023. 254 c. Режим доступа: https://oncology-association.ru/wp-content/uploads/2023/08/sop-2022-el.versiya_compressed.pdf. [Дата обращения: 30.08.2024].
Об авторах
И. А. СаловРоссия
Салов Игорь Аркадьевич, д.м.н., проф.
410012 Саратов, ул. Большая Казачья, д. 112
Т. А. Басова
Россия
Басова Татьяна Александровна, к.м.н.
410012 Саратов, ул. Большая Казачья, д. 112
Ю. В. Михайлова
Россия
Михайлова Юлия Владиславовна, к.м.н.
410012 Саратов, ул. Большая Казачья, д. 112
Я. И. Фролова
Россия
Фролова Яна Ильинична
410012 Саратов, ул. Большая Казачья, д. 112
Что уже известно об этой теме?
► Рак молочной железы (РМЖ) у беременных – редкая патология в практике врача акушера-гинеколога и наиболее частая среди онкопатологии у беременных.
► РМЖ не является показанием для прерывания беременности.
► Современные методы терапии позволяют успешно лечить данный вид рака при условии пролонгирования беременности, давая шанс на выживание и радость материнства.
Что нового дает статья?
► Статья призвана привлечь внимание врача акушера-гинеколога, оказывающего первичную медико-санитарную помощь в амбулаторных условиях, к проблеме РМЖ у беременных.
► Клинический случай в очередной раз подтверждает перспективность лечения РМЖ и сохранении беременности.
Как это может повлиять на клиническую практику в обозримом будущем?
► Ознакомление с данным клиническим случаем позволит повысить онконастороженность в отношении беременных в возрасте после 35 лет с наличием факторов риска развития рака – РМЖ у родственниц 1–2 линии родства, поздние роды.
► Обязательный и тщательный осмотр молочных желез у беременных при постановке на учет, проведение ультразвукового исследования в конце I триместра беременности позволят своевременно заподозрить онкозаболевание, правильно составить и осуществить алгоритм лечебно-диагностических мероприятий для достижения благоприятного исхода.
Рецензия
Для цитирования:
Салов И.А., Басова Т.А., Михайлова Ю.В., Фролова Я.И. Рак молочной железы, ассоциированный с беременностью: особенности течения, диагностики и лечения. Акушерство, Гинекология и Репродукция. 2024;18(5):754–760. https://doi.org/10.17749/2313-7347/ob.gyn.rep.2024.563
For citation:
Salov I.A., Basova T.A., Mikhailova Yu.V., Frolova I.I. Pregnancy-associated breast cancer: course, diagnosis and treatment. Obstetrics, Gynecology and Reproduction. 2024;18(5):754–760. (In Russ.) https://doi.org/10.17749/2313-7347/ob.gyn.rep.2024.563

Контент доступен под лицензией Creative Commons Attribution-NonCommercial-ShareAlike 4.0 International License.











































