Перейти к:
Выбор лечебной тактики у пациентки с диагнозом рак молочной железы и новообразованием легкого
https://doi.org/10.17749/2313-7347/ob.gyn.rep.2024.518
Аннотация
Рак молочной железы (РМЖ) длительное время занимает лидирующую позицию в структуре онкологических заболеваний среди женского населения в мире. По данным статистики, метастазирование РМЖ в легочную ткань составляет 21–32 % всех случаев отдаленного метастазирования. Метастазы в легкие, как правило, возникают в течение 5 лет после первоначального диагноза РМЖ, чаще поражая периферические отделы легкого, что объясняет сложность их дифференциальной диагностики. Кроме того, они оказывают значительное влияние на течение заболевания и выживаемость пациентов, в связи с чем каждый случай сочетанной патологии в виде РМЖ и солидного новообразования легкого представляет интерес с точки зрения клинико-патологических особенностей, равно как и диагностического подхода, с последующим выбором тактики хирургического лечения. Очевидно, что лечебная концепция в подобных случаях строится на знании морфологической структуры первичной опухоли и подтверждении метастатического процесса. Однако в случае малого размера легочного очага высказаться о характере процесса затруднительно. Лечебно-диагностическая тактика в подобных случаях в настоящее время подробно не разработана. На клиническом примере сочетания РМЖ и единичного очагового образования легкого малых размеров мы предлагаем эффективную схему диагностики и лечения пациентов в подобных случаях.
Ключевые слова
Для цитирования:
Германович Н.Ю., Пикунов М.Ю., Щеголькова Т.А., Мищенко И.М. Выбор лечебной тактики у пациентки с диагнозом рак молочной железы и новообразованием легкого. Акушерство, Гинекология и Репродукция. 2024;18(5):735–742. https://doi.org/10.17749/2313-7347/ob.gyn.rep.2024.518
For citation:
Germanovich N.Yu., Pikunov M.Yu., Shchegolkova T.A., Mishchenko I.M. The choice of therapeutic tactics in a patient with diagnosed breast cancer and lung neoplasm. Obstetrics, Gynecology and Reproduction. 2024;18(5):735–742. (In Russ.) https://doi.org/10.17749/2313-7347/ob.gyn.rep.2024.518
Введение / Introduction
Рак молочной железы (РМЖ) продолжительное время занимает ведущее положение в структуре онкологических заболеваний среди женского населения в мире. Термин «распространенный рак молочной железы» включает в себя как местнораспространенный, так и метастатический РМЖ (мРМЖ), который, несмотря на эффективность современных методов лечения, по-прежнему остается инкурабельным заболеванием с 5-летней общей выживаемостью до 25 % [1].
Метастатический РМЖ – это гетерогенная группа заболеваний с различными клиническими проявлениями. Встречается как солитарное (одиночное или олигометастатическое), так и множественное, или диффузное, поражение того или иного органа [2].
Использование рентгенологических методов диагностики позволяет обнаружить солитарную тень в легком у 3 % женщин с верифицированным диагнозом РМЖ. Зачастую подобные образования расцениваются как вторичные очаги, реже диагностируют метахронный первичный рак, доброкачественную опухоль или другие неопухолевые заболевания легкого, такие как гемангиома, туберкулома [3].
Поражение легочной ткани при мРМЖ статистически составляет 21–32 % всех случаев отдаленного метастазирования, возникая, как правило, в течение 5 лет после первоначально установленного диагноза и уступая по распространенности лишь вторичному поражению костной системы у 30–60 % пациентов [4]. Физиологически метастазы в легкие нарушают их нормальную функцию: развивается симптомокомплекс в виде кашля, затрудненного дыхания, кровохарканья, что в 60–70 % случаев приводит к летальному исходу. Наиболее часто поражение затрагивает периферические отделы легкого, что объясняет сложность диагностики данных новообразований [4].
С развитием современных методов визуализации, таких как мультиспиральная компьютерная томография (МСКТ) и позитронно-эмиссионная томография (ПЭТ), стало возможным выявление наиболее ранних и мелких новообразований в легких у пациентов с диагнозом РМЖ. Диагностика гистологических типов узловых образований в легких имеет решающее значение для выбора тактики лечения.
Зачастую визуализирующие исследования могут быть только ориентировочными, но не диагностическими. Для диагностики узловых образований в легких доступна тонкоигольная аспирационная биопсия под контролем компьютерной томографии (КТ), трансбронхиальная игольчатая аспирационная биопсия, торакоцентез, эндобронхиальное конвексное ультразвуковое исследование (УЗИ), торакоскопия, бронхоскопия, медиастиноскопия.
Однако, когда размер легочного узла менее 1 см, или его расположение неблагоприятно для проведения диагностической пробы, биопсия может быть безрезультатной или технически невыполнимой. В таком случае хирургическое вмешательство, а именно, малоинвазивная видеоторакоскопическая резекция легкого является методом подтверждения патоморфологического диагноза легочных узлов у пациентов с диагнозом РМЖ [5]. Данный метод позволяет ориентировать врачей в выборе тактики лечения и в ряде случаев избежать излишней токсичной полихимиотерапии.
Ключевым моментом в лечении пациентов с верифицированным диагнозом РМЖ и новообразованием в легком является мультидисциплинарный подход с привлечением специалистов различных направлений: хирургов-онкологов, специалистов лучевой диагностики, врачей-радиологов, химиотерапевтов, патоморфологов. Необходимо проводить тщательное обследование пациентов до начала системного лечения, включая полный физикальный осмотр, оценку лабораторных показателей, исследование органов грудной клетки с использованием вышеупомянутых методов визуализации, с решением вопроса о возможности выполнения биопсии очага.
Существует группа пациентов с олигометастатическим поражением, составляющая от 1 до 3 % случаев, с одиночным метастазом в органе. При этом малый объем опухолевой ткани потенциально поддается локальному лечению, направленному на достижение длительной ремиссии, сроком вплоть до 20 лет [2].
Впервые теорию «олигометастатической болезни», обозначающей «промежуточное» состояние между локализованными опухолями и метастатической болезнью, предложили в 1995 г. S. Hellman и R.R. Weichselbaum применительно к раку предстательной и молочной железы [6]. Суть теории заключалась в том, что удаление первичных метастазов может нести потенциальную пользу и положительно влиять на продолжительность жизни больных с единичными метастазами, уменьшая тем самым опухолевую массу. Приведенные авторами результаты демонстрируют 10-летнюю выживаемость у пациентов с диссеминированным раком предстательной и молочной железы. Таким образом, хирургическое удаление единичных метастазов позволяет элиминировать опухолевые клоны, а также в ряде случаев отложить токсичную химио- или гормонотерапию, улучшить отдаленные результаты лечения [6].
При этом удаление первичной опухоли у пациентов с диагнозом мРМЖ достоверно не связано с увеличением общей выживаемости, однако может быть применимо для улучшения качества жизни, а также с целью предупреждения изъязвления, удаления источника инфекции и кровотечения. Кроме того, согласно существующим гипотезам, удаление первичной опухоли имеет преимущества с точки зрения иммунной системы, поскольку устраняет опухолевые стволовые клетки, отвечающие за прогрессирование, метастазирование и рецидивирование опухоли [7].
Видеоторакоскопическая резекция легкого является одним из эффективных методов диагностики и лечения, позволяющая верифицировать очаговые новообразования в легком, выявляемые у пациентов с установленным диагнозом РМЖ. Однако, по мнению F. Tanaka с соавт., для диагностики легочных узлов первоначально должна быть выполнена тонкоигольная аспирационная биопсия и лишь в случае неудачи – хирургическая биопсия [8].
В рамках клинического наблюдения представляем опыт лечения пациентки с установленным диагнозом РМЖ и периферическим очаговым новообразованием легкого.
Клиническое наблюдение / Clinical case
Пациентка Л., 68 лет, поступила в ФГБУ НМИЦ хирургии им. А.В. Вишневского Минздрава России 30.01.2023 с жалобами на наличие новообразования в левой молочной железе.
Анамнез / History of disease
В 2016 г. пациентка Л. прошла комбинированное лечение по поводу рака правой молочной железы T1N0M0, IA стадия, люминальный А. В декабре 2022 г. при самообследовании обнаружила новообразование в левой молочной железе, обратилась за консультацией к онкологу. Обследована.
По данным маммографического исследования (ММГ) от 09.12.2022 на границе наружных квадрантов левой молочной железы визуализируется новообразование с «лучистым» неровным контуром, с нечеткими границами, размером 15,5×19,7 мм (рис. 1).
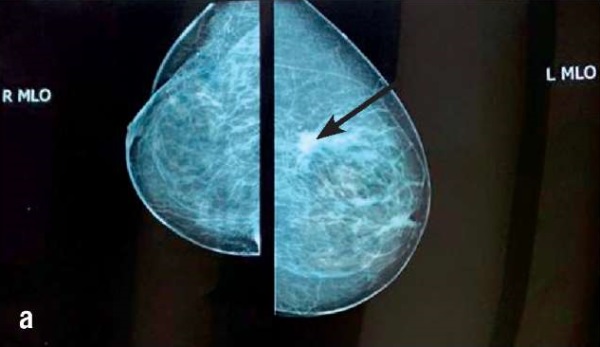
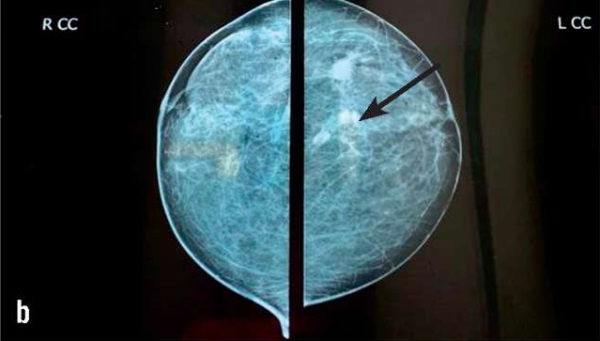
Рисунок 1. Пациентка Л. ММГ-изображения: а – косая проекция (стрелкой обозначена опухоль левой молочной железы); b – прямая проекция (стрелкой обозначена опухоль левой молочной железы).
Figure 1. Patient L. MMG images: a – oblique projection (arrow indicates left mammary gland tumor); b – direct projection (arrow indicates left mammary gland tumor).
По результату выполненного УЗИ молочных желез и регионарных лимфатических узлов (13.12.2022): на границе наружных квадрантов левой молочной железы лоцируется гипоэхогенное образование с неровными, нечеткими границами, размером 20×15×14 мм. BIRADS 6. Справа – послеоперационный рубец без особенностей. Регионарные лимфатические узлы слева не увеличены.
Выполнена трепан-биопсия новообразования левой молочной железы под УЗ-контролем.
Гистологическое и иммуногистохимическое (ИГХ) заключение № 6787 от 19.12.2023: опухоль в биоптатах ткани молочной железы соответствует инвазивной дольковой карциноме второй степени злокачественности (Grade 2, The Nottingham combined histologic grade – Ellson-Ellisgrading system). Опухолевые клетки сильно положительны по наличию рецепторов Estrogen (100 %, 8 баллов), по наличию рецепторов Progesteron (100 %, 8 баллов), с низкой пролиферативной активностью (ИП Ki67 – 15 %) и реакцией к Her2/Neu "2+". FISH-реакция: согласно критериям ASCO/CAP`23, в исследованном образце не обнаружена амплификация гена Her2. Люминальный тип А.
Установлен диагноз: первично-множественный метахронный рак: 1. Рак правой молочной железы T1N0M0, IA стадия, люминальный А, состояние после комбинированного лечения в 2016 г. 2. Рак левой молочной железы T1сN0M0, IA cтадия, люминальный А. Периферическое очаговое новообразование S10 левого легкого.
По данным МСКТ органов грудной клетки (21.12.2022): в субплевральных отделах S10 нижней доли левого легкого определяется единичный солидный очаг с четкими контурами размером до 7 мм.
Ввиду невозможности предоставить КТ-архив ранее выполненного исследования с целью пересмотра, пациентка направлена на дополнительное обследование.
Для верификации образования в S10 нижней доли левого легкого, а также для исключения его метастатического характера пациентке рекомендовано выполнить ПЭТ-КТ, так как проведение трансторакальной пункционной биопсии технически затруднительно (рис. 2).
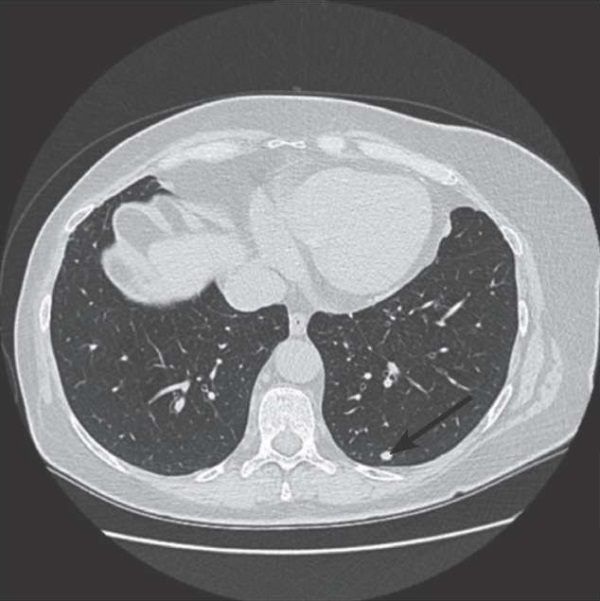
Рисунок 2. Пациентка Л. МСКТ-изображение: единичный солидный очаг с четкими контурами S10 нижней доли левого легкого размером до 7 мм (обозначен стрелкой).
Figure 2. Patient L. MSCT image: a single solid lesion with clear contours S10 of the left lung lower lobe, up to 7 mm in size (indicated by arrow).
Согласно заключению ПЭТ-исследования (20.01.2023): единичный солидный очаг в S10 левого легкого размером 7 мм, не накапливает радиофармпрепарат (РФП). Образование в верхне-наружном квадранте левой молочной железы, неправильной формы, размером 14×14 мм, накапливает контрастный препарат, с повышенным метаболизмом (РФП SU Vmax 5,1).
По результатам онкологического консилиума, консилиума специалистов лучевой диагностики, проведенного в ФГБУ НМИЦ хирургии им. А.В. Вишневского Минздрава России, а также консультации торакального хирурга и хирурга-онколога пациентки Л., новообразование левого легкого расценено в большей степени как доброкачественное. Однако окончательное суждение о диагнозе возможно только после морфологической верификации с решением вопроса о тактике лечения.
Рекомендована двухэтапная хиругическая тактика: резекция S10 левого легкого со срочным гистологическим исследованием операционного материала. При отсутсвии данных за метастатический характер образования в легком – радикальная мастэктомия слева.
В случае подтверждения вторичного генеза образования в легком – отказ от хирургического вмешательства на молочной железе в пользу полихимиотерапии.
Предоперационно пациентка обследована. Лабораторные показатели (30.01.2023) в пределах референсных значений.
Хирургическая тактика / Surgical tactics
Симультанное оперативное вмешательство (31.01.2023): 1) VATS-резекция нижней доли левого легкого. После видеоторакоскопической ревизии левой плевральной полости визуальных признаков опухоли S10 легкого нет. При попытке пальцевого исследования паренхимы легкого удалось выявить интрапаренхиматозно плотно-эластическое образование округлой формы диаметром 8 мм. Выполнена резекция легкого с образованием.
При срочном гистологическом исследовании получен ответ: фиброма легкого. Таким образом, вторичный метастатический генез образования в легком был исключен. Выполнен второй этап: 2) радикальная мастэктомия слева в модификации по Madden с перевязкой лимфатических сосудов подмышечно-подключичной области.
Пациентка находилась на лечении 11 дней. Послеоперационный период протекал благоприятно, без особенностей. На первые сутки пациентка переведена из отделения реанимации и интенсивной терапии, удален плевральный дренаж. Рентгенография органов грудной клетки в прямой и боковой проекции (01.02.2023): данных за наличие пневмоторакса, значимого гидроторакса не получено. Послеоперационные швы состоятельны, без признаков воспаления и ишемии. Заживление швов первичным натяжением.
Гистологическое заключение / Histopathology report
1) Инфильтративный дольковый рак левой молочной железы II степени злокачественности, типичного тубулярного и солидного строения, размерами 2,2×1,6×1,7 см, без вовлечения соска и кожи железы; рТ2рN0(0/13)сМ0; G2; Рn0; L0; V0; R0. Люминальный подтип А, ER – 8, PR – 8, Ki67 – 12 %, Her2 "1+" (рис. 3).
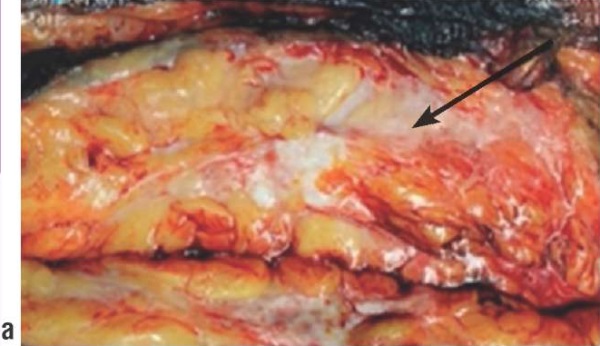
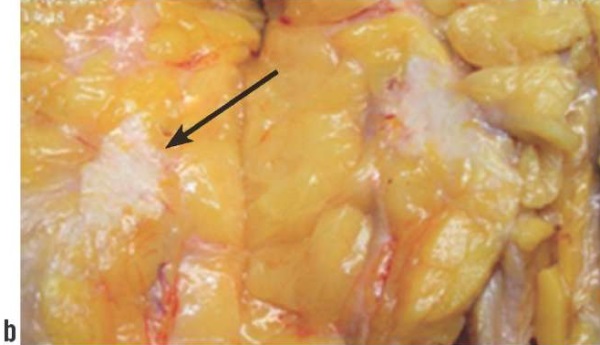
Рисунок 3. Пациентка Л. Макропрепарат: а, b – на разрезе стрелкой обозначен инфильтративный дольковый рак верхне-наружного квадранта левой молочной железы размером 2,2×1,6×1,7 см.
Figure 3. Patient L. Macroscopic specimen: a, b –infiltrative lobular cancer of upper outer quadrant in left mammary gland, size 2.2×1.6×1.7 cm, is indicated by arrow.
2) Узловое образование нижней доли левого легкого без признаков злокачественности наиболее соответствует аденофиброме легкого. Учитывая результат ИГХ-исследования, выполненного с целью уточнения диагноза, а также гистологическую структуру, образование нижней доли левого легкого размерами 0,8×0,7×0,7 см более соответствует солитарной фиброзной опухоли (рис. 4).
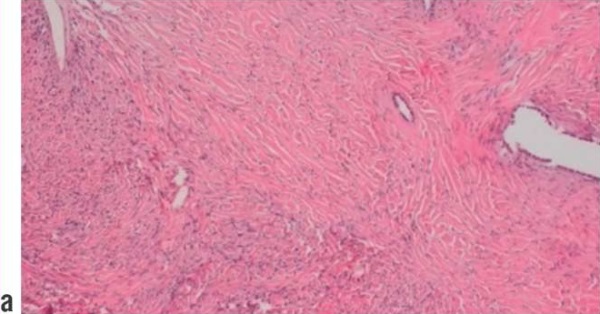
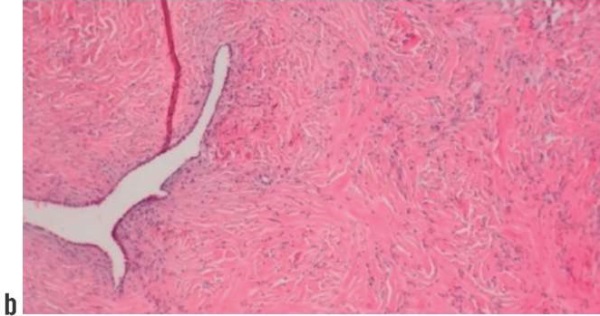
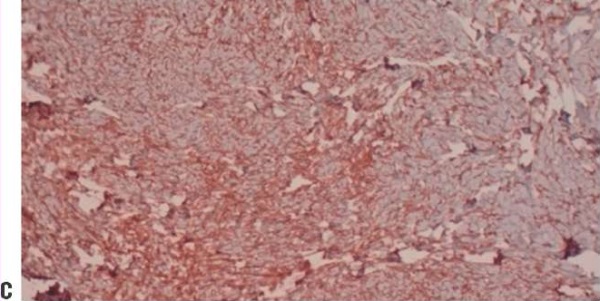
Рисунок 4. Пациентка Л. Микропрепарат. Солитарная фиброзная опухоль: а, b – гематоксилин-эозин, ×100; c – иммуногистохимическая реакция экспрессия биомаркера CD34 (маркер эндотелия сосудов микроциркуляторного русла), ×200.
Figure 4. Patient L. Microscopic specimen. Solitary fibrous tumor: a, b – stained by hematoxylin and eosin, ×100; c – immunohistochemical reaction of CD34 biomarker (endothelial marker in microcirculatory bed vessels) expression, ×200.
Учитывая результат планового гистологического исследования, пациентке назначена гормональная терапия ингибиторами ароматазы, а также рекомендовано динамическое наблюдение.
Обсуждение / Discussion
Аденофиброма легкого (АФ) – чрезвычайно редкая доброкачественная опухоль, морфологически сходная с фиброаденомой и филлоидной опухолью молочной железы. Впервые АФ была впервые описана R. Scarff и F. Gowar в 1944 г. Они предположили, что ее происхождение может быть таким же, как у хрящевой гамартомы легкого. С тех пор в мире зарегистрировано около 30 гистологически верифицированных случаев. С. Butler и J. Kleinerman в 1963 г. описали ее как неопластическую находку. В 1993 г. S. Suster и C.A. Moran предположили, что эта опухоль является незрелым типом гамартомы. A. Cavazza с соавт. в 2003 г. описали ее как солитарную фиброзную псевдопапиллярную опухоль легкого. На сегодняшний день точная этиология и гистогенез опухоли остаются неясными [9].
Аденофиброма легкого характеризуется двухфазной дифференцировкой, так как состоит из железоподобного пространства, выстланного респираторным эпителием и стромальными веретенообразными клетками. В случае АФ повышается риск ошибочного диагноза с солитарными фиброзными опухолями (СФО) из-за их морфологического сходства [10].
В ранних исследованиях отмечалось, что АФ и СФО, в свою очередь, дифференцируют с метастатическим поражением легочной ткани при РМЖ. Их различие клинически важно, поскольку СФО потенциально могут иметь агрессивное клиническое течение, в то время как сообщений о злокачественном поведении АФ не отмечалось [11].
В представленном нами клиническом наблюдении образование в S10 левого легкого было морфологически расценено как СФО в ходе двухэтапного исследования операционного материала с ИГХ исследованием.
В конце ХIХ века E. Wagner впервые описал солитарную фиброзную опухоль как редко встречающуюся, мягкотканную, первичную опухоль в плевре, существование которой длительное время оспаривалось. Данные образования рассматривались в качестве метастазов злокачественных опухолей с неизвестной локализацией первичного узла. В настоящее время описаны лишь отдельные казуистические случаи СФО, в связи с чем установить истинную частоту их возникновения затруднительно [12].
Впоследствии были описаны СФО почти в каждом экстраплевральном анатомическом участке. Кроме того, на сегодняшний день известна наиболее частая локализация СФО, а именно, в плевре, легких, средостении и брюшине, однако встречаются и иные локализации.
Этиология СФО остается неизвестной, и не было продемонстрировано никакой связи с факторами окружающей среды, такими как потребление табака или воздействие асбеста [13].
Патоморфологические характеристики СФО впервые описаны P. Klemperer и С.В. Rabin в 1931 г. [14]. Большинство опухолей медленно растут и случайно диагностируются как безболезненные образования. Однако большие опухоли могут вызывать местные симптомы, такие как боль, сдавливание дыхательных путей. Морфологически СФО могут быть как доброкачественными, так и злокачественными (соотношение 7: 1) [15].
Первоначальное лечение СФО в основном заключается в хирургической резекции. Роль адъювантного лечения или лечения неоперабельного, рецидивирующего заболевания остается неясной и противоречивой.
Небольшой процент СФО обладают атипичными признаками. Гистологические критерии для классификации СФО как доброкачественных или злокачественных были описаны D.M. England с соавт. в 1989 г. Эти критерии включают более 4 митозов на 10 полей высокой мощности, наличие некроза, гиперцеллюлярность со скученностью и перекрытием. Опухоль может иметь доброкачественные или злокачественные гистологические признаки, однако эти признаки не всегда предсказывают клиническое поведение опухоли [16].
Именно поэтому данное клиническое наблюдение, а также каждый случай сочетанной патологии представляет интерес с точки зрения клинико-патологических особенностей, а также выбора тактики хирургического лечения.
Заключение / Conclusion
Новообразования легких у пациентов с установленным диагнозом РМЖ не всегда могут быть легочными метастазами, и решение о лечении следует принимать только после подтверждения патологического диагноза. В тех случаях, когда трансбронхиальная биопсия не позволяет подтвердить диагноз, хирургическое вмешательство, а именно, видеоторакоскопическая резекция легочного узла со срочным гистологическим исследованием является доступным методом исключения отдаленного метастазирования с возможностью последующего хирургического лечения первичного очага. Позволяя избежать агрессивной химио- и гормонотерапии, мультидисциплинарный подход в диагностике, а также в выборе тактики лечения пациентов с сочетанной патологией оказывает значительное влияние на качество жизни и дальнейшее ведение пациентов с диагнозом РМЖ.
Список литературы
1. Cardoso F., Costa A., Senkus E. et al. 3-rd ESO-ESMO International Consensus Guidelines for Advanced Breast Cancer (ABC 3). Ann Oncol. 2017;28(1):16–33. https://doi.org/10.1093/annonc/mdw544.
2. Основы и принципы онкопластической хирургии при раке молочной железы. Под ред. З. Матрая, Г. Гуляша, Т. Ковача, М. Каслера; пер. с англ. К.С. Николаева, А.В. Комяхова, Р.С. Песоцкого, Ш.А. Джалиловой; под ред. А.А. Бессонова, А.С. Емельянова, М.А. Джеляловой, В.С. Аполлоновой. Санкт-Петербург: МедЛит, 2021. 767 с.
3. Пикин О.В., Трахтенберг А.Х., Осипов В.В. и др. Хирургический метод в диагностике и лечении больных с очаговыми образованиями в легких при раке молочной железы. Сибирский онкологический журнал. 2012;(6):21–5.
4. Medeiros B., Allan A.L. Molecular mechanisms of breast cancer metastasis to the lung: clinical and experimental perspectives. Int J Mol Sci. 2019;20(9):2272. https://doi.org/10.3390/ijms20092272.
5. Fan J., Chen D., Du H. et al. Prognostic factors for resection of isolated pulmonary metastases in breast cancer patients: a systematic review and meta-analysis. J Thorac Dis. 2015;7(8):1441–51. https://doi.org/10.3978/j.issn.2072-1439.2015.08.10.
6. Никулин М.П. Олигометастазы рака молочной железы и рака предстательной железы: целесообразность хирургического лечения. Практическая онкология. 2016;17(3):200–11.
7. Bafford A.C., Burstein H.J., Barkley C.R. et al. Breast surgery in stage IV breast cancer: impact of staging and patient selection on overall survival. Breast Cancer Res Treat. 2009;115(1):7–12. https://doi.org/10.1007/s10549-008-0101-7.
8. Tanaka F., Li M., Hanaoka N. et al. Surgery for pulmonary nodules in breast cancer patients. Ann Thorac Surg. 2005;79(5):1711–4. https://doi.org/10.1016/j.athoracsur.2004.10.033.
9. Al-Amer M., Abdeen Y., Shaaban H., Alderink C. Solitary pulmonary adenofibroma in a middle-aged man with bladder cancer. Lung India. 2017;34(6):570–2. https://doi.org/10.4103/lungindia.lungindia_167_17.
10. Liang Z., Zhou P., Wang Y. et al. Pulmonary adenofibroma: clinicopathological and genetic analysis of 7 cases with literature review. Front Oncol. 2021;11:667111. https://doi.org/10.3389/fonc.2021.667111.
11. Olson N.J., Czum J.M., de Abreu F.B. et al. Synchronous pulmonary adenofibroma and solitary fibrous tumor: case report and review of the literature. Int J Surg Pathol. 2019;27(3):322–7. https://doi.org/10.1177/1066896918807302.
12. Двораковская И.В., Ариэль Б.М., Платонова И.С. и др. Солитарная фиброзная опухоль грудной полости. Пульмонология. 2014;(5):20–6.
13. Saynak M., Veeramachaneni N.K., Hubbs J.L. et al. Solitary fibrous tumors of chest: another look with the oncologic perspective. Balkan Med J. 2017;34(3):188–99. https://doi.org/10.4274/balkanmedj.2017.0350.
14. Klemperer P., Rabin C.B. Primary neoplasms of the pleura. A report of five cases. Arch Pathol. 1931;11:385–412.
15. Thway K., Ng W., Noujaim J. et al. The current status of solitary fibrous tumor: diagnostic features, variants, and genetics. Int J Surg Pathol. 2016;24(4):281–92. https://doi.org/10.1177/1066896915627485.
16. England D.M., Hochholzer L., McCarthy M.J. Localized benign and malignant fibrous tumors of the pleura. A clinicopathologic review of 223 cases. Am J Surg Pathol. 1989;13(8):640–58. https://doi.org/10.1097/00000478-198908000-00003.
Об авторах
Н. Ю. ГермановичРоссия
Германович Наталья Юрьевна, к.м.н.
115093 Москва, Большая Серпуховская ул., д. 27
М. Ю. Пикунов
Россия
Пикунов Михаил Юрьевич, к.м.н.
115093 Москва, Большая Серпуховская ул., д. 27
Т. А. Щеголькова
Россия
Щеголькова Татьяна Александровна
115093 Москва, Большая Серпуховская ул., д. 27
И. М. Мищенко
Россия
Мищенко Инна Михайловна
115093 Москва, Большая Серпуховская ул., д. 27
Что уже известно об этой теме?
► Метастатический рак молочной железы (РМЖ) – это гетерогенная группа заболеваний с различными клиническими проявлениями. Встречается как солитарное (одиночное или олигометастатическое), так и множественное, или диффузное, поражение того или иного органа.
► У 3 % женщин с верифицированным РМЖ рентгенологически обнаруживают солитарную тень в легком, интерпретируемую как метастатический очаг. Метастазирование РМЖ в легочную ткань составляет 21–32 % всех случаев отдаленного метастазирования, в 60–70 % случаев приводит к летальному исходу.
► Когда размер легочного узла менее 1 см или его расположение неблагоприятно для проведения диагностической пробы, хирургическое вмешательство является методом подтверждения патоморфологического диагноза легочных узлов у пациентов с диагнозом РМЖ.
Что нового дает статья?
► Приведен лечебно-диагностический алгоритм лечения пациенток с диагнозом РМЖ и очаговым периферическим новообразованием легкого.
► Продемонстрирована роль хирургического вмешательства, а именно, видеоторакоскопической резекции легкого со срочным гистологическим исследованием как метода верификации диагноза и определения морфологической природы новообразования.
► Разработана двухэтапная хирургическая тактика, одномоментно исключающая вторичный характер образования в легком, с последующим удалением первичного очага.
Как это может повлиять на клиническую практику в обозримом будущем?
► Применение предложенного лечебно-диагностического алгоритма в клинической практике позволит оптимизировать и улучшить качество лечения пациенток с диагнозом РМЖ и очаговым периферическим новообразованием легкого.
► Использование приведенной двухэтапной хирургической тактики позволит морфологически верифицировать единичные очаговые образования в легких, имеющие неблагоприятное расположения для проведения диагностической пункции.
► Исключение вторичного поражения у пациенток с диагнозом РМЖ даст возможность избежать излишней кардио-, гепато- и нефротоксичной химиотерапии.
Рецензия
Для цитирования:
Германович Н.Ю., Пикунов М.Ю., Щеголькова Т.А., Мищенко И.М. Выбор лечебной тактики у пациентки с диагнозом рак молочной железы и новообразованием легкого. Акушерство, Гинекология и Репродукция. 2024;18(5):735–742. https://doi.org/10.17749/2313-7347/ob.gyn.rep.2024.518
For citation:
Germanovich N.Yu., Pikunov M.Yu., Shchegolkova T.A., Mishchenko I.M. The choice of therapeutic tactics in a patient with diagnosed breast cancer and lung neoplasm. Obstetrics, Gynecology and Reproduction. 2024;18(5):735–742. (In Russ.) https://doi.org/10.17749/2313-7347/ob.gyn.rep.2024.518

Контент доступен под лицензией Creative Commons Attribution-NonCommercial-ShareAlike 4.0 International License.











































