Перейти к:
Влияние синтетической и восстановленной формы фолиевой кислоты на показатели метионинового обмена в эксперименте на различных моделях крыс линии Wistar
https://doi.org/10.17749/2313-7347/ob.gyn.rep.2024.517
Аннотация
Введение. В настоящее время назначение препаратов фолиевой кислоты в прегравидарном периоде является эмпирическим. Наряду с синтетической фолиевой кислотой существует восстановленная форма фолиевой кислоты – 5-метилтетрагидрофолат (англ. 5-methyltetrahydrofolate, 5-MTHF). Производители данной формы заявляют, что 5-MTHF преодолевает метаболические дефекты, вызванные полиморфизмом в гене метилентетрагидрофолатредуктазы (англ. methylenetetrahydrofolate reductase, MTHFR) c.665C>T, в связи с чем его применение имеет преимущества перед синтетической фолиевой кислотой (птероилмоноглутаминовая кислота, ПГА). Однако крупных исследований, подтверждающих данную гипотезу, не проводилось.
Цель: оценить влияние различных препаратов фолиевой кислоты на показатели метионинового обмена в экспериментальных моделях крыс линии Wistar.
Материалы и методы. Половозрелым самкам крыс линии Wistar было создано состояние хронической гипергомоцистеинемии (ГГЦ) с помощью ежедневной метиониновой нагрузки. После развития состояния ГГЦ экспериментальным животным вводили ПГА либо 5-MTHF. Часть животных без ГГЦ также получала препараты фолиевой кислоты или воду. В 3 этапа (через 1, 2 нед и 1,5 мес от добавления фолатов) был выполнен отбор проб крови с измерением уровня гомоцистеина (ГЦ), концентрации фолиевой кислоты в плазме и в эритроцитах.
Результаты. При метиониновой нагрузке у половозрелых крыс наблюдалось развитие ГГЦ, при котором уровень ГЦ был значимо выше (p < 0,05) по сравнению со значениями в контрольной группе. Добавление препаратов фолиевой кислоты на фоне ГГЦ, вызванной метиониновой нагрузкой, не привело к снижению концентрации ГЦ. У экспериментальных животных, которым вводили ПГА или 5-MTHF, концентрация фолиевой кислоты в сыворотке крови и эритроцитах не изменялась с увеличением срока введения препаратов. Не установлено преимуществ 5-MTHF перед синтетической фолиевой кислотой в отношении уровня ГЦ и накопления фолиевой кислоты в эритроцитах. Вместо ожидаемого снижения уровня ГЦ у ГГЦ моделей под действием исследуемых фолатов получен противоположный эффект. При уже имеющейся нефолатзависимой хронической ГГЦ уровень ГЦ нарастал от 1-го к 3-му этапу.
Заключение. Хроническая нефолатзависимая ГГЦ, вызванная с помощью постоянного перорального введения метионина, купировалась у экспериментальных моделей самостоятельно, при этом дополнительное добавление фолатов способствовало росту ГЦ в плазме крови. На экспериментальных моделях крыс с нормальным уровнем фолиевой кислоты в эритроцитах было показано, что добавление в рацион препаратов фолиевой кислоты не приводит к ее дальнейшему накоплению. Исследование не показало преимуществ 5-МТГФ перед синтетической фолиевой кислотой в отношении снижения уровня ГЦ в плазме крови и накопления фолиевой кислоты в эритроцитах.
Ключевые слова
Для цитирования:
Сазонова А.П., Милютина Ю.П., Беспалова О.Н., Пачулия О.В., Залозняя И.В., Кореневский А.В. Влияние синтетической и восстановленной формы фолиевой кислоты на показатели метионинового обмена в эксперименте на различных моделях крыс линии Wistar. Акушерство, Гинекология и Репродукция. 2024;18(5):658–666. https://doi.org/10.17749/2313-7347/ob.gyn.rep.2024.517
For citation:
Sazonova A.P., Milyutina Yu.P., Bespalova O.N., Pachuliia O.V., Zalozniaia I.V., Korenevsky A.V. Effect of synthetic and reduced folic acid on methionine metabolism parameters in various experimental models with Wistar rats. Obstetrics, Gynecology and Reproduction. 2024;18(5):658–666. (In Russ.) https://doi.org/10.17749/2313-7347/ob.gyn.rep.2024.517
Введение / Introduction
На сегодняшний день назначение препаратов фолиевой кислоты в прегравидарном периоде является эмпирическим. Выбор препаратов может зависеть от активного вещества и дозы. Наряду с синтетической фолиевой кислотой существует восстановленная форма фолиевой кислоты – 5-метилтетрагидрофолат (англ. 5-methyltetrahydrofolate, 5-MTHF). Производители данной формы заявляют, что 5-MTHF преодолевает метаболические дефекты, вызванные полиморфизмом c.665C>T в гене метилентетрагидрофолатредуктазы (англ. methylenetetrahydrofolate reductase, MTHFR), а потому его применение имеет преимущества перед синтетической фолиевой кислотой и его использование может быть персонифицированным [1–3]. Однако крупных исследований не проводилось. Поэтому назначение препарата 5-MTHF в настоящее время не обосновано.
Доказано, что прием фолиевой кислоты в дозе 400 мкг до зачатия снижает риск рождения ребенка с врожденным дефектом нервной трубки (ДНТ) [4–6]. При этом на протяжении последних 30 лет женщины во многих странах согласно существующим национальным программам потребляют пищевые продукты, обогащенные синтетической фолиевой кислотой [7]. Многие исследования показывают, что данные национальные программы снизили распространенность ДНТ во всем мире [7]. Однако в это же время происходило совершенствование и широкое распространение методов ультразвукового и биохимического скрининга, благодаря которым стало возможным своевременное выявление врожденных пороков развития плода и прерывание беременности на ранних сроках. Возможно, роль фолатов в снижении ДНТ незаслуженно преувеличена. Более того, существуют опасения по поводу отдаленных эффектов неметаболизированной фолиевой кислоты, которые до сих пор остаются малоизученными [8–11].
Птероилмоноглутаминовая кислота (ПГА) – это синтетическая форма фолатов, которая отличается от естественных фолатов невосстановленным птеридиновым кольцом. ПГА используется в качестве пищевой добавки или для обогащения основных продуктов питания. Синтетическая фолиевая кислота в норме абсорбируется в кишечнике и поступает в кровь в виде 5-MTHF [12][13]. С помощью специальных переносчиков – связанного с протоном транспортера фолатов (англ. proton-coupled folate transporter, PCFT) SLC46A1 и анионообменника с пониженным содержанием фолиевой кислоты (англ. reduced folate carrier 1, RFC1) SLC19A1 – фолаты попадают в клетки кишечника [14]. Было показано, что в плазме крови выявляется неизмененная фолиевая кислота в дозе свыше 300 мкг [15], которая быстро выводится почками. Однако за период своего нахождения в кровеносном русле синтетическая фолиевая кислота поступает к клеткам. Как и 5-MTHF, ПГА проникает в клетки путем эндоцитоза при участии специфических фолатных рецепторов [16].
В процессе эритропоэза в красном костном мозге в клетках эритроидного ряда транспорт фолатов реализуется через фолатсвязывающий белок (англ. folate binding protein, FBP) и RFC1-транспортер (двунаправленный механизм антипорта анионов) [17]. Концентрация фолиевой кислоты в эритроцитах может свидетельствовать о степени насыщенности организма фолатами [18].
Если 5-MTHF естественно внедряется в метаболический цикл фолатов и служит донором метильных групп, то синтетическая фолиевая кислота не может быть вовлечена в фолатный цикл. Однако в клетках ПГА превращается в дигидрофолат, ингибитор фермента, опосредующего превращение 5,10-метилентетрагидрофолата (англ. 5,10-methylenetetrahydrofolate, 5,10-MTHF) в 5-MTHF, который необходим для восстановления гомоцистеина (ГЦ) в метионин [19]. Таким образом, избыток фолиевой кислоты приводит к частичному снижению метаболизма эндогенных фолатов, снижению синтеза метионина и повышению уровня ГЦ, который отчасти рассматривается как косвенный показатель работы фолатного цикла [20].
Препараты, разработанные на основе 5-MTHF, поступают в клетки организма в восстановленной форме в отличие от синтетической фолиевой кислоты. Предположительно, добавки 5-MTHF эффективны, независимо от наличия у пациента гомозиготного и/или гетерозиготного генотипа 677C→T полиморфизма MTHFR. В связи с этим 5-MTHF может стать полной альтернативой коррекции фолатного статуса во время беременности, если преимущества данного препарата будут доказаны [2].
На сегодняшний день гипергомоцистеиновые модели крыс используются для оценки токсического эффекта ГЦ. Коррекция состояния гипергомоцистеинемии (ГГЦ) в экспериментальных моделях различными формами фолиевой кислоты в настоящее время активно изучается.
В настоящее время состояние ГГЦ в экспериментальных моделях создается с помощью дефицита фолатов (трансгенные животные, недостаток поступления фолатов с пищей) или без их дефицита (введение метионина, ГЦ, дефицит других витаминов группы В) [21–23].
Цель: оценить влияние различных препаратов фолиевой кислоты на показатели метионинового обмена в экспериментальных моделях крыс линии Wistar.
Материалы и методы / Materials and Methods
В экспериментальных модельных исследованиях состояние ГГЦ у крыс было создано с помощью метиониновой нагрузки [23].
Экспериментальные животные / Experimental animals
Эксперименты были выполнены на 36 половозрелых крысах-самках линии Wistar массой 150–200 г. Животные содержались в виварии с искусственной вентиляцией и контролируемым стандартным световым режимом (12 ч света – 12 ч темноты), получали стандартный лабораторный корм (полнорационный комбикорм, рецепт ПК-120, ГОСТ 34566-2019, ООО «Провими», Россия) и воду.
Животные были разделены на 6 групп по 6 животных в каждой группе: группа 1 (контрольная) – самки крыс, которым ежедневно в течение 2,5 мес перорально через зонд вводили воду; группа 2 (метиониновая) – самки, у которых создавали экспериментальную ГГЦ путем ежедневного однократного перорального введения через зонд 0,15 % водного раствора L-метионина в дозе 0,6 г/кг массы животного в 11 часов циркадианного времени (ЦВ) в течение 2,5 мес; группа 3 (группа ГГЦ+ПГА) – самки с метиониновой и фолатной нагрузкой, которым спустя 1 мес от начала приема метионина начали вводить однократно ежедневно перорально через зонд ПГА в дозе 20 мкг/кг массы животного в 5 часов ЦВ в течение 1,5 мес, с продолжением введения 0,15 % водного раствора L-метионина ежедневно в 11 часов ЦВ; группа 4 (группа ГГЦ+5-MTHF) – самки с метиониновой и фолатной нагрузкой, которым спустя 1 мес от начала приема метионина начали вводить однократно ежедневно перорально через зонд 5-MTHF в дозе 20 мкг/кг массы животного в 5 часов ЦВ в течение 1,5 мес, при этом продолжалось введение 0,15 % водного раствора L-метионина ежедневно в 11 часов ЦВ; группа 5 (группа ПГА) – модель с фолатной нагрузкой, самки, которым вводили однократно ежедневно перорально через зонд ПГА в дозе 20 мкг/кг массы животного в 5 часов ЦВ в течение 1,5 мес; группа 6 (группа 5-MTHF) – модель с фолатной нагрузкой, самки, которым вводили однократно ежедневно перорально через зонд 5-MTHF в дозе 20 мкг/кг массы животного в 5 часов ЦВ в течение 1,5 мес (табл. 1).
Таблица 1. Характеристика экспериментальных групп.
Table 1. Characteristics of experimental groups.
|
Группа |
Вода |
Метионин в 11 часов ЦВ |
ПГА в 5 часов ЦВ |
5-МТГФ в 5 часов ЦВ |
|
|
Группа 1 |
+ |
– |
– |
– |
|
|
Группа 2 |
– |
+ |
– |
– |
Состояние ГГЦ |
|
Группа 3 |
– |
+ |
+ |
– |
|
|
Группа 4 |
– |
+ |
– |
+ |
|
|
Группа 5 |
– |
– |
+ |
– |
|
|
Группа 6 |
– |
– |
– |
+ |
Отбор проб крови у всех групп проходил в 3 этапа: на 112-й, 119-й, 160-й день постнатального развития – через 1 и 2 нед и через 1,5 мес от начала введения фолатов соответственно (рис. 1).
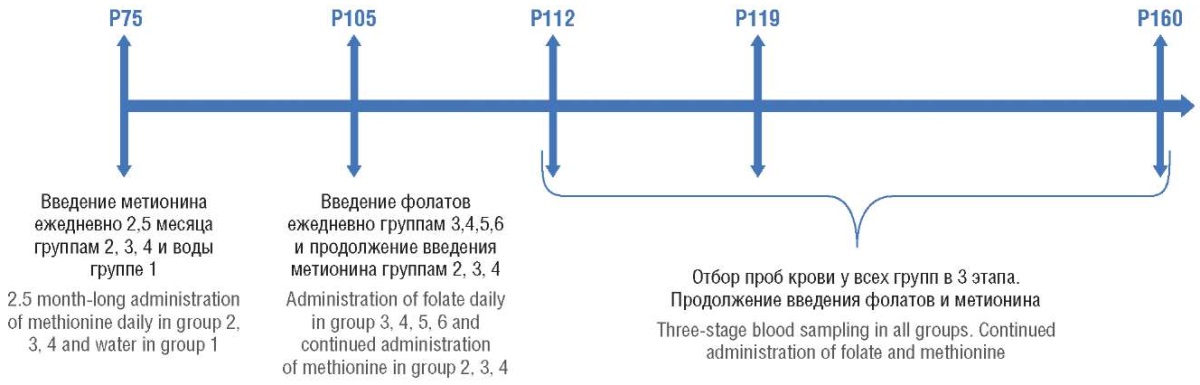
Рисунок 1. Основные этапы эксперимента.
Примечание: Р – постнатальное развитие, дни.
Figure 1. Major stages of experimental model.
Note: P – postnatal development, days.
Подготовка и анализ плазмы и эритроцитов крови / Plasma and erythrocyte preparation and analysis
Цельная кровь собиралась в 5 часов ЦВ, т. е. через 18 ч от последнего введения метионина и через 24 ч после введения фолатов, из десны в пробирки с K3-ЭДТА для последующего исследования уровня фолиевой кислоты в эритроцитах (группы 1, 5, 6). Эритроциты выделяли путем центрифугирования в течение 10 мин при 2000 g. Осадок с клетками переносился в пробирку с барбиталовым буфером (500 мкл) – раствор DGVB++ (англ. Dextrose Gelatin Veronal Buffer, Ca2+, Mg2+): 2,5 ммоль/л натрий-барбиталовый буфер (pH = 7,35), содержащий 71 ммоль/л NaCl, 150 ммоль/л глюкозы, 1,0 ммоль/л MgCl2, 0,15 ммоль/л CaCl2, 0,05 % желатина. Эритроцитарную массу отмывали барбиталовым буфером 2 раза, далее одну часть ресуспендировали в Millipore H2O для исследования количества эритроцитов. При λ = 541 нм измеряли оптическую плотность (англ. optical density, OD) полученного лизата эритроцитов (OD = 0,37 соответствовало 1×109 эритроцитов/мл). Остаток эритроцитарной массы в барбиталовом буфере, а также плазму крови замораживали при температуре – 80° до исследования. После разморозки в эритроцитарной массе измеряли содержание фолиевой кислоты с последующим расчетом концентрации фолиевой кислоты в пмоль/106 эритроцитов. В плазме крови также оценивали уровень ГЦ и фолиевой кислоты [24]. Исследование было выполнено на приборе Architect (Abbot, Германия).
Этические аспекты / Ethical aspects
Все работы с лабораторными животными одобрены этическим комитетом НИИ ФГБНУ НИИ АГиР им. Д.О. Отта (протокол № 88 от 08.12.2017) и выполнялись в соответствии с принципами гуманности, изложенными в директиве Европейского союза № 86/609 ЕС и Европейской Конвенции о защите позвоночных животных, используемых для экспериментов или в иных научных целях (Страсбург, 18.03.1986) ETS № 123, и положениями Хельсинкской декларации Всемирной медицинской ассоциации о гуманном отношении к животным (2000).
Статистический анализ / Statistical analysis
Статистическая обработка полученных данных проведена с использованием программы Statistica 10.0 (StatSoft Inc., США). Данные представлены в виде медианы (Me) и интерквартильного интервала (Q1–Q3). На основании оценки нормальности распределения признаков для сравнения выборок были применены Н-критерий Крускала–Уоллиса и U-критерий Манна–Уитни. Для выявления направления корреляционных связей был использован коэффициент Спирмена. Различия считали статистически значимыми при р < 0,05.
Результаты / Results
Было показано, что в группе контроля концентрация ГЦ в плазме была сопоставима на всех 3 этапах отбора крови. При метиониновой нагрузке у половозрелых самок-крыс (группа 2) наблюдалось развитие ГГЦ, при которой уровень ГЦ был значимо выше (p < 0,05) по сравнению со значениями в контрольной группе (табл. 2). На 2-м этапе различия между данными группами оказались статистически значимыми (p < 0,05). Существенных различий в содержании ГЦ между группами 3 и 4 (с метиониновой и фолатной нагрузкой), а также между группами 5 и 6 (с фолатной нагрузкой) обнаружено не было. В связи с этим соответствующие группы были объединены.
Таблица 2. Содержание гомоцистеина в плазме крови.
Table 2. Assessing blood homocysteine level.
|
Этап |
Содержание гомоцистеина, мкмоль/л Me [ Q1–Q3] |
|||
|
Группа 1 |
Группа 2 |
Группа 3+4 |
Группа 5+6 |
|
|
1 |
2,45 [ 1,75–3,72] |
3,74 [ 3,085–5,21] |
6,13 [ 4,49–9,49]*# |
2,7 [ 2,18–3,2] |
|
2 |
2,13 [ 1,97–3,36] |
15,44 [ 6,55–23,86]* |
16,21 [ 8,29–27,13]*# |
2,4 [ 2,24–2,64] |
|
3 |
3,34 [ 2,9–4,6] |
5,59 [ 5,15–12,14] |
18,64 [ 9,85–30,68]**# |
5,4 [ 4,54–5,69] |
Примечание: *p < 0,05; **p < 0,01 – различия статистически значимы по сравнению с группой 1; #p < 0,05 – различия статистически значимы по сравнению с группой 5+6.
Note: *p < 0.05; **p < 0.01 – significant differences compared to group 1; #p < 0.05 – significant differences compared to group 5+6.
Концентрация ГЦ у группы 2 с метиониновой нагрузкой нарастала от 1-го ко 2-му этапу и снижалась к 3-му этапу почти до нормального уровня. Группы с метиониновой и фолатной нагрузкой (группа 3+4) имели противоположный результат: концентрация ГЦ последовательно возрастала от 1-го к 3-му этапу. Повышенный уровень ГЦ в группе 3+4 по сравнению с группой 5+6 на всем протяжении эксперимента указывает на отсутствие предотвращения состояния ГГЦ под действием фолатов. При этом уровень ГЦ в группе 5+6, а также отдельно в группах 5 и 6 не отличался от его значений в контрольной группе.
При оценке уровня фолиевой кислоты в сыворотке крови статистически значимых различий между группами на всех 3 этапах не обнаружено (табл. 3). Значимого накопления фолиевой кислоты в плазме не наблюдалось, отмечена лишь тенденция к ее повышению к 3-му этапу исследования. Была обнаружена положительная корреляция между уровнем фолиевой кислоты в плазме крови и ее содержанием в эритроцитах (rs = 0,83; p < 0,05).
Таблица 3. Содержание фолиевой кислоты в плазме крови.
Table 3. Assessing blood folic acid level.
|
Этап |
Содержание фолиевой кислоты, нмоль/л Me [ Q1–Q3] |
|||
|
Группа 1 |
Группа 2 |
Группа 3+4 |
Группа 5+6 |
|
|
1 |
76,2 [ 65,88–99,6] |
55,38 [ 47,77–78,14] |
71,95 [ 68,8–113,08] |
59,84 [ 58,12–70,36] |
|
2 |
81,83 [ 64,2–82] |
55,24 [ 51,72–76,04] |
57,80 [ 32,92–69,54] |
67,42 [ 42,32–71,4] |
|
3 |
86,48 [ 84,57–86,92] |
124, 04 [ 81,62–140,94] |
103,61 [ 71,76–140,88] |
106,76 [ 87,28–109,36] |
В нашем исследовании мы измеряли фолиевую кислоту в эритроцитах у групп 1, 5 и 6, при этом значимых отличий уровня фолиевой кислоты в эритроцитах в группах 5 и 6 от группы контроля также не обнаружено на всем протяжении эксперимента (табл. 4).
Таблица 4. Содержание фолиевой кислоты в эритроцитах.
Table 4. Assessing erythrocyte folic acid level.
|
Этап |
Содержание фолиевой кислоты в эритроцитах, пмоль/10⁶ клеток Me [ Q1–Q3] |
||
|
Группа 1 |
Группа 5 |
Группа 6 |
|
|
1 |
0,78 [ 0,63–0,86] |
0,78 [ 0,78–0,88] |
0,65 [ 0,47–0,69] |
|
2 |
0,81 [ 0,67–1,0] |
0,70 [ 0,61–1,17] |
0,64 [ 0,58–0,80] |
|
3 |
0,72 [ 0,72–0,82] |
0,68 [ 0,61–0,84] |
0,73 [ 0,61–0,86] |
В контрольной группе концентрация фолиевой кислоты в эритроцитах на всех этапах оставалась в пределах нормальных значений и не менялась. В группах 5 и 6, которым вводили ПГА и 5-МТГФ соответственно, концентрация фолиевой кислоты была сопоставима с таковой в контрольной группе, и роста последней не происходило. Статистически значимых различий в уровне фолиевой кислоты в эритроцитах между группами не наблюдалось.
Обсуждение / Discussion
Наше исследование не показало преимуществ 5-МТГФ перед синтетической фолиевой кислотой в отношении снижения уровня ГЦ в плазме крови и накопления фолиевой кислоты в эритроцитах.
Экспериментальные животные содержались на сбалансированном питании, которое обеспечивало нормальное поступление всех необходимых веществ, в том числе и фолиевой кислоты. На фоне сбалансированного насыщения организма всеми необходимыми витаминами и микроэлементами организм крыс в условиях длительного избыточного поступления метионина самостоятельно регулировал высокий уровень ГЦ со снижением его до контрольных значений.
Вместо ожидаемого снижения содержания ГЦ в моделях ГГЦ под действием исследуемых фолатов мы получили противоположный эффект. При уже имеющейся ГГЦ уровень ГЦ нарастал от 1-го к 3-му этапу отбора крови. Можно предположить, что метаболические пути регуляции концентрации ГЦ при ГГЦ с учетом избытка фолатной нагрузки оказываются неспособными снизить уровень ГЦ до контрольного, что в целом не противоречит особенностям фолатного цикла, в котором избыток фолиевой кислоты приводит к увеличению уровня дигидрофолата с последующим ингибированием MTHFR [19].
Вероятно, некоторые группы женщин могут попадать под наши условия: хроническая нефолатзависимая ГГЦ. Таким образом, возможно, что дополнительное введение фолатов может неблагоприятно сказаться на метаболической системе таких женщин, и уровень ГЦ будет нарастать вместо ожидаемого снижения.
Женщины во многих странах согласно существующим национальным программам потребляют пищевые продукты, обогащенные синтетической фолиевой кислотой. В преконцепционный период им также назначается профилактическая доза фолиевой кислоты без предварительной оценки фолатного статуса [7].
Несмотря на нормальный уровень фолатов, существует состояние ГГЦ, вызванное другими факторами, например, сидячий образ жизни, избыточное употребление алкоголя и кофеина, курение, недостаток витаминов В6, В12 и D, гипофункция щитовидной железы, почечная недостаточность и т. д. [11].
Вероятно, фортификация продуктов и дополнительное назначение профилактической дозы фолиевой кислоты в прегравидарный период без предварительной оценки показателей метионинового обмена может иметь ряд неблагоприятных эффектов, т. е. возможно, положительный эффект такого вмешательства может оказаться неоднозначным.
Наш эксперимент показал, что полноценное питание крыс способствует нормальному поддержанию уровня фолиевой кислоты в эритроцитах, и дополнительное введении фолатов не приводит к росту ее содержания. Однако у людей в крови обнаружена неметаболизированная фолиевая кислота, которая может накапливаться в организме, и эффекты ее до сих пор малоизвестны [8–11].
Оценка фолатного статуса перед назначением различных форм фолатов, возможно, является необходимым мероприятием для избежания избыточного накопления фолиевой кислоты в организме, а также неблагоприятного влияния на метаболические системы женщин.
Заключение / Conclusion
Хроническая нефолатзависимая ГГЦ, вызванная с помощью постоянного перорального введения метионина, купировалась у экспериментальных моделей самостоятельно, при этом дополнительное добавление фолатов способствовало росту ГЦ в плазме крови.
На экспериментальных моделях крыс с нормальным уровнем фолиевой кислоты в эритроцитах было показано, что добавление в рацион препаратов фолиевой кислоты не приводит к ее дальнейшему накоплению.
Исследование не показало преимуществ 5-МТГФ перед синтетической фолиевой кислотой в отношении снижения уровня ГЦ в плазме крови и накопления фолиевой кислоты в эритроцитах.
Список литературы
1. Seremak-Mrozikiewicz A. Metafolin – alternative for folate deficiency supplementation in pregnant women. Ginekol Pol. 2013;84(7):641–6. https://doi.org/10.17772/gp/1618.
2. Cochrane K.M., Mayer C., Devlin A.M. et al. Is natural (6S)-5-methyltetrahydrofolic acid as effectiveas synthetic folic acid in increasing serum and red blood cell folate concentrations during pregnancy? A proof-of-concept pilot study. Trials. 2020;21(1):380. https://doi.org/10.1186/s13063-020-04320-3.
3. Pietrzik K., Bailey L., Shane B. Folic acid and L-5-methyltetrahydrofolate: comparison of clinical pharmacokinetics and pharmacodynamics. Clin Pharmacokinet. 2010;49(8):535–48. https://doi.org/10.2165/11532990-000000000-00000.
4. Prevention of neural tube defects: results of the Medical Research Council Vitamin Study. Lancet. 1991;338(8760):131–7. https://doi.org/10.1016/0140-6736(91)90133-A.
5. Czeizel A.E., Dudas I., Paput L., Banhidy F. Prevention of neural-tube defects with periconceptional folic acid, methylfolate, or multivitamins? Ann Nutr Metab. 2011;58(4):263–71. https://doi.org/10.1159/000330776.
6. U.S. Preventive Services Task Force. Folic acid for the prevention of neural tube defects: U.S. Preventive Services Task Force recommendation statement. Ann Intern Med. 2009;150(9):626–31. https://doi.org/10.7326/0003-4819-150-9-200905050-00009.
7. Quinn M., Halsey J., Sherliker P. et al. Global heterogeneity in folic acid fortification policies and implications for prevention of neural tube defects and stroke: a systematic review. ЕClinicalMedicine. 2023;67:102366. https://doi.org/10.1016/j.eclinm.2023.102366.
8. Tang J.S., Cait A., White R.M. et al. MR1-dependence of unmetabolized folic acid side-effects. Front Immunol. 2022;3:946713. https://doi.org/10.3389/fimmu.2022.946713.
9. Kalmbach R., Paul L., Selhub J. Determination of unmetabolized folic acid in human plasma using affinity HPLC. Am J Clin Nutr. 2011;94(1):343S–347S. https://doi.org/10.3945/ajcn.111.013433.
10. Chen P., Tang L., Song Y. et al. Association of folic acid dosage with circulating unmetabolized folic acid in Chinese adults with H-type hypertension: a multicenter, double-blind, randomized controlled trial. Front Nutr. 2023;10:1191610. https://doi.org/10.3389/fnut.2023.1191610.
11. Dai C., Fei Y., Li J. A novel review of homocysteine and pregnancy complications. BioMed Res Int. 2021;2021:6652231. https://doi.org/10.1155/2021/6652231.
12. Clare C.E., Brassington A.H., Kwong W.Y., Sinclair K.D. One-carbon metabolism: linking nutritional biochemistry to epigenetic programming of long-term development. Annu Rev Anim Biosci. 2019;7:263–87. https://doi.org/10.1146/annurev-animal-020518-115206.
13. Visentin M., Diop-Bove N., Zhao R., Goldman I.D. The intestinal absorption of folates. Annu Rev Physiol. 2014;76:251–74. https://doi.org/10.1146/annurev-physiol-020911-153251.
14. Duthie S.J., Narayanan S., Blum S. et al. Folate deficiency in vitro induces uracil misincorporation and DNA hypomethylation and inhibits DNA excision repair in immortalized normal human colon epithelial cells. Nutr Cancer. 2000;37(2):245–51. https://doi.org/10.1207/S15327914NC372_18.
15. Kelly P., McPartlin J., Goggins M. et al. Unmetabolized folic acid in serum: acute studies in subjects consuming fortified food and supplements. Am J Clin Nutrition. 1997;65(6):1790–5. https://doi.org/10.1093/ajcn/65.6.1790.
16. Shane B. Folate chemistry and metabolism. In: Folate in health and disease. Ed. L. Bailey. N.Y.: Marcel Dekker, 2017. 1–22.
17. Matherly L.H., Goldman D.I. Membrane transport of folates. Vitam Horm. 2003;66:403–56. https://doi.org/10.1016/s0083-6729(03)01012-4.
18. Koury M.J., Ponka P. New insights into erythropoiesis: the roles of folate, vitamin B12, andiron. Annu Rev Nutr. 2004;24:105–31. https://doi.org/10.1146/annurev.nutr.24.012003.132306.
19. Керкешко Г.О., Арутюнян А.В., Аржанова О.Н., Милютина Ю.П. Оптимизация терапии фолатами при осложнениях беременности. Журнал акушерства и женских болезней. 2013;62(6):25–36.
20. Hoss G.R.W., Sperb-Ludwig F., Schwartz I.V.D, Blom H.J. Classical homocystinuria: a common inborn error of metabolism? An epidemiological study based on genetic databases. Mol Genet Genomic Med. 2020;8(6):1214. https://doi.org/10.1002/mgg3.1214.
21. Korokin M.V., Pokrovskiy M.V., Novikov O.O. et al. A model of hyperhomocysteine-induced endothelial dysfunction in rats. Bull Exp Biol Med. 2011;152(2):213–5. https://doi.org/10.1007/s10517-011-1491-9.
22. Zhuo J.M., Praticò D. Normalization of hyperhomocysteinemia improves cognitive deficits and ameliorates brain amyloidosis of a transgenic mouse model of Alzheimer’s disease. FASEB J. 2010;24(10):3895–902. https://doi.org/10.1096/fj.10-161828.
23. Милютина Ю.П., Пустыгина А.В., Щербицкая А.Д. и др. Сравнение показателей окислительного стресса в сыворотке крови крыс при различных моделях гипергомоцистеинемии. Acta Biomedica Scientifica. 2016;1(3–2):120–3.
24. Зильфян В.Н., Кумкумаджян В.А. Новый метод взятия крови у мелких лабораторных животных. Журнал экспериментальной и клинической медицины. 1970:10(4):12–4.
Об авторах
А. П. СазоноваРоссия
Сазонова Анастасия Павловна
99034 Санкт-Петербург, Менделеевская линия, д. 3
Scopus Author ID: 58729079700. WoS ResearcherID: KIL-6249-2024
Ю. П. Милютина
Россия
Милютина Юлия Павловна, к.б.н.
99034 Санкт-Петербург, Менделеевская линия, д. 3
Scopus Author ID: 24824836300. WoS ResearcherID: ААЕ-6182-2019
О. Н. Беспалова
Россия
Беспалова Олеся Николаевна, д.м.н.
99034 Санкт-Петербург, Менделеевская линия, д. 3
Scopus Author ID: 57189999252. WoS ResearcherID: D-3880-2018
О. В. Пачулия
Россия
Пачулия Ольга Владимировна, к.м.н.
99034 Санкт-Петербург, Менделеевская линия, д. 3
Scopus Author ID: 57299197900. WoS ResearcherID: Q-7819-2018
И. В. Залозняя
Россия
Залозняя Ирина Владимировна
99034 Санкт-Петербург, Менделеевская линия, д. 3
Scopus Author ID: 56510246800. WoS ResearcherID: ABB-7622-2020
А. В. Кореневский
Россия
Кореневский Андрей Валентинович, д.б.н.
99034 Санкт-Петербург, Менделеевская линия, д. 3
Scopus Author ID: 6037015200. WoS ResearcherID: K-3444-2013
Что уже известно об этой теме?
► Два наиболее изученных полиморфизма в гене MTHFR – c.665C>T и c.1286A>C являются причинами умеренной гипергомоцистеинемии (ГГЦ) в условиях дефицита фолиевой кислоты. Нормализация уровня фолиевой кислоты при данной патологии позволяет снизить уровень гомоцистеина (ГЦ) в плазме крови до оптимального.
► Существуют синтетическая и восстановленная формы фолиевой кислоты (5-метилтетрагидрофолат, 5-МТГФ). Гипотетически 5-МТГФ преодолевает метаболические дефекты, вызванные полиморфизмом в гене MTHFR, в связи с чем его применение имеет преимущества перед синтетической фолиевой кислотой. Однако крупных работ, подтверждающих данное предположение, не проводилось.
► На протяжении последних 30 лет женщины во многих странах согласно национальным программам потребляют продукты, фортифицированные синтетической фолиевой кислотой. Однако существуют опасения по поводу отдаленных эффектов неметаболизированной фолиевой кислоты, которые до сих пор остаются малоизученными.
Что нового дает статья?
► Впервые используется экспериментальная модель крыс линии Wistar для оценки влияния применения фолиевой кислоты и ее производных на метиониновый обмен.
► В эксперименте на крысах линии Wistar преимущества 5-МТГФ перед синтетической фолиевой кислотой в отношении снижения уровня ГЦ в плазме и накопления фолиевой кислоты в эритроцитах не обнаружены.
► Хроническая нефолатзависимая ГГЦ, развившаяся у экспериментальных моделей крыс путем постоянного перорального введения метионина, не купировалась добавлением фолатов. Напротив, в данных условиях мы обнаружили прирост уровня ГЦ в плазме крови.
Как это может повлиять на клиническую практику в обозримом будущем?
► Оценка фолатного статуса перед назначением различных форм фолатов, возможно, является необходимым мероприятием для избежания избыточного накопления фолиевой кислоты в организме, а также неблагоприятного влияния на метаболические системы женщин.
► Хроническая нефолатзависимая умеренная ГГЦ требует детального исследования фолатного статуса и образа жизни женщин во избежание излишнего назначения фолатов.
► В нашем эксперименте было показано, что на фоне оптимального питания крыс линии Wistar при добавлении фолатов накопления фолиевой кислоты в эритроцитах и плазме крови не происходит. Фортификация продуктов синтетической фолиевой кислотой, возможно, имеет неоднозначные эффекты.
Рецензия
Для цитирования:
Сазонова А.П., Милютина Ю.П., Беспалова О.Н., Пачулия О.В., Залозняя И.В., Кореневский А.В. Влияние синтетической и восстановленной формы фолиевой кислоты на показатели метионинового обмена в эксперименте на различных моделях крыс линии Wistar. Акушерство, Гинекология и Репродукция. 2024;18(5):658–666. https://doi.org/10.17749/2313-7347/ob.gyn.rep.2024.517
For citation:
Sazonova A.P., Milyutina Yu.P., Bespalova O.N., Pachuliia O.V., Zalozniaia I.V., Korenevsky A.V. Effect of synthetic and reduced folic acid on methionine metabolism parameters in various experimental models with Wistar rats. Obstetrics, Gynecology and Reproduction. 2024;18(5):658–666. (In Russ.) https://doi.org/10.17749/2313-7347/ob.gyn.rep.2024.517

Контент доступен под лицензией Creative Commons Attribution-NonCommercial-ShareAlike 4.0 International License.










































