Перейти к:
Показатели гемостаза после хирургического лечения наружного генитального эндометриоза
https://doi.org/10.17749/2313-7347/ob.gyn.rep.2024.575
Аннотация
Введение. Эндометриоз является одним из распространенных заболеваний с не до конца проясненными природой возникновения и патогенетическими механизмами. Исследования указывают на наличие нарушений в системе гемостаза у женщин с этим заболеванием. При этом характер выраженности данных изменений и их природа остаются предметом дискуссии.
Цель: изучить особенности динамики отдельных показателей системы гемостаза у пациенток, перенесших хирургическое лечение наружного генитального эндометриоза (НГЭ).
Материалы и методы. В проспективное интервенционное сравнительное контролируемое исследование были включены в общей сложности 120 участниц: 40 пациенток с НГЭ, которым назначено хирургическое лечение (основная группа), 40 пациенток с другими доброкачественными гинекологическими заболеваниями, требующих хирургического вмешательства (группа сравнения), и 40 практически здоровых женщин (контрольная группа). Диапазон возраста участниц исследования составил 18–45 лет. Оценку состояния системы гемостаза проводили по результатам трех визитов в течение 3 месяцев наблюдения с помощью следующих биомаркеров: содержание металлопротеиназы ADAMTS-13 (англ. a disintegrin and metalloproteinase with thrombospondin type 1 motif, member 13), фактора фон Виллебранда (англ. von Willebrand factor, vWF), D-димера, протеина С, антитромбина III (АТ-III), значения активированного частичного тромбопластинового времени (АЧТВ) и Парус-теста.
Результаты. У женщин с НГЭ до проведения хирургического лечения наблюдали субклиническое, но статистически значимое по сравнению с другими группами увеличение концентраций прокоагуляционных биомаркеров: vWF – 1,24 [1,17–1,35] ЕД/мл и D-димера – 173,5 [73,5–221,23] нг/мл. Оценка остальных показателей не показала существенной клинической значимости наблюдаемых изменений. Проведенное хирургическое вмешательство сопровождалось повышением уровня отдельных прокоагуляционных факторов спустя одну неделю после лечения, что, по всей видимости, связано с хирургическими манипуляциями. Спустя 3 месяца состояние системы гемостаза частично нормализовалось, на что указывало снижение содержания изучаемых биомаркеров, которое в отдельных случаях было статистически значимо ниже по отношению к значениям в той же группе до хирургического вмешательства. В то же время различия между исследуемыми группами оставались статистически значимыми.
Заключение. У больных с НГЭ отмечен риск тромбообразования, носящий субклинический характер. При этом хирургическое лечение и реабилитация в восстановительном периоде позволили в целом улучшить состояние системы гемостаза, тем самым снизив риск тромбообразования.
Ключевые слова
Для цитирования:
Байгалмаа Б., Бицадзе В.О., Солопова А.Г., Ефанов А.Е., Войновский А.Е. Показатели гемостаза после хирургического лечения наружного генитального эндометриоза. Акушерство, Гинекология и Репродукция. 2024;18(5):648–657. https://doi.org/10.17749/2313-7347/ob.gyn.rep.2024.575
For citation:
Baigalmaa B., Bitsadze V.O., Solopova A.G., Efanov A.E., Voynovskiy A.Е. External genital endometriosis post-surgery hemostasis parameters. Obstetrics, Gynecology and Reproduction. 2024;18(5):648–657. (In Russ.) https://doi.org/10.17749/2313-7347/ob.gyn.rep.2024.575
Введение / Introduction
Согласно информации, опубликованной в бюллетене Всемирной организации здравоохранения в 2023 г. [1], а также в исследовании P.A.W. Rogers с соавт. [2], примерно 10 % женщин репродуктивного возраста страдают от различных форм эндометриоза. В то же время ряд других исследовательских групп в проведенных эпидемиологических исследованиях разных лет указали частоту встречаемости заболевания до 1,5 % среди женщин в отдельных странах [3–6]. Несмотря на достаточно высокий разброс встречаемости эндометриоза, представленные данные указывают на актуальность проведения исследований, посвященных изучению особенностей течения и коррекции эндометриоза.
В основе данного заболевания лежит разрастание скоплений эктопических клеток эндометрия, при этом активация их роста зачастую совпадает с периодом от менархе до менопаузы [1]. Первые попытки понять природу эндометриоза были предприняты еще в начале прошлого столетия. Так, J.A. Sampson выдвинул предположение, что появление эктопических скоплений клеток эндометрия происходит благодаря выбросу фрагментов ткани из матки через фаллопиевы трубы [7]. Следующие предложенные теории связывали риск появления эндометриоза с особенностями развития в пренатальном и раннем постнатальном периоде [8][9]. Тем самым в научном сообществе имеется общее понимание причины возникновения заболевания, но более тонкие механизмы патогенеза остаются предметом дискуссии.
Проведен сравнительно большой массив клинических исследований, посвященных изучению особенностей патогенеза эндометриоза, в том числе и развитию коагулопатии у пациентов с различными формами эндометриоза [10–12]. Так, в ряде исследований у пациенток с данным заболеванием наблюдали развитие тромбоцитоза, сокращение продолжительности активированного частичного тромбопластинового времени (АЧТВ), протромбинового времени, тромбинового времени и изменение ряда тромбоцитарных индексов (тромбокрит, средний объем тромбоцита). В то же время отдельные исследовательские группы в своих работах указали на отсутствие обозначенных изменений или диагностической значимости данных биомаркеров [13–19]. Тем самым научное сообщество на текущий момент не пришло к единой позиции в понимании характера и выраженности течения коагулопатии у женщин с эндометриозом.
Рассматривая отдельные формы эндометриоза, особенно актуальной представляется болевая форма наружного генитального эндометриоза (НГЭ). Данная форма заболевания характеризуется следующими изменениями: хронические выраженные тазовые боли, снижение физической и социальной активности, расстройства настроения [20][21]. Указанные симптомы при отсутствии эффективной медицинской и психологической поддержки могут существенно снижать качество жизни и приводить к появлению суицидальных наклонностей [21].
Совокупность обозначенных проблем, в частности широкая распространенность заболевания, неоднозначные результаты клинических исследований оценки изменений в системе гемостаза, а также необходимость коррекции состояния пациенток с отдельными формами эндометриоза, определяют цель исследования.
Цель: изучить особенности динамики отдельных показателей системы гемостаза у пациенток, перенесших хирургическое лечение НГЭ.
Материалы и методы / Materials and Methods
Дизайн исследования / Study design
В проспективное интервенционное сравнительное контролируемое исследование были включены в общей сложности 120 участниц в возрасте 18–45 лет: основная группа – пациентки с подтвержденным НГЭ, требующий хирургического вмешательства (n = 40); группа сравнения – пациентки с иной доброкачественной гинекологической патологией, требующей хирургического лечения (n = 40); контрольная группа – практически здоровые женщины (n = 40). Хирургическое лечение предусматривало пангистерэктомию или двустороннюю аднексэктомию с удалением очагов НГЭ и других патологических тканей.
Динамику состояния пациенток основной группы и группы сравнения оценивали по результатам трех посещений в следующие контрольные точки: посещение I – до проведения хирургического лечения; посещение II – через 1 неделю после проведенного лечения; посещение III – через 3 месяца после проведения хирургического вмешательства. Среди участниц из контрольной группы оценку состояния здоровья проводили через аналогичные промежутки времени при посещении врача. Какого-либо хирургического лечения женщины из группы контроля в период наблюдения не проходили.
Критерии включения и исключения / Inclusion and exclusion criteria
Критерии включения: женщины в возрасте ≥ 18 и ≤ 50 лет с хирургически и морфологически подтвержденным диагнозом «наружный генитальный эндометриоз» III–IV степени для пациенток основной группы; женщины в возрасте ≥ 18 и ≤ 50 лет с доброкачественными новообразованиями гинекологической направленности (функциональные кисты яичника, дермоидные кисты яичника, кисты желтого тела) для пациенток группы сравнения; практически здоровые женщины в возрасте ≥ 18 и ≤ 50 лет, у которых не наблюдали гинекологических заболеваний, для участниц контрольной группы; пациентки, подписавшие информированное добровольное согласие.
Критерии исключения: отсутствие возможности верификации диагноза и динамического мониторинга состояния здоровья на всех этапах проведения исследования с учетом конкретной клинической ситуации; послеоперационные осложнения; отказ от участия в исследовании.
Методы исследования / Study methods
На каждом посещении проводили проверку пациентов на наличие критериев исключения из исследования, сбор анамнеза, клиническую беседу, физикальное и инструментальное обследование, гинекологический осмотр. Также пациентки консультировались терапевтом и реабилитологом по поводу их текущего состояния здоровья. Проводили клинико-лабораторное исследование для оценки состояния системы гемостаза с помощью следующих биомаркеров в плазме крови: содержание металлопротеиназы ADAMTS-13 (англ. a disintegrin and metalloproteinase with thrombospondin type 1 motif, member 13), фактора фон Виллебранда (англ. von Willebrand factor, vWF), D-димера, протеина С, антитромбина III (АТ-III), значения АЧТВ и Парус-теста.
Концентрацию ADAMTS-13, vWF, протеина С определяли методом иммуноферментного анализа с помощью готовых наборов ELISA, уровень D-димера – методом «усиленного» латексного иммуноанализа, концентрацию AT-III – в хромогенном тесте с помощью прибора Ceveron alpha (Techoclone GmbH, Австрия). Продолжительность АЧТВ и значение Парус-теста определяли с помощью прибора CoaDATA 4004 (Labitec, Германия).
Методы статистического анализа / Statistical analysis
Анализ данных не выявил нормального распределения при проверке выборок критерием Шапиро–Уилка, как следствие, дальнейшую статистическую обработку данных проводили с помощью непараметрических критериев. Проведение межгруппового сравнения было осуществлено при помощи теста Краскела–Уоллиса и критерия Данна, сравнение с исходными значениями – при помощи теста Вилкоксона. Различия между группами и с исходными значениями считали значимыми при p < 0,05. Данные в таблицах представлены в виде медианы, первого и третьего квартилей (Ме [Q1; Q3]), в рисунках – медианы и межквартильного размаха (Ме [Q1–Q3]).
Результаты / Results
Клинико-анамнестические данные / Clinical and anamnestic data
Оценка клинико-анамнестических данных не выявила каких-либо выраженных особенностей, характерных для женщин с НГЭ; отмечена примерно равная частота встречаемости отягощенного преморбидного фона различных видов среди участниц исследования (табл. 1).
Таблица 1. Характеристики преморбидного фона у участниц исследования.
Table 1. Premorbid background characteristics in study participants.
|
Показатель Parameter |
Контрольная группа Control group n = 40 |
Группа сравнения Comparison group n = 40 |
Основная группа Main group n = 40 |
|
Артериальная гипертензия, n (%) |
5 (12,50) |
6 (15,00) |
5 (12,50) |
|
Варикозная болезнь нижних конечностей, n (%) |
6 (15,00) |
3 (7,5) |
5 (12,5) |
|
Гипотиреоз, n (%) |
3 (7,5) |
4 (10,0) |
3 (7,5) |
|
Желчнокаменная болезнь, n (%) |
1 (2,5) |
1 (2,5) |
3 (7,5) |
|
Мочекаменная болезнь, n (%) |
2 (5,0) |
2 (5,0) |
4 (10,0) |
|
Сахарный диабет 2-го типа, n (%) |
3, (7,5) |
4 (10,0) |
3 (7,5) |
|
Хронический бронхит, n (%) |
3 (7,5) |
4 (10,0) |
– |
|
Хронический гастрит, n (%) |
2 (5,0) |
2 (5,0) |
1 (2,5) |
|
Хронический пиелонефрит, n (%) |
2 (5,0) |
5 (12,50) |
– |
|
Язвенная болезнь желудка, n (%) |
3 (7,5) |
3 (7,5) |
5 (12,50) |
Биомаркеры системы свертывания крови / Blood coagulation system biomarkers
Проведенный клинико-лабораторный анализ уровня основных биомаркеров системы свертывания крови позволил выявить наличие коагулопатии у женщин с НГЭ (табл. 2, рис. 1, 2).
Таблица 2. Биомаркеры системы свертывания крови.
Table 2. Blood coagulation system biomarkers.
|
Показатель Ме [ Q1; Q3] |
Посещение Visit |
Контрольная группа Control group n = 40 |
Группа сравнения Comparison group n = 40 |
Основная группа Main group n = 40 |
|
ADAMTS-13, МЕ/мл ADAMTS-13, IU/ml |
I |
0,64 [ 0,57; 0,70] |
0,66 [ 0,53; 0,75] |
0,74 [ 0,67; 0,82] |
|
II |
0,65 [ 0,60; 0,68] |
0,57 [ 0,47; 0,65] |
0,65 [ 0,57; 0,75]#▲ |
|
|
III |
0,59 [ 0,51; 0,66]▲ |
0,65 [ 0,57; 0,70] |
0,97 [ 0,69; 1,11] |
|
|
vWF, ЕД/мл vWF, U/ml |
I |
0,75 [ 0,61; 0,82] |
0,81 [ 0,70; 0,90] |
1,24 [ 1,17; 1,35] |
|
II |
0,44 [ 0,38; 0,52]▲ |
0,79 [ 0,67; 0,91] |
1,35 [ 1,25; 1,53] |
|
|
III |
0,80 [ 0,74; 0,87]▲ |
0,83 [ 0,69; 0,94] |
1,21 [ 1,09; 1,32] |
|
|
АЧТВ, с АPTT, s |
I |
28,70 [ 27,10; 29,70] |
29,50 [ 28,35; 30,83] |
37,75 [ 36,83; 38,78] |
|
II |
28,30 [ 27,38; 29,50] |
32,00 [ 30,00; 34,25] |
38,65 [ 36,93; 40,00] |
|
|
III |
28,95 [ 27,68; 29,93] |
30,30 [ 28,58; 31,95] |
35,00 [ 33,90; 36,20] |
|
|
D-димер, нг/мл D-dimer, ng/ml |
I |
47,25 [ 29,75; 69,63] |
53,20 [ 29,30; 71,70] |
173,50 [ 73,50; 221,23] |
|
II |
48,95 [ 23,93; 83,7] |
131,62 [ 99,4; 164,8] |
329,70 [ 255,73; 390,48] |
|
|
III |
37,85 [ 24,85; 47,58]▲ |
42,90 [ 26,25; 53,63]▲ |
98,90 [ 76,63; 126,7] |
|
|
AT-III, % |
I |
98,37 [ 78,48; 107,98] |
86,79 [ 66,30; 98,28] |
115,35 [ 109,05; 122,88] |
|
II |
87,75 [ 75,78; 96,03]▲ |
88,75 [ 78,03; 99,55] |
100,45 [ 90,20; 114,18] |
|
|
III |
97,45 [ 83,68; 109,53] |
89,4 [ 81,58; 101,85]▲ |
113,65 [ 107,43; 119,83] |
Примечание: ADAMTS-13 – металлопротеиназа; vWF – фактор фон Виллебранда; АЧТВ – активированное частичное тромбоплатиновое время; AT-III – антитромбин-III,  p < 0,05 – различия статистически значимы по сравнению с контрольной группой; #p < 0,05 – различия статистически значимы по сравнению с группой сравнения; ▲p < 0,05 – различия статистически значимы по сравнению с исходными значениями.
p < 0,05 – различия статистически значимы по сравнению с контрольной группой; #p < 0,05 – различия статистически значимы по сравнению с группой сравнения; ▲p < 0,05 – различия статистически значимы по сравнению с исходными значениями.
Note: ADAMTS-13 – metalloproteinase; vWF – von Willebrand factor; APTT – activated partial thromboplatin time; AT-III – antithrombin-III,  p < 0.05 – significant differences compared to control group; #p < 0.05 – significant differences compared to comparison group; ▲p < 0.05 – significant differences compared to baseline values.
p < 0.05 – significant differences compared to control group; #p < 0.05 – significant differences compared to comparison group; ▲p < 0.05 – significant differences compared to baseline values.
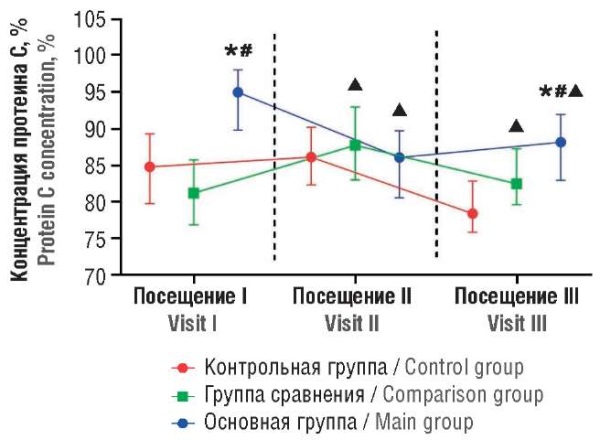
Рисунок 1. Динамика концентрации протеина С.
Примечание:  p < 0,05 – различия статистически значимы по сравнению с контрольной группой; #p < 0,05 – различия статистически значимы по сравнению с группой сравнения; ▲p < 0,05 – различия статистически значимы по сравнению с исходными значениями.
p < 0,05 – различия статистически значимы по сравнению с контрольной группой; #p < 0,05 – различия статистически значимы по сравнению с группой сравнения; ▲p < 0,05 – различия статистически значимы по сравнению с исходными значениями.
Figure 1. Temporal protein C concentration alterations.
Note:  p < 0.05 – significant differences compared to control group; #p < 0.05 – significant differences compared to comparison group; ▲p < 0.05 – significant differences compared to baseline values.
p < 0.05 – significant differences compared to control group; #p < 0.05 – significant differences compared to comparison group; ▲p < 0.05 – significant differences compared to baseline values.
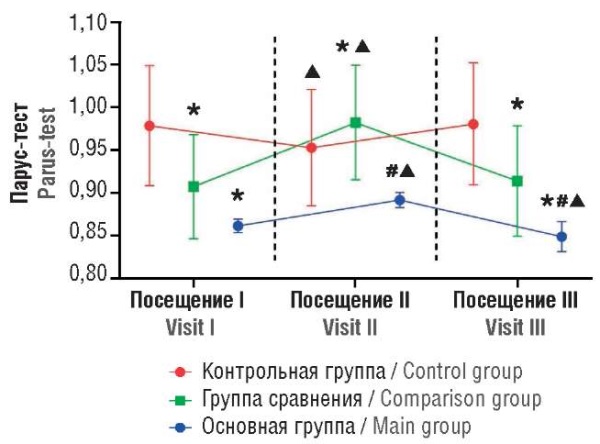
Рисунок 2. Динамика значения Парус-теста.
Примечание:  p < 0,05 – различия статистически значимы по сравнению с контрольной группой; #p < 0,05 – различия статистически значимы по сравнению с группой сравнения; ▲p < 0,05 – различия статистически значимы по сравнению с исходными значениями.
p < 0,05 – различия статистически значимы по сравнению с контрольной группой; #p < 0,05 – различия статистически значимы по сравнению с группой сравнения; ▲p < 0,05 – различия статистически значимы по сравнению с исходными значениями.
Figure 2. Temporal Parus-test alterations.
Note:  p < 0.05 – significant differences compared to control group; #p < 0.05 – significant differences compared to comparison group; ▲p < 0.05 – significant differences compared to baseline values.
p < 0.05 – significant differences compared to control group; #p < 0.05 – significant differences compared to comparison group; ▲p < 0.05 – significant differences compared to baseline values.
До проведения хирургического вмешательства у пациенток основной группы наблюдали слабовыраженное, но статистически значимое увеличение содержания ADAMTS-13, протеина С и значения Парус-теста по сравнению с аналогичными показателями у женщин из группы сравнения и контрольной группы. В то же время у пациенток с НГЭ (в основной группе) отметили выраженное и статистически значимое увеличение концентрации vWF до 1,24 [ 1,17; 1,35] ЕД/мл, в то время как в группе сравнения уровень vWF составлял 0,81 [ 0,70; 0,90] ЕД/мл, в контрольной – 0,75 [ 0,61; 0,82] ЕД/мл (p < 0,05); содержание D-димера в основной группе достигало 173,5 [ 73,5; 221,23] нг/мл, при этом в группе сравнения – 53,20 [ 29,30; 71,70] нг/мл, в контрольной – 47,25 [ 29,75; 69,63] нг/мл (p < 0,05); значения AT-III в основной группе составляли 115,35 [ 109,05; 122,88] %, в группе сравнения – 86,79 [ 66,30; 98,28] %, в контрольной группе – 98,37 [ 78,48; 107,98] %, соответственно (p < 0,05).
Через 1 неделю (при посещении II) после проведенного хирургического вмешательства у пациенток из основной группы отмечено статистически значимое снижение концентрации антигена ADAMTS-13, протеина С и AT-III по сравнению с исходными значениями. Среди участниц с НГЭ при посещении II отметили существенный рост уровня vWF, D-димера и значения Парус-теста. Различия между группами участниц исследования оставались статистически значимыми.
Спустя 3 месяца после хирургического лечения НГЭ (при посещении III) у женщин основной группы отмечено статистически значимое (p < 0,05) увеличение концентрации ADAMTS-13 (до 0,97 [ 0,69; 1,11] МЕ/мл) по отношению к исходным значениям (по сравнению с посещением I). В то же время у пациенток из основной группы наблюдали статистически значимое сокращение значений АЧТВ, уменьшение концентраций протеина С, D-димера и значения Парус-теста по сравнению с исходными данными. По окончании периода наблюдения различия между женщинами из основной группы и участницами из контрольной группы или группы сравнения сохранялись.
Обсуждение / Discussion
Коагулопатии вне зависимости от характера являются одними из тяжелых осложнений множества заболеваний как при сахарном диабете 2-го типа, аутоиммунных заболеваний, так и в течение инфекционного процесса и ряда гинекологических заболеваний [22–25]. Справедливым будет отметить, что отсутствие должной коррекции выявленного осложнения в достаточно скором времени приводит к появлению у пациентов жизнеугрожающих состояний. По этой причине понимание патогенетического механизма нарушения нормальной работы системы свертывания крови при эндометриозе является предельно важным аспектом как в раскрытии тонких механизмов патогенеза заболевания, так и ведения пациентов на этапе лечения и реабилитации.
Анализ полученных результатов показал отсутствие взаимосвязи между отягощенным преморбидным фоном и НГЭ, что, по нашему мнению, вполне ожидаемо. Как было ранее обозначено, риск развития эндометриоза в первую очередь связан с выходом клеток эндометрия из анатомически правильного местоположения через фаллопиевы трубы в брюшную полость [7]. В данном случае наличие преморбидного фона не имеет очевидной и подтвержденной связи с НГЭ.
Оценка биомаркеров системы гемостаза у женщин с НГЭ, проведенная в рамках текущего исследования, безусловно, указала на наличие коагулопатии у пациенток с изучаемым заболеванием. В то же время описанные выше результаты требуют дополнительной оценки клинической значимости наблюдаемой динамики и выявленных различий. Оценка клинической значимости в рамках данного исследования включала дополнительное сравнение полученных усредненных значений с референсными значениями, определяющих клиническую норму. Данный шаг позволяет существенно повысить ценность полученных выводов путем нивелирования выявленных статистически значимых различий между показателями, которые, тем не менее, в каждой из групп находились в пределах клинической нормы.
Оценка концентрации ADAMTS-13, металлопротеиназы, участвующей в регулировании vWF, среди женщин, участвующих в исследовании, выявило, что все полученные значения находились в пределах референсного диапазона (0,41–1,41 МЕ/мл) в течение всего периода наблюдения [26]. Тем самым обозначенные в результатах статистически значимые различия между группами и от посещения к посещению внутри групп, по всей видимости, имеют низкую клиническую значимость. Оценка уровня vWF среди пациенток с НГЭ указала на выраженный рост показателя по сравнению с наблюдаемым у женщин из остальных групп. Однако усредненные значения находились в пределах верхней границы референсного диапазона (0,5–1,50 ЕД/мл), что также несколько снижает клиническую ценность наблюдения. В то же время сочетанная динамика увеличения значений ADAMTS-13 и vWF, по всей видимости, указывает на компенсированную форму процессов тромбообразования и по этой причине носящее субклинический характер.
Оценка динамики концентрации протеина С и результата Парус-теста указала на слабовыраженный характер наблюдаемых изменений у пациенток с НГЭ как по отношению к показателям у других участниц исследования, так и по отношению к исходным значениям. К определенному характеру изменений необходимо добавить, что все наблюдаемые значения оцениваемых показателей находились в пределах референсных значений (70–130 % для концентрации протеина С и не менее 0,7 для нормализованного значения Парус-теста). Тем самым отмеченные изменения уровня протеина С и результата Парус-теста имеют низкую клиническую значимость.
Несколько противоречиво выглядят измеренные значения АТ-III и АЧТВ. Согласно полученным данным, у женщин с НГЭ выявлено выраженное увеличение продолжительности АЧТВ и уровня АТ-III по отношению к этим показателям у других участниц исследования. Важным будет заметить, что увеличение значений обозначенных показателей указывает на риск развития кровотечений, связанных с гипофункцией системы гемостаза. Однако, усредненные значения указанных показателей находились в районе верхней границы референсного диапазона (24–35 секунд для АЧТВ и 80–120 % для АТ-III). Тем самым упомянутые ранее статистически значимые различия, по всей видимости, имеют низкую клиническую значимость. Представленные результаты расходятся с данными, полученными исследовательскими группами Р. Vigano с соавт. [18], Q. Wu с соавт. [19], К. Zhao с соавт. [27] и Х. Ling с соавт. [28], в которых показано сокращение продолжительности АЧТВ при эндометриозе. Подробное рассмотрение упомянутых исследований позволило выявить различия в их дизайнах по сравнению с текущим. Р. Vigano с соавт. [18] и Х. Ling с соавт. [28] изучили состояние системы свертывания крови у женщин с эндометриозом без указания видов эндометриоза. В свою очередь, Q. Wu с соавт. [19], К. Zhao с соавт. [27] изучили состояние системы гемостаза у женщин с эндометриозом яичников. Исходя из указанного, можно предположить, что сокращение АЧТВ, представленное в исследованиях, либо имеет отношение к эндометриозу яичников, либо результаты были получены преимущественно у женщин с данным видом эндометриоза, что в определенной степени соотносится с данными о высоком риске развития тромбоза у пациенток с новообразованиями в яичниках [29–31]. По этой причине требуется дополнительное подтверждение полученных результатов для выяснения, является ли наблюдаемое удлинение АЧТВ характерным для течения НГЭ, или же полученные результаты в текущем исследовании не имели клинической значимости.
В то же время наблюдали приблизительно 3–5-кратное увеличение концентрации D-димера, указывающее на процесс тромбообразования, у пациенток с эндометриозом по сравнению с показателем у женщин из других групп [32]. Несмотря на обозначенное увеличение изучаемого показателя, превышение референсных значений (до 250 нг/мл) D-димера соотносилось только с проведением хирургического вмешательства.
Таким образом, на основании полученных результатов и последующей оценки клинической значимости наблюдаемых изменений можно указать на наличие коагулопатии у пациенток с НГЭ. При этом нарушение со стороны системы свертывания крови проявлялось преимущественно субклинической формой процесса тромбообразования. В свою очередь проведенная терапия показала некоторое улучшение состояния системы гемостаза спустя 3 месяца после проведенной терапии, однако изучаемые показатели у пациенток с НГЭ оставались существенно выше по сравнению с аналогичными оцениваемыми параметрами системы свертывания крови среди остальных участниц исследования.
Заключение / Conclusion
Эндометриоз до сих пор остается одним из немногих хронических гинекологических заболеваний, которое имеет сравнительно высокую распространенность и невыясненный механизм возникновения заболевания и течения патологических изменений. Проведенное исследование было направлено на изучение состояния гемостаза у пациенток с НГЭ после хирургического лечения. Полученные результаты определили риск тромбообразования у пациенток данного профиля, на что указывало субклиническое увеличение содержания прокоагуляционных биомаркеров в крови.
Хирургическое вмешательство способствовало нормализации состояния системы свертывания крови у женщин с НГЭ. Однако исследованные показатели к концу наблюдения все еще существенно отличались от таковых у женщин с другими доброкачественными гинекологическими заболеваниями или практически здоровых участниц исследования. По всей видимости, требуется дополнительное исследование для оценки изменения системы гемостаза на более длительном промежутке времени или оценки целесообразности использования лекарственных средств коррекции гемостаза у женщин, перенесших хирургическое лечение НГЭ.
Список литературы
1. Эндометриоз. Всемирная организация здравоохранения, 2023. Режим доступа: https://www.who.int/news-room/fact-sheets/detail/endometriosis. [Дата обращения: 12.09.2024].
2. Rogers P.A.W., D’Hooghe T.M., Fazleabas A. et al. Priorities for endometriosis research: recommendations from an international consensus workshop. Reprod Sci. 2009;16(4):335–46. https://doi.org/10.1177/1933719108330568.
3. Abbas S., Ihle P., Köster I., Schubert I. Prevalence and incidence of diagnosed endometriosis and risk of endometriosis in patients with endometriosis-related symptoms: findings from a statutory health insurance-based cohort in Germany. Eur J Obstet Gynecol Reprod Biol. 2012;160(1):79–83. https://doi.org/10.1016/j.ejogrb.2011.09.041.
4. Ballard K.D., Seaman H.E., de Vries C.S., Wright J.T. Can symptomatology help in the diagnosis of endometriosis? Findings from a national case-control study – Part 1. BJOG. 2008;115(11):1382–91. https://doi.org/10.1111/j.1471-0528.2008.01878.x.
5. Eisenberg V.H., Weil C., Chodick G., Shalev V. Epidemiology of endometriosis: a large population-based database study from a healthcare provider with 2 million members. BJOG. 2018;125(1):55–62. https://doi.org/10.1111/1471-0528.14711.
6. Pugsley Z., Ballard K. Management of endometriosis in general practice: the pathway to diagnosis. Br J Gen Pract. 2007;57(539):470–6.
7. Sampson J.A. Peritoneal endometriosis due to the menstrual dissemination of endometrial tissue into the peritoneal cavity. Am J Obstet Gynecol. 1927;14(4):422–69. https://doi.org/10.1016/S0002-9378(15)30003-X.
8. Brosens I., Benagiano G. Is neonatal uterine bleeding involved in the pathogenesis of endometriosis as a source of stem cells? Fertil Steril. 2013;100(3):622–3. https://doi.org/10.1016/j.fertnstert.2013.04.046.
9. Burney R.O., Giudice L.C. Pathogenesis and pathophysiology of endometriosis. Fertil Steril. 2012;98(3):511–9. https://doi.org/10.1016/j.fertnstert.2012.06.029.
10. Brosens I.A. Endometriosis – a disease because it is characterized by bleeding. Am J Obstet Gynecol. 1997;176(2):263–7. https://doi.org/10.1016/s0002-9378(97)70482-4.
11. Sharma R.P., Delly F., Marin H., Sturza S. Endometriosis causing lower extremity deep vein thrombosis – case report and review of the literature. Int J Angiol. 2011;18(4):199–202. https://doi.org/10.1055/s-0031-1278354.
12. Chiaramonte R., Castorina S., Castorina E.G. et al. Thrombosis of iliac vessels, a rare complication of endometriosis: Case report and review of literature. J Adv Res. 2017;8(1):1–5. https://doi.org/10.1016/j.jare.2016.10.007.
13. Ding D., Liu X., Guo S.W. Further evidence for hypercoagulability in women with ovarian endometriomas. Reprod Sci. 2018;25(11):1540–8. https://doi.org/10.1177/1933719118799195.
14. Ding S., Lin Q., Zhu T. et al. Is there a correlation between inflammatory markers and coagulation parameters in women with advanced ovarian endometriosis? BMC Womens Health. 2019;19:169. https://doi.org/10.1186/s12905-019-0860-9.
15. Chen Z.Y., Zhang L.F., Zhang Y.Q. et al. Blood tests for prediction of deep endometriosis: а case-control study. World J Clin Cases. 2021;9(35):10805–15. https://doi.org/10.12998/wjcc.v9.i35.10805.
16. Seckin B., Ates M.C., Kirbas A., Yesilyurt H. Usefulness of hematological parameters for differential diagnosis of endometriomas in adolescents/young adults and older women. Int J Adolesc Med Health. 2018;33(2). https://doi.org/10.1515/ijamh-2018-0078.
17. Turgut A., Hocaoglu M., Ozdamar O. et al. Could hematologic parameters be useful biomarkers for the diagnosis of endometriosis? Bratisl Lek Listy. 2019;120(12):912–8. https://doi.org/10.4149/BLL_2019_153.
18. Viganò P., Ottolina J., Sarais V. et al. Coagulation status in women with endometriosis. Reprod Sci. 2018;25(4):559–65. https://doi.org/10.1177/1933719117718273.
19. Wu Q., Ding D., Liu X., Guo S.W. Evidence for a hypercoagulable state in women with ovarian endometriomas. Reprod Sci. 2015;22(9):1107–14. https://doi.org/10.1177/1933719115572478.
20. Сорокина А.В. Эндометриоз. Медицинская сестра. 2010;(8):21–2.
21. Мягченкова К.И., Хащенко Е.П., Уварова Е.В. Психоэмоциональные особенности и болевая симптоматика у пациенток, страдающих генитальным эндометриозом в раннем репродуктивном возрасте. Репродуктивное здоровье детей и подростков. 2021;17(2):41–50. https://doi.org/10.33029/1816-2134-2020-17-2-41-50.
22. Chang H.-H., Chiang B.-L. The diagnosis and classification of autoimmune coagulopathy: an updated review. Autoimmun Rev. 2014;13(4–5):587–90. https://doi.org/10.1016/j.autrev.2014.01.032.
23. Bacon J.L. Abnormal uterine bleeding: current classification and clinical management. Obstet Gynecol Clin North Am. 2017;44(2):179–93. https://doi.org/10.1016/j.ogc.2017.02.012.
24. Williams B., Zou L., Pittet J.F., Chao W. Sepsis-induced coagulopathy: a comprehensive narrative review of pathophysiology, clinical presentation, diagnosis, and management strategies. Anesth Analg. 2024;138(4):696–711. https://doi.org/10.1213/ANE.0000000000006888.
25. Хасанова Ю.В., Нелаева А.А., Галкина А.Б., Медведева И.В. Роль коагуляции и воспаления в развитии диабетической нефропатии у больных сахарным диабетом 2 типа. Сахарный диабет. 2012;(1):31–4. https://doi.org/10.14341/2072-0351-5976.
26. Колосков А.В., Мангушло А.А. Металлопротеаза Adamts-13. Гематология и трансфузиология. 2019;64(4):471–82. https://doi.org/10.35754/0234-5730-2019-64-4-471-482.
27. Zhao K., Qu P. Noninvasive evaluation of ovarian endometriosis: a single-center experience. Ann Palliat Med. 2021;10(4):4728–35. https://doi.org/10.21037/apm-21-481.
28. Ling X., Wang T. Diagnostic and prognostic value of coagulation-related factors in endometriosis. Am J Transl Res. 2022;14(11):7924–31.
29. Metcalf R.L., Fry D.J., Swindell R. et al. Thrombosis in ovarian cancer: a case control study. Br J Cancer. 2014;110(5):1118–24. https://doi.org/10.1038/bjc.2014.3.
30. Greco P.S., Bazzi A.A., McLean K. et al. Incidence and timing of thromboembolic events in patients with ovarian cancer undergoing neoadjuvant chemotherapy. Obstet Gynecol. 2017;129(6):979–85. https://doi.org/10.1097/AOG.0000000000001980.
31. Мансурова А.С., Красильников С.Э., Войцицкий В.Е. Двойная угроза. Рак яичников и тромботические осложнения. Российский онкологический журнал. 2021;26(3):101–6. https://doi.org/10.17816/onco107326.
32. Луговской Э.В., Колесникова И.Н., Платонова Т.Н. и др. Одновременное количественное определение растворимого фибрина и D-димера в плазме крови для оценки угрозы тромбообразования. Клиническая медицина. 2013;91(11):38–44.
Об авторах
Б. БайгалмааМонголия
Байгалмаа Балдансамбуу
Улан-Батор
В. О. Бицадзе
Россия
Бицадзе Виктория Омаровна, д.м.н., проф., профессор РАН
119991 Москва, ул. Трубецкая, д. 8, стр. 2
Scopus Author ID: 6506003478. WoS ResearcherID: F-8409-2017
А. Г. Солопова
Россия
Солопова Антонина Григорьевна, д.м.н., проф.
119991 Москва, ул. Трубецкая, д. 8, стр. 2
Scopus Author ID: 6505479504. WoS ResearcherID: Q-1385-2015
А. Е. Ефанов
Россия
Ефанов Александр Евгеньевич
123423 Москва, ул. Саляма Адиля, д. 2/44
А. Е. Войновский
Россия
Войновский Александр Евгеньевич, д.м.н., проф.
123423 Москва, ул. Саляма Адиля, д. 2/44
WoS ResearcherID: S-6385-2016
Что уже известно об этой теме?
► Эндометриоз – хроническое заболевание, характеризующееся разрастанием ткани эндометрия в пространстве вне матки.
► Эндометриоз сопровождается развитием коагулопатии.
Что нового дает статья?
► Наружный генитальный эндометриоз (НГЭ) сопровождается субклиническим течением процессов тромбообразования.
► Коагулопатия при НГЭ поддается коррекции.
Как это может повлиять на клиническую практику в обозримом будущем?
► Комплексная оценка биомаркеров состояния системы гемостаза позволит лучше контролировать состояние пациентов после проведенного хирургического лечения НГЭ.
► Динамическая оценка содержания фактора фон Виллебранда и D-димера существенно повысит точность определения состояния системы гемостаза.
Рецензия
Для цитирования:
Байгалмаа Б., Бицадзе В.О., Солопова А.Г., Ефанов А.Е., Войновский А.Е. Показатели гемостаза после хирургического лечения наружного генитального эндометриоза. Акушерство, Гинекология и Репродукция. 2024;18(5):648–657. https://doi.org/10.17749/2313-7347/ob.gyn.rep.2024.575
For citation:
Baigalmaa B., Bitsadze V.O., Solopova A.G., Efanov A.E., Voynovskiy A.Е. External genital endometriosis post-surgery hemostasis parameters. Obstetrics, Gynecology and Reproduction. 2024;18(5):648–657. (In Russ.) https://doi.org/10.17749/2313-7347/ob.gyn.rep.2024.575

Контент доступен под лицензией Creative Commons Attribution-NonCommercial-ShareAlike 4.0 International License.











































