Перейти к:
Преимущества, недостатки и оптимизация органосохраняющих методов лечения миомы матки
https://doi.org/10.17749/2313-7347/ob.gyn.rep.2024.550
Аннотация
Введение. Миома матки (ММ) – доброкачественное моноклональное гормоночувствительное образование, формирующееся из гладкомышечных клеток и поражающее до 29 % женщин в возрасте 15–54 года по всему миру. С учетом текущей демографической ситуации и возрастающей с каждым годом тенденции планирования беременности в старшем репродуктивном возрасте, органосохраняющий подход в лечении ММ становится приоритетным.
Цель: исследование эффективности применения селективного модулятора рецепторов прогестерона (СМРП) для лечения ММ у женщин пременопаузального возраста.
Материалы и методы. В проспективном когортном исследовании приняли участие 40 пациенток с ММ, средний возраст которых составил 39,3 ± 5,8 лет. Методом простой рандомизации пациентки были разделены на 2 группы по 20 человек. Средний возраст пациенток был сопоставим и составил 38,15 ± 5,65 и 40,5 ± 5,8 лет в группах 1 и 2 соответственно (p = 0,203). В обеих группах после оценки печеночных проб в соответствии с инструкцией применялось курсовое лечение препаратом группы СМРП (улипристала ацетат) в суточной дозе 5 мг в течение 84 дней (один курс) с перерывом до начала второй менструации после отмены препарата. Группа 1 прошла 2 курса терапии, группа 2 – 3 курса. После каждого курса пациенткам выполняли контрольные ультразвуковые исследования (УЗИ), где оценивали величину объема матки и диаметр доминантного миоматозного узла и анализировали печеночные пробы. Количественную оценку разницы между двумя размерами MM и доминантного узла и максимальным размером объема матки в динамике с оценкой размера эффекта выражали в разности средних (Δ) с 95 % доверительным интервалом (ДИ).
Результаты. По данным УЗИ, матка в группе 1 была увеличена в среднем до 129,49 ± 75,57 см3, максимальный размер доминантного узла составил 38,90 ± 17,38 мм; в группе 2 матка была увеличена до 294,83 ± 161,37 см3 с максимальным размером доминантного узла 53,33 ± 25,48 мм. В результате проведенной терапии в группе 1 был достигнут значимый регресс размеров доминантного узла уже после первого курса терапии: величина эффекта количественной оценки разницы между двумя размерами MM и доминантного узла (Δ) составила 8,70 (4,11; 13,29) мм (p < 0,001). После второго курса в сравнении с первым отмечалась стабилизация размеров (Δ) 1,00 (–1,39; 3,39) мм (p = 0,390); суммарный эффект (Δ) составил 9,67 (–14,59; –4,75) мм (p < 0,001). В группе 2 после первого курса также наблюдался регресс доминантного узла, величина эффекта (Δ) составила 9,49 (7,08; 11,89) мм (p = 0,001). Эффект (Δ) после второго курса в группе 2 был более выражен по сравнению с первым курсом и составил 10,74 (5,86; 15,61) мм (p = 0,001). Однако после третьего курса наблюдался рост узлов в сравнении со вторым курсом – (Δ) 8,25 (0,67; 15,83) мм (p = 0,329). Несмотря на отсутствие выраженной отрицательной динамики, 9 пациенткам в группе 2 по показаниям была проведена эмболизация маточных артерий во избежание рецидива.
Заключение. Терапия СМРП может применяться как в качестве самостоятельного средства терапии ММ, так и в комбинации с хирургическими методиками. Она позволяет ряду женщин забеременеть без предшествующей миомэктомии, а пациенткам, приближающимся по возрасту к менопаузе, избежать оперативного лечения и мягко вступить в естественную постменопаузу. На сегодняшний день консервативные и оперативные методы лечения лейомиом должны дополнять друг друга с целью достижения наилучших клинических исходов.
Ключевые слова
Для цитирования:
Тихомиров А.Л., Казенашев В.В., Максимова О.В., Маминова М.В., Давыденко Н.Л., Руруа Н.В., Сонина Т.А. Преимущества, недостатки и оптимизация органосохраняющих методов лечения миомы матки. Акушерство, Гинекология и Репродукция. 2024;18(5):635-647. https://doi.org/10.17749/2313-7347/ob.gyn.rep.2024.550
For citation:
Tikhomirov A.L., Kazenashev V.V., Maksimova O.V., Maminova M.V., Davydenko N.L., Rurua N.V., Sonina T.A. Advantages, disadvantages and optimization of organ-sparing methods for uterine fibroids treatment. Obstetrics, Gynecology and Reproduction. 2024;18(5):635-647. (In Russ.) https://doi.org/10.17749/2313-7347/ob.gyn.rep.2024.550
Введение / Introduction
Миома матки (ММ) – доброкачественное моноклональное гормоночувствительное образование, формирующееся из гладких миоцитов шейки и тела матки [1]. Частота встречаемости лейомиом составляет до 29 % [2], распространенность ММ в Восточной Сибири по результатам неселективной выборки из 2389 женщин составила 26,4 % [3], а по данным аутопсических методов исследования может достигать 70–80 % [4]. Заболевание в большинстве случаев протекает бессимптомно, в то время как у 25 % женщин выявляются аномальные маточные кровотечения (АМК), хроническая тазовая боль, дисфункция смежных органов, сопутствующие симптомы железодефицитной анемии (ЖДА), дисгормональные заболевания молочных желез, бесплодие, осложнения гестации и ее течения [5]. ММ занимает уверенное второе место среди гинекологической патологии и, несмотря на внедрение миниинвазивных органосохраняющих методик лечения, остается причиной каждой третьей гистерэктомии в мире [5]. В последние годы отмечено также «омоложение» ММ вследствие усовершенствования визуализирующих методов исследования, поэтому диагностика образования у пациенток младше 25 лет уже не является казуистикой. Данный аспект вкупе с тенденцией планирования беременности в позднем репродуктивном периоде делает проблему сохранения женского здоровья особенно актуальной.
Этиология и патогенез ММ в настоящее время остаются вопросами спорными и неоднозначными [5]. Лейомиома является прогестеронзависимым образованием, что подтверждается преимущественным увеличением узлов в размерах в секреторную фазу менструального цикла [5]. Гипотеза о ведущей роли эстрогенов большинством авторов признается устаревшей, так как локальная гиперэстрогенная среда, создаваемая клетками опухоли, лишь способствует повышению плотности рецепторов прогестерона в тканях ММ в фолликулярную фазу менструального цикла, в то время как именно прогестерон является важнейшим митогеном для ее роста и развития [4]. Роль данного гормона реализуется через стимуляцию экспрессии эндотелиальных и сосудистых факторов роста. На сегодняшний день также активно изучается роль генетического фактора в развитии новообразования. Так, цитогенетические исследования показали, что около 40–50 % миоматозных узлов имеют хромосомные и генные аномалии, включая изменения в генах MED12, HMGA2, COL4A5/COL4A6 и др. [6], которые могут носить характер вторичной соматической мутации. При этом данные исследования потенциально способны прогнозировать риск рецидивов ММ и способствовать более тщательному дифференцированному подходу к выбору лечения этого контингента больных.
К развитию лейомиом предрасполагают следующие факторы: раннее менархе и позднее деторождение, низкие репродуктивные показатели, чрезмерная терапия с использованием боди-идентичных гестагенов, наличие хронических воспалительных заболеваний органов малого таза и кишечника в анамнезе, а также негроидная раса, ожирение, отягощение семейного анамнеза [4][7]. В частности, при хронических воспалительных заболеваниях гениталий и кишечника инфекционные агенты за счет разных механизмов, потенциально попадая в матку, могут инициировать иммуновоспалительную реакцию, сопровождающуюся продукцией мононуклеарами большого количества факторов роста – эпидермального фактора роста (англ. epidermal growth factor, EGF), инсулиноподобного фактора роста (англ. insulin-like growth factor, IGF), фактора роста эндотелия сосудов (англ. vascular endothelial growth factor, VEGF) – основных триггеров лейомиомы, а также усиленным синтезом межклеточного матрикса активированными миофибробластами [8]. Все это приводит к активизации формирования и ускорению темпов роста миоматозных узлов. При этом признаки хронического воспаления органов малого таза и кишечника у женщин с ММ ассоциированы с неэффективностью гормональной терапии, что подчеркивает значимость эрадикации возбудителей и восстановления нормоценоза половых путей и кишечника как важного этапа медикаментозного лечения [8].
С учетом текущей демографической ситуации, органосохраняющий подход в лечении ММ является приоритетным. Единого алгоритма в настоящее время не разработано, да и едва ли он возможен в условиях разнообразия клинической картины и особенностей течения патологии в каждом конкретном случае заболевания. Поэтому терапия ММ предполагает строго персонализированный подход. На сегодняшний день становится очевидным, что различные варианты медикаментозной терапии и оперативного лечения не должны противопоставляться и исключать друг друга, ведь именно возможность комбинации хирургического и терапевтического подходов обеспечивает наилучшие клинические исходы.
Важно понимать, что при обнаружении даже мелких, клинически незначимых миоматозных узлов длительная пассивно-выжидательная тактика может способствовать упущению терапевтических возможностей. Только клинически незначимые аваскулярные субсерозные ММ могут быть подвержены динамическому наблюдению, преимущественно в период перименопаузы и при условии регулярности посещений пациенткой врача акушера-гинеколога.
Основным же показанием к медикаментозному лечению остается «симптомная» ММ [4][5]. Терапевтическая стратегия в зависимости от клинической ситуации может преследовать 3 основные цели: снижение выраженности симптомов заболевания и улучшение качества жизни, стабилизация гемостатических показателей как этап предоперационной подготовки у женщин с тяжелой ЖДА, а также регресс миоматозных узлов. «Золотым стандартом» лечения в нашей стране до настоящего времени считаются агонисты гонадотропин-рилизинг-гормона (аГнРГ), которые способны остановить кровотечение в течение 7–14 дней после начала приема и вызвать регресс миоматозных узлов при достаточно продолжительном применении. Однако возможности их использования ограничены ввиду нежелательных побочных эффектов вследствие гипофункции яичников, что сопровождается менопаузальными симптомами и обусловливает необходимость вспомогательной (add-back) терапии эстрогенами [4]. Также одним из недостатков лечения является отсутствие стойкого эффекта – после отмены препарата у достаточно молодых пациенток размеры миоматозных узлов возвращаются к исходным параметрам. Поэтому аГнРГ все чаще используются как средство кратковременной предоперационной подготовки у пациенток с тяжелыми АМК или как самостоятельный вариант терапии у женщин с ММ и аденомиозом, вплотную приближающихся к возрасту менопаузы и имеющих противопоказания к операции или отказывающихся от хирургического лечения.
С этими же целями в клинической практике также может быть использована группа селективных модуляторов рецепторов прогестерона (СМРП), в частности, улипристала ацетат (УПА). Доказано, что препарат способствует уменьшению интраоперационной кровопотери, сокращению сроков пребывания пациенток в стационаре после миомэктомии и стабильному регрессу миоматозных узлов, что в ряде клинических случаев позволяет вовсе избежать оперативного вмешательства и рассматривать применение УПА как самостоятельный метод терапии ММ [9]. При таком подходе рекомендовано лечение длительными прерывистыми курсами [10]. Показанием могут считаться ММ 3–5-го типов по классификации 2011 г. Международной федерации гинекологии и акушерства (англ. International Federation of Gynecology and Obstetrics, FIGO) [11].
Селективные модуляторы рецепторов прогестерона, в отличие от аГнРГ, не вызывают нежелательных побочных явлений в виде сопутствующих симптомов гипоэстрогении и хорошо переносятся пациентками. Однако применение УПА может быть ограничено у женщин с сопутствующими гиперпластическими процессами в эндометрии. В многочисленных исследованиях было доказано, что связанные с приемом препарата изменения слизистой оболочки матки, так называемые изменения эндометрия, ассоциированные с применением модуляторов рецепторов прогестерона (англ. progesterone receptor modulators Associated Endometrial Changes, PAEC), носят исключительно доброкачественный характер и полностью обратимы [9]. Тем не менее, по данным ряда источников, рекомендовано проведение пайпель-биопсии эндометрия у женщин с сопутствующими гиперпластическими процессами в целях снижения рисков усугубления течения заболевания [9]. Аналогичное исследование может быть назначено лечащим врачом спустя 6 месяцев после отмены препарата [9]. Согласно обновленной инструкции от 31.08.2021, одобренной Минздравом России, применение УПА в обязательном порядке должно сопровождаться мониторингом функции печени ввиду возможной гепатотоксичности у лиц с латентно протекающими заболеваниями гепатобилиарной системы [9][11]. Прямым показанием к прекращению приема служит трехкратное повышение уровня трансаминаз, а также более чем двукратное повышение билирубина относительно верхней границы нормы [11].
В 2020 г. Комитет Европейской комиссии по лекарственным препаратам для медицинского применения (англ. European Medicines Agency, ЕМА) посчитал, что польза от применения УПА превышает возможные риски, в особенности у пациенток, для которых по различным причинам альтернативные методы лечения недоступны или малоэффективны [12]. Таким образом, УПА имеет впечатляющую доказательную базу, изученную клиническую эффективность, хорошую переносимость пациентками, способствует стабилизации показателей гемодинамики и регрессу миоматозных узлов, который сохраняется даже после отмены препарата, что в ряде случаев позволяет избежать оперативного лечения [9–11].
Говоря об органосохраняющей тактике ведения пациенток с ММ, нельзя не упомянуть хорошо зарекомендовавший себя миниинвазивный, стабильно-регрессионный метод эмболизации маточных артерий (ЭМА). Он является операцией выбора для женщин с выполненной репродуктивной функцией, размеры миоматозных узлов которых не превышают 6 см в диаметре, особенно если им по различным причинам может быть противопоказано обширное хирургическое вмешательство или гормональные методы лечения. Методика эмболизации в разных странах может несколько отличаться, но суть этой микроинвазивной операции остается неизменной – добиться полной двухсторонней селективной катетеризации маточных артерий и коаксиальной окклюзии дистальных артериол [13]. Ожидаемым исходом вмешательства является полное прекращение артериального кровотока (в ходе ЭМА на экране рентген-монитора регистрируется прекращение поступления контраста в узлы миомы, после ЭМА – на основании данных цветного доплеровского картирования [13]), дегидратация узлов, образование их кальцинированной капсулы, а также асептический некроз, гиалиноз и кальцификация узлов. Контрольные ультразвуковые исследования (УЗИ) эффективности лечения проводятся через 3, 6, 12 месяцев после ЭМА. Нежелательным побочным эффектом может являться постэмболизационный болевой синдром разной степени выраженности. Неспецифическими послеоперационными симптомами также являются возможное повышение температуры тела и чувство общего недомогания [13]. Патогенетически возникновение «сильных» и «нестерпимых» болей можно объяснить затруднением венозного оттока от инволюционирующих узлов ММ у пациенток с варикозной болезнью [13]. Данную проблему можно решить с помощью применения флавоноидов и других групп венопротекторов в раннем послеоперационном периоде. Воздействуя системно на венозную стенку, препараты снижают выраженность гипердинамической реакции кровообращения, способствуют лучшему оттоку венозной крови от ишемизированных узлов и облегчают болевой синдром [13].
Наиболее дискутабельным вопросом в отношении ЭМА уже длительное время является гипотеза о ее отрицательном влиянии на овариальный резерв. Вероятно, снижение числа антральных фолликулов является следствием недостаточности коллатерального кровотока в яичниках. Поэтому большинство стран не рекомендуют применение ЭМА у женщин, имеющих репродуктивные планы, и в особенности прибегающих к вспомогательным репродуктивным технологиям (ВРТ) [1][14–17]. Тем не менее в 2019 г. метаанализ 353 пациенток показал, что снижение числа антральных фолликулов на контрольных УЗИ у женщин, подвергшихся ЭМА, регистрируемое через 3–4 месяца после вмешательства, полностью нивелируется в течение 1 года, а в ряде случаев методика даже провоцирует rebound-эффект [18][19]. Гемодинамические сдвиги в бассейне яичниковой артерии способны скомпенсировать недостаточность кровотока в коллатералях восходящей маточной артерии, который гипотетически может пострадать при эмболизации, что объясняет последующее восстановление числа фолликулов [19].
Не менее серьезным осложнением ЭМА, ограничивающим применение методики у женщин репродуктивного возраста, являются последующие выкидыши на ранних сроках беременностей, что предположительно связано с изменениями морфофункциональных свойств здорового миометрия, подвергшегося кратковременной ишемизации в процессе операции [20]. Тем не менее существуют убедительные доказательства, что искусственно созданная ишемия обычно разрешается в течение 48–72 часов после ЭМА благодаря высокоразвитой сети коллатералей ветвей маточных, яичниковых и подвздошных артерий в здоровом миометрии, в то время как узлы лейомиомы, имеющие чаще единственный источник кровоснабжения, инфарктируют [20]. Более того, в последнее время в хирургической практике все чаще применяется усовершенствованная техника проведения операции – суперселективная ЭМА [21]. Она позволяет разрешить большинство нюансов, связанных с возможными послеоперационными рисками для репродуктивного здоровья, такими как снижение овариального резерва, некротизация здорового миометрия, нарушение плацентации и рецидивирование ММ [21]. В ряде наблюдений последний аспект можно объяснить наличием дополнительного кровоснабжения узлов миомы из артериального бассейна контрлатеральной стороны [21], эмболизацию которой в ряде клиник технически провести не могут. Суперселективную билатеральную эмболизацию можно назвать технологией «снайпера». Она позволяет полноценно обескровить все узлы миомы, снизить риск нецелевой эмболизации, уменьшить объем ишемизированной ткани и таким образом снизить интенсивность постэмболизационного болевого синдрома [21]. Во многом этому способствует используемый нами доступ для ЭМА через лучевую артерию, что также уменьшает время операции и, следовательно, лучевую нагрузку, избавляет пациентку от дискомфортной тугой давящей повязки в области правого паха, вынужденного положения с вытянутой ногой и мочевого катетера на 12 часов, как ранее это было при доступе через бедренную артерию по Сельдингеру.
Цель: исследование эффективности применения СМРП для лечения ММ у женщин пременопаузального возраста.
Материалы и методы / Materials and Methods
Дизайн исследования / Study design
В проспективном когортном исследовании приняли участие 40 пациенток, средний возраст которых составил 39,3 ± 5,8 лет. Методом простой рандомизации пациентки были разделены на 2 группы по 20 человек с целью определения оптимальной эффективности терапии в зависимости от ее продолжительности. Средний возраст пациенток был сопоставим и составил 38,15 ± 5,65 и 40,5 ± 5,8 лет в группах 1 и 2 соответственно (p = 0,203).
Критерии включения и исключения / Inclusion and exclusion criteria
Критерии включения: умеренные и тяжелые симптомы ММ у женщин пременопаузального возраста; получение добровольного письменного согласия.
Критерии исключения: почечная и/или печеночная недостаточность; рак матки, шейки матки, яичников или молочной железы; беременность; кровотечение из влагалища неясной этиологии или по причинам, не связанным с ММ; отказ от участия в исследовании.
Лечение / Therapy
В обеих группах после оценки печеночных проб применялось курсовое лечение препаратом группы СМРП (улипристала ацетат) согласно обновленной инструкции по применению препарата УПА (5 мг) для лечения больных миомой матки от 31.08.2021, одобренной Минздравом России, в суточной дозе 5 мг в течение 84 дней (один курс) с перерывом до начала второй менструации после отмены препарата. Группа 1 прошла 2 курса терапии, группа 2 – 3 курса. После каждого курса пациенткам выполняли контрольное УЗИ, где оценивали величину объема матки и диаметр доминантного миоматозного узла и анализировали печеночные пробы.
Статистический анализ / Statistical analysis
Анализ данных проводили при помощи статистического программного обеспечения R версии 4.3.2 (R Core Team). Данные, измеренные в непрерывной шкале, представлялись в виде среднего (M) и стандартного отклонения (SD), медианы (Me) и нижнего и верхнего квартилей (LQ; UQ). Проверка близости к гауссову распределению осуществлялась при помощи критерия согласия Шапиро–Уилка. Качественные данные представлены в виде абсолютных (n) и относительных (%) величин. Для проверки статистических гипотез для независимых выборок использовали критерий Стьюдента, Манна–Уитни, точный критерий Фишера. Величину эффекта количественной оценки разницы между двумя размерами миомы и доминантного узла и максимальный размер объема матки в динамике с оценкой размера эффекта выражали в разности средних (Δ) с 95 % доверительным интервалом (ДИ).
Для оценки величины объема матки и диаметра максимального миоматозного узла на разных этапах лечения применялся однофакторный дисперсионный анализ (one-way ANOVA) для повторных измерений с применением апостериорного теста множественного сравнения и расчетом поправки Бонферрони и парный t-тест для связанных выборок. Принятый уровень значимости – p < 0,05.
Результаты / Results
Сравнительная характеристика пациенток до лечения приведена в таблице 1.
Таблица 1. Сравнительная характеристика пациенток до лечения.
Table 1. Pre-treatment comparative patient characteristics.
|
Параметр Parameter |
Все / Total N = 40 |
Группа 1 / Group 1 N = 20 |
Группа 2 / Group 2 N = 20 |
p |
|
Возраст, лет / Age, years M ± SD Me (LQ; UQ) Min–Max |
39,325 ± 5,79 37,0 (36,0; 44,5) 28,0–49,0 |
39,325 ± 5,79 36,5 (34,0; 44,0) 28,0–46,0 |
40,50 ± 5,83 40 (35,5; 45,5) 32,0–49,0 |
0,203¹ |
|
Наличие жалоб, n/N (%) Complaints, n/N (%) |
11/40 (27,5) |
4/20 (20,0) |
7/20 (35,0) |
0,480² |
|
Наличие OMK, n/N (%) HMB, n/N (%) |
11/40 (27,5) |
4/20 (20,0) |
7/20 (35,0) |
0,480² |
|
Наличие AMK, n/N (%) AUB, n/N (%) |
8/40 (20,0) |
2/20 (10,0) |
6/20 (30,0) |
0,235² |
|
Размер миомы матки, недель Uterine fibroids size, weeks M ± SD Me (LQ; UQ) Min–Max |
8,62 ± 2,25 9,0 (7,0; 11,0) 5,0–13,0 |
7,22 ± 1,59 7,0 (6,0; 8,0) 7,0–5,0 |
9,95 ± 1,99 10,0 (9,0; 11,0) 5,0–13,0 |
< 0,001³ |
|
Объем миомы матки*, ³см³ Uterine fibroids volume*, cm³ M ± SD Me (LQ; UQ) Min–Max |
212,16 ± 149,93 140,97 (103,18; 314,08) 47,41–506,64 |
129,49 ± 75,57 121,84 (77,11; 139,76) 47,41–290,32 |
294,83 ± 161,37 314,08 (149,76; 496,40) 74,09–506,64 |
< 0,001³ |
|
Максимальный размер доминантного узла, мм Dominant node maximum size, mm M ± SD Me (LQ; UQ) Min–Max |
46,11 ± 22,74 36 (26,5; 66,5) 14,0–85,0 |
38,9 ± 17,38 35,0 (24,5;55,0) 14,0–67,0 |
53,33 ± 25,48 38,25 (31,0; 81,5) 24,0–85,0 |
0,034³ |
Примечание: N – численность выборки; (LQ; UQ) – нижний и верхний квартили; ОМК – обильное маточное кровотечение; АМК – аномальное маточное кровотечение; ¹ – критерий Стьюдента (t-test); ² – точный критерий Фишера; ³ – критерий Манна–Уитни (U-test); * – формула для эллипсоида [22].
Note: N – sample size; (LQ; UQ) – lower and upper quartiles; HMB – heavy uterine bleeding; AUB – abnormal uterine bleeding; ¹ – Student’s t-test; ² – Fisher’s exact test; ³ – Mann–Whitney U-test; * – formula for an ellipsoid [22].
По данным УЗИ, матка в группе 1 была увеличена в среднем до 129,49 ± 75,57 см³, максимальный размер доминантного узла составил 38,90 ± 17,38 мм; в группе 2 матка была увеличена до 294,83 ± 161,37 см³ с максимальным размером доминантного узла 53,33 ± 25,48 мм.
После первого курса терапии в группе 1 (табл. 2) был достигнут значимый регресс размеров объема матки: –35,86 (–60,63; –11,08) см³ (p = 0,007), после второго курса терапии отмечалась стабилизация размеров объема матки (Δ) –0,19 (–3,56; 3,19) см³ (p = 0,907), суммарный эффект (Δ) составил –33,63 (–62,93; –4,33) см³ (p = 0,027).
Таблица 2. Основной клинический исход: максимальный размер объема матки в динамике с оценкой размера эффекта.
Table 2. Main clinical outcome: dynamic maximum uterine volume size and effect size assessment.
|
Параметр Parameter |
Группа 1 / Group 1 N = 20 |
Группа 2 / Group 2 N = 20 |
|
Объем миомы матки до лечения, см³ (0) / Pre-treatment uterine fibroid volume, cm³ (0) |
||
|
M ± SD Me (LQ; UQ) Min–Max |
129,49 ± 75,57 121,84 (77,11; 139,76) 47,41–290,32 |
294,83 ± 161,37 314,08 (149,76; 496,40) 74,10–506,64 |
|
Объем миомы матки после 1-го курса, см³ (1) / Post-course 1 uterine fibroid volume, cm³ (1) |
||
|
M ± SD Me (LQ; UQ) Min–Max |
93,64 ± 47,53 82,4 (50,13; 123,99) 41,56–78,24 |
183,94 ± 77,10 228,61 (103,35; 245,16) 77,95–271,18 |
|
Объем миомы матки после 2-го курса, см³ (2) / Post-course 2 uterine fibroid volume, cm³ (2) |
||
|
M ± SD Me (LQ; UQ) Min–Max |
94,39 ± 50,79 84,28 (46,55; 121,36) 41,02–182,21 |
211,54 ± 114,84 178,24 (127,65; 361,22) 78,07–383,75 |
|
Объем миомы матки после 3-го курса, см³ (3) / Post-course 3 uterine fibroid volume, cm³ (3) |
||
|
M ± SD Me (LQ; UQ) Min–Max |
– – – |
225,60 ± 173,09 140,23 (112,55; 471,75) 14,50–485,95 |
|
р |
0,1141 0,007(1-2) 0,027(1-3) 0,907(2-3) |
0,0771 < 0,001(1-2) < 0,001(1-3) 0,001(1-4) 0,074(2-3) 0,329(2-4) |
|
Δ M (95 % ДИ) / Δ M (95 % CI) |
||
|
Разность (Δ) после 1-го курса – до лечения |
–35,86 (–60,63; –11,08) |
–110,89 (–155,51; –66,26) |
|
Разность (Δ) после 2-го курса – до лечения |
–33,63 (–62,93; –4,33) |
–83,29 (–114,57; –52,01) |
|
Разность (Δ) после 3-го курса – до лечения |
– |
–69,23 (–106,70; –31,75) |
|
Разность (Δ) после 2-го курса – после 1-го курса |
–0,19 (–3,56; 3,19) |
27,59 (–2,89; 58,09) |
|
Разность (Δ) после 3-го курса – после 2-го курса |
– |
14,07 (–15,35; 43,48) |
Примечание: (LQ; UQ) – нижний и верхний квартили; 95 % ДИ – 95 % доверительный интервал; (0-1), (0-2), (0-3), (1-2), (1-3) – парный t-test, где 1, 2, 3 и т. д. периоды наблюдения; 1 – однофакторный дисперсионный анализ.
Note: (LQ; UQ) – lower and upper quartiles; 95 % CI – 95 % confidence interval; (0-1), (0-2), (0-3), (1-2), (1-3) – paired t-test, where 1, 2, 3, etc. denote examination time points; 1 – one-way ANOVA.
В группе 2 после первого курса (табл. 2) также наблюдался значимый регресс размеров объема матки: –110,89 (–155,51; –66,26) см³ (p < 0,001). Суммарный эффект (Δ) после второго и третьего курсов терапии составил –83,29 (–114,57; –52,01) см³ (p < 0,001) и –69,23 (–106,70; –31,75) см³ (p = 0,001) соответственно.
В результате проведенной терапии в группе 1 был достигнут значимый регресс размеров доминантного узла уже после первого курса (табл. 3), величина эффекта (Δ) составила –8,70 (4,11; 13,29) мм (p < 0,001). После второго курса в сравнении с первым отмечалась стабилизация размеров (Δ): 1,00 (–1,39; 3,39) мм (p = 0,390), суммарный эффект (Δ) составил –9,67 (–14,59; –4,75) мм (p < 0,001). При этом у 2 пациенток терапия была остановлена в связи с наступлением желанной беременности в перерывах между курсами.
Таблица 3. Основной клинический исход: максимальный размер доминантного узла в динамике с оценкой размера эффекта.
Table 3. Main clinical outcome: dynamic dominant node maximum size and effect size assessment.
|
Параметр Parameter |
Все / Total N = 40 |
Группа 1 / Group 1 N = 20 |
Группа 2 / Group 2 N = 20 |
|
Максимальный размер доминантного узла до лечения, см³ (0) |
|||
|
M ± SD Me (LQ; UQ) Min–Max |
46,11 ± 22,74 36,0 (26,5; 66,5) 14,0–85,0 |
38,90 ± 17,38 35,0 (24,5; 55,0) 14,0–67,0 |
53,33 ± 25,48 38,25 (31,0; 81,5) 24,0–85,0 |
|
Максимальный размер доминантного узла после 1-го курса, см³ (1) |
|||
|
M ± SD Me (LQ; UQ) Min–Max |
37,02 ± 20,24 29,85 (21,75; 49,25) 10,0–78,0 |
30,20 ± 13,49 30,5 (18,75; 44,0) 10,0–50,0 |
43,84 ± 23,69 29,35 (24,25; 71,00) 17,0–78,0 |
|
Максимальный размер доминантного узла после 2-го курса, см³ (2) |
|||
|
M ± SD Me (LQ; UQ) Min–Max |
31,50 ± 15,05 26,5 (22,0; 47,5) 9,0–55,0 |
29,72 ± 15,75 24,5 (17,5; 40,5) 9,0–55,0 |
33,10 ± 14,61 27,50 (22,75; 49,25) 11,0–53,0 |
|
Максимальный размер доминантного узла после 3-го курса, см³ (3) |
|||
|
M ± SD Me (LQ; UQ) Min–Max |
41,35 ± 27,81 30,50 (22,75; 71,75) 9,0–85,0 |
– – – |
41,35 ± 27,81 30,5 (22,75; 71,75) 9,0–85,0 |
|
р |
0,0211 < 0,001(0-1) < 0,001(0-2) 0,001(0-3) 0,003(1-2) 0,329(1-3) |
0,1271 < 0,001(0-1) < 0,001(0-2) 0,390(1-2) |
0,0641 < 0,001(0-1) < 0,001(0-2) 0,001(0-3) < 0,001(1-2) 0,329(1-3) |
|
Δ M (95 % ДИ) / Δ M (95 % CI) |
|||
|
Разность (Δ) после 1-го курса – до лечения |
–9,09 (–11,57; –6,62) |
–8,70 (–13,29; –4,11) |
–9,49 (–11,89; –7,08) |
|
Разность (Δ) после 2-го курса – до лечения |
–15,22 (–19,18; –11,26) |
–9,67 (–14,59; –4,75) |
–20,23 (–25,74; –14,70) |
|
Разность (Δ) после 3-го курса – до лечения |
–11,98 (–18,57; –5,38) |
– |
–11,98 (–18,57; –5,38) |
|
Разность (Δ) после 2-го курса – после 1-го курса |
–5,18 (–8,49; –1,86) |
1,00 (–1,39; 3,39) |
–10,74 (–15,61; –5,86) |
|
Разность (Δ) после 3-го курса – после 2-го курса |
8,25 (0,67; 15,83) |
– |
8,25 (0,67; 15,83) |
Примечание: (LQ; UQ) – нижний и верхний квартили; 95 % ДИ – 95 % доверительный интервал; (0-1), (0-2), (0-3), (1-2), (1-3) – парный t-test, где 1, 2, 3 и т. д. периоды наблюдения; 1 – однофакторный дисперсионный анализ.
Note: (LQ; UQ) – lower and upper quartiles; 95 % CI – 95 % confidence interval; (0-1), (0-2), (0-3), (1-2), (1-3) – paired t-test, where 1, 2, 3, etc. denote examination time points; 1 – one-way ANOVA.
В группе 2 после первого курса также наблюдался регресс доминантного узла (табл. 3), величина эффекта (Δ) составила –9,49 (–11,89; –7,08) мм (р < 0,001). Эффект (Δ) после второго курса был более выражен и составил –10,74 (–15,61; –5,86) мм (р < 0,001). После третьего курса хотя и наблюдалось незначительное увеличение доминантного узла в сравнении со вторым курсом, но его размер не достиг исходных размеров, и величина суммарного эффекта (Δ) составила 8,25 (0,67; 15,83) мм (p = 0,329).
Несмотря на отсутствие выраженной отрицательной динамики, 9 пациенткам в группе 2 по показаниям была проведена ЭМА во избежание рецидива. В обеих группах на протяжении курсов терапии побочных эффектов зарегистрировано не было.
Курсовая терапия СМРП вызывала статистически значимый регресс миоматозных узлов в группах 1 и 2 с последующей стабилизацией достигнутого результата (рис. 1, 2).
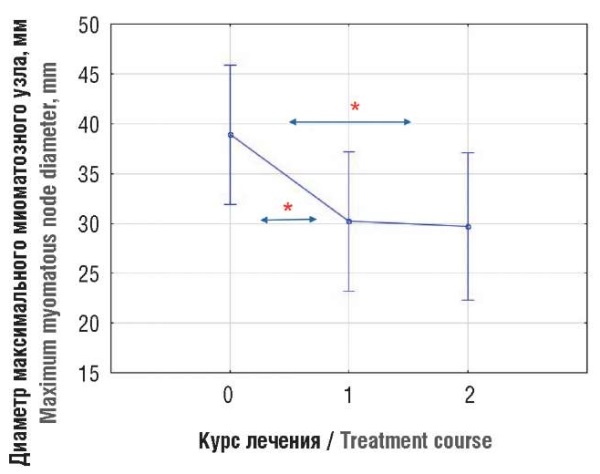
Рисунок 1. Динамика размеров миоматозного узла после двух курсов терапии в группе 1.
Примечание: точки 0, 1, 2 (по оси Х) означают номера визита пациента, где 0 – визит до лечения, 1 – визит после 1-го курса лечения, 2 – визит после 2-го курса лечения; *р < 0,05 – статистически значимая разница (Δ) размера миоматозного узла между визитами.
Figure 1. Dynamics of myomatous node sizes after two therapy courses in group 1.
Note: points 0, 1, 2 (along the X-axis) indicate the patient’s visit numbers, where 0 – pre-treatment visit, 1 – post-course 1 visit, 2 – post-course 2 visit; *p < 0.05 – significant difference (Δ) in inter-visit myomatous node sizes.
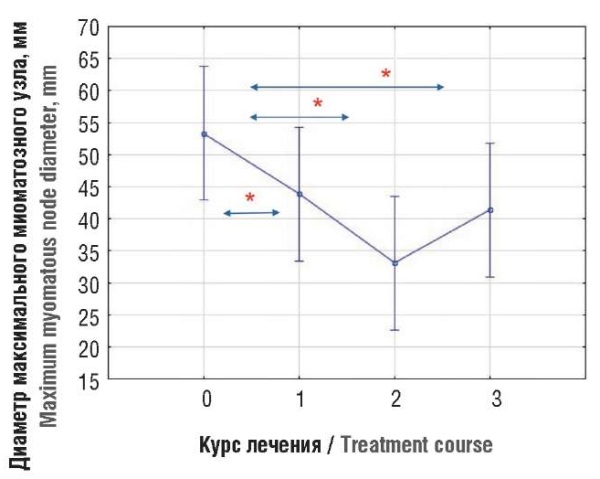
Рисунок 2. Динамика размеров миоматозного узла после трех курсов терапии в группе 2.
Примечание: точки 0, 1, 2, 3 (по оси Х) означают номера визита пациента, где 0 – визит до лечения, 1 – визит после 1-го курса лечения, 2 – визит после 2-го курса лечения, 3 – визит после 3-го курса лечения; *р < 0,05 – статистически значимая разница (Δ) размера миоматозного узла между визитами.
Figure 2. Dynamics of myomatous node sizes after three therapy courses in group 2.
Note: points 0, 1, 2 (along the X-axis) indicate the patient’s visit numbers, where 0 – pre-treatment visit, 1 – post-course 1 visit, 2 – post-course 2 visit, 3 – post-course 3 visit; *p < 0.05 – significant difference (Δ) in inter-visit myomatous node sizes.
Обсуждение / Discussion
Наиболее выраженный регрессионный эффект терапии с применением УПА отмечен после первых двух курсов, что ранее отмечалось за рубежом [23]. Это во многом объясняется ранее зарегистрированными первоочередными деваскуляризацией и ингибицией пролиферации в лейомиомах. Дальнейший, менее выраженный регресс узлов, по-видимому, обусловлен постепенным уменьшением объема экстрацеллюлярного матрикса. Эти механизмы были убедительно продемонстрированы в серии клинико-морфологических отечественных и зарубежных исследований [24–26]. Обильные маточные кровотечения (ОМК) и железодефицитные состояния были купированы в 100 % случаев уже после первого курса применения СМРП. Наблюдалась быстрая остановка кровотечения, аменорея наступала в течение 4–5 дней после начала терапии и продолжалась на протяжении всего 3-месячного курса лечения, что позволяет совместно использовать препараты железа и купировать ЖДА. Подобные результаты ранее были зафиксированы в Международном метаанализе применения лекарственных средств перед миомэктомией [27].
В лучшем случае пациентка избежит хирургического лечения, в худшем – терапия УПА окажется антианемической и регрессионой подготовкой перед операцией. Такой подход важен, так как предоперационная анемия (даже легкой степени тяжести) связана с повышенным риском осложнений и смертности у пациенток, подвергающихся хирургическому лечению [28][29]. Помимо этого известно, что предоперационная регрессионная и антианемическая подготовка обеспечивает безопасную гистерорезекцию ММ и избавляет от необходимости проводить операцию повторно [30].
Терапия СМРП может применяться как при подготовке к хирургическим методам, так и в качестве самостоятельного средства терапии ММ. В 2021 г. был представлен Британский опыт применения УПА для курсовой медикаментозной терапии у молодых женщин с симптомной ММ, у которых нет ближайших репродуктивных планов (если эти пациентки будут подвергнуты миомэктомии, то имеется риск рецидива ММ и необходимости для повторной миомэктомии в будущем), или когда хирургическое вмешательство может быть небезопасным и пациентка не хочет оперироваться [31].
Регрессионный и стабилизирующий эффект УПА обусловливает возможность наступления желанной беременности в тех случаях, когда узлы ММ являются ведущим фактором бесплодия. Хотя в данном исследовании мы не стремились оценить репродуктивную функцию после терапии СМРП, однако по данным международного систематического обзора 39 % пациенток забеременели без хирургического вмешательства [32].
Женщинам перименопаузального возраста терапия СМРП дает возможность избежать оперативного лечения до наступления естественной менопаузы [33].
В этом отношении перспективным может являться изучение интермиттирующих курсов терапии с использованием СМРП, на что, в частности, указывают результаты зарубежной публикации 2023 г. [34].
Одним из недостатков терапевтического подхода с использованием СМРП является отсутствие в ряде клинических наблюдений стойкого регресса ММ, что может объясняться зафиксированными нами ранее при клинико-морфологических исследованиях в 8 % наблюдений особенностями строения узлов по типу периваскулярных эпителиально-клеточных опухолей (ПЭКом) [24]. Перспективным является оценка эмболизации ММ при неполной достаточности терапии СМРП.
Заключение / Conclusion
В последние годы в отечественных и зарубежных подходах к лечению лейомиом наблюдается выраженный переход к стратегии органосохраняющего лечения. Понимание патогенетических механизмов ММ указывает на необходимость персонализированного подхода в каждом конкретном случае заболевания. На сегодняшний день консервативные и оперативные методы лечения лейомиом должны не противопоставляться, а, напротив, дополнять друг друга с целью достижения наилучших клинических результатов.
Список литературы
1. Dolmans M.M., Petraglia F., Catherino W.H., Donnez J. Pathogenesis of uterine fibroids: current understanding and future directions. Fertil Steril. 2024;122(1):6–11. https://doi.org/10.1016/j.fertnstert.2024.02.048.
2. Stewart Е.А, Nowak R.А. Uterine fibroids: hiding in plain sight. Physiology (Bethesda). 2022;37(1):16–27. https://doi.org/10.1152/physiol.00013.2021.
3. Atalyan A.V., Suturina L.V., Nadeliaeva I.G. et al. Prevalence of uterine fibroids in women in Eastern Siberia: a cross-sectional study. International Journal of Biomedicine. 2021;11(4):515–8. https://doi.org/10.21103/Article11(4)_OA18.
4. Гинекология по Уильямсу. Под ред. Б.Л. Хоффман, Дж.О. Шорджа, Л.М. Хальворсон и др. Пер. с англ. под ред. Г.Т. Сухих, В.Н. Серова. М.: ГЭОТАР-Медиа, 2023. 1280 с.
5. Адамян Л.В., Сонова М.М., Арсланян К.Н., Логинова О.Н. Современные аспекты комплексного лечения миомы матки. Лечащий врач. 2019;(3):46–50.
6. Upadhyay S., Dubey P.K. Gene variants polymorphisms and uterine leiomyoma: an updated review. Front Genet. 2024;15:1330807. Mar 20. https://doi.org/10.3389/fgene.2024.1330807.
7. Khan N.H., McNally R., Kim J.J., Wei J.-J. Racial disparity in uterine leiomyoma: new insights of genetic and environmental burden in myometrial cells. Mol Hum Reprod. 2024;30(3):gaae004. https://doi.org/10.1093/molehr/gaae004.
8. Тихомиров А.Л., Сонина Т.А., Багирова Х. Особенности микроценоза миомы матки. Трудный пациент. 2021;19(7):9–12. https://doi.org/10.224412/2074-1005-2021-7-9-12.
9. Козаченко А.В., Ревазова З.В., Адамян Л.В. и др. Гормональная подготовка к хирургическому лечению больных миомой матки репродуктивного возраста. Медицинский Совет. 2019;(13):29–35. https://doi.org/10.21518/2079-701X-2019-13-29-35.
10. Бадмаева С.Ж., Цхай В.Б., Каплунов В.А., Наркевич А.Н. Сравнительный анализ эффективности различных видов медикаментозной профилактики рецидива миомы матки у пациенток репродуктивного возраста, перенесших миомэктомию. Сибирское медицинское обозрение. 2020;124(4):77–83. https://doi.org/10.20333/2500136-2020-4-77-83.
11. Давыдов А.И., Лебедев В.А., Пашков В.М. и др. Улипристала ацетат и хирургическое лечение лейомиомы матки. Дифференциация подходов с учетом обновленной инструкции к лекарственному препарату. Вопросы гинекологии, акушерства и перинатологии. 2022;21(5):88–94. https://doi.org/10.20953/1726-1678-2022-5-88-94.
12. Ulipristal acetate 5 mg medicinal products. European Medicines Agency. Available at: https://www.ema.europa.eu/en/medicines/human/referrals/ulipristal-acetate-5mg-medicinal-products. [Accessed: 30.06.2024].
13. Юдина Т.А., Манухин И.Б., Тихомиров А.Л. Оптимизация постэмболизационного периода у больных миомой матки. Акушерство и гинекология. 2017;(12):110–14. https://doi.org/10.18565/aig.2017.12.110-114.
14. Kroncke T., David M. Uterine artery embolization (UAE) for fibroid treatment: results of 6th Radiological Gynecological Expert Meeting. Rofo. 2017;189(6):511–4. https://doi.org/10.1055/s-0043-108551.
15. van Overhagen H., Reekers J.A. Uterine artery embolization for symptomatic leiomioma. Cardiovasc Intervent Radiol. 2015;38(3):536–42. https://doi.org/10.1007/s00270-014-1031-x.
16. Expert Panel on Interventional Radiology; Makary M.S., Zane K., Hwang G.L. et al. ACR Appropriateness Criteria® Management of Uterine Fibroids: 2023 Update. J Am Coll Radiol. 2024;21(6S):S203–S218. https://doi.org/10.1016/j.jacr.2024.02.022.
17. Royal College of Obstetricians and Gynaecologists, Royal College of Radiologists. Clinical recommendations on the use of uterine artery embolization (UAE) in the management of fibroids. 3rd ed., 2013. https://www.rcog.org.uk/globalassets/documents/guidelines/23-12-2013_rcog_rcr_uae.pdf. [Accessed: 30.06.2024].
18. El Shamy T., Amer S.A.K., Mohamed A.A. et al. The impact of uterine artery embolization on ovarian reserve: A systematic review and meta-analysis. Acta Obstet Gynecol Scand. 2020;99;(1):16–23. https://doi.org/10.1111/aogs.13698.
19. Chen W.H., Huang K.H., Kung F.T. Effects of uterine artery occlusion during myomectomy on ovarian reserve: Serial follow-up of sex hormone levels, ultrasound parameters and Doppler characteristics. J Obstet Gynaecol Res. 2020;46(5):752–8. https://doi.org/10.1111/jog.14236.
20. Ющенко М.А., Мозес В.Г., Рудаева Е.В. и др. Современные подходы к профилактике инфекций после эмболизации маточных артерий при миоме матки. Мать и Дитя в Кузбассе. 2023;(2):66–70.
21. Политова А.К., Боломатов Н.В., Бруслик С.В. и др. Суперселективная эмболизация артерий, питающих миоматозные узлы, при лечении пациенток с миомой матки. Вестник Национального медико-хирургического Центра имени Н.И. Пирогова. 2022;17(1):23–7.
22. Озерская И.А. Стандартизация ультразвукового исследования миометрия и эндометрия (MUSA, IETA). М.: МЕДпресс-информ, 2023. 88 с.
23. Donnez J., Donnez O., Matule D. et al. Long-term medical management of uterine fibroids with ulipristal acetate. Fertil Steril. 2016;105(1):165–73.e4. https://doi.org/10.1016/j.fertnstert.2015.09.032.
24. Тихомиров А.Л., Зайратьянц О.В. Клинико-морфологическая тенденция лечения миомы матки улипристала ацетатом. Архив акушерства и гинекологии имени В.Ф. Снегирева. 2015;2(4):52–4. https://doi.org/10.17816/aog35406.
25. Адамян Л.В., Зайратьянц О.В., Тихомиров А.Л. и др. Антипролиферативное и проапоптотическое действие селективного модулятора рецепторов прогестерона улипристала на лейомиому матки in vivo. Проблемы репродукции. 2014;20(3):41–4.
26. Ciebiera M., Włodarczyk M., Wrzosek M. et al. Ulipristal acetate decreases transforming growth factor β3 serum and tumor tissue concentrations in patients with uterine fibroids. Fertil Steril. 2018;109(3):501–507.e2. https://doi.org/10.1016/j.fertnstert.2017.11.023.
27. Lethaby A, Puscasiu L, Vollenhoven B. Preoperative medical therapy before surgery for uterine fibroids. Cochrane Database Systc Rev. 2017;11(11):CD000547. https://doi.org/10.1002/14651858.CD000547.pub2.
28. Musallam K.M., Tamim H.M., Richards T. et al. Preoperative anaemia and postoperative outcomes in non-cardiac surgery: a retrospective cohort study. Lancet. 2011;15;378(9800):1396–407. https://doi.org/10.1016/S0140-6736(11)61381-0.
29. Clevenger B, Richards T. Pre-operative anaemia. Anaesthesia. 2015;70 Suppl 1:20–8, e6–8. https://doi.org/10.1111/anae.12918.
30. Ferrero S., Scala C., Vellone V.G. et al. Preoperative treatment with ulipristal acetate before outpatient hysteroscopic myomectomy. Gynecol Obstet Invest. 2020;85(2):178–83. https://doi.org/10.1159/000505604.
31. Ekanem E, Talaulikar V. Medical therapy for fibroids: what next for ulipristal acetate? Adv Ther. 2021;38(1):137–48. https://doi.org/10.1007/s12325-020-01555-z.
32. De Gasperis-Brigante C., Singh S.S., Vilos G. et al. Pregnancy outcomes following ulipristal acetate for uterine fibroids: a systematic review. J Obstet Gynaecol Can. 2018;40(8):1066–1076.e2. https://doi.org/10.1016/j.jogc.2018.05.020.
33. Donnez J., Dolmans M.-M. Uterine fibroid management: from the present to the future. Hum Reprod Update. 2016;22(6):665–86. https://doi.org/10.1093/humupd/dmw023.
34. Kyeong H.K., Choi J., Na Y.J., Kim H.G. Effects of long-term intermittent pharmacological therapy with ulipristal acetate on reducing the volume of uterine fibroids and relieving symptoms. Minerva Obstet Gynecol. 2023;75(3):236–42. https://doi.org/10.23736/S2724-606X.23.05197-7.
Об авторах
А. Л. ТихомировРоссия
Тихомиров Александр Леонидович, д.м.н., проф.
127006 Москва, Долгоруковская ул., д. 4
В. В. Казенашев
Россия
Казенашев Виктор Викторович, к.м.н.
127006 Москва, Долгоруковская ул., д. 4
О. В. Максимова
Россия
Максимова Ольга Владимировна, к.м.н.
127006 Москва, Долгоруковская ул., д. 4
М. В. Маминова
Россия
Маминова Мария Владимировна
127006 Москва, Долгоруковская ул., д. 4
Н. Л. Давыденко
Россия
Давыденко Наталья Леонидовна
125367 Москва, Волоколамское шоссе, д. 84
Н. В. Руруа
Россия
Руруа Нана Вахтанговна
125367 Москва, Волоколамское шоссе, д. 84
Т. А. Сонина
Россия
Сонина Татьяна Александровна
119602 Москва, ул. Академика Анохина, д. 8, стр. 1
Что уже известно об этой теме?
► Миома матки (ММ) – доброкачественное прогестеронзависимое образование миометрия.
► Селективные модуляторы рецепторов прогестерона (СМРП) могут быть использованы для патогенетической терапии ММ.
Что нового дает статья?
► Наиболее выраженный эффект наблюдался после первого курса терапии СМРП.
► Отсутствие регрессионного эффекта от применения СМРП может вызывать подозрение на особенности формирования и развития узлов миомы по гистологическому принципу.
► Селективная эмболизация маточных артерий (ЭМА) доступом через лучевую артерию оптимизирует данный микроинвазивный метод лечения ММ.
Как это может повлиять на клиническую практику в обозримом будущем?
► Применение СМРП в качестве предоперационной подготовки позволяет заменить миомэктомию на менее инвазивное оперативное вмешательство – ЭМА.
► Консервативный и оперативный подходы в лечении ММ не должны противопоставляться, а напротив, дополнять друг друга с целью достижения наилучших клинических исходов.
Рецензия
Для цитирования:
Тихомиров А.Л., Казенашев В.В., Максимова О.В., Маминова М.В., Давыденко Н.Л., Руруа Н.В., Сонина Т.А. Преимущества, недостатки и оптимизация органосохраняющих методов лечения миомы матки. Акушерство, Гинекология и Репродукция. 2024;18(5):635-647. https://doi.org/10.17749/2313-7347/ob.gyn.rep.2024.550
For citation:
Tikhomirov A.L., Kazenashev V.V., Maksimova O.V., Maminova M.V., Davydenko N.L., Rurua N.V., Sonina T.A. Advantages, disadvantages and optimization of organ-sparing methods for uterine fibroids treatment. Obstetrics, Gynecology and Reproduction. 2024;18(5):635-647. (In Russ.) https://doi.org/10.17749/2313-7347/ob.gyn.rep.2024.550

Контент доступен под лицензией Creative Commons Attribution-NonCommercial-ShareAlike 4.0 International License.










































