Перейти к:
Концепция тромбовоспаления как основы тромботических осложнений, прогрессии опухоли и метастазирования у онкогинекологических больных
https://doi.org/10.17749/2313-7347/ob.gyn.rep.2024.542
Аннотация
Результаты исследований последних лет показывают, что в патогенез тромбоза при раке, а также в прогрессию опухоли, метастазирование и формирование химиорезистентности большой вклад вносят биология опухоли, активация свертывания и воспаления. Рак является независимым предиктором тромбоза. Опухолевые клетки в процессе канцерогенеза экспрессируют провоспалительные цитокины, проангиогенные и прокоагулянтные факторы, а также стимулируют другие клетки к экспрессии различных компонентов, способствуя развитию тромбовоспаления. Открытие внеклеточных ловушек нейтрофилов (англ. neutrophil extracellular traps, NETs) дает возможность по-новому взглянуть на биологию нейтрофилов и их участие в тромбовоспалении и опухолевом процессе. Тесное взаимодействие между опухолевыми клетками, опухоль-ассоциированными нейтрофилами и NETs с участием других игроков микроокружения опухоли лежит в основе активации тромбовоспаления у онкологических пациентов, что не только приводит к тромбообразованию, но и способствует росту и диссеминации опухоли.
Ключевые слова
Для цитирования:
Макацария А.Д., Слуханчук Е.В., Бицадзе В.О., Солопова А.Г., Хизроева Д.Х., Ашрафян Л.А., Серов В.Н., Войновский А.Е., Унгиадзе Д.Ю., Лазарчук А.В., Третьякова М.В., Макацария Н.А., Сальникова П.В., Гашимова Н.Р., Григорьева К.Н., Закашанский К.Л., Элалами И., Гри Ж. Концепция тромбовоспаления как основы тромботических осложнений, прогрессии опухоли и метастазирования у онкогинекологических больных. Акушерство, Гинекология и Репродукция. 2024;18(4):450-463. https://doi.org/10.17749/2313-7347/ob.gyn.rep.2024.542
For citation:
Makatsariya A.D., Slukhanchuk E.V., Bitsadze V.O., Solopova A.G., Khizroeva J.Kh., Ashrafyan L.A., Serov V.N., Voynovskiy A.Е., Ungiadze J.Yu., Lazarchuk A.V., Tretyakova M.V., Makatsariya N.A., Salnikova P.V., Gashimova N.R., Grigoreva K.N., Zakashansky K.L., Elalamy I., Gris J. The concept of thromboinflammation underlying thrombotic complications, tumor progression and metastasis in gynecological cancer patients. Obstetrics, Gynecology and Reproduction. 2024;18(4):450-463. https://doi.org/10.17749/2313-7347/ob.gyn.rep.2024.542
Введение / Introduction
О тесной связи между раком и тромбозом известно в течение почти 150 лет. Последние 20 лет большое внимание международного сообщества обращено на проблему рак-ассоциированных тромбозов. Идет активное изучение их механизмов, биомаркеров, создаются все новые шкалы оценки риска рак-ассоциированного тромбоза, поиск новых терапевтических мишеней. Кроме непосредственного вреда, который оказывают тромбоэмболические осложнения онкологическим пациентам, рак-ассоциированный тромбоз мешает проведению адекватной противоопухолевой терапии. Находясь длительно после эпизода тромбоза на антикоагулянтной терапии, пациент зачастую не может быть подвергнут ни оперативному вмешательству ввиду высокого риска; ему также нет возможности назначить ряд эффективных средств химиотерапии с выраженным прокоагулянтным эффектом. Кроме того, прием антикоагулянтов на протяжении длительного времени повышает уже риск развития значительных кровотечений у онкологических больных. У пациентов с рак-ассоциированным тромбозом ранее одобренные для использования препараты – оральные антикоагулянты, ингибиторы Ха фактора показали, с одной стороны, свою эффективность и возможность их использования в качестве альтернативы парентеральному введению низкомолекулярного гепарина, с другой стороны, их использование сопровождается повышенным риском кровотечения, особенно при ряде опухолей, а также взаимодействием с противоопухолевыми средствами.
Традиционно рак-ассоциированный тромбоз рассматривали лишь с позиции венозной тромбоэмболии, однако в последние годы было показано, что у онкологических пациентов повышен риск развития и артериальных тромбозов. В настоящее время тема артериальных тромбозов при раке является перспективной к разработке с позиций уточнения механизмов развития и факторов риска.
У онкологинекологических пациенток повышенный риск тромбоза традиционно объясняется триадой Вирхова – способностью опухоли вызывать гиперкоагуляцию, стаз крови и дисфункцию эндотелия. Многочисленные результаты исследований, полученных за последние годы, позволяют описать у онкологических больных патогенез тромбоза другой триадой, а именно, триадой тромбовоспаления (рис. 1). В состав триады тромбовоспаления в таком случае войдут биологические свойства опухолевой ткани и запускаемая опухолью активация системы гемостаза и реакций воспаления. Реакции тромбовоспаления при этом, с одной стороны, запускают опухоль, а с другой, они способствуют ее прогрессии и метастазированию.

Рисунок 1. Триада Вирхова и триада тромбовоспаления [рисунок авторов].
Figure 1. Virchow's triad and thromboinflammation triad [drawn by authors].
Тромбовоспаление: определение понятия / Thromboinflammation: definition of concept
2004 год считается годом возникновения понятия тромбовоспаления. Именно в этом году V. Brinkmann с соавт. открыли внеклеточные ловушки нейтрофилов (англ. neutrophil extracellular traps, NETs) и процесс, в результате которого они формируются – нетоз [1]. Понятие тромбовоспаления включает в себя взаимную активацию системы гемостаза и реакций воспаления [2].
Тромбовоспаление как процесс является результатом развития и взаимодействия других более простых процессов живых организмов. Реакции на повреждение и инфекционные агенты на ранних этапах эволюции животных были едиными. Они являются прототипами нынешних реакций тромбовоспаления. Так, например, реакции коагуляции отвечали не только за гемостаз при повреждении сосуда, но и за воспаление и регенерацию. У некоторых беспозвоночных и сейчас коагуляция происходит в гемолимфе. Принимающие в ней участие клетки носят название гемоцитов. У более развитых позвоночных они являются клетками-предшественниками современных тромбоцитов. Под влиянием внешних факторов гемоциты запускают процессы коагуляции гемолимфы, одновременно захватывают патоген и ограничивают его распространение. Данный процесс является ранней базовой реакцией, которая позднее подразделилась на 3 системы реагирования – гемостаз, иммунитет и воспаление. В наше время у человека в тромбовоспалении принимают участие тромбоциты, система гемостаза, компоненты комплемента, клетки-участники воспалительной реакции, лейкоциты и нейтрофилы, выделяемые ими провоспалительные цитокины, производные сложных процессов с их участием – внеклеточные ловушки нейтрофилов, клетки врожденного иммунитета [2]. Реакции тромбовоспаления уже выявлены при различных заболеваниях, включая критические состояния, такие как сепсис и инсульт.
Нейтрофилы / Neutrophils
Полиморфно-ядерные нейтрофилы – самый распространенный тип лейкоцитов. Свое название они получили в связи с отсутствием окрашивания при проведении лабораторной диагностики. Их также называют полиморфно-ядерными за счет дольчатой структуры ядра. Нейтрофилы являются главными клетками противомикробной защиты за счет мощного антимикробного арсенала гранул. Опухоли – это своего рода незаживающие раны. Среди многих компонентов микроокружения опухоли нейтрофилы и их продукты одни из тех, кто участвует в опухолевой прогрессии, уклонении от иммунного надзора и метастазировании [3].
Нейтрофилы уничтожают патогены, используя комбинацию механизмов, таких как окислительный взрыв, фагоцитоз, выброс антимикробных субстанций и NETs. Последние – основные игроки тромбовоспаления, приводящие к дисрегуляции всех звеньев системы гемостаза.
Нейтрофилы привлекаются в участок воспаления в 3 этапа: активация, адгезия и экстравазация, в которых активное участие принимают хемокины и селектины [4]. Активируют нетоз различные агенты, в том числе провоспалительные медиаторы, в частности, хемокины. Последние присутствуют в большом количестве в опухолевом микроокружении. Недавние исследования показали, что нейтрофилы обладают нейтрофильными адаптивными (подобными памяти) реакциями. Например, использование БЦЖ (англ. bacillus Calmette-Guerrin, BCG) способствует развитию адаптивного ответа нативных нейтрофилов [5], что приводит к перепрограммированию транскриптома нейтрофилов и эпигенетическим модификациям и высвобождению провоспалительных медиаторов. При повторной стимуляции нейтрофилов они быстро привлекаются и активируются с более интенсивной иммунной реакцией.
Тромбоциты активируют клетки опухоли, которые активируют тромбоциты. Так замыкается порочный круг рак-ассоциированного тромбоза. Кроме того, тромбоциты активируют нейтрофилы к выбросу NETs и усилению течения дальнейших реакций тромбовоспаления, прогрессии опухоли и появлению метастазов [2]. Основными игроками на поле тромбовоспаления являются NETs. Все виды тромбов у онкологических пациентов содержат NETs. Это свидетельствует о том, что тромбовоспаление является неотъемлемой частью патогенеза тромбоза [6].
Внеклеточные ловушки нейтрофилов / Neutrophil extracellular traps
Нейтрофилы являются источниками внеклеточных ловушек, которые формируются в результате сложной последовательности реакций под названием нетоз. NETs состоят из нитей деконденсированной ДНК, белков и гистонов. Нити ДНК формируют структуру сетей, в которых «запутаны» остальные компоненты NETs. Губительным влиянием на ткани обладают эластаза нейтрофилов (англ. neutrophil elastase, NE), миелопероксидаза (англ. myeloperoxidase, MPO) и катепсин G в структуре NETs [2][7]. Нетоз по своей интенсивности может быть физиологическим и избыточным. Избыточный нетоз способствует как патологическому тромбообразованию, так и кровоизлияниям, острому воспалению и деструкции тканей [8]. Участие NETs в патогенезе развития уже установлено для аутоиммунных заболеваний, таких как псориаз, системная красная волчанка, ревматоидный артрит, а также атеросклероз, васкулит, онкологические заболевания и др. [9].
Провоспалительные цитокины / Proinflammatory cytokines
Содержание интерлейкинов (англ. interleukins, ILs) в плазме крови значительно повышено у онкологических больных, особенно у пациентов с венозными тромбозами. По результатам опубликованных исследований, интерлейкины, в частности IL-8, при индукции его сверхэкспрессии на фоне немелкоклеточного рака легкого напрямую влиял на интенсивность нетоза [10][11]. Опухолевые клетки активно выделяют провоспалительные цитокины. NETs активируют синтез цитокинов в макрофагах [12]. Далее, вновь синтезированные цитокины активно участвуют в усилении нетоза. Исследованиями in vitro была подтверждена индукция интерлейкином IL-1β реакций нетоза. При этом нетоз не подавлялся воздействием антагониста рецептора интерлейкина-1 (англ. interleukin-1 receptor antagonist, IL-1RA) [13].
Интерлейкин-8 выделяют макрофаги, клетки эндотелия и эпителиальные клетки, в которых содержатся толл-подобные рецепторы (англ. toll-like receptors, TLRs) [13]. IL-8 обеспечивает привлечение нейтрофилов в участок воспаления и последующий нетоз. Концентрация IL-8 значительно повышена при гепатоцеллюлярной карциноме и карциноме носоглотки, при опухолях предстательной железы и толстой кишки [14]. На фоне химиотерапии паклитакселом у пациенток с опухолями яичников в плазме крови концентрация IL-8 снижается, в связи с чем его можно рассматривать в качестве маркера эффективности терапии. За счет взаимодействия IL-8 с рецепторами IL-8-R1/2 на поверхности нейтрофилов происходит доставка нейтрофилов к клеткам опухоли [15][16]. У онкологических пациентов в большинстве исследований констатируют высокие концентрации циркулирующего IL-8 [17]. IL-8 благоприятствует росту и инвазии опухоли, формированию новой опухолевой сосудистой сети и метастатическому распространению опухоли [18]. Более злокачественный фенотип опухолей с худшим прогнозом определяют в опухолях, продуцирующих в большом количестве IL-8 [19].
Активируют мегакариопоэз и повышают концентрацию тромбоцитов IL-1 и IL-6. IL-2 снижает секрецию альфа-гранул тромбоцитами, в то время как интерферон гамма (англ. interferon gamma, IFN-γ) и IL-1 повышают выброс плотных гранул. Путь тромбомодулин–протеин С–протеин S подавляют IL-1 и фактор некроза опухоли альфа (англ. tumor necrosis factor alpha, TNF-α). Клетки эндотелия и моноциты в большом количестве выделяют тканевой фактор (англ. tissue factor, TF) под влиянием TNF-α и IL-6 [20][21]. Под влиянием IL-1, TNF-α и IFN-γ клетки эндотелия выделяют ингибитор активатора плазминогена-1 (англ. plasminogen activator inhibitor-1, PAI-1) [1][22].
Структурные компоненты внеклеточных ловушек нейтрофилов / Structural constituents of neutrophil extracellular traps
Тромбовоспаление переходит из разряда нормальной реакции на раздражитель в патологический процесс при избыточном нетозе в результате либо повышенного синтеза NETs, либо сбоя в их утилизации. Циркулирующие в большом количестве экзогенные и эндогенные ДНКазы в условиях воспалительного процесса разрушают NETs. При этом происходит высвобождение гистонов-протеаз из связи с ДНК с последующей реализацией их протеолитических свойств. Они разрушают внеклеточный матрикс, повреждают эндотелий и другие клетки [23]. После повреждения гистонами эндотелий начинает выделять Н2О2, вновь запуская нетоз.
NETs воздействуют на все звенья системы гемостаза [24]. Активация гемостаза происходит по внутреннему и по внешнему путям. ДНК NETs вместе с TF, выступая в роли кофактора тромбин-зависимой активации фактора XI, участвует в активации по внешнему пути [25]. ДНК NETs на отрицательно заряженных поверхностях проводит активацию по внутреннему пути с активацией фактора XII [26]. Гистоны NETs активируют тромбоциты с участием тромбина [27]. Гистон Н4, связываясь с протромбином, активирует его.
Фибринолиз затрудняется компонентами NETs по нескольким направлениям. Укрепление протофибрил фибрина происходит на фоне латеральной агрегации с участием гистонов. Утолщение фибрина происходит и за счет нековалентных и ковалентных связей с гистонами. Плазмин не способен обеспечить полноценный фибринолиз за счет проникновения ДНК NETs в фибрин. Гистоны выступают в роли мишеней и подавляют работу плазмина, занимают участки связывания с фибрином на плазминогене [6][28]. ДНК NETs нарушает tPA-опосредованный (англ. tissue plasminogen activator, tPA) переход плазминогена в плазмин в связи с формирование комплексов PAI-1 с tPA [29].
NETs за счет влияния гистонов нарушают работу основных антикоагулянтов. Активированный протеин С (англ. activated protein C, APC) инактивируют нейтрофильная оксидаза и эластаза. Гистоны нарушают взаимодействие антитромбина, тромбомодулина и тромбина [30].
Результатом активации эндотелия, в том числе и компонентами NETs, является выделение фактора фон Виллебранда (англ. von Willebrand factor, vWF). После экзоцитоза vWF привлекает большое количество тромбоцитов в участок повреждения эндотелия, что способствует микротромбообразованию. Таким образом, NETs вмешиваются в нормальную работу оси ADAMTS-13/vWF.
Так, избыточный нетоз при различных состояниях, в том числе и у онкологических пациентов, ведет к полной дисрегуляции системы гемостаза.
Антифосфолипидные антитела / Antiphospholipid antibodies
Все больше исследований доказывают связь между циркуляцией антифосфолипидных антител (АФА) и процессами тромбовоспаления. S. Yalavarthi c соавт. описали запускаемый антикардиолипиновыми антителами (англ. anticardiolipin antibodies, aCL) нетоз при антифосфолипидном синдроме (АФС) как новый механизм тромбоза [31]. АФА активируют нейтрофилы c последующим нетозом. Это подтверждает тот факт, что нейтрофилы от пациентов с АФС усиливают спонтанное высвобождение NETs. Обнаружена in vivo положительная корреляция между концентрациями волчаночного антикоагулянта (англ. lupus anticoagulant, LA), IgG антител к β2-гликопротеину 1 (англ. anti-β2-glycoprotein 1 antibodies, aβ2-GP1), IgG aCL и циркулирующими комплексами МPО-ДНК in vivo. На поверхности нейтрофилов также выявлен β2-GP1, что объясняет связывание aβ2-GP1 с нейтрофилами с запуском нетоза [6].
Высвобождаемые при нетозе молекулы система иммунитета расспознает как аутоантигены. При этом после запуска аутоиммунных реакций формируется порочный круг, способствующий дальнейшему высвобождению аутоантигенов [32]. Нетоз приводит как к протромботическому состоянию, так и к синтезу АФА. Замыкая порочный круг, эти два процесса у онкологических пациентов взаимно усиливают друг друга, способствуя созданию протромботического состояния.
Фактор фон Виллебранда и металлопротеиназа ADAMTS-13 / Von Willebrand factor and metalloproteinase ADAMTS-13
В регуляции микротромбообразования в организме человека принимает участие крупный мультимерный гликопротеин vWF, который выделяется эндотелием при повреждении. Основной задачей мультимера является привлечение, активация и агрегация тромбоцитов на коллагеновом матриксе субэндотелиального слоя с последующим формированием тромба и остановкой кровотечения. Помимо этого, vWF участвует в воспалительных реакциях, в опухолевом росте, ангиогенезе и метастазировании. Концентрация vWF значительно повышена при различных злокачественных новообразованиях (рис. 2).
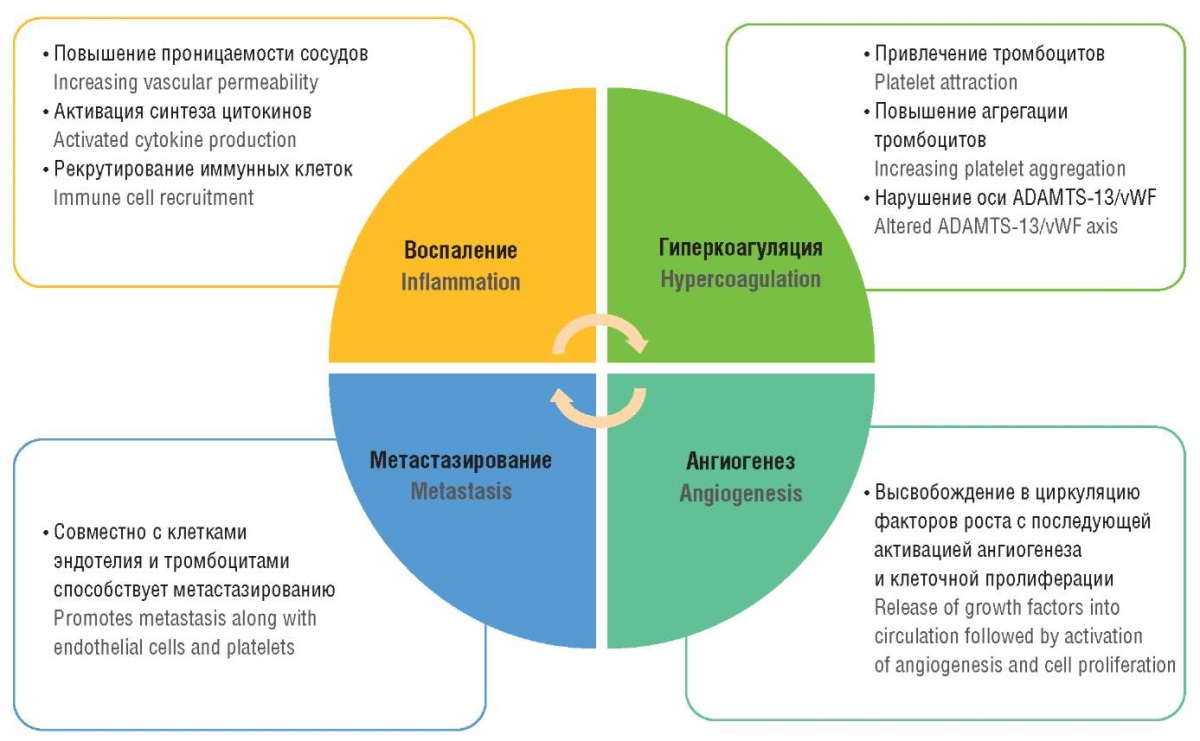
Рисунок 2. Фактор фон Виллебранда в структуре концепции тромбовоспаления при раке
[рисунок авторов].
Figure 2. Von Willebrand factor in the pattern of thromboinflammation concept in cancer
[drawn by authors].
Металлопротеиназа ADAMTS-13 (англ. a disintegrin and metalloproteinase with thrombospondin type 1 motif, member 13) является основным фактором, определяющим количество мультимеров vWF. Накопление vWF и снижение уровня ADAMTS-13 ведет к образованию агрегатов vWF с тромбоцитами и отложению фибрина в микрососудистой сети. Данный процесс носит название феномена микроангиопатии при раке [33].
Согласно данным литературы, повышение концентрации vWF и/или снижение концентрации ADAMTS-13 были сопряжены с худшим прогнозом выживания при колоректальном раке [34], опухолях головы и шеи [35], раке легких [36] и макроглобулинемии Вальденстрема [37]. Механизм, вызывающий снижение концентрации ADAMTS-13 в плазме крови онкологических пациентов, не до конца изучен. Различные онкогены регулируют экспрессию внеклеточных протеиназ, которые могут непосредственно нарушать работу фермента.
Врожденный и приобретенный дефицит фермента ADAMTS-13, снижение концентрации и активности vWF являются потенциальными маркерами риска микротромбообразования. Опухолевые клетки в процессе своего роста и инвазии нарушают целостность и активируют клетки эндотелия. На этом фоне высвобождается большое количество мультимеров vWF, а также запускается активация металлопротеиназы ADAMTS-13. При массивной активации эндотелия идет интенсивное потребление ADAMTS-13 c последующим снижением как ее концентрации, так и активности. Между степенью активации эндотелия и опухолевым ростом существует прямая зависимость. По мере роста опухолевой ткани интенсивность потребления ADAMTS-13 нарастает. Аналогично ситуация обстоит и при других состояниях, сопровождающихся эндотелиопатией, таких как системные воспалительные заболевания, сепсис и ДВС-синдром. Мультимеры vWF на фоне абсолютного или относительного (при циркуляции ингибиторов) дефицита ADAMTS-13 запускают активацию и агрегацию тромбоцитов с формированием смешанных опухолево-тромбоцитарных тромбоэмболов.
Фактор фон Виллебранда облегчает адгезию на эндотелии и переход опухолевых клеток через стенку сосуда. Таким образом он облегчает процессы метастазирования [36]. В исследованиях in vitro клетки меланомы сами активировали эндотелий и способствовали выбросу эндотелием мультимеров vWF с последующей агрегацией тромбоцитов и тромбозом [38]. Как показали исследования, при раке снижение концентрации ADAMTS-13 на фоне избыточного выброса vWF ведет к тромбозу. Эту ситуацию потенциально можно скорректировать введением рекомбинантной ADAMTS-13 (rADAMTS-13) [38].
Активность ADAMTS-13 снижают NETs, которые связываются с vWF путем электростатического взаимодействия свободной ДНК с доменом A1 и привлекают в очаг новые нейтрофилы [6][39][40]. Гепарин способен препятствовать этому взаимодействию [41]. Помимо этого, ДНК NETs занимает участки связывания гликопротеина Iba (англ. glycoprotein Iba, GPIba) в домене А1 в vWF [20][42].
Положительно заряженные фрагменты NE позволяют ей связываться с vWF. Для привлечения тромбоцитов и лейкоцитов к эндотелию vWF является ключевым медиатором. Результатом взаимодействия vWF является привлечение большего количества лейкоцитов к активированному эндотелию [20]. Эксперимент показал, что тромбоциты после активации стимулируют нетоз только в присутствии vWF [43][44].
Снижение концентрации и активности ADAMTS-13, а также рост концентрации и активности vWF являются универсальными механизмами тромбоза в микроциркуляторном русле при таких состояниях, как сепсис и ДВС-синдром [45]. NETs влияют на активность ADAMTS-13 и vWF. Активированные нейтрофилы и NETs за счет влияния таких своих производных, как протеазы, пептиды, цитокины и реактивные формы кислорода меняют структуру и конформацию связывающих участков ADAMTS-13.
Пептидил-аргинин деиминаза 4 (англ. peptidyl arginine deiminase 4, PAD4) принимает активное участие в нетозе и цитруллинировании белков. Фермент PAD4 обнаруживается в ядре лейкоцитов. Цитруллинирование – это превращение в белках остатков аргинина в остатки цитруллина под действием PAD4, лишающее белок заряда [46–49]. После привлечения и стимуляции нейтрофилов происходит фосфорилирование НАДФН-оксидазы, синтез реактивных форм кислорода и цитруллинирование гистонов. Подавление PAD4 снижает интенсивность нетоза за счет отсутствия цитруллинирования гистона H3 и связанных с этим последующих реакций синтеза NETs [50]. У мышей, лишенных PAD4, нет способности к деконденсации хроматина и последующему нетозу [49][51].
Пептидил-аргинин деиминаза 4 также является составной частью NETs. Она участвует в формировании NETs, преобразуя остатки аргинина в гистонах в цитруллин [52] и деконденсируя хроматин. PAD4 может цитруллинировать и металлопротеиназу ADAMTS-13 в плазме крови на остатки аргинина, меняя структуру и, как следствие, ее активность [20][53].
В состав NETs входят альфа-дефенсины или пептиды нейтрофилов человека (англ. human neutrophil peptides, HNPs), которые играют большую роль в иммунных реакциях в организме человека. За счет способности активировать тромбоциты [54] и снижать фибринолиз они обладают прокоагулянтными свойствами [55]. HNPs связываются с А2 доменом в vWF, за счет чего модулируют функционирование оси ADAMTS-13/vWF. Исследования показали, что у пациентов с острой тромботической тромбоцитопенической пурпурой (ТТП) в плазме крови концентрации HNPs повышены [20][56].
Одной из протеаз NETs является миелопероксидаза, которая является катализатором реакции синтеза хлорноватистой кислоты из H2O2 и Cl–. Хлорноватистая кислота окисляет метионин до метионинсульфоксида. Это происходит в участке расщепления ADAMTS-13 в A2 домене vWF и в самой ADAMTS-13, что нарушает функционирование оси ADAMTS-13/vWF [57–59]. За счет влияния системы MPO–H2O2–Cl– при нетозе происходит нарушение баланса в системе ADAMTS-13/vWF и, как результат, тромбообразование в микрососудистом русле [20]. Плазмин и NE in vitro расщепляют ADAMTS-13 в плазме крови. Исследования продемонстрировали вклад нетоза и тромбовоспаления в массивное микротромообразование у пациентов с острыми формами ТТП, у которых оказались повышены концентрации в плазме крови компонентов NETs – комплексов ДНК-гистон и МPО и снижена концентрация тромбоцитов [20][60].
Провоспалительные цитокины контролируют выброс эндотелием и расщепление мультимеров vWF на более мелкие фрагменты [20][61]. IL-6 подавляет расщепление мультимеров vWF металлопротеиназой ADAMTS-13. Комплекс IL-6/IL-6-рецептор, TNF-α и IL-8 усиливают выброс мультимеров vWF [62].
При ДВС-синдроме на фоне сепсиса определяются низкомолекулярные формы ADAMTS-13 [56]. Снижение концентрации и активности ADAMTS-13 на фоне избыточного нетоза обеспечивает циркуляцию мультимеров vWF, привлекающих и активирующих все больше нейтрофилов и тромбоцитов. Введение ДНКазы I или рекомбинантной ADAMTS-13 является потенциальным механизмом выхода из формирующегося таким образом порочного круга [20].
Тромбовоспаление и резистентность к химиотерапии / Thromboinflammation and chemotherapy resistance
Традиционно считалось, что опухолевая ткань является основным источником свободной ДНК (свДНК) в плазме крови онкологических пациентов. На фоне опухолевого процесса свДНК напоминает ДНК из NETs, а значит, нетоз может лежат в основе химиорезистентности [63].
В эксперименте у мышей PAD4+/+ с опухолью легкого при использовании химиопрепаратов на основе платины отмечен выброс свДНК и тромбообразование. Аналогичных изменений не выявлено у мышей PAD4–/–, что означает, что рост концентрации свДНК и тромбина при использовании платиносодеращий химиотерапии непосредственно связан с PAD4 и нетозом, что было подтверждено и другими исследованиями (рис. 3) [49][64][65]. Не апоптоз или некроз, а нетоз увеличивает концентрацию свДНК в плазме крови [65]. У мышей PAD4+/+ на фоне химиотерапии введение ДНКазы снижало риск тромбообразования, чего не было отмечено у мышей PAD4–/– [66]. Нетоз под воздействием гранулоцитарного колониестимулирующего фактора (англ. granulocyte colony-stimulating factor, G-CSF) запускают опухоль-ассоциированные нейтрофилы [64]. Результаты проведенных исследований доказывают связь между опухолевой прогрессией, концентрацией нейтрофилов и ростом содержания G-CSF и свДНК в плазме крови онкологических пациентов [66].
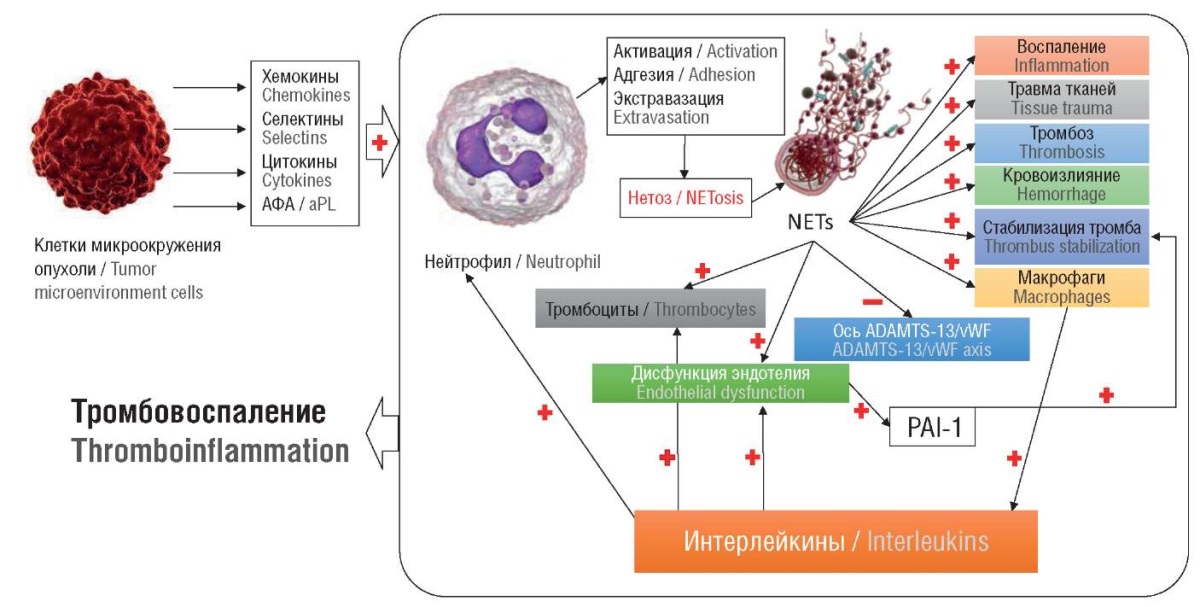
Рисунок 3. Интегральная концепция тромбовоспаления при раке [рисунок авторов].
Примечание: АФА – антифосфолипидные антитела;
NETs – внеклеточные ловушки нейтрофилов; vWF – фактор фон Виллебранда;
PAI-1 – ингибитор активатора плазминогена-1.
Figure 3. Integral concept of thromboinflammation in cancer [drawn by authors].
Note: aPL – antiphospholipid antibodies; NETs – neutrophil extracellular traps;
vWF – von Willebrand factor; PAI-1 – plasminogen activator inhibitor-1.
Нейтрофилы и ранее у ученых ассоциировались с плохим ответом на иммунотерапию препаратами-ингибиторами контрольных точек. Как показали последние исследования, нетоз действительно лежит в основе плохого ответа на химиотерапию [67]. При использовании препаратов-ингибиторов контрольных точек при аденокарциноме поджелудочной железы нетоз ограждал опухолевые клетки от действия CD8+ T-клеток [49][68].
Окутывая опухолевую клетку и препятствуя контакту с CD8+ Т-клетками и клетками-естественными киллерами, NETs in vitro механически защищают опухоль. Разрушить этот каркас в эксперименте позволяет введение ДНКазы 1. Однако для деградации NETs требуются сверхфизиологические концентрации ДНКазы 1 [49][69][70]. Помимо этого, эффективность тромболизиса повышается за счет одновременной обработки сгустков крови ДНКазой и tPA [49][71].
В настоящее время доказана роль в формировании химиорезистентности эластазы нейтрофилов, матричной металлопротеиназы (англ. matrix metalloproteinase, ММР) ММР-9 и катепсина G, а также лиганда запрограммированной клеточной гибели 1 (англ. programmed cell death ligand-1, PD-L1) и молекулы карциноэмбрионального антигена клеточной адгезии 1 (англ. carcinoembryonic antigen cell adhesion molecule 1, CEACAM1) [49][72]. MMP-9 – металлопротеиназа, разрушающая внеклеточный матрикс (ВКМ) [73]. Исследования продемонстрировали химиорезистентность опухоли и деградацию ВКМ на фоне повышенной экспрессии ММР-9 при раке желудка [74]. ММР-9 также участвует в неоангиогенезе опухоли и снижает перфузию в опухоль химиотерапевтических препаратов [49][75]. Один из компонентов NETs – нейтрофильная эластаза способствует росту опухоли, влияя на эпителиально-мезенхимальный переход, в результате которого опухолевая клетка переходит в мезенхимальный фенотип [72][76]. Клетки мезенхимального фенотипа обладают большей, по сравнению с исходной, способностью к миграции и апоптозу [49][77]. Трансмембранный гликопротеин CEACAM1 также входит в состав NETs и принимает участие в истощении пула Т-клеток и активации адгезии и миграции клеток опухоли [49][78]. Мембранный рецептор запрограммированной клеточной гибели 1 (англ. programmed cell death protein-1, PD-1) в норме регулирует противоопухолевую активность Т-клеток. Истощение пула Т-клеток происходит на фоне взаимодействия PD-1 и PDL-1, входящего в состав NETs, что неумолимо ведет к развитию резистентности к иммунотерапии [79–81]. Участие нейтрофилов и NETs в формировании химиорезистентности многокомпонентно и требует дальнейшего изучения, как и пути возможного преодоления этой резистентности.
Связь между нейтропенией и улучшением прогноза выживаемости давно привлекала внимание, но не имела логического объяснения. В настоящее время объяснить этот феномен возможно благодаря знаниям о механизмах тромбовоспаления. Нейтропения на этом фоне не только представляется маркером эффективности химиотерапии, но подтверждает существование NETs-зависимых механизмов резистентности.
Заключение / Conclusion
Значение тромбовоспаления в целом и нетоза в частности в клинической онкологии находится на старте изучения. Уже полученные о тромбовоспалении данные определяют необходимость углубления знаний в этой области. Актуальность проблемы тромбовоспаления и нарушений гемостаза у онкологических пациентов обусловлена необходимостью усовершенствования принципов профилактики осложнений и прогнозирования течения заболевания. Молекулярные механизмы онкотромбозов, прогрессии опухоли и метастазирования у онкогинекологических пациенток с учетом новых данных о тромбовоспалении в онкогинекологии, а также основанные на них подходы к лабораторной диагностике и терапии остаются крайне актуальными вопросами современной медицины.
Список литературы
1. Brinkmann V., Reichard U., Goosmann C. et al. Neutrophil extracellular traps kill bacteria. Science. 2004;303(5663):1532-5. https://doi.org/10.1126/science.1092385.
2. Бицадзе В.О., Слуханчук Е.В., Солопова А.Г. и др. Роль микроокружения в росте и распространении опухоли. Акушерство, Гинекология и Репродукция. 2024;18(1):96-111. https://doi.org/10.17749/2313-7347/ob.gyn.rep.2024.489.
3. Слуханчук Е.В., Бицадзе В.О., Солопова А.Г. и др. Тромбовоспаление у онкологических больных. Акушерство, Гинекология и Репродукция. 2022;16(5):611-22. https://doi.org/10.17749/2313-7347/ob.gyn.rep.2022.355.
4. Leal A.C., Mizurini D.M., Gomes T. et al. Tumor-derived exosomes induce the formation of neutrophil extracellular traps: implications for the establishment of cancer-associated thrombosis. Sci Rep. 2017;7(1):1-12. https://doi.org/10.1038/s41598-017-06893-7.
5. Moorlag S.J., Rodriguez-Rosales Y.A., Gillard J. et al. BCG vaccination induces long-term functional reprogramming of human neutrophils. Cell Rep. 2020;33(7):108387. https://doi.org/10.1016/j.celrep.2020.108387.
6. Макацария А.Д., Слуханчук Е.В., Бицадзе В.О. и др. Тромботический шторм, нарушения гемостаза и тромбовоспаление в условиях COVID-19. Акушерство, Гинекология и Репродукция. 2021;15(5):499-514. https://doi.org/10.17749/2313-7347/ob.gyn.rep.2021.247.
7. Слуханчук Е.В., Бицадзе В.О., Солопова А.Г. и др. Вклад внеклеточных ловушек нейтрофилов в протромботическое состояние и прогрессию опухоли у онкогинекологических пациенток. Акушерство, Гинекология и Репродукция. 2023;17(1):53-64. https://doi.org/10.17749/2313-7347/ob.gyn.rep.2023.385.
8. Слуханчук Е.В., Бицадзе В.О., Солопова А.Г. и др. Внеклеточные ловушки нейтрофилов как маркеры тромбовоспаления в патогенезе злокачественных новообразований женских половых органов и молочной железы. Акушерство, Гинекология и Репродукция. 2022;16(4):426-37. https://doi.org/10.17749/2313-7347/ob.gyn.rep.2022.335.
9. Слуханчук Е.В. NETs и онкологический процесс. Акушерство, Гинеко-логия и Репродукция. 2021;15(1):107—16. https://doi.org/10.17749/2313-7347/ob.gyn.rep.2021.204.
10. Sunaga N., Imai H., Shimizu K. et al. Oncogenic KRAS-induced interleukin-8 overexpression promotes cell growth and migration and contributes to aggressive phenotypes of non-small cell lung cancer. Int J Cancer. 2012;130(8):1733-44. https://doi.org/10.1002/ijc.26164.
11. Alfaro C., Teijeira A., Onate C. et al. Tumor-produced interleukin-8 attracts human myeloid-derived suppressor cells and elicits extrusion of neutrophil extracellular traps (NETs). Clin Cancer Res. 2016;22(15):3924— 36. https://doi.org/10.1158/1078-0432.CCR-15-2463.
12. Magna M., Pisetsky D.S. The alarmin properties of DNA and DNA-associated nuclear proteins. Clin Ther. 2016;38(5):1029-41. https://doi.org/10.1016/j.clinthera.2016.02.029.
13. Meher A.K., Spinosa M., Davis J.P. et al. Novel role of IL (interleukin)-1 p in neutrophil extracellular trap formation and abdominal aortic aneurysms. Arterioscler Thromb Vasc Biol. 2018;38(4):843-53. https://doi.org/10.1161/ATVBAHA.117.309897.
14. Zarogoulidis P., Katsikogianni F., Tsiouda T. et al. Interleukin-8 and interleukin-17 for cancer. Cancer Invest. 2014;32(5):197-205. https://doi.org/10.3109/07357907.2014.898156.
15. Kohidai L., Csaba G. Chemotaxis and chemotactic selection induced with cytokines (IL-8, Rantes and TNF-alpha) in the unicellular Tetrahymena pyriformis. Cytokine. 1998;10(7):481-6. https://doi.org/10.1006/cyto.1997.0328.
16. Nie M., Yang L., Bi X. et al. Neutrophil extracellular traps induced by IL8 promote diffuse large B-cell lymphoma progression via the TLR9 signaling NETs promote DLBCL progression. Clin Cancer Res. 2019;25(6):1867-79. https://doi.org/10.1158/1078-0432.CCR-18-1226.
17. Baggiolini M., Walz A., Kunkel S. Neutrophil-activating peptide-1/ interleukin 8, a novel cytokine that activates neutrophils. J Clin Invest. 1989;84(4):1045-9. https://doi.org/10.1172/JCI114265.
18. Xu H., Zeng Y., Liu L. et al. PRL-3 improves colorectal cancer cell proliferation and invasion through IL-8 mediated glycolysis metabolism. Int J Oncol. 2017;51(4):1271-9. https://doi.org/10.3892/ijo.2017.4090.
19. Sanmamed M.F., Carranza-Rua O., Alfaro C. et al. Serum interleukin-8 reflects tumor burden and treatment response across malignancies of multiple tissue origins serum IL8 and tumor burden. Clin Cancer Res. 2014;20(22):5697-707. https://doi.org/10.1158/1078-0432.CCR-13-3203.
20. Слуханчук Е.В., Бицадзе В.О., Солопова А.Г. и др. Иммунотромбоз у онкологических больных: вклад внеклеточных ловушек нейтрофилов, ADAMTS-13 и фактора фон Виллебранда. Акушерство, Гинекология и Репродукция. 2022;16(6):648-63. https://doi.org/10.17749/2313-7347/ob.gyn.rep.2022.364.
21. Юпатов Е.Ю., Мустафин И.Г., Курманбаев Т.Е. и др. Роль нарушений локального гемостаза в генезе патологии эндометрия. Акушерство, Гинекология и Репродукция. 2021;15(4):430-40. https://doi.org/10.17749/2313-7347/ob.gyn.rep.2021.214.
22. Malte A.L., H0jbjerg J.A., Larsen J.B. Platelet parameters as biomarkers for thrombosis risk in cancer: A systematic review and meta-analysis. Semin Thromb Hemost. 2024;50(3):360-83. https://doi.org/10.1055/s-0043-1764381.
23. Jiménez-Alcázar M., Napirei M., Panda R. et al. Impaired DNase1-mediated degradation of neutrophil extracellular traps is associated with acute thrombotic microangiopathies. J Thromb Haemost. 2015;13(5):732-42. https://doi.org/10.1111/jth.12796.
24. Gould T., Lysov Z., Liaw P. Extracellular DNA and histones: double-edged swords in immunothrombosis. J Thromb Haemost. 2015;13:S82-S91. https://doi.org/10.1111/jth.12977.
25. Vu T.T., Leslie B.A., Stafford A.R. et al. Histidine-rich glycoprotein binds DNA and RNA and attenuates their capacity to activate the intrinsic coagulation pathway. J Thromb Haemost. 2016;115(01):89-98. https://doi.org/10.1160/TH15-04-0336.
26. Naudin C., Burillo E., Blankenberg S. et al. Factor XII contact activation. Semin Thromb Hemost. 2017;43(8):814-26. https://doi.org/10.1055/s-0036-1598003.
27. Noubouossie D.F., Whelihan M.F., Yu Y.-B. et al. In vitro activation of coagulation by human neutrophil DNA and histone proteins but not neutrophil extracellular traps. Blood. 2017;129(8):1021-9. https://doi.org/10.1182/blood-2016-06-722298.
28. Longstaff C., Varju I., Sotonyi P. et al. Mechanical stability and fibrinolytic resistance of clots containing fibrin, DNA, and histones. J Biol Chem. 2013;288(10):6946-56. https://doi.org/10.1074/jbc.M112.404301.
29. Komissarov A.A., Florova G., Idell S. Effects of extracellular DNA on plasminogen activation and fibrinolysis. J Biol Chem. 2011;286(49):41949-62. https://doi.org/10.1074/jbc.M111.301218.
30. Varjú I., Longstaff C., Szabó L. et al. DNA, histones and neutrophil extracellular traps exert anti-fibrinolytic effects in a plasma environment. Thromb Haemost. 2015;113(06):1289-98. https://doi.org/10.1160/TH14-08-0669.
31. Yalavarthi S., Gould T.J., Rao A.N. et al. Release of neutrophil extracellular traps by neutrophils stimulated with antiphospholipid antibodies: a newly identified mechanism of thrombosis in the antiphospholipid syndrome. Arthritis Rheumatol. 2015;67(11):2990-3003. https://doi.org/10.1002/art.39247.
32. Obermeier H.L., Riedl J., Ay C. et al. The role of ADAMTS-13 and von Willebrand factor in cancer patients: results from the Vienna cancer and thrombosis study. Res Pract Thromb Haemost. 2019;3(3):e12197. https://doi.org/10.1002/rth2.12197.
33. Mazetto B.M., Orsi F.L., Barnabé A. et al. Increased ADAMTS13 activity in patients with venous thromboembolism. Thromb Res. 2012;130(6):889-93. https://doi.org/10.1016/j.thromres.2012.09.009.
34. Liu Y., Starr M.D., Bulusu A. et al. Correlation of angiogenic biomarker signatures with clinical outcomes in metastatic colorectal cancer patients receiving capecitabine, oxaliplatin, and bevacizumab. Cancer Med. 2013;2(2):234-42. https://doi.org/10.1002/cam4.71.
35. Sweeney J.D., Killion K.M., Pruet C.F., Spaulding M.B. von Willebrand factor in head and neck cancer. Cancer. 1990;66(11):2387-9. https://doi.org/10.1002/1097-0142(19901201)66:11<2387::aid-cncr2820661123>3.0.co;2-u.
36. Guo R., Yang J., Liu X. et al. Increased von Willebrand factor over decreased ADAMTS-13 activity is associated with poor prognosis in patients with advanced non-small-cell lung cancer. J Clin Lab Anal. 2018;32(1):e22219. https://doi.org/10.1002/jcla.22219.
37. Hivert B., Caron C., Petit S. et al. Clinical and prognostic implications of low or high level of von Willebrand factor in patients with Waldenstrom macroglobulinemia. Blood. 2012;120(16):3214-21. https://doi.org/10.1182/blood-2011-11-388256.
38. Bauer A.T., Suckau J., Frank K. et al. von Willebrand factor fibers promote cancer-associated platelet aggregation in malignant melanoma of mice and humans. Blood. 2015;125(20):3153-63. https://doi.org/10.1182/blood-2014-08-595686.
39. Goertz L., Schneider S.W., Desch A. et al. Heparins that block VEGF-A-mediated von Willebrand factor fiber generation are potent inhibitors of hematogenous but not lymphatic metastasis. Oncotarget. 2016;7(42):68527. https://doi.org/10.18632/oncotarget.11832.
40. Макацария А.Д., Слуханчук Е.В., Бицадзе В.О. и др. Внеклеточные ловушки нейтрофилов: участие в процессах воспаления и дизрегуляции гемостаза, в том числе у пациентов с COVID-19 и тяжелой акушерской патологией. Акушерство, Гинекология и Репродукция. 2021;15(4):335-50. https://doi.org/10.17749/2313-7347/ob.gyn.rep.2021.238.
41. Huang R.H., Fremont D.H., Diener J.L. et al. A structural explanation for the antithrombotic activity of ARC1172, a DNA aptamer that binds von Willebrand factor domain A1. Structure. 2009;17(11):1476-84. https://doi.org/10.1016/j.str.2009.09.011.
42. Grassle S., Huck V., Pappelbaum K.I. et al. von Willebrand factor directly interacts with DNA from neutrophil extracellular traps. Arterioscler Thromb Vasc Biol. 2014;34(7):1382-9. https://doi.org/10.1161/ATVBAHA.113.303016.
43. Carestia A., Kaufman T., Rivadeneyra L. et al. Mediators and molecular pathways involved in the regulation of neutrophil extracellular trap formation mediated by activated platelets. J Leucoc Biol. 2016;99(1):153-62. https://doi.org/10.1189/jlb.3A0415-161R.
44. Honda M., Kubes P. Neutrophils and neutrophil extracellular traps in the liver and gastrointestinal system. Nat Rev Gastroenter Hepatol. 2018;15(4):206-21. https://doi.org/10.1038/nrgastro.2017.183.
45. Farkas P., Csuka D., Mikes B. et al. Complement activation, inflammation and relative ADAMTS13 deficiency in secondary thrombotic microangiopathies. Immunobiology. 2017;222(2):119—27. https://doi.org/10.1016/j.imbio.2016.10.014.
46. Vossenaar E.R., Zendman A.J., van Venrooij W.J., Pruijn G.J. PAD, a growing family of citrullinating enzymes: genes, features and involvement in disease. Bioessays. 2003;25(11):1106—18. https://doi.org/10.1002/bies.10357.
47. Hensen S.M., Pruijn G.J. Methods for the detection of peptidylarginine deiminase (PAD) activity and protein citrullination. Mol Cell Proteomics. 2014;13(2):388-96. https://doi.org/10.1074/mcp.R113.033746.
48. van Beers J.J., Zendman A.J., Raijmakers R. et al. Peptidylarginine deiminase expression and activity in PAD2 knock-out and PAD4-low mice. Biochimie. 2013;95(2):299-308. https://doi.org/10.1016/j.biochi.2012.09.029.
49. Слуханчук Е.В., Бицадзе В.О., Солопова А.Г. и р. Маркеры внеклеточ-ных ловушек нейтрофилов у женщин со злокачественными ново-образованиями репродуктивной системы, получавших хирургическое лечение и адъювантную химиотерапию. Акушерство, Гинекология и Репродукция. 2023;17(4):420—32. https://doi.org/10.17749/2313-7347/ob.gyn.rep.2023.432.
50. Lewis H.D., Liddle J., Coote J.E. et al. Inhibition of PAD4 activity is sufficient to disrupt mouse and human NET formation. Nat Chem Biol. 2015;11(3):189—91. https://doi.org/10.1038/nchembio.1735.
51. Martinod K., Demers M., Fuchs T.A. et al. Neutrophil histone modification by peptidyl arginine deiminase 4 is critical for deep vein thrombosis in mice. Proc Natl Acad Sci U S A. 2013;110(21):8674—9. https://doi.org/10.1073/pnas.1301059110.
52. Hisada Y., Sachetto A.T.A., Mackman N. Circulating tissue factor-positive extracellular vesicles and their association with thrombosis in different diseases. Immunol Rev. 2022;312(1):61—75. https://doi.org/10.1111/imr.13106.
53. Sorvillo N., Mizurini D.M., Coxon C. et al. Plasma peptidylarginine deiminase IV promotes VWF-platelet string formation and accelerates thrombosis after vessel injury. Circ Res. 2019;125(5):507—19. https://doi.org/10.1161/CIRCRESAHA.118.314571.
54. Quinn K., Henriques M., Parker T. et al. Human neutrophil peptides: a novel potential mediator of inflammatory cardiovascular diseases. Am J Physiol Heart Circ Physiol. 2008;295(5):H1817—24. https://doi.org/10.1152/ajpheart.00472.2008.
55. Higazi A.A., Ganz T., Kariko K., Cines D.B. Defensin modulates tissue-type plasminogen activator and plasminogen binding to fibrin and endothelial cells. J Biol Chem. 1996;271(30):17650-5. https://doi.org/10.1074/jbc.271.30.17650.
56. Pillai V.G., Bao J., Zander C.B. et al. Human neutrophil peptides inhibit cleavage of von Willebrand factor by ADAMTS13: a potential link of inflammation to TTP. Blood. 2016;128(1):110-9. https://doi.org/10.1182/blood-2015-12-688747.
57. Crawley J.T., Lam J.K., Rance J.B. et al. Proteolytic inactivation of ADAMTS13 by thrombin and plasmin. Blood. 2005;105(3):1085-93. https://doi.org/10.1182/blood-2004-03-1101.
58. Chen J., Fu X., Wang Y. et al. Oxidative modification of von Willebrand factor by neutrophil oxidants inhibits its cleavage by ADAMTS13. Blood. 2010;115(3):706-12. https://doi.org/10.1182/blood-2009-03-213967.
59. Nishimura K., Sano M., Ohtaka M. et al. Development of defective and persistent Sendai virus vector: a unique gene delivery/expression system ideal for cell reprogramming. J Biol Chem. 2011;286(6):4760-71. https://doi.org/10.1074/jbc.M110.183780.
60. Zheng L., Abdelgawwad M.S., Zhang D. et al. Histone-induced thrombotic thrombocytopenic purpura in adamts13-/-zebrafish depends on von Willebrand factor. Haematologica. 2020;105(4):1107-19. https://doi.org/10.3324/haematol.2019.237396.
61. Richardson P.G., Chanan-Khan A., Schlossman R.L. et al. Phase II trial of Single Agent Bortezomib (VELCADE®) in patients with previously untreated multiple myeloma (MM). Blood. 2004;106(11):336. https://doi.org/10.1182/blood.V104.11.336.336.
62. Ono T., Mimuro J., Madoiwa S. et al. Severe secondary deficiency of von Willebrand factor - cleaving protease (ADAMTS13) in patients with sepsis-induced disseminated intravascular coagulation: its correlation with development of renal failure. Blood. 2006;107(2):528-34. https://doi.org/10.1182/blood-2005-03-1087.
63. Lysov Z., Dwivedi D.J., Gould T.J., Liaw P.C. Procoagulant effects of lung cancer chemotherapy: impact on microparticles and cell-free DNA. Blood Coagul Fibrinolysis. 2017;28(1):72-82. https://doi.org/10.1097/MBC.0000000000000546.
64. Swystun L.L., Mukherjee S., Liaw P.C. Breast cancer chemotherapy induces the release of cell-free DNA, a novel procoagulant stimulus. J Thromb Haemost. 2011;9(11):2313-21. https://doi.org/10.1111/j.1538-7836.2011.04465.x.
65. Lysov Z., Swystun L.L., Kuruvilla S. et al. Lung cancer chemotherapy agents increase procoagulant activity via protein disulfide isomerasedependent tissue factor decryption. Blood Coagul Fibrinolysis. 2015;26(1):36-45. https://doi.org/10.1097/MBC.0000000000000145.
66. Demers M., Krause D.S., Schatzberg D. et al. Cancers predispose neutrophils to release extracellular DNA traps that contribute to cancer-associated thrombosis. Proc Natl Acad Sci U S A. 2012;109(32):13076-81. https://doi.org/10.1073/pnas.1200419109.
67. Zhang Y., Guoqiang L., Sun M., Lu X. Targeting and exploitation of tumor-associated neutrophils to enhance immunotherapy and drug delivery for cancer treatment. Cancer Biol Med. 2020;17(1):32-43. https://doi.org/10.20892/j.issn.2095-3941.2019.0372.
68. Zhang Y., Chandra V., Riquelme Sanchez E. et al. Interleukin-17-induced neutrophil extracellular traps mediate resistance to checkpoint blockade in pancreatic cancer. J Exp Med. 2020;217(12):e20190354. https://doi.org/10.1084/jem.20190354.
69. Farrera C., Fadeel B. Macrophage clearance of neutrophil extracellular traps is a silent process. J Immunol. 2013;191(5):2647-56. https://doi.org/10.4049/jimmunol.1300436.
70. Teijeira A., Garasa S., Gato M. et al. Cxcr1 and cxcr2 chemokine receptor agonists produced by tumors induce neutrophil extracellular traps that interfere with immune cytotoxicity. Immunity.19;52(5):856-71.e8. https://doi.org/10.1016/j.immuni.2020.03.001.
71. Fuchs T.A., Brill A., Duerschmied D. et al. Extracellular DNA traps promote thrombosis. Proc Natl Acad Sci U S A. 2010;107(36):15880-5. https://doi.org/10.1073/pnas.1005743107.
72. Cools-Lartigue J., Spicer J., Najmeh S., Ferri L. Neutrophil extracellular traps in cancer progression. Cell Mol Life Sci. 2014;71:4179-94. https://doi.org/10.1007/s00018-014-1683-3.
73. Cabral-Pacheco G.A., Garza-Veloz I., Castruita-De la Rosa C. et al. The roles of matrix metalloproteinases and their inhibitors in human diseases. Int J Mol Sci. 2020;21(24):9739. https://doi.org/10.3390/ijms21249739.
74. Gao H., Lan X., Li S., Xue Y. Relationships of MMP-9, E-cadherin, and VEGF expression with clinicopathological features and response to chemosensitivity in gastric cancer. Tumor Biol. 2017;39(5):1010428317698368. https://doi.org/10.1177/1010428317698368.
75. Viallard C., Larrivee B. Tumor angiogenesis and vascular normalization: alternative therapeutic targets. Angiogenesis. 2017;20(4):409-26. https://doi.org/10.1007/s10456-017-9562-9.
76. Zhu T., Zou X., Yang C. et al. Neutrophil extracellular traps promote gastric cancer metastasis by inducing epithelial-mesenchymal transition. Int J Mol Med. 2021;48(1):1-13. https://doi.org/10.3892/ijmm.2021.4960.
77. Ribatti D., Tamma R., Annese T. Epithelial-mesenchymal transition in cancer: a historical overview. Transl Oncol. 2020;13(6):100773. https://doi.org/10.1016/j.tranon.2020.100773.
78. Rayes R.F., Vourtzoumis P., Rjeily M.B. et al. Neutrophil extracellular trap-associated CEACAM1 as a putative therapeutic target to prevent metastatic progression of colon carcinoma. J Immunol. 2020;204(8):2285-94. https://doi.org/10.4049/jimmunol.1900240.
79. Wherry E.J. T cell exhaustion. Nat Immunol. 2011;12(6):492-9. https://doi.org/10.1038/ni.2035.
80. Jiang W., He Y., He W. et al. Exhausted CD8+ T cells in the tumor immune microenvironment: new pathways to therapy. Front Immunol. 2021;11:622509. https://doi.org/10.3389/fimmu.2020.622509.
81. Kaltenmeier C., Yazdani H.O., Morder K. et al. Neutrophil extracellular traps promote T cell exhaustion in the tumor microenvironment. Front Immunol. 2021;12:785222. https://doi.org/10.3389/fimmu.2021.785222.
Об авторах
А. Д. МакацарияРоссия
Макацария Александр Давидович - д.м.н., проф., академик РАН.
119991 Москва, ул. Трубецкая, д. 8, стр. 2
Scopus Author ID 57222220144; WoS ResearcherID M-5660-2016
Е. В. Слуханчук
Россия
Слуханчук Екатерина Викторовна - к.м.н.
119991 Москва, ул. Трубецкая, д. 8, стр. 2
В. О. Бицадзе
Россия
Бицадзе Виктория Омаровна - д.м.н., проф., профессор РАН.
119991 Москва, ул. Трубецкая, д. 8, стр. 2
Scopus Author ID 6506003478; WoS ResearcherID F-8409-2017
А. Г. Солопова
Россия
Солопова Антонина Григорьевна - д.м.н., проф.
119991 Москва, ул. Трубецкая, д. 8, стр. 2
Scopus Author ID 6505479504; WoS ResearcherID Q-1385-2015
Д. Х. Хизроева
Россия
Хизроева Джамиля Хизриевна - д.м.н., проф.
119991 Москва, ул. Трубецкая, д. 8, стр. 2
Scopus Author ID 57194547147; WoS ResearcherID F-8384-2017
Л. А. Ашрафян
Россия
Ашрафян Лев Андреевич - д.м.н., проф., академик РАН.
117997 Москва, ул. академика Опарина, д. 4
Scopus Author ID 57194173388
В. Н. Серов
Россия
Серов Владимир Николаевич - д.м.н., проф., академик РАН.
117997 Москва, ул. академика Опарина, д. 4
А. Е. Войновский
Россия
Войновский Александр Евгеньевич - д.м.н., проф.
123423 Москва, ул. Саляма Адиля, д. 2/44
WoS ResearcherlD S-6385-2016
Д. Ю. Унгиадзе
Грузия
Унгиадзе Джумбер Юрьевич - д.м.н., проф.
6010 Автономная Республика Аджария, Батуми, ул. Ниношвили, д. 35
А. В. Лазарчук
Россия
Лазарчук Арина Владимировна.
119991 Москва, ул. Трубецкая, д. 8, стр. 2
М. В. Третьякова
Россия
Третьякова Мария Владимировна - к.м.н.
119991 Москва, ул. Трубецкая, д. 8, стр. 2
Н. А. Макацария
Россия
Макацария Наталия Александровна - к.м.н.
119991 Москва, ул. Трубецкая, д. 8, стр. 2
WoS ResearcherID F-8406-2017
П. В. Сальникова
Россия
Сальникова Полина Владимировна.
119991 Москва, ул. Трубецкая, д. 8, стр. 2
Н. Р. Гашимова
Россия
Гашимова Нилуфар Рамиль кызы.
119991 Москва, ул. Трубецкая, д. 8, стр. 2
К. Н. Григорьева
Россия
Григорьева Кристина Николаевна.
119991 Москва, ул. Трубецкая, д. 8, стр. 2
К. Л. Закашанский
Соединённые Штаты Америки
Закашанский Константин Львович.
10029-6574 Нью-Йорк, ящик 1173, Пятая авеню, 1176
И. Элалами
Россия
Элалами Исмаил - д.м.н., проф.
119991 Москва, ул. Трубецкая, д. 8, стр. 2; Франция, 75006 Париж, Улица медицинского факультета, д. 12; Франция, 75020 Париж, Китайская улица, д. 4
Scopus Author ID 7003652413; WoS ResearcherID AAC-9695-2019
Ж.-К. Гри
Россия
Гри Жан-Кристоф - д.м.н., проф.
119991 Москва, ул. Трубецкая, д. 8, стр. 2; Франция, 34090 Монпелье, ул. Огюста Бруссоне, д. 163
Scopus Author ID 7005114260; WoS ResearcherID AAA-2923-2019
Рецензия
Для цитирования:
Макацария А.Д., Слуханчук Е.В., Бицадзе В.О., Солопова А.Г., Хизроева Д.Х., Ашрафян Л.А., Серов В.Н., Войновский А.Е., Унгиадзе Д.Ю., Лазарчук А.В., Третьякова М.В., Макацария Н.А., Сальникова П.В., Гашимова Н.Р., Григорьева К.Н., Закашанский К.Л., Элалами И., Гри Ж. Концепция тромбовоспаления как основы тромботических осложнений, прогрессии опухоли и метастазирования у онкогинекологических больных. Акушерство, Гинекология и Репродукция. 2024;18(4):450-463. https://doi.org/10.17749/2313-7347/ob.gyn.rep.2024.542
For citation:
Makatsariya A.D., Slukhanchuk E.V., Bitsadze V.O., Solopova A.G., Khizroeva J.Kh., Ashrafyan L.A., Serov V.N., Voynovskiy A.Е., Ungiadze J.Yu., Lazarchuk A.V., Tretyakova M.V., Makatsariya N.A., Salnikova P.V., Gashimova N.R., Grigoreva K.N., Zakashansky K.L., Elalamy I., Gris J. The concept of thromboinflammation underlying thrombotic complications, tumor progression and metastasis in gynecological cancer patients. Obstetrics, Gynecology and Reproduction. 2024;18(4):450-463. https://doi.org/10.17749/2313-7347/ob.gyn.rep.2024.542

Контент доступен под лицензией Creative Commons Attribution-NonCommercial-ShareAlike 4.0 International License.











































