Перейти к:
Инновационные методы решения проблемы женского бесплодия, ассоциированного с эндокринными нарушениями
https://doi.org/10.17749/2313-7347/ob.gyn.rep.2024.514
Аннотация
Цель: провести анализ литературы, посвященной инновационным методам диагностики и лечения, применяемым для решения проблемы женского бесплодия, ассоциированного с эндокринными нарушениями.
Материалы и методы. Проведен поиск публикаций в электронных базах данных PubMed, Google Scholar и еLibrary. Отбор публикаций осуществляли в соответствии с рекомендациями PRISMA. Все соответствующие статьи, опубликованные до января 2024 г., были включены в настоящий обзор. В результате поиска было извлечено 374 публикации из PubMed, 147 публикаций из eLibrary и 33 публикации из Google Scholar. Дубликаты и неполнотекстовые версии статей были исключены. После процедуры отбора в обзор были включены 72 публикации.
Результаты. В ходе анализа данных определены ключевые аспекты, которые позволили глубже понять эндокринные нарушения, влияющие на женское бесплодие. В частности, продемонстрированы новые корреляции между уровнями определенных гормонов и успешностью лечения, а также идентифицированы патогенетические механизмы, влияющие на процесс зачатия и вынашивания ребенка. Эти результаты позволят разработать более точные диагностические критерии и эффективные методы лечения, что увеличит шансы женщин на успешное зачатие и вынашивание ребенка.
Заключение. В ходе обобщения современных достижений в области диагностики и лечения эндокринного бесплодия у женщин определены новые диагностические критерии и эффективные методы лечения, которые могут значительно улучшить результаты. Значительный потенциал рассмотренных инновационных подходов и методов способствует улучшению репродуктивного здоровья и повышению шансов на успешное зачатие. Мы настоятельно рекомендуем внедрение этих передовых технологий в клиническую практику для оптимизации репродуктивных успехов.
Ключевые слова
Для цитирования:
Анварова Ш.А., Шукуров Ф.И., Туламетова Ш.А. Инновационные методы решения проблемы женского бесплодия, ассоциированного с эндокринными нарушениями. Акушерство, Гинекология и Репродукция. 2024;18(5):706-719. https://doi.org/10.17749/2313-7347/ob.gyn.rep.2024.514
For citation:
Anvarova Sh.A., Shukurov F.I., Tulametova Sh.A. Innovative methods for solving the problem of female infertility associated with endocrine disorders. Obstetrics, Gynecology and Reproduction. 2024;18(5):706-719. (In Russ.) https://doi.org/10.17749/2313-7347/ob.gyn.rep.2024.514
Введение / Introduction
Согласно данным Всемирной организации здравоохранения, проблема женского бесплодия занимает одно из ведущих мест среди проблем репродуктивного здоровья [1]. Особую трудность представляет бесплодие, ассоциированное с эндокринными нарушениями, в силу его многоаспектности и связи с различными функциональными системами организма. По различным оценкам, значительная доля случаев женского бесплодия напрямую связана с нарушениями в эндокринной системе, что делает эту проблему не только медицинской, но и социально значимой [2].
Современные достижения в области медицины и биотехнологий открывают новые перспективы в диагностике и лечении женского бесплодия эндокринного генеза [3]. Однако комплексность и многофакторность эндокринных нарушений требуют интеграции разнообразных подходов и методов диагностики, прогнозирования, лечения и профилактики. В этом ракурсе наличие актуального, систематизированного обзора инновационных методов решения проблемы женского бесплодия, ассоциированного с эндокринными нарушениями, становится крайне необходимым [4].
В последние годы значительный прогресс в области репродуктивной эндокринологии и вспомогательных репродуктивных технологий (ВРТ) обозначил новые перспективы и возможности для лечения эндокринного бесплодия [5]. Однако продолжаются поиски более эффективных и доступных методов лечения, что подчеркивает необходимость дальнейших исследований в этой области.
Цель: провести анализ литературы, посвященной инновационным методам диагностики и лечения, применяемым для решения проблемы женского бесплодия, ассоциированного с эндокринными нарушениями.
Материалы и методы / Materials and Methods
Поиск публикаций выполняли в электронных базах данных PubMed, Google Scholar и еLibrary. Алгоритм поиска включал в себя использование следующих ключевых слов и их сочетаний на русском и английском языках: «фертильность», «бесплодие», «эндокринные нарушения», «диагностика эндокринного бесплодия», «лечение эндокринного бесплодия», «профилактика эндокринного бесплодия» и «прогнозирование эндокринного бесплодия», «fertility», «infertility», «endocrine disorders», «diagnosis of endocrine infertility», «treatment of endocrine infertility», «prevention of endocrine infertility», «prognostication of endocrine infertility». Отбор публикаций осуществляли в соответствии с рекомендациями PRISMA.
Публикации оценивали на соответствие следующим критериям включения: публикация из области репродуктологии, включает только взрослых, описывает методы решения проблемы женского бесплодия, ассоциированного с эндокринными нарушениями. Авторы независимо друг от друга анализировали названия и аннотации всех выявленных публикаций, после чего извлекался полный текст релевантных исследований. В обзор включались клинические исследования, соответствующие теме настоящего обзора, опубликованные на русском и английском языках. Дубликаты и неполнотекстовые версии статей были исключены. Полный текст потенциально подходящих публикаций вычитывался для окончательного отбора. Разногласия между авторами разрешались путем консенсуса. Все соответствующие статьи, опубликованные до января 2024 г., были включены в настоящий обзор. В результате поиска было извлечено 374 публикации из PubMed, 147 публикаций из eLibrary и 33 публикации из Google Scholar. После процедуры отбора в обзор были включены 72 публикации (рис. 1).
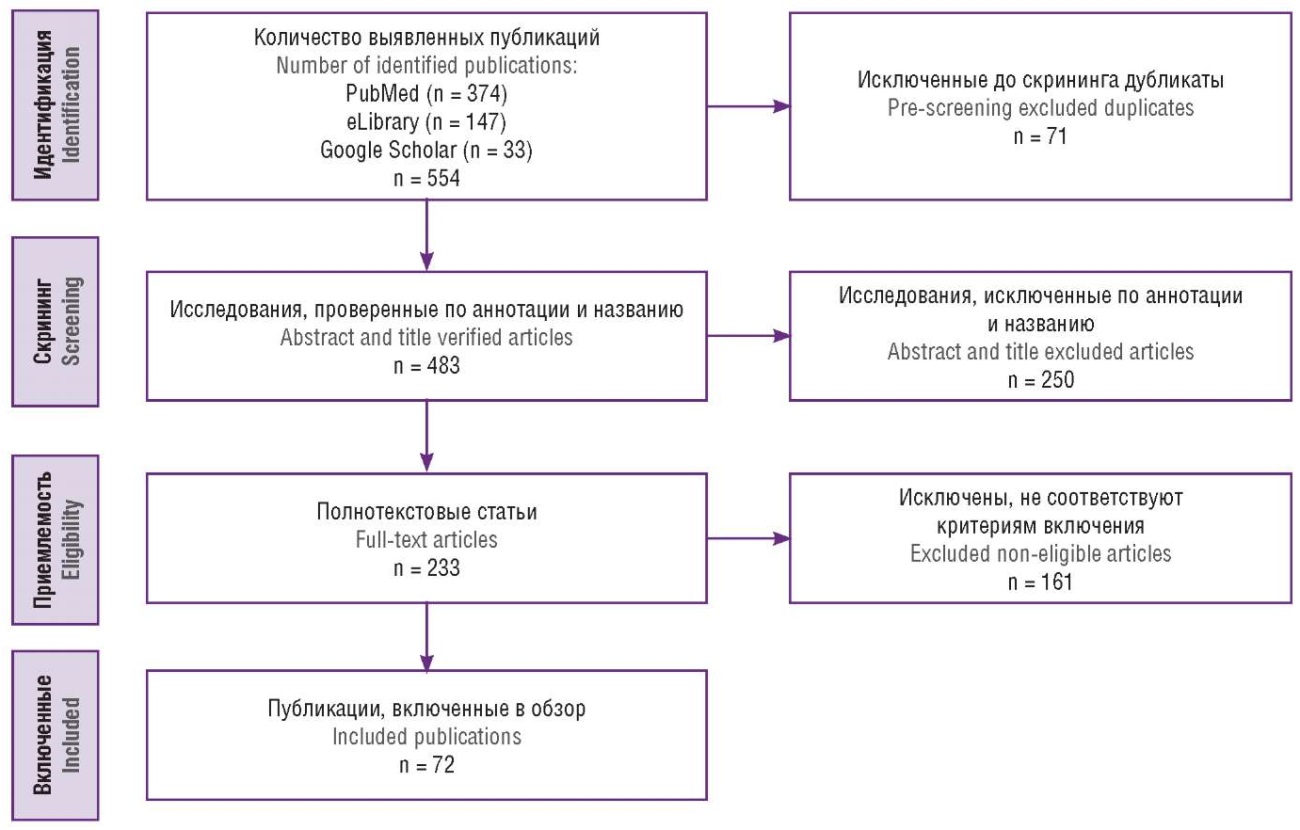
Рисунок 1. Алгоритм поиска публикаций.
Figure 1. Publication search algorithm.
Результаты и обсуждение / Results and Discussion
Эпидемиология, этиология и патогенез эндокринного бесплодия у женщин / Epidemiology, etiology and pathogenesis of female endocrine infertility
Эпидемиология и распространенность эндокринных нарушений в области женского бесплодия продолжают быть ключевыми направлениями исследований в репродуктивной медицине [6]. Эндокринные нарушения являются одной из основных причин женского бесплодия, причем их доля в общей структуре причин может достигать 30–40 % [7]. В своем исследовании А.В. Лабыгина (2011) анализирует различные эндокринные патологии, влияющие на способность к зачатию, что может предоставить дополнительную информацию о распространенности конкретных нарушений [8]. Исследование, проведенное Н.М. Подзолковой с соавт. (2015), подчеркивает влияние эндокринных нарушений на успешность зачатия, включая случаи использования ВРТ [9].
Благодаря улучшению методов диагностики и повышению осведомленности о механизмах развития бесплодия, ученые и клиницисты значительно расширили свои знания о распространенности и влиянии эндокринных факторов на репродуктивное здоровье женщин. В своей работе Т.А. Назаренко (2023) предоставляет обширный обзор влияния эндокринных нарушений на фертильность, акцентируя внимание на значимости понимания возрастных изменений и их воздействия на репродуктивную систему [10].
Этиология эндокринного бесплодия у женщин охватывает широкий спектр факторов и механизмов, нарушающих нормальный репродуктивный процесс. Эти нарушения могут затрагивать различные уровни репродуктивной системы, от гипоталамуса до яичников [11]. Гипоталамо-гипофизарные дисфункции играют значительную роль в этиологии эндокринного бесплодия у женщин, влияя на регуляцию репродуктивной системы на множественных уровнях.
Нарушения регуляции могут вызывать дисбаланс в процессе секреции гонадотропин-рилизинг гормона (ГнРГ) гипоталамусом, что, в свою очередь, влияет на секрецию лютеинизирующего гормона (ЛГ) и фолликулостимулирующего гормона (ФСГ) гипофизом [12]. Нарушения этих процессов могут привести к ановуляции, ключевому фактору в развитии женского бесплодия.
Синдром поликистозных яичников (СПКЯ) является наиболее частой эндокринной причиной бесплодия и встречается у 25–30 % женщин репродуктивного возраста [13]. СПКЯ характеризуется нарушением овуляции, гиперандрогенией и наличием поликистозных яичников на ультразвуковом исследовании (УЗИ) [14]. Этот синдром связан не только с бесплодием, но и с повышенным риском развития метаболических нарушений, включая инсулинорезистентность и сахарный диабет 2-го типа (СД-2). Современные исследования подтверждают тесную связь между инсулинорезистентностью и СПКЯ, подчеркивая важность метаболических факторов в патогенезе этого состояния [15].
М.Э.К. Азизова (2015) в своей работе анализирует СПКЯ с позиций современных представлений, выделяя роль инсулинорезистентности и ее влияние на репродуктивное здоровье женщин [16]. В исследовании L. Pal и D.B. Seifer (2014) были проанализированы механизмы, благодаря которым СПКЯ препятствует нормальной овуляции и влияет на фертильность [17]. Это предоставляет ценные сведения о патогенезе СПКЯ и возможных терапевтических подходах. Исследование метаболических и репродуктивных аспектов СПКЯ анализирует его комплексное влияние на здоровье женщин. Доказано, что СПКЯ связан не только с репродуктивными проблемами, но и с повышенным риском развития СД-2, сердечно-сосудистых заболеваний и метаболического синдрома. Подчеркивается важность ранней диагностики и комплексного подхода к лечению, учитывающего как репродуктивное, так и общее здоровье [18].
Исследование СПКЯ, выполненное Е.П. Ганчар, является одним из фундаментальных в понимании связи между этим состоянием и бесплодием [19]. В нем изучались механизмы, через которые нарушения инсулиновой резистентности и гиперандрогения влияют на овуляцию и фертильность у женщин. Современные подходы к диагностике и лечению СПКЯ, описанные R. Aziz, подчеркивают важность комплексного подхода, включающего изменение образа жизни, медикаментозную терапию и при необходимости применение ВРТ [20].
Нарушения функции щитовидной железы являются значимым фактором в этиологии эндокринного бесплодия у женщин. Щитовидная железа играет особую роль в регуляции обмена веществ, вырабатывая гормоны, которые влияют практически на каждую клетку, ткань и орган в теле, в том числе и на репродуктивную систему [21]. Дисфункция щитовидной железы, включая гипотиреоз, может оказывать значительное влияние на репродуктивное здоровье женщин, приводя к нарушениям менструального цикла и ановуляции. Исследование G.E. Krassas с соавт. (2010) показывает, что адекватная диагностика и коррекция уровней тиреоидных гормонов являются ключевыми для преодоления бесплодия у женщин, ассоциированного с нарушениями функции щитовидной железы [22].
Гипотиреоз и гипертиреоз могут нарушать менструальный цикл, делая овуляцию нерегулярной или даже отсутствующей, что существенно снижает шансы на зачатие. Исследование, проведенное K. Poppe (2021), доказывает, что как гипотиреоз, так и гипертиреоз могут влиять на фертильность [23]. Гипотиреоз часто ассоциируется с повышенным уровнем пролактина, который может подавлять овуляцию. Среди женщин репродуктивного возраста распространенность субклинического гипотиреоза, при котором уровень стимулирующего щитовидную железу гормона – тиреотропного гормона (ТТГ) повышен, а уровень тироксина (Т4) остается в пределах нормы, составляет 2–4 % [24]. Это состояние часто остается недиагностированным, поскольку симптомы могут быть неспецифичными или слабо выраженными. Кроме того, аутоиммунные заболевания щитовидной железы, такие как аутоиммунный тиреоидит, также могут влиять на фертильность даже при нормальных уровнях гормонов щитовидной железы [25].
Это подчеркивает важность адекватной диагностики и коррекции функциональных нарушений щитовидной железы для улучшения репродуктивного здоровья. Роль гормонов щитовидной железы в репродуктивном здоровье подробно освещена в работе А. Fumarola с соавт. (2013), обсуждаются механизмы, посредством которых гормоны щитовидной железы влияют на овуляцию и имплантацию [26].
Дисфункция надпочечников также играет важную роль в этиологии эндокринного бесплодия у женщин, поскольку надпочечники участвуют в производстве ряда жизненно важных гормонов, включая кортизол, андрогены и альдостерон [27]. Эти гормоны регулируют множество функций в организме, в том числе метаболизм, иммунную функцию, артериальное давление и косвенно репродуктивную систему. Гиперандрогения как проявление дисфункции надпочечников может оказывать воздействие на менструальный цикл и овуляцию, а также на процессы оплодотворения [28].
Гиперпролактинемия является еще одной частой эндокринной причиной бесплодия, поражающей до 0,4 % всех женщин и до 9–17 % женщин, страдающих бесплодием [29]. Гиперпролактинемия может вызывать аменорею, олигоменорею, ановуляцию и галакторею, что напрямую влияет на фертильность. Это состояние может быть обусловлено различными причинами, включая опухоли гипофиза, прием определенных лекарственных препаратов, гипотиреоз и другие заболевания. Гиперпролактинемия, являющаяся одним из факторов эндокринного бесплодия, может вызывать нарушения менструального цикла и овуляции. Т.В. Овсянникова с соавт. (2011) подробно рассматривают современные подходы к диагностике и лечению этого состояния, подчеркивая эффективность допамин-агонистов в нормализации уровня пролактина и восстановлении репродуктивной функции [30].
Исследования, проведенные U.B. Kaiser (2015) по гиперпролактинемии и ее влиянию на репродуктивную функцию, подчеркивают значительную роль этого состояния в нарушении овуляции. Кроме того, было показано, что повышенные уровни пролактина могут нарушать нормальный процесс овуляции и способствовать развитию бесплодия [31].
В исследовании Z. Zahiri с соавт. (2016) доказана значимость метаболизма и его влияния на фертильность. Особое внимание уделено роли адипокинов – гормонов, вырабатываемых жировой тканью, в регуляции репродуктивной функции [32]. Эти работы показывают, как метаболические нарушения, связанные с ожирением и метаболическим синдромом, могут приводить к эндокринному бесплодию. Механизмы воздействия метаболических факторов на репродуктивную систему включают изменения в секреции адипокинов, что может вызвать дисбаланс гормонов, необходимых для нормального функционирования репродуктивной системы.
Исследования N.M. Lainez и D. Coss (2019) демонстрируют, как метаболические факторы могут непосредственно влиять на репродуктивную функцию, подчеркивая необходимость учета этих факторов при разработке лечебных стратегий [33]. Лептин – гормон, играющий ключевую роль в регуляции аппетита и метаболизма, также оказывает значительное влияние на репродуктивную систему. Уровни лептина в организме также могут влиять на синтез гонадотропных гормонов и, следовательно, на фертильность. Исследования показывают, как дефицит или избыток лептина может воздействовать на фертильность, подчеркивая его ключевую роль в поддержании нормальной репродуктивной функции [34]. Лептин не только регулирует энергетический баланс, но также играет важную роль во множестве репродуктивных процессов, включая регуляцию менструального цикла и овуляцию. Таким образом, как дефицит, так и избыток лептина может стать причиной нарушений репродуктивной функции, делая его важным маркером для исследований в контексте диагностики и лечения бесплодия.
Таким образом, знание эпидемиологии, распространенности, этиологии и патогенеза различных эндокринных нарушений позволяет медицинским специалистам, занимающимся проблемой женского бесплодия, ассоциированного с эндокринными нарушениями, более эффективно подходить к лечению бесплодия. Это, в свою очередь, повышает шансы у женщин на успешное зачатие и вынашивание ребенка.
Диагностика эндокринного бесплодия у женщин / Diagnostics of female endocrine infertility
Комплексная оценка гормонального статуса женщины играет решающую роль в диагностике и лечении эндокринного бесплодия. В дополнение к исследованию уровней ЛГ, ФСГ, пролактина, тиреоидных гормонов, антимюллерова гормона (АМГ), ингибина В, лептина, тестостерона и дегидроэпиандростерона сульфата (ДГЭА-С) важно учитывать другие гормональные маркеры и их взаимодействия, которые могут влиять на репродуктивную функцию [35]. B.N. Kalro (2003) в своей работе рассматривает влияние уровней гонадотропных и половых гормонов на различные формы эндокринного бесплодия у женщин. Это исследование подчеркивает важность комплексной гормональной оценки для определения наиболее эффективных методов лечения [36].
Гонадотропные гормоны – ФСГ и ЛГ играют центральную роль в регуляции репродуктивной системы женщин и, соответственно, в диагностике эндокринного бесплодия. Эти гормоны вырабатываются передней долей гипофиза и оказывают прямое влияние на яичники, стимулируя их к росту фолликулов и овуляции [37].
Фолликулостимулирующий гормон имеет решающее значение на начальном этапе менструального цикла, поскольку стимулирует рост и развитие фолликулов в яичниках. В каждом цикле под воздействием ФСГ из числа примордиальных фолликулов определяется один или несколько, которые будут активно расти и развиваться, готовясь к овуляции. Уровень ФСГ определяют в первые дни менструального цикла (обычно на 2–3-й день) для оценки овариального резерва и функции яичников. Повышенные уровни ФСГ могут свидетельствовать об уменьшенном овариальном резерве или начале менопаузы, тогда как низкие уровни могут указывать на недостаточную функцию гипофиза [38].
Лютеинизирующий гормон играет центральную роль в середине менструального цикла, когда его резкий всплеск приводит к овуляции – выходу зрелой яйцеклетки из фолликула. После овуляции ЛГ способствует образованию желтого тела из остатков лопнувшего фолликула и производству прогестерона, который подготавливает эндометрий матки к возможной имплантации эмбриона. Измерение уровня ЛГ имеет важное значение для определения фазы овуляции и диагностики нарушений, связанных с овуляцией [39]. Соотношение ФСГ к ЛГ является важным диагностическим показателем, особенно при диагностике СПКЯ. У здоровых женщин в начале менструального цикла это соотношение обычно составляет около 1:1. При СПКЯ наблюдается повышение уровня ЛГ по сравнению с ФСГ, что приводит к соотношению 2:1 или даже выше, что может указывать на наличие этого синдрома [40].
В целом, оценка уровней ФСГ и ЛГ, а также их соотношения играет ключевую роль в диагностике эндокринного бесплодия. Эти показатели помогают определить фазы менструального цикла, оценить функциональность гипоталамо-гипофизарно-яичниковой оси и выявить возможные нарушения овуляции или другие аномалии, оказывающие влияние на репродуктивную систему женщины [41]. Кроме того, анализ уровня этих гормонов может указать на специфические эндокринные состояния, которые могут препятствовать зачатию. Например, повышенное соотношение ЛГ к ФСГ может не только свидетельствовать о наличии СПКЯ, но и указывать на гиперандрогению, которая может сопровождаться повышенной выработкой мужских половых гормонов и нарушением овуляторного процесса [42]. Патологические уровни этих гормонов могут быть связаны с преждевременной овариальной недостаточностью или гипогонадотропным гипогонадизмом, и каждое из этих состояний требует специализированного подхода к лечению.
Важность анализа ФСГ и ЛГ в диагностике бесплодия также обусловлена их ролью в мониторинге эффективности лечения [43]. Например, в процессе стимуляции овуляции при экстракорпоральном оплодотворении (ЭКО) отслеживание уровней этих гормонов позволяет адаптировать лечебный протокол для достижения оптимального ответа яичников, минимизируя риск развития синдрома гиперстимуляции яичников (СГЯ). Для повышения точности диагностики и выбора метода лечения эндокринного бесплодия у женщин часто используют комбинацию анализов ФСГ и ЛГ с другими исследованиями. К ним относятся УЗИ яичников, анализ уровня АМГ для оценки овариального резерва, а также тесты на инсулинорезистентность и гормоны щитовидной железы [44]. Такой комплексный подход позволяет получить максимально полную картину состояния репродуктивной системы пациентки и разработать индивидуализированный план лечения, направленный на устранение выявленных нарушений и восстановление фертильности.
Одним из основных маркеров, играющих значимую роль в регуляции менструального цикла и поддержании овуляции, является эстрадиол. Он влияет на репродуктивное здоровье женщины, и изменения его уровня могут указывать на нарушения в функционировании яичников и об эндокринных расстройствах, приводящих к бесплодию. Помимо эстрадиола и уже упомянутого соотношения ЛГ к ФСГ, которое является важным для диагностики СПКЯ из-за его характерного повышения, необходимо уделить внимание и другим гормонам [45].
Прогестерон также играет ключевую роль во второй фазе менструального цикла, подготавливая эндометрий к возможной имплантации эмбриона. Гипопрогестеронемия может указывать на недостаточность лютеиновой фазы, что является одной из причин эндокринного бесплодия. Прогестерон выполняет важную функцию в подготовке эндометрия к имплантации эмбриона и поддержании ранней беременности. Недостаточность прогестерона часто ассоциируется с эндокринным бесплодием и нарушениями лютеиновой фазы. Исследования, проведенные Р.Б. Базарбековой с соавт. (2017), акцентируют внимание на важности оценки уровней прогестерона при комплексной диагностике и лечении бесплодия [46].
Андрогены, включая тестостерон и ДГЭА-С, хотя и считаются мужскими гормонами, в небольших количествах присутствуют и у женщин. Их повышенные уровни могут быть признаком СПКЯ и других состояний, влияющих на фертильность [47].
Ингибин B и АМГ являются биохимическими маркерами овариального резерва и могут предоставить ценную информацию о количестве фолликулов в яичниках, а следовательно, о репродуктивном потенциале женщины. Низкие уровни АМГ и ингибина B связаны с уменьшением овариального резерва. Изучение содержания АМГ при диагностике СПКЯ и других форм эндокринного бесплодия занимает важное место в современной репродуктивной медицине. S. Ou с соавт. (2023) обсуждают роль АМГ как маркера овариального резерва, что имеет ключевое значение при планировании стратегии лечения СПКЯ [48]. Таким образом, комплексная оценка уровней половых гормонов включает не только изучение эстрадиола, ЛГ и ФСГ, но и анализ прогестерона, андрогенов, ингибина B и АМГ для более точной диагностики и интерпретации эндокринных нарушений, влияющих на фертильность. Этот подход позволяет охватить широкий спектр потенциальных причин бесплодия и разработать наиболее эффективную стратегию лечения.
Кортизол и другие гормоны стресса также заслуживают внимания при диагностике эндокринного бесплодия. Хронический стресс может привести к дисбалансу в гормональном статусе, влияя на репродуктивную функцию через гипоталамо-гипофизарно-адреналовую ось. Повышенные уровни кортизола могут подавлять овуляцию и вызывать нарушения в менструальном цикле [49].
Нарушения функции щитовидной железы, такие как гипотиреоз или гипертиреоз, могут негативно влиять на фертильность, мешая наступлению беременности или способствуя ее прерыванию. S.H. Safe (2000) обсуждает связь между функцией щитовидной железы и фертильностью, указывая на то, что дисфункция щитовидной железы может существенно влиять на способность к зачатию [50]. Это подтверждает необходимость тщательного обследования щитовидной железы у женщин, страдающих эндокринным бесплодием. Дисбаланс уровней гормонов щитовидной железы может указывать на нарушения в овариальном резерве или эндокринные нарушения.
Понимание сложных взаимосвязей между этими гормонами и их влиянием на репродуктивную систему позволяет более точно диагностировать эндокринные нарушения и разрабатывать индивидуализированные стратегии лечения бесплодия.
Включение в анализ гормонов, таких как паратиреоидный гормон (ПТГ) и витамин D, может дать дополнительную информацию о метаболическом статусе и его влиянии на репродуктивную функцию. Недостаток витамина D связан с нарушениями овуляции и уменьшением качества эмбрионов в программах ЭКО. Анализ адипонектина и других гормонов, вырабатываемых жировой тканью, может дать ценную информацию о связи между массой тела и фертильностью. Известно, что как избыточная, так и недостаточная масса тела могут негативно сказываться на овуляции и шансах на успешное зачатие [51].
При СПКЯ особое внимание уделяется инсулинорезистентности и уровню гликемии, поскольку инсулинорезистентность является частым сопутствующим состоянием. Исследование уровней глюкозы и инсулина на голодный желудок, а также проведение теста на толерантность к глюкозе помогают оценить чувствительность к инсулину и риск развития СД-2 [52]. Функциональные тесты, такие как тест с дексаметазоном для оценки функции надпочечников или тест с использованием синтетических аналогов ГнРГ для оценки функции гипофиза могут быть использованы для дополнительной диагностики эндокринных нарушений, влияющих на репродуктивную функцию [53].
При диагностике эндокринного бесплодия также необходим сбор полного клинического анамнеза и анализ образа жизни пациента, включая диету, физическую активность, уровень стресса и наличие вредных привычек. Эти факторы могут оказывать значительное влияние на гормональный баланс и репродуктивное здоровье. Таким образом, для успешной диагностики и лечения эндокринного бесплодия у женщин требуется мультидисциплинарный подход, объединяющий гормональное тестирование, функциональную диагностику, генетические исследования, а также оценку образа жизни и психологического состояния. Этот подход позволяет не только идентифицировать конкретные эндокринные нарушения, но и разработать комплексные тактики лечения, направленные на устранение идентифицированных проблем.
Важную роль в диагностике эндокринных нарушений, приводящих к бесплодию, играют также молекулярно-генетические исследования для выявления генетических мутаций или полиморфизмов, связанных с эндокринными и репродуктивными нарушениями. Такие анализы также могут быть особенно полезны в случаях бесплодия неясного генеза или при повторных неудачных попытках ЭКО. Мутации в определенных генах могут быть ответственны за нарушения в развитии и функции репродуктивной системы. Например, мутации в гене FMR1 ассоциируются с преждевременным истощением овариального резерва, а генетические изменения, связанные с гиперпролактинемией, могут влиять на овуляторные процессы [54]. В работе Y. Chen и S.Y. Fang (2018) обсуждается генетическая основа СПКЯ и роль диетических добавок в модуляции эндокринных и фертильных дисбалансов [55]. Такие исследования подчеркивают важность молекулярных и генетических аспектов в разработке индивидуализированных стратегий лечения.
Т.О. Симонова и Л.Н. Смелышева (2012) подчеркивают, что медико-генетические аспекты бесплодия заслуживают особого внимания при планировании лечения, включая генетическое консультирование и возможное применение предимплантационной генетической диагностики для повышения шансов на успешную беременность [56]. Генетическое консультирование рекомендуется для пар с историей наследственных заболеваний или с необъяснимым бесплодием, поскольку некоторые генетические нарушения могут влиять на фертильность.
Ключевым аспектом диагностики является учет влияния окружающей среды и контакта с веществами, нарушающими эндокринную систему, которые могут негативно сказываться на функции репродуктивной системы. Воздействие на организм определенных химикатов, включая фталаты, бисфенол А и другие вещества с эндокринно-разрушительным потенциалом, может способствовать возникновению эндокринных дисбалансов и, как следствие, бесплодия [57].
Комплексный подход к диагностике эндокринного бесплодия также включает в себя оценку инсулинорезистентности и метаболических нарушений, особенно у пациенток с СПКЯ, поскольку метаболический синдром тесно связан с этим состоянием. Использование таких тестов, как оральный глюкозотолерантный тест (ОГТТ) и измерение уровня гликированного гемоглобина (HbA1c), может быть полезно для выявления нарушений углеводного обмена [58].
Другой важной частью комплексного подхода к диагностике эндокринного бесплодия является оценка уровня витамина D и других микроэлементов, таких как железо, цинк и селен, которые играют важную роль в репродуктивной функции и могут влиять на гормональный баланс. Недостаток витамина D, в частности, ассоциируется с нарушениями менструального цикла и овуляции, а также с уменьшением овариального резерва [59].
Ультразвуковое исследование (УЗИ) играет ключевую роль не только в оценке структуры яичников и матки, но и в изучении эндометрия. Оно может выявить патологии, такие как полипы, миому или гиперплазию, влияющие на имплантацию эмбриона и наступление беременности. Трансвагинальное УЗИ с доплерометрией позволяет оценить кровоснабжение матки и яичников, что является важным показателем их функционального состояния, и может выявлять скрытые патологии, невидимые при стандартном УЗИ [60].
Магнитно-резонансная томография (МРТ) головного мозга может быть рекомендована в случаях подозрения на нарушения гипоталамо-гипофизарной системы, включая наличие аденомы гипофиза, которая может приводить к гиперпролактинемии и другим гормональным нарушениям. МРТ позволяет точно локализовать и оценить размеры опухолей, что важно для дальнейшего лечения и мониторинга [61]. Комплексный подход к диагностике должен также включать обсуждение образа жизни и психологического состояния, так как стресс, нездоровое питание и вредные привычки могут существенно влиять на репродуктивное здоровье.
В заключение, учитывая сложность и многоаспектность эндокринного бесплодия, важно подчеркнуть необходимость индивидуализированного подхода к каждой пациентке. Это включает в себя не только широкий спектр диагностических процедур, но и разработку персонализированных планов лечения, которые могут включать гормональную терапию, поддержку образа жизни, пищевые добавки, а в некоторых случаях и ассистированные репродуктивные технологии, такие как ЭКО или интрацитоплазматическая инъекция сперматозоида (ИКСИ) [62]. Мультидисциплинарный подход и тесное взаимодействие между специалистами различных направлений медицины являются ключом к успешной помощи женщинам, сталкивающимся с этой сложной проблемой.
Лечение эндокринного бесплодия у женщин / Treatment of female endocrine infertility
Лечение эндокринного бесплодия у женщин включает комплексные стратегии, нацеленные на устранение гормональных и метаболических нарушений, препятствующих наступлению беременности. Эти стратегии варьируются в зависимости от конкретной этиологии нарушения. Основываясь на работах Г.Т. Сухих и Т.А. Назаренко (2010) [63], Н.А. Данкович и В.Н. Воробей-Виховской (2013) [64], подчеркивается важность индивидуализации методов лечения и непрерывного научного поиска в области репродуктивного здоровья женщин. Лечение должно быть направлено не только на восстановление фертильности, но и на улучшение общего состояния здоровья женщины, учитывая все аспекты ее жизни и желания.
При гипоталамо-гипофизарных дисфункциях лечение нацелено на восстановление нормального ритма высвобождения гонадотропинов, нарушение которого может быть вызвано стрессом, значительным снижением веса или патологиями. Для этой цели используется ГнРГ и его аналоги для нормализации выработки ЛГ и ФСГ.
Лечение дисфункции яичников охватывает СПКЯ и другие состояния, влияющие на овуляцию. Это может включать стимуляцию овуляции с использованием кломифена или экзогенных ФСГ и ЛГ. При кломифенрезистентности проводится лапароскопическая каутеризация яичников для стимуляции овуляции в случаях СПКЯ. При СПКЯ, сопровождающемся инсулинорезистентностью, назначаются сенсибилизаторы, такие как метформин, глюкофаж, сиофор и другие препараты. У женщин с дисфункцией щитовидной железы в случае гипотиреоза назначается L-тироксин или эутирокс для нормализации уровней тиреоглобулина (ТГ) и тироксина (Т4) [65].
При лечении женщин с дисфункцией надпочечников может быть назначен дексаметазон для снижения продукции андрогенов. Лечение гиперпролактинемии включает применение допамин-агонистов (например, достинекс, бромокриптин или каберголин) для снижения уровня пролактина. Такие исследования, как проведенное А. López-Moreno и M. Aguilera (2020), изучают влияние пробиотиков на микробиоту, связанную с эндокринной и фертильной дисфункцией, подчеркивая важность диетической коррекции [66].
Женщинам, страдающим бесплодием на фоне эндокринных нарушений, которые не поддаются медикаментозному лечению, могут быть рекомендованы ВРТ, такие как ИКСИ и ЭКО. Р.М. Даниелян и А.М. Гзгзян (2017) описывают использование ВРТ у пациентов с эндокринной патологией, демонстрируя важность индивидуализированных методов лечения для улучшения шансов на успешное зачатие [67].
Не следует недооценивать значение психологической поддержки, поскольку бесплодие часто влечет за собой значительный эмоциональный стресс. Консультации и поддержка могут помочь справиться с напряжением, связанным с диагнозом и лечением. Работа М.Г. Рябовой (2013) подчеркивает, что управление стрессом и психологическая поддержка играют критическую роль в лечении бесплодия, особенно когда оно связано с психоэмоциональными факторами [68]. Когнитивно-поведенческая терапия и поддержка сообщества могут быть важными компонентами комплексного подхода к лечению бесплодия. Выбор конкретного метода лечения должен основываться на тщательной диагностике, включая анализ гормонального статуса, УЗИ яичников и другие диагностические процедуры. Важно учитывать все аспекты здоровья женщины, включая возраст, общее состояние здоровья, длительность бесплодия и предпочтения пары.
Лечение эндокринного бесплодия требует регулярного мониторинга для оценки эффективности принимаемых мер. Это может включать контроль гормонального статуса, УЗИ для оценки реакции яичников на стимуляцию, а также изменения менструального цикла. В заключение, лечение эндокринного бесплодия у женщин – это многоаспектный процесс, который может включать медикаментозное лечение, хирургическое вмешательство, ВРТ, а также изменения в образе жизни и психологическую поддержку. Всеобъемлющий подход, учитывающий все потенциальные этиологические факторы и индивидуальные особенности пациента, является ключом к успешному восстановлению фертильности.
Профилактика эндокринного бесплодия у женщин / Prevention of female endocrine infertility
Профилактика эндокринного бесплодия у женщин охватывает широкий спектр мер, направленных на поддержание здорового образа жизни и предупреждение гормональных нарушений. Как указывают Е.В. Семенова и Н.А. Кириллов (2018), профилактика эндокринного бесплодия должна включать сбалансированное питание, регулярные физические упражнения, избегание вредных привычек и регулярные посещения врача для раннего выявления и коррекции гормональных нарушений [69]. Новые перспективы в лечении обещают улучшение качества жизни и повышение шансов на успешное зачатие благодаря развитию медицинских технологий и углублению знаний о механизмах репродуктивной системы. В работе Т.А. Кондратьевой и Н.В. Артымук (2009) рассматриваются современные подходы к диагностике и лечению СПКЯ, что является важной частью профилактики эндокринного бесплодия. Авторы подчеркивают значимость ранней диагностики и адекватного лечения СПКЯ для предотвращения бесплодия у женщин репродуктивного возраста [70].
К основным аспектам профилактики относятся сбалансированное питание, включающее достаточное количество фруктов, овощей, цельнозерновых продуктов и белков, ограничение потребления сахара и обработанных продуктов для избегания набора массы тела и развития инсулинорезистентности. Р.А. Манушарова (2014) исследовала основные клинико-патогенетические варианты женского эндокринного бесплодия, предлагая рекомендации по его профилактике. В работе рассматриваются такие меры, как регулярный мониторинг гормонального статуса, ранняя диагностика и своевременное лечение эндокринных нарушений [71].
Регулярные умеренные физические упражнения способствуют контролю массы тела, улучшению чувствительности к инсулину и поддержанию гормонального баланса. Важно избегать избыточной массы тела или экстремального похудения для поддержания нормального гормонального фона. Плановые посещения гинеколога и эндокринолога помогают в раннем выявлении и коррекции гормональных нарушений.
Кроме того, следует избегать курения и чрезмерного употребления алкоголя, поскольку они могут отрицательно сказываться на фертильности. Ограничение контакта с токсичными веществами, такими как пестициды и некоторые виды пластиков, также важно. Обеспечение достаточного количества сна необходимо для поддержания оптимального гормонального баланса. Л.В. Ткаченко и Н.А. Линченко (2014) изучали уровень гонадотропных и половых гормонов при некоторых формах эндокринного бесплодия у женщин, что включает профилактические меры для улучшения фертильности. Авторы подчеркивают важность гормональной коррекции и мониторинга для повышения шансов на успешное зачатие [72]. По рекомендации врача может потребоваться прием витаминов и минералов, поддерживающих репродуктивное здоровье.
Контроль за состояниями здоровья, влияющими на фертильность, такими как диабет, является еще одним важным элементом. Перед планированием беременности рекомендуется пройти медицинское обследование для выявления и коррекции возможных проблем. Соблюдение этих рекомендаций способствует не только профилактике эндокринного бесплодия, но и улучшению общего состояния здоровья.
Заключение / Conclusion
Представлен всесторонний анализ современных достижений в области диагностики и лечения эндокринного бесплодия у женщин. Изучен широкий спектр инновационных подходов и методов и обнаружен значительный потенциал этих технологий в улучшении репродуктивного здоровья и повышении шансов на успешное зачатие. Современные медицинские технологии, объединенные с глубоким пониманием эндокринных механизмов, открывают новые горизонты для тысяч пар, стремящихся завести детей. Тем не менее, чтобы обеспечить доступность и эффективность этих методов для всех нуждающихся, а также для дальнейшего углубления знаний о сложной природе женского бесплодия, необходимо продолжать научные исследования и разработки в этой области.
Список литературы
1. Адамян Л.В., Андреева Е.Н., Гаспарян С.А. и др. Синдром поликистозных яичников в репродуктивном возрасте (современные подходы к диагностике и лечению). Клинические рекомендации (протокол лечения). М., 2015. 22 с.
2. Гончарова Н.Н., Мартышкина Е.Ю., Казначеева Т.В. и др. Медико-генетические аспекты бесплодия. Акушерство, Гинекология и Репродукция. 2012;6(2):35–40.
3. Кроненберг Г.М. Эндокринология по Вильямсу. Репродуктивная эндокринология. [перевод с английского]. М.: ГЭОТАР-Медиа, 2020. 503 с.
4. Абашидзе А.А. Структура бесплодия. О чем не стоит забывать. Справочник врача общей практики. 2014;(4):81–4.
5. Щербакова Е.С., Лусевич А.И. Эндокринное бесплодие. Аллея науки. 2020;2(6):403–6.
6. Рахметова М.Р., Алимова М.М., Ережепбаев Т.О., Бахтиярова А.М.. Особенности диагностики и лечения эндокринного бесплодия. Academic Research in Educational Sciences. 2022;3(4):722–8. https://doi.org/10.24412/2181-1385-2022-4-722-728.
7. Назаренко Т.А., Мишиева Н.Г. Бесплодие и возраст: пути решения проблемы: руководство. М.: МЕДпресс-информ, 2014. 216 с.
8. Лабыгина А.В. Основные клинико-патогенетические варианты женского эндокринного бесплодия. Международный эндокринологический журнал. 2011;3(35):140–8.
9. Подзолкова Н.М., Кузнецова И.В., Колода Ю.А. Эндокринное бесплодие: от программируемого зачатия до экстракорпорального оплодотворения: руководство для врачей. М.: ГЭОТАР-Медиа, 2015. 112 с.
10. Назаренко Т.А. Стимуляция функции яичников. М.: МЕДпресс-информ, 2023. 268 с.
11. Самойлова А.В., Кострова Е.В. Особенности экспрессии рецепторов к эстрадиолу и прогестерону при гиперплазиях эндометрия у женщин с эндокринным бесплодием. Журнал акушерства и женских болезней. 2009;58(1):38–43.
12. Елифанов А.В., Лепунова О.Н. Уровень гонадотропных и половых гормонов при некоторых формах эндокринного бесплодия у женщин. Вестник Тюменского государственного университета. Медико-биологические науки. 2014;(6):114–22.
13. Гродницкая Е.Э., Щербатюк Ю.В., Бендусов И.А. и др. Антимюллеров гормон как маркер синдрома поликистозных яичников. Проблемы репродукции. 2013;(6):27–30.
14. O'Brien B., Dahiya R., Kimble R. Hyperandrogenism, insulin resistance and acanthosis nigricans (HAIR-AN syndrome): an extreme subphenotype of polycystic ovary syndrome. BMJ Case Rep. 2020;13(4):e231749. https://doi.org/10.1136/bcr-2019-231749.
15. Шукуров Ф.И., Мамажанова Д.М., Саттарова К.А., Юлдашева Н.З. Оценка эффективности применения препарата Белара в адъювантной терапии синдрома поликистозных яичников после эндохирургического лечения. Экспериментальная и клиническая фармакология. 2022;85(8):14–6. https://doi.org/10.30906/0869-2092-2022-85-8-14-16.
16. Азизова М.Э.К. Синдром поликистозных яичников с позиций современных представлений. Казанский медицинский журнал. 2015;9(1):77–80. https://doi.org/10.17750/KMJ2015-077.
17. Pal L., Seifer D.B. Polycystic ovary syndrome: current and emerging concepts. New York: Springer, 2014. 340 р.
18. Zhang J., Bao Y., Zhou X., Zheng L. Polycystic ovary syndrome and mitochondrial dysfunction. Reprod Biol Endocrinol. 2019;17(1):67. https://doi.org/10.1186/s12958-019-0509-4.
19. Ганчар Е.П. Метаболомика в предикции эндокринного бесплодия у женщин с метаболическим синдромом. Вестник Витебского государственного медицинского университета. 2015;14(4):40–9.
20. Azziz R. PCOS in 2015: new insights into the genetics of polycystic ovary syndrome. Nat Rev Endocrinol. 2015;12(2):74–5. https://doi.org/10.1038/nrendo.2015.230.
21. Dosiou C. Thyroid and fertility: recent advances. Thyroid. 2020;30(4):479–86. https://doi.org/10.1089/thy.2019.0382.
22. Krassas G.E., Poppe K., Glinoer D. Thyroid function and human reproductive health. Endocr Rev. 2010;31(5):702–55. https://doi.org/10.1210/er.2009-0041.
23. Poppe K. Management of endocrine disease: Thyroid and female infertility: more questions than answers?! Eur J Endocrinol. 2021;184(4):R123–R135. https://doi.org/10.1530/EJE-20-1284.
24. Andreeva P. Thyroid gland and fertility. Akush Ginekol. 2014;53(7):18–23. (In Bulgarian).
25. Baird D.T. Endocrinology of female infertility. Br Med Bull. 1979;35(2):193–8. https://doi.org/10.1093/oxfordjournals.bmb.a071569.
26. Fumarola A., Grani G., Romanzi D. et al. Thyroid function in infertile patients undergoing assisted reproduction. Am J Reprod Immunol. 2013;70(4):336–41. https://doi.org/10.1111/aji.12113.
27. Goodman N.F., Cobin R.H., Futterweit W. et al. American Association of Clinical Endocrinologists, American College of Endocrinology, and Androgen Excess and PCOS Society Disease State Clinical Review: Guide to the Best Practices in the Evaluation and Treatment of Polycystic Ovary Syndrome – Part 2. Endocr Pract. 2015;21(12):1415–26. https://doi.org/10.4158/EP15748.DSC.
28. Мурашко О.В., Кулага О.К. Эндокринные расстройства у женщин репродуктивного возраста с доброкачественными кистозными опухолями яичников в сочетании с хроническими воспалительными заболеваниями репродуктивных органов. Проблемы здоровья и экологии. 2013;(2):75–82. https://doi.org/10.51523/2708-6011.2013-10-2-14.
29. Камилова Д.Р. Бесплодие у женщин с галакторией. Акушерство и гинекология. 1993;(6):52–4.
30. Овсянникова Т.В., Макаров И.О., Камилова Д.П., Хачатрян А.М. Гиперпролактинемия: современные подходы к диагностике и лечению. Гинекология. 2011;13(6):4–7.
31. Kaiser U.B. Decade in review-reproductive endocrinology: Understanding reproductive endocrine disorders. Nat Rev Endocrinol. 2015;11(11):640–1. https://doi.org/10.1038/nrendo.2015.179.
32. Zahiri Z., Sharami S.H., Milani F. et al. Metabolic syndrome in patients with polycystic ovary syndrome in Iran. Int J Fertil Steril. 2016;9(4):490–6. https://doi.org/10.22074/ijfs.2015.4607.
33. Lainez N.M., Coss D. Obesity, neuroinflammation, and reproductive function. Endocrinology. 2019;160(11):2719–36. https://doi.org/10.1210/en.2019-00487.
34. Шукуров Ф.И. Эндокринные расстройства у женщин с бесплодием, обусловленным доброкачественными структурными изменениями яичников. Журнал теоретической и клинической медицины. 2016;(2):71–3.
35. Колесникова Л.И., Семенова Н.В., Лабыгина А.В. и др. Оценка антиоксидантного статуса у женщин с эндокринным бесплодием. Журнал акушерства и женских болезней. 2010;59(4):57–60.
36. Kalro B.N. Impaired fertility caused by endocrine dysfunction in women. Endocrinol Metab Clin North Am. 2003;32(3):573–92. https://doi.org/10.1016/s0889-8529(03)00041-0.
37. Blumenfeld Z. GnRH-agonists in fertility preservation. Curr Opin Endocrinol Diabetes Obes. 2008;15(6):523–8. https://doi.org/10.1097/MED.0b013e32831a46e9.
38. de Castro E.C., de Souza F.R., Filho G.M., do Amaral W.N. Correlation between age and antral follicles count in infertile women. Rev Bras Ginecol Obstet. 2012;34(4):184–8. (In Portuguese). https://doi.org/10.1590/s0100-72032012000400008.
39. Liu X., Li J., Wang W. et al. Therapeutic restoration of female reproductive and endocrine dysfunction using stem cells. Life Sci. 2023;322:121658. https://doi.org/10.1016/j.lfs.2023.121658.
40. Robertson D.M., Lee C.H., Baerwald A. Interrelationships among reproductive hormones and antral follicle count in human menstrual cycles. Endocr Connect. 2016;5(6):98–107. https://doi.org/10.1530/EC-16-0077.
41. Weghofer A, Barad DH, Darmon S. et al. What affects functional ovarian reserve, thyroid function or thyroid autoimmunity? Reprod Biol Endocrinol. 2016;14(1):26. https://doi.org/10.1186/s12958-016-0162-0.
42. Kakoly N.S., Khomami M.B., Joham A.E. et al. Ethnicity, obesity and the prevalence of impaired glucose tolerance and type 2 diabetes in PCOS: a systematic review and meta-regression. Hum Reprod Update. 2018;24(4):455–67. https://doi.org/10.1093/humupd/dmy007.
43. Concepción-Zavaleta M.J., Coronado-Arroyo J.C., Quiroz-Aldave J.E. et al. Endocrine factors associated with infertility in women: an updated review. Expert Rev Endocrinol Metab. 2023;18(5):399–417. https://doi.org/10.1080/17446651.2023.2256405.
44. Van Voorhis B.J. Ultrasound assessment of the ovary in the infertile woman. Semin Reprod Med. 2008;26(3):217–22. https://doi.org/10.1055/s-2008-1076140.
45. Zhou S.J., Zhao M.J., Li C., Su X. The comparison of evaluative effectiveness between antral follicle count/age ratio and ovarian response prediction index for the ovarian reserve and response functions in infertile women. Medicine. 2020;99(36):e21979. https://doi.org/10.1097/MD.0000000000021979.
46. Базарбекова Р.Б., Локшин В.Н., Саидова С.С. и др. Вспомогательные репродуктивные технологии у пациентов с эндокринной патологией. Репродуктивная медицина. 2017;(4):33–40.
47. Семенова Е.В., Кириллов Н.А. Этиология женского бесплодия. Современные проблемы медицины и естественных наук. 2018;(7):79–83.
48. Ou S., Liao M., Cui L. et al. Associations between microbial presence in follicular fluid with IVF outcomes: a systematic review and meta-analysis. J Assist Reprod Genet. 2023;40(11):2501–11. https://doi.org/10.1007/s10815-023-02912-x.
49. Mitra S., Nayak P.K., Agrawai S. Laparoscopic ovarian drilling: an alternative but not the ultimate in the management of polycystic ovary syndrome. J Nat Sci Biol Med. 2015;6(1):40–8. https://doi.org/10.4103/0976-9668.149076.
50. Safe S.H. Endocrine disruptors and human health – is there a problem? An update. Environ Health Perspect. 2000;108(6):487–93. https://doi.org/10.1289/ehp.00108487.
51. Tian М., Zeng S., Cai S. et al. 25(OH)VitD and human endocrine and functional fertility parameters in women undergoing IVF/ICSI. Front Endocrinol. 2022:13:986848. https://doi.org/10.3389/fendo.2022.986848.
52. Механикова А.А., Калинова Д.В. Причины женского бесплодия. Молодежный сборник научных статей «Научные стремления». 2016;(20):79–80.
53. Витязева И.И. Инновационные технологии в лечении бесплодия у пациентов с эндокринопатиями. Доктор.Pу. 2009;(6–2):39–42.
54. Тепляшина Е.А., Екимова М.В., Пожиленкова Е.А. и др. Молекулярные маркеры гормонально-зависимого этапа фолликулогенеза при эндокринном бесплодии. Сибирский научный медицинский журнал. 2012;32(5):75–9.
55. Chen Y., Fang S.Y. Potential genetic polymorphisms predicting polycystic ovary syndrome. Endocr Connect. 2018;7(5):R187–R195. https://doi.org/10.1530/EC-18-0121.
56. Симонова Т.О., Смелышева Л.Н. Уровень половых гормонов у женщин с эндокринной формой бесплодия и различным тонусом ВНС. Вестник Курганского государственного университета. 2012;(1):38–41.
57. Caserta D., Bordi G., Ciardo F. et al. The influence of endocrine disruptors in a selected population of infertile women. Gynecol Endocrinol. 2013;29(5):444–7. https://doi.org/10.3109/09513590.2012.758702.
58. Милеева Л.В., Алексанян Я.Н. Синдром поликистозных яичников как причина эндокринного бесплодия. Смоленский медицинский альманах. 2019;(1):194–5.
59. Björvang R.D., Damdimopoulou P. Persistent environmental endocrine-disrupting chemicals in ovarian follicular fluid and in vitro fertilization treatment outcome in women. Ups J Med Sci. 2020;125(2):85–94. https://doi.org/10.1080/03009734.2020.1727073.
60. López-Moreno A., Suárez A., Avanzi C. et al. Probiotic strains and intervention total doses for modulating obesity-related microbiota dysbiosis: a systematic review and meta-analysis. Nutrients. 2020;12(7):1921. https://doi.org/10.3390/nu12071921.
61. Вакс В.В. Гиперпролактинемия: причины, клиника, диагностика и лечение. Consilium medicum. 2001;3(11):516–25.
62. Попенко А.Н. Анализ эффективности вспомогательных репродуктивных технологий методом интрацитоплазматической инъекции сперматозоида. Вестник Челябинского государственного университета. 2013;(7):142–4.
63. Сухих Г.Т., Назаренко Т.А. Бесплодный брак. Современные подходы к диагностике и лечению: руководство для врачей. ГЭОТАР-Медиа, 2010. 774 c.
64. Данкович Н.А., Воробей-Виховская В.Н. Причины и формы бесплодия. Современные возможности диагностики и лечения. Здоровье женщины. 2013;(3):192–7.
65. Ермошенко Б.Г., Крутова В.А., Надточий А.В. Восстановление репродуктивной функции у пациенток с эндокринным фактором бесплодия. Кубанский научный медицинский вестник. 2009;(3):46–50.
66. López-Moreno A., Aguilera M. Probiotics dietary supplementation for modulating endocrine and fertility microbiota dysbiosis. Nutrients. 2020;12(3):757. https://doi.org/10.3390/nu12030757
67. Даниелян Р.М., Гзгзян А.М. Лечение бесплодия у женщин с синдромом поликистозных яичников методами вспомогательных репродуктивных технологий. Журнал акушерства и женских болезней. 2017;66(5):37–45.
68. Рябова М.Г. Индивидуально-психологические особенности женщин с различными типами нарушения репродуктивной функции. Вестник Тамбовского университета. Серия: гуманитарные науки. 2013;(9):190–8.
69. Семенова Е.В., Кириллов Н.А. Этиология женского бесплодия. Современные проблемы медицины и естественных наук. 2018;(7):79–83.
70. Кондратьева Т.А., Артымук Н.В. Современные подходы к диагностике и лечению бесплодия. Мать и дитя в Кузбассе. 2009;(2):3–7.
71. Манушарова Р.А. Бесплодный брак. Эффективная фармакотерапия. 2014;(9):34–39.
72. Ткаченко Л.В., Линченко Н.А. Коррекция гормонального гомеостаза у женщин с бесплодием и недостаточностью лютеиновой фазы менструального цикла. Гинекология. 2014;16(4):24–7.
Об авторах
Ш. А. АнвароваУзбекистан
Анварова Шахноза Абдукаюмовна
Узбекистан, 100109 Ташкент, ул. Фароби, д. 2
Ф. И. Шукуров
Узбекистан
Шукуров Фархад Ишкулович, д.м.н., проф.
eLibrary SPIN-code: 6837-1062
Узбекистан, 100109 Ташкент, ул. Фароби, д. 2
Ш. А. Туламетова
Узбекистан
Туламетова Шахло Азаджановна
Узбекистан, 100109 Ташкент, ул. Фароби, д. 2
Что уже известно об этой теме?
► Женское бесплодие, связанное с эндокринными нарушениями, включает такие состояния, как синдром поликистозных яичников, гипотиреоз, нарушения гипоталамо-гипофизарной оси, что приводит к ановуляции и проблемам с имплантацией, затрудняя возможность зачатия и вынашивания беременности.
► Эндокринные нарушения вызывают дисбаланс гормонов, ановуляцию и нарушение регуляции менструального цикла, что приводит к недостаточной подготовке эндометрия для имплантации и сохранения беременности.
► Коррекция эндокринных нарушений у женщин с бесплодием, связанным с данной патологией, приводит к восстановлению гормонального баланса, нормализации менструального цикла и повышению шансов на успешное зачатие.
Что нового дает статья?
► Применение новейших биотехнологий в диагностике и лечении эндокринных нарушений включает редактирование генов, которые могут влиять на гормональный баланс. Предлагаются персонализированные терапевтические подходы на основе генетического профиля пациентки, что позволяет значительно повысить эффективность лечения и минимизировать побочные эффекты.
► Новые фармакологические агенты, целенаправленно воздействующие на специфические эндокринные пути, увеличивают эффективность стимуляции овуляции и улучшают условия для имплантации.
► Внедрение интегративных подходов в лечение, сочетающих традиционные методы с инновационными технологиями и оптимизацией лечебных схем, позволяет достичь более высокой эффективности в лечении бесплодия.
Как это может повлиять на клиническую практику в обозримом будущем?
► Внедрение генетического профилирования позволит более точно подбирать методы лечения, основываясь на индивидуальных особенностях пациентов.
► Новые фармакологические агенты и технологии целенаправленного воздействия на эндокринные пути помогут увеличить эффективность экстракорпорального оплодотворения (ЭКО).
► Оптимизация лечебных протоколов поможет снизить общие затраты на лечение бесплодия, сокращая время и количество необходимых попыток ЭКО.
Рецензия
Для цитирования:
Анварова Ш.А., Шукуров Ф.И., Туламетова Ш.А. Инновационные методы решения проблемы женского бесплодия, ассоциированного с эндокринными нарушениями. Акушерство, Гинекология и Репродукция. 2024;18(5):706-719. https://doi.org/10.17749/2313-7347/ob.gyn.rep.2024.514
For citation:
Anvarova Sh.A., Shukurov F.I., Tulametova Sh.A. Innovative methods for solving the problem of female infertility associated with endocrine disorders. Obstetrics, Gynecology and Reproduction. 2024;18(5):706-719. (In Russ.) https://doi.org/10.17749/2313-7347/ob.gyn.rep.2024.514

Контент доступен под лицензией Creative Commons Attribution-NonCommercial-ShareAlike 4.0 International License.











































