Перейти к:
Первичный гиперпаратиреоз на фоне беременности, наступившей в результате процедуры экстракорпорального оплодотворения
https://doi.org/10.17749/2313-7347/ob.gyn.rep.2024.458
Аннотация
Первичный гиперпаратиреоз (ПГПТ) у беременных выявляется редко, в ряде случае оставаясь недиагностированным ввиду неспецифической клинической картины. При этом заболевание может приводить к развитию жизнеугрожающих осложнений со стороны матери и ребенка. Процедура экстракорпорального оплодотворения (ЭКО) также ассоциирована с увеличением вероятности неблагоприятных исходов по сравнению с общей популяцией. Своевременная диагностика и персонализированное лечение, учитывая крайне высокий риск осложнений в случае сочетания ПГПТ и беременности в исходе ЭКО, требуют особого внимания со стороны медицинских специалистов и формирования мультидисциплинарной команды.
Ключевые слова
Для цитирования:
Бондаренко А.С., Бибик Е.Е., Воскобойников В.В., Колегаева О.И., Сазонова А.И., Еремкина А.К., Лунякина О.В., Ионанидзе Т.Ю., Аксененко А.А., Есаян Р.М., Тетруашвили Н.К., Платонова Н.М., Мокрышева Н.Г. Первичный гиперпаратиреоз на фоне беременности, наступившей в результате процедуры экстракорпорального оплодотворения. Акушерство, Гинекология и Репродукция. 2024;18(3):414-424. https://doi.org/10.17749/2313-7347/ob.gyn.rep.2024.458
For citation:
Bondarenko A.S., Bibik E.E., Voskoboynikov V.V., Kolegaeva O.I., Sazonova A.I., Eremkina A.K., Lunyakina O.V., Ionanidze T.Yu., Aksenenko A.A., Esayan R.M., Tetruashvili N.K., Platonova N.M., Mokrysheva N.G. Primary hyperparathyroidism in pregnancy after in vitro fertilization. Obstetrics, Gynecology and Reproduction. 2024;18(3):414-424. (In Russ.) https://doi.org/10.17749/2313-7347/ob.gyn.rep.2024.458
Введение / Introduction
Первичный гиперпаратиреоз (ПГПТ) относится к одному из наиболее распространенных эндокринных заболеваний [1]. На долю опухолевой патологии околощитовидных желез (ОЩЖ), диагностированной во время беременности, по данным литературы приходится около 0,05–1,4 % всех случаев ПГПТ [2][3]. Однако истинная распространенность остается неизвестной. Чаще всего в этот период симптомы заболевания неспецифичны [4], определение показателей фосфорного-кальциевого обмена не входит в рутинные скрининговые мероприятия [5]. Кроме того, физиологические изменения, происходящие в организме женщины, такие как увеличение скорости клубочковой фильтрации, гипоальбуминемия, транспорт кальция через плаценту и снижение синтеза паратиреоидного гормона (ПТГ), затрудняют лабораторную диагностику заболевания [6].
По результатам последних исследований, осложнения ПГПТ у беременных развиваются примерно в 14 % случаев, хотя в более ранних работах приводится значимо более высокая частота – до 67 % [7]. Наиболее частыми являются преэклампсия (ПЭ) – 25 % [8], манифестный нефролитиаз – 17–36 % [9], острый калькулезный панкреатит – 7–13 % [10]. Крайне опасное ПГПТ-ассоциированное нарушение – гиперкальциемический криз, обусловленный резким повышением уровня сывороточного кальция (чаще в раннем послеродовом периоде при прекращении плацентарного кровообращения или в период лактации) [10].
Со стороны плода частота осложнений может достигать 80 %, среди них возможны самопроизвольное прерывание беременности, мертворождение, задержка роста плода, преждевременные роды [7]. Кроме того, стойкая материнская гиперкальциемия подавляет нормальное развитие ОЩЖ ребенка и может приводить к развитию тяжелой гипокальциемии у новорожденных, проявляющейся в крайних случаях тетанией вплоть до неонатальной смерти [10][11]. Хронический гипопаратиреоз при этом развивается достаточно редко.
Возможности медикаментозной терапии ПГПТ у беременных ограничены, выбор тактики лечения зависит от клинического течения, выраженности биохимических нарушений и срока гестации. Результаты исследований последних лет демонстрируют преимущество хирургической тактики по сравнению с консервативным ведением в отношении профилактики неонатальных осложнений [12–14].
Ниже представляем описание клинического случая 47-летней женщины с ПГПТ на фоне беременности, наступившей в результате экстракорпорального оплодотворения (ЭКО).
Клинический случай / Clinical case
Этические аспекты / Ethical aspects
Взаимодействие с пациенткой отвечало принципам, установленным Хельсинской декларацией 1964 г. и ее последующим изменениям или сопоставимым нормам этики.
В соответствии с положениями Федерального закона № 152-ФЗ от 27.07.2006 «О персональных данных» при подготовке статьи использованы обезличенные персональные данные пациента.
Пациентка добровольно подписала информированное согласие на публикацию персональной медицинской информации в обезличенной форме.
Клиническая характеристика пациентки / Patient clinical characteristics
Пациентка О., 47 лет, обратилась в августе 2022 г. на 9-й неделе беременности с жалобами на общую слабость, повышенную утомляемость, повышение артериального давления (АД) до 150/90 мм рт. ст.
Анамнез жизни / Anamnesis of life
При сборе анамнеза установлено, что в возрасте 25 лет после падения со второго этажа были диагностированы компрессионные переломы позвонков грудного отдела позвоночника. Также несколько лет назад по результатам ультразвукового исследования (УЗИ) были обнаружены микролиты в обеих почках, лечения не получала в связи с отсутствием клинической симптоматики и изменений по результатам общего анализа мочи. С 32 лет появились эпизоды повышения АД, максимально до 150/90 мм рт. ст. С учетом молодого возраста пациентки, проводился скрининг вторичных причин артериальной гипертензии. По результатам лабораторных анализов исключены первичный гиперальдостеронизм, эндогенный гиперкортицизм, феохромоцитома. Семейный анамнез не отягощен. На момент обращения женщина получала постоянную антигипертензивую терапию: нифедипин (с модифицированным высвобождением) 60 мг утром, метилдопа по 250 мг 3 раза в сутки. Со слов пациентки, на фоне терапии АД сохранялось в пределах нормотонии – 110–125/75–85 мм рт. ст.
Акушерско-гинекологический анамнез / Obstetric and gynecological anamnesis
Известно, что первая беременность в возрасте 35 лет закончилась антенатальной гибелью плода вследствие нарушения фетоплацентарного кровотока. В возрасте 40 лет в связи с развитием аномальных маточных кровотечений была выполнена гистероскопия, раздельное диагностическое выскабливание, диагностирована гиперплазия эндометрия, в 43 года – гистерорезектоскопия по поводу субмукозной миомы матки; тогда же диагностирована преждевременная недостаточность яичников.
Анамнез наблюдаемой беременности / History of observed pregnancy
Настоящая вторая беременность наступила с треть-
ей попытки процедуры ЭКО с использованием донорских яйцеклеток. В ходе прегравидарной подготовки пациентка проходила комплексное обследование. По результатам лабораторных анализов выявлен высоко-нормальный уровень альбумин-скорректированного кальция сыворотки крови – 2,56 ммоль/л (референсный интервал – 2,1–2,6 ммоль/л); уровень ПТГ не исследовали.
Диагностика первичного гиперпаратиреоза / Diagnostics of primary hyperparathyroidism
Первый триместр беременности протекал в отсутствие значимых жалоб женщины на самочувствие, но по результатам обследования на 9-й неделе гестации выявлена значимая гиперкальциемия (альбумин-скорректированный кальций – 2,99 ммоль/л) в сочетании с повышенным уровнем ПТГ до 18,2 пмоль/л (референсный интервал – 1,70–6,40 пмоль/л) и целевым показателем 25(OH)D (30,1 нг/мл). Дополнительно было рекомендовано исследование уровня суточной кальциурии, которая составила 12,9 ммоль/сут (референсный интервал – 2,50–7,50 ммоль/сут). Таким образом, установлен диагноз ПГПТ. При УЗИ у нижнего полюса левой доли щитовидной железы (ЩЖ) обнаружено гипоэхогенное образование левой нижней ОЩЖ размерами 17×16×8 мм. Также были выявлены признаки умеренных диффузных изменений ЩЖ (рис. 1). По данным лабораторных анализов, функция ЩЖ не нарушена – уровень тиреотропного гормона (ТТГ) составил 1,37 мкМЕ/мл.
Принимая во внимание клиническую картину заболевания, срок беременности, пациентке была рекомендована коррекция питания и питьевого режима (исключение потребления кальцийсодержащих продуктов, адекватная пероральная регидратация), регулярный контроль уровня кальция крови. Выполнение селективной паратиреоидэктомии в плановом порядке было намечено на II триместр беременности. Динамика лабораторных показателей на фоне консервативной терапии представлена на рисунке 2.
По данным ультразвукового скрининга, во II триместре беременности фетометрические параметры соответствовали 16,5 нед гестации после ЭКО и переноса эмбриона, отмечена низкая плацентация с угрозой кровотечения и признаки варикозного расширения вен малого таза. Гинекологом рекомендован прием прогестерона по 200 мг 3 раза в день в послеоперационном периоде.
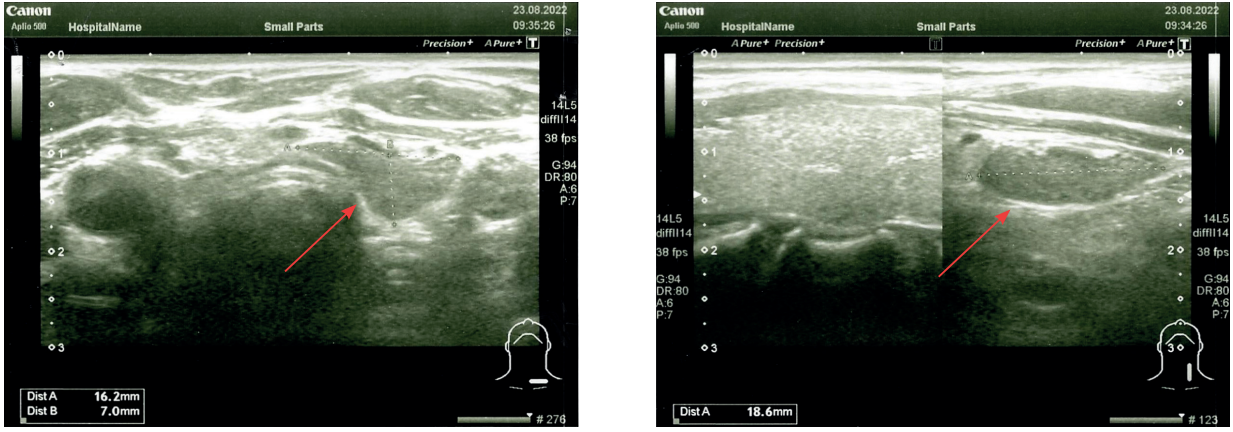
Рисунок 1. Пациентка О. Ультразвуковое исследование щитовидной и околощитовидных желез. Cтрелками показано образование левой нижней околощитовидной железы.
Figure 1. Patient O. Ultrasound examination of the thyroid and parathyroid glands. The arrows indicate the lesion of the left lower parathyroid gland.
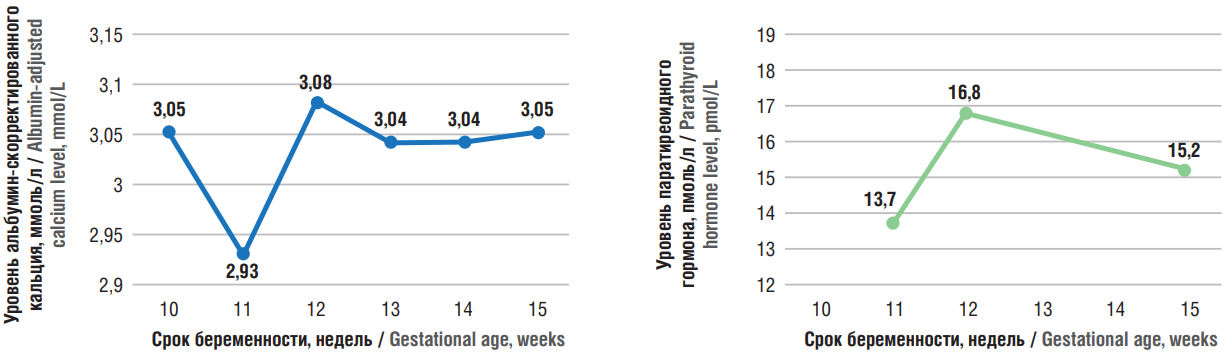
Рисунок 2. Динамика лабораторных показателей на фоне консервативной терапии.
Figure 2. Dynamic of laboratory parameters during conservative therapy.
Результаты хирургического лечения / Results of surgical treatment
На сроке беременности 17 нед выполнено хирургическое удаление левой нижней ОЩЖ. Уровень ПТГ до операции составлял 55,09 пг/мл (5,84 пмоль/л), через 15 мин после – 14,54 пг/мл (1,54 пмоль/л). На следующие сутки после паратиреоидэктомии отмечена нормокальциемия по уровню ионизированного кальция (1,22 ммоль/л), однако значение ПТГ снизилось до 9,45 пг/мл (1,00 пмоль/л), в связи с чем были назначены препараты колекальциферола 4000 МЕ/сут, альфакальцидола 0,5 мкг/сут, карбоната кальция 500 мг 2 раза в сутки. Ранний послеоперационный период протекал без особенностей.
По результатам гистологического исследования операционного материала подтверждена аденома солидно-фолликулярного и псевдососочкового строения из главных клеток со светлой и оксифильной цитоплазмой, к которой прилежала ткань неизмененной ОЩЖ. Через 3 дня после хирургического лечения пациентка выписана из стационара в удовлетворительном состоянии с рекомендацией контроля лабораторных показателей минерального обмена в динамике на фоне приема препаратов витамина D и кальция. Результаты динамического наблюдения и коррекция терапии представлены в таблице 1.
Таблица 1. Динамика лабораторных показателей после хирургического вмешательства и коррекция терапии.
Table 1. Dynamics of laboratory parameters after surgery and therapy correction.
Срок после оперативного вмешательства Time after surgery | Кальций общий, ммоль/л Total calcium, mmol/L | Альбумин, г/л Albumin, g/L | Альбумин-скорректированный кальций, ммоль/л Albumin-adjusted calcium, mmol/L | Паратиреоидный гормон, пмоль/л Parathyroid hormone, pmol/L |
Сутки после операции 24 hours post-surgery | 2,20 | 37,5 | 2,25 | 1,00 |
Колекальциферол 4000 МЕ/сут, альфакальцидол 0,5 мкг/сут, карбонат кальция 500 мг 2 раза в сутки | ||||
10 дней после операции 10 days post-surgery | 2,40 | 37,3 | 2,45 | 2,9 |
23 дня после операции 23 days post-surgery | 2,61 | 37,0 | 2,67 | 5,8 |
Отмена карбоната кальция / Discontinuation of calcium carbonate | ||||
42 дня после операции 42 days post-surgery | 2,33 | 37,3 | 2,38 | – |
Отмена альфакальцидола / Discontinuation of alfacalcidol | ||||
Референсный интервал Reference range | 2,15–2,50 | 35–52 | 2,15–2,50 | 1,70–6,40 |
Течение беременности после хирургического лечения / The course of pregnancy after surgical treatment
Учитывая риск венозных тромбоэмболических осложнений, с 28-й недели с профилактической целью проводилась терапия эноксапарином натрия 0,8 мл/сут подкожно. До 29-й недели беременности состояние пациентки сохранялось удовлетворительным, в последующем она отметила повышение АД выше целевых значений (до 150–160/90–95 мм рт. ст.) на фоне постоянного приема антигипертензивных препаратов, развитие отеков. На 31-й неделе гестации с диагнозом тяжелая ПЭ, HELLP-синдром (включающий в себя гемолиз эритроцитов, повышение уровня печеночных ферментов, тромбоцитопению) женщина была госпитализирована в профильный акушерский стационар, проведена операция кесарева сечения.
Исход беременности / Pregnancy outcome
Родилась живая девочка массой 1384 г, длиной 40 см, 7/8 баллов по шкале Апгар. За счет наличия дыхательных нарушений и недоношенности состояние ребенка было расценено как тяжелое, диагностирована врожденная пневмония. Новорожденная была переведена в отделение реанимации и интенсивной терапии, где проводилась респираторная поддержка и антибактериальная терапия. Клинических признаков гипокальциемии не отмечалось. По данным лабораторных анализов, уровень альбумин-скорректированного кальция на 6-е сутки жизни составил 2,53 ммоль/л, уровень 25(ОН)D на 25-е сутки – 42,01 нг/мл. На 14-е сутки жизни девочка была переведена в отделение патологии новорожденных и недоношенных детей, на 32-е сутки в удовлетворительном состоянии выписана домой.
Обсуждение / Discussion
Целый ряд эндокринных заболеваний может оказывать негативное влияние на фертильность. Среди женщин, участвующих в программах ЭКО, частота эндокринных заболеваний особенно высока – до 70 % [15]. К настоящему времени данных об отрицательном влиянии ПГПТ на репродуктивную функцию не получено, однако нарушения минерального обмена значимо влияют на течение беременности, здоровье матери и плода/новорожденного [16].
В период беременности и лактации в женском организме происходит ряд физиологических изменений, которые дают возможность обеспечить плод и новорождённого необходимыми количествами макро- и микроэлементов [10]. В норме у беременных, потребляющих рекомендованное количество кальцийсодержащих продуктов, уровень ПТГ снижается до нижне-нормальных значений и остается таким до самых родов, а при последующем грудном вскармливании – до его окончания. Важным регулятором минерального обмена в эти периоды жизни женщины становится паратгормон-подобный пептид (ПТГпП), который вырабатывается плацентой, молочными железами, децидуальной тканью матки и тканями плода. Под его контролем осуществляется транспорт кальция через плаценту и поддержание его уровня в сыворотке матери и плода [10]. В период гестации абсорбция кальция в кишечнике увеличивается в 2–3 раза к концу I триместра, также на ранних сроках беременности активируются процессы костной резорбции. В свою очередь, аккумуляция кальция в организме плода происходит только в III триместре, а для поддержания гомеостаза компенсаторно развивается гиперкальциурия. Важно отметить, что в раннем послеродовом периоде уровень кальциемии матери существенно повышается вследствие прекращения трансплацентарного транспорта кальция. Описанные изменения при наличии гормонально-активной опухоли ОЩЖ могут усугублять течение ПГПТ, степень гиперкальциемии, значимо увеличивая риск развития осложнений в период беременности и в раннем послеродовом периоде [17].
Медицинские действия, проводимые в рамках ЭКО и направленные на стимуляцию выработки половых гормонов, вероятно, не оказывают значимого влияния на минеральный обмен. Тем не менее, согласно данным крупного ретроспективного когортного исследования, процедуры ЭКО ассоциированы с увеличением вероятности неблагоприятных исходов по сравнению с общей популяцией [18]. Результаты исследований также свидетельствуют об ухудшении результатов ЭКО среди пациенток с различными эндокринными заболеваниями, несмотря на коррекцию гормональных нарушений [15].
В связи с отсутствием рекомендаций по скрининговому исследованию показателей фосфорно-кальциевого обмена, своевременная диагностика ПГПТ представляет трудности. Насторожить клинициста может наличие в анамнезе переломов костей, потери беременности неясного генеза, язвенная болезнь желудка или двенадцатиперстной кишки, психические расстройства, мочекаменная болезнь и артериальная гипертензия, как в нашем случае [19–22]. Выявленная у пациентки О. нормокальциемия маскировала заболевание в прегравидарном периоде. Вероятно, диагноз мог быть установлен ранее в случае проведения расширенного обследования. В связи с чем представляется целесообразным проведение углубленного обследования женщин перед планированием беременности и ЭКО при наличии патологий, ассоциированных с нарушениями фосфорно-кальциевого обмена, включающего определение уровней общего кальция и альбумина (с расчетом альбумин-скорректированного кальция), фосфора, ПТГ и 25(ОН)D сыворотки крови с консультацией врача-эндокринолога при наличии отклонений описанных параметров. Возможно, наша пациентка болела ПГПТ в течение длительного времени, но его продолжительность, как и негативное влияние на течение первой беременности, остаются нерешенными вопросами.
Возраст пациентки, крайне высокий риск осложнений при сочетании ПГПТ и беременности в исходе ЭКО в представленном клиническом случае требовали особого подхода и активного взаимодействия членов мультидисциплинарной команды с целью выбора оптимальной тактики лечения, направленной на сохранение столь долгожданной и желанной беременности. В литературе описаны лишь единичные аналогичные наблюдения, кратко представленные в рамках серий клинических случаев ПГПТ во время беременности и демонстрирующие благоприятные исходы. Например, в исследовании H.-N. Jiao с соавт. (2021) среди 11 пациенток с ПГПТ у одной женщины беременность наступила в результате ЭКО. Исходно в общей группе медиана уровня кальция сыворотки крови составила 3,08 [ 2,95; 3,28] ммоль/л, ПТГ – 300,4 [ 201,0; 493,4] пг/мл. Паратиреоидэктомия была проведена в 7 случаях во II триместре, одной пациентке в I триместре и одной – в послеродовом периоде. Оперативное лечение во всех случаях прошло успешно (привело к значительному снижению уровня кальция и ПТГ) и без осложнений [23]. В работе A.N. DiMarco c соавт. описано 17 подобных случаев, среди них также одна беременность с использованием вспомогательных репродуктивных технологий. У данной пациентки 32 лет ПГПТ был диагностирован до наступления беременности, однако при УЗИ и сцинтиграфии расположение патологической ОЩЖ установить не удалось. Во II триместре беременности уровень альбумин-скорректированного кальция достиг 2,85 ммоль/л, ПТГ составил 6 пмоль/л. На 24-й неделе гестации в связи с отсутствием визуализации образований ОЩЖ была выполнена билатеральная ревизия шеи с удалением двух аденом и достижением ремиссии заболевания. Осложнений хирургического лечения, последующего периода беременности и родов не наблюдалось [14].
Выбор метода лечения ПГПТ зависит от степени гиперкальциемии, наличия осложнений заболевания и срока гестации [2]. Консервативная тактика может рассматриваться при мягком течении заболевания (отсутствии значимых клинических проявлений) и повышении уровня кальция крови менее чем на 0,25 ммоль/л относительно верхней границы референсного диапазона, установленного лабораторией [24][25]. Медикаментозная коррекция гиперкальциемии ограничена в связи с возможными потенциальными рисками для плода. Такие препараты, как цинакальцет, кальцитонин, бисфосфонаты относятся к категории С [26–29], хотя имеется ограниченный опыт их применения во время беременности. Использование деносумаба в период гестации не рекомендовано [30][31]. В качестве первой линии лечения используется регидратационная терапия с ограничением потребления кальцийсодержащих продуктов [25]. Кроме того, с целью предотвращения вторичного повышения ПТГ при дефиците 25(ОН)D возможно назначение препаратов нативного витамина D в низких дозах [24]. В нашем случае на раннем сроке беременности женщина строго придерживалась рекомендаций по расширенному питьевому режиму и коррекции питания, что позволило поддерживать ее состояние без отрицательной динамики.
Хотя состояние пациентки на фоне консервативной терапии оставалось стабильным, в связи с сохранением выраженной гиперкальциемии, высокими рисками развития осложнений у матери и плода было рекомендовано хирургическое вмешательство. Оперативное лечение ПГПТ показано при повышении уровня кальция более чем на 0,25 ммоль/л относительно верхней границы референсного диапазона и/или при наличии костно-висцеральных проявлений [24][25]. Известно, что эффективность паратирео-
идэктомии достигает 90–95 %, а послеоперационные осложнения при проведении минимально инвазивной селективной паратиреоидэктомии развиваются лишь в 1–3 % случаев [3].
При планировании хирургического вмешательства необходимо учитывать, что основные периоды органогенеза протекают в I триместре, в этот же период наиболее высокий риск самопроизвольных абортов, а в третьем III возрастает риск преждевременных родов [32]. Поэтому оптимальным сроком проведения паратиреоидэктомии является II триместр беременности, который и был выбран в описанном случае. Тем не менее в литературе представлены результаты успешных операций как в I, так и в III триместре [33–35], что свидетельствует о возможности радикального лечения на любом сроке при наличии абсолютных показаний.
В качестве метода предоперационной топической диагностики в данном случае было проведено УЗИ, являющееся основным у беременных пациенток с ПГПТ [36–38], подтверждено образование левой нижней ОЩЖ. Другие методы топической диагностики, как правило, не используются ввиду лучевой нагрузки на плод.
Для оценки эффективности хирургического вмешательства рекомендуется интраоперационная оценка уровня ПТГ до и через 15 мин после удаления образования ОЩЖ. Снижение уровня ПТГ на 50 % и более от исходного свидетельствует о радикальности проведенного лечения [39][40]. В описанном примере оперативное вмешательство прошло успешно, что подтверждено зафиксированным четырехкратным снижением уровня ПТГ. С целью своевременной диагностики гипокальциемии в послеоперационном периоде всем пациентам рекомендуется контроль уровня альбумин-скорректированного кальция в первые сутки после операции [41][42]. Хотя в данном случае уровень сывороточного кальция сохранялся нормальным, в связи с зафиксированным транзиторным гипопаратиреозом превентивно назначена терапия препаратами кальция и активного метаболита витамина D.
Несмотря на отсутствие серьёзных осложнений в послеоперационном периоде, беременность завершилась преждевременными родами на 31-й неделе в связи с развитием у пациентки ПЭ, которая является одним из наиболее опасных осложнений беременности. Считается, что ключевую роль в патогенезе ее развития играет генерализованная эндотелиальная дисфункция, обусловленная избыточной выработкой плацентарных антиангиогенных факторов [43][44]. В свою очередь, ПГПТ также может приводить к нарушению функций эндотелия сосудистого русла [45–48]. Таким образом, частая ассоциация между данными патологическими состояниями может быть обусловлена развитием общих патофизиологических процессов. В литературе представлены данные, подтверждающие повышенный риск развития ПЭ среди женщин с ПГПТ, несмотря на успешно выполненную паратиреоидэктомию в анамнезе [49].
Заключение / Conclusion
Благодаря скоординированной тактике медицинских специалистов в описанном нами клиническом случае женщине удалось сохранить беременность и родить здорового ребенка. Еще раз стоит подчеркнуть важность определения показателей фосфорно-
кальциевого обмена как в рамках прегравидарной подготовки, так и в период беременности. Своевременная диагностика и персонализированное лечение ПГПТ требуют особого внимания со стороны медицинского персонала, привлечения специалистов мультидисциплинарной команды, что позволяет значимо снизить риски развития осложнений со стороны матери и ребенка.
Список литературы
1. Minisola S., Arnold A., Belaya Z. et al. Epidemiology, pathophysiology, and genetics of primary hyperparathyroidism. J Bone Miner Res. 2022;37(11):2315–29. https://doi.org/10.1002/jbmr.4665.
2. Ali D.S., Dandurand K., Khan A.A. Primary hyperparathyroidism in pregnancy: literature review of the diagnosis and management. J Clin Med. 2021;10(13):2956. https://doi.org/10.3390/jcm10132956.
3. Мокрышева Н.Г., Липатенкова А.К., Таллер Н.А. Первичный гиперпаратиреоз и беременность. Акушерство и гинекология. 2016;(10):18– 25. https://doi.org/10.18565/aig.2016.10.18-25.
4. Schnatz P.F., Curry S.L. Primary hyperparathyroidism in pregnancy: evidence-based management. Obstet Gynecol Surv. 2002;57(6):365–76. https://doi.org/10.1097/00006254-200206000-00022.
5. Приказ Минздрава России от 20.10.2020 N 1130н «Об утверждении Порядка оказания медицинской помощи по профилю “акушерство и гинекология”». М.: Министерство здравоохранения Российской Федерации, 2020. 688 с. Режим доступа: https://base.garant.ru/74840123/. [Дата обращения: 15.10.2023].
6. Hacker A.N., Fung E.B., King J.C. Role of calcium during pregnancy: maternal and fetal needs. Nutr Rev. 2012;70(7):397–409. https://doi.org/10.1111/j.1753-4887.2012.00491.x.
7. McCarthy A., Howarth S, Khoo S. et al. Management of primary hyperparathyroidism in pregnancy: a case series. Endocrinol Diabetes Metab Case Rep. 2019;2019:19-0039. https://doi.org/10.1530/EDM-19-0039. Online ahead of print.
8. Nastos C., Paspala AS., Mavroeidi I. et al. Surgical management of primary hyperparathyroidism during pregnancy: a systematic review of the literature. Gynecol Endocrinol. 2021;37(12):1086–95. https://doi.org/10.1080/09513590.2021.1932801.
9. Iqbal N., Steinberg H., Aldasouqi S., Edmondson J.W. Nephrolithiasis during pregnancy secondary to primary hyperparathyroidism. Urology. 2001;57(3):554. https://doi.org/10.1016/s0090-4295(00)01061-x.
10. Kovacs C.S. Maternal mineral and bone metabolism during pregnancy, lactation, and post-weaning recovery. Physiol Rev. 2016;96(2):449–547. https://doi.org/10.1152/physrev.00027.2015.
11. Мокрышева Н.Г., Крупинова Ю.А., Воронкова И.А. Околощитовидные железы: нормальное развитие, анатомическое и гистологическое строение. Эндокринная хирургия. 2018;12(4):178–87. https://doi.org/10.14341/serg10039.
12. Hu Y., Cui M., Sun Z. et al. Clinical presentation, management, and outcomes of primary hyperparathyroidism during pregnancy. Int J Endocrinol. 2017;2017:3947423. https://doi.org/10.1155/2017/3947423.
13. Rigg J., Gilbertson E., Barrett H.L. et al. Primary hyperparathyroidism in pregnancy: maternofetal outcomes at a quaternary referral obstetric hospital, 2000 Through 2015. J Clin Endocrinol Metab. 2019;104(3):721– 9. https://doi.org/10.1210/jc.2018-01104.
14. DiMarco A.N., Meeran K., Christakis I. et al. Seventeen cases of primary hyperparathyroidism in pregnancy: a call for management guidelines. J Endocr Soc. 2019;3(5):1009–21. https://doi.org/10.1210/js.2018-00340.
15. Herman T., Csehely S., Orosz M. et al. Impact of endocrine disorders on IVF outcomes: results from a large, single-centre, prospective study. Reprod Sci. 2023;30(6):1878–90. https://doi.org/10.1007/s43032-022-01137-0.
16. Arshad M.F., Arambewela M.H., Bennet W.M. et al. Primary hyperparathyroidism in pregnancy: experience of a tertiary centre. Primary hyperparathyroidism in pregnancy: experience of a tertiary centre. Surg Today. 2023;53(4):470–5. https://doi.org/10.1007/s00595-022-02583-8.
17. Strebeck R.J., Schneider A.M., Whitcombe D.D. et al. Hyperparathyroidism in pregnancy: a review of the literature. Obstet Gynecol Surv. 2022;77(1):35–44. https://doi.org/10.1097/OGX.0000000000000977.
18. Sabban H., Zakhari A., Patenaude V. et al. Obstetrical and perinatal morbidity and mortality among in-vitro fertilization pregnancies: a population-based study. Arch Gynecol Obstet. 2017;296(1):107–13. https://doi.org/10.1007/s00404-017-4379-8.
19. Cong X., Shen L., Gu X. Current opinions on nephrolithiasis associated with primary hyperparathyroidism. Urolithiasis. 2018;46(5):453–7. https://doi.org/10.1007/s00240-018-1038-x.
20. Behrens M., Boyle S., Fingeret A.L. Evaluation for primary hyperparathyroidism in patients who present with nephrolithiasis. J Surg Res. 2021;257:79–84. https://doi.org/10.1016/j.jss.2020.07.049.
21. Chiodini I., Cairoli E., Palmieri S. et al. Non classical complications of primary hyperparathyroidism. Best Pract Res Clin Endocrinol Metab. 2018;32(6):805–20. https://doi.org/10.1016/j.beem.2018.06.006.
22. Tournis S., Makris K., Cavalier E. et al. Cardiovascular risk in patients with primary hyperparathyroidism. Curr Pharm Des. 2020;26(43):5628–36. https://doi.org/10.2174/1381612824999201105165642.
23. Jiao H.-N., Sun L.-H., Liu Y. et al. Multidisciplinary team efforts to improve the pregnancy outcome of pregnancy complicated with primary hyperparathyroidism: case series from a single hospital. BMC Pregnancy Childbirth. 2021;21(1):576. https://doi.org/10.1186/s12884-021-04042-7.
24. Мокрышева Н.Г., Еремкина А.К., Мирная С.С. и др. Клинические рекомендации по первичному гиперпаратиреозу, краткая версия. Проблемы эндокринологии. 2021;67(4):94–124. https://doi.org/10.14341/probl12801.
25. Bollerslev J., Rejnmark L., Zahn A. et al. European Expert Consensus on practical management of specific aspects of parathyroid disorders in adults and in pregnancy: recommendations of the ESE Educational Program of Parathyroid Disorders (PARAT 2021). Eur J Endocrinol. 2022;186(2):R33–R63. https://doi.org/10.1530/EJE-21-1044.
26. Chen Y., Pedersen L.H., ChuW.W., Olsen J. Drug exposure side effects from mining pregnancy data. ACM SIGKDD Explorations Newsletter. 2007;9(1):22–9. https://doi.org/10.1145/1294301.1294308.
27. Krysiak R., Wilk M., Okopien B. Recurrent pancreatitis induced by hyperparathyroidism in pregnancy. Arch Gynecol Obstet. 2011;284(3):531–4. https://doi.org/10.1007/s00404-010-1668-x.
28. Levy S., Fayez I., Taguchi N. et al. Pregnancy outcome following in utero exposure to bisphosphonates. Bone. 2009;44(3):428–30. https://doi.org/10.1016/j.bone.2008.11.001.
29. Horjus C., Groot I., Telting D. et al. Cinacalcet for hyperparathyroidism in pregnancy and puerperium. J Pediatr Endocrinol Metab. 2009;22(8):741– 9. https://doi.org/10.1515/jpem.2009.22.8.741.
30. Boyce R.W., Varela A., Chouinard L. et al. Infant cynomolgus monkeys exposed to denosumab in utero exhibit an osteoclast-poor osteopetroticlike skeletal phenotype at birth and in the early postnatal period. Bone. 2014;64:314–25. https://doi.org/10.1016/j.bone.2014.04.002.
31. Okamatsu N., Sakai N., Karakawa A. et al. Biological effects of anti-RANKL antibody administration in pregnant mice and their newborns. Biochem Biophys Res Commun. 2017;491(3):614–21. https://doi.org/10.1016/j.bbrc.2017.07.154.
32. Pothiwala P., Levine S.N. Parathyroid surgery in pregnancy: review of the literature and localization by aspiration for parathyroid hormone levels. J Perinatol. 2009;29(12):779–84. https://doi.org/10.1038/jp.2009.84.
33. Schnatz P.F., Thaxton S. Parathyroidectomy in the third trimester of pregnancy. Obstet Gynecol Surv. 2005;60(10):672–82. https://doi.org/10.1097/01.ogx.0000180889.23678.fb.
34. Brychta I., Mayer A., Gergel M. et al. Primary hyperparathyroidism in pregnancy: a case of successful parathyroidectomy in the third trimester. Neuro Endocrinol Lett. 2021;42(8):517–21.
35. Sharma S.G., Levine S.N., Yatavelli R.K. et al. Parathyroidectomy in first trimester of pregnancy. J Endocr Soc. 2020;4(3):bvaa015. https://doi.org/10.1210/jendso/bvaa015.
36. Vitetta G.M., Neri P., Chiecchio A. et al. Role of ultrasonography in the management of patients with primary hyperparathyroidism: retrospective comparison with technetium-99m sestamibi scintigraphy. J Ultrasound. 2014;17(1):1–12. https://doi.org/10.1007/s40477-014-0067-8.
37. Committee Opinion No. 723: Guidelines for diagnostic imaging during pregnancy and lactation. Obstet Gynecol. 2017;130(4):e210–e216. https://doi.org/10.1097/AOG.0000000000002355.
38. Bunch P.M., Kelly H.R. Preoperative imaging techniques in primary hyperparathyroidism: a review. JAMA Otolaryngol Head Neck Surg. 2018;144(10):929–37. https://doi.org/10.1001/jamaoto.2018.1671.
39. Кузнецов Н.С., Ким И.В., Кузнецов С.Н. Интраоперационное определение паратгормона в стратегии хирургического лечения первичного гиперпаратиреоза. Эндокринная хирургия. 2011;5(2):18–25. https://doi.org/10.14341/2306-3513-2011-2-18-25.
40. Pavlidis E.T., Pavlidis T.E. Update on the current management of persistent and recurrent primary hyperparathyroidism after parathyroidectomy. World J Clin Cases. 2023;11(10):2213–25. https://doi.org/10.12998/wjcc.v11.i10.2213.
41. He C., Zhang Y., Li L. et al. Risk factor analysis and prediction of severe hypocalcemia after total parathyroidectomy without auto-transplantation in patients with secondary hyperparathyroidism. Int J Endocrinol. 2023;2023:1901697. https://doi.org/10.1155/2023/1901697.
42. Shahriarirad R., Meshkati Y.S.M., Ardekani A. et al. Calcitriol supplementation before parathyroidectomy and calcium level after surgery in parathyroid adenoma patients: a randomized controlled trial. J Endocrinol Invest. 2023;46(5):985–90. https://doi.org/10.1007/s40618-022-01963-8.
43. Rana S., Lemoine E., Granger J.P., Karumanchi S.A. Preeclampsia: pathophysiology, challenges, and perspectives. Circ Res. 2019;124(7):1094–112. https://doi.org/10.1161/CIRCRESAHA.118.313276.
44. Tomimatsu T., Mimura K., Matsuzaki S. et al. Preeclampsia: maternal systemic vascular disorder caused by generalized endothelial dysfunction due to placental antiangiogenic factors. Int J Mol Sci. 2019;20(17):4246. https://doi.org/10.3390/ijms20174246.
45. Горбачева А.М., Бибик Е.Е., Добрева Е.А. и др. Растворимый эндоглин – потенциальный маркер эндотелиальной дисфункции у пациентов с первичным гиперпаратиреозом: пилотное исследование. Ожирение и метаболизм. 2022;19(4):358–68. https://doi.org/10.14341/omet12923.
46. Gambardella J., De Rosa M., Sorriento D. et al. Parathyroid hormone causes endothelial dysfunction by inducing mitochondrial ROS and specific oxidative signal transduction modifications. Oxid Med Cell Longev. 2018;2018:9582319. https://doi.org/10.1155/2018/9582319.
47. Colak S., Aydogan B.I., Canpolat A.G. et al. Is primary hyperparathyroidism a cause of endothelial dysfunction? Clin Endocrinol (Oxf). 2017;87(5):459–65. https://doi.org/10.1111/cen.13418.
48. Vadana M., Cecoltan S., Ciortan L. et al. Parathyroid hormone induces human valvular endothelial cells dysfunction that impacts the osteogenic phenotype of valvular interstitial cells. Int J Mol Sci. 2022;23(7):3776. https://doi.org/10.3390/ijms23073776.
49. Hultin H., Hellman P., Lundgren E. et al. Association of parathyroid adenoma and pregnancy with preeclampsia. J Clin Endocrinol Metab. 2009;94(9):3394–9. https://doi.org/10.1210/jc.2009-0012.
Об авторах
А. С. БондаренкоРоссия
Бондаренко Аксения Сергеевна – клинический ординатор
117292 Москва, ул. Дмитрия Ульянова, д. 11
Е. Е. Бибик
Россия
Бибик Екатерина Евгеньевна – к.м.н., научный сотрудник, врач-эндокринолог отделения патологии околощитовидных желез и нарушений минерального обмена
117292 Москва, ул. Дмитрия Ульянова, д. 11
В. В. Воскобойников
Россия
Воскобойников Валерий Витальевич – к.м.н., старший научный сотрудник, врач-хирург отдела хирургии
117292 Москва, ул. Дмитрия Ульянова, д. 11
О. И. Колегаева
Россия
Колегаева Оксана Игоревна – врач-эндокринолог терапевтического отделения
117997 Москва, ул. Академика Опарина, д. 4
А. И. Сазонова
Россия
Сазонова Анна Игоревна – к.м.н., врач-эндокринолог терапевтического отделения
117997 Москва, ул. Академика Опарина, д. 4
А. К. Еремкина
Россия
Еремкина Анна Константиновна – к.м.н., научный сотрудник, зав. отделением патологии околощитовидных желез и нарушений минерального обмена
117292 Москва, ул. Дмитрия Ульянова, д. 11
О. В. Лунякина
Россия
Лунякина Ольга Витальевна – врач-эндокринолог терапевтического отделения
117997 Москва, ул. Академика Опарина, д. 4
Т. Ю. Ионанидзе
Россия
Ионанидзе Тэя Юрьевна – к.м.н., врач акушер-гинеколог, младший научный сотрудник 2-го акушерского отделения патологии беременности
117997 Москва, ул. Академика Опарина, д. 4
А. А. Аксененко
Россия
Аксененко Артем Анатольевич – к.м.н., врач акушер-гинеколог 1-го гинекологического отделения
117997 Москва, ул. Академика Опарина, д. 4
Р. М. Есаян
Россия
Есаян Роза Михайловна – к.м.н., врач-эндокринолог, зав. терапевтическим отделением
117997 Москва, ул. Академика Опарина, д. 4
Н. К. Тетруашвили
Россия
Тетруашвили Нана Картлосовна – д.м.н., профессор, руководитель 2-го отделения акушерского отделения патологии беременности
117997 Москва, ул. Академика Опарина, д. 4
Н. М. Платонова
Россия
Платонова Надежда Михайловна – д.м.н., зав. отделом терапевтической эндокринологии, Государственный научный центр Российской Федерации
117292 Москва, ул. Дмитрия Ульянова, д. 11
Н. Г. Мокрышева
Россия
Мокрышева Наталья Георгиевна – д.м.н., профессор, член-корр. РАН, зав. кафедрой персонализированной и трансляционной медицины, директор
117292 Москва, ул. Дмитрия Ульянова, д. 11
Что уже известно об этой теме?
► Физиологические изменения, происходящие в организме женщины в период беременности, затрудняют лабораторную диагностику первичного гиперпаратиреоза (ПГПТ).
► При отсутствии лечения частота развития осложнений ПГПТ у беременных составляет по разным данным от 14 до 67 %, у новорожденных – до 80 %.
► Возможности медикаментозной терапии ПГПТ у беременных ограничены. Результаты исследований последних лет демонстрируют преимущество хирургической тактики по сравнению с консервативным ведением в отношении профилактики неонатальных осложнений.
Что нового дает статья?
► Целесообразно проведение углубленного обследования у женщин перед планированием беременности и экстракорпорального оплодотворения (ЭКО) при наличии патологий, ассоциированных с нарушениями фосфорно-кальциевого обмена.
► Крайне высокий риск осложнений при сочетании ПГПТ и беременности в исходе ЭКО требуют особого подхода и активного взаимодействия членов мультидисциплинарной команды с целью выбора оптимальной тактики лечения, направленной на сохранение беременности.
Как это может повлиять на клиническую практику в обозримом будущем?
► Нами будет предложено внедрение скринингового определения показателей фосфорно-кальциевого обмена как в рамках прегравидарной подготовки, так и в период беременности.
Рецензия
Для цитирования:
Бондаренко А.С., Бибик Е.Е., Воскобойников В.В., Колегаева О.И., Сазонова А.И., Еремкина А.К., Лунякина О.В., Ионанидзе Т.Ю., Аксененко А.А., Есаян Р.М., Тетруашвили Н.К., Платонова Н.М., Мокрышева Н.Г. Первичный гиперпаратиреоз на фоне беременности, наступившей в результате процедуры экстракорпорального оплодотворения. Акушерство, Гинекология и Репродукция. 2024;18(3):414-424. https://doi.org/10.17749/2313-7347/ob.gyn.rep.2024.458
For citation:
Bondarenko A.S., Bibik E.E., Voskoboynikov V.V., Kolegaeva O.I., Sazonova A.I., Eremkina A.K., Lunyakina O.V., Ionanidze T.Yu., Aksenenko A.A., Esayan R.M., Tetruashvili N.K., Platonova N.M., Mokrysheva N.G. Primary hyperparathyroidism in pregnancy after in vitro fertilization. Obstetrics, Gynecology and Reproduction. 2024;18(3):414-424. (In Russ.) https://doi.org/10.17749/2313-7347/ob.gyn.rep.2024.458

Контент доступен под лицензией Creative Commons Attribution-NonCommercial-ShareAlike 4.0 International License.











































