Перейти к:
Инновационные подходы к оценке факторов риска, диагностике и лечению неонатальных тромбозов
https://doi.org/10.17749/2313-7347/ob.gyn.rep.2024.530
Аннотация
Новорожденные относятся к группе высокого тромботического риска по сравнению с детьми других возрастов, в особенности этой патологии подвержены тяжелобольные и недоношенные дети. Снижение частоты случаев неонатальных тромбозов может быть обусловлено улучшением методов лечения тяжелых состояний у новорожденных и повышенной выживаемостью недоношенных детей. Система гемостаза у новорожденных и взрослых имеет известные физиологические различия: у них различаются параметры концентрации, скорости синтеза факторов свертывания крови, скорости обмена веществ, уровни тромбина и плазмина. При этом у новорожденных пороговые показатели естественных ингибиторов свертывания крови (протеинов С и S, антитромбина, кофактора II гепарина) и витамин К-зависимых факторов (F) свертывания (FII, FVII, FIX, FX) достаточно низкие, в то время как содержание FVIII и фактора фон Виллебранда превышает аналогичное у взрослых. Таким образом, у новорожденных наблюдается пониженная фибринолитическая активность плазмы. Основными факторами риска развития тромботических осложнений являются центральные венозные катетеры, изменения объема жидкости в организме, заболевания печени, а также сепсис и воспалительные процессы, в частности COVID-19. Значение врожденной и приобретенной тромбофилии у матери и новорожденного может быть дополнительным фактором риска тромботических осложнений. В терапии и профилактике тромбозов новорожденных препаратами первого выбора являются низкомолекулярные гепарины.
Ключевые слова
Для цитирования:
Макацария А.Д., Воробьев А.В., Лазарчук А.В., Эйнуллаева С.Э., Гоменко Н.А., Магомедова Ф.А., Бицадзе В.О., Хизроева Д.Х., Макацария Н.А., Зубенко В.Б., Третьякова М.В., Блинов Д.В., Ягубова Ф.Э., Гашимова Н.Р., Григорьева К.Н., Пониманская М.А., Ли О.Н., Мостовой А.В., Карпова А.Л., Гри Ж., Элалами И. Инновационные подходы к оценке факторов риска, диагностике и лечению неонатальных тромбозов. Акушерство, Гинекология и Репродукция. 2024;18(3):382-400. https://doi.org/10.17749/2313-7347/ob.gyn.rep.2024.530
For citation:
Makatsariya A.D., Vorobev A.V., Lazarchuk A.V., Einullaeva S.E., Gomenko N.A., Magomedova F.A., Bitsadze V.O., Khizroeva J.Kh., Makatsariya N.A., Zubenko V.B., Tretyakova M.V., Blinov D.V., Yagubova F.E., Gashimova N.R., Grigoreva K.N., Ponimanskaya M.A., Li O.N., Mostovoi A.V., Karpova A.L., Gris J., Elalamy I. Innovative approaches to assessing risk factors, diagnostics and treatment of neonatal thrombosis. Obstetrics, Gynecology and Reproduction. 2024;18(3):382-400. (In Russ.) https://doi.org/10.17749/2313-7347/ob.gyn.rep.2024.530
Введение / Introduction
Неонатальный тромбоз – редкое (0,7–0,14 на 10 тыс.), но опасное заболевание, приводящее к значительному уровню заболеваемости и смертности среди новорожденных [1]. С 1997 по 2018 гг. число новорожденных с неонатальным тромбозом увеличилось в 13 раз [1][2]. От 2 до 4 % новорожденных умирают по причине венозной тромбоэмболии (ВТЭ) [3][4]. После поступления новорожденного в отделение интенсивной терапии (ОИТ) риск неонатального тромбоза возрастает, и общая его частота у пациентов этого отделения составляет около 0,2 % [5]. По результатам проведенного двухлетнего проспективного исследования в Нидерландах, было установлено, что ВТЭ развивается в 85 % случаев у новорожденных во время пребывания в стационаре [3]. В связи с тем, что тромбоз новорожденных может протекать бессимптомно или неспецифично, его не всегда удается выявить на ранних этапах развития [4][6].
Важным патогенетическим фактором у новорожденных является состояние системы свертывания крови, которое отличается от детей более старшей возрастной группы и взрослых [1]. Белки свертывания крови у плода синтезируются на ранней стадии и не проникают через плаценту. При рождении активность витамин К-зависимых факторов (F) FII, FVII, FIX и FX, а также содержание контактных FXI и FXII снижаются примерно до 50 % от референсных значений для взрослых и приближаются к уровню взрослого человека к 6 мес жизни [7][8], а концентрации естественных антикоагулянтов (антитромбина, кофактора II гепарина и протеинов С и S) при рождении снижены. Фибринолитическая система характеризуется снижением уровня плазминогена и α2-антиплазмина. Все эти особенности в большинстве случаев зависят от срока беременности и, следовательно, в большей степени проявляются у недоношенных детей. Несмотря на эти особенности неонатального гемостаза, у здорового новорожденного редко развивается спонтанная ВТЭ, но развитию тромбоза могут способствовать некоторые провоцирующие факторы. Для лучшего понимания механизмов системы гемостаза у здоровых и тяжелобольных детей, определения клинически значимых критериев, оценочных тестов, а также разработки эффективных стратегий лечения необходимы дополнительные исследования.
Эпидемиология тромбозов у новорожденных / Epidemiology of neonatal thrombosis
Согласно проведенным исследованиям в Канаде, Германии и Дании, частота тромбозов среди новорожденных составляет приблизительно 2,4 на 1000 детей в ОИТ и 5,5 на 100 тыс. рождений в целом. По результатам метаанализа, обобщающего частоту тромбозов, приблизительно в 2 % случаев данная патология развивается в ОИТ, что согласуется с предыдущими исследованиями [9]. Первый канадский реестр новорожденных был создан в 1990 г. и включал в себя данные 15 канадских педиатрических центров [10]. Было выявлено 137 пациентов с тромбозом, общая заболеваемость ТГВ/ТЭЛА (тромбоз глубоких вен/тромбоэмболия легочной артерии) составила 5,3 на 10 тыс. госпитализаций или 0,07 на 10 тыс. в этом регистре.
В список случаев заболеваний университета Макмастера включены данные врачей из 64 центров Северной Америки, Европы и Австралии [11]. Зарегистрированы 97 случаев ВТЭ. Было установлено, что сепсис и обширные хирургические вмешательства являются наиболее значимыми факторами риска развития тромбоза. У 21 новорожденного развился тромбоз почечных вен, а у 39 детей была обнаружена ВТЭ другой локализации. В 89 % случаев провоцирующим фактором развития тромбоза была установка катетера.
В исследовании, которое проводилось в Германии, зарегистрирована частота ВТЭ 5,1 на 100 тыс. новорожденных. В общей сложности было зафиксировано 79 случаев неонатального тромбоза [12]. Диагноз был подтвержден с помощью ультразвуковой доплерографии. Тромбоз почечных вен развился у 35 новорожденных, у 25 новорожденных была выявлена другая локализация ВТЭ; во всех остальных случаях у новорожденных развился артериальный тромбоз. В 59 случаях развитие тромбоза было связано с такими различными факторами риска, как установка центрального венозного катетера (n = 25), асфиксия (n = 13), сепсис (n = 11), обезвоживание (n = 6), сахарный диабет у матери (n = 2) и болезни сердца (n = 1). Генетическая тромбофилия была диагностирована в 7 случаях.
С 1994 по 2006 гг. было проведено Датское исследование, которое включало пациентов в возрасте от 0 до 18 лет с диагнозом ВТЭ и выявило различия в частоте венозных и артериальных тромбозов у детей в зависимости от пола и возраста [13]. Самая высокая заболеваемость была зарегистрирована у детей в возрасте до 1 года, особенно у мальчиков. Факторы риска выявлены в 86,6 % случаев, а у 47,9 % новорожденных была диагностирована наследственная тромбофилия.
Согласно данным неонатологических центров Итальянского регистра по детским тромбозам, сообщалось о 75 новорождённых в возрасте от 0 до 28 дней в период с 2007 по 2013 гг. ВТЭ наблюдалась у 41 (55 %) новорожденного, артериальный тромбоз – у 22 (29 %), а у других участников исследования был зарегистрирован тромбоз вен головного мозга; 65 % детей были мужского пола, в 29 (25 %) случаях тромбоз был диагностирован в первый день жизни [6]. Среди всех случаев тромбоза 70 % были связаны с материнскими/плацентарными факторами риска, при этом у 33 % пациентов была диагностирована наследственная тромбофилия. В 73 % случаев факторы риска были связаны с использованием катетеров и инфекционными осложнениями. Также по результатам исследования было установлено, что использование глюкокортикостероидов (ГКС) у недоношенных детей является дополнительным фактором риска. Несмотря на то что системные ГКС оказывают протромботическое действие, сужают сосуды и снижают клиренс активированных факторов свертывания крови, связь между развитием тромбоза и применением ГКС до настоящего времени не установлена.
Частота развития инсультов у доношенных и недоношенных новорожденных составляет 25 случаев на 100 тыс. населения в год, половина из которых ишемические [1]. По оценкам проведенных исследований, в Северной Америке частота развития неонатального ишемического инсульта (ИИ) составляет 2,5–2,7 случая на 100 тыс. детей в год, а во Франции – 3 случая на 100 тыс. детей в год. Среди самых распространенных причин летального исхода детей первого года жизни в США является ИИ [8]. Заболеваемость тромбозом церебральных венозных синусов составляет около 0,4 % на 1000 новорожденных.
Система гемостаза у новорожденных / Neonatal hemostasis system
Система гемостаза новорожденного ребенка отличается от гемостаза не только взрослого человека, но и детей более старшего возраста [7]. Факторы свертывания крови во внутриутробном периоде не проникают через плаценту, и их синтез начинается на 11-й неделе беременности. На 19–27-й неделе беременности значения многих факторов все еще остаются на низком уровне, за исключением значений фактора фон Виллебранда (англ. von Willebrand factor, vWF). На 28–31-й неделе беременности содержание vWF и фибриногена остается в норме, а другие показатели все еще снижены. Большинство компонентов системы
свертывания крови у новорожденных достигают взрослых значений к 6 мес жизни (табл. 1) [7][14][15].
Казалось бы, новорожденные должны быть больше склонны к кровотечениям из-за низкого уровня факторов свертывания, однако время кровотечения и образования тромба у них меньше, чем у взрослых [16–18]. Существует «гемостатический баланс» про- и антикоагулянтных факторов, благодаря которому у здорового новорожденного практически никогда не развивается ВТЭ (рис. 1) [15]. Выработка тромбина у новорожденных эквивалентна примерно 90 % от таковой у взрослых, что является достаточным условием для образования кровоостанавливающего сгустка, несмотря на возрастные различия [19].
Таблица 1. Сравнительная характеристика факторов свертывания крови и естественных антикоагулянтов у доношенных детей при рождении и через 6 мес.
Table 1. Comparative characteristics of blood coagulation factors and natural anticoagulants in full-term children at birth and 6 months later.
Параметры системы гемостаза Hemostasis parameters | При рождении At birth | Через 6 мес 6 months later |
Фибриноген Fibrinogen | Высокий High level | Высокий High level |
Фактор фон Виллебранда von Willebrand factor | ≈ 153 %* | ≈ 100 %* |
Антитромбин Antithrombin | 40–60 %* | Достигает уровня взрослых на 90-й день Reaches adult level at day 90 |
Протеин S Protein S | 40–60 %* | Достигает уровня взрослых на 90-й день Reaches adult level at day 90 |
Протеин С Protein С | Низкий Low level | Низкий Low level |
Факторы контактной системы: XI, XII, прекалликреин, высокомолекулярный кининоген Contact system factors: XI, XII, prekallikrein, high molecular weight kininogen | ≈ 40–50 %* | ≈ 80–90 %* |
Витамин К-зависимые факторы II, VII, IX, X Vitamin K-dependent factors II, VII, IX, X | ≈ 40–50 %* | ≈ 80–90 %* |
Факторы V и XIII Factors V and XIII | ≈ 70–80 %* | Достигает уровня взрослых на 5-й день Reaches adult level at day 5 |
Антигемофильный глобулин Antihemophilic globulin | ≈ 100 %* | Медленно снижается до 75 % Slowly decreases down to75 % |
α2-макроглобулин α2-macroglobulin | Высокий High level | Продолжает увеличиваться Continues to increase |
Примечание: *процент от референсного уровня взрослого.
Note: *percentage out of adult reference level.
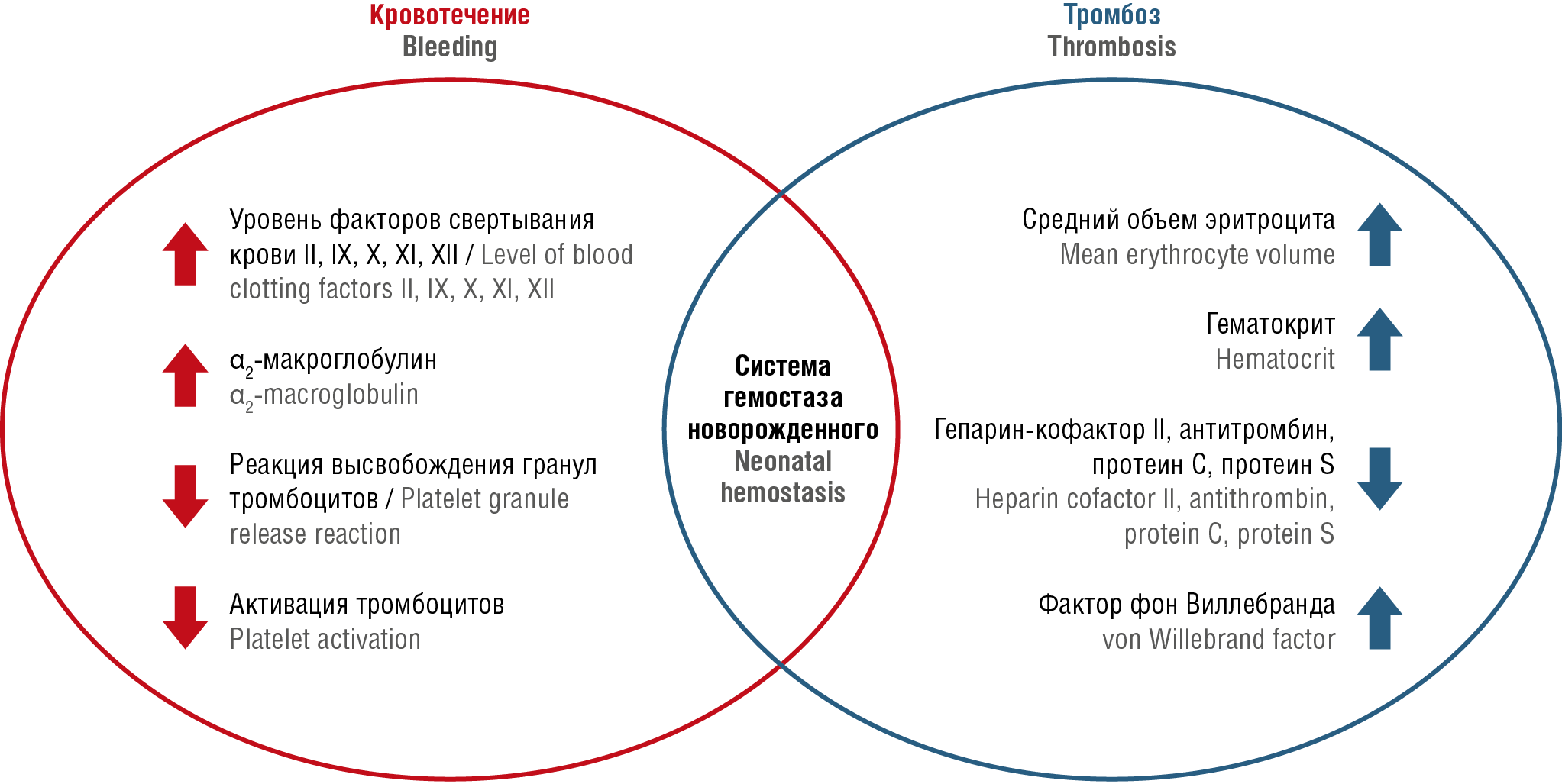
Рисунок 1. Гемостаз новорожденных [рисунок авторов].
Figure 1. Neonatal hemostasis [drawn by authors].
Результаты, полученные с помощью стандартных тестов на свертываемость, не подтверждают тот факт, что низкие уровни ингибиторов могли бы компенсировать низкие концентрации факторов свертывания и обеспечить достаточную выработку тромбина. Было установлено, что способность к выработке тромбина в плазме здорового новорожденного заметно снижена и происходит значительно медленнее, чем у взрослых. В плазме новорожденных может вырабатываться только 30–50 % максимальной активности тромбина по сравнению с взрослыми.
G. Cvirn с соавт. установили, что одновременный эффект низкой антикоагулянтной способности трех ингибиторов – активированного протеина С (англ. activated protein С, АРС), ингибитора пути тканевого фактора (англ. tissue factor pathway inhibitor, TFPI) и антитромбина сокращает время свертывания крови и способствует более быстрому образованию FХа и тромбина в пуповине, будучи активированным более низким уровнем тканевого фактора (англ. tissue factor, TF) по сравнению с содержанием этих компонентов в плазме взрослого человека; поэтому гемостаз у новорожденных выражен более значительно, чем у взрослых, несмотря на низкий уровень прокоагулянтных факторов [20][21].
У большинства здоровых новорожденных, грудничков и детей раннего возраста механизмы гомеостаза компенсаторно могут поддерживаться показателями про- и антикоагулянтных факторов, тем самым предотвращая серьезные кровотечения и тромботические осложнения. Однако неонатальный гемостаз обладает меньшей буферной способностью и может быть легко нарушен в результате тромбоза, возникшего на фоне имеющихся факторов риска, таких как сопутствующие заболевания, снижение фибринолитической способности, резистентности к гепарину из-за низкого уровня антитромбина, более высокого клиренса нефракционированного гепарина (НФГ) и повышенной чувствительности к антикоагулянтам. Увеличение частоты случаев неонатальных тромбозов может быть объяснено совершенствованием в лечении тяжелых неонатальных состояний, а также увеличением выживаемости недоношенных детей. Компенсаторные механизмы у недоношенных новорожденных развиты незначительно. У недоношенных детей еще больше различий в про- и антикоагулянтных факторах по сравнению с детьми, рожденными в срок, из-за более низких уровней факторов свертывания, но c течением времени они быстро приближаются к нормальным показателям.
В 1987 г. М. Andrew с соавт. опубликовали первые контрольные значения протромбина крови и времени активации тромбоцитов у здоровых доношенных детей [14]. В 1988 г. было проведено исследование на здоровых новорожденных, родившихся в срок от 30 до 36 нед [22]. В исследовании участвовали дети в возрасте 1, 5, 30 или 90 дней жизни. У недоношенных детей происходит постнатальное созревание факторов свертывания крови до уровня взрослого человека. К 6 мес жизни большинство компонентов системы свертывания крови у недоношенных детей достигает значений, близких к таковым у взрослых [22]. При преждевременных родах среднее значение протеина С составляет 38 %, уровень протеина S еще ниже (26–28 %) и не компенсируется α2-макроглобулином (110 %), несмотря на быстрое его повышение. Активность витамин К-зависимых факторов свертывания крови особенно снижена у недоношенных детей по сравнению с рожденными в срок. Большинство недоношенных детей более подвержены сепсису, а также у них наблюдается повышенное взаимодействие тромбоцитов с vWF. Продолжительность кровотечения у недоношенных новорожденных, родившихся после 37 нед беременности, примерно в 2 раза выше, чем у новорожденных, родившихся в более ранние сроки (р < 0,001) [16].
В ирландском перекрестном исследовании недоношенных детей в возрасте от 30 нед не было выявлено различий в потенциале эндогенного тромбина в плазме доношенных детей. Несмотря на увеличение времени свертывания, выработка тромбина была одинаковой у таких недоношенных и доношенных новорожденных [23]. Е. Neary с соавт. установили, что у недоношенных детей уровни FII, FVII, FIX и протеина S, а также антитромбина ниже, чем у доношенных детей [23].
Роль кофактора гепарина II (ГК II), так называемого «малого» антитромбина, в системе гемостаза у новорожденных все еще остается неизвестной. ГК II избирательно ингибирует тромбин и обладает умеренным сродством к связыванию с гепарином. Скорость ингибирования тромбина с помощью ГК II значительно ниже, чем с помощью антитромбина, и уровень ГК II в плазме крови на 25–50 % выше, чем антитромбина. Доношенные и недоношенные новорожденные имеют более низкий уровень ГК II, что, вероятнее всего, отражает незрелость функции печени; взрослого уровня данные значения достигают к 5–7 месяцам жизни. Ни у взрослых, ни у детей с тромбозом в анамнезе активность ГК II не была снижена. Учитывая, что отсутствие ГК II не сильно коррелирует с тромбозом, его физиологические функции все еще находятся на стадии изучения. Уровень растворимого тромбомодулина
в плазме крови, который отражает повреждение эндотелия, повышается у доношенных детей, перенесших асфиксию.
Тромбомодулин (англ. thrombomodulin, ТМ) является многодоменным гликопротеиновым рецептором тромбина и наиболее известен своей ролью кофактора в клинически важном естественном антикоагулянтном пути протеина С. ТМ связывает тромбин и превращает его из прокоагулянта в антикоагулянтный фермент, который активирует протеин С. ТМ экспрессируется на поверхности эндотелиальных клеток и присутствует в растворимой форме (англ. soluble thrombomodulin, sTM) в плазме и в моче. Потеря ТМ с поверхности эндотелиальных клеток может способствовать тромбообразованию. ТМ обладает не только антикоагулянтной активностью, но и оказывает противовоспалительное действие, используя АРС-зависимые и АРС-независимые механизмы. В дополнение к своей антикоагулянтной и противовоспалительной функции комплекс ТМ-тромбин запускает активируемый тромбином ингибитор фибринолиза (англ. thrombin-activated fibrinolysis inhibitor, TAFI), который ингибирует фибринолиз, вызванный тканевым активатором плазминогена (англ. tissue plasminogen activator, tPA). Было установлено, что воспаление снижает экспрессию ТМ на поверхности эндотелия, и это явление может способствовать гиперкоагуляции, которая характерна для тромбовоспаления. Концентрация ТМ в плазме крови и соотношение ТМ/креатинин в сыворотке крови при рождении были даже выше у детей с очень низкой массой тела при рождении, чем у доношенных детей [24].
Функция тромбоцитов у новорожденного / Neonatal platelet function
Функция и физиология тромбоцитов также зависят от возраста. Результаты исследования по формированию системы гемостаза у новорожденных показали, что количество тромбоцитов в период внутриутробного развития увеличивается на ~2×109/л за каждую неделю беременности. Даже у недоношенных детей среднее количество тромбоцитов составляло ≥ 200×109/л (в пределах нормы для взрослого человека) [25].
Исследование показало, что послеродовой период оказал значительное влияние на количество тромбоцитов. В течение первых 9 нед наблюдалось 2 пика уровня тромбоцитов: один на 2–3-й неделе, а второй – на 6–7-й неделе. Верхний предел ожидаемых значений (95-й процентиль) во время этих пиков достигал 750×109/л. Среднее количество тромбоцитов у детей примерно такое же, как и у взрослых. Нормальный диапазон количества тромбоцитов у новорожденных и грудничков составляет от 150×109/л до 450×109/л, хотя некоторые данные указывают на несколько более низкую норму, особенно у недоношенных детей [26]. У недоношенных новорожденных может быть более высокая частота тромбоцитопении и кровотечений, чаще развивающихся в головном мозге. Активация тромбоцитов in vitro показывает снижение активации и реакции на различные индукторы, например, коллаген, АДФ, тромбоксан А2 (TxA2), тромбин и адреналин. Реактивность тромбоцитов новорожденных повышается с увеличением срока беременности. У недоношенных новорожденных гипореактивность тромбоцитов возникает из-за снижения экспрессии гликопротеинов (англ. glycoproteins, GP) в мембране [27]. Тромбоциты, исследованные у младенцев на сроке беременности менее 30 нед, содержали более низкие уровни мембранных гликопротеинов, на их поверхности было меньше Р-селектина [28], и они были менее реактивными, чем тромбоциты доношенных новорожденных [29]. В том же иисследовании как у доношенных новорожденных, так и у недоношенных младенцев был обнаружен значительно более низкий уровень экспрессии гликопротеина GPIIb/IIIa в тромбоцитах периферической крови по сравнению с взрослыми. В настоящее время ясно, что тромбоциты выполняют не только гемостатические, но и важные негемостатические функции, участвуя в неоангиогенезе, иммунных реакциях и воспалении [30, 31]. Тромбоциты пуповинной крови доношенных и недоношенных новорожденных показали сниженную реакцию на большинство физиологических агонистов. Эта гипореактивность частично обусловлена как недостаточным синтезом, так и реакцией на важный медиатор функции тромбоцитов – TxA2. Сообщалось, что у новорожденных нарушен пострецепторный путь передачи сигнала через TxA2-рецептор, и этот дефект в передаче сигнала через фосфолипазу C-β (англ. phospholipase C-β, PLCβ) способствует наблюдаемому плохому ответу тромбоцитов новорожденных на TxA2 и, следовательно, к TxA2-зависимым агонистам, таким как коллаген. Этот пострецепторный дефект передачи сигнала в тромбоцитах пуповинной крови может объяснять различные нарушения функции тромбоцитов у новорожденных, включая плохую агрегацию и секрецию, снижение активности PLCβ, нарушение мобилизации кальция, снижение выработки TxA2 и снижение реакции на него [32]. Неонатальные тромбоциты также плохо реагируют на агонист рецептора, связанного с тирозинкиназой, поэтому снижена экспрессия гликопротеина GPVI и лектиноподобного рецептора 2 С-типа (англ. C-type lectin-like receptor-2, CLEC-2) [33].
Снижение функции тромбоцитов у новорожденных связано с различными факторами:
– гипореактивность сродства тромбоцитов к адреналину вызвана снижением количества α2-адренергических рецепторов на поверхности клетки;
– снижение реакции тромбоцитов на тромбин происходит из-за отсутствия активируемых протеазой рецепторов (англ. protease-activated receptors, PARs) PAR-1 и PAR-4 на неонатальных тромбоцитах [33];
– снижение передачи сигнала приводит к гипореактивности TxA2 у новорожденных;
– снижение активации тромбоцитов после введения коллагена связано с недостатком рецепторов GPVI в сочетании с дефектами внутриклеточных сигнальных путей. Доказательством может служить недостаточное фосфорилирование нерецепторной тирозинкиназы (англ. spleen tyrosine kinase, SYK) и CLEC-2 в неонатальных тромбоцитах [33].
Недавнее исследование показало, что тромбоциты новорожденных отличаются от тромбоцитов взрослых. Тромбоциты новорожденных имеют бóльшую чувствительность, несмотря на то, что подавляются простагландином Е1 (англ. prostaglandin E1, PGE1). В клетках крови также повышен уровень цАМФ, индуцируемый PGE1. Однако биологическая значимость этого механизма до сих пор не ясна, и проведенные тесты показывают повышенное функционирование оси PGE2-ADP-протеинкиназа II [35]. Альфа-гранулы тромбоцитов содержат факторы роста и белки, например, vWF, Р-селектин, факторы свертывания крови и др.
Клинические особенности неонатального тромбоза / Clinical features of neonatal thrombosis
Итальянский регистр является крупнейшим доступным источником сведений о неонатальных и педиатрических тромбозах и включает в себя описание 2668 случаев. В нем собраны данные о 1001 новорожденном и детях, страдающих церебральным или системным тромбозом, из 48 итальянских педиатрических отделений и ОИТ. Имеющиеся данные показали, что 57,8 % пациентов были мужского пола. Возраст первого тромботического события составил в среднем 0,9 года. У 24,8 % был выявлен неонатальный церебральный тромбоз, у 8,7 % – неонатальный системный тромбоз, у 41,5 % – детский церебральный тромбоз и у 25,1 % – детский системный тромбоз [36].
Перинатальный артериальный ишемический инсульт (ПАИИ) – это нарушение мозгового кровообращения, которое включает в себя группу артериальных ишемических повреждений, поражающие преимущественно доношенных и недоношенных детей в пренатальном, перинатальном и послеродовом периодах. Каждый тип ПАИИ имеет различные клинические проявления, факторы риска и отдаленные исходы. Клинические проявления ПАИИ характеризуются острой энцефалопатией, судорожными припадками и угнетением центральной нервной системы и приводят к значительной долговременной инвалидизации [37]. Истинная частота перинатального инсульта неизвестна, но сообщалось о различных случаях, частота которых варьировала от 0,025 % при рождении [38] до 17 % при вскрытии доношенных новорожденных [39]. Для подтверждения паренхиматозного кровоизлияния с окклюзией соответствующей артерии необходимо визуализирующее исследование головного мозга [40]. При возникновении инсульта чаще всего поражается левая средняя мозговая артерия, так как путь возможных кардиогенных эмболий короче в том случае, если они проходят через аорту и левую сонную артерию.
Исследования показывают, что в перинатальном инсульте задействованы многочисленные факторы риска, и патология плаценты может быть пусковым механизмом [41]. Определенные состояния матери и плода, включая тромботическую васкулопатию и антифосфолипидный синдром (АФС), могут привести к попаданию эмболов в кровоток плода через плацентарный кровоток. Помимо приобретенных факторов риска, полученные данные свидетельствуют о том, что генетические факторы риска развития протромботических осложнений – мутация фактора V Лейден и полиморфизм протромбина G20210A играют роль в развитии симптоматического неонатального инсульта. Повышенный уровень липопротеина (> 30 мг/дл) и дефицит протеина С также наблюдались у новорожденных с ПАИИ [42].
Тромбоз церебрального венозного синуса (ТЦВС) – редкое заболевание, приводящее к неврологическим последствиям у 40 % выживших, а также к летальному исходу, приближающимся к 10 % случаев [43]. Клинические проявления ТЦВС сходны с таковыми при ПАИИ [44]. Новорожденный может испытывать апноэ во сне или судороги (58 %), диффузные неврологические симптомы (76 %), очаговые неврологические симптомы (42 %) [43], впадать в кому (30 %), иметь головную боль (18 %) и двигательную слабость (21 %) [45]. Клинические симптомы могут быть неспецифическими, что может затруднить постановку диагноза и лечение.
Важными проявлениями ТЦВС являются отек и признаки повышения внутричерепного давления. Чаще всего в патологический процесс вовлекаются сосуды верхних сагиттальных и поперечных синусов. Наиболее точным методом диагностики является магнитно-резонансная томография (МРТ) с контрастированием, но также используется ультразвуковое исследование (УЗИ) [46]. Смертность при тромбозе венозных синусов оценивается в пределах от 2 до 24 %, а основными осложнениями являются детский церебральный паралич, эпилепсия и когнитивные нарушения [47]. Тяжелые случаи могут привести к потере функции конечностей [48].
Развитие неонатального внутрисердечного тромбоза в основном связано с установкой центрального венозного катетера (ЦВК), который необходим для лечения новорожденных в критическом состоянии. Этот тип тромбоза связан с развитием эндокардита, обструкцией легочной артерии, дисфункцией желудочков и высокой смертностью [49]. Внутрисердечный тромбоз часто возникает у детей после серьезных хирургических вмешательств, связанных с тяжелыми пороками сердца [50]. Исследование новорожденных, перенесших паллиативное лечение, показало, что в 23–33 % случаев после операции развивался внутрисердечный тромбоз [51]. Эхокардиография является наиболее распространенным методом диагностики с минимально инвазивной стратегией. Основными клиническими проявлениями у новорожденного являются появление аномальных шумов, стойкая тромбоцитопения и сердечная недостаточность.
Тромбоз почечных вен является наиболее распространенным осложнением, несвязанным с установкой катетера. Показатель распространенности составляет 0,5 на 1000 госпитализаций в ОИТ. Односторонний тромбоз почечных вен встречается в 70 % случаев, причем в 64 % случаев он локализуется с левой стороны; данная патология чаще встречается у мальчиков [52]. Основными клиническими проявлениями являются макрогематурия, пальпируемые образования в брюшной полости и тромбоцитопения. Другими симптомами могут быть олигурия, протеинурия, острое поражение почек и повышение артериального давления. Наиболее распространенными факторами риска являются недоношенность и асфиксия при рождении. Основным методом диагностики является ультразвуковая доплерография; на снимке можно увидеть эхогенный сгусток, расширение вен или отсутствие кровотока. Наиболее распространенными осложнениями тромбоза почечных вен являются кровоизлияние в надпочечники, тромбоз нижней полой вены и гипертония.
Наиболее распространенными факторами риска тромбоза воротной вены у недоношенных детей являются омфалит, сепсис и фототерапия. Постановка диагноза может быть сложной задачей из-за отсутствия клинических проявлений. У многих детей тромбоз воротной вены проходит самостоятельно. Портальная гипертензия может проявиться даже через 10 лет после рождения. Довольно серьезным осложнением тромбоза является кавернозная трансформация воротной вены со спленомегалией и обратным портальным кровотоком [53].
При остром тромбозе бедренной артерии обычно наблюдается изменение цвета конечности с бледного на синюшный. Отсутствие пульса на бедренной артерии является показанием к УЗИ, которое обычно выявляет тромб, обтурирующий кровоток в нижней конечности [54].
Молниеносная пурпура новорожденных – опасное для жизни заболевание, которое часто развивается через несколько часов после рождения. Это заболевание проявляется острым, быстро прогрессирующим тромбозом сосудов малого диаметра, расположенных преимущественно на коже конечностей. Пурпура характеризуется внезапным развитием внутрисосудистого тромбоза и геморрагического инфаркта кожи, что быстро приводит к диссеминированному внутрисосудистому свертыванию крови (ДВС-синдрому) с коагулопатией и симптомами шока. Впервые данное заболевание было описано в 1962 г. Только спустя несколько десятилетий была установлена связь между молниеносной пурпурой и дефицитом протеина S [55]. При отсутствии немедленной диагностики и терапевтического вмешательства наблюдается высокая смертность. Тяжесть клинических проявлений зависит от генетической вариабельности врожденного дефицита протеинов С и S. Кожные поражения сначала темно-красные, но со временем становятся фиолетово-черными и некротизируются. Пятна часто появляются в местах травм, например там, где вводится внутривенный катетер. Серьезный дефицит протеина С связан с отслоением сетчатки, кровоизлиянием в стекловидное тело и тромбозом сосудов головного мозга [56]. Об остром течении заболевания свидетельствуют следующие лабораторные показатели: тромбоцитопения, гипофибриногенемия, повышение продуктов распада фибрина, удлинение протромбинового времени и увеличение времени активации тромбоцитов в крови. Также может развиться микроангиопатическая гемолитическая анемия [57]. Молниеносная пурпура новорожденных, вызванная врожденным или приобретенным дефицитом протеина С или S, остается опасным для жизни состоянием, приводящим к летальному исходу. Раннее распознавание симптомов, ускоренная диагностика и немедленная заместительная терапия могут снизить риск возникновения смертности [58].
Факторы риска неонатального тромбоза / Risk factors for neonatal thrombosis
Новорожденные являются наиболее уязвимой группой пациентов по риску развития тромбоза, а тяжелобольные и недоношенные дети подвергаются наибольшему риску. Неонатальный тромбоз обычно является вторичным по отношению к основным состояниям или провоцирующим факторам, хотя каждый отдельный фактор риска не всегда может быть идентифицирован.
Факторы риска неонатального тромбоза связаны с классической триадой Вирхова, которая включает повреждение стенки сосуда, затруднение кровотока (стаз) и наличие состояния гиперкоагуляции. Развитие неонатального тромбоза может быть связано как с состоянием здоровья матери, так и с состоянием здоровья самого новорожденного. Состояния, связанные с использованием катетера, следует выделить в отдельную категорию факторов риска (рис. 2).
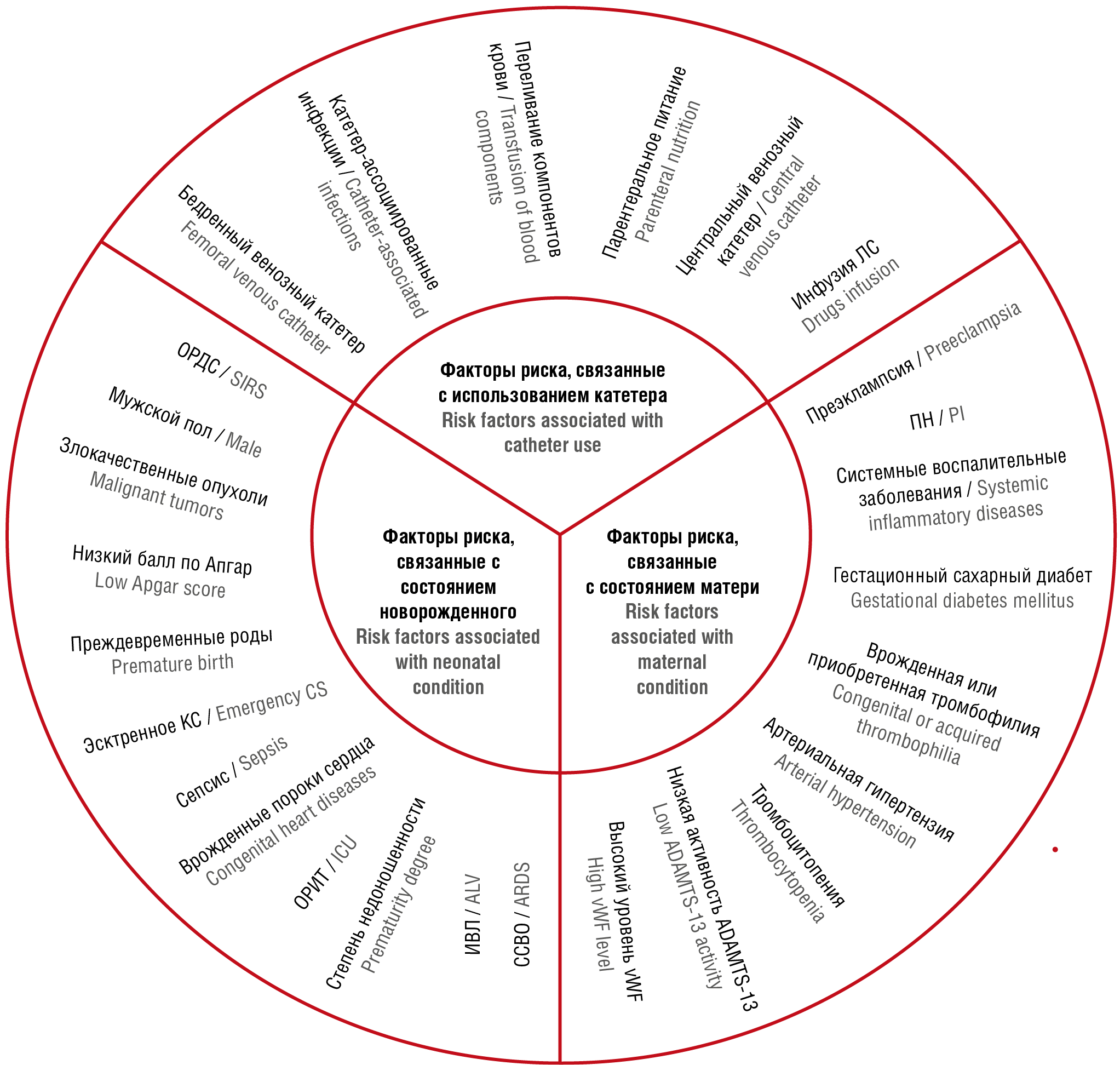
Рисунок 2. Классификация факторов риска развития неонатального тромбоза [рисунок авторов].
Примечание: ОРИТ – отделение реанимации и интенсивной терапии; ИВЛ – искусственная вентиляция легких; ССВО – синдром системного воспалительного ответа; vWF – фактор фон Виллебранда; ПН – плацентарная недостаточность; ЛС – лекарственные средства; КС – кесарево сечение; ОРДС – острый респираторный дистресс-синдром.
Figure 2. Classification of risk factors for neonatal thrombosis [drawn by authors].
Note: ICU – intensive care unit; ALV – artificial lung ventilation; SIRS – systemic inflammatory response syndrome; vWF – von Willebrand factor; PI – placental insufficiency; ЛС – drugs; CS – caesarean section; ARDS – acute respiratory distress syndrome.
Факторы риска, связанные с использованием катетера / Risk factors associated with catheter use
Наличие ЦВК является одной из наиболее частых причин тромбоза. Около 60 % случаев тромботических осложнений происходят в течение первого года жизни [59]. Венозный катетер способствует образованию тромбов за счет увеличения всасывания белка, адгезии тромбоцитов и лейкоцитов, а также увеличения выработки тромбина. Другой причиной тромбоза у детей является катетер-ассоциированная инфекция, которая возникает из-за миграции бактерий с кожи по катетеру. Исследования продемонстрировали четкую связь между тромбозом и инфекцией у новорожденных [60].
Периферические катетеры необходимы младенцам в ОИТ новорожденных для введения лекарств, парентерального питания и переливания крови, что также является дополнительным фактором риска. Около половины всех случаев тромботических осложнений у новорожденных происходят в артериальном русле. Ятрогенные осложнения, связанные с использованием катетеров артерии пуповины, периферических артерий или бедренной артерии, являются основной причиной образования тромбов.
Большинство исследований посвящено катетерам пупочной вены и центральным катетерам, данные о применении бедренных венозных катетеров ограничены [61]. Введение катетера через бедренную вену у мальчиков является дополнительным фактором риска развития неонатального тромбоза. Исследования, сравнивающие частоту неонатальных тромбозов вследствие установки ЦВК (отношение шансов (ОШ) = 8,2; 95 % доверительный интервал (ДИ) = 1,6–41,7) и бедренного венозного катетера, показывают, что установка и использование бедренного венозного катетера повышает риск неонатального тромбоза [62].
Факторы риска, связанные с состоянием новорожденного / Risk factors associated with neonatal condition
Тромботические осложнения возникают при снижении компенсаторных механизмов системы свертывания крови у новорожденных.
Исследования показывают, что ВТЭ, связанная с оказанием медицинской помощи, может возникнуть из-за искусственной вентиляции легких (ОШ = 7,27; 95 % ДИ = 2,02–26,17), перенесенных инфекций (ОШ = 7,24; 95 % ДИ = 2,66–19,72) и обширных хирургических вмешательств (ОШ = 5,60; 95 % ДИ = 1,82–17,22) [63].
К другим факторам риска относятся срок беременности, продолжительность пребывания в ОИТ и врожденные пороки сердца. Различные инфекционные осложнения, такие как системные воспалительные заболевания и сепсис, также могут быть факторами риска развития неонатального тромбоза. Риск тромбоза у новорожденных, родившихся после 37 нед беременности, значительно ниже, чем у недоношенных детей. Некоторые авторы считают, что выбор способа родоразрешения, в частности экстренное кесарево сечение, может иметь важное значение в развитии неонатального тромбоза. Факторы риска развития ВТЭ также включают преждевременные роды (ОШ = 5,5; 95 % ДИ = 1,8–16,9) и низкий балл по шкале Апгар (ОШ = 9,2; 95 % ДИ = 1,9–45,2) [64]. Мужской пол (OШ = 2,12) является дополнительным фактором риска неонатального тромбоза.
Ретроспективное исследование с многофакторным анализом показало, что респираторный дистресс-синдром является важной предпосылкой к развитию нео-
натального тромбоза [65]. Тромботическая тромбоцитопеническая пурпура (ТТП), вызванная врожденной мутацией гена ADAMTS-13 (англ. a disintegrin and metalloproteinase with thrombospondin type 1 motif, member 13), также может провоцировать развитие мик-
рососудистого тромбоза [66]. Дефицит ADAMTS-13 в плазме крови повышает уровень мультимеров vWF. Дисфункция оси vWF/ADAMTS-13 рассматривается как фактор риска развития инсульта у детей и вторичной тромботической микроангиопатии [66].
Большинство исследований показывают, что у новорожденных активность ADAMTS-13 ниже, а уровень vWF выше, чем у взрослых. Однако, как и при циркулирующих антифосфолипидных антителах (АФА), снижение уровня ADAMTS-13 и повышение уровня vWF у новорожденных не вызывает тромботических осложнений.
Тромбоз может возникнуть в сочетании с дополнительными факторами риска, такими как гипоксия, сепсис и другие острые состояния, а также при длительном использовании ЦВК.
Факторы риска неонатального тромбоза, связанные с состоянием матери / Risk factors associated with maternal condition
Основным фактором риска неонатального тромбоза, связанным с состоянием матери, являются акушерские осложнения в анамнезе, такие как преэклампсия, плацентарная недостаточность и системные воспалительные заболевания. При развитии преэклампсии происходит снижение плацентарного кровотока из-за патологии, развивающейся в плаценте, и сосудистых нарушений плацентарного ложа. Нарушения здоровья матери могут быть связаны с гиперкоагуляцией, которая активирует каскад свертывания крови у новорожденного [67]. Например, при гестационном сахарном диабете происходит повреждение сосудистой стенки, развивается эндотелиопатия, что увеличивает риск неонатального тромбоза [68].
Исследования показывают, что к факторам риска у матери относится наличие артериальной гипертензии (ДИ = 1,05–1,91) и тромбоцитопении (ДИ = 1,59–3,06). Неонатальный тромбоз также связан с наследственной или приобретенной материнской или неонатальной тромбофилией. Наличие материнской тромбофилии повышает потенциал свертывания крови и вызывает предтромботические состояния во время беременности. Этот механизм приводит к фетально-
плацентарному тромбозу. Частота тромботических осложнений наиболее высока в группе детей, родившихся на сроке 22–27 нед беременности [7].
Врожденная и приобретенная тромбофилия как фактор риска развития тромбозов / Congenital or acquired thrombophilia as a risk factor for developing thrombosis
Роль генетической и приобретенной тромбофилии в патогенезе неонатальных тромбозов является предметом активных дискуссий и изучения, некоторые авторы сообщали об обнаружении АФА у новорожденных [69][70]. Также наличие тромбофилии у матери тоже может играть роль в патогенезе тромбозов у новорожденных [70]. Однако же циркуляция АФА, как и детский АФС, встречаются очень редко; всего в нескольких исследованиях сообщалось о педиатрическом АФС [71–74].
В исследовании Y. Berkun с соавт., посвященному изучению роли АФА в развитии церебральных тромбозов у новорожденных, из 12 обследованных был выявлен повышенный уровень антител к β2-гликопротеину IgG у 6 детей, IgM – у 1, антикардиолипиновый IgG – у 5, IgM – у 3, волчаночный антикоагулянт – у 6, двойной позитивный тест был у 6 детей, сочетанная форма тромбофилии была обнаружена у 3 обследованных: гомозиготный MTHFR и гетерозиготная мутация FV Лейден [75].
Что касается роли материнского АФС, было проведено исследование, включавшее 16 детей с перинатальным тромбозом, рожденных от матерей с АФС; большинство тромботических событий были артериальными (13 из 16), среди них преобладали инсульты (8 из 16), однако циркуляция АФА была выявлена только у 2 новорожденных [76].
Сложностью диагностики АФС у новорожденных являются еще и пересмотренные критерии АФС, которые включают сочетание клинических (тромбоз или привычное невынашивание беременности) и лабораторных (стойкая циркуляция АФА) проявлений [77]. Эти критерии могут быть неприменимы для младенцев по нескольким причинам: у них не может быть типичных для АФС провоцирующих факторов, таких как беременность или прием гормональной контрацепции или заместительная гормональная терапия; естественно, у них не может быть истории потери беременности. Кроме того, сама по себе циркуляция АФА, вероятно, не приводит к развитию тромбозов, однако же в сочетании с обозначенными выше факторами риска вероятность развития тромботических осложнений может значительно повышаться. Степень незрелости новорожденного, установка катетера, обезвоживание, синдром системного воспалительного ответа (ССВО) и сочетанная генетическая тромбофилия могут действовать как механизм «второго удара» в сочетании с циркуляцией АФА.
Имеется несколько сообщений о случаях неонатального тромбоза, связанного с трансплацентарным переносом антител типа IgG; это предположение сделано на основании обнаружения конкордантности антител, выявленных в парах мать–ребенок [76]. Однако в нескольких случаях были обнаружены разные типы антител у матерей и новорожденных, так что, вероятнее всего, материнские антитела не являются основным патогенным фактором неонатального АФС [69].
Что касается генетической тромбофилии, то она является общепризнанным фактором риска ВТЭ у взрослых; также описано, что она увеличивает риск тромботических осложнений у детей и новорожденных, что было подтверждено в метаанализе [78]. Кроме того, данные последующего наблюдения за рецидивом ВТЭ у детей позволяют предположить, что частота рецидивов составляет от 3 % (новорожденные) до 21 % (идиопатическая ВТЭ), которая может увеличиваться при наличии генетической тромбофилии [79][80].
COVID-19, тромбовоспаление и неонатальный тромбоз / COVID-19, thromboinflammation and neonatal thrombosis
Отдельно следует обсудить значение такого фактора риска, как коронавирусная инфекция. Пациенты с инфекцией COVID-19 страдают от непропорционально высокой активности комплемента, а также избыточной коагуляции, что приводит к тромботическим осложнениям и неблагоприятному исходу заболевания [81]. В настоящее время мало что известно о влиянии COVID-19 на плаценту и новорожденного [82]. COVID-19 ассоциируется с мультисистемным воспалительным синдромом у детей, чаще всего на поздних стадиях заболевания, когда возбудитель уже не обнаруживается с помощью метода полимеразной цепной реакции. Клинические проявления варьируют, но часто проявляются симптомами, подобными симптомам Кавасаки, такими как лихорадка, конъюнктивит, полиморфная макулопапулезная сыпь, частые желудочно-кишечные симптомы, повышенные уровни С-реактивного белка, печеночных трансаминаз, прокальцитонина, лактатдегидрогеназы, креатинфосфокиназы, интерлейкинов (англ. interleukin, IL) IL-6 и IL-10 [83].
Новорожденные с инфекцией COVID-19 имеют широкий спектр клинических проявлений – от бессимптомного носительства до критического состояния и фатального исхода. COVID-19 ассоциирован с коагулопатией и тромбоэмболией у взрослых и детей, что приводит к преждевременным родам, задержке роста плода, выкидышу и нарушению перфузии плаценты [84]. Неонатальная инфекция COVID-19 может передаваться от матери новорожденному в послеродовом периоде. У детей нарушения гемостаза, связанные с COVID-19, приводят к удлинению протромбинового времени и времени активации тромбоцитов в крови, а также повышению значений D-димера и фибриногена. Следует отметить, что уровень D-димера, измеренный у новорожденных, оказывается выше, чем у взрослых. Поэтому повышенную концентрацию D-димера у новорожденных, инфицированных COVID-19, следует интерпретировать с осторожностью. Связанные с COVID-19 провоспалительные цитокины индуцируют повреждение эндотелия, что приводит к активации первичного гемостаза и избыточной экспрессии TF [85]. Повышенная прокоагулянтная активность тромбоцитов сочетается с ингибированием активности плазмина за счет снижения уровня активатора плазминогена урокиназного типа (англ. urokinase plasminogen activator, uPA) и повышения уровня ингибитора активатора плазминогена-1 (англ. plasminogen activator inhibitor-1, PAI-1). Также может наблюдаться легкая тромбоцитопения или тромбоцитоз. У пациентов с COVID-19 значительно повышена концентрация D-димера, что является следствием активации эндотелия. Активация вызвана инфекционной стимуляцией, тяжелой гипоксемией и местным легочным микротромбозом.
В условиях развития воспаления, не только на фоне коронавирусной инфекции, но и при других септических состояниях развивается феномен тромбовоспаления, при котором происходит локальная гиперактивация иммунных клеток и их включение в состав тромба. Как само воспаление, так и тромбоз могут быть стимулированы множественными факторами, включая повреждение сосуда, замедление кровотока или состояние гиперкоагуляции. В случае новорожденных тромбовоспаление чаще всего ассоциируется с использованием ЦВК, внутриутробной инфекций, системными воспалительными заболеваниями у матери, АФС и COVID-19.
Тромбовоспаление фактически является синхронным взаимодействием тромботического и воспалительного процессов, т. е. реализуется концепция «двойного удара», при котором происходит мультипликация провоспалительных и прокоагулянтных факторов, направленных на нарушение функций системы гемостаза. Воспаление может стимулировать тромбоз посредством активации и повреждения эндотелия, агрегации тромбоцитов и непосредственной стимуляции экспрессии факторов свертывания. Повреждение эндотелия сосудов является первым шагом к тромбозу, вызывая адгезию и активацию тромбоцитов. Как внутренние, так и внешние факторы воздействия, включая использование ЦВК, могут индуцировать тромбовоспаление.
Таким образом, тромбовоспаление играет одну из важных ролей в развитии тромботических осложнений у новорожденных, связывая систему гемостаза и воспалительные процессы в одну патологическую цепь событий. Активное выявление факторов риска и раннее лечение уже развившихся воспалительных состояний, а также рациональное использование ЦВК могут способствовать снижению риска тромбоза у новорожденных.
В многоцентровом ретроспективном когортном исследовании сообщалось о случаях ВТЭ у 2,1 % пациентов с COVID-19 и у 6,5 % пациентов с мультисистемным воспалительным синдромом [86]. Тромботические осложнения включают в себя ТГВ, тромбоз легочных вен и церебрального венозного синуса.
Тромбоз вен головного мозга (ТВГМ) – редкое, но опасное осложнение COVID-19, которое встречается как у взрослых, так и у детей. ТВГМ возникает у недоношенных детей, мать которых заразилась коронавирусной инфекцией в III триместре беременности. Тяжелый неонатальный тромбоз в этих клинических случаях развивается в результате материнской инфекции COVID-19, которая влияет на протромботический статус новорожденного [87]. Несколько клинических исследований демонстрируют мальперфузию сосудов плода или тромботическую васкулопатию плода у женщин, инфицированных COVID-19, в 10 из 20 случаев [88]. Материнская инфекция COVID-19 также может вызывать патологии плода, включая преждевременные роды по медицинским показаниям, задержку роста и выкидыш [89].
Ранняя диагностика неонатального тромбоза центральных вен затруднена из-за редкости заболеваний и вариабельности клинических проявлений. При инфицировании матери COVID-19 в I триместре рекомендуется дополнительное УЗИ в середине триместра. Если инфекция возникла во II или III триместре беременности, рекомендуется провести дополнительную оценку фетометрических параметров в III триместре. Коронавирусная инфекция не является показанием к досрочному родоразрешению или кесареву сечению, и сроки родов должны определяться тяжестью заболевания, сопутствующими заболеваниями матери, сроком беременности и состоянием системы «мать–плод» [90]. Высокий уровень заболеваемости COVID-ассоциированными тромбозами требует соответствующей тромбопрофилактики у новорожденных. Рекомендуется антикоагулянтная терапия низкомолекулярным гепарином (НМГ) или НФГ, особенно у детей и новорожденных с факторами риска. Также COVID-19 связан с высокой частотой преждевременных родов и преэклампсии по сравнению с беременностями без COVID-19, что увеличивает риск преждевременных родов и обуславливает худшее состояние новорожденных по шкале Апгар.
Нарушения системы гемостаза, вызванные коронавирусной инфекцией у матери, могут увеличить риск развития венозного тромбоза у новорожденных, что требует серьезного клинического обследования и ранней диагностики. Необходимы дальнейшие исследования для выяснения патофизиологических механизмов COVID-19 во время беременности и влияния COVID-19 на развитие плода.
Принципы лечения неонатальных тромбозов / Principles of treatment of neonatal thrombosis
Так как в системе гемостаза новорожденных и взрослых имеются различия, то и подходы к лечению неонатальных тромбозов также будут неодинаковы. При назначении лечения важное значение имеет расчет дозы каждого лекарственного препарата в зависимости от массы тела и возраста. Среди многочисленных препаратов, используемых в качестве антикоагулянтов в акушерской и педиатрической практике, наиболее известны варфарин, НФГ и НМГ. По сравнению с варфарином и НФГ, НМГ в меньшей степени подвергается неспецифическому связыванию с белками плазмы и обладает повышенной биодоступностью. Преимуществом применения НМГ является снижение связывания с тромбоцитарным фактором 4 (англ. platelet factor 4, PF4) и остеобластами. Этот механизм снижает риск развития гепарин-индуцированной тромбоцитопении и остеопении.
В настоящее время для лечения неонатального тромбоза используют гепарин (особенно НМГ), тромболитики и в критических случаях тромбэктомию [91]. Лечение катетер-ассоциированного неонатального тромбоза включает антикоагулянты, НМГ, тромболитики и симптоматическую терапию [92]. НМГ является наиболее часто используемым антикоагулянтом у новорожденных. Согласно недавнему систематическому обзору, риск рецидива неонатального тромбоза после терапии НМГ составляет приблизительно 3 %. Применение НФГ возможно только при достаточном уровне антитромбина. Терапию начинают с внутривенного болюсного введения 50–100 Ед/кг, затем дозу увеличивают до 400–500 Ед/кг.
При выборе дозы препарата для лечения неонатального тромбоза рекомендуется придерживаться терапевтического диапазона. В некоторых исследованиях рекомендуемый целевой уровень анти-Ха фактора составляет 0,35–0,7 МЕ/мл, в других – 0,5–1,0 МЕ/мл. Для новорожденных, получающих ежедневную терапию НМГ, рекомендуется увеличить дозу препарата до целевого диапазона от 0,5 до 1,0 МЕ/мл. Новорожденным с острым тромбозом часто вводят свежезамороженную плазму, чтобы предотвратить развитие ДВС-синдрома [93]. Ограниченное применение варфарина в педиатрии связано с его узким терапевтическим диапазоном и повышенным риском массивных кровотечений [94]. Кроме того, варфарин имеет множество побочных эффектов и может взаимодействовать с другими лекарственными препаратами, что, безусловно, усложняет его терапевтическое применение. Применение новых пероральных антикоагулянтов у детей все еще находится на стадии обсуждения [95].
Важно учитывать, что фармакокинетика и фармакодинамика препаратов тесно связаны с возрастом, стабильностью клинического состояния и другими факторами. Детям не следует назначать пероральные антикоагулянты прямого действия, поскольку до сих пор отсутствует информация о соответствующих дозировках, безопасности и эффективности. Однако исследования этих препаратов имеют большой потенциал на будущее.
Профилактика неонатальных тромбозов / Prevention of neonatal thrombosis
Профилактика неонатальных тромбозов у новорожденных в первую очередь направлена на предотвращение и устранение факторов риска. Необходимо диагностировать различные генетические нарушения системы гемостаза, например, АФС и генетическую тромбофилию у обоих родителей. Для предотвращения плацентарной недостаточности рекомендуется правильная тактика ведения беременности. Точная диагностика и лечение сопутствующих заболеваний у матери помогают предотвратить неонатальный тромбоз. Профилактика неонатального тромбоза, связанного с использованием катетеров, с помощью антикоагулянтных препаратов не имеет доказательной базы [59]. Периоперационная антитромботическая профилактика у взрослых является достаточно распространенной, но клинических исследований, оценивающих эффективность и безопасность антитромботической терапии у детей, не проводилось. Общепринятых протоколов периоперационной профилактики также не существует [96]. Профилактика нео-
натального тромбоза путем своевременного и надлежащего предотвращения факторов риска улучшит возможности лечения новорожденных детей.
Заключение / Conclusion
Неонатальные тромбозы являются чрезвычайно опасным заболеванием для новорожденных. Патогенез неонатального тромбоза включает много факторов как со стороны матери и плода, так и может быть ятрогенным катетер-ассоциированным, и нарушения свертываемости крови у новорожденных являются серьезной и актуальной проблемой. Система гемостаза отличается от таковой у взрослых, поэтому врачу необходимо понимать патогенез заболевания у детей. Клинические проявления неонатального тромбоза очень разнообразны и варьируют от отсутствия каких-либо симптомов до появления опасных для жизни состояний. Развитие тромбоза у новорожденного обусловлено сочетанием различных факторов риска как у ребенка, так и у матери. Пандемия COVID-19 также внесла коррективы в патогенез и клинические проявления неонатального тромбоза. Коронавирусная инфекция является фактором риска развития коагулопатии и тромбоэмболии и приводит к развитию тромбовоспаления как серьезного патогенетического звена тромботических осложнений.
Тромбофилия, будь то генетическая или приобретенная, увеличивает риск тромбоза у новорожденных. Генетическая тромбофилия может увеличивать риск тромбоза у новорожденных, особенно если у ребенка присутствуют другие факторы риска. Приобретенная тромбофилия также является серьезным фактором риска тромбозов, особенно при циркуляции АФА к разным фосфолипидам или сочетанной тромбофилии. Важно отметить, что ведение новорожденных с тромбофилией требует индивидуального подхода. Это может включать в себя мониторинг состояния системы гемостаза, использование антикоагулянтов при необходимости и применение стратегий для снижения риска развития тромбовоспаления.
Диагностика и лечение неонатального тромбоза должны быть стандартизированы с учетом результатов более перспективных клинических исследований. В большинстве случаев всем новорожденным с патологиями показано обследование на наличие нарушений свертываемости крови. Важно отметить, что стандартная процедура взятия капиллярной крови позволяет получить лишь небольшое количество крови для лабораторной диагностики и не может применяться для специальных исследований, например, для исследования функции гемостаза. При этом отбор крови из артерий и вен у новорожденных не всегда возможен; также существуют и дополнительные риски, связанные с использованием постоянных катетеров, такие как инфекция и тромбоз, что строго ограничивает срок их использования. Также увеличивается потребность в проведении анализов у постели больного для более простой и быстрой диагностики нарушений свертываемости крови.
В настоящее время не разработано однозначных и эффективных стратегий профилактики неонатального тромбоза, поэтому рекомендуется правильное и комплексное ведение беременности и снижение факторов риска. Антикоагулянтные препараты имеют много побочных эффектов, но их применение необходимо для эффективного лечения. Тщательный выбор терапии зависит от фармакодинамики и патофизиологии неонатальных тромбозов. Возможно, снижение количества тромбозов связано с улучшением качества диагностики и усилением наблюдения пациенток во время всего периода беременности. В будущих исследованиях необходимо обратить внимание на долгосрочные наблюдения за детьми для выявления отдаленных последствий неонатального тромбоза.
Список литературы
1. Haley K.M. Neonatal venous thromboembolism. Front Pediatr. 2017;5:136. https://doi.org/10.3389/fped.2017.00136.
2. Bhat R., Kumar R., Kwon S. et al. Risk factors for neonatal venous and arterial thromboembolism in the neonatal intensive care unit – a case control study. J Pediatr. 2018;195:28–32. https://doi.org/10.1016/j.jpeds.2017.12.015.
3. van Ommen C.H., Heijboer H., Büller H.R. et al. Venous thromboembolism in childhood: a prospective two-year registry in the Netherlands. J Pediatr. 2001;139(5):676–81. https://doi.org/10.1067/mpd.2001.118192.
4. Chalmers E.A. Neonatal thrombosis. J Clin Pathol. 2000;53(6):419–23. https://doi.org/10.1136/jcp.53.6.419.
5. Robinson V., Achey M.A., Nag U.P. et al. Thrombosis in infants in the neonatal intensive care unit: analysis of a large national database. J Thromb Haemost. 2021;19(2):400–7. https://doi.org/10.1111/jth.15144.
6. Saracco P., Bagna R., Gentilomo C. et al.; Neonatal Working Group of Registro Italiano Trombosi Infantili (RITI). Clinical data of neonatal systemic thrombosis. J Pediatr. 2016;171:60–66.e1. https://doi.org/10.1016/j.jpeds.2015.12.035.
7. Levy-Mendelovich S., Cohen O., Klang E., Kenet G. 50 years of pediatric hemostasis: knowledge, diagnosis, and treatment. Semin Thromb Hemost. 2023;49(3):217–24. https://doi.org/10.1055/s-0042-1756704.
8. Makatsariya A., Bitsadze V., Khizroeva J. et al. Neonatal thrombosis. J Matern Fetal Neonatal Med. 2022;35(6):1169–77. https://doi.org/10.1080/14767058.2020.1743668.
9. Song S., Li Z., Zhao G. et al. Epidemiology and risk factors for thrombosis in children and newborns: systematic evaluation and meta-analysis. BMC Pediatr. 2023;23(1):292. https://doi.org/10.1186/s12887-023-04122-x.
10. Andrew M., David M., Adams M. et al. Venous thromboembolic complications (VTE) in children: first analyses of the Canadian Registry of VTE. Blood. 1994;83:1251–7.
11. Schmidt B., Andrew M. Neonatal thrombosis: report of a prospective Canadian and international registry. Pediatrics. 1995;96(5 Pt 1):939–43.
12. Nowak-Göttl U., von Kries R., Göbel U. Neonatal symptomatic thromboembolism in Germany: two-year survey. Arch Dis Child Fetal Neonatal Ed. 1997;76(3):F163–7. https://doi.org/10.1136/fn.76.3.f163.
13. Tuckuviene R., Christensen A.L., Helgestad J. et al. Pediatric venous and arterial noncerebral thromboembolism in Denmark: a nationwide population-based study. J Pediatr. 2011;159(4):663–9. https://doi.org/10.1016/j.jpeds.2011.03.052.
14. Andrew M., Paes B., Milner R. et al. Development of the human coagulation system in the full-term infant. Blood. 1987;70(1):165–72.
15. Achey M.A., Nag U.P., Robinson V.L. et al. The developing balance of thrombosis and hemorrhage in pediatric surgery: clinical implications of age-related changes in hemostasis. Clin Appl Thromb Hemost. 2020;26;1076029620929092. https://doi.org/10.1177/1076029620929092.
16. Del Vecchio A., Latini G., Henry E., Christensen R.D. Template bleeding times of 240 neonates born at 24 to 41 weeks gestation. J Perinatol. 2008;28(6):427–31. https://doi.org/10.1038/jp.2008.10.
17. Andrew M., Paes B., Bowker J., Vegh P. Evaluation of an automated bleeding time device in the newborn. Am J Hematol. 1990;35(4):275–7. https://doi.org/10.1002/ajh.2830350411.
18. Boudewijns M., Raes M., Peeters V. et al. Evaluation of platelet function on cord blood in 80 healthy term neonates using the Platelet Function Analyser (PFA-100); shorter in vitro bleeding times in neonates than adults. Eur J Pediatr. 2003;162(3):212–3. https://doi.org/10.1007/s00431-002-1093-7.
19. Andrew M., Vegh P., Johnston M. et al. Maturation of the hemostatic system during childhood. Blood. 1992;80(8):1998–2005.
20. Cvirn G., Gallistl S., Leschnik B., Muntean W. Low tissue factor pathway inhibitor (TFPI) together with low antithrombin allows sufficient thrombin generation in neonates. J Thromb Haemost. 2003;1(2):263–8. https://doi.org/10.1046/j.1538-7836.2003.00081.x.
21. Cvirn G., Gallistl S., Rehak T. et al. Elevated thrombin-forming capacity of tissue factor-activated cord compared with adult plasma. J Thromb Haemost. 2003;1(8):1785–90. https://doi.org/10.1046/j.1538-7836.2003.00320.x.
22. Andrew M., Paes B., Milner R. et al. Development of the human coagulation system in the healthy premature infant. Blood. 1988;72(5):1651–7.
23. Neary E., McCallion N., Kevane B. et al. Coagulation indices in very preterm infants from cord blood and postnatal samples. J Thromb Haemost. 2015;13(11):2021–30. https://doi.org/10.1111/jth.13130.
24. Nako Y., Ohki Y., Harigaya A. et al. Plasma thrombomodulin level in very low birthweight infants at birth. Acta Paediatr. 1997;86(10):1105–9. https://doi.org/10.1111/j.1651-2227.1997.tb14817.x.
25. Wiedmeier S.E., Henry E., Sola-Visner M.C., Christensen R.D. Platelet reference ranges for neonates, defined using data from over 47,000 patients in a multihospital healthcare system. J Perinatol. 2009;29(2):130–6. https://doi.org/10.1038/jp.2008.141.
26. Sillers L., Van Slambrouck C., Lapping-Carr G. Neonatal thrombocytopenia: etiology and diagnosis. Pediatr Ann. 2015;44(7):e175– 80. https://doi.org/10.3928/00904481-20150710-11.
27. Bednarek F.J., Bean S., Barnard M.R. et al. The platelet hyporeactivity of extremely low birth weight neonates is age-dependent. Thromb Res. 2009;124(1):42–5. https://doi.org/10.1016/j.thromres.2008.10.004.
28. Waller A.K., Lantos L., Sammut A. et al. Flow cytometry for near-patient testing in premature neonates reveals variation in platelet function: a novel approach to guide platelet transfusion. Pediatr Res. 2019;85():874–84. https://doi.org/10.1038/s41390-019-0316-9.
29. Sitaru A.G., Holzhauer S., Speer C.P. et al. Neonatal platelets from cord blood and peripheral blood. Platelets. 2005;16(3–4):203–10. https://doi.org/10.1080/09537100400016862.
30. Andres O., Schulze H., Speer C.P. Platelets in neonates: Central mediators in haemostasis, antimicrobial defence and inflammation. Thromb Haemost. 2015;113(1):3–12. https://doi.org/10.1160/TH14-05-0476.
31. Davenport P., Sola-Visner M. Platelets in the neonate: not just a small adult. Res Pract Thromb Haemost. 2022;6(3):e12719. https://doi.org/10.1002/rth2.12719.
32. Israels S.J., Cheang T., Roberston C. et al. Impaired signal transduction in neonatal platelets. Pediatr Res. 1999;45(5 Pt 1):687–91. https://doi.org/10.1203/00006450-199905010-00014.
33. Hardy A.T., Palma-Barqueros V., Watson S.K. et al. Significant hyporesponsiveness to GPVI and CLEC-2 agonists in pre-term and full-term neonatal platelets and following immune thrombocytopenia. Thromb Haemost. 2018;118(6):1009–20. https://doi.org/10.1055/s-0038-1646924.
34. Schlagenhauf A., Schweintzger S., Birner-Grünberger R. et al. Comparative evaluation of PAR1, GPIb-IX-V, and integrin αIIbβ3 levels in cord and adult platelets. Hamostaseologie. 2010;30 Suppl 1:S164–7.
35. Palma-Barqueros V., Torregrosa J.M., Caparrós-Pérez E. et al. Developmental differences in platelet inhibition response to prostaglandin E1. Neonatology. 2020;117(1):15–23. https://doi.org/10.1159/000504173.
36. Pelizza M.F., Martinato M., Rosati A. et al. The new Italian registry of infantile thrombosis (RITI): a reflection on its journey, challenges and pitfalls. Front Pediatr. 2023;11:1094246. https://doi.org/10.3389/fped.2023.1094246.
37. Martinez-Biarge M., Ferriero D.M., Cowan F.M. Perinatal arterial ischemic stroke. Handb Clin Neurol. 2019;162:239–66. https://doi.org/10.1016/B978-0-444-64029-1.00011-4.
38. Lynch J.K., Hirtz D.G., DeVeber G., Nelson K.B. Report of the National Institute of Neurological Disorders and Stroke workshop on perinatal and childhood stroke. Pediatrics. 2002;109(1):116–23. https://doi.org/10.1542/peds.109.1.116.
39. Hunt R.W., Inder T.E. Perinatal and neonatal ischaemic stroke: a review. Thromb Res. 2006;118(1):39–48. https://doi.org/10.1016/j.thromres.2004.12.021.
40. Gacio S., Muñoz Giacomelli F., Klein F. Presumed perinatal ischemic stroke: a review. Arch Argent Pediatr. 2015;113(5):449–55. (English, Spanish). https://doi.org/10.5546/aap.2015.eng.449.
41. Elbers J., Viero S., MacGregor D. et al. Placental pathology in neonatal stroke. Pediatrics. 2011;127(3):e722–9. https://doi.org/10.1542/peds.2010-1490.
42. Günther G., Junker R., Sträter R. et al.; Childhood Stroke Study Group. Symptomatic ischemic stroke in full-term neonates: role of acquired and genetic prothrombotic risk factors. Stroke. 2000;31(10):2437–41. https://doi.org/10.1161/01.str.31.10.2437.
43. Dlamini N., Billinghurst L., Kirkham F.J. Cerebral venous sinus (sinovenous) thrombosis in children. Neurosurg Clin N Am. 2010;21(3):511–27. https://doi.org/10.1016/j.nec.2010.03.006.
44. deVeber G., Andrew M., Adams C. et al. Cerebral sinovenous thrombosis in children. N Engl J Med. 2001;345():417–23. https://doi.org/10.1056/NEJM200108093450604.
45. Wasay M., Dai A.I., Ansari M. et al. Cerebral venous sinus thrombosis in children: A multicenter cohort from the United States. J Child Neurol. 2008;23(1):26–31. https://doi.org/10.1177/0883073807307976.
46. Manco-Johnson M.J. How I treat venous thrombosis in children. Blood. 2006;107(1):21–9. https://doi.org/10.1182/blood-2004-11-4211.
47. Moharir M.D., Shroff M., Pontigon A.M. et al. A prospective outcome study of neonatal cerebral sinovenous thrombosis. J Child Neurol. 2011;26(9):1137–44. https://doi.org/10.1177/0883073811408094.
48. Zhu W., Zhang H., Xing Y. Clinical characteristics of venous thrombosis associated with peripherally inserted central venous catheter in premature infants. Children (Basel). 2022;9(8):1126. https://doi.org/10.3390/children9081126.
49. Ulloa-Ricardez A., Romero-Espinoza L., Estrada-Loza Mde J. et al. Risk factors for intracardiac thrombosis in the right atrium and superior vena cava in critically ill neonates who required the installation of a central venous catheter. Pediatr Neonatol. 2016;57(4):288–94. https://doi.org/10.1016/j.pedneo.2015.10.001.
50. Cholette J.M., Rubenstein J.S., Alfieris G.M. et al. Elevated risk of thrombosis in neonates undergoing initial palliative cardiac surgery. Ann Thorac Surg. 2007;84(4):1320–5. https://doi.org/10.1016/j.athoracsur.2007.05.026.
51. Fenton K.N., Siewers R.D., Rebovich B., Pigula F.A. Interim mortality in infants with systemic-to-pulmonary artery shunts. Ann Thorac Surg. 2003;76(1):152–6. https://doi.org/10.1016/s0003-4975(03)00168-1.
52. Messinger Y., Sheaffer J.W., Mrozek J. et al. Renal outcome of neonatal renal venous thrombosis: review of 28 patients and effectiveness of fibrinolytics and heparin in 10 patients. Pediatrics. 2006;118(5):e1478–84. https://doi.org/10.1542/peds.2005-1461.
53. Moon C.J., Kwon T.H., Lee H.S. Portal vein thrombosis and food proteininduced allergic proctocolitis in a premature newborn with hypereosinophilia: a case report. BMC Pediatr. 2021;21(1):49. https://doi.org/10.1186/s12887-021-02510-9.
54. Tsonis O., Gouvias T., Gkrozou F. et al. Neonatal femoral artery thrombosis at the time of birth: a case report. J Pediatr Neonatal Individ Med. 2020;9(2):e090214. https://doi.org/10.7363/090214.
55. Mahasandana C., Suvatte V., Marlar R.A. et al. Neonatal purpura fulminans associated with homozygous protein S deficiency. Lancet. 1990;335(8680):61–2. https://doi.org/10.1016/0140-6736(90)90201-f.
56. Hattenbach L.O., Beeg T., Kreuz W., Zubcov A. Ophthalmic manifestation of congenital protein C deficiency. J AAPOS. 1999;3(3):188–90. https://doi.org/10.1016/s1091-8531(99)70066-2.
57. Chalmers E., Cooper P., Forman K. et al. Purpura fulminans: recognition, diagnosis and management. Arch Dis Child. 2011;96(11):1066–71. https://doi.org/10.1136/adc.2010.199919.
58. Marlar R.A., Montgomery R.R., Broekmans A.W. Diagnosis and treatment of homozygous protein C deficiency. Report of the Working Party on Homozygous Protein C Deficiency of the Subcommittee on Protein C and Protein S, International Committee on Thrombosis and Haemostasis. J Pediatr. 1989;114(4 Pt 1):528–34. https://doi.org/10.1016/s0022-3476(89)80688-2.
59. van Ommen C.H., Sol J.J. Developmental hemostasis and management of central venous catheter thrombosis in neonates. Semin Thromb Hemost. 2016;42(7):752–9. https://doi.org/10.1055/s-0036-1592299.
60. Thornburg C.D., Smith P.B., Smithwick M.L. et al. Association between thrombosis and bloodstream infection in neonates with peripherally inserted catheters. Thromb Res. 2008;122(6):782–5. https://doi.org/10.1016/j.thromres.2007.10.001.
61. Bhatt M.D., Chan A.K. Venous thrombosis in neonates. Fac Rev. 2021;10;20. https://doi.org/10.12703/r/10-20.
62. Dubbink-Verheij G.H., Pelsma I.C.M., van Ommen C.H. et al. Femoral vein catheter is an important risk factor for catheter-related thrombosis in (near-)term neonates. J Pediatr Hematol Oncol. 2018;40(2):e64–e68. https://doi.org/10.1097/MPH.0000000000000978.
63. Amankwah E.K., Atchison C.M., Arlikar S. et al. Risk factors for hospitalassociated venous thromboembolism in the neonatal intensive care unit. Thromb Res. 2014;134(2):305–9. https://doi.org/10.1016/j.thromres.2014.05.036.
64. Tuckuviene R., Christensen A.L., Helgested J. et al. Infant, obstetrical and maternal characteristics associated with thromboembolism in infancy: a nationwide population-based case-control study. Arch Dis Child Fetal Neonatal Ed. 2012;97(2):F417–22. https://doi.org/10.1136/archdischild-2011-300665.
65. Bhat R., Kwon S., Zaniletti I. et al. Risk factors associated with venous and arterial neonatal thrombosis in the intensive care unit: a multicentre casecontrol study. Lancet Haematol. 2022;9(3):e200–e207. https://doi.org/10.1016/S2352-3026(21)00399-9.
66. Vorobev A.V., Bitsadze V.O., Khizroeva J.Kh. et al. Neonatal thrombosis: risk factors and principles of prophylaxis. Obstetrics, Gynecology and Reproduction. 2021;15(4):390–403. (In Russ.). https://doi.org/10.17749/2313-7347/ob.gyn.rep.2021.233.
67. Walker S.C., Creech C.B., Domenico H.J. et al. A real-time risk-prediction model for pediatric venous thromboembolic events. Pediatrics. 2021;147(6):e2020042325. https://doi.org/10.1542/peds.2020-04232.
68. Ovesen P.G., Jensen D.M., Damm P. et al. Maternal and neonatal outcomes in pregnancies complicated by gestational diabetes. a nationwide study. J Matern Fetal Neonatal Med. 2015;28(14):1720–4. https://doi.org/10.3109/14767058.2014.966677.
69. Simchen M.J., Goldstein G., Lubetsky A. et al. Factor v Leiden and antiphospholipid antibodies in either mothers or infants increase the risk for perinatal arterial ischemic stroke. Stroke. 2009;40(1):65–70. https://doi.org/10.1161/STROKEAHA.108.527283.
70. Kenet G., Lütkhoff L.K., Albisetti M. et al. Impact of thrombophilia on risk of arterial ischemic stroke or cerebral sinovenous thrombosis in neonates and children: a systematic review and meta-analysis of observational studies. Circulation. 2010;121(16):1838–47. https://doi.org/10.1161/CIRCULATIONAHA.109.913673.
71. Campos L.M., Kiss M.H., D'Amico E.A., Silva C.A. Antiphospholipid antibodies and antiphospholipid syndrome in 57 children and adolescents with systemic lupus erythematosus. Lupus. 2003;12(11):820–6. https://doi.org/10.1191/0961203303lu471oa.
72. Kenet G., Aronis S., Berkun Y. et al. Impact of persistent antiphospholipid antibodies on risk of incident symptomatic thromboembolism in children: a systematic review and meta-analysis. Semin Thromb Hemost. 2011;37(7):802–9. https://doi.org/10.1055/s-0031-1297171.
73. Avcin T., Cimaz R., Meroni P.L. Recent advances in antiphospholipid antibodies and antiphospholipid syndromes in pediatric populations. Lupus. 2002;11(1):4–10. https://doi.org/10.1191/0961203302lu146rr.
74. Berkun Y., Padeh S., Barash J. et al. Antiphospholipid syndrome and recurrent thrombosis in children. Arthritis Rheum. 2006;55(6):850–5. https://doi.org/10.1002/art.22360.
75. Berkun Y., Simchen M.J., Strauss T. et al. Antiphospholipid antibodies in neonates with stroke--a unique entity or variant of antiphospholipid syndrome? Lupus. 2014;23(10):986–93. https://doi.org/10.1177/0961203314531842.
76. Boffa M.C., Lachassinne E. Infant perinatal thrombosis and antiphospholipid antibodies: a review. Lupus. 2007;16(8):634–41. https://doi.org/10.1177/0961203307079039.
77. Miyakis S., Lockshin M.D., Atsumi T. et al. International consensus statement on an update of the classification criteria for definite antiphospholipid syndrome (APS). J Thromb Haemost. 2006;4(2):295– 306. https://doi.org/10.1111/j.1538-7836.2006.01753.x.
78. Young G., Albisetti M., Bonduel M. et al. Impact of inherited thrombophilia on venous thromboembolism in children: a systematic review and metaanalysis of observational studies. Circulation. 2008;118(13):1373–82. https://doi.org/10.1161/CIRCULATIONAHA.108.789008.
79. Nowak-Göttl U., Junker R., Kreuz W. et al.; Childhood Thrombophilia Study Group. Risk of recurrent venous thrombosis in children with combined prothrombotic risk factors. Blood. 2001;97(4):858–62. https://doi.org/10.1182/blood.v97.4.858.
80. Limperger V., Kenet G., Goldenberg N.A. et al. Impact of high-risk thrombophilia status on recurrence among children with a first non-centralvenous-catheter-associated VTE: an observational multicentre cohort study. Br J Haematol. 2016;175(1):133–40. https://doi.org/10.1111/bjh.14192.
81. Fletcher-Sandersjöö A., Bellander B.M. Is COVID-19 associated thrombosis caused by overactivation of the complement cascade? A literature review. Thromb Res. 2020;194:36–41. https://doi.org/
82. Gashimova N.R., Pankratyeva L.L., Bitsadze V.O. et al. Intrauterine activation of the fetal immune system in response to maternal COVID-19. Obstetrics, Gynecology and Reproduction. 2023;17(2):188–201. (In Russ.). https://doi.org/10.17749/2313-7347/ob.gyn.rep.2023.404.
83. Bitsadze V.O., Grigoreva K.N., Khizroeva J.K. et al. Novel coronavirus infection and Kawasaki disease. J Matern Fetal Neonatal Med. 2022;35(16):3044–8. https://doi.org/10.1080/14767058.2020.1800633.
84. Barrero-Castillero A., Beam K.S., Bernardini L.B. et al.; Harvard NeonatalPerinatal Fellowship COVID-19 Working Group. COVID-19: neonatalperinatal perspectives. J Perinatol. 2021;41(5):940–51. https://doi.org/10.1038/s41372-020-00874-x.
85. Leeman R., Shoag J., Borchetta M. et al. Clinical implications of hematologic and hemostatic abnormalities in children with COVID-19. J Pediatr Hematol Oncol. 2022;44(1):e282–e286. https://doi.org/10.1097/MPH.0000000000002176.
86. Helms J., Tacquard C., Severac F. et al.; CRICS TRIGGERSEP Group (Clinical research in intensive care and sepsis trial group for global evaluation and research in sepsis). High risk of thrombosis in patients with severe SARS-CoV-2 infection: a multicenter prospective cohort study. Intensive Care Med. 2020;46():1089–98. https://doi.org/10.1007/s00134-020-06062-x.
87. Campi F., Longo D., Bersani I. et al. Neonatal cerebral venous thrombosis following maternal SARS-CoV-2 infection in pregnancy. Neonatology. 2022;119(2):268–72. https://doi.org/10.1159/00052053.
88. Baergen R.N., Heller D.S. Placental pathology in COVID-19 positive mothers: preliminary findings. Pediatr Dev Pathol. 2020;23():177–80. https://doi.org/10.1177/1093526620925569.
89. Dashraath P., Wong J.L.J., Lim M.X.K. et al. Coronavirus disease 2019 (COVID-19) pandemic and pregnancy. Am J Obstet Gynecol. 2020;222(6):521–31. https://doi.org/10.1016/j.ajog.2020.03.021.
90. Stephens A.J., Barton J.R., Bentum N.A. et al. General guidelines in the management of an obstetrical patient on the labor and delivery unit during the COVID-19 pandemic. Am J Perinatol. 2020;37(8):829–36. https://doi.org/10.1055/s-0040-1710308.
91. Monagle P., Chan A.K.C., Goldenberg N.A. et al. Antithrombotic therapy in neonates and children: Antithrombotic Therapy and Prevention of Thrombosis, 9th ed: American College of Chest Physicians EvidenceBased Clinical Practice Guidelines. Chest. 2012;141(2 Suppl):e737S– e801S. https://doi.org/10.1378/chest.11-2308.
92. Ting J., Yeung K., Paes B. et al.; Thrombosis and Hemostasis in Newborns (THiN) Group. How to use low-molecular-weight heparin to treat neonatal thrombosis in clinical practice. Blood Coagul Fibrinolysis. 2021;32(8):531–8. https://doi.org/10.1097/MBC.0000000000001052.
93. Kenet G., Cohen O., Bajorat T., Nowak-Göttl U. Insights into neonatal thrombosis. Thromb Res. 2019;181 Suppl 1:S33–S36. https://doi.org/10.1016/S0049-3848(19)30364-0.
94. Monagle P., Newall F. Management of thrombosis in children and neonates: practical use of anticoagulants in children. Hematol Am Soc Hematol Educ Program. 2018;2018(1):399–404. https://doi.org/10.1182/asheducation-2018.1.399.
95. Male C., Thom K., O’Brien S.H. Direct oral anticoagulants: what will be their role in children? Thromb Res. 2019;173:178–85. https://doi.org/10.1016/j.thromres.2018.06.021.
96. Pagowska-Klimek I. Perioperative thromboembolism prophylaxis in children – is it necessary? Anaesthesiol Intensive Ther. 2020;52(4):316– 22. https://doi.org/10.5114/ait.2020.97599.
Об авторах
А. Д. МакацарияРоссия
Макацария Александр Давидович – д.м.н., профессор, академик РАН, зав. кафедрой акушерства, гинекологии и перинатальной медицины Клинического института детского здоровья имени Н.Ф. Филатова ФГАОУ ВО Первый Московский государственный медицинский университет имени И.М. Сеченова Министерства здравоохранения Российской Федерации (Сеченовский Университет); вице-президент Российского общества акушеров- гинекологов (РОАГ); Заслуженный врач Российской Федерации; Почетный профессор Венского Университета
Scopus Author ID: 57222220144.
Researcher ID: M-5660-2016
119991 Москва, Трубецкая ул., д. 8, стр. 2
А. В. Воробьев
Россия
Воробьев Александр Викторович – к.м.н., доцент кафедры акушерства, гинекологии и перинатальной медицины Клинического института детского здоровья имени Н.Ф. Филатова
Scopus Author ID: 57191966265.
Researcher ID: F-8804-2017
119991 Москва, Трубецкая ул., д. 8, стр. 2
А. В. Лазарчук
Россия
Лазарчук Арина Владимировна – студент 6-го курса
119991 Москва, Трубецкая ул., д. 8, стр. 2
С. Э. Эйнуллаева
Россия
Эйнуллаева Сабина Элхан кызы – студент 6-го курса
119991 Москва, Трубецкая ул., д. 8, стр. 2
Н. А. Гоменко
Россия
Гоменко Наталья Александровна – студент 5-го курса
119991 Москва, Трубецкая ул., д. 8, стр. 2
Ф. А. Магомедова
Россия
Магомедова Фатима Абасовна – студент 5-го курса
119991 Москва, Трубецкая ул., д. 8, стр. 2
В. О. Бицадзе
Россия
Бицадзе Виктория Омаровна – д.м.н., профессор РАН, профессор кафедры акушерства, гинекологии и перинатальной медицины Клинического института детского здоровья имени Н.Ф. Филатова
119991 Москва, Трубецкая ул., д. 8, стр. 2
Д. Х. Хизроева
Россия
Хизроева Джамиля Хизриевна – д.м.н., профессор кафедры акушерства, гинекологии и перинатальной медицины Клинического института детского здоровья имени Н.Ф. Филатова
Scopus Author ID: 57194547147.
Researcher ID: F-8384-2017
119991 Москва, Трубецкая ул., д. 8, стр. 2
Н. А. Макацария
Россия
Макацария Наталия Александровна – к.м.н., доцент кафедры акушерства, гинекологии и перинатальной медицины Клинического института детского здоровья имени Н.Ф. Филатова
Researcher ID: F-8406-2017
119991 Москва, Трубецкая ул., д. 8, стр. 2
В. Б. Зубенко
Россия
Зубенко Владислав Борисович – соискатель кафедры акушерства, гинекологии и перинатальной медицины Клинического института детского здоровья имени Н.Ф. Филатова ФГАОУ ВО Первый Московский государственный медицинский университет имени И.М. Сеченова Министерства здравоохранения Российской Федерации (Сеченовский университет); зам. главного врача по акушерско-гинекологической помощи ГБУЗ Ставропольского края «Ставропольский краевой клинический перинатальный центр»
119991 Москва, Трубецкая ул., д. 8, стр. 2;
355002 Ставрополь, ул. Ломоносова, д. 44
М. В. Третьякова
Россия
Третьякова Мария Владимировна – к.м.н., ассистент кафедры акушерства, гинекологии и перинатальной медицины Клинического института детского здоровья имени Н.Ф. Филатова
119991 Москва, Трубецкая ул., д. 8, стр. 2
Д. В. Блинов
Россия
Блинов Дмитрий Владиславович – к.м.н., ассистент кафедры спортивной медицины и медицинской реабилитации Института клинической медицины имени Н.В. Склифосовского ФГАОУ ВО Первый Московский государственный медицинский университет имени И.М. Сеченова Министерства здравоохранения Российской Федерации (Сеченовский Университет); руководитель по медицинским и научным вопросам, Институт Превентивной и Социальной Медицины; доцент кафедры спортивной, физической и реабилитационной медицины АНО ДПО «Московский медико-социальный институт имени Ф.П. Гааза»
119991 Москва, Трубецкая ул., д. 8, стр. 2;
127006 Москва, ул. Садовая-Триумфальная, д. 4–10;
123056 Москва, 2-я Брестская ул., д. 5, с. 1–1а
Ф. Э. Ягубова
Россия
Ягубова Фидан Эльчин кызы – клинический ординатор кафедры акушерства, гинекологии и перинатальной медицины Клинического института детского здоровья имени Н.Ф. Филатова
119991 Москва, Трубецкая ул., д. 8, стр. 2
Н. Р. Гашимова
Россия
Гашимова Нилуфар Рамиль кызы – аспирант кафедры акушерства, гинекологии и перинатальной медицины Клинического института детского здоровья имени Н.Ф. Филатова
119991 Москва, Трубецкая ул., д. 8, стр. 2
К. Н. Григорьева
Россия
Григорьева Кристина Николаевна – ассистент кафедры акушерства, гинекологии и перинатальной медицины Клинического института детского здоровья имени Н.Ф. Филатова
119991 Москва, Трубецкая ул., д. 8, стр. 2
М. А. Пониманская
Россия
Пониманская Мария Александровна – к.м.н., зам. главного врача по акушерско-гинекологической помощи
123423 Москва, ул. Саляма Адиля, д. 2/44
О. Н. Ли
Россия
Ли Ок Нам – к.м.н., зам. главного врача
123423 Москва, ул. Саляма Адиля, д. 2/44
А. В. Мостовой
Россия
Мостовой Алексей Валерьевич – к.м.н., руководитель службы реанимации и интенсивной терапии ГБУЗ «Городская клиническая больница № 67 имени Л.А. Ворохобова Департамента здравоохранения города Москвы»; доцент кафедры неонатологии имени профессора В.В. Гаврюшова ФГБОУ ДПО «Российская медицинская академия непрерывного профессионального образования» Министерства здравоохранения Российской Федерации; ассистент кафедры поликлинической терапии, клинической лабораторной диагностики и медицинской биохимии ИПДО ФГБОУ ВО «Ярославский государственный медицинский университет» Министерства здравоохранения Российской Федерации; главный внештатный специалист-неонатолог Министерства здравоохранения Российской Федерации в Северо-Кавказском федеральном округе
123423 Москва, ул. Саляма Адиля, д. 2/44;
123995 Москва, ул. Баррикадная, 2/1, корп. 1;
150000 Ярославль, ул. Революционная, д. 5
А. Л. Карпова
Россия
Карпова Анна Львовна – к.м.н., зав. неонатологическим стационаром ГБУЗ «Городская клиническая больница № 67 имени Л.А. Ворохобова Департамента здравоохранения города Москвы»; доцент кафедры неонатологии имени профессора В.В. Гаврюшова ФГБОУ ДПО «Российская медицинская академия непрерывного профессионального образования» Министерства здравоохранения Российской Федерации; ассистент кафедры поликлинической терапии, клинической лабораторной диагностики и медицинской биохимии ИПДО ФГБОУ ВО «Ярославский государственный медицинский университет» Министерства здравоохранения Российской Федерации
123423 Москва, ул. Саляма Адиля, д. 2/44;
123995 Москва, ул. Баррикадная, 2/1, корп. 1;
150000 Ярославль, ул. Революционная, д. 5
Ж-К. Гри
Россия
Гри Жан-Кристоф – д.м.н., профессор кафедры акушерства, гинекологии и перинатальной медицины Клинического института детского здоровья имени Н.Ф. Филатова
Scopus Author ID: 7005114260.
Researcher ID: AAA-2923-2019
119991 Москва, Трубецкая ул., д. 8, стр. 2;
34090 Монпелье, ул. Огюста Бруссоне, д. 163
И. Элалами
Россия
Элалами Исмаил – д.м.н., профессор кафедры акушерства, гинекологии и перинатальной медицины Клинического института детского здоровья имени Н.Ф. Филатова ФГАОУ ВО Первый Московский государственный медицинский университет имени И.М. Сеченова Министерства здравоохранения Российской Федерации (Сеченовский Университет); профессор медицинского Университета Сорбонны, Париж, Франция; директор гематологии Центра Тромбозов, Госпиталь Тенон
119991 Москва, Трубецкая ул., д. 8, стр. 2;
Франция, 75006 Париж, Улица медицинского факультета, д. 12;
75020 Париж, Китайская улица, д. 4
Что уже известно об этой теме?
► Неонатальные тромбозы являются довольно редким, но серьезным состоянием, которое может быть фатальным для новорожденных.
► Одним из основных факторов риска развития неонатальных тромбозов считается использование центральных венозных катетеров.
► Лечение неонатального тромбоза – сложный процесс, требующий индивидуального подхода, зависящего от локализации тромба, состояния здоровья ребенка и присутствия других факторов риска.
Что нового дает статья?
► Представлены новые данные по факторам риска неонатальных тромбозов с учетом результатов последних исследований.
► Проанализировано влияние на развитие неонатальных тромбозов врожденной и приобретенной тромбофилии, тромбовоспаления и новой коронавирусной инфекции COVID-19 у матери.
► Рассмотрены новые методы профилактики и лечения неонатальных тромбозов, которые могут способствовать снижению летальности и морбидности новорожденных.
Как это может повлиять на клиническую практику в обозримом будущем?
► Внедрение новых методов оценки риска для более точного прогнозирования развития неонатальных тромбозов позволит их предотвращать и улучшить исход для новорожденных.
► Инновационные подходы к диагностике, описанные в статье, могут обеспечить более быстрое и точное определение тромбоза или претромботического состояния, что позволит начать проактивное лечение и повысит эффективность терапии.
► Новые стратегии лечения могут привести к изменению стандартных рекомендаций по ведению пациентов с неонатальными тромбозами.
Рецензия
Для цитирования:
Макацария А.Д., Воробьев А.В., Лазарчук А.В., Эйнуллаева С.Э., Гоменко Н.А., Магомедова Ф.А., Бицадзе В.О., Хизроева Д.Х., Макацария Н.А., Зубенко В.Б., Третьякова М.В., Блинов Д.В., Ягубова Ф.Э., Гашимова Н.Р., Григорьева К.Н., Пониманская М.А., Ли О.Н., Мостовой А.В., Карпова А.Л., Гри Ж., Элалами И. Инновационные подходы к оценке факторов риска, диагностике и лечению неонатальных тромбозов. Акушерство, Гинекология и Репродукция. 2024;18(3):382-400. https://doi.org/10.17749/2313-7347/ob.gyn.rep.2024.530
For citation:
Makatsariya A.D., Vorobev A.V., Lazarchuk A.V., Einullaeva S.E., Gomenko N.A., Magomedova F.A., Bitsadze V.O., Khizroeva J.Kh., Makatsariya N.A., Zubenko V.B., Tretyakova M.V., Blinov D.V., Yagubova F.E., Gashimova N.R., Grigoreva K.N., Ponimanskaya M.A., Li O.N., Mostovoi A.V., Karpova A.L., Gris J., Elalamy I. Innovative approaches to assessing risk factors, diagnostics and treatment of neonatal thrombosis. Obstetrics, Gynecology and Reproduction. 2024;18(3):382-400. (In Russ.) https://doi.org/10.17749/2313-7347/ob.gyn.rep.2024.530

Контент доступен под лицензией Creative Commons Attribution-NonCommercial-ShareAlike 4.0 International License.











































