Перейти к:
Оптимизация внутриматочных вмешательств при самопроизвольном аборте
https://doi.org/10.17749/2313-7347/ob.gyn.rep.2024.522
Аннотация
Введение. Остатки плодного яйца (ОПЯ) выявляются у 15 % женщин после самопроизвольного или медицинского аборта. Слепое удаление ОПЯ из полости матки до сих является «золотым стандартом» хирургического лечения, однако оно может быть связано с высоким риском ряда осложнений, создающих серьезную угрозу репродуктивной функции и качеству жизни женщины. Альтернативным методом элиминации ОПЯ является оперативная гистероскопия, демонстрирующая преимущества визуального контроля.
Цель: оценить клиническую эффективность и безопасность удаления ОПЯ при неполном самопроизвольном аборте с помощью гистероскопической морцелляции.
Материалы и методы. В проспективное сравнительное исследование включены 135 женщин с неполным самопроизвольным абортом в возрасте от 18 до 40 лет, среди которых выделены 3 группы: группа 1 – 42 пациентки, которым выполнялась электромеханическая вакуум-аспирация (ЭВА) ОПЯ; группа 2 – 44 пациентки, которым проводилась мануальная вакуум-аспирация (МВА) ОПЯ; группа 3 – 49 пациенток, которым проводилась гистероскопическая морцелляция (ГМ) ОПЯ. У всех пациенток измеряли уровень общего эндотоксина, определяли цитокиновый профиль метроаспиратов, показатель микроциркуляции в эндометрии до и в 1-е сутки после оперативного лечения, выполняли ультразвуковое исследование (УЗИ) гениталий на 3–5-е сутки после операции.
Результаты. В послеоперационном периоде в группах ЭВА и МВА определен значительный рост концентраций общего эндотоксина и интерлейкина (англ. interleukin, IL) IL-1β по сравнению с показателями до лечения (р < 0,05); в группе ГМ их значения после операции достоверно не изменились (р > 0,05). Рост содержания IL-8 и фактора некроза опухоли альфа (англ. tumor necrosis factor alpha, TNF-α) после операции был статистически значимым во всех группах (p = 0,001). В группах ЭВА и МВА выявлено снижение уровней противовоспалительных цитокинов IL-4 и IL-10 (p = 0,001), а в группе ГМ их значения существенно не менялись (p > 0,05). Значимое увеличение скорости микрокровотока при сравнении с показателями до лечения обнаружено в группах ЭВА и МВА (p = 0,001); в группе ГМ скорость микрокровотока значимо не отличалась от исходной (р = 0,415). Неполное удаление ОПЯ установлено у 4,5 % пациенток группы МВА, у всех пациенток групп ЭВА и ГМ диагностирована полная элиминация ОПЯ. Интраоперационного кровотечения, перфорации матки не было ни у одной пациентки.
Заключение. Ближайшие результаты лечения показали, что удаление ОПЯ посредством ГМ является эффективным и безопасным методом лечения. Ограниченный воспалительный ответ и стабильная микроциркуляция в эндометрии при использовании ГМ свидетельствуют о минимальном воздействии на эндометрий, что снижает вероятность послеоперационной адгезии.
Ключевые слова
Для цитирования:
Салов И.А., Наумова Ю.В., Ломовицкая М.В. Оптимизация внутриматочных вмешательств при самопроизвольном аборте. Акушерство, Гинекология и Репродукция. 2024;18(3):352-364. https://doi.org/10.17749/2313-7347/ob.gyn.rep.2024.522
For citation:
Salov I.A., Naumova I.V., Lomovitskaya M.V. Optimization of intrauterine interventions in spontaneous abortion. Obstetrics, Gynecology and Reproduction. 2024;18(3):352-364. (In Russ.) https://doi.org/10.17749/2313-7347/ob.gyn.rep.2024.522
Введение / Introduction
Остатки плодного яйца (ОПЯ) определяются как задержка трофобластической или фетальной ткани в полости матки после самопроизвольного, артифициального или несостоявшегося аборта [1]. Частота выявления ОПЯ зависит от срока гестации (чаще в I и II триместрах), метода лечения (хирургическое или нехирургическое) и продолжительности наблюдения [1][2]. Чаще всего ОПЯ встречаются после медикаментозных абортов с распространенностью до 15 % [3].
Несмотря на то что ОПЯ могут быть случайно диагностированы во время ультразвукового исследования (УЗИ), они часто ассоциированы с маточным кровотечением, болью в животе и/или лихорадкой, а также могут вызвать серьезные долгосрочные осложнения, такие как эндометрит и образование внутриматочных спаек, потенциально приводящих к вторичному бесплодию [3].
Лечение ОПЯ недостаточно стандартизировано из-за отсутствия научно обоснованных руководств. Варианты ведения пациенток с ОПЯ включают выжидательную тактику, медикаментозное лечение и хирургическое вмешательство в зависимости от тяжести кровотечения у пациентки, наличия внутриматочной инфекции и ультразвуковых характеристик оставшегося материала [4][5]. Сообщается, что частота полной эвакуации оставшихся продуктов зачатия при выжидательной тактике составляет от 47 до 81 % [6][7] по сравнению с 95–97 % при хирургическом лечении [8]. Медикаментозное лечение включает введение утеротоников, таких как мизопростол; в случае отсутствия эффекта требуется хирургическое лечение [9, 10].
Хирургическое удаление ОПЯ возможно путем «слепого» кюретажа или гистероскопической резекции.
Хирургическое лечение, заключающееся в «слепом» кюретаже (вакуум-аспирации) ОПЯ, до сих пор считается «золотым стандартом» [11]. Однако «слепое» внутриматочное вмешательство может быть ассоциировано с риском развития ряда осложнений, таких как повреждение базального слоя эндометрия, кровотечение, перфорация матки, образование внутриматочных синехий, а также неполное удаление ОПЯ [7]. По данным ряда исследований, при гистероскопии, выполненной по поводу ОПЯ, частота внутриматочных спаек достигала 50 % у пациенток, которым ранее проводилось неполное «слепое» выскабливание матки [3][11].
Среди поздних осложнений выделяют нарушение имплантации плодного яйца из-за эффекта инородного тела, аномальную плацентацию, а также потенциальные неблагоприятные последствия для репродуктивных исходов, в частности, самопроизвольные аборты или бесплодие [3][11]. Любой метод, используемый для эвакуации содержимого полости матки, может быть связан с вышеупомянутыми осложнениями. Однако было обнаружено, что эти риски значительно выше у пациенток, которым выполнялось выскабливание [3][12][13].
Альтернативой выскабливанию матки является оперативная гистероскопия, которая демонстрирует преимущество «визуального контроля». Использование оперативной гистероскопии обеспечивает высокую вероятность полной эвакуации ОПЯ, снижение частоты повторных вмешательств и уменьшение послеоперационных внутриматочных спаек за счет ограничения операционного поля [14].
Остатки плодного яйца могут быть удалены с помощью петли резектоскопа, морцелляции или гистероскопического захвата [3][7][12]. Резектоскопия используется чаще, чем морцелляция. Однако при резектоскопии существует риск термического повреждения внутренних органов [15], а также базального слоя эндометрия, что приводит к заживлению за счет репарации вместо регенерации. Данный процесс повышает вероятность возникновения спаек [16]. Гистероскопическая морцелляция (ГМ), в свою очередь, не требует энергетических затрат, что устраняет возможность висцерального теплового повреждения. Кроме того, по сравнению с резектоскопом гистероскопический морцеллятор использует гистероскоп меньшего размера, что требует меньшего расширения шейки матки [17]. Другим значительным преимуществом техники ГМ является операционный обзор, который поддерживается за счет аспирации ткани на всем протяжении, что снижает травматизацию эндометрия [17]. При резектоскопии наличие флотирующей ткани требует использования зажима для ее удаления, что увеличивает продолжительность операции, а также может привести к непреднамеренной перфорации матки. В этом отношении морцелляция является более безопасным методом лечения, чем резектоскопия [17][18].
Несмотря на ряд преимуществ использования ГМ в лечении ОПЯ, в научной литературе представлены лишь немногочисленные результаты клинического применения метода.
Цель: оценить клиническую эффективность и безопасность удаления ОПЯ при неполном самопроизвольном аборте с помощью ГМ.
Материалы и методы / Materials and Methods
Дизайн исследования / Study design
В период с сентября 2021 г. по декабрь 2022 г. на клинической базе кафедры акушерства и гинекологии лечебного факультета ФГБОУ ВО Саратовский ГМУ им. В.И. Разумовского Минздрава России (ГУЗ Саратовская ГКБ № 1 им. Ю.Я. Гордеева) проведено проспективное сравнительное исследование 135 женщин
в возрасте от 18 до 40 лет, находившихся на стационарном лечении по поводу ОПЯ после самопроизвольного аборта в I триместре беременности. Диагноз был установлен на основании данных анамнеза, характерной клинической картины заболевания и данных УЗИ – наличие гетерогенных гиперэхогенных включений в полости матки с активным кровотоком в режиме цветного доплеровского картирования.
Критерии включения и исключения / Inclusion and exclusion criteria
Критерии включения: возраст от 18 до 40 лет; наличие ОПЯ после самопроизвольного аборта в I триместре беременности, подтвержденных УЗИ; отсутствие серьезной соматической патологии; подписанное информированное согласие.
Критерии исключения: возраст менее 18 и более 40 лет; тяжелая экстрагенитальная патология; срок гестации более 13 нед на момент выкидыша; отказ пациентки от участия в исследовании.
Группы обследованных / Patient groups
В группу 1 вошли 42 пациентки с неполным самопроизвольным абортом, которым выполнялась электромеханическая вакуум-аспирация (ЭВА) остатков плодного яйца. Использовали четырехканальный хирургический отсасыватель жидкостей и воздуха из ран и полостей ОХ-8/40-«Элема-Н» (АМ4М10) (ООО «Элема-Н», Россия).
В группу 2 были включены 44 пациентки, которым проводилась мануальная вакуум-аспирация (МВА) остатков плодного яйца. Использовали мануальный вакуум-аспиратор Ipas MVA Plus (Pahsco, США).
В группу 3 были включены 49 пациенток, которым проводилась ГМ остатков плодного яйца с помощью морцеллятора MorceCut Lap II (ООО «Эндомедиум+», Россия).
Всем пациенткам проводили антибактериальную профилактику инфекционных осложнений во время оперативного вмешательства (цефтриаксон 2 г внут-
римышечно однократно).
Методы исследования / Study methods
Всем пациенткам, включенным в исследование, было проведено клинико-лабораторное обследование согласно клиническим рекомендациям по ведению пациенток с самопроизвольным абортом [19].
Для оценки степени выраженности воспалительного ответа при использовании различных способов эвакуации ОПЯ у всех пациенток до начала лечения и на первые сутки после оперативного лечения в аспирате из полости матки определяли уровень общего эндотоксина методом активированных частиц (МАЧ–Endotox spp.), разработанным в ФГБУ НМИЦ ССХ им. А.Н. Бакулева Минздрава России (решение комитета по новым медицинским технологиям Минздрава России от 24.03.2003), с помощью стандартных наборов; методом иммуноферментного анализа (ИФА) с использованием реактивов «Вектор-БЕСТ» (ООО НПП «ЛАЗМА», Россия) изучали цитокиновый профиль: содержание провоспалительных цитокинов – интерлейкинов (англ. interleukin, IL) IL-1β, IL-8, фактора некроза опухоли альфа (англ. tumor necrosis factor alpha, TNF-α) и противовоспалительных цитокинов IL-4, IL-10.
Исследование микроциркуляции в эндометрии выполняли методом лазерной доплеровской флоуметрии (ЛДФ) и оптической тканевой оксиметрии при помощи аппарата «ЛАКК-М» (ООО НПП «ЛАЗМА», Россия). Методом ЛДФ определяли показатель микроциркуляции в перфузионных единицах (пф. ед.).
С целью уточнения диагноза (перед оперативным вмешательством) и для оценки результата лечения (на 3–5-й день после операции) пациенткам выполнялось УЗИ внутренних гениталий по общепринятой методике ультразвуковым аппаратом (Hitachi Аloka ARIETTA V60, Япония) с использованием геля в качестве проводящей среды при исследовании.
Этические аспекты / Ethical aspects
Все процедуры, выполненные пациенткам в рамках данного исследования, проводились в соответствии с Хельсинкской декларацией 1964 г. и ее последующими изменениями. Все женщины, принимавшие участие в исследовании, были осведомлены о целях настоящего исследования, об использовании кода-
идентификатора, обеспечивающего анонимность, при внесении полученных данных в базу. Пациентки, согласившиеся участвовать в исследовании, предоставили письменное информированное согласие. Протокол исследования (№ 34 от 07.09.2021) был рассмотрен и одобрен комитетом по этике ФГБОУ ВО Саратовский ГМУ им. В.И. Разумовского Минздрава России.
Статистический анализ / Statistical analysis
Статистический анализ был выполнен с использованием многофункциональной программы Statistics IBM SPSS для Windows, версия 23.0 (Armonk, NY: IBM Corp., США). Для оценки нормальности распределения данных был использован критерий Колмогорова–Смирнова. Так как данные имели нормальное распределение, сравнения между группами были выполнены с использованием однофакторного регрессионного анализа ANOVA; критерий χ2 был использован для сравнения процентов. Полученные результаты представлены как среднее значение и стандартное отклонение (М ± SD), а также в виде общих чисел и процентов. Для статистического анализа данных при исследовании динамики показателей относительно исходных уровней ввиду нормального распределения изучаемых признаков использовали t-критерий Стьюдента для зависимых выборок, критический уровень значимости принимался р < 0,05.
Учитывая необходимость множественных сравнений, поправка Бонферрони применялась для контроля вероятности групповой ошибки. Значения «p» были скорректированы поправкой Бонферрони для множественных тестов (p < 0,0167 по коррекции Бонферрони; 0,05/3 = 0,0167).
Результаты / Results
Клинико-анамнестическая характеристика / Clinical and anamnestic characteristics
Основные характеристики трех групп женщин, включенных в исследование, представлены в таблице 1.
Пациентки всех групп были сопоставимы по возрасту, социальному статусу, характеру экстрагенитальной и сопутствующей гинекологической патологии.
Более половины обследованных женщин сообщили о наличии у них экстрагенитальной патологии. Заболевания мочевыделительной системы и желудочно-кишечного тракта встречались у пациенток наиболее часто. Кроме того, у некоторых женщин, включенных в исследование, имела место сочетанная экстрагенитальная патология.
Настоящая беременность, осложнившаяся неполным выкидышем, была первой у 26 % обследованных. Акушерский анамнез отягощен самопроизвольным, артифициальным абортом, патологическим течением беременности, родов, оперативным родоразрешением у 43 % женщин. При анализе гинекологической заболеваемости выявлено, что наиболее часто у пациенток, включенных в исследование, встречались воспалительные заболевания органов малого таза, эктопия шейки матки, нарушения овариально-менструального цикла.
Таблица 1. Сравнительная характеристика групп женщин, включенных в исследование.
Table 1. Comparative characteristics of patient groups included in the study.
Показатель Parameter | Группа 1 (ЭВА) Group 1 (ЕVA) n = 42 | Группа 2 (МВА) Group 2 (MVA) n = 44 | Группа 3 (ГМ) Group 3 (НМ) n = 49 | р |
Возраст, лет, М ± SD / Age, years, M ± SD | 25,20 ± 5,64 | 26,40 ± 5,28 | 24,70 ± 5,42 | > 0,0167 |
Социальный статус, n (%) / Social status, n (%): – работающие / employed – студентки / students – домохозяйки / housewives | 26 (61,9) 9 (21,4) 7 (16,6) | 24 (54,5) 10 (22,7) 10 (22,7) | 30 (61,2) 9 (18,4) 10 (20,4) | > 0,0167 |
Пациентки с экстрагенитальной патологией, n (%) / Patients with extragenital pathology, n (%) | 25 (59,5) | 23 (52,3) | 31 (63,3) | > 0,0167 |
Структура экстрагенитальной патологии / Extragenital pathology | ||||
Заболевания мочевыделительной системы (хронический пиелонефрит, цистит), n (%) / Urinary tract diseases (chronic pyelonephritis, cystitis), n (%) | 7 (16,7) | 9 (20,5) | 8 (16,3) | > 0,0167 |
Заболевания эндокринной системы (заболевания щитовидной железы), n (%) / Endocrine system diseases (thyroid diseases), n (%) | 1 (2,4) | 3 (6,8) | 2 (4,1) | > 0,0167 |
Заболевания органов зрения (миопия), n (%) / Eye diseases | 6 (14,3) | 4 (9,1) | 5 (10,2) | > 0,0167 |
Заболевания сердечно-сосудистой системы (артериальная гипертензия), n (%) / Cardiovascular diseases (arterial hypertension), n (%) | 3 (7,1) | 2 (4,6) | 3 (6,1) | > 0,0167 |
Заболевания желудочно-кишечного тракта (хронический панкреатит, холецистит, гастрит, эзофагит, дуоденит), n (%) / Gastrointestinal tract diseases (chronic pancreatitis, cholecystitis, gastritis, esophagitis, duodenitis), n (%) | 10 (23,8) | 7 (15,9) | 8 (16,3) | > 0,0167 |
Акушерский анамнез / Obstetric history | ||||
Первобеременные пациентки, n (%) / Primiparas, n (%) | 10 (23,8) | 8 (18,2) | 17 (34,7) | > 0,0167 |
Пациентки с отягощенным акушерским анамнезом, n (%) / Patients with burdened obstetric history, n (%) | 19 (45,2) | 17 (38,6) | 22 (44,9) | > 0,0167 |
Структура гинекологической патологии / Gynecological pathology | ||||
Эктопия шейки матки, n (%) / Cervical ectopia, n (%) | 10 (23,8) | 12 (27,3) | 11 (22,5) | > 0,0167 |
Воспалительные заболевания органов малого таза, n (%) / Pelvic inflammatory diseases, n (%) | 20 (47,6) | 14 (31,8) | 17 (34,7) | > 0,0167 |
Миома матки, n (%) / Uterine fibroids, n (%) | 5 (11,9) | 4 (9,1) | 3 (6,1) | > 0,0167 |
Синдром поликистозных яичников n (%) / Polycystic ovary | 4 (9,5) | 2 (4,5) | 4 (8,2) | > 0,0167 |
Тубэктомия в анамнезе по поводу пиосальпинкса или внематочной беременности, n (%) / History of tubectomy for pyosalpinx or ectopic pregnancy, n (%) | 4 (9,5) | 2 (4,6) | 1 (2,0) | > 0,0167 |
Резекция яичников в анамнезе, n (%) / History of ovarian resection, n (%) | 2(4,8) | 1 (2,3) | 0 | > 0,0167 |
Эндометриоз, n (%) / Endometriosis, n (%) | 3 (7,1) | 2 (4,6) | 4 (8,2) | > 0,0167 |
Кольпит и бактериальный вагиноз, n (%) / Vaginitis and bacterial vaginosis, n (%) | 1 (2,4) | 3 (6,8) | 4 (8,2) | > 0,0167 |
Нарушение овариально-менструального цикла, n (%) / Menstrual irregularities, n (%) | 7 (16,7) | 11 (25,0) | 11 (22,5) | > 0,0167 |
Лабораторные данные / Laboratory data
Для оценки повреждающего воздействия на эндометрий различных хирургических способов элиминации ОПЯ в рамках исследования определены уровни общего эндотоксина, провоспалительных (IL-1β, IL-8, TNF-α), противовоспалительных (IL-4, IL-10) цитокинов и показатель микроциркуляции в эндометрии в динамике – до оперативного лечения и в первые сутки после оперативного лечения (табл. 2).
Таблица 2. Маркеры воспалительного ответа метроаспиратов и показатели микроциркуляции в эндометрии до и на первые сутки после оперативного лечения (М ± SD).
Table 2. Markers of metroaspirate inflammatory response and parameters of endometrial microcirculation before surgical treatment and on day 1 afterwards (M ± SD).
Показатель Parameter | Группа 1 (ЭВА) Group 1 (ЕVA) n = 42 | Группа 2 (МВА) Group 2 (MVA) n = 44 | Группа 3 (ГМ) Group 3 (НМ) n = 49 | р | Референсный диапазон Reference range | |||
До лечения | Первые сутки после лечения | До лечения | Первые сутки после лечения | До лечения | Первые сутки после лечения | |||
Показатель эндогенной интоксикации / Parameter of endogenous intoxication | ||||||||
Эндотоксин метроаспиратов, пг/мл | 4,52 ± 1,06 | 21,30 ± 8,34 | 4,96 ± 1,08 | 25,20 ± 9,24 | 4,85 ± 1,06 | 4,21 ± 0,22 | p1 = 0,049 р2 = 0,032 р3 = 0,556 | < 7,5 |
Цитокиновый профиль / Cytokine profile | ||||||||
IL-1β, пг/мл | 2,16 ± 0,92 | 6,19 ± 1,74 | 1,99 ± 0,67 | 6,99 ± 1,88 | 2,34 ± 1,03 | 4,72 ± 1,75 | p1 = 0,044 р2 = 0,014 р3 = 0,244 | < 5,0 |
IL-8, пг/мл | 31,66 ± 6,27 | 71,59 ± 5,23 | 28,51 ± 5,92 | 75,33 ± 5,78 | 34,74 ± 6,04 | 64,55 ± 3,22 | p1 = 0,001 р2 = 0,001 р3 = 0,001 | < 62,0 |
TNF-α, пг/мл | 3,11 ± 0,44 | 12,92 ± 0,98 | 2,69 ± 0,31 | 10,51 ± 0,84 | 2,89 ± 0,57 | 6,47 ± 0,34 | p1 = 0,001 р2 = 0,001 р3 = 0,001 | 0–5,9 |
IL-4, пг/мл | 1,56 ± 0,18 | 0,12 ± 0,04 | 1,94 ± 0,27 | 0,27 ± 0,11 | 2,01 ± 0,32 | 1,92 ± 0,18 | p1 = 0,001 р2 = 0,001 р3 = 0,434 | 0–4,0 |
IL-10, пг/мл | 20,67 ± 2,05 | 9,89 ± 1,53 | 18,58 ± 1,86 | 10,12 ± 1,27 | 21,77 ± 2,01 | 23,41 ± 4,58 | p1 = 0,001 р2 = 0,001 р3 = 0,344 | 0–31,0 |
Показатель микроциркуляции в эндометрии / Endometrial microcirculation parameter | ||||||||
Показатель микроциркуляции, пф. ед. | 8,11 ± 0,95 | 16,03 ± 1,56 | 8,25 ± 1,06 | 16,98 ± 1,79 | 8,19 ± 0,88 | 9,01 ± 0,48 | p1 = 0,001 р2 = 0,001 р3 = 0,415 | |
Примечание: IL – интерлейкин; TNF-α – фактор некроза опухоли альфа; р1 – значимость различий показателей в группе 1 (ЭВА) до и на первые сутки после лечения; р2 – значимость различий показателей в группе 2 (МВА) до и на первые сутки после лечения; р3 – значимость различий показателей в группе 3 (ГМ) до и на первые сутки после лечения.
Note: IL – interleukin; TNF-α – tumor necrosis factor alpha; p1 – significance of differences in group 1 (EVA) before and on day 1 after treatment; p2 – significance of differences in group 2 (MVA) before and on day 1 after treatment; р3 – significance of differences in group 3 (HM) before and on day 1 after treatment.
Средние уровни общего эндотоксина, провоспалительных и противовоспалительных цитокинов метроаспиратов у пациенток трех групп до оперативного лечения значимо не различались и находились в нормальных пределах. Статистически значимых различий не отмечалось и в показателе микроциркуляции в эндометрии.
Динамика значений общего эндотоксина метроаспиратов, провоспалительных и противовоспалительных цитокинов, а также показателя микроциркуляции в эндометрии до лечения и в первые сутки после удаления ОПЯ представлена на рисунках 1–4. Обращает на себя внимание значительный рост уровня общего эндотоксина метроаспиратов в послеоперационном периоде в группах 1 и 2 (ЭВА и МВА, рис. 1, 2) по сравнению с показателями до лечения (р = 0,049 и р = 0,032, соответственно). В группе 3 (ГМ) уровень общего эндотоксина метроаспиратов в динамике в первые сутки после операции достоверно не изменился (р > 0,05) (рис. 3). На рисунке 4 представлено содержание маркеров воспалительного ответа в метроаспиратах и показатель эндометральной микроциркуляции в раннем послеоперационном периоде. При сравнении уровня эндотоксина на первые сутки после операции в группе 3 (ГМ) и группах 1 и 2 (ЭВА и МВА) различия были статистически значимыми (р = 0,014 и p = 0,013, соответственно). Таким образом, эндотоксиновая реакция в эндометрии после вакуум-аспирации ОПЯ значительно выражена.
Исследование цитокинового профиля показало, что исходный средний уровень системных цитокинов во всех группах был в пределах нормальных значений (табл. 2). В первые послеоперационные сутки содержание провоспалительных цитокинов (IL-1β, IL-8, TNF-α) возросло во всех группах, причем в группах 1 и 2 (ЭВА и МВА) отмечено статистически значимое (p = 0,044 и р = 0,014, соответственно) повышение IL-1β при сравнении с показателями до операции (рис. 1, 2), а вот в группе 3 (ГМ, рис. 3) при аналогичном сравнении различия были недостоверны (р = 0,244). Различия уровня IL-1β в трех группах на первые послеоперационные сутки были статистически незначимы (рис. 4).
Изменения уровня IL-8 в первые послеоперационные сутки статистически значимы во всех группах (p = 0,001 для всех групп) при сравнении с показателями до операции (рис. 1–3). В первые послеоперационные сутки различий уровня IL-8 между группами отмечено не было (рис. 4). Во всех группах в первые после-
операционные сутки отмечено статистически значимое повышение уровня TNF-α (p = 0,001 для всех групп) при сравнении с показателями до операции (рис. 1–3). Однако в группе 1 и 2 (ЭВА и МВА) в первые послеоперационные сутки данный показатель повысился статистически значимо сильнее (р = 0,001 и р = 0,001, соответственно), чем в группе ГМ (рис. 4).
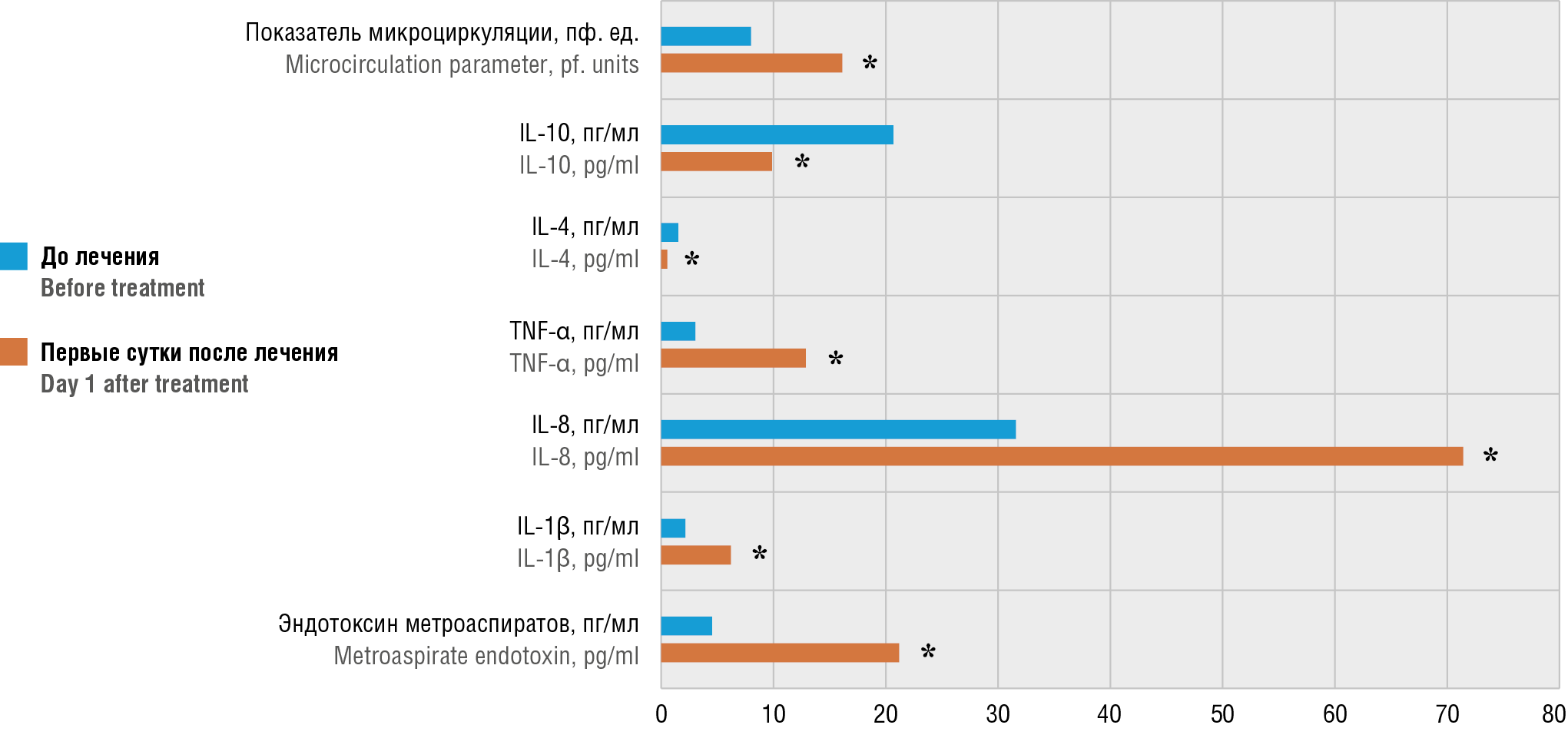
Рисунок 1. Динамика маркеров воспалительного ответа и показателя микроциркуляции в эндометрии в группе пациенток с электромеханической вакуум-аспирацией остатков плодного яйца.
Примечание: IL – интерлейкин; TNF-α – фактор некроза опухоли альфа; *р < 0,05 – различия статистически значимы по сравнению со значениями до лечения.
Figure 1. Dynamics of inflammatory response markers and endometrial microcirculation after electromechanical vacuum aspiration of retained products of conception.
Note: IL – interleukin; TNF-α – tumor necrosis factor alpha; *p < 0.05 – significant differences compared to the values before treatment.
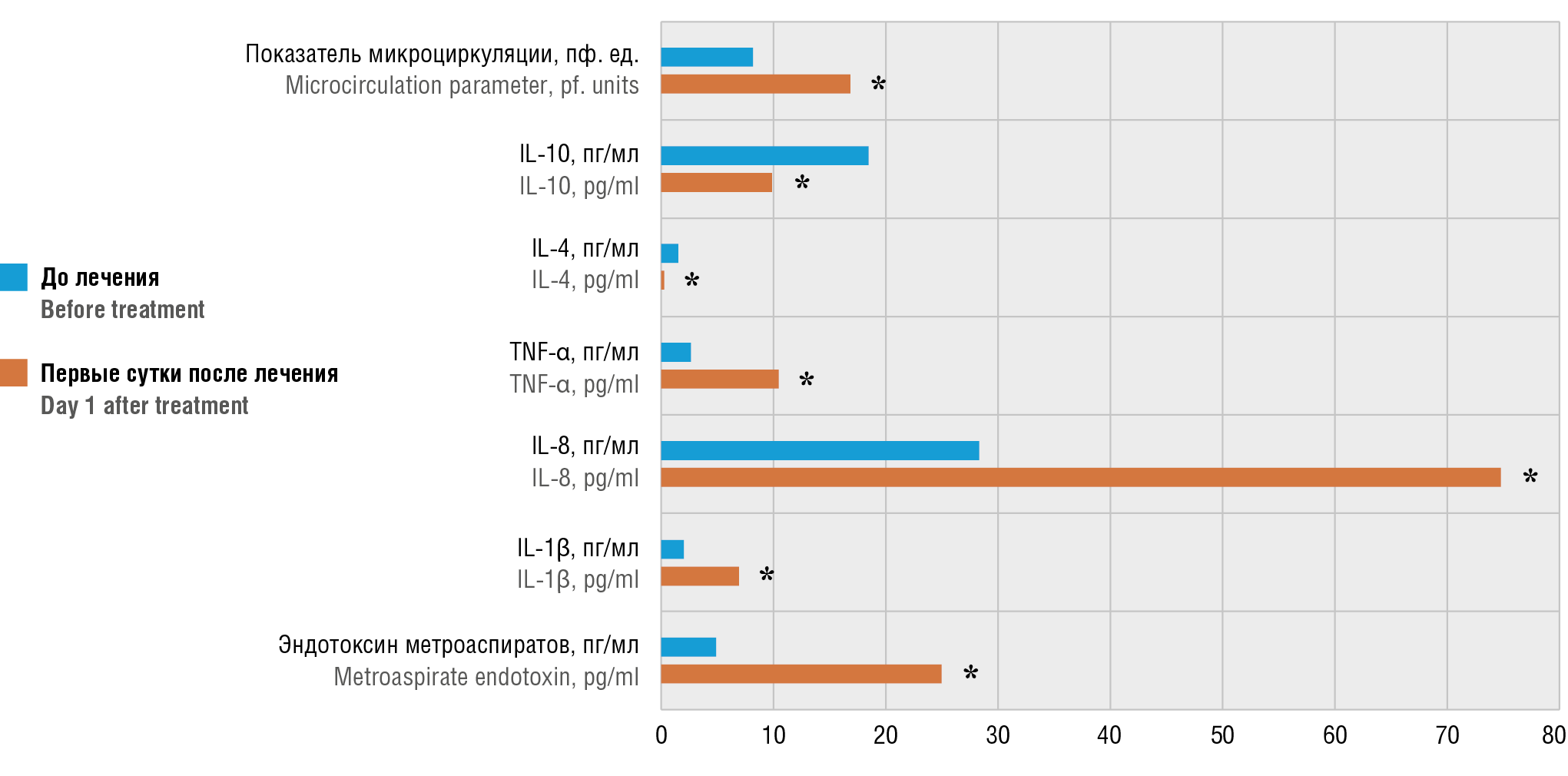
Рисунок 2. Динамика маркеров воспалительного ответа и показателя микроциркуляции в эндометрии в группе пациенток с мануальной вакуум-аспирацией остатков плодного яйца
Примечание: IL – интерлейкин; TNF-α – фактор некроза опухоли альфа; *р < 0,05 – различия статистически значимы по сравнению со значениями до лечения.
Figure 2. Dynamics of inflammatory response markers and endometrial microcirculation after manual vacuum aspiration of retained products of conception.
Note: IL – interleukin; TNF-α – tumor necrosis factor alpha; *p < 0.05 – significant differences compared to the values before treatment.
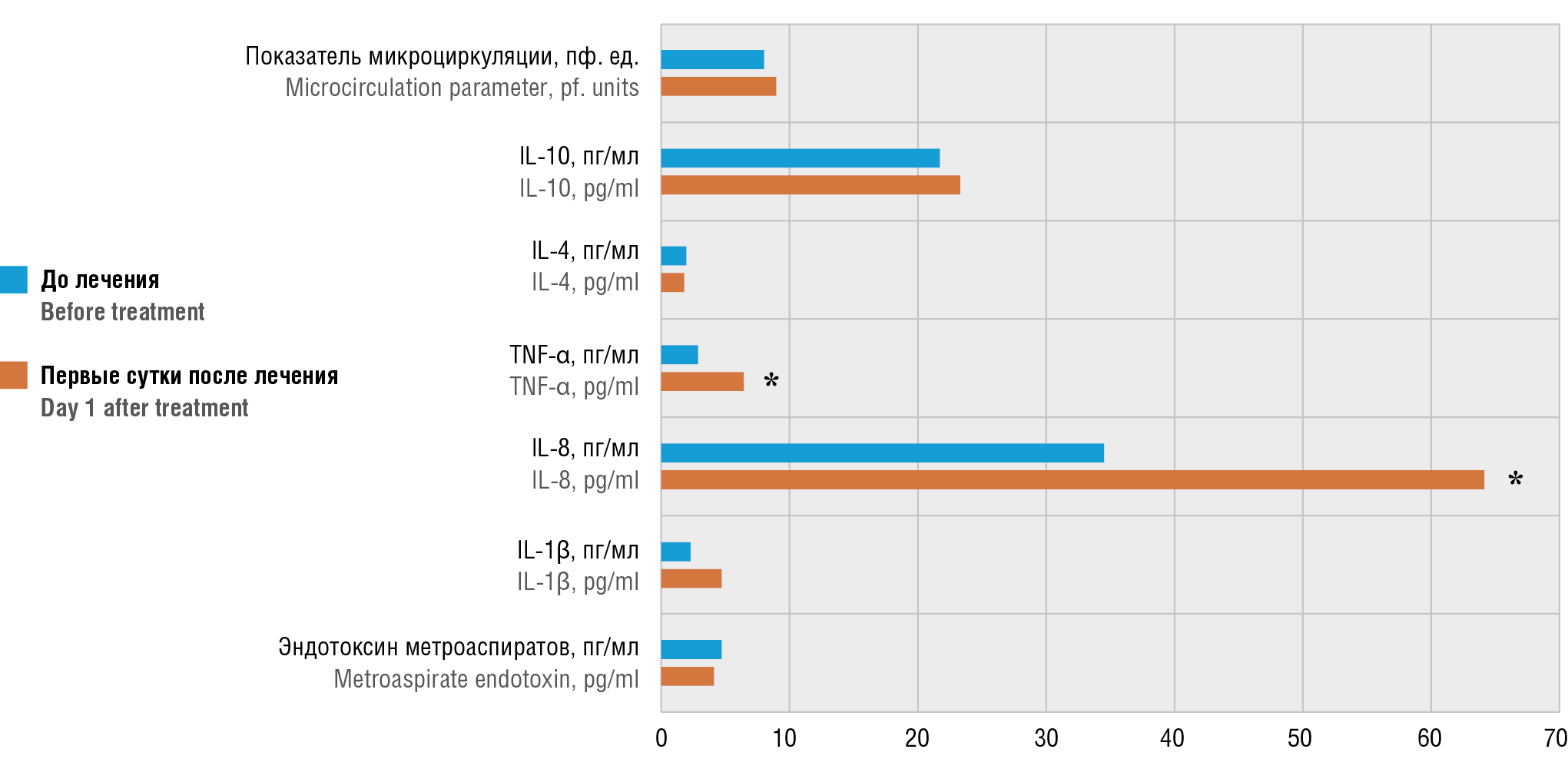
Рисунок 3. Динамика маркеров воспалительного ответа и показателя микроциркуляции в эндометрии в группе пациенток с гистероскопической морцелляцией остатков плодного яйца.
Примечание: IL – интерлейкин; TNF-α – фактор некроза опухоли альфа; *р < 0,05 – различия статистически значимы по сравнению со значениями до лечения.
Figure 3. Dynamics of inflammatory response markers and endometrial microcirculation after hysteroscopic morcellation of retained products of conception.
Note: IL – interleukin; TNF-α – tumor necrosis factor alpha; *p < 0.05 – significant differences compared to the values before treatment.
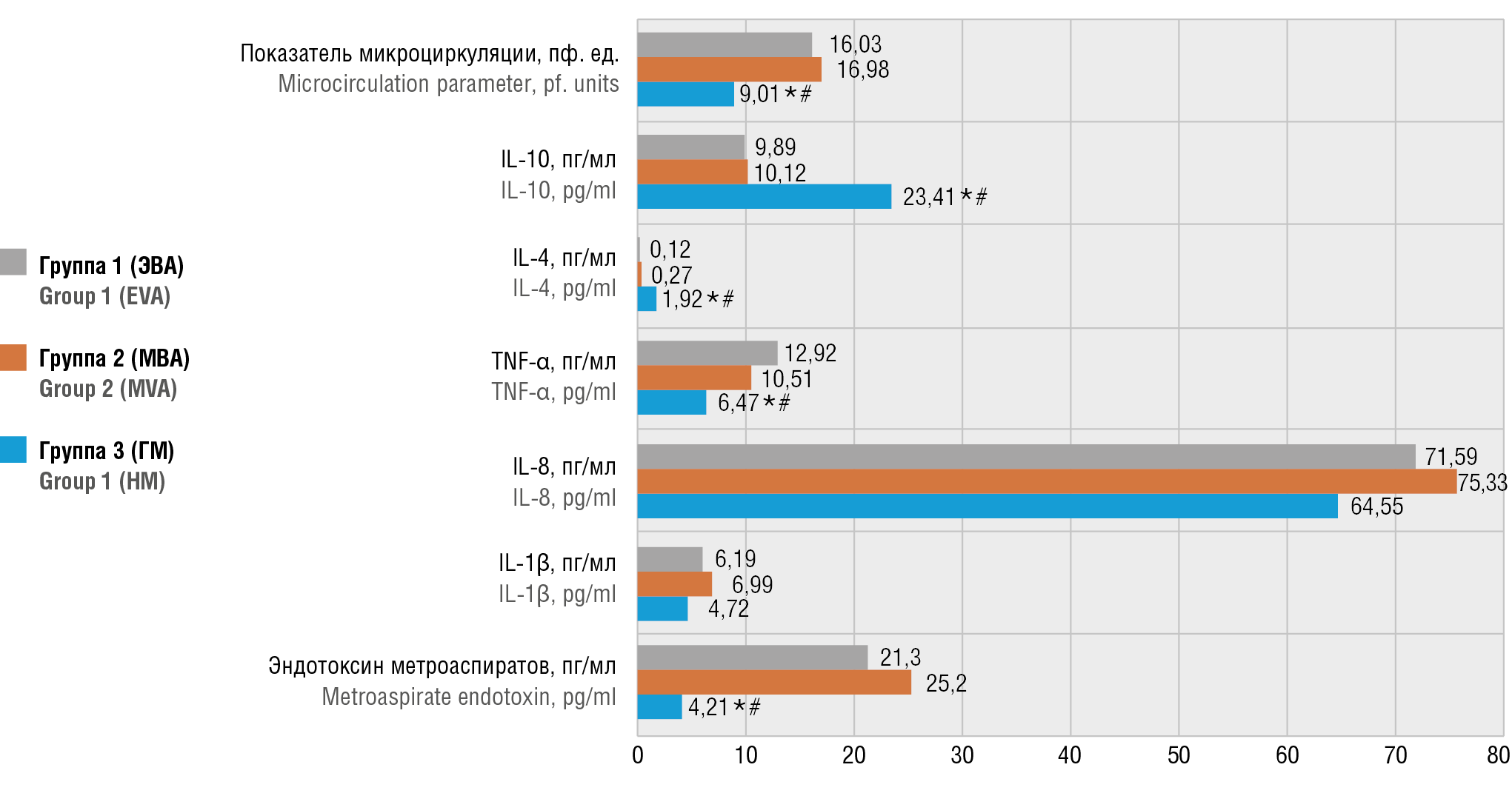
Рисунок 4. Маркеры воспалительного ответа и показатель микроциркуляции в эндометрии в первые сутки после оперативного лечения.
Примечание: IL – интерлейкин; TNF-α – фактор некроза опухоли альфа; *p < 0,0167 – различия статистически значимы по сравнению с группой 1;
#p < 0,0167 – различия статистически значимы по сравнению с группой 2.
Figure 4. Markers of inflammatory response and endometrial microcirculation parameter on day 1 after surgical treatment.
Note: IL – interleukin; TNF-α – tumor necrosis factor alpha;*p < 0.0167 – significant differences compared to group 1; #p < 0.0167 – significant differences compared to group 2.
Уровень противовоспалительных цитокинов (IL-4, IL-10) в группе 1 и 2 (ЭВА и МВА) имел тенденцию к снижению. Различия статистически значимы при сравнении значений IL-4 до лечения и на первые сутки после операции в группах ЭВА (p = 0,001) и МВА (р = 0,001), а также значений IL-10 до лечения и на первые сутки после операции в группах ЭВА (p = 0,001) и МВА (р= 0,001). В группе ГМ уровень противовоспалительных цитокинов значимо не изменился, и на первые послеоперационные сутки был существенно выше, чем в группах ЭВА (p = 0,001 и р = 0,002, соотвественно) и МВА (p = 0,001 для IL-4 и IL-10). Полученные результаты могут свидетельствовать об инициации воспалительной реакции в эндометрии в раннем пос-
леоперационном периоде в ответ на травму при вакуум-аспирации ОПЯ, что, свою очередь, в последующем может быть ассоциировано с формированием внутриматочных синехий.
Кроме того, в группе ЭВА и МВА выявлено значимое увеличение скорости микрокровотока при сравнении с показателями до лечения (p = 0,001 и р = 0,001, соответственно). В группе ГМ скорость микрокровотока значимо не различалась в динамике (р = 0,415). При сравнении показателей микрокровотока в первые пос-
леоперационные сутки в группе ГМ с аналогичными показателями группы ЭВА и МВА различия оказались статистически значимы (р = 0,001 и р = 0,001, соответственно). Увеличение скорости микрокровотока после воздействия вакуум-аспирации также может указывать на развитие эндометрального воспаления.
При контрольном УЗИ у всех пациенток групп ЭВА и ГМ установлена полная элиминация ОПЯ; у 2 (4,5 %) пациенток группы МВА при контрольном УЗИ на 3–5-е сутки после операции выявлено неполное удаление ОПЯ, однако различия между группами статистически незначимы.
Наличие интраоперационного кровотечения, перфорации матки не были отмечены ни у одной пациентки.
Обсуждение / Discussion
Настоящее исследование посвящено изучению эффективности и безопасности различных оперативных способов удаления ОПЯ при самопроизвольном аборте.
Как известно, одним из наиболее грозных осложнений внутриматочного вмешательства является повреждение базального слоя эндометрия, развитие асептического воспаления, что в отсроченной перспективе ведет к формированию внутриматочных синехий, которые являются основной причиной женского бесплодия и невынашивания беременности, что серьезно угрожает здоровью и качеству жизни женщин [20]. Принято считать, что различные факторы, такие как хирургическое вмешательство в полости матки и инфекция вызывают повреждение или травму базального слоя эндометрия, а также инфильтрацию воспалительных клеток в поврежденный участок [21]. В ответ на повреждение тканей иммунокомпетентные клетки, эпителиальные и стромальные клетки способны экспрессировать ряд цитокинов, участуя в процессах репарации эндометрия [22]. Ряд исследований демонстрируют взаимосвязь повышенного уровня провоспалительных цитокинов в эндометрии с развитием фиброза [23]. Адгезивный процесс в полости матки достаточно часто сочетается с хроническим эндометритом. Так, по данным авторов, более чем у 64 % пациенток с выраженными внутриматочными синехиями обнаружены маркеры хронического эндометрита [24]. Стоит отметить, что любой метод, используемый для эвакуации содержимого полости матки, может быть связан с вышеупомянутыми осложнениями. Однако, по некоторым данным, риск осложнений значительно выше у пациенток, которым выполнялось «слепое» выскабливание матки [11, 12, 25].
Результаты крупного метаанализа, проведенного А.В. Hooker с соавт., показали, что по сравнению со «слепым» кюретажем гистероскопическая эвакуация ОПЯ сопровождалась меньшим количеством неполных эвакуаций (29 % против 1 %), внутриматочных спаек (30 % против 13 %), а также тенденцией к более раннему зачатию после гистероскопии [25].
В ретроспективном анализе I. Ben-Ami с соавт. (2014) отметили, что по сравнению с дилатацией и кюретажем гистероскопическое удаление ОПЯ способствовало сокращению времени до последующего зачатия, низкой частоте возникновения бесплодия. По данным авторов, общая частота зачатия после гистероскопической резекции составила 81,1 % по сравнению с 65,4 % после «слепого» внутриматочного вмешательства [13].
Использование ГМ в лечении ОПЯ было описано в литературе совсем недавно [18][26][27]. Результаты одного из исследований, в котором пациентки с ОПЯ были рандомизированы для гистероскопической морцелляции и гистероскопической резекции, продемонстрировали безопасность обоих подходов и высокие показатели полного удаления ткани; однако ГМ выполнялась значительно быстрее, чем петлевая резекция [26].
В отечественной и зарубежной литературе нам не удалось найти исследований, оценивающих выраженность воспалительного ответа в эндометрии при использовании стандартного «слепого» кюретажа (вакуум-аспирации) ОПЯ или оперативной гистероскопии.
По результатам нашего исследования, у пациенток, которым эвакуация ОПЯ проводилась методом ГМ, рост значений эндотоксина и провоспалительного цитокина IL-1β в метроаспиратах в раннем послеоперационном периоде был статистически незначим. Кроме того, мы не обнаружили значимого снижения содержания противовоспалительных цитокинов IL-4 и IL-10. Отсутствовали также достоверные различия в показателях микроциркуляции в эндометрии в пред- и послеоперационном периоде. Напротив, в группах пациенток с вакуумной аспирацией ОПЯ электромеханическим или мануальным способом был отмечен значимый рост общего эндотоксина и провоспалительных цитокинов при снижении противовоспалительных цитокинов, а также изменения микроциркуляции в эндометрии, что может быть предиктором формирования внутриматочных синехий.
Гистероскопическая морцелляция обеспечила полную элиминацию ОПЯ у всех пациенток; у 4,5 % женщин после механической вакуум-аспирации сохранялись ОПЯ, что потребовало повторного внутриматочного вмешательства. По данным T.W. Hamerlynck с соавт., полная элиминация ОПЯ установлена у 94,3 % пациенток при использовании ГМ [12].
Интраоперационное кровотечение, перфорация матки не отмечены ни у одной пациентки. В свою очередь, S.H. Ansari с соавт. сообщали о развитии интраоперационного кровотечения при гистероскопической морцелляции ОПЯ у 4,6 % пациненток [28]. Другие авторы представили единичные случаи использования морцелляции при неполном самопроизвольном аборте и сообщали об отсутствии интра- и послеоперационных осложнений [4][26][27].
Заключение / Conclusion
Ближайшие результаты лечения показали, что удаление ОПЯ с помощью ГМ является оптимальным и эффективным методом лечения. Отсутствие значимого повреждающего воздействия на эндометрий, стабильность микрокровотока и ограниченный воспалительный ответ в эндометрии при использовании ГМ значительно снижают вероятность послеоперационной адгезии.
Таким образом, гистероскопическая морцелляция остатков плодного яйца является предпочтительным методом оперативного лечения при неполном самопроизвольном аборте.
Список литературы
1. Guarino A., Di Benedetto L., Assorgi C. et al. Conservative and timely treatment in retained products of conception: a case report of placenta accreta ritention. Int J Clin Exp Pathol. 2015;8(10):13625–9.
2. Sharma D.P., Choudhary D.V., Rahariya D.P. Overview of retained products of conception and its management. IOSR Journal of Dental and Medical Sciences. 2017;16(4):70–5. https://doi.org/10.9790/0853-1604087075.
3. Smorgick N., Barel O., Fuchs N. et al. Hysteroscopic management of retained products of conception: meta-analysis and literature review. Eur J Obstet Gynecol Reprod Biol. 2014;173:19–22. https://doi.org/10.1016/j.ejogrb.2013.11.020.
4. Sutherland N.S.V., Rajesh H. The intrauterine Bigatti Shaver System: an alternative option for focal retained products of conception. Case Rep Obstet Gynecol. 2018;2018:1536801. https://doi.org/10.1155/2018/1536801.
5. Foreste V., Gallo A., Manzi A. et al. Hysteroscopy and retained products of conception: an update. Gynecol Minim Invasive Ther. 2021;10(4):203–9. https://doi.org/10.4103/GMIT.GMIT_125_20.
6. Munros J., Gracia M., Nonell R. et al. Delayed hysteroscopic removal of retained products of conception is associated with spontaneous expulsion. SRL Reprod Med Gynecol. 2017;3(1):024–028.
7. Hooker A.B., Thurkow A. Asherman’s syndrome after removal of placenta remnants: a serious clinical problem. Gynecol Surg. 2011;8(4):449–53. https://doi.org/10.1007/s10397-011-0677-5.
8. Nanda K., Lopez L.M., Grimes D.A. et al. Expectant care versus surgical treatment for miscarriage. Cochrane Database Syst Rev. 2012;(3):CD003518. https://doi.org/10.1002/14651858.CD003518.pub3.
9. Klement A.H., Frederic M., Bentov Y. et al. Oral contraceptive pills as an option for non-surgical management of retained products of conception – a preliminary study. Gynecol Endocrinol. 2018;34(7):609–11. https://doi.org/10.1080/09513590.2018.1427714.
10. Stewart K.T., Lee J.S., Pan K. et al. Outcome of using vaginal misoprostol for treatment of retained products of conception after first trimester miscarriage: a retrospective cohort study. Eur J Contracept Reprod Health Care. 2020;25(6):474–9. https://doi.org/10.1080/13625187.2020.1807498.
11. Alonso L., Nieto L., Carugno J. Hysteroscopic removal of retained products of conception implanted over a focal area of adenomyosis: a case report. J Minim Invasive Gynecol. 2018;25(3):382–3. https://doi.org/10.1016/j.jmig.2017.09.010.
12. Hamerlynck T.W., Blikkendaal M.D., Schoot B.C. et al. An alternative approach for removal of placental remnants: hysteroscopic morcellation. J Minim Invasive Gynecol. 2013;20(6):796–802. https://doi.org/10.1016/j.jmig.2013.04.024.
13. Ben-Ami I., Melcer Y., Smorgick N. et al. A comparison of reproductive outcomes following hysteroscopic management versus dilatation and curettage of retained products of conception. Int J Gynaecol Obstet. 2014;127(1):86–9. https://doi.org/10.1016/j.ijgo.2014.05.003.
14. Capmas P., Lobersztajn A., Duminil L. et al. Operative hysteroscopy for retained products of conception: efficacy and subsequent fertility. J Gynecol Obstet Hum Reprod. 2019;48(3):151–4. https://doi.org/10.1016/j.jogoh.2018.12.005.
15. Jansen F.W., Vredevoogd C.B., van Ulzen K. et al. Complications of hysteroscopy: a prospective, multicenter study. Obstet Gynecol. 2000;96(2):266–70. https://doi.org/10.1016/s0029-7844(00)00865-6.
16. Gambadauro P., Gudmundsson J., Torrejón R. Intrauterine adhesions following conservative treatment of uterine fibroids. Obstet Gynecol Int. 2012;2012:853269. https://doi.org/10.1155/2012/853269.
17. Mallick R., Middleton B. The use of hysteroscopic morcellation in the outpatient management of retained products of conception. Res Rep Gynaecol Obstet. 2017;1(1):15–7. https://doi.org/10.13140/RG.2.2.27125.17128.
18. Hamerlynck T.W., van Vliet H.A., Beerens A.S. et al. Hysteroscopic morcellation versus lLoop resection for removal of placental remnants: a randomized trial. J Minim Invasive Gynecol. 2016;23(7):1172–80. https://doi.org/10.1016/j.jmig.2016.08.828.
19. Клинические рекомендации – Выкидыш (самопроизвольный аборт) – 2021-2022-2023 (19.01.2023). М.: Министерство здравоохранения Российской Федерации, 2023. 25 с. Режим доступа: http://disuria.ru/_ld/12/1232_kr21O02O05MZ.pdf. [Дата обращения: 31.03.2024].
20. Warembourg S., Huberlant S., Garric X. et al. Prevention and treatment of intra-uterine synechiae: review of the literature. J Gynecol Obstet Biol Reprod (Paris). 2015;44(4):366–79. (In French). https://doi.org/10.1016/j.jgyn.2014.10.014.
21. Thiruchelvam U., Dransfield I., Saunders P.T., Critchley H.O. The importance of the macrophage within the human endometrium. J Leukoc Biol. 2013;93(2):217–25. https://doi.org/10.1189/jlb.0712327.
22. Ge Y., Huang M., Zhu X.M., Yao Y.M. Biological functions and clinical implications of interleukin-34 in inflammatory diseases. Adv Protein Chem Struct Biol. 2020;119:39–3. https://doi.org/10.1016/bs.apcsb.2019.02.003.
23. Wang J., Li D., Pan Y. et al. Interleukin-34 accelerates intrauterine adhesions progress related to CX3CR1+ monocytes/macrophages. Eur J Immunol. 2021;51(10):2501–12. https://doi.org/10.1002/eji.202149174.
24. Wang Z.N., Wang M.S., Xi X. Clinical evidence of positive correlation between intrauterine adhesions and chronic endometritis: a retrospective study. Eur Rev Med Pharmacol Sci. 2023;27(10):4601–7. https://doi.org/10.26355/eurrev_202305_32467.
25. Hooker A.B., Aydin H., Brölmann H.A.M., Huirne J.A.F. Long-term complications and reproductive outcome after the management of retained products of conception: a systematic review. Fertil Steril. 2016;105(1):156– 64e1–2. https://doi.org/10.1016/j.fertnstert.2015.09.021.
26. Tam T., Estes S.J. Hysteroscopic morcellator used in the diagnosis and evacuation of retained products of conception. J Gynecol Surg. 2013;29(6):332–5. https://doi.org/10.1089/gyn.2013.0038.
27. Petrozza J. Removal of retained products of conception using a hysteroscopic morcellator: a safer alternative. J Minim Invasive Gynecol. 2015;22(6):S1–S235. https://doi.org/10.1016/j.jmig.2015.08.489.
28. Ansari S.H., Bigatti G., Aghssa M.M. Operative hysteroscopy with the Bigatti shaver (IBS®) for the removal of placental remnants. Facts Views Vis Obgyn. 2018;10(3):153–9.
Об авторах
И. А. СаловРоссия
Салов Игорь Аркадьевич – д.м.н., профессор, заслуженный врач Российской Федерации, зав. кафедрой акушерства и гинекологии лечебного факультета, директор Университетской клиники акушерства и гинекологии
Scopus Author ID: 6602843316.
Author ID: 428263
410012 Саратов, ул. Большая Казачья, д. 112
Ю. В. Наумова
Россия
Наумова Юлия Владимировна – к.м.н., доцент кафедры акушерства и гинекологии лечебного факультета
410012 Саратов, ул. Большая Казачья, д. 112
М. В. Ломовицкая
Россия
Ломовицкая Марина Владимировна – ординатор кафедры акушерства и гинекологии лечебного факультета
410012 Саратов, ул. Большая Казачья, д. 112
Что уже известно об этой теме?
► Остатки плодного яйца (ОПЯ) выявляются у 10–15 % пациенток после самопроизвольного или медицинского аборта.
► В лечении ОПЯ «слепое» внутриматочное вмешательство до сих пор является «золотым стандартом».
► «Слепое» удаление ОПЯ часто ассоциировано с развитием ряда осложнений, создающих серьезную угрозу фертильности и качеству жизни женщины.
Что нового дает статья?
► Представлены результаты сравнительного анализа применения гистероскопической морцелляции (ГМ) и «слепой» вакуумной аспирации для удаления ОПЯ.
► На основании анализа маркеров воспалительного ответа, микроциркулляции в эндометрии в раннем послеоперационном периоде сделаны выводы о минимальном повреждающем воздействии метода ГМ на эндометрий, что снижает вероятность послеоперационной адгезии.
Как это может повлиять на клиническую практику в обозримом будущем?
► ГМ является эффективным и безопасным способом удаления ОПЯ и может являться предпочтительной альтернативой «слепым» внутриматочным вмешательствам.
Рецензия
Для цитирования:
Салов И.А., Наумова Ю.В., Ломовицкая М.В. Оптимизация внутриматочных вмешательств при самопроизвольном аборте. Акушерство, Гинекология и Репродукция. 2024;18(3):352-364. https://doi.org/10.17749/2313-7347/ob.gyn.rep.2024.522
For citation:
Salov I.A., Naumova I.V., Lomovitskaya M.V. Optimization of intrauterine interventions in spontaneous abortion. Obstetrics, Gynecology and Reproduction. 2024;18(3):352-364. (In Russ.) https://doi.org/10.17749/2313-7347/ob.gyn.rep.2024.522

Контент доступен под лицензией Creative Commons Attribution-NonCommercial-ShareAlike 4.0 International License.











































