Перейти к:
Прогнозирование и ранняя диагностика преэклампсии на основе оценки транскриптомного профиля
https://doi.org/10.17749/2313-7347/ob.gyn.rep.2024.521
Аннотация
Цель: разработать модель прогнозирования преэклампсии (ПЭ) на основании клинически наиболее значимых дифференциально экспрессируемых плазматических микроРНК.
Материалы и методы. Проведено проспективное наблюдательное сравнительное исследование в параллельных группах. В исследование включены 62 женщины, разделенные на 2 группы: 32 пациентки с ПЭ и 30 клинически здоровых женщин с неосложненным течением беременности. Транскриптомный анализ для идентификации дифференциально экспрессируемых микроРНК в плазме крови выполнен с помощью секвенирования нового поколения (англ. next generation sequencing, NGS).
Результаты. Расчет отношений рисков развития ПЭ позволил идентифицировать 14 плазменных микроРНК, оказывающих влияние на развитие ПЭ. Ассоциированные с ПЭ микроРНК hsa-miR-103a-3p, hsa-miR-451а и hsa-miR-516a-5p обладают высокой диагностической ценностью при сочетанном определении уровня их экспрессии в плазме крови беременных на ранних сроках.
Заключение. Разработанная прогностическая модель может быть применена к беременным, входящим в группу риска по развитию ПЭ, что в перспективе позволит снизить акушерские осложнения и улучшить перинатальные исходы.
Ключевые слова
Для цитирования:
Мельник А.В., Соловьева В.Е., Яценко Ю.О., Филиппова А.Е., Асрян Э.Г., Сейтумеров Т.Э., Мышак Е.Р., Чернышева Ю.А., Зиядинова С.А., Кононенко В.О., Кадырова М.Р., Денисенко А.А., Исмагилова К.Т., Мушинский Д.В., Сорокина Л.Е. Прогнозирование и ранняя диагностика преэклампсии на основе оценки транскриптомного профиля. Акушерство, Гинекология и Репродукция. 2024;18(3):316-327. https://doi.org/10.17749/2313-7347/ob.gyn.rep.2024.521
For citation:
Melnik A.V., Solovyova V.E., Yatsenko Yu.O., Filippova A.E., Asryan E.G., Seitumerov T.Е., Myshak E.R., Chernysheva Yu.A., Ziyadinova S.A., Kononenko V.O., Kadyrova M.R., Denisenko A.A., Ismagilova K.T., Mushinsky D.V., Sorokina L.E. Transcriptomic profile assessment for preeclampsia prediction and early diagnostics. Obstetrics, Gynecology and Reproduction. 2024;18(3):316-327. (In Russ.) https://doi.org/10.17749/2313-7347/ob.gyn.rep.2024.521
Введение / Introduction
На сегодняшний день достоверно установлено, что преэклампсия (ПЭ), представляя собой мультифакториальную патологию, является результатом суммарного воздействия различных факторов – генетических, эпигенетических, иммунологических, средовых и др. [1][2]. Учитывая влияние ПЭ на демографические показатели, одной из ключевых задач современной акушерско-гинекологической службы является персонализированное прогнозирование возможных осложнений беременности для минимизации рисков репродуктивных потерь и снижения материнской и перинатальной смертности [3]. Подобная превентивная и риск-ориентированная стратегия при работе с женщинами репродуктивного возраста должна основываться на индивидуальной оценке факторов риска, имеющих теоретическое обоснование с точки зрения доказательной медицины [4][5].
В настоящее время основной сохраняющейся тенденцией является поиск доступных малоинвазивных биомаркеров, с помощью которых можно прогнозировать развитие и тяжесть ПЭ на ранних сроках беременности. При этом фокус большинства современных исследований направлен на изучение комплекса анамнестических, клинических и биохимических предикторов развития данной патологии [6][7]. Несмотря на многолетнюю историю изучения вопроса, недостаток знаний в отношении этиопатогенеза ПЭ все еще остаётся ключевым фактором, значительно ограничивающим возможность эффективного прогнозирования патологии на ранних этапах.
Сегодня благодаря стремительному развитию «омиксных» технологий стало возможным изменить вектор фундаментальных исследований и расширить представления о механизмах развития ПЭ на молекулярном уровне [8].
В этом аспекте особое внимание привлекают молекулы микроРНК, представляющие собой важные элементы посттранскрипционного контроля экспрессии генов в различных клетках и тканях [9]. Экспоненциальный рост числа исследований в области транскриптомики позволил оценить регуляторный потенциал микроРНК в отношении реализации процессов воспаления, оксидантного стресса, клеточного цикла, апоптоза, иммунной и эндотелиальной дисфункции [10]. Указанные биологические процессы традиционно рассматриваются как основные патогенетические звенья плацентарной недостаточности, приводящие к клиническим проявлениям ПЭ.
Принимая во внимание возможность обнаружения микроРНК во всех биологических жидкостях [11], активной областью исследований является поиск и идентификация новых молекул, вовлеченных в развитие ПЭ, которые могли бы стать новыми неинвазивными биомаркерами данной акушерской патологии. Открывающаяся перспектива предоставляет новые возможности не только для разработки инновационных диагностических инструментов ПЭ, но и делает возможным расширение спектра терапевтических возможностей.
Цель: разработать модель прогнозирования ПЭ на основании клинически наиболее значимых дифференциально экспрессируемых плазматических микроРНК.
Материалы и методы / Materials and Methods
Дизайн исследования / Study design
В период 2023–2024 гг. на базе Перинатального центра ГБУЗ РК РКБ им. Н.А. Семашко (Симферополь) выполнено проспективное наблюдательное сравнительное исследование в параллельных группах. Включены 62 беременные, которые в последующем были рандомизированы на 2 группы: группу «пре-
эклампсия» составили 32 пациентки с установленным соответствующим диагнозом [12]; в группу «норма» вошли 30 женщин с неосложненным течением беременности и родов.
Критерии включения и исключения / Inclusion and exclusion criteria
Критерии включения в группу «преэклампсия»: возраст 18–45 лет; установленный диагноз ПЭ; одноплодная беременность; информированное согласие на участие в исследовании.
Критерии включения в группу «норма»: возраст 18–45 лет; неосложненное течение беременности и своевременные роды; информированное согласие на участие в исследовании.
Критерии исключения: возраст менее 18 и более 45 лет; многоплодная беременность; экстрагенитальная патология в стадии декомпенсации; отказ от участия в исследовании.
Методы исследования / Study methods
В ходе работы всем обследованным выполнен общий и гинекологический осмотр, лабораторные и инструментальные исследования, указанные в методических рекомендациях по ведению беременности [12].
Транскриптомный анализ для идентификации дифференциально экспрессируемых микроРНК в плазме крови выполнен с помощью секвенирования нового поколения (англ. next generation sequencing, NGS).
Экстракция РНК из плазмы периферической крови / Peripheral blood plasma RNA isolation
Отбор проб крови для транскриптомного анализа осуществляли в утренние часы натощак с использованием вакуумных систем кубитального доступа в стерильные пробирки типа Vacuette® с антикоагулянтом (Greiner Bio-One, Австрия) в объеме 10 мл. Получение плазмы из венозной крови осуществлялось путем центрифугирования цельных образцов крови в течение 20 мин со скоростью 3000 об/мин. Образцы плазмы замораживались и хранились при температуре –20 °С. Выделение РНК проводилось согласно инструкции фирмы-производителя с использованием набора miRNeasySerum/Plasma Kit (Qiagen, Германия).
Глубокое секвенирование микроРНК / MicroRNA deep sequencing
Библиотеки комплементарной ДНК (кДНК) из выделенных 250 нг суммарной РНК готовили с использованием наборов NEBNext® Multiplex Small RNA Library Prep Set for Illumina® (New England Biolabs, Германия). Глубокое секвенирование выполняли на платформе Illumina NextSeq при использовании соответствующих расходных материалов NextSeq 500/550 High Output v2 kit (llumina, Inc., США). Количество и качество кДНК оценивали с помощью Qubit™ ssDNA Assay Kit (Cat. No. Q10212 Thermo Fisher Scientific, США) и флуориметра Qubit®. Очищенную кДНК-библиотеку секвенировали на платформе MGI DNBSEQ-G400 (BGI, Китай) в режиме SE50. Качество секвенирования оценивали при помощи сервиса Novoalign (http://www.novocraft.com/products/novoalign/) посредством выравнивания нуклеотидных последовательностей против референсного генома, аннотированного в базе miRBase (http://www.mirbase.org).
Этические аспекты / Ethical aspects
Текущая работа выполнена в соответствии с этическими стандартами Хельсинкской декларации Всемирной медицинской ассоциации 1964 г. и ее последующими изменениями. Все участницы исследования подписали добровольное информированное согласие. Проведение исследования одобрено локальным этическим комитетом Ордена Трудового Красного Знамени Медицинского института имени С.И. Георгиевского (структурное подразделение ФГАОУ ВО КФУ имени В.И. Вернадского), протокол № 5 от 23.05.2023.
Методы статистического анализа / Statistic alanalysis
Статистическую обработку полученных данных осуществляли с ипользованием программы Statistica версия 6.0 (StatSoft Inc., США). Форму распределения количественных показателей оценивали с использованием критерия Шапиро–Уилка. При соответствии параметрическому распределению данных использовали параметрический t-критерий Стьюдента и представляли данные в виде среднего арифметического и стандартного отклонения (М ± σ). При несоответствии нормальной форме распределения количественных показателей использовали непараметрический критерий Манна–Уитни и представляли результаты в виде медианы (Ме) и интерквартильного размаха [Q25; Q75]. Сравнение категориальных переменных выполняли с использованием критерия Фишера. В случае ограничений возможности его использования анализ осуществляли с помощью Z-критерия для долей с поправкой для концевых точек. В таблицах и в расчетах приведены абсолютные значения числа вариант (n), их процентные значения (%).
Степень экспрессируемости микроРНК в плазме крови оценивали с использованием двухстороннего теста Вилкоксона–Манна–Уитни. Порог статистической значимости составлял p ≤ 0,05.
Для оценки вклада микроРНК в риск развития ПЭ использовали метод логистической регрессии. Отбор моделей был произведен на основе критерия χ2 для модели в целом, псевдо-коэффициентов детерминации Кокса и Снелла, Нэйджелкерка и критерия Вальда для коэффициентов модели. С целью нивелирования малого размера выборки оценку коэффициентов и уровней значимости проводили с помощью процедуры бутстрепа на основе 1000 выборок.
Прогностическая способность созданных логистических моделей оценена при помощи ROC-анализа (англ. Receiver Operation Characteristic; операционная характеристика приемника) и бинарной логистической регрессии.
Результаты / Results
Характеристика женщин с осложненным и неосложненным течением беременности представлена в таблице 1.
Дебют ПЭ был зарегистрирован в среднем на сроке 33,79 [32,45; 35,12] нед беременности. Манифестация симптомов до 34 нед была отмечена у 4 (12,5 %) пациенток, после 34 нед – у 28 (87,5 %). Большинство беременных с осложненным течением беременности – 29 (90,6 %) имели умеренную форму ПЭ, в то время как тяжелый фенотип был отмечен лишь у 3 (9,4 %) пациенток. Синдром задержки роста плода был диагностирован также у 3 (9,4 %) женщин с ПЭ.
Секвенирование образцов плазмы крови пациенток с ПЭ и женщин с физиологическим течением беременности позволило выявить ряд особенностей на уровне транскриптома. Проведенный расчет отношений рисков развития ПЭ позволил идентифицировать 14 микроРНК, оказывающих влияние на развитие патологии.
Показано, что увеличение экспрессированности miR-103a-3p (р = 0,023), miR-193a-3p (р = 0,023), miR-3179 (р = 0,047), miR-374b-5p (р = 0,048), miR-4433b-5p (р = 0,049), miR-487b-5p (р = 0,024) повышает шансы развития ПЭ. При этом снижение экспрессии miR-18a-5p (р = 0,026), miR-361-3p (р = 0,025), miR-374a-3p (р = 0,025), miR-451a (р = 0,025), miR-516a-5p (р = 0,025), miR-518e-3p (р = 0,027), miR-523-3p (р = 0,027), miR-5582-3p (р = 0,025), напротив, ассоциировано со снижением рисков ПЭ (рис. 1).
С помощью алгоритма пошагового включения/исключения дифференциально экспрессируемых плазматических микроРНК были построены прогностические модели развития ПЭ (табл. 2).
В последующем с использованием ROC-анализа проведена оценка прогностического качества полученных моделей (рис. 2, табл. 3).
Проведенный анализ позволяет сделать вывод, что наибольшей прогностической способностью обладает модель, включающая hsa-miR-103a-3p, hsa-miR-451а и hsa-miR-516a-5p.

Рисунок 1. Сравнительный анализ экспрессии микроРНК.
Примечание: по оси Y указана экспрессия в виде log2CPM – относительный уровень экспрессии в выборке (log2 трансформация); CPM – количество прочтений на миллион.
Figure 1. Comparatively analyzed microRNA expression.
Note: the Y axis shows expression in the form log2CPM – relative expression level in the sample (log2 transformation); CPM – the number of reads per million.
Таблица 1. Клинико-анамнестическая характеристика.
Table 1. Clinical and anamnestic characteristics.
Показатель Parameter | Преэклампсия Preeclampsia n = 32 | Норма Norm n = 30 | p |
Возраст, лет, Me [Q1; Q3] / Age, years, Me [Q1; Q3] | 29,76 [ 27,85; 31,67] | 28,8 [ 25,62; 31,98] | 0,594 |
Индекс массы тела, кг/м2, Me [Q1; Q3] / Body mass index, kg/m2, | 31,17 [ 28,73; 33,62] | 28,17 [ 26,43; 29,90] | 0,045 |
ПЭ в анамнезе, n (%) / PE history, n (%) | 3 (9,4) | 0 (0) | 0,231 |
Пренатальный скрининг: риск ПЭ высокий, n (%) / Prenatal screening: high PE risk, n (%) | 20 (62,5) | 0 (0) | < 0,001 |
Манифестация ПЭ, недель, Me [Q1; Q3] / PE manifestation, gestational age, weeks, Me [Q1; Q3] | 33,79 [ 32,45; 35,12] | – | – |
Ранняя ПЭ, n (%) / Early PE, n (%) | 4 (12,5) | – | – |
Поздняя ПЭ, n (%) / Late PE, n (%) | 28 (87,5) | – | – |
Умеренная ПЭ, n (%) / Moderate PE, n (%) | 29 (90,6) | – | – |
Тяжелая ПЭ, n (%) / Severe PE, n (%) | 3 (9,4) | – | – |
Задержка роста плода, n (%) / Fetal growth retardation, n (%) | 3 (9,4) | – | – |
САД, мм рт. ст., Me [Q1; Q3] / SBP, mm Hg, Me [Q1; Q3] | 145 [ 140,0; 153,5] | 115 [ 110; 120] | < 0,001 |
ДАД, мм рт. ст., Me [Q1; Q3] / DBP, mm Hg, Me [Q1; Q3] | 90 [ 86; 100] | 70 [ 60; 75] | < 0,001 |
Протеинурия, г/л, Me [Q1; Q3] / Proteinuria, g/L, Me [Q1; Q3] | 0,65 [ 0,30; 1,65] | – | – |
Отеки, n (%) / Edema, n (%) | 18 (56,3) | 2 (10,0) | < 0,001 |
Примечание: ИМТ – индекс массы тела; ПЭ – преэклампсия; САД – систолическое артериальное давление; ДАД – диастолическое артериальное давление.
Note: BMI – body mass index; PE – preeclampsia; SBP – systolic blood pressure; DBP – diastolic blood pressure.
Таблица 2. Многофакторные прогностические модели развития преэклампсии.
Table 2. Multivariate predictive models for preeclampsia development.
микроРНК microRNA | Отношение шансов (95 % ДИ)* Odds ratio (95% CI) | р* |
Модель 1 / Model 1 | ||
hsa-miR-103a-3p | 6,43 (6,12–6,81) | 0,006 |
hsa-miR-497-5p | 0,14 (0,13–0,14) | 0,006 |
hsa-miR-516a-5p | 0,16 (0,15–0,16) | 0,006 |
Константа (коэффициент) / Constant (coefficient) | 18,27 | 0,006 |
Модель 2 / Model 2 | ||
hsa-miR-193a-3p | 6,34 (1,39–19,3) | 0,003 |
hsa-miR-5582-3p | 0,16 (0,14–0,80) | 0,003 |
hsa-miR-523-3p | 0,15 (0,14–0,79) | 0,003 |
Константа (коэффициент) / Constant (coefficient) | 18,25 | 0,003 |
Модель 3 / Model 3 | ||
hsa-miR-487b-5p | 1,33 (1,05–6,0) | 0,001 |
hsa-miR-18a-5p | 0,75 (0,12–0,84) | 0,001 |
Константа (коэффициент) / Constant (coefficient) | –0,01 | 0,741 |
Примечание: *оценено с использованием процедуры бутстрепа на основе 1000 выборок.
Note: *estimated using bootstrap procedure based on 1000 samples.
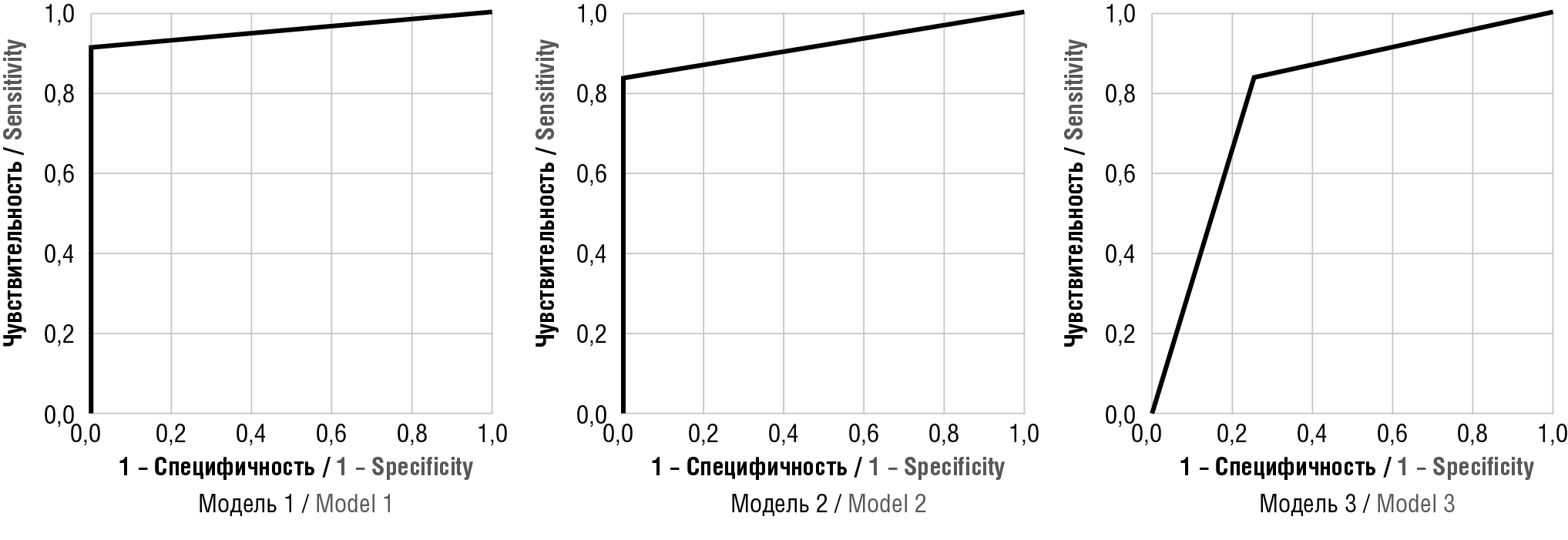
Рисунок 2. ROC-кривые для созданных логистических моделей прогнозирования преэклампсии.
Figure 2. ROC curves for generated preeclampsia prediction logistic models.
Таблица 3. Оценка прогностической способности многофакторных моделей для прогнозирования преэклампсии.
Table 3. Assessing the predictive power of multivariate preeclampsia prediction models
Модель Model | p | R2 Кокса и Снелла Cox and Snell R2 | R2 Нэйджелкерка Nagelkerke R2 | Площадь под ROC-кривой Area under ROC curve | Чувствительность Sensitivity | Специфичность Specificity |
Модель 1 Model 1 | < 0,001 | 0,675 | 0,870 | 0,958 | 0,932 | 1,0 |
Модель 2 Model 2 | < 0,001 | 0,541 | 0,801 | 0,917 | 0,917 | 0,75 |
Модель 3 Model 3 | 0,002 | 0,530 | 0,785 | 0,792 | 0,909 | 0,6 |
Обсуждение / Discussion
В настоящее время ПЭ рассматривается как сложное, мультисистемное и многофакторное состояние. Учитывая вклад ПЭ в показатели материнской и перинательной заболеваемости и смертности, актуальным продолжает быть поиск предикторов для ранней диагностики ПЭ, что даст в перспективе возможность своевременно провести прегравидарную подготовку и комплекс профилактических мероприятий [13].
Накоплен достаточный пул исследований, посвящённых изучению этиологических факторов, лежащих в основе ПЭ: молекулярно-генетических, иммунологических, метаболических и т. д. При этом наиболее обоснованным подходом, безусловно, является поиск патогенетически обоснованных маркеров, вовлеченных в развитие ПЭ [14–17].
Принято считать, что развитие гестационных осложнений напрямую сопряжено с дисрегуляцией таких критических клеточных процессов как пролиферация, миграция, инвазия и апоптоз клеток трофобласта, сопровождающих неправильное развитие и функционирование плаценты во время беременности. С молекулярной точки зрения, ключевое значение в регуляции данных процессов принадлежит микроРНК, экспрессируемым в плаценте. Между тем уровень экспрессии микроРНК определяется рядом других факторов, таких как гипоксия, сигнальные пути или эпигенетические модификации [18–20]. Результаты проведенных исследований подтвердили возможность рассмотрения циркулирующих микроРНК как потенциальных биомаркеров ПЭ и продемонстрировали зависимость диагностической ценности той или иной молекулы от фенотипического варианта патологии [21]. Таким образом, необходимо продолжение исследований для уточнения особенностей патогенеза ПЭ, а также для подтверждения прогностической ценности и способности распознавания микроРНК-кандидатов.
В текущем исследовании с помощью транскриптомного анализа мы исследовали профиль плазматических микроРНК в когорте пациенток с ПЭ в поисках потенциальных новых биомаркеров данного осложнения беременности.
В ходе проведенного глубокого секвенирования были идентифицированы 14 микроРНК, показавших координированную или не полностью координированную аберрантную экспрессию в плазме крови пациенток с ПЭ. При анализе литературных данных было установлено, что большинство из дифференциально экспрессирующихся микроРНК в группе ПЭ ассоциированы с процессом физиологической плацентации и регулируют экспрессию генов, участвующих в пролиферации, дифференцировке, инвазии, миграции, апоптозе и ангиогенезе в ткани трофобласта.
Особый интерес в контексте нашего исследования представляют данные о диагностической ценности hsa-miR-103a-3p, hsa-miR-451а и hsa-miR-516a-5p. Показано, что повышение экспрессированности hsa-miR-103a-3p повышает шансы развития ПЭ, в то время как снижение hsa-miR-451а и hsa-miR-516a-5p, напротив, минимизирует риски формирования патологии.
В отношении miR-103a-3p в литературе имеются указания на вовлеченность данной микроРНК в функционирование кардиоваскулярной системы и почек. В работе китайских коллег показано, что miR-103a-3p в эндотелиальных клетках почечных клубочков оказывает инбигирующее воздействие на экспрессию противовоспалительного гена SNRK. В свою очередь, снижение уровня SNRK было ассоциировано с воспалением и фиброзированием почечной ткани. Авторы указывают, что подобные эффекты опосредуется посредством модулирования активности оси SNRK/NF-κB/p65 [22]. С. Zhang с соавт. в своей работе указывают на кардиопротективный потенциал miR-103a-3p, который проявляется в снижении выраженности процессов апоптоза и аутофагии клеток миокарда в условиях гипоксии. Данный эффект реализуется посредством подавления экспрессии Atg5 и нарушения взаимодействия Bcl-2-Beclin-1 [23]. В другой работе группа ученых под руководством L. He установила, что активация miR-103a-3p приводит к подавлению кальцификации сосудов путем ингибирования активности транскрипционного фактора RUNX2 [24].
Вовлеченность miR-451a в патогенез ПЭ подтверждается данными базы miRWalk, а также рядом отечественных и зарубежных исследований. Так, в работе В.С. Пакина с соавт. у пациенток с гестационным сахарным дебетом была показана аберрантная экспрессия 27 плацентарных микроРНК, при этом только в отношении his-miR-451a были установлены статистически значимые различия [25]. Показано, что гиперэкспрессированность в плацентарной ткани miR-451a у пациенток с ПЭ и гестационным сахарным диабетом может способствовать ингибированию активности PI3K/AKT/mTOR-сигнального пути [26] и VEGF-опосредованного ангиогенеза на фоне нарушения окислительно-восстановительного баланса в условиях гипергликемии [27]. В свою очередь уменьшение экспрессии фактора роста эндотелия сосудов (англ. vascular endothelial growth factor, VEGF) обуславливает нарушение маточно-плацентарного кровотока и приводит к развитию эндотелиальной дисфункции. В in vitro работе O. Ishibashi с соавт. в первичной культуре клеток трофобласта зафиксировано изменение экспрессии под влиянием гипоксии, что может указывать на вовлеченность данной микроРНК в регуляцию оксилительного баланса [28]. В клиническом исследовании A.V. Timofeeva с соавт. одновременное обнаружение 3 микроРНК (let-7d-3p, miR-451a и miR-1307-3p), устойчивых к многократному замораживанию/оттаиванию образцов сыворотки крови, в комплексе с биохимическими маркерами – хорионическим гонадотропином человека (β-ХГЧ) и ассоциированным с беременностью протеином-А плазмы (англ. pregnancy-associated plasma protein-A, РАРР-А) и показателями инструментальных исследований (англ. Umbilical Artery Pulsatility Index, UAPI) позволило авторам создать прогностическую модель ранней и поздней ПЭ [29].
Несколько неожиданными оказались наши результаты в отношении hsa-miR-516a-5p, кодируемой генами, расположенными внутри кластеров хромосомы 19. Примечательно, что различная экспрессия паттернов микроРНК C19MC может характеризовать разные этапы беременности в зависимости от срока гестации и развития ворсинчатого дерева. Установлено, что «отцовский» C19MC кластер преимущественно экспрессируется на ранних этапах развития беременности и ассоциирован с фундаментальными процессами глубокой инвазии трофобласта и ремоделирования спиральных артерий матки. Увеличение экспрессии микроРНК кластера C19MC имеет место в случаях развития гипоксии трофобласта/плаценты, которая, как известно, является неотъемлемым патогенетическим звеном ПЭ [30]. Наши собственные данные не подтвердили наличие гиперэкспрессии miR-516a-5p у беременных с ПЭ в III триместре, что ставит под сомнение возможность изолированного ее использования в качестве маркера развития и прогрессирования данного осложнения беременности.
Таким образом, полученные в текущем исследовании результаты открывают широкие перспективы для раннего эффективного прогнозирования ПЭ с учетом индивидуальных особенностей.
Заключение / Conclusion
МикроРНК представляют собой многообещающие биомаркеры с высоким диагностическим потенциалом, которые могут использоваться в качестве индикаторов для раннего эффективного прогнозирования осложнений беременности.
Ассоциированные с ПЭ микроРНК hsa-miR-103a-3p, hsa-miR-451а и hsa-miR-516a-5p обладают высокой диагностической ценностью при сочетанном определении уровня их экспрессии в плазме крови беременных на ранних сроках.
Разработанная прогностическая модель может быть применена к беременным, входящим в группу риска по развитию ПЭ, что в перспективе позволит снизить акушерские осложнения и улучшить перинатальные исходы.
Список литературы
1. Scholien R.R., Hopman M.T., Sweep F.C. et al. Co-occurrence of cardiovascular and prothrombotic risk factors in women with a history of preeclampsia. Obstet Gynecol. 2013;121(1):97–105. https://doi.org/10.1097/aog.0b013e318273764b.
2. Белокриницкая Т.Е., Фролова Н.И., Анохова Л.И. Молекулярно-генетические предикторы осложнений беременности. Новосибирск: Наука, 2019. 188 с.
3. The global strategy for women’s, children’s and adolescents’ health (2016-2030). New York: United Nations, 2015. 108 p. Режим доступа: https://www.who.int/docs/default-source/child-health/the-global-strategy-for-women-s-children-s-and-adolescents-health-2016-2030.pdf. [Дата доступа: 20.04.2024].
4. Mészáros B., Kukor Z., Valent S. Recent advances in the prevention and screening of preeclampsia. J Clin Med. 2023;12(18):6020. https://doi.org/10.3390/jcm12186020.
5. ACOG Practice Bulletin No. 202: Gestational Hypertension and Preeclampsia. Obstet Gynecol. 2019;133(1):1. https://doi.org/10.1097/AOG.0000000000003018.
6. Tiruneh S.A., Vu T.T.T., Moran L.J. et al. Externally validated prediction models for pre-eclampsia: systematic review and meta-analysis. Ultrasound Obstet Gynecol. 2024;63(5):592–604. https://doi.org/10.1002/uog.27490.
7. Danielli M., Thomas R.C., Gillies C.L. et al. Blood biomarkers to predict the onset of pre-eclampsia: a systematic review and meta-analysis. Heliyon. 2022;8(11):e11226. https://doi.org/10.1016/j.heliyon.2022.e11226.
8. Roberts J.M., Rich-Edwards J.W., McElrath T.F. et al; Global Pregnancy Collaboration. Subtypes of preeclampsia: recognition and determining clinical usefulness. Hypertension. 2021;77(5):1430–41. https://doi.org/10.1161/HYPERTENSIONAHA.120.14781.
9. Xie G., Chen H., He C. et al. The dysregulation of miRNAs in epilepsy and their regulatory role in inflammation and apoptosis. Funct Integr Genomics. 2023;23(3):287. https://doi.org/10.1007/s10142-023-01220-y.
10. Redman C.W.G., Staff A.C., Roberts J.M. Syncytiotrophoblast stress in preeclampsia: the convergence point for multiple pathways. Am J Obstet Gynecol. 2022;226(2S):S907–S927. https://doi.org/10.1016/j.ajog.2020.09.047.
11. Гареев И.Ф., Бейлерли О.А. Циркулирующие микроРНК как биомаркеры: какие перспективы? Профилактическая медицина. 2018;21(6):142–50. https://doi.org/10.17116/profmed201821061142.
12. Клинические рекомендации – Преэклампсия. Эклампсия. Отеки, протеинурия и гипертензивные расстройства во время беременности, в родах и послеродовом периоде – 2021-2022-2023 (24.06.2021). М.: Министерство здравоохранения Россиийской Федерации, 2021. 54 с. Режим доступа: https://cr.minzdrav.gov.ru/recomend/637_1. [Дата доступа: 20.04.2024].
13. Laasanen J., Romppanen E.L., Hiltunen M. et al. Two exonic single nucleotide polymorphisms in the microsomal epoxide hydrolase gene are jointly associated with preeclampsia. Eur J Hum Genet. 2002;10(9):569–73. https://doi.org/10.1038/sj.ejhg.5200849.
14. Timofeeva A.V., Gusar V.A., Kan N.E. et al. Identification of potential early biomarkers of preeclampsia. Placenta. 2018;61:61–71. https://doi.org/10.1016/j.placenta.2017.11.011.
15. Iacobelli S., Bonsante F., Robillard P.-V. Comparison of risk factors and perinatal outcomes in early onset and late onset preeclampsia: a cohort based study in Reunion Island. J Reprod Immunol. 2017;123:12–6. https://doi.org/10.1016/j.jri.2017.08.005.
16. Jardim L., Rios D., Perucci L. et al. Is the imbalance between pro-angiogenic and anti-angiogenic factors associated with preeclampsia? Clini Chim Acta. 2015;447:34–8. https://doi.org/10.1016/j.cca.2015.05.004.
17. Panaitescu A., Syngelaki A., Prodan N. et al. Chronic hypertension and adverse pregnancy outcome: a cohort study. Ultrasound Obstet Gynecol. 2017;50(2):228–35. https://doi.org/10.1002/uog.17554.
18. Donker R.B., Mouillet J.-F., Nelson D.M., Sadovsky Y. The expression of Argonaute2 and related microRNA biogenesis proteins in normal and hypoxic trophoblasts. Mol Hum Reprod. 2007;13(4):273–9. https://doi.org/10.1093/molehr/gam006.
19. Ji L., Brkić J., Liu M. et al. Placental trophoblast cell differentiation: physiological regulation and pathological relevance to preeclampsia. Mol Asp Med. 2013;34(5):981–1023. https://doi.org/10.1016/j.mam.2012.12.008.
20. Seitz H., Royo H., Bortolin M.-L. et al. A large imprinted microRNA gene cluster at the mouse Dlk1-Gtl2 domain. Genome Res. 2004;14(9):1741–8. https://doi.org/10.1101/gr.2743304.
21. Yin Y., Liu M., Yu H. et al. Circulating microRNAs as biomarkers for diagnosis and prediction of preeclampsia: a systematic review and meta-analysis. Eur J Obstet Gynecol Reprod Biol. 2020;253:121–32. https://doi.org/10.1016/j.ejogrb.2020.08.016.
22. Lu Q., Ma Z., Ding Y. et al. Circulating miR-103a-3p contributes to angiotensin II-induced renal inflammation and fibrosis via a SNRK/NF-κB/p65 regulatory axis. Nat Commun. 2019;10(1):2145. https://doi.org/10.1038/s41467-019-10116-0.
23. Zhang C., Zhang C., Wang H. et al. Effects of miR-103a-3p on the autophagy and apoptosis of cardiomyocytes by regulating Atg5. Int J Mol Med. 2019;43(5):1951–60. https://doi.org/10.3892/ijmm.2019.4128.
24. He L., Xu J., Bai Y. et al. MicroRNA-103a regulates the calcification of vascular smooth muscle cells by targeting runt-related transcription factor 2 in high phosphorus conditions. Exp Ther Med. 2021;22(3):1036. https://doi.org/10.3892/etm.2021.10468.
25. Пакин В.С., Вашукова Е.С., Капустин Р.В. и др. Оценка уровня микроРНК в плаценте при тяжелом гестозе на фоне гестационного сахарного диабета. Журнал акушерства и женских болезней. 2017;66(3):110–5. https://doi.org/10.17816/JOWD663110-115.
26. Li T., Mo X., Fu L. et al. Molecular mechanisms of long noncoding RNAs on gastric cancer. Oncotarget. 2016;7(8):8601–12. https://doi.org/10.18632/oncotarget.6926.
27. Madsen H., Ditzel J. Blood-oxygen transport in first trimester of diabetic pregnancy. Acta Obstet Gynecol Scand. 1984;63(4):317–20. https://doi.org/10.3109/00016348409155523.
28. Ishibashi O., Ohkuchi A., Ali M.M. et al. Hydroxysteroid (17-β) dehydrogenase 1 is dysregulated by miR-210 and miR-518c that are aberrantly expressed in preeclamptic placentas: a novel marker for predicting preeclampsia. Hypertension. 2012;59(2):265–73. https://doi.org/10.1161/HYPERTENSIONAHA.111.180232.
29. Timofeeva A.V., Fedorov I.S., Sukhova Y.V. et al. Prediction of early- and late-onset pre-eclampsia in the preclinical stage via placenta-specific extracellular miRNA profiling. Int J Mol Sci. 2023;24(9):8006. https://doi.org/10.3390/ijms24098006.
30. Inno R., Kikas T., Lillepea K., Laan M. Coordinated expressional landscape of the human placental miRNome and transcriptome. Front Cell Dev Biol. 2021;9:697947. https://doi.org/10.3389/fcell.2021.697947.
Об авторах
А. В. МельникРоссия
Мельник Анастасия Викторовна – студент 6-го курса 2-го Медицинского факультета Ордена Трудового Красного Знамени Медицинского института имени С.И. Георгиевского
295051 Симферополь, бульвар Ленина, д. 5/7
В. Е. Соловьева
Россия
Соловьева Валерия Евгеньевна – студент 6-го курса 1-го Медицинского факультета Ордена Трудового Красного Знамени Медицинского института имени С.И. Георгиевского
295051 Симферополь, бульвар Ленина, д. 5/7
Ю. О. Яценко
Россия
Яценко Юлия Олеговна – студент 6-го курса 2-го Медицинского факультета Ордена Трудового Красного Знамени Медицинского института имени С.И. Георгиевского
295051 Симферополь, бульвар Ленина, д. 5/7
А. Е. Филиппова
Россия
Филиппова Анна Евгеньевна – студент 6-го курса 2-го Медицинского факультета Ордена Трудового Красного Знамени Медицинского института имени С.И. Георгиевского
295051 Симферополь, бульвар Ленина, д. 5/7
Э. Г. Асрян
Россия
Асрян Элен Гегамовна – студент 6-го курса 2-го Медицинского факультета Ордена Трудового Красного Знамени Медицинского института имени С.И. Георгиевского
295051 Симферополь, бульвар Ленина, д. 5/7
Т. Э. Сейтумеров
Россия
Сейтумеров Таир Эдемович – студент 6-го курса 2-го Медицинского факультета Ордена Трудового Красного Знамени Медицинского института имени С.И. Георгиевского
295051 Симферополь, бульвар Ленина, д. 5/7
Е. Р. Мышак
Россия
Мышак Елена Руслановна – студент 6-го курса 1-го Медицинского факультета Ордена Трудового Красного Знамени Медицинского института имени С.И. Георгиевского
295051 Симферополь, бульвар Ленина, д. 5/7
Ю. А. Чернышева
Россия
Чернышева Юлия Александровна – студент 6-го курса 1-го Медицинского факультета Ордена Трудового Красного Знамени Медицинского института имени С.И. Георгиевского
295051 Симферополь, бульвар Ленина, д. 5/7
С. А. Зиядинова
Россия
Зиядинова Севиля Айдеровна – студент 6-го курса 1-го Медицинского факультета Ордена Трудового Красного Знамени Медицинского института имени С.И. Георгиевского
295051 Симферополь, бульвар Ленина, д. 5/7
В. О. Кононенко
Россия
Кононенко Владислава Олеговна – студент 6-го курса 1-го Медицинского факультета Ордена Трудового Красного Знамени Медицинского института имени С.И. Георгиевского
295051 Симферополь, бульвар Ленина, д. 5/7
М. Р. Кадырова
Россия
Кадырова Медине Ренатовна – студент 6-го курса 1-го Медицинского факультета Ордена Трудового Красного Знамени Медицинского института имени С.И. Георгиевского
295051 Симферополь, бульвар Ленина, д. 5/7
А. А. Денисенко
Россия
Алина Алексеевна Денисенко – студент 6-го курса 1-го Медицинского факультета Ордена Трудового Красного Знамени Медицинского института имени С.И. Георгиевского
295051 Симферополь, бульвар Ленина, д. 5/7
К. Т. Исмагилова
Россия
Исмагилова Карина Тахировна – студент 6-го курса 2-го Медицинского факультета Ордена Трудового Красного Знамени Медицинского института имени С.И. Георгиевского
295051 Симферополь, бульвар Ленина, д. 5/7
Д. В. Мушинский
Россия
Мушинский Даниил Викторович – студент 6-го курса 2-го Медицинского факультета Ордена Трудового Красного Знамени Медицинского института имени С.И. Георгиевского
295051 Симферополь, бульвар Ленина, д. 5/7
Л. Е. Сорокина
Россия
Сорокина Лея Евгеньевна – младший научный сотрудник лаборатории цитологии ФГБУ «Национальный медицинский исследовательский центр акушерства, гинекологии и перинатологии имени академика В.И. Кулакова» Министерства здравоохранения Российской Федерации; врач аллерголог- иммунолог ЗАО «Медицинский центр в Коломенском»
117997 Москва, ул. Академика Опарина, д. 4;
115533 Москва, ул. Высокая, д. 19, корп. 2
Что уже известно об этой теме?
► Преэклампсия (ПЭ) представляет собой мультифакториальную патологию и является результатом суммарного воздействия различных факторов (генетических, эпигенетических, иммунологических, средовых и др.).
► Основной тенденцией в настоящее время является поиск анамнестических, клинических и биохимических предикторов развития данной патологии, в частности, доступных в применении на практике биомаркеров, с помощью которых можно прогнозировать развитие и тяжесть ПЭ на ранних сроках беременности.
► Принимая во внимание широкий функциональный потенциал микроРНК, активной областью исследований является поиск и идентификация новых молекул, вовлеченных в развитие ПЭ.
Что нового дает статья?
► Показано, что ПЭ характеризуется специфическими молекулярными изменениями на уровне транскриптома.
► Установлена высокая прогностическая ценность молекул hsa-miR-103a-3p, hsa-miR-451а и hsa-miR-516a-5p, вовлеченных в патогенез ПЭ.
► Разработана прогностическая модель развития ПЭ на основании клинически наиболее значимых дифференциально экспрессируемых плазматических микроРНК.
Как это может повлиять на клиническую практику в обозримом будущем?
► МикроРНК представляют собой многообещающие биомаркеры с хорошим диагностическим потенциалом для внедрения в программу скрининга для прогнозирования ПЭ и могут использоваться в качестве чувствительного индикатора для клинического прогнозирования осложнений беременности.
► Разработанная логистическая модель может быть применена для прогнозирования и ранней диагностики ПЭ, что в перспективе позволит снизить акушерские осложнения и улучшить перинатальные исходы.
Рецензия
Для цитирования:
Мельник А.В., Соловьева В.Е., Яценко Ю.О., Филиппова А.Е., Асрян Э.Г., Сейтумеров Т.Э., Мышак Е.Р., Чернышева Ю.А., Зиядинова С.А., Кононенко В.О., Кадырова М.Р., Денисенко А.А., Исмагилова К.Т., Мушинский Д.В., Сорокина Л.Е. Прогнозирование и ранняя диагностика преэклампсии на основе оценки транскриптомного профиля. Акушерство, Гинекология и Репродукция. 2024;18(3):316-327. https://doi.org/10.17749/2313-7347/ob.gyn.rep.2024.521
For citation:
Melnik A.V., Solovyova V.E., Yatsenko Yu.O., Filippova A.E., Asryan E.G., Seitumerov T.Е., Myshak E.R., Chernysheva Yu.A., Ziyadinova S.A., Kononenko V.O., Kadyrova M.R., Denisenko A.A., Ismagilova K.T., Mushinsky D.V., Sorokina L.E. Transcriptomic profile assessment for preeclampsia prediction and early diagnostics. Obstetrics, Gynecology and Reproduction. 2024;18(3):316-327. (In Russ.) https://doi.org/10.17749/2313-7347/ob.gyn.rep.2024.521

Контент доступен под лицензией Creative Commons Attribution-NonCommercial-ShareAlike 4.0 International License.










































