Перейти к:
Частота обнаружения и длительность циркуляции маркеров антифосфолипидного синдрома у пациентов с подтвержденным диагнозом COVID-19
https://doi.org/10.17749/2313-7347/ob.gyn.rep.2024.504
Аннотация
Цель: разработать иммуноферментные тесты для определения маркеров антифосфолипидного синдрома (АФС) и определить частоту обнаружения трех типов антифосфолипидных антител (аФЛ) у пациентов с COVID-19 на разных стадиях заболевания.
Материалы и методы. Проведено сравнительное продольное контролируемое исследование, обследованы 120 человек с диагнозом COVID-19, подтвержденным с помощью полимеразной цепной реакции с обратной транскрипцией. В качестве контрольной группы использовали образцы сыворотки крови доноров, собранные до ноября 2019 г. Лабораторное исследование включало определение IgA, IgM и IgG к кардиолипину, β2-гликопротеину 1 (англ. β2-glycoprotein 1, β2-GP1), фосфатидилсерин-протромбиновому комплексу (англ. phosphatidylserine-prothrombin complex, PS-PT) с использованием тест-систем отечественного производства на основе непрямого двухстадийного иммуноферментного анализа.
Результаты. Валидация разработанных экспериментальных тестов проведена в сравнении с коммерческими аналогами зарубежного производства и относительно международных стандартов. Изучены альтернативные антигенные мишени для эффективной диагностики антител к β2-GP1. Анализ частоты обнаружения аФЛ у пациентов на разных стадиях COVID-19 показал, что аутоантитела среди пациентов в острой фазе встречались в 1,3 раза чаще, чем в стадии реконвалесценции (81,7 и 65,0 % соответственно). Первое ранговое место по частоте обнаружения занимали IgG к β2-GP1, кардиолипину и PS-PT, второе – IgM к кардиолипину. Профиль выявляемых аФЛ изменялся в зависимости от стадии заболевания и времени, прошедшего от момента постановки диагноза.
Заключение. Созданы рекомбинантные конструкции и оптимизированы условия проведения анализа для определения различных типов аФЛ. Показано, что наравне с другими вирусными инфекциями COVID-19 является триггером выработки аутоантител. У 54,2 % лиц, инфицированных SARS-CoV-2, обнаруживался как минимум один тип аутоантител. Большинство из этих вирус-ассоциированных аФЛ предположительно являются транзиторно позитивными.
Ключевые слова
Для цитирования:
Михайлова Ю.В., Чепурченко Н.В., Обрядина А.П. Частота обнаружения и длительность циркуляции маркеров антифосфолипидного синдрома у пациентов с подтвержденным диагнозом COVID-19. Акушерство, Гинекология и Репродукция. 2024;18(2):180-187. https://doi.org/10.17749/2313-7347/ob.gyn.rep.2024.504
For citation:
Mikhailova Yu.V., Chepurchenko N.V., Obriadina A.P. Detection frequency and duration of circulating antiphospholipid syndrome markers in patients with verified COVID-19. Obstetrics, Gynecology and Reproduction. 2024;18(2):180-187. (In Russ.) https://doi.org/10.17749/2313-7347/ob.gyn.rep.2024.504
Введение / Introduction
Антифосфолипидный синдром (АФС) является приобретенным и потенциально опасным для жизни пациентов симптомокомплексом, который обусловлен синтезом антифосфолипидных антител (аФЛ). Одними из триггеров развития АФС являются инфекционные заболевания [1]. В настоящее время описаны случаи выявления аФЛ у больных COVID-19, что свидетельствует о высоком риске возникновения артериальных и венозных тромбозов у таких пациентов [2][3]. Показано сродство диффузной коагулопатии при COVID-19 с развитием катастрофического АФС, который часто заканчивается фатально [2].
Согласно международным рекомендациям (XI Международный конгресс по аФЛ, 2006, Сидней) лабораторным критерием АФС является выявление волчаночного антикоагулянта (ВА) и/или антикардиолипиновых антител IgG/IgM (англ. anti-cardiolipin antibodies, aCL) и/или антител к β2-гликопротеину 1 (англ. anti-β2-glycoprotein 1 antibodies, аβ2-GP1) IgG/IgM. В качестве дополнительного исследования при подозрении на АФС и отрицательных результатов на вышеуказанные маркеры рекомендуется определение aCL IgA и аβ2-GP1 IgA [4–6]. Значительный интерес в качестве более специфичного маркера АФС представляют антитела к отдельным доменам (D) β2-GP1. Так, субпопуляция антител к D1 (аD1-β2-GP1) предполагается в основном ответственной за развитие тромбозов при АФС [7][8]. Доказательное значение в диагностике АФС антител к другим фосфолипидам и кофакторным белкам, таким как фосфотидилсерин-протромбиновый комплекс (англ. phosphatidylserine-prothrombin complex, PS-PT) в настоящий момент рассматривается. В ряде случаев обнаружение этих антител рассматривается как «пре-АФС»/«вероятный АФС» и предшествует развитию тромботических осложнений [9]. Определенный профиль аФЛ может быть идентифицирован как высокий/низкий риск последующего развития тромбозов, а также может коррелировать с тяжестью течения заболевания [10][11].
К настоящему времени отечественному здравоохранению доступен целый ряд зарубежных коммерческих тестов, и практически нет отечественных аналогов для определения аФЛ. Вместе с тем стандартизация и сходимость результатов лабораторных тестов разных производителей по отдельным маркерам АФС остаются существенной проблемой, что ведет к ошибкам в диагностике аутоантител. Расхождение результатов тестирования на наличие аФЛ обусловлено гетерогенностью методик выявления, вариабельностью используемых реагентов, отсутствием общепризнанных международных стандартов и единиц измерения концентрации аутоантител [12].
Цель: разработать иммуноферментные тесты для определения маркеров АФС и определить частоту обнаружения трех типов аФЛ у пациентов с COVID-19 на разных стадиях заболевания.
Материалы и методы / Materials and Methods
Дизайн исследования / Study design
Проведено сравнительное продольное контролируемое исследование, обследованы 120 человек в возрасте 18–67 лет с диагнозом COVID-19, подтвержденным с помощью полимеразной цепной реакции с обратной транскрипцией (ОТ-ПЦР). У большинства пациентов заболевание протекало в среднетяжелой (68,5 %) или легкой форме (26,2 %), тяжелая форма COVID-19 установлена у 3,0 % обследованных, и в 2,3 % случаев инфекция протекала бессимптомно. Больные в острой фазе COVID-19 проходили лечение в амбулаторных условиях или наблюдались в стационаре (на базе ФБУЗ «Приволжский окружной медицинский центр» ФМБА, Нижний Новгород), сбор клинического материала для исследования проводили на сроке 2–4 недели от постановки диагноза. Реконвалесценты COVID-19 (доноры ГБУЗ «Оренбургская областная клиническая станция переливания крови», Оренбург) были обследованы в динамике: через 1,5, 3,5 и 9 мес от постановки диагноза. Данные о сроках инфицирования взяты из анамнеза пациентов. В качестве контрольной группы использовали 60 образцов сыворотки крови доноров, собранные до ноября 2019 г.
Методы исследования / Study methods
Лабораторное исследование включало определение антител классов IgA, IgM и IgG к кардиолипину, β2-GP1, PS-PT. Для определения данных аФЛ на базе ООО «НПО «Диагностические системы» были разработаны экспериментальные наборы реагентов на основе непрямого двухстадийного иммуноферментного анализа (ИФА).
Валидация экспериментальных тестов для выявления разных типов аФЛ проведена на образцах сывороток крови от больных первичным и вторичным АФС (n = 70); с системными ревматоидными заболеваниями (n = 10); с инфекционными заболеваниями разной этиологии (n = 251); от беременных с патологией на фоне АФС (n = 10); содержащие ревматоидный фактор (n = 11); от доноров (случайная выборка, n = 201). Было проведено сравнение с коммерческими аналогами производства Orgentec Diagnostika GmbH (Германия), Euroimune AG (Германия), Innova Diagnostics Inc. (США). Калибраторы аттестованы относительно E.N. Harris стандарта (Louisville APL Diagnostics, США) и IgG Sapporo стандарта (HCAL, Werfen, Австралия) с использованием коллекции образцов, аттестованных в референс-тесте – Orgentec Diagnostika. Положительными считали результаты проведенного ИФА-теста на аФЛ при пороговом значении выше 99-го перцентиля для каждого из выявляемых маркеров АФС.
Использование тестирования на аD1-β2-GP1 в качестве более специфичного маркера АФС затруднено низкой сходимостью результатов между существующими немногочисленными коммерческими наборами [8]. Так, несомненный интерес представляет поиск альтернативных эпитопов/доменов β2-GP1 в качестве диагностически эффективных мишеней для детекции аутоантител. Предполагается, что сигнальный пептид P1, содержащий аФЛ-связывающий мотив и не присутствующий в зрелом β2-GP1, способен вызывать аутоиммунные реакции. В работе P. de Moerloose с соавт. (2017) показано, что CD4+ Т-клетки были способны распознавать последовательность Р1 [13].
Для этой цели были изучены потенциальные антигенные эпитопы β2-GP1, смоделированные с помощью рекомбинантных белков (n = 12) и синтетических пептидов (n = 3). Выбор и создание возможных иммунологически значимых областей β2-GP1 проведены на основании данных, опубликованных в базах PubMed Национального центра биотехнологической информации США (англ. National Center for Biotechnology Information, NCBI) и GenBank NCBI. Для дальнейшей работы в качестве перспективных были отобраны 4 последовательности, оптимизированы условия проведения ИФА индивидуально для каждой из этих конструкций. Для верификации созданных конструкций, содержащих в своем составе последовательности белка β2-GP1, были использованы: 34 образца сыворотки крови, содержащие аβ2-GP1 (аттестованные как положительные в тестах Orgentec, Euroimune, Innova Diagnostics); 5 образцов, содержащих аD1-β2-GP1 (аттестованные как положительные в тесте Innova Diagnostics); 46 образцов от доноров крови.
Этические аспекты / Ethical aspects
Все процедуры, выполненные в данном исследовании, соответствуют этическим стандартам Хельсинкской декларации 1964 г. и ее последующим изменениям или сопоставимым нормам этики. Клинический материал для исследования представлял собой не персонализированные остаточные образцы, полученные в ходе рутинного тестирования, или архивные образцы из банка образцов предприятия (ООО «НПО «Диагностические системы»). Добровольное информированное согласие от пациентов получено в начале лечебно-диагностического процесса по месту лечения.
Статистический анализ / Statistical alanalysis
Аккумулирование базы собранных клинических данных выполнялось с помощью электронной таблицы Microsoft Excel. Статистический анализ результатов был проведен с использованием пакетов программ Analyse-it 5/66 компании Analyse-it Software, Ltd. (Великобритания) для ряда параметров валидации экспериментальных тестов и SPSS Statistics 26.0 (англ. Statistical Package for the Social Sciences) производства IBM (США) для расчета частоты встречаемости отдельных типов аутоантител в группах сравнения (значение выраженно в процентном соотношении с расчетом стандартного отклонения). Достоверность различий между двумя парными выборками считали с использованием t-критерия Стьюдента. Результаты считали статистически значимыми при p < 0,05.
Результаты и обсуждение / Results and Discussion
Валидация экспериментальных тестов / Validation of experimental tests
Валидация экспериментальных тестов показала, что внутриплашечная, межплашечная, межсерийная воспроизводимость (повторяемость) каждого из наборов реагентов не превышала 8 %. Для сравнения использованы тесты производства Orgentec Diagnostika GmbH (Германия). Получена корреляция между тестами ООО «НПО «Диагностические системы» и Orgentec: для aCL разных классов получено значение R² = 0,92; для аβ2-GP1 разных классов – R² = 0,95.
Оценка перекрестной реактивности с инфекционными заболеваниями показала отсутствие таковой при ВИЧ-инфекции, гепатитах В и С как для тестов на aCL, так и аβ2-GP1. При сифилисе этот показатель составил 2,2 % (95 % доверительный интервал (ДИ) = 0,4–11,6 %), при COVID-19 – 1,7 % (95 % ДИ = 0,5–5,8 %) как для тестов на aCL, так и аβ2-GP1.
Проведенные исследования по валидации данных наборов реагентов (в сравнении с референс-тестами; с использованием признанных международных стандартов; оценкой перекрестной реактивности на образцах, полученных от пациентов с соматическими, аутоиммунными и инфекционными заболеваниями и т. д.) показали высокие аналитические характеристики тестов. Аналитическая чувствительность тестов не превышает 0,5 Ед/мл.
Альтернативные антигенные мишени для эффективной диагностики аβ2-GP1 / Alternative antigenic targets for effective aβ2-GP1diagnostics
В качестве альтернативной антигенной мишени для эффективной диагностики аβ2-GP1 были рассмотрены отдельные эпитопы/домены β2-GP1. Результаты оценки выбранных рекомбинантных белков и пептидов представлены в таблице 1.
Таблица 1. Результаты оценки выбранных последовательностей на образцах,
содержащих и не содержащих антитела к полноразмерному белку β2-гликопротеин 1.
Table 1. Results of evaluating select sequences in samples
with antibodies against full-length protein β2-glycoprotein 1.
|
Антиген/пептид Antigen/peptide |
Чувствительность, % Sensitivity, % n = 34 |
Специфичность, % Specificity, % n = 46 |
Диагностическая эффективность, % Diagnostic efficiency, % n = 80 |
|
Антиген D1 (66аа) D1 antigen (66аа) |
11 (32,4) |
41 (89,1) |
52 (60,85) |
|
Антиген D4-5 D4-5 antigen |
14 (41,2) |
36 (78,3) |
50 (59,8) |
|
Пептид P1 P1 Peptide |
19 (55,9) |
40 (87,0) |
59 (71,5) |
|
Пептид P6 P6 Peptide |
6 (17,6) |
40 (87,0) |
46 (52,3) |
Установлено, что максимальную диагностическую эффективность для определения аβ2-GP1 имеют пептид Р1 (71,5 %) и рекомбинантный белок D1 (66аа) – 60,8 %. Полученные результаты требуют дальнейшего изучения диагностической значимости данных областей в ассоциации с клиническими проявлениями АФС. Кроме того, аФЛ-связывающие мотивы, присутствующие в пептидах, способны ингибировать активность аФЛ и могут обеспечить стратегию профилактики АФС в качестве альтернативы использованию антикоагулянтов [7].
Частота обнаружения аФЛ на разных стадиях COVID-19 / aPL detection frequency at different COVID-19 stages
Среди пациентов в острой фазе COVID-19 аФЛ выявлены у 81,7 % обследованных, что в 5 раз превысило аналогичный показатель среди контрольной группы (16,7 %) (t = 9,38; p < 0,001) (рис. 1). В стадию реконвалесценции отмечено достоверное снижение данного показателя (t = 2,10; p = 0,038), аФЛ выявлялись у 36–39 % переболевших на протяжении 9 мес после постановки диагноза.
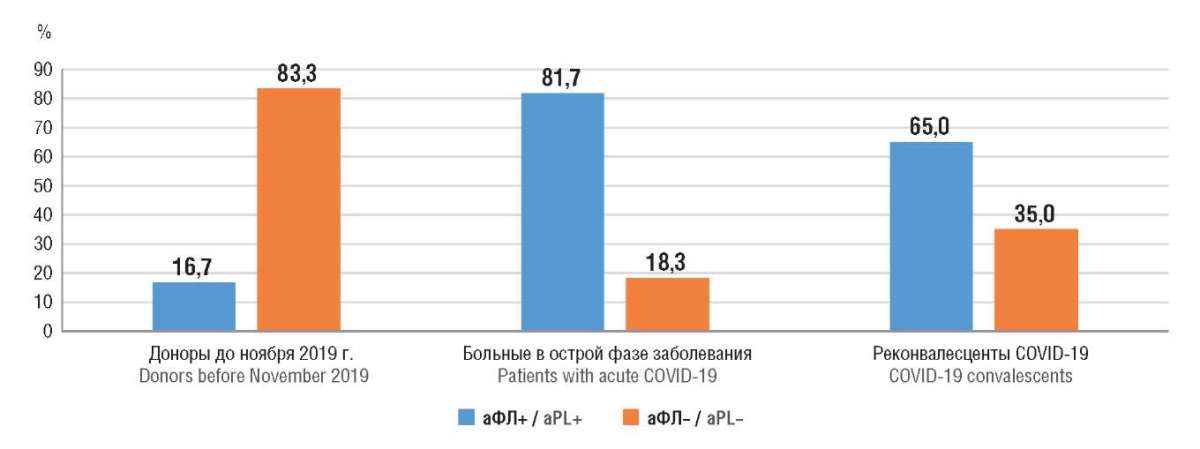
Рисунок 1. Частота выявления (%) антифосфолипидных антител (аФЛ)
среди обследованного контингента.
Figure 1. Frequency (%) of antiphospholipid antibody (aPL) detection
in the examined subject cohort.
В образцах сыворотки крови доноров контрольной группы отмечена одинаково низкая встречаемость отдельных маркеров АФС, не превышающая 1,7–3,3 %. В то же время у лиц, инфицированных SARS-CoV-2, профиль выявленных аФЛ и частота обнаружения отличались значительными колебаниями (табл. 2).
Таблица 2. Частота выявления антифосфолипидных антител (аФЛ)
среди обследованных групп.
Table 2. Frequency of antiphospholipid antibody (aPL) detection
among the groups examined.
|
Тип аФЛ Type of aРL |
Контрольная группа Control group n = 60 n (%) |
Больные в острой фазе COVID-19 Patients with acute COVID-19 n = 60 n (%) |
Реконвалесценты COVID-19, месяцы от постановки диагноза COVID-19-convalescents, months after diagnosis n = 60 n (%) |
||
|
3,5 |
6 |
9 |
|||
|
aCL IgG |
1 (1,7) |
21 (35,0) |
2 (3,3) |
2 (3,3) |
18 (30,0) |
|
aCL IgM |
1 (1,7) |
18 (30,0) |
19 (31,7) |
12 (20,0) |
15 (25,0) |
|
aCL IgA |
1 (1,7) |
0 (0,0) |
1 (1,7) |
0 (0,0) |
0 (0,0) |
|
аβ2-GP1 IgG |
1 (1,7) |
23 (38,3) |
7 (11,7) |
1 (1,7) |
7 (11,7) |
|
аβ2-GP1 IgM |
1 (1,7) |
0 (0,0) |
0 (0,0) |
0 (0,0) |
0 (0,0) |
|
аβ2-GP1 IgA |
1 (1,7) |
6 (10,0) |
1 (1,7) |
2 (3,3) |
3 (5,0) |
|
аPS-PT IgG |
2 (3,3) |
20 (33,3) |
21 (35,0) |
19 (31,7) |
13 (21,7) |
|
аPS-PT IgM |
1 (1,7) |
0 (0,0) |
9 (15,0) |
11 (18,3) |
1 (1,7) |
|
аPS-PT IgA |
1 (1,7) |
7 (11,7) |
1 (1,7) |
7 (11,7) |
2 (3,3) |
|
Любые аФЛ Any aРL |
10 (16,7) |
49 (81,7) |
39 (65,0) |
36 (60,0) |
39 (65,0) |
Примечание: aCL – антикардиолипиновые антитела;
аβ2-GP1 – антитела к β2-гликопротеину 1;
аPS-PT – антитела к фосфотидилсерин-протромбиновому комплексу.
Note: aCL – anticardiolipin antibodies;
аβ2-GP1 – anti-β2-glycoprotein 1 antibodies;
аPS-PT – anti-phosphatidylserine-prothrombin complex antibodies.
Среди всех выявляемых маркеров АФС у больных COVID-19 первое ранговое место по частоте обнаружения занимают IgG к β2-GP1, кардиолипину и PS-PT (38,3, 35,0 и 33,3 % соответственно), на втором месте – aCL IgM (30,0 %), наименьшая встречаемость показана для IgA к PS-PT и β2-GP1 (11,7 и 10,0% соответственно).
У реконвалесцентов COVID-19 исследование было проведено трижды с интервалами между сбором клинического материала в 2,5–3 мес, что позволило оценить изменения в профиле аФЛ, которые превалируют на разных сроках после постановки диагноза (рис. 2). В первые 6 мес лидирующие позиции занимали IgG к PS-PT и aCL IgM. На момент третьего сбора клинического материала у этих лиц резко начинали превалировать aCL IgG (30,0 % от всех выявленных маркеров), что можно рассматривать как отсроченные последствия перенесенной инфекции или влияние других факторов, не связанных с COVID-19.
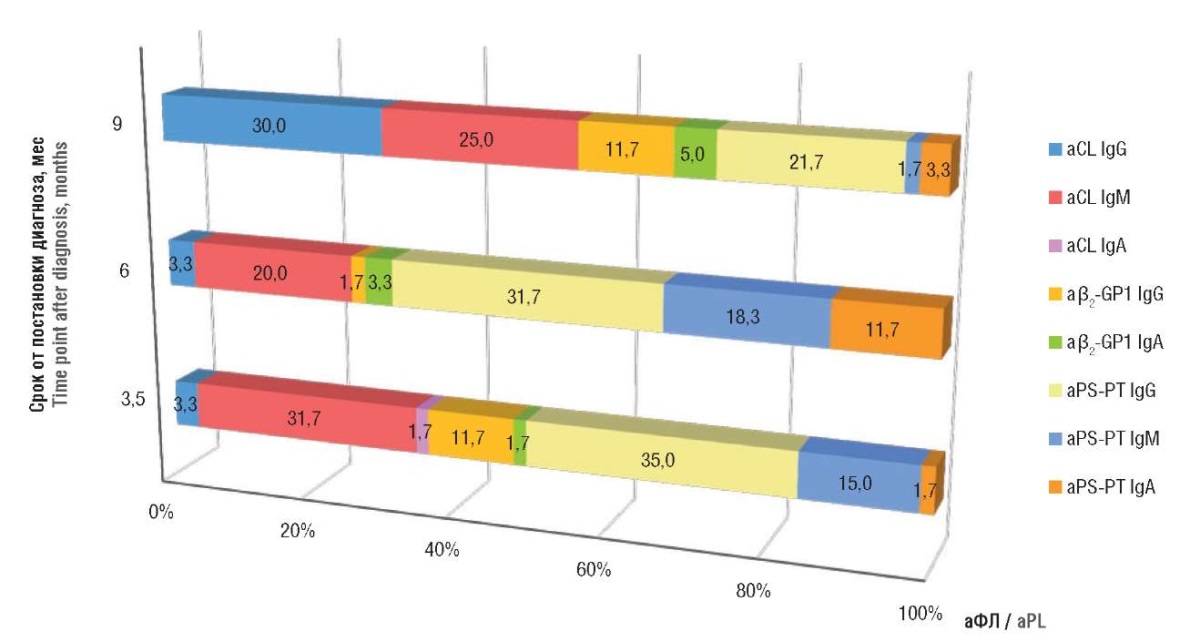
Рисунок 2. Профиль антифосфолипидных антител (аФЛ) у реконвалесцентов COVID-19
на разных сроках от постановки диагноза.
Примечание: aCL – антикардиолипиновые антитела;
аβ2-GP1 – антитела к β2-гликопротеину 1;
аPS-PT – антитела к фосфотидилсерин-протромбиновому комплексу.
Figure 2. Antiphospholipid antibody (aPL) profile
in COVID-19 convalescents at varying time points after diagnosis.
Note: aCL – anticardiolipin antibodies;
аβ2-GP1 – anti-β2-glycoprotein 1 antibodies;
аPS-PT – anti-phosphatidylserine-prothrombin complex antibodies.
Следует отметить, что аβ2-GP1 IgM у больных не выявлены как в острой фазе COVID-19, так и в стадии реконвалесценции. IgM к PS-PT отсутствовали на ранних стадиях заболевания и появлялись только спустя 3,5 мес от постановки диагноза.
Таким образом, при проведении исследования по обнаружению аФЛ среди пациентов на различных стадиях COVID-19 нами была установлена значительная частота встречаемости данных аутоантител. У всех пациентов с диагнозом COVID-19 в острую стадию течения заболевания обнаружен, по крайней мере, один лабораторный маркер АФС: 10 (20,8 %) пациентов были с положительным результатом теста на 2 и более типов аФЛ и 12 (25,0 %) – на 3 и более типов антител. Около трети лиц с диагнозом COVID-19 имеют высокую вероятность возникновения тромбозов [4–6]. В нашем исследовании более половины положительных находок были связаны с двумя типами аФЛ: IgG к PS-PT и aCL IgM; доля больных с наличием антител к PS-PT и отсутствием других аФЛ составила 6,7 %. В ряде случаев состояние этих пациентов может рассматриваться как предшествующее развитию тромботических осложнений [9].
Динамический анализ позволил выявить изменения в спектре циркулирующих аФЛ в организме больного по мере развития заболевания. Большинство из этих вирус-ассоциированных aФЛ предположительно являются транзиторно позитивными и циркулируют кратковременно в организме больного. Вместе с тем клинические последствия их появления требуют дальнейшего изучения. Некоторые исследователи предполагают, что местная иммунная стимуляция вследствие вирусной инфекции может накладываться на ранее циркулирующие в организме человека аФЛ и таким образом приводить к тяжелому тромбовоспалительному поражению легких пациентов с COVID-19 [2][14].
Нами не установлено достоверных различий в частоте обнаружения каких-либо аФЛ в зависимости от тяжести COVID-19.
Заключение / Conclusion
Созданы рекомбинантные конструкции для определения различных типов аФЛ и альтернативных иммунологически значимых областей β2-GP1. Оптимизированы условия проведения ИФА индивидуально для каждого вида определяемых аутоантител. Дизайн тестов, требования к образцам, метрологическая прослеживаемость соответствуют российским и международным стандартам, что позволяет рекомендовать данные тест-системы для использования в клинической лабораторной диагностике с целью выявления маркеров АФС.
Показано, что наравне с другими вирусными инфекциями COVID-19 является триггером выработки аФЛ. У 54,2 % лиц, инфицированных SARS-CoV-2, обнаруживался как минимум один тип аФЛ, у 45,8 % обследованных лиц были выявлены 2 и более лабораторных маркеров АФС. Вместе с тем некритериальные аФЛ, такие как антитела к PS-PT, могут быть более распространены, чем критериальные, поэтому следует рассмотреть вопрос включения их в скрининг лабораторных маркеров АФС у ковидных больных. Роль длительно циркулирующих вирус-ассоциированных aФЛ в развитии тяжелого тромбовоспалительного поражения у больных COVID-19 и особенно в постковидный период требует дальнейшего изучения.
Список литературы
1. Abdel-Wahab N., Talathi S., Lopez-Olivo M.A., Suarez-Almazor M.E. Risk of developing antiphospholipid antibodies following viral infection : a systematic review and meta-analysis. Lupus. 2018;27(4):572–83. doi: 10.1177/0961203317731532.
2. Zuo Y., Estes Sh.K., Ali R.A. et al. Prothrombotic autoantibodies in serum from patients hospitalized with COVID-19. Sci Transl Med. 2020;12(570):eabd3876. doi: 10.1126/scitranslmed.abd3876.
3. Devreese K.M.J., Linskens E.A., Benoit D., Peperstraete H. Antiphospholipid antibodies in patients with COVID-19: A relevant observation? J Thromb Haemost. 2020;18(9):2191–201. doi: 10.1111/jth.14994.
4. Miyakis S., Lockshin M., Atsumi T. et al. International consensus statement on an update of the classification criteria for definite antiphospholipid syndrome (APS). J Thromb Haemost. 2006;4(2):295–306. doi: 10.1111/j.1538-7836.2006.01753.x.
5. Клинические рекомендации по лечению антифосфолипидного синдрома. М., 2013. 23 с. Режим доступа: https://diseases.medelement.com/disease/%D0%B0%D0%BD%D1%82%D0%B8%D1%84%D0%BE%D1%81%D1%84%D0%BE%D0%BB%D0%B8%D0%BF%D0%B8%D0%B4%D0%BD%D1%8B%D0%B9-%D1%81%D0%B8%D0%BD%D0%B4%D1%80%D0%BE%D0%BC-%D1%80%D0%B5%D0%BA%D0%BE%D0%BC%D0%B5%D0%BD%D0%B4%D0%B0%D1%86%D0%B8%D0%B8-%D1%80%D1%84/15088?ysclid=lwbsoacwoh959114663 [Дата обращения: 20. 02. 2024].
6. Александрова Е.Н., Новиков А.А., Насонов Е.Л. Рекомендации по лабораторной диагностике ревматических заболеваний Общероссийской общественной организации «Ассоциация ревматологов России» – 2015. Современная ревматология. 2015;9(4):25–36.
7. Cередавкина Н.В., РешетнякТ.М. IX Европейский форум по антифосфолипидным антителам. Краткий обзор. Научно-практическая ревматология. 2014;52(1):115–21. URL: https://cyberleninka.ru/article/n/ix-evropeyskiy-forum-po-antifosfolipidnym-antitelam-kratkiy-obzor?ysclid=lwbsqxk9a6390047991.
8. De Laat B., Derksen R.H., Urbanus R.T., de Groot P.G. IgG antibodies that recognize epitope Gly40-Arg43 in domain I of beta 2-glycoprotein I cause LAC, and their presence correlates strongly with thrombosis. Blood. 2005;105(4):1540–5. doi: 10.1182/blood-2004-09-3387.
9. Zohoury N., Bertolaccini M.L., Rodriguez-Garcia J.L. et al. Closing the serological gap in the antiphospholipid syndrome: the value of «non-criteria» antiphospholipid antibodies. J Rheumatol. 2017;44(11):1597–602. doi: 10.3899/jrheum.170044.
10. Choi B., Choudhary M.C., Regan J. et al. Persistence and evolution of SARS-CoV-2 in an immunocompromised host. N Engl J Med. 2020;383(23):2291–93. doi: 10.1056/NEJMc2031364.
11. Tang N., Li D., Wang X., Sun Z. Abnormal coagulation parameters are associated with poor prognosis in patients with novel coronavirus pneumonia. J Thromb Haemost. 2020;18(4):844–7. doi: 10.1111/jth.14768.
12. Meroni P.L., Biggioggero M., Pierangeli S.S. et al. Standardization of autoantibody testing: a paradigm for serology in rheumatic diseases. Nat Rev Rheumatol. 2014;10(1):35–43. doi: 10.1038/nrrheum.2013.180.
13. De Moerloose P., Fickentscher C., Boehlen F. et al. Patient-derived anti-β2GP1 antibodies recognize a peptide motif pattern and not a specific sequence of residues. Haematologica. 2017;102(8):1324–32. doi: 10.3324/haematol.2017.170381.
14. Sciascia S., Sanna G., Murru V. et al. Anti-prothrombin (aPT) and anti-phosphatidylserine/prothrombin (aPS/PT) antibodies and the risk of thrombosis in the antiphospholipid syndrome. A systematic review. Thromb Haemost. 2014;111(2):354–64. doi: 10.1160/TH13-06-0509.
Об авторах
Ю. В. МихайловаРоссия
Юлия Владимировна Михайлова, к.б.н., главный редактор, начальник отдела
редакционно-издательский отдел
603093; ул. Яблоневая, д. 22 (а/я 69); Нижний Новгород
Н. В. Чепурченко
Россия
Наталья Валерьевна Чепурченко, микробиолог
отдел внедрения новых технологий
603093; ул. Яблоневая, д. 22 (а/я 69); Нижний Новгород
А. П. Обрядина
Россия
Анна Петровна Обрядина, д. б. н., зам. генерального директора
603093; ул. Яблоневая, д. 22 (а/я 69); Нижний Новгород
Что уже известно об этой теме?
► Ряд инфекционных заболеваний служит триггером для формирования аутоиммунной патологии, а аутоантитела, в свою очередь, вызывают развитие тромбозов, увеличивая тяжесть заболевания.
► Учитывая значительное сходство иммунных механизмов развития тромбоза между антифосфолипидным синдромом (АФС) и COVID-19, ряд авторов связывают склонность к тромбообразованию при новой коронавирусной инфекции с наличием антифосфолипидных антител (аФЛ).
► В условиях импортозамещения остро стоял вопрос создания отечественных тестов для диагностики маркеров АФС.
Что нового дает статья?
► Выявлена высокая встречаемость аФЛ у пациентов с подтвержденным диагнозом COVID-19 в острой фазе и ранее не имевших в анамнезе АФС.
► Впервые оценены изменения в спектре выявляемых аФЛ и длительность циркуляции на протяжении 9 мес от момента постановки диагноза.
Как это может повлиять на клиническую практику в обозримом будущем?
► Патогенная природа аФЛ, связанных с COVID-19, требует пристального изучения как фактора отсроченного тромбообразования в постковидный период.
► Некритериальные аФЛ, такие как антитела к фосфатидилсерин-протромбиновому комплексу, могут быть более распространены, чем критериальные, поэтому следует рассмотреть вопрос включения их в скрининг лабораторных маркеров АФС у ковидных больных.
► Компания ООО «НПО «Диагностические системы» является первым отечественным производителем ИФА-тестов для обнаружения маркеров АФС. Разработанные диагностикумы успешно прошли клинические испытания, имеют подтвержденные высокие аналитические характеристики, что может свидетельствовать о высокой степени достоверности полученных с их использованием результатов анализов в таком сложном направлении лабораторной диагностики, как аутоиммунная патология.
Рецензия
Для цитирования:
Михайлова Ю.В., Чепурченко Н.В., Обрядина А.П. Частота обнаружения и длительность циркуляции маркеров антифосфолипидного синдрома у пациентов с подтвержденным диагнозом COVID-19. Акушерство, Гинекология и Репродукция. 2024;18(2):180-187. https://doi.org/10.17749/2313-7347/ob.gyn.rep.2024.504
For citation:
Mikhailova Yu.V., Chepurchenko N.V., Obriadina A.P. Detection frequency and duration of circulating antiphospholipid syndrome markers in patients with verified COVID-19. Obstetrics, Gynecology and Reproduction. 2024;18(2):180-187. (In Russ.) https://doi.org/10.17749/2313-7347/ob.gyn.rep.2024.504

Контент доступен под лицензией Creative Commons Attribution-NonCommercial-ShareAlike 4.0 International License.











































