Перейти к:
К вопросу о повторных неудачах имплантации при вспомогательных репродуктивных технологиях
https://doi.org/10.17749/2313-7347/ob.gyn.rep.2024.508
Аннотация
Имплантация эмбриона – первый ключевой этап успешной беременности, однако неудачи имплантации в программах вспомогательных репродуктивных технологий (ВРТ) остаются довольно распространенным явлением. Основные известные факторы повторных неудач имплантации (англ. repeated implantation failure, RIF) у пациентов, перенесших ВРТ: нездоровый образ жизни, генетический фактор инизкое качество гамет, патологиисо стороны матки, эндометриоз и аденомиоз, тромбофилия, а также мужской фактор и факторы со стороны эмбриона. Факторам RIF и способам их преодоления уделяется большое внимание исследователей. Однако, несмотря на то, что установлено много возможных причин RIF, многое остается неизвестным относительно этиологии и преодоления этого состояния. В клинической практике нередко применяются исследования и вмешательства без четкого научного обоснования или убедительных доказательств их эффективности из-за отсутствия стандартизации методов диагностики и лечения. Для повышения шансов успешного наступления беременности в программах ВРТ необходима эффективная стратегия лечения, включающая терапию факторов риска RIF каждой конкретной пациентки.
Ключевые слова
Для цитирования:
Первушина А.А., Хизроева Д.Х., Бицадзе В.О. К вопросу о повторных неудачах имплантации при вспомогательных репродуктивных технологиях. Акушерство, Гинекология и Репродукция. 2024;18(3):401-413. https://doi.org/10.17749/2313-7347/ob.gyn.rep.2024.508
For citation:
Pervushina A.A., Khizroeva J.Kh., Bitsadze V.O. Regarding repeated implantation failures coupled to assisted reproductive technologies. Obstetrics, Gynecology and Reproduction. 2024;18(3):401-413. (In Russ.) https://doi.org/10.17749/2313-7347/ob.gyn.rep.2024.508
Введение / Introduction
Бесплодие определяется как заболевание, характеризующееся невозможностью достичь клинической беременности после 12 мес регулярной половой жизни без контрацепции вследствие нарушения способности человека к воспроизводству либо индивидуально, либо с его/её партнером [1]. Медицинские вмешательства, направленные на лечение бесплодия, могут быть начаты и ранее одного года, в зависимости от данных медицинского, сексуального и репродуктивного анамнеза, возраста, физикального обследования и диагностики [1]. Несмотря на значительные успехи, достигнутые в последние десятилетия в области репродуктивной медицины, эмбриологии и генетики, бесплодие остается одной из самых актуальных проблем в гинекологии. По оценкам Всемирной организации здравоохранения, от этого состояния страдает 17,5 % взрослого населения в мире [2].
Бесплодие и вспомогательные репродуктивные технологии / Infertility and assisted reproductive technologies
Вспомогательные репродуктивные технологии (ВРТ) являются одним из наиболее эффективных методов преодоления бесплодия. Тем не менее, несмотря на широкое применение и развитие, ВРТ не могут гарантировать беременность и живорождение. Так, согласно данным, собранным в отчете Российской ассоциации репродукции человека (РАРЧ) за 2021 г., в программах экстракорпорального оплодотворения (ЭКО) частота наступления беременности в расчете на цикл составила 28,6 %, а на перенос эмбрионов – 34,8 %. Родами завершились 76,7 % беременностей, потери беременности при этом достигают 23,3 % (из 92 % известных исходов) [3].
Вероятность успеха ЭКО зависит от множества различных факторов. Первый важный этап успешной беременности – имплантация эмбриона. Несмотря на значительные достижения в области репродуктивной медицины, неудачи имплантации в программах ЭКО остаются довольно распространенным явлением.
Факторы риска повторных неудач имплантации / Risk factors for repeated implantation failures
Рабочая группа Европейского общества репродукции человека и эмбриологии (англ. European Society of Human Reproduction and Embryology, ESHRE) по рецидивирующим (повторным) неудачам имплантации (англ. repeated implantation failure, RIF) рекомендует рассматривать RIF как вторичное явление ВРТ, поскольку его можно наблюдать только у пациентов, перенесших ЭКО. В своем практическом руководстве они предлагают следующее определение рецидивирующих (повторных) неудач имплантации: RIF – это клиническое явление, при котором перенос эмбрионов, считающихся жизнеспособными, «достаточно часто» не приводит к положительному результату теста на беременность у конкретного пациента, и которое служит основанием для рассмотрения дальнейших исследований и/или вмешательств. Согласно рекомендациям ESHRE, подозревать/диагностировать RIF и начинать дальнейшее обследование и/или лечение следует в том случае, если при применении ВРТ было как минимум 2 неудачи имплантации, а суммарная вероятность имплантации больше 60 % (рис. 1) [4].
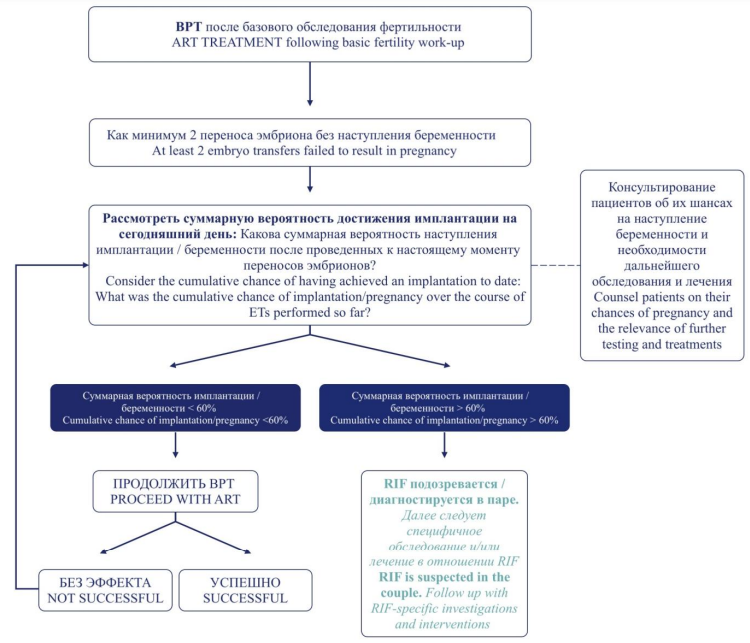
Рисунок 1. Применение персонализированного определения повторных неудач имплантации (англ. repeated implantation failure, RIF) в клинической практике (адаптировано из [4]). Эта блок-схема соответствует априорному условию, согласно которому пациентка/пара сможет добиться беременности с помощью ВРТ и что процедуры ВРТ выполняются полностью обученным и квалифицированным персоналом с использованием самых современных технологий и процедур.
Примечание: ВРТ – вспомогательные репродуктивные технологии.
Figure 1. Personalized determination of repeated implantation failure (RIF) in clinical practice (adapted from [4]). This flowchart corresponds to the priori condition that the patient/couple will be able to achieve pregnancy through ART and that ART procedures are performed by fully trained and qualified personnel using state-of-the-art technology and procedures.
Note: ART – assisted reproductive technologies.
Рецидивирующие неудачи имплантации представляют собой сложное клиническое явление, в основе которого лежит совокупность факторов со стороны матери, отца и эмбриона.
Факторы со стороны матери / Maternal factors
Известно, что эмбрион хорошего качества является основой успешной имплантации, однако состояние здоровья матери имеет решающее значение [5]. Основные факторы риска RIF со стороны матери представлены на рисунке 2.
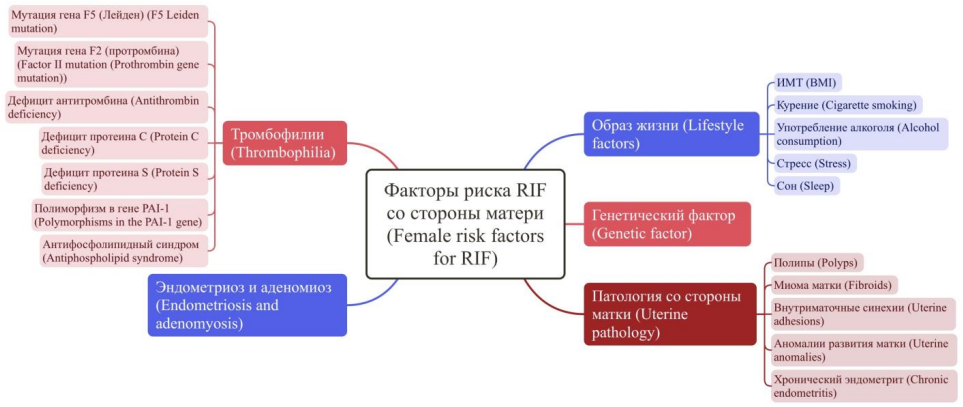
Рисунок 2. Факторы риска повторных неудач имплантации (англ. repeated implantation failure, RIF) со стороны матери.
Примечание: ИМТ – индекс массы тела; PAI-1 – ингибитор активатора плазминогена-1.
Figure 2. Maternal risk factors for repeated implantation failure (RIF).
Note: BMI – body mass index; PAI-1 – plasminogen activator inhibitor-1.
Образ жизни / Lifestyle
Известные факторы риска развития RIF включают индекс массы тела (ИМТ), курение, употребление алкоголя и стресс [5].
Индекс массы тела / Body mass index
Влияние ожирения на женскую репродуктивную систему, наступление и исходы беременности, в том числе с помощью ВРТ, доказано во многих научных работах [6–8].
Систематический обзор и метаанализ 21 исследования, направленного на оценку связи женского ожирения с вероятностью живорождения после ЭКО, продемонстрировал, что ИМТ ≥ 30 кг/м2 оказывает существенное негативное влияние на уровень рождаемости после ЭКО [7].
Нарушение репродуктивной функции у женщин с ожирением может быть связано с нарушением фолликулогенеза, качества ооцитов, эмбриогенеза и внутриутробной среды [6]. Установлена связь между ожирением и изменениями состава фолликулярной жидкости, в которой находятся ооциты на протяжении всего периода созревания, что может привести к ухудшению созревания ооцитов и, как следствие, их качества, которое может определяться количеством оплодотворенных яйцеклеток и частотой успешного оплодотворения [8]. В то же время проведение преимплантационного генетического тестирования анеуплоидий (ПГТ-А) у женщин с ожирением не выявило какой-либо значимой связи между ожирением и уровнем анеуплоидии или количеством эуплоидных эмбрионов [7].
Существуют противоречивые данные относительно того, оказывает ли ожирение существенное влияние на эндометрий. Несмотря на то что есть исследования, не подтверждающие негативного влияния ожирения на рецептивность эндометрия, многие исследования показывают повышенный риск привычного невынашивания у пациенток с повышенным ИМТ. Лептин, вырабатываемый клетками жировой ткани, вероятно, влияет на эндометрий. Хроническое нарушение регуляции путей этого гормона при ожирении может отрицательно влиять на имплантацию эмбриона [8].
Женщинам с ожирением, пытающимся забеременеть, следует рекомендовать снижение массы тела до беременности.
Курение и употребление алкоголя / Smoking and alcohol consumption
Курение в анамнезе женщины может приводить как к снижению овариального резерва, так и ухудшению качества яйцеклеток, что может отрицательно влиять на результаты программ ВРТ [9].
Прием более одной порции алкоголя (10 мл этилового спирта) в день может снизить эффективность ЭКО [5].
Стресс / Stress
Нет сомнений в том, что бесплодие, и в особенности повторные неудачи ЭКО, вызывают стресс у пациентов. Влияние стресса на результаты ВРТ остается спорным, однако очевидно, что работа с психологическим состоянием женщин потенциально может уменьшать тревожность и приводить к увеличению вероятности наступления беременности [10].
Сон / Sleep
Хорошее качество сна может быть ассоциировано с более высоким уровнем клинической беременности и живорождения в программах ЭКО у пациенток моложе 35 лет, в то время как плохое качество сна может быть фактором риска неблагоприятных результатов ЭКО у этой группы пациенток [11].
Генетический фактор и возраст матери / Genetic factor and maternal age
Крупные исследования показали, что эмбриональные хромосомные нарушения (анеуплоидия плода) являются наиболее распространенной причиной выкидыша более чем в 55 % случаев [12][13]. Анеуплоидные бластоцисты обладают значительно сниженной способностью к развитию на преимплантационной стадии и незначительным имплантационным потенциалом [14].
Существует положительная корреляция между возрастом матери и риском анеуплоидии [15][16]. В частности, возрастают нарушения сегрегации хромосом во время мейоза, которые приводят к образованию ооцитов с неправильным числом хромосом. Когда анеуплоидный ооцит оплодотворяется спермотозоидом, он дает начало анеуплоидному эмбриону, который, за исключением редких ситуаций, приводит к самопроизвольному аборту. С возрастом женщины подвергаются более высокому риску самопроизвольного прерывания беременности или беременности с хромосомными аномалиями плода, такими как синдром Дауна (трисомия 21), синдром Эдвардса (трисомия 18) и синдром Тернера (моносомия X) [16].
Для исключения эмбрионов с анеуплоидией, основной эмбриональной причиной невынашивания беременности и неудач имплантации, можно проводить преимплантационное генетическое тестирование на анеуплоидии (ПГТ-А) [17].
Патология со стороны матки / Uterine pathology
На успех имплантации могут влиять полипы эндометрия, миомы матки, внутриматочные синехии, аномалии развития матки, хронический эндометрит и нарушения рецепторного аппарата эндометрия.
Полипы / Polyps
Полипы эндометрия – одна из наиболее распространенных патологий эндометрия у пациенток с RIF [18].
Описано несколько этиопатогенетических причин бесплодия, ассоциированного с полипами эндометрия. Одна из них – механическая обструкция устьев маточных труб или цервикального канала [19]. С другой стороны, полипы эндометрия могут вызвать бесплодие, оказывая биохимические эффекты. Полипы эндометрия вызывают воспалительную реакцию эндометрия, что негативно влияет на процесс имплантации. Помимо маркеров воспаления, влиять на транспорт сперматозоидов и имплантацию эмбриона могут повышенные уровни гликоделина, ароматазы и сниженные уровни мРНК генов HOXA10 и HOXA11, одних из ключевых регуляторов рецептивности эндометрия [20].
Миома матки / Uterine fibroids
Влияние миомы на зачатие и беременность зависит от ее расположения и размеров. Интрамуральная и субсерозная миомы могут не влиять на фертильность, в то время как подслизистая миома может приводить к снижению частоты наступления клинической беременности и имплантации [21].
Общепризнано, что чем ближе миома расположена к полости матки и слизистой оболочке эндометрия, тем более неблагоприятное влияние она может оказать на фертильность, снижая шансы на успешную имплантацию и вынашивание беременности. Механическое сжатие миомой интерстициальной части маточных труб или деформация полости матки может нарушить транспорт ооцитов и сперматозоидов [22].
На процесс имплантации миома матки может влиять за счет нескольких механизмов, включая повышенную сократимость матки, нарушение цитокинового профиля, аномальную васкуляризацию и хроническое воспаление [23].
Внутриматочные синехии / Intrauterine synechiae
Внутриматочные синехии (спайки) нарушают функциональный слой эндометрия и могут приводить к неудачной имплантации, механически препятствовуя прикреплению эмбриона.
Аномалии развития матки / Uterine developmental abnormalities
Внутриматочная перегородка матки может быть фактором, способствующим неудаче имплантации. При этом двурогая матка (полная перегородка матки), скорее всего, оказывает меньшее влияние на наступление беременности [24].
Полипы, миомы, спайки и перегородки могут повлиять на имплантацию, и золотым стандартом их диагностики является гистероскопия. Р. Cenksoy с соавт. в своем исследовании продемонстрировали следующие результаты: у 44,9 % пациентов были аномальные результаты гистероскопии, а 51,0 % этих женщин забеременели после коррекции выявленной патологии. При этом частота имплантаций была значительно выше у пациенток после полипэктомии, но не у пациенток после рассечения спаек, что позволяет предположить, что различные патологии могут не иметь одинакового уровня успешной имплантации и беременности после хирургического вмешательства [25].
Хронический эндометрит / Chronic endometritis
Хронический эндометрит (ХЭ) – стойкое воспаление внутренней оболочки эндометрия, которое снижает его рецептивность и отрицательно влияет на репродуктивные результаты лечения ЭКО с переносом эмбриона. ХЭ часто связан с бесплодием, выкидышами и RIF [26–31].
Наиболее распространенными предполагаемыми микроорганизмами, приводящими к ХЭ, являются Streptococcus, Enterococcus, Escherichia и Staphylococcus, а также Chlamydia trachomatis (Chlamydia), Neisseria gonorrhoeae (гонорея), Mycoplasma hominis, Mycobacterium Tuberculosis и некоторые вирусы [27].
Нарушая иммунное микроокружение полости матки, ХЭ влияет на рецептивность эндометрия, что приводит к неудачной имплантации эмбриона у пациенток с RIF [28][29].
Золотым стандартом диагностики ХЭ является гистероскопия с биопсией эндометрия. Гистологически ХЭ характеризуется наличием воспалительных клеток в строме эндометрия, включая плазматические клетки, лимфоциты, эозинофилы и лимфоидные фолликулы. Другие гистопатологические характеристики ХЭ включают поверхностный отек, повышенную плотность стромы и несинхронизированную дифференцировку между эпителием и стромой эндометрия [27].
Для дифференциальной диагностики используется иммуногистохимическое исследование с определением маркеров ХЭ на молекулярном уровне, главным образом, плазматических клеток CD138.
Антибиотикотерапия в настоящее время является наиболее эффективным методом лечения для восстановления фертильности при ХЭ. Частота наступления беременности при ЭКО увеличивается после лечения ХЭ антибиотиками [26].
Помимо антибиотикотерапии, PRP-терапия (англ. Platelet Rich Plasma; плазмотерапия) потенциально может улучшить исходы беременности у женщин с ХЭ и RIF [30]. Однако клинические исследования эффективности PRP в улучшении функции эндометрия матки остаются противоречивыми.
Эндометриоз и аденомиоз / Endometriosis and adenomyosis
Воспаление играет ключевую роль в патофизиологии эндометриоза. Хроническое воспаление может вызывать спаечный процесс в малом тазу, приводить к непроходимости маточных труб, влиять на качество ооцитов, препятствовать овуляции и оплодотворению, а также имплантации эмбрионов [31]. Методы ВРТ помогают в преодолении некоторых из этих последствий, таких как нарушения овуляции или трубно-перитонеальный фактор бесплодия. Тем не менее пациентки с эндометриозом могут сталкиваться с проблемами и во время программ ВРТ.
Несмотря на то что существуют исследования, не подтверждающие достоверную связь эндометриоза с бесплодием и исходами программ ВРТ [32, 33], большинство ученых сходятся во мнении о том, что эндометриоз оказывает негативный эффект на фертильность и результаты программ ВРТ. Так, в амбиспективном когортном исследовании C. Zhong с соавт. 330 пациенток с диагнозом «эндометриоз» (без лечения, после раннего лечения – до диагностирования у них RIF и после позднего лечения – после диагностики RIF), которые прошли суммарно 1043 цикла ЭКО/ИКСИ и имеющих неудачи имплантации в анамнезе, выявили, что эндометриоз негативно влиял на исход циклов ЭКО/ИКСИ, а лечение этого заболевания значительно улучшало прогноз, особенно при повторяющихся неудачах имплантации в анамнезе [34].
Возникновение бесплодия при аденомиозе объясняется в основном локальным воспалением эндометрия. Очаги аденомиоза могут привести к агрегации тромбоцитов и гипоксии, что провоцирует выработку воспалительных цитокинов и простагландинов, а также увеличение локальной выработки эстрогенов [35]. Это может как повышать сократительную активность матки за счет действия эстрогенов на рецепторы окситоцина, так и способствовать фиброзу за счет эпителиально-мезенхимального перехода и трансдифференцировки фибробластов в миофибробласты. Несмотря на то что считается, что аномальные маточные сокращения нарушают транспорт гамет и эмбрионов, ключевую роль в создании неблагоприятной среды для имплантации эмбриона играет локальное воспаление и фиброз [36]. Поскольку аденомиоз не связан с неблагоприятным воздействием на фолликулогенез, а служит препятствием для имплантации, он может быть одной из причин RIF.
Большой вклад в связь эндометриоза и нарушений фертильности вносит эндометриоз яичников (эндометриомы). Хирургическое удаление эндометриом, как и другие оперативные вмешательства на яичниках, крайне неблагоприятно влияет на овариальный резерв женщины [37, 38]. Снижение фолликулярного запаса влечет за собой уменьшение количества ооци-
тов, которые можно получить во время протокола ЭКО, что в конечном итоге приводит к снижению шансов на рождение живого ребенка с каждым последующим циклом стимуляции яичников [39].
Доступные методы терапии эндометриоза лечат симптомы, но не избавляют от самого заболевания. Варианты лечения включают агонисты гонадотропин-рилизинг-гормона (ГнРГ), пероральные контрацептивы, ингибиторы ароматазы и прогестины, а также хирургическое лечение.
Тромбофилия / Thrombophilia
Беременность сопровождается состоянием гиперкоагуляции, которое усиливается на протяжении всей беременности и является максимальным ближе к родам. Примерно половина эпизодов венозных тромбоэмболических осложнений (ВТЭО) происходит в течение 6 нед после родов, поэтому в послеродовом периоде, несмотря на то, что он длится намного меньше антенатального, ежедневный абсолютный риск ВТЭО наиболее высок [40]. Главным образом, во время беременности наблюдается повышенная активность факторов свертывания крови VIII, VII, V, X, XII, VII, фактора фон Виллебранда (англ. von Willebrand factor, vWF), повышение уровня фибриногена, а также гипофибринолиз. Одновременно с этим выявлено снижение активности антикоагулянтной системы: снижается концентрация протеина S и развивается приобретенная резистентность к активированному протеину С (англ. activated protein С, АРС).
Торможение системы фибринолиза во время беременности связано с постоянной продукцией ингибитора активатора плазминогена-2 (англ. plasminogen activator inhibitor-2, PAI-2) в плацентарном ложе и увеличением экспрессии ингибитора активатора плазминогена-1 (англ. plasminogen activator inhibitor-1, PAI-1) на поверхности эндотелия [41].
Тромбофилия представляет собой патологическую предрасположенность к образованию тромбов, которые могут вызывать локальные сосудистые нарушения, что, в свою очередь, может влиять на имплантацию эмбриона [42]. Известна роль тромбофилии в привычном невынашивании беременности, а сейчас эта патология стала широко рассматриваться и как возможная причина RIF.
К тромбофилиям высокого риска развития тромбоза относят [42]:
- мутацию гена фактора V (мутация Лейдена) – F5 G1691A, гомозигота;
- мутацию гена фактора II (протромбина) – F2 G20210A, гомозигота;
- сочетание гетерозиготных мутаций факторов V (Лейден) и II (протромбина);
- дефицит антитромбина;
- дефицит протеина С;
- дефицит протеина S;
- антифосфолипидный синдром (АФС).
Мутация гена фактора V (мутация Лейдена) / Factor V (Leiden) gene mutation
Причиной связи наследственных тромбофилий с прерыванием беременности на ранних сроках, а также с неудачами имплантации является нарушение сосудистых изменений, лежащих в основе успешной беременности [41].
Фактор V G1691A представляет собой мутированный белок, который образуется в результате замены гуанина на аденин в положении 1691, в результате чего в аминокислотном остатке 506 (R506Q) вместо аргинина присутствует глутамат. Мутация фактора V G1691A можно рассматривать как фактор рецидивирующих неудач ЭКО [43].
Наследственное нарушение коагуляции фактора V G1691A и протромбина G20210A во время беременности усугубляет ранее существовавшее состояние гиперкоагуляции во время беременности.
Мутация гена фактора II (протромбина) / Factor II (prothrombin) gene mutation
Мутация гена протромбина G20210A – одна из наиболее распространенных наследственных тромбофилий [44].
Протромбин – предшественник тромбина, который является конечным продуктом каскада свертывания крови и расщепляет фибриноген до фибрина. Тромбин действует на тромбоциты, факторы V, VIII, XIII и активируемый тромбином ингибитор фибринолиза (англ. thrombin-activated fibrinolysis inhibitor, TAFI) [45]. Одиночная точечная мутация гена протромбина в 11-й хромосоме приводит к замене гуанина на аденин в положении нуклеотида 20210. Это, в свою очередь, приводит к повышению уровня протромбина в крови, TAFI, наряду с увеличением экспрессии мРНК и белка протромбина, что в совокупности приводит к состоянию гиперкоагуляции [46].
Дефицит антитромбина, протеина С, протеина S / Antithrombin, protein C, protein S deficiency
X. Liu с соавт. в своем метаанализе исследовали, существует ли связь между наследственной тромбофилией у беременных и риском привычного невынашивания беременности, и пришли к выводу, что женщины с мутацией G1691A гена фактора V, мутацией G20210A гена протромбина и дефицитом протеина S имеют повышенный риск повторных потерь беременности; однако дефицит антитромбина и дефицит протеина С в их исследовании не были связаны с риском привычного невынашивания [47]. Несмотря на то что дефицит антитромбина и дефицит протеина С имеют относительно более высокий тромбогенный потенциал [48], исследований по их изучению меньше из-за их потенциально меньшей распространенности у беременных: распространенность дефицита антитромбина и протеина С в общей популяции оценивается в 0,02–0,20 % и 0,2–1,5 % соответственно [49]. Необходимы дополнительные исследования, чтобы прояснить эту взаимосвязь.
Ингибитор активатора плазминогена-1 / Plasminogen activator inhibitor-1
Ингибитор активатора плазминогена-1 является одним из белков системы фибринолиза, который имеет решающее значение для имплантации эмбриона. Белок PAI-1 представляет собой ингибитор сериновой протеазы, который регулирует фибринолиз и тромбоз путем ингибирования активности тканевого активатора плазминогена (англ. tissue plasminogen activator, t-PA) и урокиназного активатора плазминогена (англ. urokinase plasminogen activator, uPA). PAI-1, являясь основным ингибитором плазминогена, необходим для регулирования баланса коагуляции и фибринолиза на границе между матерью и плодом. Это имеет решающее значение для инвазии трофобласта во время имплантации эмбриона. Предполагается, что нарушения продукции PAI-1 могут оказывать повреждающее влияние на имплантацию эмбриона и раннюю плацентацию.
Одна из наиболее распространенных мутаций, влияющих на продукцию PAI-1, – мутация PAI-1-675 4G/4G, которая связана с более высокой экспрессией гена PAI-1. Метаанализ H. Zeng с соавт. подтвердил, что женщины с генотипом PAI-1 4G/4G подвергаются более высокому риску RIF, а значит, генотип PAI-675 4G/4G может служить одним из предрасполагающих факторов RIF [50].
Антифосфолипидный синдром / Antiphospholipid syndrome
Один из распространенных факторов неудач имплантации в программах ЭКО – это антифосфолипидный синдром (АФС), аутоиммунное заболевание, основным клиническим проявлениями которого являются тромбозы и осложнения беременности на фоне циркуляции высокого титра антифосфолипидных антител (АФА).
Антифосфолипидные антитела – неспецифические антитела против кардиолипина, фосфатидилсерина, фосфатидинозитола, фосфатидилглицерола, фосфатидилхолина, аннексина V и β2-гликопротеина 1.
АФС может приводить к прерыванию беременности, а также к преждевременным родам и преэклампсии. По данным некоторых исследований, АФС может быть связан с первичным бесплодием [51]. АФА связываются с трофобластом, снижая его способность к инвазии, оказывают провоспалительные эффекты, способствуя плацентарной недостаточности, ограничению внутриутробного роста и потере плода [52]. Исследования показали, что вышеперечисленные антитела присутствуют у пациентов с RIF, однако специфические клинические и лабораторные критерии АФС могут не соблюдаться у этой группы пациенток [4].
В недавнем обзоре Е. Papadimitriou с соавт. обобщены исследования, оценивающие распространенность АФА у женщин с RIF [53]. Относительный риск для наличия любого типа АФА составил 3,06 у женщин с RIF по сравнению с женщинами, имеющими хотя бы одно успешное ЭКО c переносом эмбриона. Еще одно недавнее исследование оценило распространенность АФС (соответствующего всем клиническим и лабораторным критериям) у 185 пациентов с RIF и показало АФС только у 2,88 % пациентов, при этом менее 5 % имели АФА [54].
АФА связаны с плохими исходами беременности, но их влияние на имплантацию эмбриона остается не до конца изученным.
В дополнение к Сиднейским рекомендациям по акушерской заболеваемости, связанной с АФА, АФА связывают с такими акушерскими осложнениями, как отслойка плаценты, преждевременный разрыв плодных оболочек и неудачи ЭКО [55]. АФА вызывают мик-
рососудистый тромбоз, который влияет на децидуализацию, делая ее недостаточной, и генерирует не-
адекватный для инвазии эмбриона эндометрий, влияя на ранние стадии имплантации, в конечном итоге приводя к женскому бесплодию, неудаче имплантации и самопроизвольному аборту [56].
J. Khizroeva с соавт. в своем исследовании показали, что женщины с циркуляцией АФА демонстрируют более высокий уровень неудач ЭКО и худшие репродуктивные результаты по сравнению с женщинами без АФА. Успешное наступление беременности, несмотря на наличие АФА, может быть связано со своевременным началом терапии ацетилсалициловой кислотой и низкомолекулярными гепаринами (НМГ) [57]. Динамическое наблюдение, стратификация рисков, а также использование ацетилсалициловой кислоты и НМГ улучшают исходы беременности у беременных с АФС [58]
Метаанализ А. Busnelli с соавт. исследовал использование НМГ у пациентов с RIF (3 неудачных переноса эмбриона), но не смог показать влияние НМГ на частоту живорождения у этой группы пациентов [59].
Еще один потенциальный эффект НМГ – противовоспалительный. В исследовании Y. Fan с соавт. адъювантное лечение НМГ в некоторой степени снижало содержание интерлейкина-6 и фактора некроза опухоли альфа (англ. tumor necrosis factor alpha, TNF-α) в сыворотке крови, что указывает на то, что НМГ обладают потенциалом ингибировать воспалительный процесс [60].
Факторы со стороны отца / Paternal factors
На мужскую фертильность могут влиять несколько факторов, которые могут быть врожденными, эндокринными, иммунологическими, онкологическими, инфекционными или обусловленными образом жизни. Причины мужского бесплодия включают крипторхизм, варикоцеле, гормональный дисбаланс и химиотерапию. Кроме того, за мужской фактор бесплодия могут быть ответственны аномалии кариотипа, мутации отдельных генов и полиморфизмы, микроделеции Y-хромосомы, а также фрагментантация ДНК сперматозоидов.
Различные методы лечения были предложены для партнеров-мужчин пациенток с RIF. К ним относятся улучшение качества спермы, например, прием антиоксидантов, и методы отбора функциональных сперматозоидов, такие как сортировка магнитно-активируемых клеток (англ. magnetic activated cell sorting, MACS), интрацитоплазматическая инъекция морфологически отобранных сперматозоидов (англ. intra cytoplasmic sperm injection, ICSI), а также хирургическое извлечение сперматозоидов, например, экстракция сперматозоидов из ткани яичка (англ. testicular sperm extraction, TESE) [4].
Образ жизни мужчин также может влиять на фертильность. Ожирение коррелирует с плохим качеством спермы [61]. Курение, избыточное потребление кофеина, употребление алкоголя не только ухудшают обычные параметры спермы, но и, вероятно, негативно влияют на целостность ДНК сперматозоидов и их окислительно-восстановительный статус [62].
Таким образом, модификация образа жизни может помочь улучшить определенные параметры спермы и качество получаемых эмбрионов, однако такие вмешательства не оценивались с точки зрения их влияния на RIF [4].
Факторы со стороны эмбриона / Embryo factors
Один из ключевых факторов, определяющих достижение живого результата ВРТ – качество эмбриона, зависит как от качества ооцита, так и от качества спермы, из которой образовался эмбрион.
Большинство клиник ЭКО в циклах ВРТ переносят эмбрионы на стадии бластоцисты (5–6-й день) вместо эмбрионов на стадии дробления (день 2). Однако Кокрейновский обзор 2016 г. установил, что доказательства в пользу переноса бластоцисты над переносом эмбрионов на стадии дробления были низкого качества для исхода живорождения и умеренного качества для клинического исхода беременности [63].
Рандомизированное контролируемое исследование 2018 г. показало отсутствие существенной разницы в исходах живорождения между женщинами с переносом замороженных эмбрионов и с переносом свежих эмбрионов с эмбрионами на стадии дробления. Кроме того, между двумя группами не было существенных различий в биохимических показателях беременности, имплантации, клинической беременности или неонатальных исходах [64].
Заключение / Conclusion
Имплантация эмбриона имеет фундаментальное значение для успешной беременности. Она зависит от наличия специфической внутриутробной среды, биологически неповрежденного эмбриона и сложного ряда взаимодействий между ними.
Рецидивирующая неудача имплантации является неприятным явлением как для пациентов, так и для врачей, и ее лечение представляет собой одну из самых сложных, но важных целей в области ВРТ. Возможные причины RIF включают неправильный образ жизни, низкое качество половых клеток, тромбофилию, факторы со стороны матки и патологии придатков. Однако, несмотря на то, что известно много факторов RIF, в большинстве случаев этиология этого состояния остается неизвестной.
Эффективная терапевтическая стратегия стала бы революцией в этой области и явилась бы фактором, увеличивающим шансы успешного наступления беременности в протоколах ВРТ. В этом контексте будущие клинические исследования должны быть сосредоточены на подтверждении терапевтических подходов, для которых уже имеются надежные данные об их эффективности.
Список литературы
1. Zegers-Hochschild F., Adamson G.D., Dyer S. et al. The International Glossary on Infertility and Fertility Care, 2017. Fertil Steril. 2017;108(3):393–406. https://doi.org/10.1016/j.fertnstert.2017.06.005.
2. ВОЗ: бесплодием страдает каждый шестой человек в мире. Женева, Швейцария: Всемирная организация здравоохранения, 2023. Режим доступа: https://www.who.int/ru/news/item/04-04-2023-1-in-6-people-globally-affected-by-infertility. [Дата доступа: 04.04.2024].
3. Регистр ВРТ РАРЧ. Отчёт за 2021 год. СПб., 2023. 29 с. Режим доступа: https://www.rahr.ru/d_registr_otchet/RegistrVRT_2021.pdf. [Дата доступа: 04.04.2024].
4. ESHRE Working Group on Recurrent Implantation Failure; Cimadomo D., de Los Santos M.J., Griesinger G. et al. ESHRE good practice recommendations on recurrent implantation failure. Hum Reprod Open. 2023;2023(3):hoad023. https://doi.org/10.1093/hropen/hoad023.
5. Ma J., Gao W., Li D. Recurrent implantation failure: a comprehensive summary from etiology to treatment. Front Endocrinol (Lausanne). 2023;13:1061766. https://doi.org/10.3389/fendo.2022.1061766.
6. Bellver J. BMI and miscarriage after IVF. Curr Opin Obstet Gynecol. 2022;34(3):114–21. https://doi.org/10.1097/GCO.0000000000000778.
7. Sermondade N., Huberlant S., Bourhis-Lefebvre V. et al. Female obesity is negatively associated with live birth rate following IVF: a systematic review and meta-analysis. Hum Reprod Update. 2019;25(4):439–51. https://doi.org/10.1093/humupd/dmz011.
8. Broughton D.E., Moley K.H. Obesity and female infertility: potential mediators of obesity’s impact. Fertil Steril. 2017;107:840–7. https://doi.org/10.1016/j.fertnstert.2017.01.017.
9. Galanti F., Licata E., Paciotti G. et al. Impact of different typologies of smoking on ovarian reserve and oocyte quality in women performing ICSI cycles: an observational prospective study. Eur Rev Med Pharmacol Sci. 2023;27(11):5190–9. https://doi.org/10.26355/eurrev_202306_32637.
10. Rooney K.L., Domar A.D. The relationship between stress and infertility. Dialogues Clin Neurosci. 2018;20(1):41–7. https://doi.org/10.31887/DCNS.2018.20.1/klrooney.
11. Liu Z., Zheng Y., Wang B. et al. The impact of sleep on in vitro fertilization embryo transfer outcomes: a prospective study. Fertil Steril. 2023;119(1):47–55. https://doi.org/10.1016/j.fertnstert.2022.10.015.
12. Papas R.S., Kutteh W.H. Genetic testing for aneuploidy in patients who have had multiple miscarriages: a review of current literature. Appl Clin Genet. 2021;14:321–9. https://doi.org/10.2147/TACG.S320778.
13. Hawke D.C., Watson A.J., Betts D.H. Extracellular vesicles, microRNA and the preimplantation embryo: non-invasive clues of embryo well-being. Reprod Biomed Online. 2021;42(1):39–54. https://doi.org/10.1016/j.rbmo.2020.11.011.
14. Martín Á., Rodrigo L., Beltrán D. et al. The morphokinetic signature of mosaic embryos: evidence in support of their own genetic identity. Fertil Steril. 2021;116(1):165–73. https://doi.org/10.1016/j.fertnstert.2020.12.031.
15. Vitagliano A., Paffoni A., Viganò P. Does maternal age affect assisted reproduction technology success rates after euploid embryo transfer? A systematic review and meta-analysis. Fertil Steril. 2023;120(2):251–65. https://doi.org/10.1016/j.fertnstert.2023.02.036.
16. Mikwar M., MacFarlane A.J., Marchetti F. Mechanisms of oocyte aneuploidy associated with advanced maternal age. Mutat Res Rev Mutat Res. 2020;785:108320. https://doi.org/10.1016/j.mrrev.2020.108320.
17. Sato T., Sugiura-Ogasawara M., Ozawa F. et al. Preimplantation genetic testing for aneuploidy: a comparison of live birth rates in patients with recurrent pregnancy loss due to embryonic aneuploidy or recurrent implantation failure. Hum Reprod. 2019;34(12):2340–8. https://doi.org/10.1093/humrep/dez229.
18. Franasiak J.M., Alecsandru D., Forman E.J. et al. A review of the pathophysiology of recurrent implantation failure Fertil Steril. 2021;116(6):1436–48. https://doi.org/10.1016/j.fertnstert.2021.09.014.
19. Vaduva C.C., Constantinescu C., Serbanescu M. et al. The association between endometrial polyps, chronic endometritis, and IVF outcomes. Eur Rev Med Pharmacol Sci. 2023;27(18):8895–04. https://doi.org/10.26355/eurrev_202309_33810.
20. Munro M.G. Uterine polyps, adenomyosis, leiomyomas, and endometrial receptivity. Fertil Steril. 2019;111(4):629–40. https://doi.org/10.1016/j.fertnstert.2019.02.008.
21. Coutinho L.M., Assis W.A., Spagnuolo-Souza A., Reis FM. Uterine fibroids and pregnancy: how do they affect each other? Reprod Sci. 2022;29(8):2145–51. https://doi.org/10.1007/s43032-021-00656-6.
22. Don E.E., Mijatovic V., Huirne J.A.F. Infertility in patients with uterine fibroids: a debate about the hypothetical mechanisms. Hum Reprod. 2023;38(11):2045–54. https://doi.org/10.1093/humrep/dead194.
23. Machado-Lopez A., Simón C., Mas A. Molecular and cellular insights into the development of uterine fibroids. Int J Mol Sci. 2021;22(16):8483. https://doi.org/10.3390/ijms22168483.
24. Carrera M, Pérez Millan F, Alcázar JL, et al. Effect of Hysteroscopic metroplasty on reproductive outcomes in women with septate uterus: systematic review and meta-analysis. J Minim Invasive Gynecol. 2022;29(4):465–75. https://doi.org/10.1016/j.jmig.2021.10.001.
25. Cenksoy P., Ficicioglu C., Yıldırım G., Yesiladali M. Hysteroscopic findings in women with recurrent IVF failures and the effect of correction of hysteroscopic findings on subsequent pregnancy rates. Arch Gynecol Obstet. 2013;287(2):357–60. https://doi.org/10.1007/s00404-012-2627-5.
26. Kimura F, Takebayashi A, Ishida M, et al. Review: chronic endometritis and its effect on reproduction. J Obstet Gynaecol Res. 2019;45(5):951–60. https://doi.org/10.1111/jog.13937.
27. Santoro A., Travaglino A., Inzani F. et al. The role of plasma cells as a marker of chronic endometritis: a systematic review and meta-analysis. Biomedicines. 2023;11(6):1714. https://doi.org/10.3390/biomedicines11061714.
28. Li Y., Xu Y., Yu S. et al. Chronic endometritis impairs embryo implantation in patients with repeated implantation failure: a retrospective study. Taiwan J Obstet Gynecol. 2022;61(6):984–8. https://doi.org/10.1016/j.tjog.2021.01.034.
29. Li J., Li X., Ding J. et al. Analysis of pregnancy outcomes in patients with recurrent implantation failure complicated with chronic endometritis. Front Cell Dev Biol. 2023;11:1088586. https://doi.org/10.3389/fcell.2023.1088586.
30. Lin Y., Qi J., Sun Y. Platelet-rich plasma as a potential new strategy in the endometrium treatment in assisted reproductive technology. Front Endocrinol (Lausanne). 2021;12:707584. https://doi.org/10.3389/fendo.2021.707584.
31. Zondervan K.T., Becker C.M., Missmer S.A. Endometriosis. N Engl J Med. 2020;382(13):1244–56. https://doi.org/10.1056/NEJMra1810764.
32. Viganò P., Reschini M., Ciaffaglione M. et al. Conventional IVF performs similarly in women with and without endometriosis. J Assist Reprod Genet. 2023;40(3):599–607. https://doi.org/10.1007/s10815-022-02700-z.
33. Somigliana E., Li Piani L., Paffoni A. et al. Endometriosis and IVF treatment outcomes: unpacking the process. Reprod Biol Endocrinol. 2023;21(1):107. https://doi.org/10.1186/s12958-023-01157-8.
34. Zhong C., Gao L., Shu L. et al. Analysis of IVF/ICSI outcomes in endometriosis patients with recurrent implantation failure: influence on cumulative live birth rate. Front Endocrinol (Lausanne). 2021;12:640288. https://doi.org/10.3389/fendo.2021.640288.
35. Guo S.W. Cracking the enigma of adenomyosis: an update on its pathogenesis and pathophysiology. Reproduction. 2022;164(5):R101–R121. https://doi.org/10.1530/REP-22-0224.
36. Khan K.N., Fujishita A., Mori T. Pathogenesis of human adenomyosis: current understanding and its association with infertility. J Clin Med. 2022;11(14):4057. https://doi.org/10.3390/jcm11144057.
37. Younis J.S., Shapso N., Ben-Sira Y. et al. Endometrioma surgery-a systematic review and meta-analysis of the effect on antral follicle count and anti-Müllerian. Am J Obstet Gynecol. 2022;226(1):33–51.e7. https://doi.org/10.1016/j.ajog.2021.06.102.
38. Moreno-Sepulveda J., Romeral C., Niño G., Pérez-Benavente A. The effect of laparoscopic endometrioma surgery on anti-Müllerian hormone: a systematic review of the literature and meta-analysis. JBRA Assist Reprod. 2022;26(1):88–104. https://doi.org/10.5935/1518-0557.20210060.
39. Polyzos N.P., Drakopoulos P., Parra J. et al. Cumulative live birth rates according to the number of oocytes retrieved after the first ovarian stimulation for in vitro fertilization/intracytoplasmic sperm injection: a multicenter multinational analysis including ~15,000 women. Fertil Steril. 2018;110(4):661–670.e1. https://doi.org/10.1016/j.fertnstert.2018.04.039.
40. Хизроева Д.Х., Бабаева Н.Н., Макацария Н.А. и др. Клиническое значение гемостазиологического скрининга на тромбофилию у беременных с тромбозами в анамнезе. Акушерство, Гинекология и Репродукция. 2022;16(5):528–40. https://doi.org/10.17749/2313-7347/ob.gyn.rep.2022.361.
41. Neamţu S.D., Stanca L., Siminel M.A. et al. The procoagulant status. Hypercoagulability as a risk factor of primary and secondary infertility. Rom J Morphol Embryol. 2021;62(3):829–34. https://doi.org/10.47162/RJME.62.3.21.
42. Клинические рекомендации – Венозные осложнения во время беременности и послеродовом периоде. Акушерская тромбоэмболия – 2022-2023-2024 (14.02.2022). М.: Министерство здравоохранения Российской Федерации, 2022. 66 с. Режим доступа: http://disuria.ru/_ld/11/1153_kr22O22MZ.pdf. [Дата доступа: 04.04.2024].
43. El Sobky E., Ragheb S.G., Deif G.M. Hereditary thrombophilia in recurrent IVF failure. Ain Shams Medical Journal. 2021;72(2):301–6.
44. Padda J., Khalid K., Mohan A. et al. Factor V Leiden G1691A and prothrombin gene G20210A mutations on pregnancy outcome. Cureus. 2021;13(8):e17185. https://doi.org/10.7759/cureus.17185.
45. Malkhassian D., Sabir S., Sharma S. Physiology, Factor XIII. In: StatPearls. Treasure Island (FL): StatPearls Publishing, 2023 Jan.
46. Sillen M., Declerck P.J. Thrombin activatable fibrinolysis inhibitor (TAFI): an updated narrative review. Int J Mol Sci. 2021;22(7):3670. https://doi.org/10.3390/ijms22073670.
47. Liu X., Chen Y., Ye C. et al. Hereditary thrombophilia and recurrent pregnancy loss: a systematic review and meta-analysis. Hum Reprod. 2021;36(5):1213–29. https://doi.org/10.1093/humrep/deab010.
48. Pearson-Stuttard B., Bagot C., Ciantar E. et al. Severe antithrombin deficiency in pregnancy: Achieving adequate anticoagulation. Obstet Med. 2019;12(1):45–51. https://doi.org/10.1177/1753495X17741025.
49. Mitriuc D., Popuşoi O., Catrinici R., Friptu V. The obstetric complications in women with hereditary thrombophilia. Med Pharm Rep. 2019;92(2):106–10. https://doi.org/10.15386/cjmed-1097.
50. Zeng H., He D., Hu L. et al. PAI-1 4G/4G genotype is associated with recurrent implantation failure: a systematic review and meta-analysis. Reprod Sci. 2021;28(11):3051–60. https://doi.org/10.1007/s43032-021-00623-1.
51. Khizroeva J., Nalli C., Bitsadze V. et al. Infertility in women with systemic autoimmune diseases. Best Pract Res Clin Endocrinol Metab. 2019;33(6):101369. https://doi.org/10.1016/j.beem.2019.101369.
52. Rodrigues V.O., Soligo A.G.E.S., Pannain G.D. Antiphospholipid antibody syndrome and infertility. Rev Bras Ginecol Obstet. 2019;41(10):621–7. https://doi.org/10.1055/s-0039-1697982.
53. Papadimitriou E., Boutzios G., Mathioudakis A.G. et al. Presence of antiphospholipid antibodies is associated with increased implantation failure following in vitro fertilization technique and embryo transfer: A systematic review and meta-analysis. PLoS One. 2022;17(7):e0260759. https://doi.org/10.1371/journal.pone.0260759.
54. Vomstein K., Voss P., Molnar K. et al. Two of a kind? Immunological and clinical risk factors differ between recurrent implantation failure and recurrent miscarriage. J Reprod Immunol. 2020;141:103166. https://doi.org/10.1016/j.jri.2020.103166.
55. Alijotas-Reig J. Does incomplete obstetric antiphospholipid syndrome really exist? Med Clin (Barc). 2021;156(10):515–9. https://doi.org/10.1016/j.medcli.2020.12.023.
56. Jarne-Borràs M., Miró-Mur F., Anunciación-Llunell A., Alijotas-Reig J. Antiphospholipid antibodies in women with recurrent embryo implantation failure: A systematic review and meta-analysis. Autoimmun Rev. 2022;21(6):103101. https://doi.org/10.1016/j.autrev.2022.103101.
57. Khizroeva J., Makatsariya A., Bitsadze V. et al. IVF Outcomes in women with antiphospholipid antibodies circulation. Res Pract Thromb Haemost. 2020;4(Suppl 1): PB1906.
58. Ambati A., Knight J.S., Zuo Y. Antiphospholipid syndrome management: a 2023 update and practical algorithm-based approach. Curr Opin Rheumatol. 2023;35(3):149–60.
59. Busnelli A., Somigliana E., Cirillo F. et al. Efficacy of therapies and interventions for repeated embryo implantation failure: a systematic review and meta-analysis. Sci Rep. 2021;11(1):1747. https://doi.org/10.1038/s41598-021-81439-6.
60. Fan Y., Jiang M., Gong D., Zou C. Efficacy and safety of low-molecular-weight heparin in patients with sepsis: a meta-analysis of randomized controlled trials. Sci Rep. 2016;6:25984. https://doi.org/10.1038/srep25984.
61. Ma J., Wu L., Zhou Y. et al. Association between BMI and semen quality: an observational study of 3966 sperm donors. Hum Reprod. 2019;34(1):155–62. https://doi.org/10.1093/humrep/dey328.
62. Rahban R., Nef S. Regional difference in semen quality of young men: a review on the implication of environmental and lifestyle factors during fetal life and adulthood. Basic Clin Androl. 2020;30:16. https://doi.org/10.1186/s12610-020-00114-4.
63. Glujovsky D., Farquhar C., Quinteiro Retamar A.M. et al. Cleavage stage versus blastocyst stage embryo transfer in assisted reproductive technology. Cochrane Database Syst Rev. 2016;(6):CD002118. https://doi.org/10.1002/14651858.CD002118.pub5.
64. Shi Y., Sun Y., Hao C. et al. Transfer of fresh versus frozen embryos in ovulatory women. N Engl J Med. 2018;378(2):126–36. https://doi.org/10.1056/NEJMoa1705334.
Об авторах
А. А. ПервушинаРоссия
Первушина Анна Андреевна – ординатор, врач акушер-гинеколог кафедры акушерства, гинекологии и перинатальной медицины Клинического института детского здоровья имени Н.Ф. Филатова
119991 Москва, ул. Большая Пироговская, д. 2, стр. 4
Д. Х. Хизроева
Россия
Хизроева Джамиля Хизриевна – профессор кафедры акушерства, гинекологии и перинатальной медицины Клинического института детского здоровья имени Н.Ф. Филатова
Scopus Author ID: 57194547147
Researcher ID: F-8384-2017
119991 Москва, ул. Большая Пироговская, д. 2, стр. 4
В. О. Бицадзе
Россия
Бицадзе Виктория Омаровна – д.м.н., профессор РАН, профессор кафедры акушерства, гинекологии и перинатальной медицины Клинического института детского здоровья имени Н.Ф. Филатова
Scopus Author ID: 6506003478
Researcher ID: F-8409-2017
119991 Москва, ул. Большая Пироговская, д. 2, стр. 4
Что уже известно об этой теме?
► Повторные неудачи имплантации (RIF) – относительно новый термин. Это состояние является актуальной многофакторной проблемой вспомогательных репродуктивных технологий (ВРТ), широко применяемых сегодня
► Возможные факторы RIF классифицируют на факторы со стороны женщины, мужчины, эмбриона, а также смешанные, что может затруднять диагностику и комплексное лечение этого состояния.
Что нового дает статья?
► Статья обобщает основные характеристики факторов RIF со стороны матери (образ жизни, генетический фактор, патологии со стороны матки, эндометриоз и аденомиоз, тромбофилия), возможные механизмы, приводящие к RIF, вопросы диагностики и актуальные варианты их преодоления, доступные в настоящее время.
Как это может повлиять на клиническую практику в обозримом будущем?
► Терапия, направленная на факторы RIF, может улучшить результаты ВРТ и повысить частоту наступления беременности и живорождения.
► Индивидуальный подход к специфическому обследованию и лечению RIF позволит избежать неэффективных медицинских вмешательств и приблизить наступление долгожданной беременности.
Рецензия
Для цитирования:
Первушина А.А., Хизроева Д.Х., Бицадзе В.О. К вопросу о повторных неудачах имплантации при вспомогательных репродуктивных технологиях. Акушерство, Гинекология и Репродукция. 2024;18(3):401-413. https://doi.org/10.17749/2313-7347/ob.gyn.rep.2024.508
For citation:
Pervushina A.A., Khizroeva J.Kh., Bitsadze V.O. Regarding repeated implantation failures coupled to assisted reproductive technologies. Obstetrics, Gynecology and Reproduction. 2024;18(3):401-413. (In Russ.) https://doi.org/10.17749/2313-7347/ob.gyn.rep.2024.508

Контент доступен под лицензией Creative Commons Attribution-NonCommercial-ShareAlike 4.0 International License.











































