Перейти к:
Обзор механизма действия и результатов клинических исследований противогрибкового препарата ибрексафунгерп
https://doi.org/10.17749/2313-7347/ob.gyn.rep.2024.500
Аннотация
Введение. Вульвовагинальный кандидоз – чрезвычайно распространенная патология женских половых органов, приводящая к длительному рецидивирующему течению и множеству осложнений. Хотя в наши дни широко известно о развитии резистентности бактериальных возбудителей к антибиотикам, не стоит забывать о подобном явлении и у других групп возбудителей инфекций. Так, грибковая инфекция также требует разработки новых терапевтических методик и медикаментозных противогрибковых препаратов, таких как ибрексафунгерп.
Цель: провести анализ литературы, раскрывающей механизм действия, эффективность, противогрибковый спектр и результаты клинических испытаний нового орального противогрибкового препарата ибрексафунгерп.
Материалы и методы. Проведен поиск публикаций в электронных базах данных PubMed, еLibrary и ClinicalTrials.gov, опубликованных за последние 25 лет. Поиск исследований проводился с использованием следующих ключевых слов на русском и английском языках: «кандидоз», «вульвовагинальный кандидоз», «противогрибковые препараты», «ибрексафунгерп», «клинические испытания», «механизм действия», «candidiasis», «vulvovaginal candidiasis», «antifungal drugs», «ibrexafungerp», «clinical trials», «mechanism of action». Оценка статей проводилась в соответствии с рекомендациями PRISMA. Авторы независимо друг от друга анализировали названия и аннотации идентифицированных публикаций, после чего извлекали полный текст релевантных исследований. После процедуры отбора в обзор было включено 46 статей.
Результаты. В обзоре представлена информация о создании препарата ибрексафунгерп, его механизм действия, активность относительно широкого спектра возбудителей, а также результаты 13 продолжающихся и завершенных клинических исследований данного препарата у пациентов с грибковой инфекцией.
Заключение. Проведенный анализ клинических исследований препарата ибрексафунгерп показал, что его хорошая пероральная биодоступность, высокая противогрибковая эффективность и однодневная дозировка в перспективе исключат необходимость в излишне длительной госпитализации и сложных графиках дозирования, тем самым увеличивая приверженность к терапии и вероятность успеха лечения.
Ключевые слова
Для цитирования:
Тагирова Л.И., Фарвазова К.Р., Валеева Д.Р., Орлова М.Д., Губайдуллин И.А., Тулябаева А.М., Абдульманова А.Р., Тряпко Р.В., Шелыгинский Д.А., Ханафиева А.Р., Семенова Н.Г., Такиуллин Э.М. Обзор механизма действия и результатов клинических исследований противогрибкового препарата ибрексафунгерп. Акушерство, Гинекология и Репродукция. 2024;18(2):232-245. https://doi.org/10.17749/2313-7347/ob.gyn.rep.2024.500
For citation:
Tagirova L.I., Farvazova K.R., Valeeva D.R., Orlova M.D., Gubaidullin I.A., Tulyabaeva A.M., Abdulmanova A.R., Tryapko R.V., Shelyginsky D.A., Khanafieva A.R., Semenova N.G., Takiullin E.M. Reviewing the mechanism of action and results of clinical studies on the antifungal drug ibrexafungerp. Obstetrics, Gynecology and Reproduction. 2024;18(2):232-245. (In Russ.) https://doi.org/10.17749/2313-7347/ob.gyn.rep.2024.500
Введение / Introduction
В современном мире наблюдается негативная динамика распространенности инфекционно-воспалительных заболеваний женских половых органов. Бактериальный вагиноз является одной из основных причин обращения представительниц женского населения России за амбулаторно-поликлинической помощью. Множество исследований свидетельствуют о высокой частоте случаев вульвовагинального кандидоза (ВВК) во всем мире [1].
Вульвовагинальный кандидоз или молочница – чрезвычайно распространенная инфекция слизистых оболочек нижнего женского репродуктивного тракта, течение которой сопровождается выраженными клиническими проявлениями. Рассматривая статистику инфекционно-воспалительных заболеваний слизистых вульвы и влагалища, по данным разных авторов, от 15 до 40 % подобных случаев обусловлены грибковой инфекцией, 75 % женщин имеют первичный ВВК в анамнезе, а у 40–45 % пациенток рецидивы встречаются 2 и более раз. Помимо прочего, у 10–20 % женщин инфекционный процесс может протекать бессимптомно или в форме носительства [2][3].
По данным исследований, негативная динамика заболеваемости ВВК связана с ростом инфицирования пациентов штаммами Candida non-albicans, резистентными к большинству противогрибковых препаратов. Также в подобных случаях специалисты встречаются с ограничениями терапевтического подхода к ВВК, что может приводить к психосоматическим нарушениям и снижению качества жизни пациенток [1].
Наиболее встречаемым возбудителем ВВК является полиморфный оппортунистический грибок Candida albicans семейства Cryptococcaceae (76–89 %), меньшую роль в заболеваемости ВВК играют C. tropicalis (3–5 %), C. parapsilosis (3–5 %), обнаруживаемая нередко в стационарах, C. krusei (1–3 %) и др. В то же время в последние годы наблюдается рост частоты выявления инфекций, вызываемых видами грибов, резистентными к противогрибковым препаратам [2][4].
Помимо роста резистентности данных видов грибов, развитие рецидивирующего ВВК (РВВК) объясняется состоянием собственно организма пациента, особенностями барьерной функции слизистых оболочек вульвы и влагалища. Поскольку грибы рода Candida относятся к условно-патогенной микрофлоре, выявляемой как в окружающей среде, так и на поверхности кожных покровов и слизистых оболочек здорового человека, РВВК может быть следствием нарушения местных и общих иммунных механизмов, а также присутствия множества факторов риска, таких как сахарный диабет, прием иммуносупрессоров, антибиотиков, гормональных препаратов и вирусных инфекционных заболеваний [5][6]. Вместе с тем, хотя ВВК не является инфекцией, передаваемой половым путем (ИППП), не исключена возможность возникновения кандидозного баланопостита у мужчин – половых партнеров женщин с BBK [2–4].
В результате оценки имеющейся статистики очевидна высокая актуальность проблемы ВВК и РВВК, требующая совершенствования как профилактических, так и лечебных мероприятий, контроля факторов риска возникновения рецидивов и разработки новых методик и медикаментозных противогрибковых препаратов.
Цель: провести анализ литературы, раскрывающей механизм действия, эффективность и противогрибковый спектр, и результаты клинических испытаний нового орального противогрибкового препарата ибрексафунгерп.
Материалы и методы / Materials and Methods
Авторами был проведен поиск публикаций в электронных базах данных PubMed, еLibrary и ClinicalTrials.gov, опубликованных за последние 25 лет. Поиск исследований проводился с использованием следующих ключевых слов на русском и английском языках: «кандидоз», «вульвовагинальный кандидоз», «противогрибковые препараты», «ибрексафунгерп», «клинические испытания», «механизм действия», «candidiasis», «vulvovaginal candidiasis», «antifungal drugs», «ibrexafungerp», «clinical trials», «mechanism of action». Оценка статей проводилась в соответствии с рекомендациями PRISMA. Авторы независимо друг от друга анализировали названия и аннотации идентифицированных публикаций, после чего извлекали полный текст релевантных исследований. Разногласия между авторами разрешались путем привлечения третьего автора, чье мнение оказывалось решающим.
Полнотекстовые версии рукописей оценивались на предмет соотстветсвия следующим критериям включения: исследование опубликовано на русском или английском языке, затрагивает тему терапии вульвовагинального кандидоза, не является тезисом и письмом в редакцию научного журнала; при отборе клинических исследований обязательным критерием включения являлось наличие оценки эффективности ибрексафунгерпа в терапии грибковых инфекций. После процедуры отбора в обзор было включено 46 публикаций. Подробный процесс поиска и отбора публикаций представлен на рисунке 1.
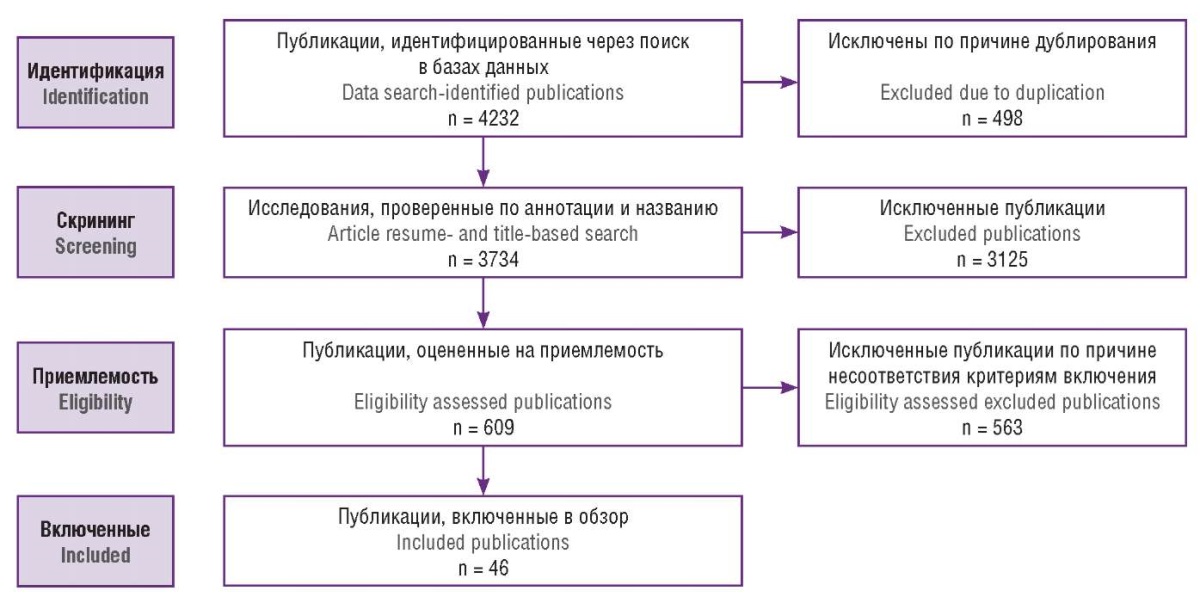
Рисунок 1. Процесс поиска публикаций.
Figure 1. Study search flowchart.
Результаты и обсуждение / Results and Discussion
Актуальная тактика лечения вульвовагинального кандидоза / Current treatment strategy for vulvovaginal candidiasis
Препараты группы азолов в последние годы являются стандартом лечения ВВК. По результатам различных исследований, коэффициент эффективности данной группы препаратов составляет 55–80 % в зависимости от конечных точек [7][8], однако у 44 % женщин обнаруживается рецидивирующее течение. Актуальные клинические рекомендации по лечению неосложненного ВВК рекомендуют короткий курс местных азолов и однократную дозу перорального флуконазола 150 мг для небеременных [9].
Местные азолы могут обеспечить немедленное облегчение, однако у некоторых пациентов проявляется гиперчувствительность к группе местных азолов, проявляющаяся зудом или жжением. Пероральный флуконазол также не лишен недостатков: помимо ограничения применения данного препарата при беременности, флуконазол может приводить к системным нарушениям желудочно-кишечного тракта. При этом для женщин с РВВК рекомендуется трехкратный пероральный прием флуконазола 150 мг каждые 72 ч с последующей поддерживающей терапией на протяжении 6 мес [9][10].
Хотя общепринятые схемы лечения ВВК эффективны в облегчении симптомов заболевания, результаты долгосрочной терапии характеризуются высокой частотой рецидивов [11]. Кроме того, азолорезистентность грибковой инфекции может привести к неэффективности проводимого лечения ВВК даже с точки зрения симптоматической терапии.
Так, неэффективность рекомендуемых схем лечения, ведущая к прогрессированию инфекционного процесса и возникновению осложнений, акцентирует внимание на высокой потребности в разработке новых противогрибковых препаратов [12].
Ибрексафунгерп в терапии вульвовагинального кандидоза / Ibrexafungerp in therapy of vulvovaginal candidiasis
Долгое время, препараты, ингибирующие синтез полимеров клеточной стенки наиболее распространенных грибковых патогенов, эхинокандины, несмотря на их высокую эффективность и низкую токсичность в терапии кандидозной инфекции, имели ограниченное применение в связи с возможностью их исключительного парентерального введения [13][14]. Данное явление связано с высокой молекулярной массой компонентов эхинокандинов, что проявляется низкой биодоступностью при их пероральном приеме. Активные исследования, проводимые с целью ликвидации данного ограничения, привели к открытию энфумафунгина, структурно отличающегося от эхинокандинов [15][16]. Дальнейшие исследования по модификации эхинокандина (повышение его пероральной биодоступности и фармакокинетического эффекта) привели к разработке его полусинтетического производного, который был назван ибрексафунгерп (англ. ibrexafungerp, IBX) [17].
Данное соединение продемонстрировало активность in vitro против клинически важных грибковых патогенов, включая Candida spp. и Aspergillus spp. Главным преимуществом IBX является активность против многих резистентных к эхинокандинам штаммов Candida, что объясняется отличиями в целевых сайтах связывания [17].
IBX (ранее SCY-078 или MK-3118) – это первый в своем классе перорально активный полусинтетический ингибитор β-(1,3)-D-глюкансинтазы (англ. glucan synthase inhibitor, GSI), участвующего в синтезе полимера грибковой клеточной стенки β-(1,3)-D-глюкана [18]. Данный препарат одобрен Управлением по контролю качества пищевых продуктов и лекарственных средств США (англ. Food and Drug Administration, FDA) в июне 2021 г.; кроме того, FDA предоставило статус квалифицированного инфекционного продукта (англ. qualified infectious disease product, QIDP) и программы ускоренного рассмотрения препаратов (англ. Fast Track Designation) для лечения и профилактики рецидивов ВВК с помощью IBX [19].
Доля глюканов составляет 50–60 % от сухого веса стенки грибковых клеток, а собственно β-(1,3)-D-глюкан является наиболее важным компонентом грибковой стенки, так как он образует ковалентные связи с множеством структур клетки грибов. Кроме того, β-(1,3)-D-глюкан, будучи самой распространенной молекулой в структуре многих грибковых клеток (65–90 %), является эффективным выбором в качестве мишени для противогрибковой терапии [20].
Механизм действия ибрексафунгерпа / Mechanism of ibrexafungerp action
Основа механизма действия GSI – нарушение структуры клеточной стенки путем ингибирования биосинтеза β-(1,3)-D-глюкана, результатом чего является ее высокая проницаемость, что ведет к нарушению осмотического давления и лизису клетки-мишени (рис. 2) [21].
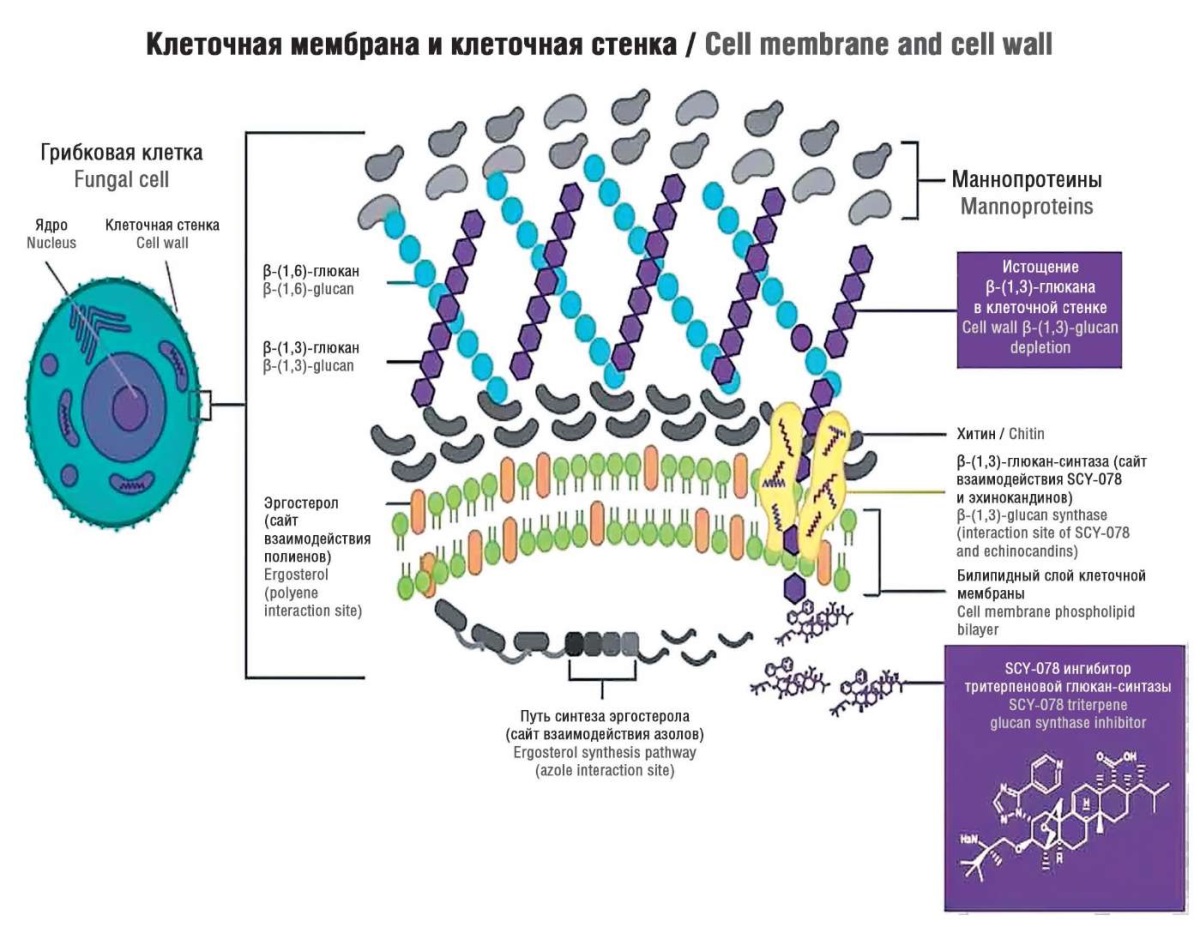
Рисунок 2. Механизм действия ибрексафунгерпа (SCY-078) (адаптировано из [21]).
Figure 2. Mechanism of ibrexafungerp (SCY-078) action (adapted from [21]).
β-(1,3)-D-глюкансинтаза – это трансмембранный ферментный комплекс гликозилтрансферазы, включающий каталитическую субъединицу Fks1p, кодируемую гомологичными генами FKS1, FKS2 и FKS3, и регуляторную субъединицу GTPase, закодированную геном Rho1p [22][23].
Каталитический блок связывает уридинфосфат (УДФ)-глюкозу, регуляторная субъединица связывает гуанозинтрифосфат (англ. guanosine triphosphate, GTP) для катализации полимеризации УДФ-глюкозы с β-(1,3)-D-глюканом, который включен в стенку грибковой клетки, где он выполняет функцию поддержания структурной целостности клеточной стенки [24]. Таким образом, механизм действия IBX аналогичен эхинокандинам – неконкурентное ингибирование фермента β-(1,3)-D-глюкансинтазы, ведущее к фунгицидному действию на Candida spp. и фунгистатическому воздействию на Aspergillus spp. [25][26].
Широкое и длительное применение эхинокандинов привело к развитию эхинокандин-резистентных (англ. echinocandin-resistant, ER) штаммов у Candida spp., и в частности, у C. glabrata и C. auris. Возникновение устойчивости к препаратам данной группы исследователи объясняют мутацией в двух областях гена FKS, обозначенных как горячие точки 1 и 2, кодирующего каталитический сайт ферментного комплекса β-(1,3)-D-глюкансинтазы [27][28]. Однако принципиальной разницей, определяющей активность IBX против резистентных штаммов грибов, является разница целевых сайтов связывания для рассматриваемых препаратов. В то же время частичное совпадение мишеней обуславливает ограниченную перекрестную резистентность между штаммами, устойчивыми к эхинокандину и IBX [29].
Так, ибрексафунгерп обладает мощной активностью против ER C. glabrata с мутациями FKS; однако уже на этапе исследований было определено, что ввиду частичной перекрестной устойчивости некоторые штаммы требуют большего значения минимальной ингибирующей концентрациия (англ. minimum inhibitory concentration, MIC) IBX. Было определено, что восприимчивость данных штаммов грибов к IBX снизилась в 1,6–16 раз относительно штаммов дикого типа. Кроме того, мутации в генах FKS1 (F625del) и FKS2 (F659del) приводят к 40- и 121-кратному увеличению MIC для IBX, соответственно, а также две дополнительные мутации (W715L и A1390D) в гене FKS2, привели к 29- и 20-кратному увеличению MIC для IBX, соответственно [21].
Активность ибрексафунгерпа in vitro / In vitro ibrexafungerp activity
Доклинические исследования препарата IBX продемонстрировали высокую противогрибковую активность против чрезвычайно широкого спектра изолятов Candida. В том числе in vitro восприимчивость к данному препарату проявилась у ряда ER изолятов, включая C. albicans, C. parapsilosis, C. tropicalis, C. auris, C. krusei, C. glabrata, C. guilliermondii, C. lusitaniae, C. inconspicua [28][30]; однако фунгицидная активность против устойчивых к эхинокандинам мутантов FKS (C. albicans, C. krusei, C. tropicalis, C. glabrata, C. auris) была переменной [28][31].
Несмотря на частичную перекрестную резистентность грибов к IBX и эхинокандинам, большинство мутантов Candida FKS были восприимчивы к IBX, в частности C. glabrata и C. auris [28][30][32]. IBX также продемонстрировал мощную активность против панрезистентности, заключающейся в устойчивости C. auris ко всем эхинокандинам и амфотерицину B [33].
Таким образом, IBX демонстрирует высокую активность против большинства Candida ER1 FKS, при этом 70–86 % устойчивых к эхинокандину мутантов восприимчивы к IBX, хотя ряд распространенных Candida spp., за исключением C. parapsilosis, требуют более высоких значений MIC [28][30][34].
Кроме того, 13 других грибковых возбудителей, включая Rhodotorula mucilaginosa, Trichosporon spp. (T. asahii, T. dermatis, T. inkin, T. japonicum) и Arxula adeninivorans, продемонстрировали переменную устойчивость к IBX [28].
Результаты другого исследования, проводимого на широком спектре изолятов IBX, продемонстрировали активность против Malassezia pachydermatis (MIC: 0,5 мкг/мл), Pichia spp. (MIC: 0,5–1,0 мкг/мл) и некоторых возбудителей рода Trichosporon (MIC: 0,125–2,00 мкг/мл) [35].
Также IBX in vitro продемонстрировал мощное ингибирование видовых комплексов Aspergillus (A. fumigatus, A. niger, A. flavus, A. terreus, A. nidulans, A. glaucus, A. ustus, A. versicolor, A. westerdijkiae, A. tamarii, A. calidoustus), включая азолоустойчивые штаммы [35][36].
Хотя ER Aspergillus spp. очень редки, был описан мутант A. fumigatus (S678P). Исследования возможности применения обозреваемого препарата также показали повышенную активность против мутанта S678P ER со значением MIC, которое было в 133 раза меньше, чем наблюдаемое при применении каспофунгина [31].
При исследовании активности IBX против медицинских значимых форм, не относящихся к Aspergillus, была выявлена подверженность его противогрибковому действию у Paecilomyces variotii, Penicillium citrinum, Scytalidium dimidiatum, Alternaria spp. и Cladosporium spp. Однако по результатам исследований, данный препарат не обладал активностью против Mucorales, Fusarium spp., Purpureocillium lilacinum, Lichtheimia coerulea, Lichtheimia corymbifera, Acremonium spp., Cladosporium cladosporioides, Trichoderma citrinoviride и Trichoderma longibrachiatum. Также была определена переменная активность IBX против Scopulariopsis spp. и скромная активность против Scedosporium apiospermum и Lomentospora prolificans [37].
Стоит отметить, что IBX был единственным среди протестированных препаратов, который имел какую-либо активность против панрезистентных изолятов Lomentospora prolificans [37].
Фармакокинетика и фармакодинамика ибрексафунгерпа / Ibrexafungerp pharmacokinetics and pharmacodynamics
Результаты исследований in vivo на модели собак, мышей и крыс продемонстрировали биодоступность первого перорально доступного ингибитора β-(1,3)-D-глюкансинтазы (GSI) около 50 %. Средний терапевтический эффект на мышиной модели после 7 дней двукратного перорального приема IBX составил 14,3 мкмоль/ч, что способствовало высокой противогрибковой активности против C. albicans. IBX был хорошо поглощен плазмой: на модели мышей, крыс и собак биодоступность составила > 51, 45 и 35 %, а период полураспада определен как ~8,3, 9,1 и 15,2 ч для мышей, крыс и собак, соответственно [38].
Оценка in vitro метаболической стабильности IBX с использованием микросом печени грызунов, собак и человека продемонстрировала показатели клиренса ≤ 11, 48 и 34 мкл/мин/мг, соответственно. В результате длительного периода полураспада, линейного снижения концентрации препарата в плазме и умеренного клиренса печени для клинических испытаний была предложена схема однократного суточного приема препарата [39].
Растворимость in vitro IBX обратно пропорциональна рН среды. По результатам исследований были получены данные о высокой растворимости данного препарата в смоделированных средах: имитация желудочного сока (SGF) > 5,2 мг/мл и имитация кишечного сока в процессе приема пищи (FeSSIF) > 3,0 мг/мл, но в среде имитации кишечного сока натощак (FaSSIF) показатели растворимости IBX значительно снижались. Однако цитратная форма IBX позволила достичь внушительных показателей растворимости: > 20 мг/мл в среде SGF и до > 4,2 мг/мл в средах FeSSIF и FaSSIF [38].
Исследование распределения IBX в тканях мышиной модели инвазивного кандидоза продемонстрировало широкое распределение препарата с устойчивым объемом распределения (VDss) > 5 л/кг, что в разы превышает показатели флуконазола и эхинокандинов [40][41].
Кроме того, оценка распределения IBX в тканях и крови после перорального введения демонстрирует многократное превышение его концентрации в тканях организма. Так, относительно плазмы крови данный препарат был выявлен с более высокой, 54-кратной концентрацией в селезенке, 50-кратной – в печени, 31-кратной – в легких, 25-кратной – в костном мозге, 20-кратной – в почках, 12-кратной – в непигментированном и 18-кратной – в пигментированном эпителии, 9-кратной – в тканях слизистой влагалища и 4-кратной концентрации – в тканях скелетной мускулатуры. Однако по результатам исследования установлено ограничение распространения IBX на ткани центральной нервной системы и жировые ткани, а также переменное распределение в ткани хрусталика глаза [39].
При исследованиях путей элиминации IBX с применением углеродной радиоактивной метрики парентеральных и пероральных образцов препарата, применяемых на животных моделях, было определено, что удаление IBX осуществляется в основном через фекалии и желчь (∼90 %), а также незначительная его доля – через мочу (∼1,5 %) [39].
Клиническая эффективность / Clinical effectiveness
В обзор включены 13 продолжающихся и завершенных клинических исследований безопасности и эффективности препарата IBX, проводимых с 01.09.2014, размещенных в базах данных PubMed и ClinicalTrials.gov. Участниками исследований выступили пациенты с разнообразной грибковой инфекцией в возрасте от 18 до 55 лет. Терапевтическим вмешательством в данном ряде исследований выступил препарат IBX под кодовым названием SCY-078, а также ряд традиционно применяемых противогрибковых препаратов, таких как вориконазол, флуконазол, микафунгин и эхинокандин. Также в проводимых исследованиях оценивается эффективность ибрексафунгерпа относительно плацебо. В клинических исследованиях противогрибкового эффекта препарата IBX первичным критерием оценки эффективности проводимой терапии является клиническое выздоровление (полное исчезновение признаков и симптомов). Вторичными критериями послужили микологическое искоренение (отрицательная культура роста грибов), клиническое излечение и микологическая эрадикация, полный клинический ответ при последующем наблюдении и безопасность и переносимость IBX. Данные клинических исследований представлены в таблице 1.
Таблица 1. Перечень текущих и завершенных клинических исследований
препарата ибрексафунгерп (SCY-078).
Table 1. List of ongoing and completed ibrexafungerp (SCY-078) clinical trials.
|
Фаза Phase |
Номер NCT NCT number |
Название Title |
Условия и количество пациентов Conditions and patient number |
Эффективность Effectiveness |
Лекарственные препараты Pharmaceutical agents |
Дизайн и сроки исследования Study design and timeframe |
|
Фаза II Phase II |
NCT03672292 |
Study to Evaluate the Safety and Efficacy of the Coadministration of Ibrexafungerp (SCY-078) With Voriconazole in Patients with Invasive Pulmonary Aspergillosis (SCYNERGIA) |
Инвазивный легочной аспергиллез Invasive pulmonary aspergillosis n = 60 |
Результаты исследования не были представлены Study data not presented |
SCY-078, вориконазол, плацебо SCY-078, voriconazole, placebo |
Многоцентровое, рандомизированное, двойное слепое исследование Multicenter, randomized, double-blind trial 22.01.2019 07.06.2021 |
|
Фаза III Phase III |
NCT03363841 |
Open-Label Study to Evaluate the Efficacy and Safety of Oral Ibrexafungerp (SCY-078) in Patients with Candidiasis Caused by Candida Auris (CARES) |
Кандидоз, инвазивная кандидемия Candidiasis, invasive candidemia n = 30 |
Результаты исследования не были представлены Study data not presented |
SCY-078 |
Многоцентровое открытое несравнительное независимое исследование Multicenter, open-label, non-comparative, independent trial 15.11.2019 15.05.2021 |
|
Фаза III Phase III |
NCT03987620 |
Efficacy and Safety of Oral Ibrexafungerp (SCY-078) vs. Placebo in Subjects with Acute Vulvovaginal Candidiasis (Vanish 306) |
Candida vulvovaginitis n = 449 |
Клиническая эффективность IBX – 72,5 %, плацебо – 49,4 % Clinical efficacy for IBX – 72.5 %, placebo – 49.4 % |
Ibrexafungerp, плацебо Ibrexafungerp, placebo |
Рандомизированное многоцентровое двойное слепое плацебо-контролируемое исследование Randomized, multicenter, double-blind, placebo-controlled trial 07.06.2019 29.04.2020 |
|
Фаза III Phase III |
NCT03734991 |
Efficacy and Safety of Oral Ibrexafungerp (SCY-078) vs. Placebo in Subjects with Acute Vulvovaginal Candidiasis (VANISH 303) |
Candida vulvovaginitis n = 366 |
Клиническая эффективность IBX – 59,5 %, плацебо – 44,0 % Clinical efficacy for IBX – 59.5 %, placebo – 44.0 % |
Ibrexafungerp, плацебо Ibrexafungerp, placebo |
Рандомизированное многоцентровое двойное слепое плацебо-контролируемое исследование Randomized, multicenter, double-blind, placebo-controlled trial 04.01.2019 04.09.2019 |
|
Фаза II Phase II |
NCT02244606 |
Oral Ibrexafungerp (SCY-078) vs. Standard-of-Care Following IV Echinocandin in the Treatment of Invasive Candidiasis |
Микозы, инвазивный кандидоз, кандидемия Mycoses, invasive candidiasis, candidemia n = 27 |
IBX продемонстрировал клиническую эффективность при приеме 500 мг – 71 %, 750 мг – 86 %; SOC – 75 % IBX demonstrated clinical efficacy of 71 % at 500 mg, 750 mg – 86 %; SOC – 75 % |
SCY-078, флуконазол, микафунгин SCY-078, fluconazole, micafungin |
Открытое рандомизированное исследование Open randomized trial 01.09.2014 08.2016 |
|
Фаза III Phase III |
NCT04029116 |
Phase 3 Study of Oral Ibrexafungerp (SCY-078) vs. Placebo in Subjects with Recurrent Vulvovaginal Candidiasis (VVC) (CANDLE) |
Рецидивирующий вульвовагинальный кандидоз Recurrent vulvovaginal candidiasis n = 440 |
Доля участников с эффективным лечением и без доказанного микологического рецидива 65 % для IBX и 53 % для плацебо Percentage of subjects with effective treatment and mycological recurrence-free subjects was 65 % for IBX and 53 % for placebo |
Флуконазол, ibrexafungerp, плацебо Fluconazole, ibrexafungerp, placebo |
Многоцентровое, рандомизированное, двойное слепое плацебо-контролируемое исследование Multicentre, randomized, double-blind, placebo-controlled trial 23.09.2019 09.2021 |
|
Фаза II Phase II |
NCT02679456 |
Safety and Efficacy of Oral Ibrexafungerp (SCY-078) vs. Oral Fluconazole in Subjects with Vulvovaginal Candidiasis |
Вульвовагинальный кандидоз Vulvovaginal candidiasis n = 90 |
Результаты исследования не были представлены Study data not presented |
SCY-078, флуконазол SCY-078, fluconazole |
Рандомизированное многоцентровое слепое исследование Randomized, multicenter, blinded trial 01.11.2015 05.09.2016 |
|
Фаза III Phase III |
NCT03059992 |
Study to Evaluate the Efficacy and Safety of Ibrexafungerp in Patients with Fungal Diseases That Are Refractory to or Intolerant of Standard Antifungal Treatment (FURI) |
Кандидоз, кокцидиоидомикоз, гистоплазмоз, бластомикоз, аспергиллез Candidiasis, coccidioidomycosis, histoplasmosis, blastomycosis, aspergillosis n = 200 |
Результаты исследования не были представлены Study data not presented |
Ibrexafungerp |
Многоцентровое открытое несравнительное исследование Multicenter, open-label, non-comparative trial 01.04.2017 05.12.2021 |
|
Фаза II Phase II |
NCT03253094 |
Dose-Finding Study of Oral Ibrexafungep (SCY-078) vs. Oral Fluconazole in Subjects with Acute Vulvovaginal Candidiasis (DOVE) |
Candida vulvovaginitis n = 186 |
На 10-й день клиническое выздоровление 58 и 52 % и микологическое искоренение 63 и 63 % для флуконазола и IBX, соответственно. На 25 день – клиническое выздоровление 50 и 70 % и микологическое искоренение 38 и 48 %, соответственно On day 10, clinical recovery was 58 and 52 % and mycological eradication was 63 and 63 % for fluconazole and IBX, respectively. On day 25 – clinical recovery was 50 and 70 % and mycological eradication 38 and 48 %, respectively |
Флуконазол, SCY-078 Fluconazole, SCY-078 |
Многоцентровое, рандомизированное, двойное слепое, двойное плацебо, активно контролируемое исследование Multicenter, randomized, double-blind, double-placebo, active-controlled trial 01.08.2017 04.05.2018 |
|
Фаза III Phase III |
NCT05178862 |
A Phase 3, Randomized, Double-blind Study for Patients with Invasive Candidiasis Treated with IV Echinocandin Followed by Either Oral Ibrexafungerp or Oral Fluconazole (MARIO) |
Инвазивный кандидоз, кандидемия Invasive candidiasis, candidemia n = 220 |
N/A |
SCY-078, флуконазол, эхинокандин SCY-078, fluconazole, echinocandin |
Многоцентровое, проспективное, рандомизированное, двойное слепое исследование Multicenter, prospective, randomized, double-blind trial 03.08.2022 02.2024 |
|
Фаза I Phase I |
NCT04307082 |
ADME Study of [ 14C]-Ibrexafungerp in Healthy Male Subjects |
Грибковая инфекция Fungal infection n = 6 |
Результаты исследования не были представлены Study data not presented |
Ibrexafungerp |
Одноцентровое, нерандомизированное исследование Single-center, non-randomized trial 02.12.2019 30.06.2020 |
|
Фаза I Phase I |
NCT05668429 |
ADME Study of [ 14C]-Ibrexafungerp in Healthy Male Subjects |
Грибковая инфекция Fungal infection n = 6 |
Результаты исследования не были представлены Study data not presented |
Ibrexafungerp |
Открытое, одноцентровое, нерандомизированное исследование Open-label, single-centre, non-randomized trial 14.12.2022 09.2023 |
|
Фаза III Phase III |
NCT05399641 |
Ibrexafungerp for the Treatment of Complicated Vulvovaginal Candidiasis |
Вульвовагинальный кандидоз Vulvovaginal candidiasis n = 150 |
N/A |
Ibrexafungerp |
Многоцентровое, открытое, рандомизированное исследование Multicentre, open-label, randomized trial 01.05.2022 30.06.2024 |
Примечание: NCT – национальное клиническое исследование;
IBX (SCY-078) – ибрексафунгерп; SOC – стандартное лечение; N/A– неприменимо.
Note: NCT – National Clinical Trial; IBX (SCY-078) – Ibrexafungerp;
SOC – standard treatment; N/A – not available.
Результаты завершенных и предварительные данные текущих исследований данного препарата демонстрируют эффективность для лечения инвазивного кандидоза широкого спектра грибковой инфекции.
В рандомизированном открытом многоцентровом исследовании у пациентов с инвазивным кандидозом, включая кандидемию (NCT02244606), IBX, вводимый в качестве перорального лечения после терапии эхинокандином, сравнивался со стандартным лечением (SOC): пероральным флуконазолом и внутривенным микафунгином для резистентных к флуконазолу изолятов. Эффективность определялась оценкой общего ответа, при этом благоприятный общий ответ определялся как исчезновение признаков и симптомов (клинический ответ), а отрицательные результаты культур Candida (микробиологический ответ) оценивались как результат терапии. Общий ответ был сходным между группами IBX (500 мг: 71 %; 750 мг: 86 %) и SOC (75 %), однако наблюдалась более высокая частота реакции в ответ на 750 мг [42].
Текущее открытое одногрупповое исследование фазы III (NCT03363841), которое по плану должно было завершиться в июне 2023 г., оценивает эффективность IBX у пациентов с инфекциями Candida auris. По предварительным результатам, инфекция была успешно уничтожена в двух случаях после лечения IBX, в том числе в случае с резистентной C. auris, который сохранялся после лечения флуконазолом и микафунганом [21]. Однако полные результаты данного исследования еще не опубликованы.
В фазе II рандомизированного двойного слепого исследования по установлению дозы DOVE (NCT03253094) было проведено сравнение эффективности перорального ибрексафунгерпа с пероральным флуконазолом у пациентов с острым ВВК. Основными конечными точками были выздоровление (полное клинико-лабораторное разрешение признаков инфекции) и микологическая эрадикация при исследовании на 10-й день после начала лечения. Показатели клинического выздоровления (52 и 58 %) и микологического искоренения (63 и 63 %) были одинаковы для IBX и флуконазола, соответственно. Однако на 25-й день показатели клинического лечения (70 и 50 %) и микологической эрадикации (48 и 38 %) были выше для IBX по сравнению с флуконазолом, соответственно [43].
В двух рандомизированных двойных слепых плацебо-контролируемых клинических испытаниях фазы III у пациентов с острым ВВК, VANISH 303 (NCT03734991) и VANISH 306 (NCT03987620), с идентичными показателями результатов, полное разрешение всех вагинальных признаков и симптомов на 10-й день лечения было значительно выше в группах IBX относительно плацебо. В VANISH 303 клиническое лечение, клиническая ремиссия и микологическая эрадикация на 25-й день составили 56,9 % против 35,7 %, 68,4 % против 45,1 % и 54,0 % против 24,2 % в группе IBX относительно плацебо, соответственно [44].
Аналогичным образом, в VANISH 306 клиническое лечение, микологическая эрадикация, клиническая ремиссия и разрешение симптомов составили 63 % против 44 %, 59 % против 30 %, 72 % против 55 % и 74 % против 52 %, соответственно, в группе IBX относительно плацебо [45].
Большое многоцентровое рандомизированное двойное слепое исследование фазы III, CANDLE (NCT04029116) по изучению эффективности сравнения IBX и плацебо у участников с рецидивирующим ВВК также продемонстрировало эффективность обозреваемого препарата. Так, по результатам исследования клинический успех составил 65 % для IBX и 53 % для плацебо [46].
Обобщая результаты II и III фазы клинических исследований, можно утверждать об эффективности препарата IBX против устойчивой грибковой флоры. Общая эффективность в достижении клинической ремиссии при применении данного препарата относительно SOC составляет 69,75 % против 61,0 % у традиционных методов и препаратов лечения. Микологическая эрадикация в данном сравнении также превалирует в случае применения препарата IBX: процент клинических случаев без доказанных рецидивов составил 55,5 %, в то время как у традиционных методов лечения данный показатель составляет 50,5 %. Исследования сравнения клинических исходов при применении IBX и плацебо также продемонстрировали эффективность обозреваемого препарата. Доля пациентов с наблюдаемым клиническим выздоровлением в случае приема IBX составила 66,55 %, что значительно превышает результат испытания с применением плацебо – 47,46 %. Микологическое искоренение в данных сценариях терапии также значительно различается и составляет для IBX 56,5 % и 27,1 % – плацебо.
Заключение / Conclusion
Наблюдаемые в последние годы рост заболеваемости инвазивной грибковой инфекции, развитие резистентности к противогрибковым препаратам и постоянное открытие новых видов грибов с множественной лекарственной устойчивостью, таких как C. auris, вызывают озабоченность общественного здравоохранения, в связи с чем разработка новых доступных препаратов с высокой эффективностью против возбудителей грибковой инфекции, в частности устойчивых к азолу и эхинокандину, обеспечивающих альтернативные варианты лечения, таких как ибрексафунгерп, неуклонно растет.
На основании проведенного анализа клинических исследований имеет место утверждение, что хорошая пероральная биодоступность, высокая противогрибковая эффективность и однодневная дозировка препарата ибрексафунгерп в перспективе исключат необходимость в излишне длительной госпитализации и сложных графиках дозирования, тем самым увеличивая приверженность к терапии и вероятность успеха лечения. Кроме того, такие достоинства IBX, как чрезвычайно низкая токсичность, повышенная активность при низких значениях рН, определяющая высокую активность при воспалении, длительное поддержание высокой концентрации препарата в тканях организма при инвазивных заболеваниях, низкий риск нежелательного лекарственного взаимодействия, позволяющие применять комбинации препаратов и лечить пациентов с множественными сопутствующими заболеваниями, предвещают данному препарату значительный успех в клинической практике.
Список литературы
1. Willems H.M.E., Ahmed S.S., Liu J. et al. Vulvovaginal candidiasis: a current understanding and burning questions. J Fungi (Basel). 2020;6(1):27. doi: 10.3390/jof6010027.
2. Гинекология: национальное руководство. Под ред. Г.М. Савельевой, Г.Т. Сухих, В.Н. Серова, В.Е. Радзинского, И.Б. Манухина. М.: ГЭОТАР-Медиа, 2022. 1008 с.
3. Хамадьянова А.У., Загидулина А.Р., Загретдинова Д.Р. и др. Перспективы исследования микробиома организма человека для лучшего понимания патогенеза рака яичников. Российский вестник акушера-гинеколога. 2023;23(1):39–46. doi: 10.17116/rosakush20232301139.
4. Байрамова Г.Р., Амирханян А.С., Чернова В.Ф. Вульвовагинальный кандидоз: патогенез, диагностика и тактика лечения. Доктор.Ру. 2018;(10):32–6. doi: 10.31550/1727-2378-2018-154-10-32-36.
5. Зиганшин А.М., Мулюков А.Р. Механизмы иммунопатологии сепсиса вирусной этиологии при COVID-19. Сибирское медицинское обозрение. 2021;(6):35–43. doi: 10.20333/25000136-2021-6-35-43.
6. Зиганшин А.М., Кейдар С.В., Халитова Р.Ш. и др. Вирус папилломы человека: этиология, патогенез, роль и значение в развитии рака шейки матки. Гинекология. 2023;25(1):17–21. doi: 10.26442/20795696.2023.1.202070.
7. Qin F., Wang Q., Zhang C. et al. Efficacy of antifungal drugs in the treatment of vulvovaginal candidiasis: a Bayesian network meta-analysis. Infect Drug Resist. 2018;11:1893–901. doi: 10.2147/IDR.S175588.
8. Je N.K., Youm S., Chun P. Real world co-prescribing contraindicated drugs with fluconazole and itraconazole. Pharmacoepidemiol Drug Saf. 2023;32(7):752–62. doi: 10.1002/pds.5604.
9. Аполихина И.А., Байрамова Г.Р., Гомберг М.А. и др. Клинические рекомендации по диагностике и лечению заболеваний, сопровождающихся патологическими выделениями из половых путей женщин. М.: Российское общество акушеров-гинекологов, 2019. 57 с.
10. Pappas P.G., Kauffman C.A., Andes D.R. et al. Clinical practice guideline for the management of candidiasis: 2016 update by the Infectious Diseases Society of America. Clin Infect Dis. 2016;62(4):e1–50. doi: 10.1093/cid/civ933.
11. Collins L.M., Moore R., Sobel J.D. Prognosis and long-term outcome of women with idiopathic recurrent vulvovaginal candidiasis caused by Candida albicans. J Low Genit Tract Dis. 2020;24(1):48–52. doi: 10.1097/LGT.0000000000000496.
12. Babic M., Hukic M. Candida albicans and non-albicans species as etiological agent of vaginitis in pregnant and non-pregnant women. Bosn J Basic Med Sci. 2010;10(1):89–97. doi: 10.17305/bjbms.2010.2744.
13. Mikamo H., Sato Y., Tamaya T. In vitro antifungal activity of FK463, a new water-soluble echinocandin-like lipopeptide. J Antimicrob Chemother. 2000;4
14. Denning D.W. Echinocandin antifungal drugs. Lancet. 2003;362(9390):1142–51. doi: 10.1016/S0140-6736(03)14472-8.
15. Peláez F., Cabello A., Platas G. et al. The discovery of enfumafungin, a novel antifungal compound produced by an endophytic Hormonema species biological activity and taxonomy of the producing organisms. Syst Appl Microbiol. 2000;23(3):333–43. doi: 10.1016/s0723-2020(00)80062-4.
16. Onishi J., Meinz M., Thompson J. et al. Discovery of novel antifungal (1,3)-beta-D-glucan synthase inhibitors. Antimicrob Agents Chemother. 2000;44(2):368–77. doi: 10.1128/AAC.44.2.368-377.2000.
17. Apgar J.M., Wilkening R.R., Parker D.L. et al. Ibrexafungerp: an orally active β-1,3-glucan synthesis inhibitor. Bioorg Med Chem Lett. 2021;32:127661. doi: 10.1016/j.bmcl.2020.127661.
18. Davis M.R., Donnelley M.A., Thompson G.R. Ibrexafungerp: a novel oral glucan synthase inhibitor. Med Mycol. 2020;58(5):579–92. doi: 10.1093/mmy/myz083.
19. SCYNEXIS Announces FDA Approval of Second Indication for BREXAFEMME® (ibrexafungerp tablets) for Reduction in Incidence of Recurrent Vulvovaginal Candidiasis. Режим доступа: https://ir.scynexis.com/news-events/press-releases/detail/314/scynexis-announces-fda-approval-of-second-indication-for. [Дата обращения: 01. 05. 2023].
20. Garcia-Rubio R., de Oliveira H.C., Rivera J., Trevijano-Contador N. et al. The fungal cell wall: Candida, Cryptococcus, and Aspergillus species. Front Microbiol. 2020;10:2993. doi: 10.3389/fmicb.2019.02993.
21. Ghannoum M., Arendrup M.C., Chaturvedi V.P. et al. Ibrexafungerp: a novel oral triterpenoid antifungal in development for the treatment of Candida auris infections. Antibiotics (Basel). 2020;9(9):539. doi: 10.3390/antibiotics9090539.
22. Hu X., Yang P., Chai C. et al. Structural and mechanistic insights into fungal β-1,3-glucan synthase FKS1. Nature. 2023;616(7955):190–8. doi: 10.1038/s41586-023-05856-5.
23. Xie J.L., Grahl N., Sless T. et al. Signaling through Lrg1, Rho1 and Pkc1 governs Candida albicans morphogenesis in response to diverse cues. PLoS Genet. 2016;12(10):e1006405. doi: 10.1371/journal.pgen.1006405.
24. Latgé J.P. The cell wall: a carbohydrate armour for the fungal cell. Mol Microbiol. 2007;66(2):279–90. doi: 10.1111/j.1365-2958.2007.05872.x.
25. Scorneaux B., Angulo D., Borroto-Esoda K. et al. SCY-078 is fungicidal against Candida species in time-kill studies. Antimicrob Agents Chemother. 2017;61(3):e01961–16. doi: 10.1128/AAC.01961-16.
26. Ghannoum M., Long L., Larkin E.L. et al. Evaluation of the antifungal activity of the novel oral glucan synthase inhibitor SCY-078, singly and in combination, for the treatment of invasive Aspergillosis. Antimicrob Agents Chemother. 2018;62(6):e00244–18. doi: 10.1128/AAC.00244-18.
27. Park S., Kelly R., Kahn J.N. et al. Specific substitutions in the echinocandin target Fks1p account for reduced susceptibility of rare laboratory and clinical Candida sp. isolates. Antimicrob Agents Chemother. 2005;49(8):3264-73. doi: 10.1128/AAC.49.8.3264-3273.2005.
28. Marcos-Zambrano L.J., Gómez-Perosanz M., Escribano P. et al. The novel oral glucan synthase inhibitor SCY-078 shows in vitro activity against sessile and planktonic Candida spp. J Antimicrob Chemother. 2017;72(7):1969–76. doi: 10.1093/jac/dkx010.
29. Garcia-Effron G., Lee S., Park S. et al. Effect of Candida glabrata FKS1 and FKS2 mutations on echinocandin sensitivity and kinetics of 1,3-beta-D-glucan synthase: implication for the existing susceptibility breakpoint. Antimicrob Agents Chemother. 2009;53(9):3690–9. doi: 10.1128/AAC.00443-09.
30. Schell W.A., Jones A.M., Borroto-Esoda K. et al. Antifungal activity of SCY-078 and standard antifungal agents against 178 clinical isolates of resistant and susceptible Candida species. Antimicrob Agents Chemother. 2017;61(11):e01102–17. doi: 10.1128/AAC.01102-17.
31. Pfaller M.A., Messer S.A., Rhomberg P.R. et al. Differential activity of the oral glucan synthase inhibitor SCY-078 against wild-type and echinocandin-resistant strains of Candida species. Antimicrob Agents Chemother. 2017;61(8):e00161–17. doi: 10.1128/AAC.00161-17.
32. Berkow E.L., Angulo D., Lockhart S.R. In vitro activity of a novel glucan synthase inhibitor, SCY-078, against clinical isolates of Candida auris. Antimicrob Agents Chemother. 2017;61(7):e00435–17. doi: 10.1128/AAC.00435-17.
33. Zhu Y.C., Barat S.A., Borroto-Esoda K. et al. Pan-resistant Candida auris isolates from the outbreak in New York are susceptible to ibrexafungerp (a glucan synthase inhibitor). Int J Antimicrob Agents. 2020;55(4):105922. doi: 10.1016/j.ijantimicag.2020.105922.
34. Jiménez-Ortigosa C., Paderu P., Motyl M.R., Perlin D.S. Enfumafungin derivative MK-3118 shows increased in vitro potency against clinical echinocandin-resistant Candida species and Aspergillus species isolates. Antimicrob Agents Chemother. 2014;58(2):1248–51. doi: 10.1128/AAC.02145-13.
35. Astvad K.M.T., Hare R.K., Arendrup M.C. Evaluation of the in vitro activity of isavuconazole and comparator voriconazole against 2635 contemporary clinical Candida and Aspergillus isolates. Clin Microbiol Infect. 2017;23(11):882–7. doi: 10.1016/j.cmi.2017.03.023.
36. Pfaller M.A., Messer S.A., Motyl M.R. et al. In vitro activity of a new oral glucan synthase inhibitor (MK-3118) tested against Aspergillus spp. by CLSI and EUCAST broth microdilution methods. Antimicrob Agents Chemother. 2013;57(2):1065–8. doi: 10.1128/AAC.01588-12.
37. Lamoth F., Alexander B.D. Antifungal activities of SCY-078 (MK-3118) and standard antifungal agents against clinical non-Aspergillus mold isolates. Antimicrob Agents Chemother. 2015;59(7):4308–11. doi: 10.1128/AAC.00234-15.
38. Wring S., Murphy G., Atiee G. et al. Clinical pharmacokinetics and drug-drug interaction potential for coadministered SCY-078, an oral fungicidal glucan synthase inhibitor, and tacrolimus. Clin Pharmacol Drug Dev. 2019;8(1):60–9. doi: 10.1002/cpdd.588.
39. Wring S.A., Randolph R., Park S. et al. Preclinical pharmacokinetics and pharmacodynamic target of SCY-078, a first-in-class orally active antifungal glucan synthesis inhibitor, in murine models of disseminated candidiasis. Antimicrob Agents Chemother. 2017;61(4):e02068–16. doi: 10.1128/AAC.02068-16.
40. Wring S., Borroto-Esoda K., Solon E., Angulo D. SCY-078, a novel fungicidal agent, demonstrates distribution to tissues associated with fungal infections during mass balance studies with intravenous and oral [14C]SCY-078 in albino and pigmented rats. Antimicrob Agents Chemother. 2019;63(2):e02119–18. doi: 10.1128/AAC.02119-18.
41. Lepak A.J., Marchillo K., Andes D.R. Pharmacodynamic target evaluation of a novel oral glucan synthase inhibitor, SCY-078 (MK-3118), using an in vivo murine invasive candidiasis model. Antimicrob Agents Chemother. 2015;59(2):1265–72. doi: 10.1128/AAC.04445-14.
42. Spec A., Pullman J., Thompson G.R. et al. MSG-10: a Phase 2 study of oral ibrexafungerp (SCY-078) following initial echinocandin therapy in non-neutropenic patients with invasive candidiasis. J Antimicrob Chemother. 2019;74(10):3056–62. URL: https://pubmed.ncbi.nlm.nih.gov/31304536/..
43. Cadet R., Tufa M., Angulo D., Nyirjesy P. A Phase 2b, dose-finding study evaluating oral Ibrexafungerp vs Fluconazole in vulvovaginal candidiasis (DOVE). Obstet Gynecol. 2019;133(1):113S–114S. doi: 10.1097/01.AOG.0000558840.33387.ee.
44. Goje O., Sobel R., Nyirjesy P. et al. Oral Ibrexafungerp for vulvovaginal candidiasis treatment: an analysis of VANISH 303 and VANISH 306. J Women Health. 2023;32(2):178–86. doi: 10.1089/jwh.2022.0132.
45. Scynexis SCYNEXIS Announces Positive Top-Line Results from Its Second Pivotal Phase 3 Study (VANISH-306) of Oral Ibrexafungerp for the Treatment of Vulvovaginal Candidiasis (Vaginal Yeast Infection). SCYNEXIS. Режим доступа: https://ir.scynexis.com/news-events/press-releases/detail/262/scynexis-pivotal-phase-3-vanish-306-trial-results-published. [Дата обращения: 01. 05. 2023].
46. Phillips N.A., Rocktashel M., Merjanian L. Ibrexafungerp for the treatment of vulvovaginal candidiasis: design, development and place in therapy. Drug Des Devel Ther. 2023;17:363–7. doi: 10.2147/DDDT.S339349.
Об авторах
Л. И. ТагироваРоссия
Лейсан Иршатовна Тагирова, ассистент
кафедра акушерства и гинекологии
450008; ул. Ленина, д. 3; Уфа
К. Р. Фарвазова
Россия
Камила Разифовна Фарвазова, студент
лечебный факультет
450008; ул. Ленина, д. 3; Уфа
Д. Р. Валеева
Россия
Дания Рустемовна Валеева, студент
450008; ул. Ленина, д. 3; Уфа
М. Д. Орлова
Россия
Мария Дмитриевна Орлова, студент
педиатрический факультет
450008; ул. Ленина, д. 3; Уфа
И. А. Губайдуллин
Россия
Ирик Азатович Губайдуллин, студент
лечебный факультет
450008; ул. Ленина, д. 3; Уфа
А. М. Тулябаева
Россия
Аделина Мурадымовна Тулябаева, студент
лечебный факультет
450008; ул. Ленина, д. 3; Уфа
А. Р. Абдульманова
Россия
Айлина Робертовна Абдульманова, студент
лечебный факультет
450008; ул. Ленина, д. 3; Уфа
Р. В. Тряпко
Россия
Руслан Виталиевич Тряпко, ассистент
кафедра акушерства и гинекологии
344022; Нахичеванский переулок, д. 29; Ростов-на-Дону
Д. А. Шелыгинский
Россия
Даниил Алексеевич Шелыгинский, студент
лечебный факультет
460000; ул. Советская, д. 6; Оренбург
А. Р. Ханафиева
Россия
Анжелика Романовна Ханафиева, студент
лечебный факультет
460000; ул. Советская, д. 6; Оренбург
Н. Г. Семенова
Россия
Настасья Генриховна Семенова, студент
лечебный факультет
450008; ул. Ленина, д. 3; Уфа
Э. М. Такиуллин
Россия
Эдуард Маратович Такиуллин, студент
лечебный факультет
450008; ул. Ленина, д. 3; Уфа
Что уже известно об этой теме?
► Хотя общепринятые схемы лечения вульвовагинального кандидоза (ВВК) эффективны в облегчении симптомов заболевания, результаты долгосрочной терапии характеризуются высокой частотой рецидивов.
► Наиболее встречаемым возбудителем ВВК является полиморфный оппортунистический грибок Candida albicans семейства Cryptococcaceae (76–89 %).
► Негативная динамика заболеваемости ВВК в последние годы, по данным исследований, связана с ростом инфицирования пациентов штаммами Candida non-albicans, резистентными к большинству противогрибковых препаратов.
Что нового дает статья?
► Доклинические исследования препарата ибрексафунгерп (IBX) продемонстрировали высокую противогрибковую активность против чрезвычайно широкого спектра изолятов Candida. В том числе in vitro восприимчивость к данному препарату проявилась у ряда эхинокандин-резистентных изолятов, включая C. albicans, C. parapsilosis, C. tropicalis, C. auris, C. krusei, C. glabrata, C. guilliermondii, C. lusitaniae, C. inconspicua; однако фунгицидная активность против устойчивых к эхинокандинам мутантов генов FKS (C. albicans, C. krusei, C. tropicalis, C. glabrata, C. auris) была переменной.
► Обобщая результаты II и III фазы клинических исследований, можно утверждать об эффективности IBX против устойчивой грибковой флоры. Общая эффективность в достижении клинической ремиссии относительно стандартного лечения составляет 69,75 % против 61 %.
► Доля пациентов с наблюдаемым клиническим выздоровлением на IBX составила 66,55 %, что значительно превышает результат плацебо – 47,46 %.
Как это может повлиять на клиническую практику в обозримом будущем?
► Высокая противогрибковая эффективность и однодневная дозировка препарата IBX в перспективе исключат необходимость в излишне длительной госпитализации и сложных графиках дозирования, тем самым увеличивая приверженность к терапии и вероятность успеха лечения.
► Такие достоинства, как чрезвычайно низкая токсичность, повышенная активность при низких значениях рН, определяющая высокую активность при воспалении, длительное поддержание высокой концентрации препарата в тканях организма при инвазивных заболеваниях, низкий риск нежелательного лекарственного взаимодействия, позволяющее применять комбинации препаратов и лечить пациентов с множественными сопутствующими заболеваниями, предвещают препарату IBX значительный успех в клинической практике.
Рецензия
Для цитирования:
Тагирова Л.И., Фарвазова К.Р., Валеева Д.Р., Орлова М.Д., Губайдуллин И.А., Тулябаева А.М., Абдульманова А.Р., Тряпко Р.В., Шелыгинский Д.А., Ханафиева А.Р., Семенова Н.Г., Такиуллин Э.М. Обзор механизма действия и результатов клинических исследований противогрибкового препарата ибрексафунгерп. Акушерство, Гинекология и Репродукция. 2024;18(2):232-245. https://doi.org/10.17749/2313-7347/ob.gyn.rep.2024.500
For citation:
Tagirova L.I., Farvazova K.R., Valeeva D.R., Orlova M.D., Gubaidullin I.A., Tulyabaeva A.M., Abdulmanova A.R., Tryapko R.V., Shelyginsky D.A., Khanafieva A.R., Semenova N.G., Takiullin E.M. Reviewing the mechanism of action and results of clinical studies on the antifungal drug ibrexafungerp. Obstetrics, Gynecology and Reproduction. 2024;18(2):232-245. (In Russ.) https://doi.org/10.17749/2313-7347/ob.gyn.rep.2024.500

Контент доступен под лицензией Creative Commons Attribution-NonCommercial-ShareAlike 4.0 International License.











































