Перейти к:
Клиническое значение определения внеклеточных ловушек нейтрофилов у женщин с онкогинекологическими заболеваниями
https://doi.org/10.17749/2313-7347/ob.gyn.rep.2023.447
Аннотация
Образование внеклеточных ловушек нейтрофилов (англ. neutrophil extracellular traps, NETs), впервые описанное в 2004 г. как ранее неизвестная стратегия нейтрофилов для борьбы с микробами, привлекает растущий интерес в исследовательском сообществе. NETs выполняют ключевую роль в воспалении и инфекции, где они используют такие эффекторные функции, как дегрануляция, фагоцитоз, образование активных форм кислорода (англ. reactive oxygen species, ROS). NETs играют решающую роль в реализации защитно-приспособительных процессов, таких как воспаление, и патогенезе неинфекционных заболеваний, таких как аутоиммунные заболевания и рак.
Ключевые слова
Для цитирования:
Асланова З.Д., Хизроева Д.Х., Солопова А.Г., Солодкий В.А., Воробьев А.В., Блинов Д.В., Асланова М.Д., Накаидзе И.А., Гри Ж., Элалами И., Макацария А.Д. Клиническое значение определения внеклеточных ловушек нейтрофилов у женщин с онкогинекологическими заболеваниями. Акушерство, Гинекология и Репродукция. 2023;17(6):751-768. https://doi.org/10.17749/2313-7347/ob.gyn.rep.2023.447
For citation:
Aslanova Z.D., Khizroeva J.Kh., Solopova A.G., Solodkiy V.A., Vorobev A.V., Blinov D.V., Aslanova M.D., Nakaidze I.A., Gris J., Elalamy I., Makatsariya A.D. Clinical significance of determining neutrophil extracellular traps in women with oncogynecological neoplasms. Obstetrics, Gynecology and Reproduction. 2023;17(6):751-768. (In Russ.) https://doi.org/10.17749/2313-7347/ob.gyn.rep.2023.447
Введение / Introduction
Иммунная система играет ключевую роль в защите организма от инфекций, а также в контроле и уничтожении опухолевых клеток. Она обладает механизмами, способными распознавать и устранять измененные и потенциально опасные клетки, включая опухолевые. Этот процесс, называемый иммунным наблюдением опухоли, является важным механизмом защиты организма от рака [1].
Взаимосвязь нейтрофилов с патогенезом опухолевого процесса является областью особого внимания со стороны многих ведущих онкологов, биологов, иммунологов [2]. Этот интерес обусловлен признанием важности воспалительного процесса, связанного с раком, в развитии многих опухолей и его значимостью как характерного признака рака. При раке наблюдается увеличение количества нейтрофилов в крови, что может быть связано с воспалительным ответом организма на опухоль. Помимо этого, при прогрессировании опухоли фенотип нейтрофилов может изменяться. Изменения фенотипа нейтрофилов при раке связаны с их активацией и дифференциацией в опухолевой микросреде. Нейтрофилы приобретают специфические свойства, которые могут варьировать в зависимости от типа опухоли и ее стадии. Например, опухолевые нейтрофилы могут проявлять высокую активность фагоцитоза, продуцировать цитокины и факторы роста, а также участвовать в формировании опухолевых сосудов. При запущенном раке было описано несколько субпопуляций циркулирующих нейтрофилов с различными характеристиками зрелости, цитотоксичности опухоли и подавления иммунитета, включая клетки-супрессоры гранулоцитарного миелоидного происхождения (англ. myeloid-derived suppressor cells, MDSCs) [3].
Фенотипы нейтрофилов / Neutrophil phenotypes
В зависимости от типа опухоли ассоциированные с опухолью нейтрофилы могут оказывать как противоопухолевые, так и проопухолевые эффекты, которые опосредованы двумя фенотипами нейтрофилов: противоопухолевые – N1 фенотип (обладает цитотоксическим действием и может уничтожать опухолевые клетки) и проонкогенные – N2 фенотип (способствует росту опухоли и прогрессированию заболевания, участвует в реконструкции внеклеточного матрикса, создавая благоприятную среду для опухолевых клеток), но данные фенотипы изучены недостаточно [4]. Различные исследования подтверждают, что реализация про- и антиканцерогенных свойств нейтрофилов зависит также и от цитокинового профиля и микроокружения опухоли. Однако необходимо понимать, что внеклeточные ловушки нейтрофилов (англ. neutrophil extrаcellular trаps, NЕTs) являются одним из важных механизмов, способствующим развитию и прогрессированию рака [5].
Противоопухолевая активность нейтрофилов / Neutrophil antitumor activity
Действительно, нейтрофилы могут быть мощными противоопухолевыми эффекторными клетками. Внутри гранул нейтрофилов находятся различные соединения, которые обладают антимикробными и цитотоксическими свойствами. Эти соединения позволяют нейтрофилам разрушать злокачественные клетки. Кроме того, нейтрофилы вырабатывают цитокины и хемокины, которые привлекают и другие клетки, обладающие способностью бороться с опухолевыми процессами. Таким образом, нейтрофилы не только самостоятельно проводят антиопухолевую активность, но и активизируют другие клеточные механизмы борьбы с опухолевыми клетками. Но все же большинство клинических наблюдений предполагают, что наличие избыточных нейтрофилов в опухоли связано с увеличением роста опухоли и, следовательно, с плохим прогнозом [6].
Наличие повышенного количества нейтрофилов в кровотоке, а также присутствие нейтрофилов в самой ткани опухоли связано с неблагоприятным исходом при различных типах рака [7]. В ходе исследования рака легких был проведен анализ фенотипа инфильтрирующих нейтрофилов, результатом которого стало обнаружение CD62LloCD54hi клеточной популяции. Это исследование подтвердило, что нейтрофилы составляют 5–25 % всех клеток, выделенных из опухолевой ткани [8]. В связи с этим количество нейтрофилов в крови по отношению к другим лейкоцитам было предложено в качестве прогностического показателя при раке. Соотношение нейтрофилов и лимфоцитов (англ. neutrophil to lymphocyte ratio, NLR) было введено в качестве простого и доступного биомаркера для оценки воспалительного и иммунного статуса у пациентов с различными типами рака. Например, при NLR > 3 у больных раком молочной железы (РМЖ) были более низкие показатели общей выживаемости, чем у пациентов с NLR ≤ 3. Высокий индекс NLR (≥ 2,2) до лечения и метастазирование в лимфатические узлы независимо коррелировали с плохим ответом [9]. В целом, индекс NLR в крови высок у пациентов с более распространенными или агрессивными формами рака и коррелирует с плохой выживаемостью пациентов со многими солидными опухолями. Несмотря на простоту использования индекса NLR, он не был принят во многих клинических условиях. Одной из причин этого является то, что нейтрофилия может быть результатом повышенного гранулопоэза, что не всегда плохой признак прогрессирования рака. Например, при раке желудка высокий индекс NLR указывает на положительный прогноз. Это свидетельствует о большой пластичности нейтрофилов. Они могут не только непосредственно убивать опухолевые клетки и контролировать рак, но и приобретать проопухолевый фенотип и благоприятствовать развитию рака [10].
Появилось большое количество исследований, указывающих на то, что NETs вовлечены в прогрессирование рака и распространение метастазов как на животных моделях, так и у онкологических больных. Но их роль при раке только начинает изучаться, поэтому еще мало известно о присутствии и действии NETs при различных типах опухолей.
Внеклеточные ловушки нейтрофилов / Neutrophil extrаcellular trаps
NETs представляют собой «паутинные структуры», которые образуются посредством запуска защитной реакции нейтрофилов, аберрантно активирующейся во время воспаления или опухолевого процесса. Данная реакция называется нетозом (англ. NETosis) и сопровождается тем, что активированные нейтрофилы вытесняют свою ДНК и внутриклеточное содержимое в «паутинную структуру» (рис. 1).

Рисунок 1. Сигнальные пути, лежащие в основе формирования
внеклеточных ловушек нейтрофилов (NETs) [рисунок авторов].
Примечание: TLR2, TLR4 – толл-подобные рецепторы; PKC – протеинкиназа C; RAF – серин-треониновая протеинкиназа; MEK – митоген-активируемая протеинкиназа; ERK – киназа, регулируемая внеклеточным сигналом; РМА – форбол 12-миристат 13-ацетат; RIPK1 – рецептор серин/треонин-протеинкиназа 1; RIPK3 – рецептор серин/треонин-протеинкиназа 3 некроптоз; MLRL – домен киназы смешанной линии, подобный псевдокиназе (белок, играющий ключевую роль в процессе некроптоза, или запрограммированной гибели клеток; DAP12 – активирующий белок дезоксуситидинкиназы, 12 кДа; Syk – нерецепторная тирозинкиназа; Cit – цитруллин; Rho – Ras-гомологичные белки; DAMPs – молекулярные фрагменты, ассоциированные с повреждениями; GM-CSF – гранулоцитарно-макрофагальный колониестимулирующий фактор; LPS – липополисахарид; С5а – компонент комплемента; ROS – активные формы кислорода; NE – эластаза нейтрофилов; MPO – миелопероксидаза; PAD4 – пептидил-аргинин деиминаза 4; eCIRP – внеклеточный индуцируемый холодом РНК-связывающий белок; TREM-1 – триггерный рецептор, экспрессируемый на миелоидных клетках; ICAM-1 – молекула межклеточной адгезии; LL37 – антимикробный пептид.
Figure 1. Signaling pathways underlying
neutrophil extracellular traps (NETs) formation [drawn by authors].
Note: TLR2, TLR4 – toll-like receptors; PKC – protein kinase C; RAF – rapidly accelerated fibrosarcoma; MEK – mitogen-activated protein kinase; ERK – extracellular signal-regulated kinase; РМА – phorbol 12-myristate 13-acetate; RIPK1 – receptor-interacting serine/threonine-protein kinase 1; RIPK3 – receptor interacting serine/threonine kinase 3; MLRL – mixed lineage kinase domain-like; DAP12 – DNAX-activating protein of 12 kDa; Syk – spleen tyrosine kinase; Cit – citrulline; Rho – Ras homologous; DAMPs – damage-associated molecular patterns; GM-CSF – granulocyte-macrophage colony-stimulating factor; LPS – lipopolysaccharide; С5а – complement component; ROS – reactive oxygen species; NE – neutrophil elastase; MPO – myeloperoxidase; PAD4 – peptidyl arginine deiminase 4; eCIRP – extracellular cold-inducible RNA-binding protein; TREM-1 – triggering receptor expressed on myeloid cells 1 type; ICAM-1 – intercellular adhesion molecule; LL37 – antimicrobial peptide LL37.
Основными белковыми компонентами NETs являются гистоны, за которыми следуют гранулярные ферменты и пептиды, включая элaстазу нейтрофилов (англ. neutrophil elаstаse, NE), миелопероксидaзу (англ. myeloperoxidаse, MPO), катепсин G, лейкоцитарную протеиназу 3 (англ. leukocyte proteinase 3, LP3), лактоферрин, желатиназу, лизоцим C, кальпротектин, дефензины (катионные пептиды иммунной системы, активные в отношении бактерий, грибков и многих оболочечных и без оболочечных вирусов) нейтрофилов и кателицидины [11] (рис. 1).
12-O-тетрадеканоилфорбол-13-ацетат (ТФА), бактерии, молекулярные паттерны, связанные с повреждением (англ. dаmage-аssociated molecular patterns, DAMPs) и цитокины индуцируют активацию пептидил-aргинин деиминазы 4 (англ. peptidyl аrginine deiminаse 4, PAD4) через толл-подобные рецепторы (англ. toll-like receptors, TLRs) TLR2 или TLR4. Эти стимуляторы могут также активировать сигнальный путь РKS-RAF-MEK-ERK, который является цепью последовательного взаимодействующего белка, которая передает сигнал от клеточных рецепторов в ядро клетки к ДНК. Эти стимуляторы могут также активировать протеинкинaзу C (англ. protein kinase C, РKC), серин-треониновую протеинкиназу RAF (англ. rapidly accelerated fibrosarcoma), митоген-активируемую протеинкиназу MEK (англ. mitogen-activated protein kinase) и киназу, регулируемую внеклеточным сигналом (англ. extracellular signal-regulated kinases, ERK). Участники пути сигнала взаимодействуют друг с другом фосфорилированием и дефосфорилированием. Такие процессы являются и механизмами активации и деактивации сигнальных каскадных белков. Таким образом, данный каскад белков РKC-RAF-MEK-ERK, является способом регулирования клеточной пролиферации, клеточного цикла, миграции клеток. В дальнейшем это приводит к увеличению продукции активных форм кислорода (англ. reactive oxygen species, ROS) и MРО и активации PAD4. Гранулoцитарно-макрoфагальный колoниестимулирующий фактор (англ. granulocyte-macrophage colony-stimulating factоr, GM-CSF), липополисахарид (англ. lipopolysaccharide, LPS) и компонент комплемента C5a также индуцируют выработку ROS и МРО, активацию PAD4. Повышенная активация PAD4 в конечном счете приводит к увеличению образования NETs. Также секреция NETs может осуществляться посредством связывания внеклеточного индуцируемого холодом РНК-связывающего белка (англ. extracellular cold-inducible RNA-binding protein, eCIRP) с мономерным трансмембранно-активируемым рецептором первого типа (англ. triggering receptor expressed on myeloid cells 1, TREM-1), что способствует экспрессии молекулы межклеточной адгезии (англ. intercellular adhesion molecule, ICAM-1), вызывает активацию Rho-киназы, тем самым увеличивая высвобождение NETs.
В зависимости от морфологических изменений в нейтрофилах, нетоз классифицируется на 3 типа:
- суицидальный нетоз (англ. suicidal NETosis) – NETs секретируются в результате гибели клеток;
- прижизненный или витальный нетоз (англ. vital NETosis) – NETs секретируются жизнеспособными клетками; процесс развивается быстрее, чем суицидальный нетоз, и этот процесс может быть вызван выбросом ядерной, а также митохондриальной ДНК;
- митохондриальный нетоз (англ. mitochondrial NETosis) – NETs, состоящие из митохондриальной ДНК, секретируемые жизнеспособными клетками.
Суицидальный нетоз – это механизм гибели нейтрофилов за счет образования NADPH-зависимых ROS [12][13]. При суицидальном нетозе запускаются особые механизмы, которые отличаются от клеточного апоптоза и некроза: распадаются ядерные и гранулярные мембраны, далее хроматин подвергается деконденсации и рассеивается в цитоплазме, смешиваясь с цитоплазматическими белками; высвобождение NETs во внеклеточное пространство осуществляется путем разрушения плазматической мембраны (рис. 1). Помимо TФА и интерлейкина-8 (англ. interleukin, IL-8), последующие исследования выявили ряд дополнительных стимулов, которые способны вызывать нетоз: бактерии, грибы, вирусы, комплексы антителоантиген, аутоантитела, конканавалин и интерфероны [13][14].
Формирование прижизненных или витальных NETs происходит без гибели клеток. В ответ на стимуляцию золотистым стафилококком нейтрофилы высвобождают NETs, не требуя гибели клеток или даже нарушения целостности плазматической мембраны [15–17]. Данный тип NETs не зависит от окислителя и опосредован TLR2-зависимым механизмом, а высвобождение митохондриальной ДНК отсутствует (рис. 1). В отличие от суицидального типа, в данном случае сохраняются некоторые нормальные функции нейтрофилов, такие как фагоцитоз. Еще одним различием между суицидальным и витальным типом NETs является время их высвобождения. Суицидальный тип требует нескольких часов после стимуляции для формирования NETs, а образование витального типа происходит в течение короткого времени после стимуляции нейтрофилов ТФА [15].
Как следует из названия, митохондриальные сети образуются, когда нейтрофилы высвобождают митохондриальную ДНК в качестве внеклеточных ловушек. Митохондриальные NETs были впервые описаны S. Yousefi с соавт. в 2009 г., которые показали, что после предварительной обработки GM-CSF и последующей стимуляции LPS или компонентом комплемента С5a нейтрофилы высвобождают NETs, сформированные из митохондриальной ДНК [18]. Это высвобождение происходило ROS-зависимым образом и не приводило к литической гибели клеток (рис. 1). При этом описанное явление наблюдалось и при других условиях, в частности, при анапластическом раке щитовидной железы. Исследования показали, что NETs способствуют пролиферации клеток анапластического рака щитовидной железы [19][20].
В настоящее время информация о каждом из представленных типов NETs имеется в ограниченном количестве, в особенности об их роли при онкогинекологических заболеваниях, что требует дальнейших исследований. NETs стали предметом многочисленных клинических исследований в связи с их уникальной ролью во врожденном иммунитете и различных патологических процессах. Тем самым их изучение позволит получить более глубокое представление о механизме их формирования и участия в инфекционных и неинфекционных процессах.
Гистоны NETs разрушают эпителиальные клетки и сосудистую сеть опухоли, что способствует распространению опухолевых клеток и ангиогенезу. Кроме того, NETs способны притягивать дендритные клетки в опухоль и проявлять антиангиогенные свойства [21]. С другой стороны, протеазы NETs разрушают экстрацеллюлярную матрицу и оказывают специфическое воздействие на ангиогенез, подвижность/инвазию раковых клеток, метастазирование и иммунный надзор опухолей [22–24]. Благодаря высвобождаемой ими матриксной металлопротеиназе-9 (англ. matrix metalloproteinase, MMP-9), NETs блокируют апоптоз опухолевых клеток, что способствует их выживанию. ММР-9 также обеспечивает миграцию, инвазию и метастазирование при раке легкого. [25]. Таким образом, гистоны NETs могут играть двоякую роль в онкологических процессах, одновременно обладая как противоопухолевыми, так и противораковыми свойствами.
Роль NETs в канцерогенезе зависит от гетерогенности опухоли, которая объясняется в первую очередь тем, что опухолевые клетки могут демонстрировать различные морфологические и фенотипические профили, включая клеточную морфологию, экспрессию генов, метаболизм, особенности пролиферации и метастатический потенциал. Ранее было проведено несколько исследований, посвященных изучению роли NETs при онкологических заболеваниях, в которых описывались механизмы участия NETs в иммунорегуляции рака, прогрессировании [1][25–27], распространении метастазов [27] и рак-ассоциированном тромбозе [27]. Тем самым NETs могут проявлять как противоопухолевую активность, так и отвечать за активацию раковых клеток.
Безусловно, компоненты NETs имеют разностороннюю направленность в отношении опухолевых клеток, поэтому важно знать более детально особенности биологических функций МРО, протеаз и гистонов [27][28] и их место в канцерогенезе, чтобы в дальнейшем можно было выделить ключевые молекулярные мишени для таргетированой терапии онкогинекологических заболеваний.
Миелопероксидаза / Myeloperoxidase
Миелопероксидаза представляет собой азурофильный гранулярный фермент нейтрофилов и является наиболее распространенным белком, экспрессируемым этими клетками. После активации фагоцитов происходит их дегрануляция, и МРО секретируется либо внутрь фагосомы, либо во внеклеточное пространство [29]. МРО является главным белком в пероксисомах нейтрофилов, моноцитов, эозинофилов и субпопуляциях тканевых макрофагов и играет ключевую роль в защитном воспалительном ответе организма. Кроме того, МРО – это ведущая бактерицидная система нейтрофилов [29].
Исследования демонстрируют, что свободная МРО высвобождается в окружающие ткани при развитии воспаления [30]. Основной функцией МРО в организме является защита от внешних инфекционных факторов, но при ряде условий она может вызывать повреждение собственных тканей организма в очагах воспаления [31].
Ферментативный цикл МРО достаточно сложен и включает в себя цикл галогенирования и пероксидазный цикл. Основным субстратом фермента является пероксид водорода, при взаимодействии с которым МРО катализирует реакцию образования гипохлорной кислоты (HOCI) и формирует мощную антимикробную систему, предназначенную для уничтожения бактерий. По данным различных авторов, MРO является одним из белков с наиболее повреждающим/цитотоксическим потенциалом для живых клеток. При наличии воспаления уровень свободной МРО в крови повышается, но для того чтобы разобраться в особенностях взаимодействия МРО, необходимо вспомнить механизмы цитотоксического действия нейтрофилов [32]. Взаимодействие нейтрофилов с патогенными или условно-патогенными микроорганизмами стимулирует фагоцитоз – процесс внутриклеточного «переваривания» (киллинг), осуществляемого благодаря активации двух сложных механизмов. Первый механизм основан на зависимости от кислорода, при котором происходит увеличение потребления глюкозы и кислорода (респираторный взрыв). Второй механизм, который не зависит от кислорода, уничтожает бактерии, находящиеся внутри фаголизосомы, через действие содержимого гранул [33]. Кислородзависимая цитотоксичность фагоцитов играет главную роль в разрушении опсонизированного объекта фагоцитоза. Эта цитотоксичность сопровождается значительным увеличением интенсивности метаболизма с использованием кислорода, который окисляет кофермент NADPH, образуя супероксид-анион [33][34]. Под действием супероксиддисмутазы супероксид-анион превращается в токсичные ROS благодаря катализу MPO. В процессе кислородзависимого уничтожения потребление кислорода нейтрофилами может значительно увеличиваться в течение нескольких секунд [35]. Нейтрофилы фагоцитируют патогены и, в итоге, уничтожают их, производя ROS в агрессивной среде фаголизосомы. Объединение бактерицидного действия содержимого гранул и ROS приводит к уничтожению микроорганизмов. ROS также являются токсичными как для объектов фагоцитоза, так и для самих нейтрофилов, которые имеют систему защиты, включающую превращение супероксид-аниона в перекись водорода и ее дальнейшую конверсию в воду с помощью каталазы [35].
Активация кислороднезависимых механизмов происходит при контакте опсонизированного объекта с мембраной фагоцита. В процессе слияния фагосомы с лизосомой вначале соединяются гранулы, содержащие лактоферрин и лизоцим, объединяются с азурофильными гранулами, содержащими катионные белки, протеиназы (например, эластаза и коллагеназа), катепсин G, дефензины и др. Эти химические вещества повреждают клеточные мембраны, нарушают некоторые метаболические процессы и приводят к распаду убитых бактерий [33][35].
Помимо защитных антибактериальных стратегий, нейтрофилы также могут иметь деструктивные патогенетические механизмы, которые связаны с цитотоксической функцией и могут быть ассоциированы с развитием онкологических заболеваний.
В литературе не существует единой точки зрения об активности МРО у больных, страдающих злокачественными заболеваниями. Авторы публикаций 1999–2007 гг. сообщают о снижении, повышении или нормальной активности МРО при онкологических заболеваниях [36][37]. Однако в исследовании, опубликованном в 2008 г., было продемонстрировано, что активность МРО у пациенток с раком яичников уже на I–II клинических стадиях заболевания была ниже и продолжала снижаться по мере прогрессирования опухоли [6]. Данные подтверждают, что нарушение защитных механизмов нейтрофилов ведет к развитию опухоли и ее метастазированию.
С другой стороны, высокий уровень МРО в крови может рассматриваться как маркер окислительного стресса и хронического воспаления, которые в свою очередь могут способствовать развитию онкологических заболеваний. Кроме того, исследования выявили генетические полиморфизмы МРО, которые могут быть связаны с повышенным риском развития рака шейки матки [38]. На прогрессирование рака также влияет присутствие MРO, которая участвует в регуляции роста опухоли, апоптозе, миграции клеток и метастазировании. МРО может регулировать и адаптивный иммунитет при раке [36], так как у пациентов с дефицитом МРО выше частота рецидивов и прогрессирования рака [39].
Изучение роли MРO в миграции, инвазии и метастазировании опухоли проводилось на эндотелиальных клетках in vivo и in vitro [36]. Многие из этих функций связаны с ферментативной активностью MРO и регуляцией нескольких белков, участвующих в сигнальных путях, включая киназу фокальной адгезии (англ. focal adhesion kinase, FAK), также известную как протеинкиназа тирозинкиназы 2 белка PTK2 (англ. PTK2 protein tyrosine kinase 2, PTK2), протеинкиназу B (Akt), p38 митoген-aктивируемые прoтеинкиназы (англ. mitogen-activated proteinkinase, MAPKs), ERK1/2 и индуцируемый гипоксией фактор-2α (англ. hypoxia-inducible factor-2α, HIF-2α) [36]. Более того, прочность и стабильность внеклеточного матрикса важна для регуляции инвазии, метастазирования и инфильтрации опухоли иммунными клетками [36]. Сообщалось, что продукты окислителей, полученные из MРO, могут модифицировать внеклеточный матрикс путем прямого повреждения ее компонентов или посредством активации матриксных металлопротеиназ (англ. matrix metalloproteinases, MMPs) [40].
Таким образом, модификация компонентов внеклеточного матрикса окислителями, полученными из МРО, может быть одним из механизмов, с помощью которого МРО регулирует миграцию опухолевых клеток и распространение метастазов.
Исследование in vitro достаточно ясно продемонстрировало, что MРО увеличивала подвижность клеток карциномы молочной железы, демонстрируя предполагаемую роль MРО в качестве хемоаттрактанта [41]. MРО может участвовать в метастатическом процессе, регулируя экспрессию компонентов внеклеточного матрикса. При обработке MРO клеток РМЖ (мышиная модель) отмечалась высокая экспрессия мРНК гена MMP-1, который связан с органоспецифическим метастазированием в легкие. MРO положительно регулировала экспрессию компонентов внеклеточного матрикса, таких как MMP-1, MMP-3, коллаген I и коллаген IV в фибробластах. Эти эффекты были связаны с повышенной адгезией опухолевых клеток и их инвазией. MРO также может усиливать миграцию фибробластов, важных составляющих микроокружения опухоли [41]. Более того, HOCl активирует MMP-2, MMP-7 и MMP-8, которые участвуют в деградации компонентов соединительной ткани и, следовательно, могут способствовать прогрессированию рака и его метастазированию [42].
Окисление компонентов внеклеточного матрикса окислителями, полученными из MРO, было связано со снижением адгезии, что приводило к изменениям в пролиферации эндотелиальных клеток и экспрессии генов, связанных с синтезом компонентов внеклеточного матрикса, клеточным циклом и клеточной адгезией [32]. Поэтому необходимо дальнейшее изучение эффектов окислителей, полученных из MРO, участвующих в модификации компонентов внеклеточного матрикса в раковых клетках и тканях, с их последующей адгезией, пролиферацией, миграцией и метастазированием, чтобы более детально разобраться с ролью MРO в развитии рака [43].
Патофизиологическое понимание обнаруженных изменений связано с нарушениями активности нейтрофильных гранулоцитов у онкологических пациентов. Эти нарушения могут быть обусловлены как кислородзависимыми, так и кислороднезависимыми факторами. Изменение мобилизационной активности клеток является фоном для этих нарушений и указывает на серьезное нарушение функциональной работоспособности нейтрофилов. Они не могут выполнять свои микробицидные, цитотоксические и цитолитические функции, которые обычно блокируют прогрессию опухолей [44].
Внеклеточные протеазы / Extracellular proteases
Другими компонентами NETs являются внеклеточные протеазы, которые занимают одни из ведущих позиций в регуляции множества физиологических процессов [45]. Известно около 69 семейств протеаз человека [46], включая MMPs, сериновые протеазы и цистеиновые протеазы, регулирующие различные биологические процессы [47]. Некоторые из канонических ролей внеклеточных протеаз известны уже много десятилетий и включают переваривание потребляемых белков трипсином в тонком кишечнике, в то время как относительно недавнее обнаружение протеаз на поверхности экзосом дополнительно открывает дверь к пониманию сложной биологии ремоделирования клеточного матрикса внеклеточными протеазами [48]. Как и многие другие белки, которые необходимы для нормальных физиологических процессов, протеазы также могут иметь нарушения в регуляции, способствуя формированию и прогрессированию различных заболеваний, включая рак.
Протеазы играют определенную роль в онкологическом процессе: ингибирование передачи сигналов с рецепторной тирозинкиназы, опосредованное выделением эктодомена. Взаимосвязь протеолитических ферментов с раком хорошо установлена, причем различные семейства протеолитических ферментов, включая сериновые протеазы, плазмин, активаторы плазминогена, калликреины тканей человека и MMPs, участвуют в росте опухоли, инвазии, ангиогенезе и метастазировании [49][50]. При различных видах рака была идентифицирована трипсиноподобная протеаза, известная как ассоциированный с опухолью трипсиноген [49], который индуцирует метастатический фенотип раковых клеток.
В 2017 г. R. Morimoto-Kamata и S. Yui доказали роль катепсина G в метастазировании за счет его способности стимулировать агрегацию клеток РМЖ in vitro [51], а T.J. Wilson с соавт. в 2008 г. [52] показали способность катепсина G модулировать микроокружение опухоли путем увеличения передачи сигналов трансформирующего фактора роста-бета (англ. transforming growth factor-beta, TGF-β). На мышиной модели с метастатическим поражением костей опухолью молочной железы выявлено, что катепсин G способствует неоваскуляризации опухоли посредством сложного механизма, включающего активацию про-MMP-9, за которой следует MMP-9-опосредованная активация TGF-β для индукции фактора роста сосудов эндотелия (англ. vаscular endothelial growth factor, VEGF) и CCL2 (хемокин (мотив C-C) лиганд 2; сhemokine (C-C motif) ligand 2). В дальнейшем описанный механизм в совокупности способствует ангиогенезу. Также необходимо отметить, что катепсин G может влиять на секрецию про-IL-1β, чтобы индуцировать пролиферацию опухолевых клеток [53] и генерировать DAMPs за счет расщепления членов семейства цитокинов IL-1, включая IL-1, IL-33 и IL-36 [54].
Следует подчеркнуть особую роль ММР-9, которая может высвобождаться при дегрануляции фагоцитов или нейтрофилов, а также при образовании NETs. ММР-9 является одной из наиболее хорошо изученных протеаз при раке и может способствовать ее росту и метастазированию [19][55]. Одной из основных функций MMP-9, отвечающей за развитие опухоли, является нарушение баланса между ингибиторами и активаторами ангиогенеза. На модели карциномы легкого Льюиса было установлено, что нейтрофилы потенцируют экспрессию ММР-9 [56]. При раке NETs-ассоциированная MMP-9 может расщеплять белки внеклеточного матрикса, одним из которых является ламинин. В дальнейшем данный процесс генерирует эпитоп интегрина, стимулирующий пробуждение «дремлющих» раковых клеток. Недавнее исследование показало, что опухолевые клетки могут индуцировать CXCR4hiCD62Llo (так называемые состарившиеся клетки) нейтрофилы, тем самым способствуя метастазированию и высвобождению большего количества NETs и MMP-9 [57].
Роль гистонов в образовании NETs / Histone role in NETosis
Гистоны (от англ. Histone, HIS) также играют важную роль в образовании сетей NETs. HIS – это маленькие белки, которые участвуют в организации структуры хроматина. Они нейтрализуют отрицательно заряженные фосфатные группы ДНК за счет своих положительно заряженных аминокислотных остатков, что позволяет плотно упаковать ДНК в ядре. HIS образуют октамер, содержащий 4 основных гистоновых белка (H3, H4, H2A, H2B, называемые кóровыми гистонами), которые окружены сегментом ДНК из 147 пар оснований. Каждый из гистоновых белков обладает характерной боковой цепью или хвостом, который плотно заполнен основными остатками лизина и аргинина. Хвосты HIS подвергаются обширным ковалентным посттрансляционным модификациям, которые взаимодействуют для управления состоянием хроматина. При изучении биологических функций HIS было показано, что они обладают как противомикробным, так и токсическим действием на живые клетки. В процессе образования NETs в ткани высвобождаются многочисленные HIS, которые являются токсичными для патогенов, но также могут наносить повреждение тканям. Антимикробная функция NETs, вероятно, связана с действием HIS.
В Соединенных Штатах Америки учеными было показано, что метилирование ДНК, модификация гистонов и микроРНК являются механизмами эпигенетической регуляции и играют роль в сложном процессе аберрантной экспрессии генов, который приводит к трансформации клеток и способствует развитию различных заболеваний, включая онкогинекологические. HIS, которые участвуют в упаковке ДНК и эпигенетической регуляции ядерных процессов, таких как транскрипция, репликация и репарация, также вовлечены в патогенез лейомиомы [58].
Ведутся исследования низкомолекулярных ингибиторов гистоновых метилтрансфераз (DOT1L и EZH2), а также ингибиторов гистондеметилазы (англ. histone lysine-specific demethylase 1, LSD1) [59], которые будут иметь решающее значение для понимания роли модификаций HIS и гистон-модифицирующих ферментов (и их интерпретаторов) в возникновении и прогрессировании рака, что в конечном итоге приведет нас к созданию новых методов лечения рака.
Роль NETs в прогрессировании опухоли / NETs in tumor progression
Прогрессирование опухоли (пролиферация и рост) NETs осуществляют с помощью различных механизмов. Во-первых, в несолидных опухолях, таких как хронический лимфоцитарный лейкоз и диффузная крупноклеточная лимфома, было показано, что NETs усиливают пролиферативную способность за счет увеличения маркеров активации и ингибирования апоптоза опухолевых клеток [60]. Более того, активация пути ядерного фактора «каппа-би» (от англ. nuclear factor kappa B, NF-κB) и сигнального преобразователя, а также активатора передачи сигналов транскрипции 3 (STAT3)/p38, стимулируемая NETs), является еще одним предложенным механизмом стимуляции пролиферации опухоли при диффузной крупноклеточной лимфоме [61]. Во-вторых, циркулирующие опухолевые клетки – это раковые клетки, которые «отпали» от опухоли и перешли в состояние покоя при воздействии неблагоприятной микросреды (отсутствие адекватного ангиогенеза и снабжения питательными веществами) [62].
Многочисленные цитокины и хемокины, секретируемые опухолевыми клетками, включая IL-8, IL-17, гранулоцитарный колониестимулирующий фактор (англ. granulocyte colony-stimulating factor, G-CSF) и CXCL6, могут привлекать нейтрофилы к участкам опухоли и вызывать нетоз. Впоследствии происходит усиленная инфильтрация нейтрофилами и образование NETs c последующим эпителиально-мезенхимальным переходом (англ. epithelial-mesenchymal transition, EMT), что в конечном итоге приводит к усиленной пролиферации опухолевых клеток [63]. Являясь ключевым компонентом NETs, NE играет важную роль в онкогенезе опухолей пищеварительной системы. NETs могут также активировать передачу сигналов TLR4-гамма-коактиватора рецептора, активируемого пролифератором пероксисом 1-α (англ. peroxisome proliferator-activated receptor gamma coactivator 1-alpha, PGC-1α), в клетках колоректального рака. Впоследствии митохондриальный аденозинтрифосфат вырабатывается через NE-активированный путь TLR4-PGC-1α, который участвует в пролиферации опухолевых клеток и метастазировании [63]. NETs через взаимодействие с TLR9 способны активировать передачу сигналов активируемой митогеном протеинкиназы (англ. mitоgen-activаted prоtein kinase, MAPK) для выполнения онкогенных функций. Ранее сообщалось об участии NETs и в развитии опухолей нервной системы.
NETs могут защищать опухолевые клетки от цитотоксического действия клеток иммунной системы путем подавления CD8+ и естественных киллеров в эпителиально-мезенхимальном переходе, тем самым способствуя выживанию и росту опухолевых клеток. Однако не до конца ясны все механизмы NETs, участвующие в канцерогенезе и метастазировании опухоли [64].
Предполагается, что циркулирующие NETs вызывают повреждения органов у больных раком аналогичное тем, которые возникают при аутоиммунных заболеваниях. Также сообщалось об их способности пробуждать «спящие» раковые клетки [63], поэтому на сегодняшний день NETs рассматриваются как потенциальные мишени для таргетной терапии рака.
В исследованиях на моделях РМЖ было показано, что сети NETs способствуют метастазированию, поскольку этот процесс был подавлен при введении ДНКазы [60]. Установлена способность NETs захватывать раковые клетки и служить адгезионным субстратом для них [66], способствуя распространению метастазов (рис. 2). Но для того, чтобы осуществился процесс метастазирования, раковые клетки должны распространиться из первичного очага, проникнув в базальную мембрану, затем в кровеносный сосуд, выжить в кровеносном русле, экстравазироваться в отдаленные ткани и, наконец, раковым клеткам нужно приспособиться и начать делиться в новой микросреде [67]. Впервые способность NETs осуществлять и поддерживать метастазирование было описано в 2013 г. [25].

Рисунок 2. Молекулярные механизмы внеклеточных ловушек нейтрофилов (NETs),
способствующие метастазированию опухоли (адаптировано из [68]).
Примечание: ССDC25 – домен спиральной спирали, содержащий белок –25; TRL4, TRL9 – толл-подобные рецепторы; MAPK – активируемая митогеном протеинкиназа; HMGB1 – белок группы высокой мобильности B1; Snail – транскрипционный репрессор экспрессии Е-кадгерина; EMT – эпителиально-мезенхимальный переход; ZEB1 – транскрипционный фактор; ММР-9 – матриксная металлопротеиназа 9; NE – эластаза нейтрофилов; PGC-1α – коактиватор рецептора, активируемый пролифератором пероксисом 1-α; p38 – протеинкиназы 38; Р – протеинкиназа; CD144 – кластер дифференциации 144, представляет собой тип кадгерина.
Figure 2. Molecular mechanisms involving neutrophil extracellular traps (NETs)
in promoting tumor metastasis (adapted from [68]).
Note: ССDC25 – coiled-coil domain containing protein –25; TRL4, TRL9 – toll-like receptors; MAPK – mitogen-activated protein kinase; HMGB1 – high-mobility group protein B1; Snail – transcriptional repressor of E-cadherin expression; EMT – epithelial-mesenchymal transition; ZEB1 – zinc finger E-box binding homeobox 1; ММР-9 – matrix metalloproteinase 9; NE – neutrophil elastase; PGC-1α – peroxisome proliferator-activated receptor gamma coactivator 1-alpha; p38 – protein kinase 38; Р – protein kinase; CD144 – сluster of differentiation 144.
Белок группы высокой мобильности B1 (англ. high-mobility group protein B1, HMGB1) или амфотерин – белок из группы ядерных негистоновых белков группы высокой подвижности (англ. high mobility group, HMG), высвобождаемый NETs, способствует метастазированию опухоли путем связывания с TLR9 для активации сигнализации p38/MAPK. HMGB1 также способствует метастазированию, связываясь с TLR4 или регулируя деградацию VE-кадгерина (белок клеточной адгезии эндотелия сосудов из семейства кадгеринов, CD144), с последующей повышенной экспрессией EMT-ассоциированных генов, ZEB1 (транскрипционный фактор) и Snail (фактор транскрипции, который способствует подавлению молекулы адгезии E-кадгерина). Компонент NETs – NE непосредственно регулирует метаболизм митохондрий через путь TLR4-p38-PGC-1α и способствует пролиферации опухоли и метастазированию. Протеазы – NE и MMP-9, полученные из NETs, необходимы для реактивации бездействующих раковых клеток путем деградации внеклеточного матрикса за счет расщепления ламинина. В нескольких раковых клетках NETs ДНК напрямую связывается с CCDC25 (домен спиральной спирали, содержащий белок –25), что приводит к метастазированию опухоли.
NETs-индуцированная гиперкоагуляция может быть осложнением некоторых онкологических заболеваний. Исследования на моделях рака кишечника также показывают, что ДНКаза может снижать риск тромбообразования и развития рака. С другой стороны, терапевтическое вирусное инфицирование опухоли может приводить к внутриопухолевой коагуляции, которая зависит от активности нейтрофилов и может способствовать уничтожению раковых клеток. Однако необходимы дополнительные исследования для определения связи между этим процессом и образованием NETs [68].
По завершении инфекционного процесса NETs должны быть удалены. Исследования C. Farrera и B. Fadeel на системе in vitro показали, что сначала происходит деградация NETs с помощью ДНКазы I, а затем они эндоцитируются и лизируются макрофагами [69]. Однако избыточное образование NETs или аберрантный нетоз могут привести к воспалительным и аутоиммунным заболеваниям, а также к закупорке кровеносных сосудов. Такие состояния могут возникать и при гиперпродукции NETs и при нарушении механизмов их удаления, например, в случае отсутствия ДНКазы I, что также может быть вызвано генетическими, гормональными изменениями или другими канцерогенными факторами.
Литературный анализ показал, что уровень NETs в плазме крови пациентов с различными типами опухолей, включая рак легких, поджелудочной железы и мочевого пузыря, был выше, чем у здоровых людей контрольной группы [70]. У пациентов с раком легких обнаружены NETs в легочной ткани, периферической крови и мокроте [71]. А у пациентов с колоректальным раком уровень NETs был выше, чем в группе контроля (здоровые) и ассоциировался с плохим прогнозом заболевания [72]. В последующем было показано наличие NETs при РМЖ с помощью иммунофлуоресцентного окрашивания [73]. Аналогичным образом в гистологических образцах метастазов колоректального рака в печень от пациентов, перенесших плановую лечебную резекцию, обнаружено высокое содержание NETs и опухоль-ассоциированных нейтрофилов. Следует отметить, что опухолевая ткань характеризовалась высокой экспрессией цитруллинированных гистонов, тем самым указывая на нетоз [65].
Взаимосвязь между опухоль-ассоциированными нейтрофилами и образованием NETs в ткани опухоли и их роль в ее иммунокоррекции была исследована при саркоме Юинга. S. Berger-Achituv с соавт. продемонстрировали наличие опухоль-ассоциированных нейтрофилов (англ. tumor-associated neutrophils, TANs) в биопсийном материале от пациентов, страдающих саркомой Юинга, где у 2 пациентов был зафиксирован высокий уровень NETs в результате активации TANs. В дальнейшем у них были обнаружены метастазы, и отмечался ранний рецидив после высоких доз химиотерапии, что позволяет предположить возможную роль NETs в прогрессировании саркомы Юинга [74]. Важная роль NETs при раке была также подтверждена их связью с изменением процессов коагуляции у пациентов, где NETs стимулировали ассоциированный с раком тромбоз в опухолях, способствуя более худшему прогнозу [14][73]. Высокие концентрации цитруллинированного гистона H3 (англ. citrullinated histone H3, сitН3) в плазме крови наблюдали у больных раком на поздних стадиях, а нейтрофилы имели более высокий уровень сitН3. Кроме того, значения сitН3 в плазме больных раком действительно коррелируют с содержанием NE, МРО, IL-6 и IL-8 [65][74].
Нарушения в системе образования NETs являются своеобразным триггерным фактором, запускающим процесс канцерогенеза, но недостаточно изученным. Информация о роли NETs в патогенезе гинекологического рака практически отсутствует в литературе, тем самым данная проблема актуальна и требует скорейшего решения.
Несмотря на внедрение в последнее десятилетие современных методов диагностики в онкологии (магнитно-резонансная, компьютерная и позитронно-эмиссионная томография, ультразвуковые аппараты экспертного класса, автоматизированные системы гистологической диагностики, иммуноморфологические исследования, опухолевые маркеры и др.), уровень поздней диагностики онкогинекологических заболеваний остается высоким. Поздняя диагностика может приводить к необходимости более агрессивных форм лечения, таких как радикальная хирургия, химиотерапия или лучевая терапия, которые могут иметь более высокий риск осложнений.
Патогенез гинекологического рака играют одну из важных ролей в достижении поставленных целей, направленных на снижение количества рецидивов, уменьшение ошибок при определении стадии заболевания и выборе стратегии лечения пациента. Необходимо продолжить изучение канцерогенеза онкогинекологических заболеваний на молекулярном уровне, что предоставит возможность выявить ключевые мишени, в большей степени ответственные за механизмы развития опухолей, и разработать методы персонализированной медицины.
Внеклеточные ловушки нейтрофилов как потенциальные молекулярные мишени для таргетной терапии / Neutrophil extracellular traps as potential molecular cues for targeted therapy
Высокий уровень NETs у онкологических больных и их роль в метастазировании и тромбозе представляет потенциальный терапевтический интерес для лечения рака. Учитывая вышесказанное, блокирование образования NETs с помощью антикоагулянтов против компонентов NETs, таких как ДНКаза I [25], ингибиторы NE [30], MРО [17] и PAD4 [75], может иметь большой потенциал (рис. 3).
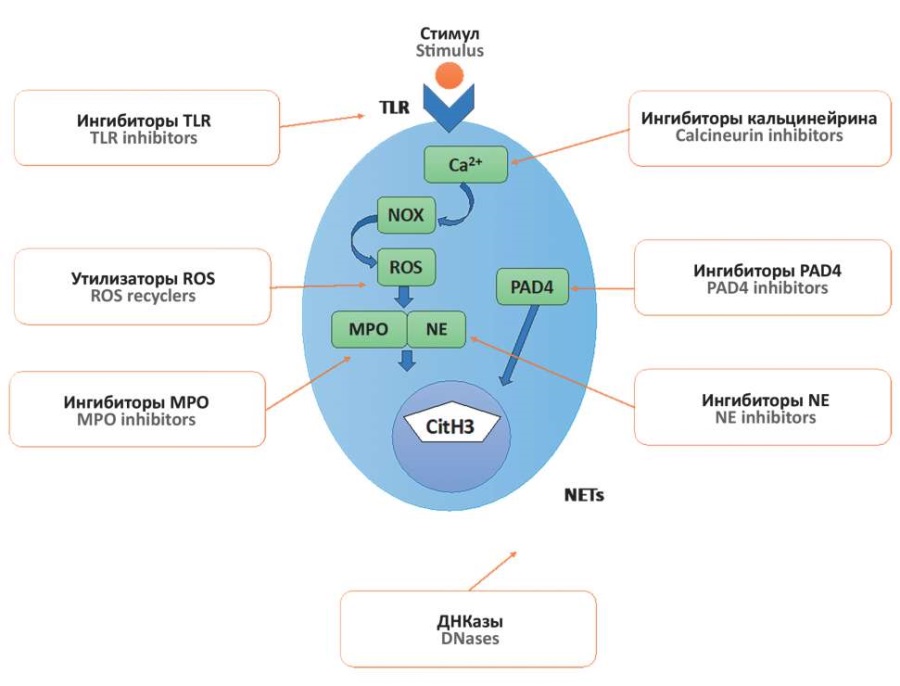
Рисунок 3. Возможные новые мишени терапии
злокачественных заболеваний с учетом патогенетического значения
внеклеточных ловушек нейтрофилов (NETs) [рисунок авторов].
Примечание: сitH3 – цитруллинированный гистон H3; MPO – миелопероксидаза; NE – эластаза нейтрофилов (англ. neutrophil elastase); NOX – NADPH–оксидазный комплекс; PAD4 – протеин-аргинин деиминаза 4; ROS – активные формы кислорода; TLR – toll-подобный рецептор.
Figure 3. Potential new targets for cancer therapy
based on pathogenetic significance of neutrophil extracellular traps (NETs)
[drawn by authors].
Note: сitH3 – citrullinated histone H3; MPO – myeloperoxidase; NE – neutrophil elastase; NOX – NADPH oxidase complex; PAD4 – protein arginine deiminase 4; ROS – reactive oxygen species; TLR – toll-like receptor.
Регулирование неконтролируемого процесса образования NETs (нетоз) представляет собой многообещающую стратегию лечения онкогинекологических заболеваний. ДНКаза и многочисленные ингибиторы могут быть использованы для воздействия на критически важные стадии образования NETs. В анализе in vitro лечение ДНКазой I подавляло рост клеток поджелудочной железы и снижало адгезию клеток рака желудка [76]. Более того, после лечения ДНКазой I раковые клетки желудка демонстрировали эпителиальный, а не мезенхимальный фенотип (инвазивный и мигрирующий фенотип) [77]. Уплотнение хроматина является наиболее важным этапом в формировании NETs и зависит от действия PAD4 посредством цитруллинации HIS. Исследования на мышиной модели показали, что удаление гена PAD4 приводило к снижению пролиферации опухолевых клеток, при этом дефицит PAD4 также может способствовать апоптозу опухолевых клеток и снижать метастатическую нагрузку [17].
На сегодняшний день проводится лишь несколько клинических испытаний для подтверждения эффективности ДНКазы у онкологических больных. Пульмозим, рекомбинантная ДНК человека, тестируется в рамках фазы 1 исследования (NCT00536952) у пациентов с раком головы и шеи (острый миелоидный/лимфоидный лейкоз) [78].
Другим способом ингибирования NETs является блокирование CXCR1 и CXCR2, которые являются ключевыми медиаторами хемотаксического рекрутирования нейтрофилов. Ось CXCR1/2-IL-8 играет важную роль в хемотаксисе нейтрофилов, а также в формировании NETs [60], тем самым привлекая большое внимание в качестве терапевтических мишеней. Выработка IL-8 может быть индуцирована IL-17, а ингибирование передачи сигналов IL-17/IL-17RA увеличивает блокаду иммунологических контрольных точек (анти-PD-1, анти-CTLA4) [79].
На данный момент проводится клиническое исследование (NCT03400332), изучающее безопасность и эффективность комбинированного лечения ингибитором IL-8 с ниволумабом (анти-PD-1 mAb) или ниволумабом и в сочетании с ипилимумабом (анти-CTLA4 mAb) [80]. Комбинированное лечение репариксином (другим молекулярным препаратом против CXCR1/2) и паклитакселом показало противоопухолевую активность наряду с отличным профилем безопасности в исследовании с HER2 (мембранный белок, тирозиновая протеинкиназа семейства рецепторов эпидермального фактора ростa EGFR/ЕrbB)-негaтивных пациентов с метастатическим РМЖ [81].
Многочисленные исследования подтверждают огромный потенциал лечения, основанный на целенаправленном блокировании NETs для эффективного контроля прогрессирования и метастазирования опухоли. Однако они имеют некоторые ограничения, так как в большинстве случаев модели основаны на ксенотрансплантированных мышах, не отражающие сложную микросреду, наблюдаемую у пациентов с опухолями. Также введение этих ингибиторов NETs имеет нецелевые эффекты, особенно у пожилых онкологических больных с ослабленным иммунитетом. Кроме того, таргетная терапия в отношении NETs также имеет определенные нежелательные эффекты, которые связаны в первую очередь с возможным влиянием на работу иммунной системы. Наконец, отсутствует информация о применении данного вида лечения среди пациентов с гинекологическим раком, так как заболевание отличается своей гетерогенностью, формирует целый спектр трудностей при создании персонализированного лечения. Поэтому изучение механизмов образования и разрушения NETs, а также их роль в тромбообразовании представляет актуальную проблему в онкогинекологии.
Заключение / Conclusion
На данный момент уже разгадано множество сигнальных путей, которые приводят к образованию NETs. Исследования показывают, что NETs могут быть вызваны физиологическими факторами, такими как микроорганизмы и их компоненты, а также фармакологическими стимулами. Было установлено, что существует 2 механизма образования NETs: классический (или суицидальный), который приводит к гибели клетки (нетоз), и витальный, при котором клетки сохраняют свою жизнеспособность, а также все естественные эффекторные функции. При классическом нетозе ферментный комплекс NADPH-оксидаза и образованные им ROS являются неотъемлемыми участниками. Однако при активации нетоза другими стимулами, такими как ионофоры кальция, митохондриальные ROS также играют роль. После обнаружения NETs стало ясно, что эти структуры являются источниками антигенов и поддерживают, а часто и активируют аутоиммунные процессы. NETs были обнаружены в сыворотке практически у всех пациентов с аутоиммунными заболеваниями, включая системную красную волчанку, ревматоидный артрит, псориаз и другие. NETs также были обнаружены при различных воспалительных неинфекционных заболеваниях, таких как болезнь Альцгеймера, панкреатит и рак. В связи с этим эффективность создания лекарственных средств для лечения этих заболеваний в значительной мере зависит от расшифровки сигнальных путей, приводящих к образованию NETs, а также от выявления их целевых медиаторов. Несмотря на то что за почти 2 десятилетия с момента первого описания NETs было расшифровано множество механизмов и медиаторов, остается много нераскрытых вопросов, на которые ожидается получить ответы в ближайшем будущем.
Образование NETs является новым важным механизмом естественного иммунитета, который имеет решающее значение для индукции воспалительного ответа на инфекцию, а также для лечения. Научные исследования NETs, их белковых компонентов и регуляторных механизмов привели к расширению наших знаний о роли нейтрофильных сетей в патогенезе различных заболеваний. NETs связывают с развитием воспалительных, автоиммунных, онкологических и инфекционных заболеваний. Дальнейшие исследования направлены на разработку новой стратегии в диагностике и лечении заболеваний и их осложнений.
Список литературы
1. Beiter T., Fragasso A., HartlD., Nieß A.M. Neutrophil extracellular traps: a walk on the wild side of exercise immunology. Sports Med. 2015;45(5):625–40. https://doi.org/10.1007/s40279-014-0296-1.
2. Finazzi G. The Italian Registry of antiphospholipid antibodies. Haematologica. 1997;82(1):101–5.
3. Saffarzadeh M., Juenemann C., Queisser M.A. et al. Neutrophil extracellular traps directly induce epithelial and endothelial cell death: a predominant role of histones. PloS One. 2012;7(2):e32366. https://doi.org/10.1371/journal.pone.0032366.
4. Fine N., Tasevski N., McCulloch C.A. et al. The neutrophil: constant defender and first responder. Front Immunol. 2020;11:571085. https://doi.org/10.3389/fimmu.2020.571085.
5. Vilen S.-T., Nyberg P., Hukkanen M. et al. Intracellular co-localization of trypsin-2 and matrix metalloprotease-9: possible proteolytic cascade of trypsin-2, MMP-9 and enterokinase in carcinoma. Exp Cell Res. 2008;314(4):914–26. https://doi.org/10.1016/j.yexcr.2007.10.025.
6. Антонеева И.И. Кислородзависимая антимикробная система нейтрофилов в динамике развития рака яичников. Казанский медицинский журнал. 2008;89(4):476–8.
7. Schauer C., Janko C., Munoz L.E. et al. Aggregated neutrophil extracellular traps limit inflammation by degrading cytokines and chemokines. Nat Med. 2014;20(5):511–7. https://doi.org/10.1038/nm.3547.
8. Shi X., Li B., Yuan Y. et al. The possible association between the presence of an MPO -463 G > A (rs2333227) polymorphism and cervical cancer risk. Pathol Res Pract. 2018;8(214):1142–8. https://doi.org/10.1016/j.prp.2018.05.018.
9. Falanga A., Rickles F.R. Pathophysiology of the thrombophilic state in the cancer patient. Semin Thromb Hemost. 1999;25(2):173–82. https://doi.org/10.1016/10.1055/s-2007-994919.
10. Fine N., Tasevski N., McCulloch C.A. et al. The neutrophil: constant defender and first responder. Front Immunol. 2020;11:571085. https://doi.org/10.1016/10.3389/fimmu.2020.571085.
11. Brinkmann V., Reichard U., Goosmann C. et al. Neutrophil extracellular traps kill bacteria. Science. 2004;303(5663):1532–5. https://doi.org/10.1126/science.1092385.
12. Arazna M., Pruchniak M.P., Zycinska K., Demkow U. Neutrophil extracellular trap in human diseases. Adv Exp Med Biol. 2013;756:1–8. https://doi.org/10.1007/978-94-007-4549-0_1.
13. Yalavarthi S., Gould T.J., Rao A.N. et al. Release of neutrophil extracellular traps by neutrophils stimulated with antiphospholipid antibodies: a newly identified mechanism of thrombosis in the antiphospholipid syndrome. Arthritis Rheumatol. 2015;67(11):2990–3003. https://doi.org/10.1002/art.39247.
14. Demers M., Wagner D.D. NETosis: a new factor in tumor progression and cancer-associated thrombosis. Semin Thromb Hemost. 2014;40(3):277–83. https://doi.org/10.1055/s-0034-1370765.
15. Malcolm K.C., Worthen G.S. Lipopolysaccharide stimulates p38-dependent induction of antiviral genes in neutrophils independently of paracrine factors. J Biol Chem. 2003;278(18):15693–701. https://doi.org/10.1074/jbc.M212033200.
16. Perobelli S.M., Galvani R.G., Gonçalves-Silva T. et al. Plasticity of neutrophils reveals modulatory capacity. Braz J Med Biol Res. 2015;48(8):665–75. https://doi.org/10.1590/1414-431X20154524.
17. Yazdani H.O., Roy E., Comerci A.J. et al. Neutrophil extracellular traps drive mitochondrial homeostasis in tumors to augment growth. Cancer Res. 2019;79(21):5626–39. https://doi.org/10.1158/0008-5472.CAN-19-0800.
18. Yousefi S., Gold J., Andina N. et al. Catapult-like release of mitochondrial DNA by eosinophils contributes to antibacterial defense. Nat Med. 2008;14(9): 949–53. https://doi.org/10.1038/nm.1855.
19. Coussens L.M., Tinkle C.L., Hanahan D., Werb Z. MMP-9 supplied by bone marrow-derived cells contributes to skin carcinogenesis. Cell. 2000;103(3):481–90. https://doi.org/10.1016/s0092-8674(00)00139-2.
20. Mayadas T.N., Cullere X., Lowell C.A. The multifaceted functions of neutrophils. Annu Rev Pathol. 2014;9:181–218. https://doi.org/10.1146/annurev-pathol-020712-164023.
21. Al-Benna S., Shai Y., Jacobsen F., Steinstraesser L. Oncolytic activities of host defense peptides. Int J Mol Sci. 2011;12(11):8027–51. https://doi.org/10.3390/ijms12118027.
22. Cristinziano L., Luca Modestino L., Loffredo S. et al. Anaplastic thyroid cancer cells induce the release of mitochondrial extracellular DNA traps by viable neutrophils. J Immunol. 2020;204(5):1362–72. https://doi.org/10.4049/jimmunol.1900543.
23. Gupta A.K., Joshi M.B., Philippova M. et al. Activated endothelial cells induce neutrophil extracellular traps and are susceptible to NETosis-mediated cell death. FEBS Lett. 2010;584(14):3193–7. https://doi.org/10.1016/j.febslet.2010.06.006.
24. Hanahan D., Weinberg R.A. Hallmarks of cancer: the next generation. Cell. 2011;144(5):646–74. https://doi.org/10.1016/j.cell.2011.02.013.
25. Cools-Lartigue J., Spicer J., McDonald B. et al. Neutrophil extracellular traps sequester circulating tumor cells and promote metastasis. J Clin Invest. 2013;123(8):3446–58. https://doi.org/10.1172/JCI67484.
26. Demers M., Krause D.S., Schatzberg D. et al. Cancers predispose neutrophils to release extracellular DNA traps that contribute to cancer-associated thrombosis. Proc Natl Acad Sci U S A. 2012;109(32):13076–81. https://doi.org/10.1073/pnas.1200419109.
27. Hoffmann J.H.O., Enk A.H. Neutrophil extracellular traps in dermatology: caught in the NET. J Dermatol Sci. 2016;84(1):3–10. https://doi.org/10.1016/j.jdermsci.2016.07.001.
28. Rosales C. Neutrophil: a cell with many roles in inflammation or several cell types? Front Physiol. 2018;9:113. https://doi.org/10.3389/fphys.2018.00113.
29. Kim J., Bae J.-S. Tumor-associated macrophages and neutrophils in tumor microenvironment. Mediators Inflamm. 2016;2016:6058147. https://doi.org/10.1155/2016/6058147.
30. Rayes R.F. Primary tumors induce neutrophil extracellular traps with targetable metastasis promoting effects. JCI Insight. 2019;5(16):e128008. https://doi.org/10.1172/jci.insight.128008.
31. Горудко И.В., Черкалина О.С., Соколов А.В. и др. Новые подходы к определению концентрации и пероксидазной активности миелопероксидазы в плазме крови человека. Биоорганическая химия. 2009;35(5):629–39.
32. Bromberg M.E., Capello M. Cancer and blood coagulation: molecular aspects. Cancer J Sci Am. 1999;5(3):132–8.
33. Loreto M.F., De Martinis M., Corsi M.P. et al. Coagulation and cancer: implications for diagnosis and management. Pathol Oncol Res. 2000;6(4):301–12. https://doi.org/10.1007/BF03187336.
34. Panagopoulos V., Leach D.A., Zinonos I. et al. Inflammatory peroxidases promote breast cancer progression in mice via regulation of the tumour microenvironment. Int J Oncol. 2017;50(4):1191–200. https://doi.org/10.3892/ijo.2017.3883.
35. Андрюков Б.Г., Сомова Л.М., Дробот Е.И., Матосова Е.В. Защитные стратегии нейтрофильных гранулоцитов от патогенных бактерий. Здоровье. Медицинская экология. Наука. 2017;(1):4–18. https://doi.org/10.5281/zenodo.345606.
36. Uribe-Querol E., Rosales C. Neutrophils in cancer: two sides of the same coin. J Immunol Res. 2015;2015:983698. https://doi.org/10.1155/2015/983698.
37. Солопова А.Г., Москвичёва В.С., Блбулян Т.А. и др. Актуальные вопросы профилактики, диагностики и лечения рака вульвы и влагалища. Акушерство, Гинекология и Репродукция. 2018;12(4):62–70. https://doi.org/10.17749/2313-7347.2018.12.4.062-070.
38. Shaul M.E., Fridlender Z.G. Cancer-related circulating and tumor-associated neutrophils – subtypes, sources and function. FEBS J. 2018;285(23):4316–42. https://doi.org/10.1111/febs.14524.
39. Merza M., Hartman H., Rahman M. et al. Neutrophil extracellular traps induce trypsin activation, Inflammation, and tissue damage in mice with severe acute pancreatitis. Gastroenterology. 2015;149(7):1920–31.e8. https://doi.org/10.1053/j.gastro.2015.08.026.
40. Metzler K.D., Fuchs T.A., Nauseef W.M. et al. Myeloperoxidase is required for neutrophil extracellular trap formation: implications for innate immunity. Blood. 2011;117(3):953–9. https://doi.org/10.1182/blood-2010-06-290171.
41. Pahler J.C., Tazzyman S., Erez N. et al. Plasticity in tumor-promoting inflammation: impairment of macrophage recruitment evokes a compensatory neutrophil response. Neoplasia. 2008;10(4):329–39. https://doi.org/10.1593/neo.07871.
42. Valadez-Cosmes P., Raftopoulou S., Mihalic Z.N. et al. Myeloperoxidase: growing importance in cancer pathogenesis and potential drug target. Pharmacol Ther. 2022;236:108052. https://doi.org/10.1016/j.pharmthera.2021.108052.
43. Cai H., Chuang C.Y., Hawkins C.L., Davies M.J. Binding of myeloperoxidase to the extracellular matrix of smooth muscle cells and subsequent matrix modification. Sci Rep. 2020;10(1):666. https://doi.org/10.1038/s41598-019-57299-6.
44. Нестерова И.В., Ковалева С.В., Фомичева Е.В. и др. Клинико-иммунологические параллели при неопластических заболеваниях органов пищеварения: клинические маркеры иммунодефицита и нарушения функционирования микробицидных и цитотоксических механизмов нейтрофильных гранулоцитов. XIV Международный конгресс по реабилитации в медицине и иммунореабилитации: тезисы докладов. Израиль, 2009. 2009;11(1):79a.
45. de Bont C.M., Eerden N., Boelens W.C., Pruijn G.J.M. Neutrophil proteases degrade autoepitopes of NET-associated proteins. Clin Exp Immunol. 2020;199(1):1–8. https://doi.org/10.1111/cei.13392.
46. López-Otín C., Matrisian L.M. Emerging roles of proteases in tumour suppression. Nat Rev Cancer. 2007;7(10):800–8. https://doi.org/10.1038/nrc2228.
47. Moali C., Hulmes D.J.S. Extracellular and cell surface proteases in wound healing: new players are still emerging. Eur J Dermatol. 2009;19(6):552–64. https://doi.org/10.1684/ejd.2009.0770.
48. Sanderson R.D., Bandari S.K., Vlodavsky I. Proteases and glycosidases on the surface of exosomes: newly discovered mechanisms for extracellular remodeling. Matrix Biol. 2019;75–76:160–9. https://doi.org/10.1016/j.matbio.2017.10.007.
49. Nyberg P., Ylipalosaari M., Sorsa T., Salo T. Trypsins and their role in carcinoma growth. Exp Cell Res. 2006;312(8):1219–28. https://doi.org/10.1016/j.yexcr.2005.12.024.
50. Vilen S.-T., Nyberg P., Hukkanen M. Intracellular co-localization of trypsin-2 and matrix metalloprotease-9: possible proteolytic cascade of trypsin-2, MMP-9 and enterokinase in carcinoma. Exp Cell Res. 2008;314(4):914–26. https://doi.org/10.1016/j.yexcr.2007.10.025.
51. Morimoto-Kamata R., Yui S. Insulin-like growth factor-1 signaling is responsible for cathepsin G-induced aggregation of breast cancer MCF-7 cells. Cancer Sci. 2017;108(8);1574–83. https://doi.org/10.1111/cas.13286.
52. Wilson T.J., Nannuru K.C., Futakuchi M. et al. Cathepsin G enhances mammary tumor-induced osteolysis by generating soluble receptor activator of nuclear factor-kappaB ligand. Cancer Res. 2008;68(14):5803–11. https://doi.org/10.1158/0008-5472.CAN-07-5889.
53. McLoed A.G., Sherrill T.P., Cheng D.-S. et al. Neutrophil-derived IL-1β impairs the efficacy of NF-κB inhibitors against lung cancer. Cell Rep. 2016;16(1):120–32. https://doi.org/10.1016/j.celrep.2016.05.085.
54. Clancy D.M., Sullivan G.P., Moran H.B.T. et al. Extracellular neutrophil proteases are efficient regulators of IL-1, IL-33, and IL-36 cytokine activity but poor effectors of microbial killing. Cell reports. 2018;22(11):2937–50. https://doi.org/10.1016/j.celrep.2018.02.062.
55. Acuff H.B., Carter K.J., Fingleton B. et al. Matrix metalloproteinase-9 from bone marrow-derived cells contributes to survival but not growth of tumor cells in the lung microenvironment. Cancer Res. 2006;66(1):259–66. https://doi.org/10.1158/0008-5472.CAN-05-2502.
56. Park J.-H., Rasch M.G., Qiu J. et al. Presence of insulin-like growth factor binding proteins correlates with tumor-promoting effects of matrix metalloproteinase 9 in breast cancer. Neoplasia. 2015;17(5):421–33. https://doi.org/10.1016/j.neo.2015.04.003.
57. Peng Z., Liu C., Victor A.R. et al. Tumors exploit CXCR4hiCD62Llo aged neutrophils to facilitate metastatic spread. Oncoimmunology. 2021;10(1);1870811. https://doi.org/10.1080/2162402X.2020.1870811.
58. Yang Q., Mas A., Diamond M.P., Al-Hendy A. The mechanism and function of epigenetics in uterine leiomyoma development. Reprod Sci. 2016;23(2):163–75. https://doi.org/10.1177/1933719115584449.
59. Audia J.E., Campbell R.M. Histone modifications and cancer. Cold Spring Harb Perspect Biol. 2016;8(4):a019521. https://doi.org/10.1101/cshperspect.a019521.
60. Podaza E., Sabbione F., Risnik D. et al. Neutrophils from chronic lymphocytic leukemia patients exhibit an increased capacity to release extracellular traps (NETs). Cancer Immunol Immunother. 2017;66(1):77–89. https://doi.org/10.1007/s00262-016-1921-7.
61. Nie M., Yang L., Bi X. et al. Neutrophil extracellular traps induced by IL8 promote diffuse large B-cell lymphoma progression via the TLR9 signaling. Clin Cancer Res. 2019;25(6):1867–79. https://doi.org/10.1158/1078-0432.CCR-18-1226.
62. Sun N., Li X., Wang Z. et al. A multiscale TiO2 nanorod array for ultrasensitive capture of circulating tumor cells. ACS Appl Mater Interfaces. 2016;8(20):12638–43. https://doi.org/10.1021/acsami.6b02178.
63. Mao Z., Zhang J., Shi Y. et al. CXCL5 promotes gastric cancer metastasis by inducing epithelial-mesenchymal transition and activating neutrophils. Oncogenesis. 2020;9(7):63. https://doi.org/10.1038/s41389-020-00249-z.
64. Teijeira A., Garasa S., Gato M. et al. CXCR1 and CXCR2 chemokine receptor agonists produced by tumors induce neutrophil extracellular traps that interfere with immune cytotoxicity. Immunity. 2020;52(5):856-871.e8. https://doi.org/10.1016/j.immuni.2020.03.001.
65. Tohme S., Yazdani H.O., Al-Khafaji A.B. et al. Neutrophil extracellular traps promote the development and progression of liver metastases after surgical stress. Cancer Res. 2016;76(6):1367–80. https://doi.org/10.1158/0008-5472.CAN-15-1591.
66. Fuchs T.A., Brill A., Duerschmied D. et al. Extracellular DNA traps promote thrombosis. Proc Natl Acad Sci U S A. 2010;107(36):15880–5. https://doi.org/10.1073/pnas.1005743107.
67. Chaffer C.L., Weinberg R.A. A perspective on cancer cell metastasis. Science. 2011;331(6024):1559–64. https://doi.org/10.1126/science.1203543.
68. Chen Y., Hu H., Tan S. et al. The role of neutrophil extracellular traps in cancer progression, metastasis and therapy. Exp Hematol Oncol. 2022;11(1):99. https://doi.org/10.1186/s40164-022-00345-3.
69. Farrera C., Fadeel B. Macrophage clearance of neutrophil extracellular traps is a silent process. J Immunol. 2013;191(5):2647–56. https://doi.org/10.4049/jimmunol.1300436.
70. Oklu R., Sheth R.A., Wong K.H.K. et al. Neutrophil extracellular traps are increased in cancer patients but does not associate with venous thrombosis. Cardiovasc Diagns Ther. 2017;7(Suppl 3):S140–S149. https://doi.org/10.21037/cdt.2017.08.01.
71. Li Y., Yang Y., Gan T. et al. Extracellular RNAs from lung cancer cells activate epithelial cells and induce neutrophil extracellular traps. Int J Oncol. 2019;55(1):69–80. https://doi.org/10.3892/ijo.2019.4808.
72. Klebanoff S.J. Myeloperoxidase: friend and foe. J Leukoc Biol. 2005;77(5):598–625. https://doi.org/10.1189/jlb.1204697.
73. Cools-Lartigue J., Spicer J., Najmeh S., Ferri L. Neutrophil extracellular traps in cancer progression. Cell Mol Life Sci. 2014;71(21):4179–94. https://doi.org/10.1007/s00018-014-1683-3.
74. Berger-Achituv S., Brinkmann V., Abed U.A. et al. A proposed role for neutrophil extracellular traps in cancer immunoediting. Front Immunol. 2013;4:48. https://doi.org/10.3389/fimmu.2013.00048.
75. Thalin C., Lundström S., Seignez C. et al. Citrullinated histone H3 as a novel prognostic blood marker in patients with advanced cancer. PLoS One. 2018;13(1):e0191231. https://doi.org/10.1371/journal.pone.0191231.
76. Cedervall J., Dragomir A., Saupe F. et al. Pharmacological targeting of peptidylarginine deiminase 4 prevents cancer-associated kidney injury in mice. Oncoimmunology. 2017;6(8):e1320009. https://doi.org/10.1080/2162402X.2017.1320009.
77. Hisada Y., Grover S.P., Maqsood A. et al. Neutrophils and neutrophil extracellular traps enhance venous thrombosis in mice bearing human pancreatic tumors. Haematologica. 2020;105(1):218–25. https://doi.org/10.3324/haematol.2019.217083.
78. Zhu T., Zou X., Yang C. et al. Neutrophil extracellular traps promote gastric cancer metastasis by inducing epithelial-mesenchymal transition. Int J Mol Med. 2021;48(1):127. https://doi.org/10.3892/ijmm.2021.4960.
79. Volkov D.V., Tetz G.V., Rubtsov Y.P. et al. Neutrophil extracellular traps (NETs): opportunities for targeted therapy. Acta Naturae. 2021;13(3):15–23. https://doi.org/10.32607/actanaturae.11503.
80. Zhang Y., Chandra V., Sanchez E.R. et al. Interleukin-17-induced neutrophil extracellular traps mediate resistance to checkpoint blockade in pancreatic cancer. J Exp Med. 2020:217(12):e20190354. https://doi.org/10.1084/jem.20190354.
81. Schalper K.A., Carleton M., Zhou M. et al. Elevated serum interleukin-8 is associated with enhanced intratumor neutrophils and reduced clinical benefit of immune-checkpoint inhibitors. Nat Med. 2020;26(5):688–92. https://doi.org/10.1038/s41591-020-0856-x.
Об авторах
З. Д. АслановаРоссия
Асланова Замиля Джамалидиновна – аспирант кафедры акушерства, гинекологии и перинатальной медицины Клинического института детского здоровья имени Н.Ф. Филатова.
119991 Москва, ул. Большая Пироговская, д. 2, стр. 4
Д. Х. Хизроева
Россия
Хизроева Джамиля Хизриевна – д.м.н., профессор кафедры акушерства, гинекологии и перинатальной медицины Клинического института детского здоровья имени Н.Ф. Филатова. Scopus Author ID: 57194547147. Researcher ID: F-8384-2017.
119991 Москва, ул. Большая Пироговская, д. 2, стр. 4
А. Г. Солопова
Россия
Солопова Антонина Григорьевна – д.м.н., профессор кафедры акушерства, гинекологии и перинатальной медицины Клинического института детского здоровья имени Н.Ф. Филатова. Scopus Author ID: 6505479504. Researcher ID: Q-1385-2015.
119991 Москва, ул. Большая Пироговская, д. 2, стр. 4
В. А. Солодкий
Россия
Солодкий Владимир Алексеевич – д.м.н., профессор, академик РАН, директор.
117997 Москва, ул. Профсоюзная, д. 86
А. В. Воробьев
Россия
Воробьев Александр Викторович – к.м.н., доцент кафедры акушерства, гинекологии и перинатальной медицины Клинического института детского здоровья имени Н.Ф. Филатова. Scopus Author ID: 57191966265. Researcher ID: F-8804-2017.
119991 Москва, ул. Большая Пироговская, д. 2, стр. 4
Д. В. Блинов
Россия
Блинов Дмитрий Владиславович – к.м.н., ассистент кафедры спортивной медицины и медицинской реабилитации. Института клинической медицины имени Н.В. Склифосовского ФГАОУ ВО Первый МГМУ имени И.М. Сеченова Министерства здравоохранения РФ (Сеченовский Университет); руководитель по медицинским и научным вопросам, Институт Превентивной и Социальной Медицины; доцент кафедры спортивной, физической и реабилитационной медицины АНО ДПО «Московский медико-социальный институт имени Ф.П. Гааза». Scopus Author ID: 6701744871. Researcher ID: E-8906-2017. RSCI: 9779-8290.
119991 Москва, ул. Большая Пироговская, д. 2, стр. 4; 127006 Москва, ул. Садовая-Триумфальная, д. 4–10; 123056 Москва, 2-я Брестская ул., д. 5, с. 1–1а
М. Д. Асланова
Россия
Асланова Марина Джамалидиновна – врач-эндокринолог отделения радионуклидной диагностики.
117997 Москва, ул. Профсоюзная, д. 86
И. А. Накаидзе
Россия
Накаидзе Инга Александровна – аспирант кафедры акушерства, гинекологии и перинатальной медицины Клинического института детского здоровья имени Н.Ф. Филатова.
119991 Москва, ул. Большая Пироговская, д. 2, стр. 4
Ж.-К. Гри
Франция
Гри Жан-Кристоф – д.м.н., профессор кафедры акушерства, гинекологии и перинатальной медицины Клинического института детского здоровья имени Н.Ф. Филатова ; профессор гематологии, зав. лабораторией гематологии факультета биологических и фармацевтических наук Университета Монпелье и Университетской больницы Нима; иностранный член РАН. Scopus Author ID: 7005114260. Researcher ID: AAA-2923-2019.
119991 Москва, ул. Большая Пироговская, д. 2, стр. 4; 34090 Монпелье, ул. Огюста Бруссоне, д. 163
И. Элалами
Франция
Элалами Исмаил – д.м.н., профессор кафедры акушерства, гинекологии и перинатальной медицины Клинического института детского здоровья имени Н.Ф. Филатова; профессор медицинского Университета Сорбонны; директор гематологии Центра Тромбозов, Госпиталь Тенон, Scopus Author ID: 7003652413. Researcher ID: AAC-9695-2019.
119991 Москва, ул. Большая Пироговская, д. 2, стр. 4; 75006 Париж, Улица медицинского факультета, д. 12; 75020 Париж, Китайская улица, д. 4
А. Д. Макацария
Россия
Макацария Александр Давидович – д.м.н., профессор, академик РАН, зав. кафедрой акушерства, гинекологии и перинатальной медицины Клинического института детского здоровья имени Н.Ф. Филатова; вице-президент Российского общества акушеров-гинекологов (РОАГ); Заслуженный врач Российской Федерации; Почетный профессор Венского Университета. Scopus Author ID: 57222220144. Researcher ID: M-5660-2016.
119991 Москва, ул. Большая Пироговская, д. 2, стр. 4
Рецензия
Для цитирования:
Асланова З.Д., Хизроева Д.Х., Солопова А.Г., Солодкий В.А., Воробьев А.В., Блинов Д.В., Асланова М.Д., Накаидзе И.А., Гри Ж., Элалами И., Макацария А.Д. Клиническое значение определения внеклеточных ловушек нейтрофилов у женщин с онкогинекологическими заболеваниями. Акушерство, Гинекология и Репродукция. 2023;17(6):751-768. https://doi.org/10.17749/2313-7347/ob.gyn.rep.2023.447
For citation:
Aslanova Z.D., Khizroeva J.Kh., Solopova A.G., Solodkiy V.A., Vorobev A.V., Blinov D.V., Aslanova M.D., Nakaidze I.A., Gris J., Elalamy I., Makatsariya A.D. Clinical significance of determining neutrophil extracellular traps in women with oncogynecological neoplasms. Obstetrics, Gynecology and Reproduction. 2023;17(6):751-768. (In Russ.) https://doi.org/10.17749/2313-7347/ob.gyn.rep.2023.447

Контент доступен под лицензией Creative Commons Attribution-NonCommercial-ShareAlike 4.0 International License.











































