Перейти к:
Характеристика тромбоцитов и тромбоцитарных индексов при COVID‑19 у беременных в зависимости от факта наличия тромбообразования
https://doi.org/10.17749/2313-7347/ob.gyn.rep.2023.429
Аннотация
Введение. Одним из наиболее частых осложнений COVID-19 является возникновение тромбозов. Период беременности сопровождается повышением восприимчивости к инфекционным заболеваниям и увеличением риска тромбозов.
Цель: оценить динамику количества тромбоцитов и тромбоцитарных индексов по общеклиническому анализу крови у беременных на фоне COVID-19 в зависимости от времени с начала заболевания и факта наличия тромбообразования.
Материалы и методы. Проведен ретроспективный анализ 230 историй болезней беременных в III триместре с COVID-19. Из них были выбраны 99 женщин, соответствовавших критериям включения: лабораторно верифицированная методом полимеразной цепной реакции инфекция COVID-19; III триместр беременности; наличие/отсутствие тромботических осложнений. Все пациентки были поделены на 2 группы: контрольную группу составили 94 беременных без тромботических осложнений в возрасте 31,5 [28,0; 35,0] лет и средним сроком беременности на момент заболевания 34,1 [30,2; 37,6] нед; в основную группу вошли 5 пациенток в возрасте 33,0 [28,5; 37,5] лет и средним сроком беременности на момент заболевания 33,2 [30,2; 37,8] нед с возникшими в ходе заболевания тромботическими осложнениями: тромбоз вен верхних и нижних конечностей; массивная тромбоэмболия легочной артерии; тромбоз селезеночной вены в воротах селезенки; тромб левого предсердия. В динамике (на 6–8-е, 9–11-е, 12–15-е, 16–23-е и 24–72-е сутки заболевания) оценивали следующие показатели: общее количество тромбоцитов, тромбокрит, средний объем тромбоцита, ширину распределения тромбоцитов по объему (англ. platelet distribution width, РDW), число крупных тромбоцитов. Проведен сравнительный анализ полученных данных в группах пациенток с тромботическими осложнениями и без тромбозов и корреляционный анализ со временем от начала заболевания и фактом тромбообразования.
Результаты. За весь период наблюдения в основной группе пациенток отмечено увеличение РDW (16,30 [15,80; 16,50]%), среднего объема тромбоцитов (10,70 [9,70; 11,80] фл), числа крупных тромбоцитов (73,00 [59,00; 96,00]×109/л) и тенденция к более высокому количеству тромбоцитов (182,50 [155,00; 184,50]×109/л) по сравнению с контрольной группой. Установлена корреляционная связь вышеуказанных показателей с сутками заболевания и моментом тромбообразования (р < 0,05). Начало развития тромбозов в основной группе приходилось в основном на 12–15-е сутки заболевания. РDW увеличивалась в обеих группах к 16–23-м суткам болезни, но более выраженные изменения были зафиксированы в основной группе (16,50 [16,40; 16,60]%) по сравнению с контрольной (16,10 [15,80; 16,40]%). Тромбокрит при проведении сравнительного анализа в обеих группах к 16–23-м суткам у пациенток основной группы был ниже границы нормы – 0,13 [0,11; 0,20]%, в контрольной группе – 0,26 [0,21; 0,31]%. Корреляционный анализ выявил положительную корреляционную связь значений тромбокрита с сутками заболевания в обеих группах. Также отмечена тенденция к увеличению среднего объема тромбоцита в основной группе к 16–23-м суткам заболевания (11,00 [10,80; 11,80] фл). Количество крупных тромбоцитов было достаточно высоким и нарастало ежесуточно в обеих группах женщин; среднее число крупных тромбоцитов за весь период наблюдения составило в основной группе 73,00 [59,00; 96,00]×109/л, в контрольной – 81,00 [66,00; 102,00]×109/л, при этом в основной группе на 16–23-е сутки их количество резко снижалось до 55,00 [42,00; 78,00]×109/л.
Заключение. Полученные данные отражают ход тромботического процесса и могут служить основанием для оценки прогноза возникновения тромботических осложнений и выделения групп высокого риска среди беременных при наличии у них COVID-19.
Для цитирования:
Спиридонова Н.В., Гриценко Т.А., Хуртова Е.Ф. Характеристика тромбоцитов и тромбоцитарных индексов при COVID‑19 у беременных в зависимости от факта наличия тромбообразования. Акушерство, Гинекология и Репродукция. 2023;17(5):597-606. https://doi.org/10.17749/2313-7347/ob.gyn.rep.2023.429
For citation:
Spiridonova N.V., Gritsenko T.A., Khurtova E.F. Thrombogenesis-related characteristics of platelets and platelet indices in pregnant COVID-19 women. Obstetrics, Gynecology and Reproduction. 2023;17(5):597-606. (In Russ.) https://doi.org/10.17749/2313-7347/ob.gyn.rep.2023.429
Введение / Introduction
Практически сразу после начала пандемии COVID-19 врачи разных стран в процессе выявления и лечения заболевших стали отмечать состояние гиперкоагуляции и тромбоэмболические осложнения (ТЭО). В мае 2020 г. от имени Европейского общества кардиологов (англ. European Society of Cardiology, ESC) в журнале European Heart Journal итальянскими авторами был опубликован клинический случай двусторонней тромбоэмболии легочной артерии (ТЭЛА) у 75-летней COVID-19-положительной женщины, госпитализированной по поводу тяжелой двусторонней пневмонии [1]. Французскими авторами в 2020 г. было проведено многоцентровое проспективное когортное исследование, посвященное выявлению риска тромбоза у пациентов с тяжелой инфекцией SARS-CoV-2. В ходе исследования было обнаружено, что у 150 пациентов было диагностировано 64 клинически значимых тромботических осложнения, в основном легочная эмболия (16,7 %). У 28 из 29 (96,6 %) пациентов, получавших непрерывную заместительную почечную терапию, наблюдался тромбоз контура [2]. В июле 2020 г. группа авторов из Нидерландов опубликовала статью, посвященную частоте развития тромботических осложнений у тяжелобольных пациентов, госпитализированных с COVID-19 в отделения интенсивной терапии; из 184 пациентов венозные тромбоэмболии подтверждены у 27 % и артериальные тромботические события – в 3,7 % случаев [3]. Исходя из данных, приводимых авторами различных исследований, связь венозных ТЭО и COVID-19 очевидна.
В настоящее время многочисленными исследованиями доказано, что заболеваемость вирусными инфекциями у беременных выше, чем в популяции [4–8]. Относительно COVID-19 нет достоверных данных о более высокой восприимчивости беременных к инфекции по сравнению с общей популяцией [9][10]. Однако, E.A.N. Wastnedge с соавт. (2020) [11] и N. Subbaraman с соавт. (2021) [12] предлагают относить беременных в группу высокого риска осложненного течения инфекции. При этом известно, что беременность – физиологическое состояние организма женщины, сопровождающееся гиперкоагуляционным сдвигом в системе гемостаза. Соответственно, в период беременности возникает повышенный риск развития венозных ТЭО [13–16].
J. Servante с соавт. в 2020 г. провели систематический обзор случаев заболевания COVID-19 при беременности, описанных в электронных библиографических базах данных (PubMed/MEDLINE, Embase и База данных по охране материнства и младенчества). В результате проведенного анализа было установлено, что гематологические осложнения чаще возникают у беременных на фоне инфекции COVID-19 (1,26 %), чем у неинфицированных беременных (0,45 %) [17].
Проблема материнской смертности в результате ТЭО остается актуальной, несмотря на все принимаемые меры по ее снижению, а с появлением COVID-19 число тромбозов при беременности и, соответственно, материнская смертность значительно выросли. В связи с этим ведется поиск возможных мер профилактики развития тромбозов и предотвращения неблагоприятных исходов у беременных.
Цель: оценить динамику количества тромбоцитов и тромбоцитарных индексов по общеклиническому анализу крови у беременных на фоне COVID-19 в зависимости от времени с начала заболевания и факта наличия тромбообразования.
Материалы и методы / Materials and Methods
Дизайн исследования / Study design
Выполнен ретроспективный анализ 230 историй болезни беременных с диагнозом «новая коронавирусная инфекция COVID-19», находившихся на стационарном лечении в ковидном госпитале ГБУЗ СОКБ им. В.Д. Середавина с 01.04.2020 по 01.11.2021.
Критерии включения и исключения / Inclusion and exclusion criteria
Критерии включения (основная группа): лабораторно верифицированная методом полимеразной цепной реакции (ПЦР) инфекция COVID-19; III триместр беременности; наличие тромботических осложнений.
Критерии включения (контрольная группа): лабораторно верифицированная методом ПЦР инфекция COVID-19; III триместр беременности; отсутствие тромботических осложнений.
Критерии исключения: I и II триместры беременности; отсутствие лабораторного подтверждения инфекции COVID-19 методом ПЦР.
Группы сравнения / Comparison groups
Всего критериям включения соответствовали 99 историй болезни. Средний возраст пациенток составил 31,1 [ 28,0; 35,0] лет, средний срок беременности – 34,0 [ 30,2; 37,5] нед, среднее количество койко-дней – 13, максимальное количество койко-дней – 65, минимальное – 6. В соответствии с целью исследования сформировали 2 группы пациенток – с наличием тромботических осложнений (основная группа, n = 5) и без таковых (контрольная группа, n = 94).
Методы исследования / Study methods
На автоматическом гематологическом анализаторе ВС-6800 III поколения (Mindray, Китай) в каждом общеклиническом анализе крови, взятом на 6–8-е, 9–11-е, 12–15-е, 16–23-е и 24–72-е сутки заболевания, анализировали количество тромбоцитов и тромбоцитарные индексы – тромбокрит, число крупных тромбоцитов, средний объем тромбоцита, средний диаметр тромбоцита, ширину распределения тромбоцитов по объему (англ. platelet distribution width, РDW) с подсчетом ретикулоцитов и лейкоформулы методом проточной цитометрии. Корреляцию динамики исследованных показателей проводили с временем от начала заболевания.
Этические аспекты / Ethical aspects
Исследование проведено в соответствии с этическими стандартами Хельсинской декларации Всемирной медицинской ассоциации 1964 г. и ее последующими изменениями и сопоставимыми нормами этики. Исследование проводилось ретроспективно, путем анализа данных историй болезни. Все персональные данные пациенток были скрыты, и поэтому информированное добровольное согласие пациентками не подписывалось. Исследование одобрено 29.09.2021 комитетом по биоэтике при ФГБОУ ВО СамГМУ Минздрава России, протокол № 235.
Статистический анализ / Statistical analysis
Сбор и хранение данных осуществляли в пакете Microsoft Excel (Microsoft, США). Для статистического анализа использовали специализированное программное обеспечение: IBM SPSS Statistics software Version 25.0 (IBM Corporation, США, лицензия № 5725-А54). Изучали соответствие нормальному распределению показателей тромбоцитов по критерию Шапиро–Уилка. Сравнение групп и периодов наблюдения проводили с использованием непараметрического критерия Манна–Уитни. Описательные статистики представлены медианой и межквартильным размахом (Me [Q1; Q3]). Для исследования взаимосвязи уровня исследованных показателей и срока заболевания применяли расчет коэффициентов корреляции Спирмена. Результаты считали статистически значимыми при p ≤ 0,05.
Результаты / Results
Средний возраст женщин основной группы составил 33,0 [ 28,5; 37,5] лет, контрольной группы – 31,5 [ 28,0; 35,0] лет (р = 0,512). Средний срок беременности на момент начала заболевания в основной группе составил 33,2 [ 30,2; 37,8] нед, в контрольной группе – 34,1 [ 30,2;37,6] нед (р = 0,737).
В основной группе (n = 5) в ходе заболевания развились следующие тромботические осложнения: тромбоз вен верхней конечности (v. basilica, v. cephalica, v. cubitalis); тромбоз вен нижних конечностей (задней большеберцовой вены, подколенной вены, неокклюзирующий тромбоз нижней полой вены выше почечных вен); массивная ТЭЛА, тромбоз селезеночной вены в воротах селезенки; тромб левого предсердия. Чаще всего тромбозы развивались в период с 16-х по 23-и сутки от момента начала заболевания.
При оценке усредненных данных за весь период наблюдения в основной группе пациенток с тромбозами выявлено увеличение среднего диаметра тромбоцитов (р < 0,001), среднего объема тромбоцитов (р = 0,017), числа крупных тромбоцитов (р = 0,039) и тенденция на момент начала исследования к более высокому количеству тромбоцитов (р = 0,055) по сравнению с пациентками контрольной группы без тромбозов (табл. 1).
Таблица 1. Количество тромбоцитов и тромбоцитарные индексы
в группах обследованных посуточно.
Table 1. Daily assessed platelet count and platelet indices
in the groups examined.
|
Сутки от начала заболевания Day after disease onset |
Тромбоциты, ×10⁹/л Platelets, ×10⁹/L Me [ Q1; Q3] |
Тромбокрит, % Plateletcrit, % Me [ Q1; Q3] |
Средний объем тромбоцита, фл Mean platelet volume, fl Me [ Q1; Q3] |
Ширина распределения тромбоцитов по объему, % Platelet distribution width, % Me [ Q1; Q3] |
Число крупных тромбоцитов, ×10⁹/л Large platelet count, ×10⁹/L Me [ Q1; Q3] |
|||||
|
Контрольная группа Control group n = 94 |
Основная группа Main group n = 5 |
Контрольная группа Control group n = 94 |
Основная группа Main group n = 5 |
Контрольная группа Control group n = 94 |
Основная группа Main group n = 5 |
Контрольная группа Control group n = 94 |
Основная группа Main group n = 5 |
Контрольная группа Control group n = 94 |
Основная группа Main group n = 5 |
|
|
6–8-е 6–8 |
157,50 [ 128,00; 195,25] |
182,50 [ 155,00; 184,50] |
0,17 [ 0,14; 0,21] |
0,18 [ 0,17; 0,19] |
10,55 [ 9,50; 11,33] |
10,20 [ 9,78; 10,93] |
15,90 [ 15,63; 16,10] |
15,65 [ 15,60; 15,78] |
68,00 [ 50,75; 78,25] |
70,00 [ 67,25; 72,75] |
|
9–11-е 9–11 |
204,00 [ 163,50; 235,50] |
202,00 [ 190,00; 241,50] |
0,21 [ 0,18; 0,23] |
0,21 [ 0,19; 0,24] |
10,10 [ 9,40; 10,90] |
9,90 [ 9,70; 10,50] |
15,80 [ 15,60; 16,05] |
15,90 [ 15,65-16,10] |
76,50 [ 66,25; 86,00] |
73,00 [ 70,00; 84,50] |
|
12–15-е 12–15 |
229,00 [ 186,00; 296,00] |
206,00 [ 136,00; 240,00] |
0,24 [ 0,19; 0,29] |
0,21 [ 0,16; 0,28] |
10,10 [ 9,48; 10,73] |
10,10 [ 9,00; 10,70] |
16,00 [ 15,70; 16,30] |
16,20 [ 5,68-16,33] |
88,00 [ 70,75; 108,25] |
77,00 [ 67,00; 97,00] |
|
16–23-е 16–23 |
247,00 [ 192,00; 310,00] |
120,00 [ 96,00; 176,00]* |
0,26 [ 0,21; 0,31] |
0,13 [ 0,11; 0,20]* |
10,30 [ 9,20; 11,20] |
11,00 [ 10,80; 11,80]* |
16,10 [ 15,80; 16,40] |
16,50 [ 16,40; 16,60]* |
97,00 [ 80,00; 115,00] |
55,00 [ 42,00; 78,00]* |
|
24–72-е 24–72 |
249,00 [ 177,75; 291,50] |
239,50 [ 149,25; 302,75] |
0,25 [ 0,17; 0,33] |
0,25 [ 0,20; 0,29] |
10,30 [ 9,35; 11,10] |
11,40 [ 8,90; 12,70] |
15,90 [ 15,80; 16,40] |
16,40 [ 15,80; 16,70] |
90,00 [ 64,25; 119,50] |
85,00 [ 67,00; 103,00] |
|
Нормальные значения Normal range |
150–400 |
0,15–0,40 |
7,5–12,4 |
10–20 |
30–90 |
|||||
Примечание: *р < 0,05 – различия статистически значимы
по сравнению с контрольной группой.
Note: *p < 0.05 – significant differences compared to control group.
Количество тромбоцитов / Platelet count
При проведении корреляционного анализа установлено наличие слабой положительной связи между сутками заболевания и количеством тромбоцитов только в контрольной группе (r = 0,394; р < 0,001). При сравнительном анализе числа тромбоцитов каждые трое суток заболевания к 12–15-м суткам в основной группе выявлена тенденция к снижению числа тромбоцитов (р = 0,075); на 16–23-е сутки среднее количество тромбоцитов достигало значений, соответствующих тромбоцитопении, а к 24-м суткам заболевания отмечалось восстановление числа тромбоцитов (рис. 1).
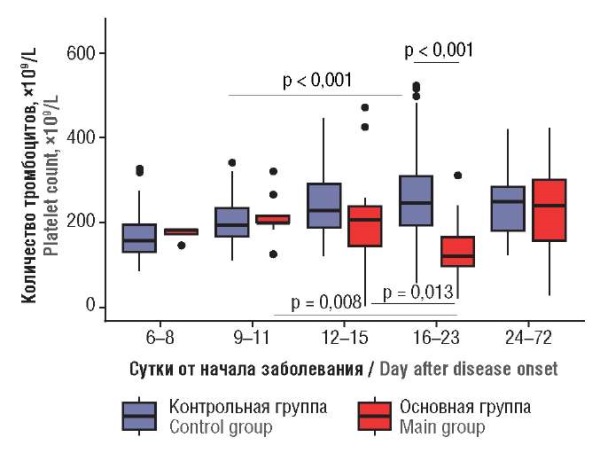
Рисунок 1. Динамика количества тромбоцитов
в зависимости от суток заболевания.
Figure 1. Dynamic change in platelet count
related to day after disease onset.
Тромбокрит / Plateletcrit
Изменение количества тромбоцитов в основной группе в зависимости от суток заболевания закономерно также отразилось и в показателе тромбокрита: установлена положительная корреляционая связь между показателем тромбокрита и сутками заболевания как в основной (r = 0,233; р = 0,034), так и в контрольной группе (r = 0,449; р < 0,001). У пациенток основной группы к 16–23-м суткам показатель тромбокрита достоверно снижался ниже уровня нормальной границы (р < 0,001), а на 24-е сутки восстанавливался до нормальных значений (рис. 2).
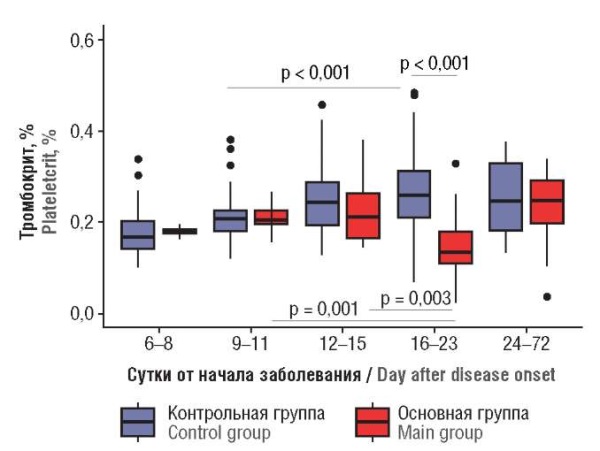
Рисунок 2. Динамика тромбокрита в зависимости от суток заболевания.
Figure 2. Platelecrit dynamics related to day after disease onset.
Средний объем тромбоцита / Mean platelet volume
При сравнении среднего объема тромбоцита в обеих группах выявлена тенденция к его увеличению к 16–23-м суткам заболевания при нормальном значении медианы только в основной группе пациенток (р = 0,002) (рис. 3). При проведении корреляционного анализа установлено наличие тенденции между увеличением среднего объема тромбоцита и сутками заболевания у пациенток основной группы (r = 0,208; р = 0,059).
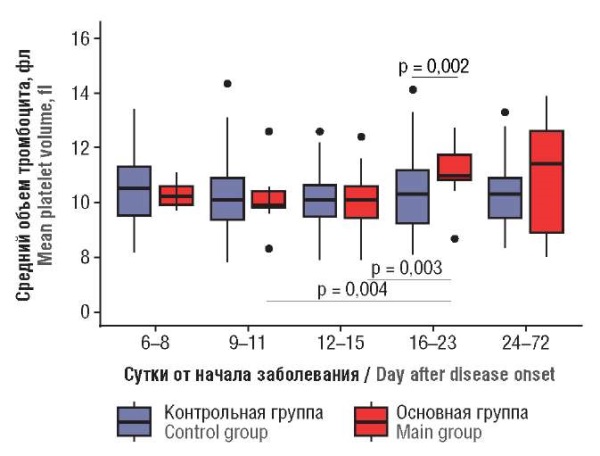
Рисунок 3. Динамика среднего объема тромбоцита
в зависимости от суток заболевания.
Figure 3. Dynamic change in mean platelet volume
related to day after disease onset.
Ширина распределения тромбоцитов по объему / Platelet volume distribution width
Ширина распределения тромбоцитов по объему (RDW) в нашем исследовании хоть и находилась в пределах нормальных значений, однако достоверно была больше в основной группе (р < 0,001). При анализе динамики RDW видно, что с увеличением суток заболевания отмечен ее рост в обеих группах, но в основной группе это увеличение было более выраженным и достигало максимума именно к 16–23-м суткам (рис. 4). При проведении корреляционного анализа установлено наличие положительной связи между RDW и сутками заболевания и в контрольной (r = 0,229; р < 0,001) и в основной группе (r = 0,284; р = 0,011).
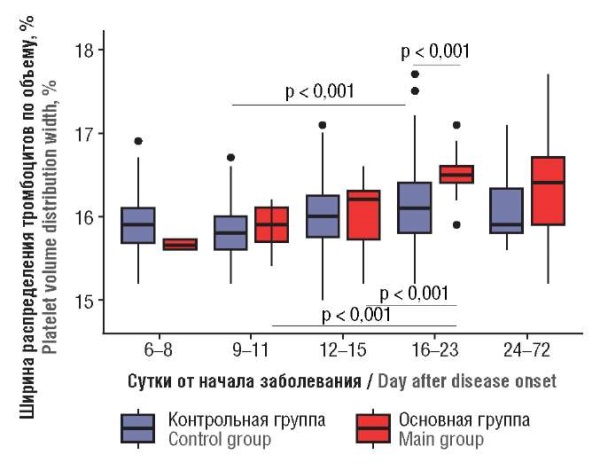
Рисунок 4. Динамика ширины распределения тромбоцитов по объему
в зависимости от суток заболевания.
Figure 4. Dynamic change in platelet volume distribution width
related to day after disease onset.
Число крупных тромбоцитов / Large platelet count
При сравнении абсолютного количества крупных тромбоцитов в контрольной группе пациенток отмечено большее их количество, чем у пациенток основной группы. При анализе динамики данного показателя в зависимости от суток заболевания выявлена следующая закономерность: в обеих группах отмечался рост числа крупных тромбоцитов, более выраженный в контрольной группе. В основной группе на 16–23-м сутки наблюдали резкое снижение количества крупных тромбоцитов, что соответствовало суткам тромбообразования (р < 0,001). Далее, к 24-м суткам число крупных тромбоцитов восстанавливалось, и прослеживалась тенденция к увеличению их количества относительно данных до момента развития тромбоза, а в контрольной группе подобных колебаний зафиксировано не было. При проведении корреляционного анализа выявлено наличие положительной связи количества крупных тромбоцитов с сутками заболевания в контрольной группе (r = 0,426; р < 0,001), а в основной группе отмечено лишь наличие тенденции к увеличению числа крупных тромбоцитов (r = 0,20; р < 0,07). В основной группе на 16–23-е сутки наблюдалось резкое снижение количества крупных тромбоцитов, что соответствовало суткам тромбообразования (рис. 5).
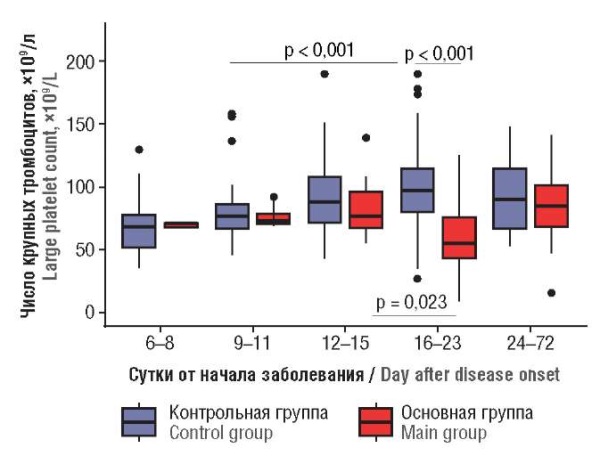
Рисунок 5. Динамика числа крупных тромбоцитов
в зависимости от суток заболевания.
Figure 5. Dynamic change in large platelet count
related to day after disease onset.
Обсуждение / Discussion
По нашему мнению, снижение общего количества тромбоцитов и тенденция к увеличению числа крупных тромбоцитов в группе пациенток с тромбозами является результатом развития тромботического процесса, в ходе которого тромбоциты расходуются на образование тромба, и признаком ответной активации мегакариоцитарного ростка, о чем свидетельствует наличие крупных незрелых форм тромбоцитов в периферической крови. Также, по мнению О.В. Петровой с соавт. (2014), данное явление, возможно, свидетельствует об усилении процессов тромбоцитопоэза в связи с их повышенным потреблением в ходе тромбообразования [18]. Данное предположение также подтверждает тот факт, что в нашем исследовании при проведении корреляционного анализа числа тромбоцитов с сутками заболевания в группе пациенток с тромбозами выявлена тенденция к снижению количества тромбоцитов к 12–15-м суткам болезни (р = 0,075), а на 16–23-и сутки, которые соответствуют суткам тромбообразования, была зафиксирована тромбоцитопения (р < 0,001). Однако существует еще несколько версий возможной причины развития тромбоцитопении. Академик А.Д. Макацария с соавт. (2021) в обзорной статье, посвященной тромботическому шторму на фоне COVID-19, рассматривают несколько возможных причин снижения количества тромбоцитов: в связи с гипоксией и окислительным стрессом происходит гиперактивация тромбоцитов и усиление процессов апоптоза [19]. Однако многие исследователи считают неуместным применение термина «апоптоз» к тромбоцитам, поскольку сам тромбоцит не имеет ядра и фактически является не клеткой, а лишь ее фрагментом. Е.О. Артеменко с соавт., рассматривая причины удаления тромбоцитов из циркулирующей крови, называют 2 основные причины – процесс физиологического обновления клеток крови и следствие процесса сверхактивации тромбоцитов, в ходе которого формируются особые прокоагулянтные тромбоциты, имеющие на своей поверхности фосфатидилсерин. Эти процессы имеют признаки программируемой клеточной гибели [20]. S.P ackson с соавт. утверждают, что тромбоциты, будучи безъядерными фрагментами клетки, подвергаясь программируемой клеточной гибели, претерпевают изменения, более характерные для некроза [21]. В качестве еще одной возможной причины развития тромбоцитопении академик А.Д. Макацария с соавт. рассматривают гепаринотерапию [19]. Известно, что с профилактической целью все пациентки получали низкомолекулярный гепарин (НМГ) для предотвращения тромботических осложнений, а при возникновении тромбозов дозировки увеличивались. Поэтому снижение уровня тромбоцитов могло быть обусловлено развитием гепарин-индуцированной тромбоцитопении.
Также существует предположение, что сам вирус может быть причиной развития тромбоцитопении, поскольку описаны механизмы проникновения РНК вируса гриппа в тромбоцит путем рецептор-опосредованного эндоцитоза, что влечет за собой активацию и программируемую клеточную гибель [22]. В ходе нашего исследования также было зафиксировано, что снижение уровня тромбоцитов было более выраженным у пациенток с наличием тромботических осложнений и более тяжелым течением инфекции. G. Lippi с соавт. (2020) при проведении метаанализа 9 исследований, посвященных тяжелому течению COVID-19, также пришли к выводу, что уменьшение количества тромбоцитов связано с повышенным риском тяжелого течения заболевания и повышением смертности пациентов с COVID-19 и, таким образом, должно служить клиническим индикатором ухудшения состояния во время госпитализации [23]. Еще в 2000 г. S. Vandershuren с соавт. [24] и в 2002 г. S. Akca с соавт. [25] описывали развитие тромбоцитопении у пациентов с тяжелым состоянием без короновирусной инфекции, находившихся на лечении в отделении реанимации и интенсивной терапии (ОРИТ). А индийские исследователи D. Khurana и S.A. Deoke (2017) вообще предлагают рассматривать тромбоцитопению как простой и доступный прогностический маркер неблагоприятных исходов для пациентов ОРИТ [26]. В Китае задолго до появления COVID-19 Z. Zou с соавт. (2004) рассматривали тромбоцитопению как маркер развития ДВС-синдрома и один из факторов развития тяжелого острого респираторного синдрома при тяжелом течении острых респираторных вирусных инфекций и даже разработали с учетом этих данных прогностическую математическую модель [27].
Изменение показателя тромбокрита, по нашему мнению, также как и изменение общего количества тромбоцитов свидетельствует о реактивном усилении процессов кроветворения, а наличие корреляций с сутками тромбообразования подтверждает эту гипотезу. Кроме увеличения числа крупных тромбоцитов, в группе пациенток с тромбозами также закономерно наблюдалась тенденция к увеличению показателя PDW к 16–23-м суткам болезни. Тенденция к увеличению PDW к 16-23 суткам была выявлена и в группе пациенток без тромбозов, однако в группе пациенток с тромбозами она была более выраженной. Данное явление, возможно, является маркером активации процесса тромбоцитопоэза и может быть объяснено выходом молодых форм тромбоцитов в периферическое кровеносное русло. Однако увеличение размера тромбоцитов может быть также признаком их функциональной активации. Е.А. Цикаленко с соавт. (2014) рассматривают появление крупных тромбоцитов при беременности как маркер активации тромбоцитарного гемостаза [28]. E. Güçlü с соавт. в своем исследовании, посвященном изменению тромбоцитарных индексов у пациентов с COVID-19, также рассматривают увеличение объема тромбоцитов и закономерное увеличение показателя PDW как маркер повышения функциональной активности тромбоцитов и активации процессов тромбоцитопоэза вследствие повышенного потребления тромбоцитов в процессе тромбообразования [29].
Заключение / Conclusion
Таким образом, при обращении внимания на время развития тромбоза отмечено, что основная масса пациенток к 16–23-м суткам уже имела тромботические осложнения. Начало развития тромбозов приходилось в основном на 12–15-е сутки заболевания COVID-19. Исходя из наших наблюдений, можно полагать, что в данном случае все же имела место тромбоцитопения потребления, развившаяся в результате тромботических осложнений, с последующим восстановлением количества тромбоцитов путем усиления процесса тромбоцитопоэза, о чем свидетельствуют изменения среднего диаметра тромбоцита и абсолютного количества крупных тромбоцитов в зависимости от суток заболевания. Кроме того, четко прослеживается зависимость динамики количественных и качественных показателей тромбоцитов в общеклиническом анализе крови от состояния пациенток и наличия осложнений, что может служить прогностическим критерием для оценки степени тяжести заболевания и риска развития тромботических осложнений.
Список литературы
1. Danzi G.B., Loffi M., Galeazzi G., Gherbesi E. Acute pulmonary embolism and COVID-19 pneumonia: a random association. Eur Heart J. 2020;41(19):1858. https://doi.org/1010.1093/eurheartj/ehaa254.
2. Helms J., Tacquard C., Severac F. et al.; CRICS TRIGGERSEP Group (Clinical Research in Intensive Care and Sepsis Trial Group for Global Evaluation and Rе search in Sepsis). High risk of thrombosis in patients with severe SARS-CoV-2 infection: a multicenter prospective cohort study. Intensive Care Med. 2020;46(6):1089–98. https://doi.org/10.1007/s00134-020-06062-x.
3. Klok F.A., Kruip M.J.H.A, van der Meer N.J.M. et al. Incidence of thrombotic complications in critically ill ICU patients with COVID-19. Thromb Res. 2020;191:145–7. https://doi.org/10.1016/j.thromres.2020.04.013.
4. Pazos M., Sperling R.S., Moran T.M., Kraus T.A. The influence of pregnancy on systemic immunity. Immunol Res. 2012;54(1–3);254–61. https://doi.org/10.1007/s12026-012-8303-9.
5. Kraus T.A., Engel S.M., Sperling R.S. et al. Characterizing the pregnancy immune phenotype: results of the Viral Immunity and Pregnancy (VIP) Study. J Clin Immunol. 2012;32(2):300–11. https://doi.org/10.1007/s10875-011-9627-2.
6. Jamieson D.J., Theiler R.N., Rasmussen S.A. Emerging infections and pregnancy. Emerg Infect Dis. 2006;12(11):1638–43. https://doi.org/10.3201/eid1211.060152.
7. Mor G., Cardenas I. The immune system in pregnancy: a unique complexity. Am J Reprod Immunol. 2010;63(6):425–33. https://doi.org/10.1111/j.1600-0897.2010.00836.x.
8. Sappenfield E., Jamieson D.J., Kourtis A.P. Pregnancy and susceptibility to infectious diseases. Infect Dis Obstet Gynecol. 2013;2013:752852. https://doi.org/10.1155/2013/752852.
9. Гончарова М.А., Петров Ю.А. Новая коронавирусная инфекция SARS-CoV-2: влияние на течение беременности. Главный врач Юга России. 2020;(4):27–31.
10. Адамян Л.В., Вечорко В.И., Конышева О.В., Харченко Э.И. Беременность и COVID-19: актуальные вопросы (обзор литературы). Проблемы репродукции. 2021;27(3):70–7. https://doi.org/10.17116/repro20212703170.
11. Wastnedge E.A.N., Reynolds R.M., van Boeckel S.R. et al. Pregnancy and COVID-19. Physiol Rev. 2021;101(1):303–18. https://doi.org/10.1152/physrev.00024.2020.
12. Subbaraman N. Pregnancy and COVID: what the data say. Nature. 2021;7849(591):193–5. https://doi.org/10.1038/d41586-021-00578-y.
13. Долгов В.В., Свирин П.В. Лабораторная диагностика нарушений гемостаза. М.–Тверь: ООО «Издательство «Триада», 2005. 227 с.
14. Шмаков Р.Г., Кирющенков П.А., Пырегов А.В. и др. Исследование системы гемостаза во время беременности и после родов. Краткий протокол. Акушерство и гинекология. 2015;(4):1–2.
15. Лелевич С.В. Клинико-лабораторные особенности периода беременности: учебно-методическое пособие для студентов лечебного, педиатрического факультетов и врачей. Гродно: ГрГМУ, 2010. 52 с. Режим доступа: http://www.grsmu.by/files/file/university/cafedry/klinicheskayaimmynologiya/files/ychebno-metod/2.pdf. [Дата обращения: 30.06.2023].
16. Ящук А.Г., Масленников А.В., Галимо Ш.Н. и др. Система гемостаза при беременности: признаки нормы и патологии. Уфа: ООО «Первая типография», 2018. 74 с.
17. Servante J., Swallow G., Thornton J.G. et al. Haemostatic and thromboembolic complications in pregnant women with COVID-19: a systematic review and critical analysis. BMC Pregnancy Childbirth. 2021;21(1):108. https://doi.org/10.1186/s12884-021-03568-0.
18. Петрова О.В., Шашин С.А., Тарасов Д.Г. Значение определения тромбоцитарных индексов у больных после коронарного шунтирования. Кардиология и сердечно-сосудистая хирургия. 2014;7(3):58–62.
19. Макацария А.Д., Слуханчук Е.В., Бицадзе В.О. и др. Тромботический шторм, нарушения гемостаза и тромбовоспаление в условиях COVID-19. Акушерство, Гинекология и Репродукция. 2021;15(5):499–514. https://doi.org/10.17749/2313-7347/ob.gyn.rep.2021.247.
20. Артеменко Е.О., Свешникова А.Н., Пантелеев М.А. Программируемая клеточная смерть тромбоцитов при их сверхактивации. Онкогематология. 2014;(3):63–6. https://doi.org/10.17650/1818-8346-2014-9-3-63-66.
21. Jackson S.P., Schoenwaelder S.M. Procoagulant platelets: are they necrotic? Blood. 2010;116(12):2011–8. https://doi.org/10.1182/blood-2010-01-261669.
22. Koupenova M., Freedman J.E. Platelets and immunity: going viral. Arterioscler Thromb Vasc Biol. 2020;40(7):1605–7. https://doi.org/10.1161/ATVBAHA.120.314620.
23. Lippi G., Plebani M., Henry B.M. Thrombocytopenia is associated with severe coronavirus disease 2019 (COVID-19) infections: A meta-analysis. Clin Chim Acta. 2020;506:145–8. https://doi.org/10.1016/j.cca.2020.03.022.
24. Vandershuren S., De Werdt A., Malbrain M. et al. Thrombocytopenia and prognosis in intensive care. Crit Care Med. 2020;28(6):1871–6. https://doi.org/10.1097/00003246-200006000-00031.
25. Akca S., Hadji-Michael P., de Mendonza A. et al. Time course of platelet count in critically ill patients. Crit Care Med. 2002;30(4):753–6. https://doi.org/10.1097/00003246-200204000-00005.
26. Khurana D., Deoke S.A. Thrombocytopenia in critically ill patients: clinical and laboratorial behavior and its correlation with short-term outcome during hospitalization. Indian J Crit Care Med. 2017;21(12):861–4. https://doi.org/10.4103/ijccm.IJCCM_279_17.
27. Zou Z., Yang Y., Chen J. et al. Prognostic factors for severe acute respiratory syndrome: a clinical analysis of 165 cases. Clin Infect Dis. 2004;38(4):483–9. https://doi.org/10.1086/380973.
28. Цикаленко Е.А., Дорн О.Ю., Степанова Е.Г. и др. Фракция больших тромбоцитов как маркер активации тромбоцитарного гемостаза при беременности. Медицина и образование в Сибири. 2014;(2):17.
29. Güçlü E., Kocayiğit H., Okan H.D. et al. Effect of COVID-19 on platelet count and its indices. Rev Assoc Med Bras (1992). 2020;66(8):1122–7. https://doi.org/10.1590/1806-9282.66.8.1122.
Об авторах
Н. В. СпиридоноваРоссия
Спиридонова Наталья Владимировна – д.м.н., профессор, зав. кафедрой акушерства и гинекологии Института последипломного образования
Scopus Author ID: 56089251400
443099 Самара, ул. Чапаевская, д. 89
Т. А. Гриценко
Россия
Гриценко Тарас Алексеевич – к.м.н., доцент кафедры госпитальной терапии с курсами поликлинической терапии и трансфузиологии
Scopus Author ID: 57190667679
443099 Самара, ул. Чапаевская, д. 89
Е. Ф. Хуртова
Россия
Хуртова Елена Федоровна – аспирант кафедры акушерства и гинекологии Института последипломного образования; врач акушер-гинеколог, врач ультразвуковой диагностики
443099 Самара, ул. Чапаевская, д. 89
443082 Самара, ул. Тухачевского, д. 88
Рецензия
Для цитирования:
Спиридонова Н.В., Гриценко Т.А., Хуртова Е.Ф. Характеристика тромбоцитов и тромбоцитарных индексов при COVID‑19 у беременных в зависимости от факта наличия тромбообразования. Акушерство, Гинекология и Репродукция. 2023;17(5):597-606. https://doi.org/10.17749/2313-7347/ob.gyn.rep.2023.429
For citation:
Spiridonova N.V., Gritsenko T.A., Khurtova E.F. Thrombogenesis-related characteristics of platelets and platelet indices in pregnant COVID-19 women. Obstetrics, Gynecology and Reproduction. 2023;17(5):597-606. (In Russ.) https://doi.org/10.17749/2313-7347/ob.gyn.rep.2023.429

Контент доступен под лицензией Creative Commons Attribution-NonCommercial-ShareAlike 4.0 International License.











































