Перейти к:
О перспективах применения лактобактериальных пробиотиков, D-маннозы и экстрактов клюквы в терапии инфекций мочевыводящих путей
https://doi.org/10.17749/2313-7347/ob.gyn.rep.2023.442
Аннотация
Для борьбы с инфекциями мочевыводящих путей (ИМП) чаще всего используются антибиотики. Принимая во внимание побочные эффекты антибиотикотерапии, существование штаммов уропатогенов, резистентных к антибиотикам, и низкую эффективность подавляющего большинства антибиотиков по отношению к бактериальным агломерациям (биоплёнкам), весьма актуален поиск альтернативных подходов к терапии ИМП. Одним из важных направлений этого поиска является использование нутрицевтиков – D-маннозы (предотвращает взаимодействие патогенных штаммов E. coli с уротелием, разрушает биоплёнки), лактобактерий (препятствуют образованию биоплёнок бактериальных патогенов, нормализуют микробиом человека, снижают воспаление) и стандартизированных экстрактов клюквы (нарушают адгезию уропатогенов, оказывают противовоспалительное действие). Результаты фундаментальных и клинических исследований указывают не только на высокую безопасность такого фармаконутрицевтического сопровождения терапии ИМП, но и на эффективность раздельного и сочетанного приёма этих нутрицевтиков, сопоставимую с эффективностью антибиотиков, особенно при лечении неосложнённых форм ИМП.
Ключевые слова
Для цитирования:
Громова О.А., Торшин И.Ю. О перспективах применения лактобактериальных пробиотиков, D-маннозы и экстрактов клюквы в терапии инфекций мочевыводящих путей. Акушерство, Гинекология и Репродукция. 2023;17(4):485-499. https://doi.org/10.17749/2313-7347/ob.gyn.rep.2023.442
For citation:
Gromova O.A., Torshin I.Yu. Regarding the prospects of using Lactobacillus-based probiotics, D-mannose and cranberry extracts in therapy of urinary tract infections. Obstetrics, Gynecology and Reproduction. 2023;17(4):485-499. (In Russ.) https://doi.org/10.17749/2313-7347/ob.gyn.rep.2023.442
Введение / Introduction
Инфекции мочевыводящих путей (ИМП) распространены у женщин всех возрастов; они могут варь- ировать от простого воспаления мочевого пузыря (цистита) до тяжелых случаев уросептического шока (при осложнениях ИМП). ИМП снижают качество жизни, а осложнения ИМП могут быть опасны для жизни женщин (в 40 % случаев осложнений) и мужчин (12 %). Особенно опасно развитие ИМП во время беременности вследствие неблагоприятного влияния на исходы беременности для матери (преэклампсия, анемия, сепсис и амнионит) и для новорожденного (низкая масса тела при рождении, преждевременные роды, мертворождение). Отрицательное влияние ИМП на исходы беременности происходит даже тогда, когда инфекция протекает бессимптомно [1].
Метаанализ 20 исследований (n = 5894), проведённых с 2008 по 2021 гг., выявил бессимптомные ИМП у 15 % беременных (95 % доверительный интервал (ДИ) = 13–17 %; p < 0,001). Пейзаж микрофлоры в моче беременных с ИМП был крайне неоднородным: в клинических изолятах мочи были найдены E. coli – 41 % (95 % ДИ = 38–45 %), не-коагулазные Staphylococci – 22 % (95 % ДИ = 18–26 %), Staphylococcus aureus – 15 % (95 % ДИ = 18–26 %), Staphylococcus saprophytic – 12 % (95 % ДИ = 6–18 %), Proteus mirabilis – 7 % (95 % ДИ = 4–10 %), Enterococcus – 6 % (95 % ДИ = 0–12 %), Pseudomonas aeruginosa – 4 % (95 % ДИ = 2–6 %), Citrobacter – 4% (95 % ДИ = 2–4 %), стрептококки группы В – 3 % (95 % ДИ = 1–5 %), Enterobacter – 2 % (95 % ДИ = 1–4 %). Доля множественной лекарственной устойчивости E. coli составила 83 % (95 % ДИ = 76–91 %), Klebsiella – 78 % (95 % ДИ = 66–90 %), Staphylococcus aureus – 89 % (95 % ДИ = 83–96 %) [2]. Таким образом, среди бактерий, ассоциированных с ИМП, наиболее частыми являются штаммы E. coli, характеризующиеся множественной лекарственной устойчивостью.
Лечение ИМП антибиотиками сталкивается с проб- лемой резистентности и побочных эффектов антибиотикотерапии. В анализе 18 клинических исследований женщин в перименопаузе, проведённых на мультиэтнических выборках пациенток с ИМП (n = 8765; 14 исследований проведены в США, по одному – в Испании, Германии, Израиле, Швейцарии), было показано, что ремиссия ИМП при лечении антибиотиком (офлоксацин) достигнута у 57 % женщин. В то же время частота проявления нежелательных эффектов была существенно выше и составила 83 % [3]. Проб- лема резистентности уропатогенов к антибиотикам и чересчур высокая частота нежелательных эффектов диктуют необходимость обратиться к поиску эффективных и безопасных методов терапии ИМП.
Для лечения ИМП актуальны исследования по использованию «не-антибиотиков» – пробиотиков, D-маннозы, экстрактов клюквы и др. Результаты систематического обзора (776 источников) и мета- анализа (6 плацебо-контролируемых исследований) мультиэтнической когорты (5 исследований – Италия, 1 исследование – США) показали, что использование D-маннозы в сравнении с другими препаратами для профилактики рецидивирующих ИМП у взрослых женщин эффективно и безопасно. Совокупный относительный риск рецидива ИМП при сравнении D-маннозы с профилактической антибиотикотерапией составил 0,39 (95 % ДИ = 0,12–1,25) [4].
По данным российских исследователей, бессимп- томная бактериурия отмечается у 1–5 % здоровых женщин пременопаузального возраста, у 10 % беременных и характеризуется таким же микробным спектром, как и при неосложненной и осложненной ИМП. Неосложненная ИМП (например, цистит) может развиваться у каждой третьей женщины к 24 годам. Микробный спектр при неосложненном бактериальном цистите или пиелонефрите одинаков и представлен E. coli (70–95 % случаев) и Staphylococcus saprophyticus (5–10 %), P. mirabilis и Klebsiella spp. (5–10 %) [5].
При терапии бактериальных ИМП антибиотиками часто забывают об одной интересной особенности многих бактерий – образование так называемых «бактериальных пленок» (англ. biofilms). Бактериальные пленки – агломеративные колонии бактерий, выживаемость которых чрезвычайно усилена за счет активной кооперации между отдельными бактериями (так называемой кворумной сигнализации). Биопленки играют важную роль в патогенезе ИМП [6]. Например, E. coli может образовывать относительно тонкую биопленку в течение 5 дней после возникновения ИМП [7]. Наличие биоплёнок при ИМП существенно снижает эффективность лечения [8], что также делает необходимым введение в терапию ИМП особых средств для торможения образования и роста биоплёнок.
В настоящей работе рассмотрены основы молекулярной биологии биоплёнок, возможность применения лактобактериальных пробиотиков для разрушения биоплёнок бактериальных уропатогенов, фундаментальные исследования D-маннозы при ИМП (включая воздействие на биоплёнки бактерий), клинические аспекты применения D-маннозы для лечения ИМП (включая сравнительные анализы показателей эффективности и безопасности терапии ИМП D-маннозой и антибиотиками), перспективы использования экстрактов клюквы в терапии ИМП и сочетанного применения лактобацилл, D-маннозы и экстрактов клюквы в клинической практике.
О молекулярной биологии бактериальных биоплёнок / Regarding the molecular biology of bacterial biofilms
Образование бактериальных агломератов – существенный фактор, который необходимо обязательно учитывать при терапии бактериальных ИМП. Биоплёнка – совокупность микроорганизмов, в которой бактерии взаимодействуют друг с другом и с поверхностью субстрата. Эти «слипшиеся» бактерии часто окружают себя так называемой «матрицей» внеклеточных полимерных веществ – агломератом, состоящим из внеклеточной ДНК, белков, полисахаридов – специальным «искусственным» субстратом, формирующимся в агрессивной среде существования [9]. Биоплёнки обнаруживаются не только при ИМП, но и при инфекциях среднего уха, гингивите, инфекциях при муковисцидозе [10], при инфицировании катетеров и контактных линз [11].
Образование биоплёнок – не просто необычная особенность биологии бактерий. Бактериальные пленки выживают при концентрациях перекиси водорода и молочной кислоты в 4–8 раз более высоких, чем выдерживают отдельные бактерии вне пленок [12]. Например, бактерии G. vaginalis более патогенны по сравнению с другими бактериями, вызывающими вагинозы, именно вследствие повышенной способности образовывать бактериальные пленки [13]. Даже при использовании сильнодействующих антибиотиков (метронизадол) кооперация бактерий в составе бактериальных пленок G. vaginalis способствует выживанию большей части патогенной флоры после антибиотикотерапии [14]. До 85 % бактериальных патогенов могут образовывать биоплёнки [15], которые осложняют терапию при эндокардите, вызывают инфекционные осложнения при трансплантации искусственных суставов и клапанов сердца [16]. Бактериальные пленки приводят к нарушению заживления ран и к опасным осложнениям ИМП [17].
Во время закрепления на субстрате бактерии испускают сигнальные молекулы, привлекающие новые бактерии в растущую биоплёнку. Сигнальные молекулы, испускаемые определёнными штаммами патогенов, являются частью системы кворумной сигнализации (англ. quorum sensing) – разновидности процесса координации поведения бактерий. У грамположительных бактерий специфическими сигнальными молекулами кворумной сигнализации являются олигопептиды, у грамотрицательных бактерий – N-ацилгомосерин лактоны. Сигнальные молекулы, известные как «аутоиндукторы» (например, аутоиндуктор-2, AI-2), встречаются и у грамотрицательных и у грамположительных бактерий. Помимо участия в бактериальной сигнализации, эти сигнальные молекулы могут активно подавлять иммунный ответ Т-лимфоцитов [18].
Важно отметить, что уропатогенные штаммы E. coli образуют биоплёнки и проявляют типичную устойчивость к повсеместно используемым антибиотикам – ампициллину, тетрациклину, пиперациллину, амоксициллину и котримоксазолу (рис. 1). Анализ штаммов E. coli, которые обнаруживаются при ИМП, показал, что формирование биоплёнок происходит в 85 % случаев [19].
Об использовании лактобактериальных пробиотиков для разрушения биоплёнок бактериальных уропатогенов / Regarding administration of Lactobacillus-based probiotics to destruct bacterial uropathogen biofilms
Описанные особенности кворумной сигнализации в биоплёнках указывают на то, что одним из наиболее эффективных способов борьбы с биоплёнками уропатогенов является использование бактерий-пробиотиков, которые содержат механизмы кворумной сигнализации и могут таким образом регулировать образование биоплёнок. В частности, лактобациллы внедряются в патогенные биоплёнки, вызывая их разрушение и гибель бактериальных патогенов [20][21]. По сравнению с антибиотиками, 6 штаммов Lactobacillus, включая L. paracasei, обладали меньшей антимикробной активностью в отношении чувствительных к антибиотикам E. coli, Proteus vulgaris и Enterococcus faecalis, но большей активностью в отношении устойчивых к антибиотикам штаммов тех же уропатогенов [22]. L. casei LC-11 и другие пробиотики ингибируют рост и образование биоплёнки Streptococcus mutans in vitro. В частности, штамм L. casei LC-11 ингибировал образование биоплёнок in vitro и также продемонстрировал максимальное удержание именно пробиотических штаммов лактобактерий в биоплёнках (p < 0,05) [23]. Таким образом, приём определённых штаммов лактобактериальных пробиотиков может принести дополнительную пользу пациенткам с рецидивирующими ИМП.
Следует отметить, что, помимо ингибирования биоплёнок при ИМП, лактобактериальные пробиотики проявляют и ряд других полезных эффектов. Например, приём Lactobacillus casei LC-11 и других пробиотических штаммов (Lactobacillus acidophilus LA-14, Lactococcus lactis LL-23, Bifidobacterium bifidum BB-06, Bifidobacterium lactis BL-4, суммарно 2×1010 КОЕ/сут) женщинами с избыточной массой тела (n = 32) положительно влиял на профиль кишечной микробиоты, снижая массу жира, уровни гликированного гемоглобина, фактора некроза опухоли альфа (англ. tumor necrosis factor alpha, TNF-α), интерлейкина-6 (англ. interleukin-6, IL-6) [24].
Прием Lactobacillus casei LC-11 в смеси с другими лактобактериальными и бифидобактериальными пробиотиками (109 КОЕ/г, 60 сут) снижал биомаркеры воспаления и улучшал окислительно-нитрозативный профиль у людей с ревматоидным артритом. По сравнению с контролем прием пробиотиков приводил к значительному снижению количества лейкоцитов (р = 0,012), уровней TNF-α (р = 0,004) и IL-6 (р = 0,039) в плазме крови. При приёме пробиотиков наблюдались более низкие уровни прооксидантных метаболитов оксида азота (р = 0,004) и более высокие уровни антиоксидантов (р = 0,019) [25].
Фундаментальные исследования D-маннозы при ИМП / Basic research of D-mannose in UTIs
D-манноза – эндогенный моносахарид, необходимый для N-гликозилирования почти одной трети протеома человека (в том числе иммуноглобулинов). Компьютерный анализ 33064 публикаций по D-маннозе указал на важность D-маннозы для гликозилирования белков протеома человека, поддержки функций не только мочевыводящей, но и сердечно-сосудистой, нервной, иммунной системы, в том числе для поддержания антибактериального и противовирусного иммунитета. Наиболее исследованным клиническим использованием D-маннозы является терапия ИМП. Блокируя взаимодействие бактерий с эндотелием, D-манноза предотвращает адсорбцию различных бактерий (уропатогенных штаммов Escherichia coli, Pseudomonas aeruginosa, шигелл, лейшманий, микобактерий и др.) на поверхности тканей, что способствует профилактике рецидивирующих ИМП [26]. Перспективными направлениями применения D-маннозы также являются снижение хронического воспаления и профилактика опухолевой патологии, особенно у женщин в менопаузе [27].
Кроме того, D-манноза может проявлять пребиотическое действие и тормозить рост бактериальных патогенов. Результаты сравнительного хемомикробиомного анализа D-маннозы, лактулозы, сорбита, ксилита и D-фруктозы (структурной основы инулина) позволили оценить эффекты этих молекул на рост 38 бактерий-комменсалов человека и на ингибирование роста 42 бактерий-патогенов. По сравнению с другими исследованными молекулами D-манноза в меньшей степени способствовала росту условно патогенных бактерий микробиома человека и в большей степени стимулировала рост Bifidobacterium longum и лактобактерий, продуцирующих масляную кислоту и другие короткоцепочечные жирные кислоты [28].
Для более полного понимания механизмов терапевтического действия D-маннозы при ИМП следует помнить, что у пациенток с ИМП кишечник колонизирован «уропатогенными», вирулентными штаммами E. coli. Такие штаммы E. coli могут колонизировать периуретральную область и подниматься вверх по мочевым путям. Для этого процесса важно свойство бактерий прикрепляться к поверхности мукозы уротелия, основанное на распознавании бактериями D-манноза-содержащих остатков в секрете мукозы. При биохимическом анализе мочи данное свойство количественно измеряется как D-маннозо-чувствительная гемагглютинация. Также прикрепление к эпителиальным клеткам мочевыводящих путей человека может зависеть от распознавания гликолипидов на основе глобосахаридов на поверхности эпителия и измеряться как устойчивая к D-маннозе гемагглютинация. Наличие таких адгезинов и определяет уропатогенность штаммов E. coli [29].
Анализ 73 штаммов E. coli от женщин с рецидивирующими ИМП показал, что 90 % уропатогенных штаммов продемонстрировали адгезию к эпителиальным клеткам. D-манноза полностью ингибировала адгезию 25 штаммов (42 %) и на 50 % ингибировала адгезию еще 11 штаммов (18 %) [30]. Таким образом, D-манноза-зависимая адгезия E. coli характерна для 60 % уропатогенных штаммов E. coli, что делает важным рассмотрение молекулярной биологии взаимодействия уропатогенных бактерий с D-маннозой.
Антибактериальное действие D-маннозы на уропатогенные штаммы E. coli связано, в первую очередь, именно с блокадой взаимодействия этих штаммов с уротелием. Блокада взаимодействия уропатогенов с эпителием осуществляется через прямые взаимодействия D-маннозы с фимбриями бактерий, также известными как «пили́» или «ворсинки». Фимбрии – нитевидные белковые структуры, расположенные на поверхности бактерий. Длина фимбрий варьирует от долей мкм (т. е. долей от размера бактерии) до 20 мкм (~20 размеров бактерий), а диаметр – от 2 до 11 нм (сопоставимо с диаметром глобулярных белков). Фимбрии осуществляют адгезию бактерий к различным поверхностям, в том числе к клеткам тканей и участвуют в формировании бактериальных биоплёнок. При колонизации эпителия бактериальные фимбрии и расположенные на них адгезины фактически «сканируют» поверхности на наличие доступных остатков D-манноза-содержащих полисахаридов. У 63 % пациенток с ИМП найдены E. coli с фимбриями 1-го типа (маннозо-чувствительная гемагглютинация), у 37 % пациенток – E. coli с фимбриями P-типа (маннозо- резистентная гемагглютинация) [19].
Уропатогенность штаммов E. coli определяется наличием в составе бактериального генома генов, кодирующих фимбриальные белки (FedF, FimH, csgA) [31] и гемагглютинин [32], гены кворумной сигнализации [33]. В частности, ген FimH кодирует белок-рецептор маннозы на оконечностях фимбрий (рис. 2).
Взаимодействия D-маннозы с фимбриальными белками уропатогенных штаммов носят высокоспе- цифичный характер. Фармакодинамические свойства D-маннозы для профилактики рецидивирующих ИМП оценивали посредством измерений антиадгезионной и антиинвазивной эффективности с использованием линии уротелиальных клеток TCC-5637. Значение IC50 (концентрация полумаксимального ингибирования) для антиадгезивной эффективности D-маннозы составило 0,51 мг/мл, а для антиинвазивной активности IC50 = 0,30 мг/мл, константа ингибирования D-маннозой роста биоплёнок составила 50 мг/мл. D-манноза ингибировала адгезию E. coli к уротелиальным клеткам при высоких концентрациях, тогда как ингибирование инвазии происходило при гораздо более низких концентрациях [34].
Клинические аспекты применения D-маннозы для лечения ИМП / Clinical aspects of D-mannose administered for UTIs treatment
Клинические исследования подтвердили высокую эффективность и безопасность использования D-маннозы и веществ-синергистов (антоцианины клюквы и др.) для терапии цистита и других ИМП [26]. Принимая во внимание изложенные выше результаты фундаментальных исследований, бактериальная адгезия к слизистой оболочке, опосредованная фимбриями бактерий (в частности, D-манноза-связывающими фимбриями типа 1 – ген FimH и др.), является важным условием для развития ИМП. Весьма низкие концентрации D-маннозы при ИМП (в среднем, менее 20 мкг/мл) [35] делают принципиально важным создать высокую концентрацию D-маннозы в моче для торможения взаимодействий уропатогенных штаммов с уротелием.
Систематический анализ 13 клинических исследований применения D-маннозы при ИМП (6 рандомизированных контролируемых, 1 рандомизированное перекрестное, 5 проспективных когортных, 1 ретроспективное когортное) показал, что эффекты D-маннозы при ИМП сравнивались с плацебо или с другими препаратами в 7 исследованиях. Показана эффективность D-маннозы в профилактике ИМП, в том числе рецидивирующих, сопоставимая с эффективностью антибиотиков. D-манноза хорошо переносится, сколько-нибудь серьёзные побочные эффекты не наблюдались (о диарее сообщили 8 % пациентов, получавших 2 г D-маннозы в течение, как минимум, 6 мес) [36].
Важно отметить, что новой разновидностью ИМП являются COVID-19-зависимые формы патологии. Как известно, коронавирус SARS-CoV-2 поражает не только легкие, а вызывает полиорганные поражения, в том числе с тяжелыми последствиями для яйцеклеток и мочеполовой системы в целом [37]. В частности, инфекция SARS-CoV-2 может стимулировать развитие ИМП, проявляющейся частыми сильными позывами к мочеиспусканию, дизурией, никтурией. Ковидные ИМП связаны не только с попаданием вирусных частиц в мочу, но и с повреждениями уротелия вследствие резкого повышения уровней провоспалительных цитокинов в крови, также попадающих в мочевой пузырь и в мочу. Симптомы ковид-ассоциированного цистита (КАЦ) развиваются на фоне полного отсутствия присутствия бактериальных возбудителей в моче. Поэтому для лечения КАЦ необходимо рекомендовать препараты или комбинации препаратов, обладающие многофакторным действием – диуретическим, противоспаечным, противовоспалительным и регулирующие местный иммунитет слизистой оболочки мочевого пузыря. D-манноза хорошо сочетается с такими комбинациями препаратов, поскольку практически не влияет на действие других препаратов и в то же время может оказывать санирующий эффект на мочеполовую систему при КАЦ [38].
Показатели эффективности и безопасности терапии ИМП в контролируемых исследованиях: сравнительные эффекты D-маннозы и антибиотиков / Efficacy and safety of UTIs therapy in controlled trials: comparative effects of D-mannose and antibiotics
Антибиотики являются эффективным способом лечения ИМП. Например, в метаанализе 12 исследований были получены оценки частоты микробиологического ответа и соответствующие 95 % ДИ для лечения нитрофурантоином и плацебо. Для пациентов с ИМП, получавших плацебо, общий микробиологический ответ (т. е. влияние на уровни бактерий) составил 34 % (95 % ДИ = 29–40 %); пациенты, получавшие нитрофурантоин (n = 934), достигли общего микробиологического ответа 77 % (95 % ДИ = 67–87 %) [39].
Показатели эффективности терапии ИМП (отношения шансов и/или другие показатели риска) существенно не отличаются для различных антибиотиков [40]. Например, в метаанализе, включившем результаты 27 исследований с участием 1700 пациентов с циститом, сравнивалась эффективность фосфомицина с другими антибиотиками [41]. Не было обнаружено различий между эффектами фосфомицина и препаратов сравнения в отношении микробиологического ответа: 83,8 % (95 % ДИ = 81,2–86,3 %) для фосфомицина, 80,9 % (95 % ДИ = 73,9–86,7 %) для нитрофурантоина и 83,7 % (95 % ДИ = 80,9–86,3 %) для других антибиотиков [41].
В систематическом обзоре 19 исследований (n = 3779) сравнивались клиническая и микробиологическая эффективность однократной дозы фосфомицина с другими схемами антибиотикотерапии. Частота микробиологического ответа составила 79 % (95 % ДИ = 76–81 %) для фосфомицина и 77 % (95 % ДИ = 72–82 %) для нитрофурантоина; средняя частота микробиологического ответа для других антибиотиков составила 82 % (95 % ДИ = 78–85 %). Частота клинического ответа (исчезновение симптомов ИМП) составила 78 % (95 % ДИ = 75–80 %) для фосфомицина и 79 % (95 % ДИ = 75–83 %) для нитрофурантоина; средняя частота клинического излечения для других антибиотиков составила 85 % (95 % ДИ = 81–88 %). Полученные результаты не показали существенных различий между показателями микробиологического и клинического ответа при использовании различных антибиотиков [42].
Пациентки с рецидивирующим ИМП (n = 308) получали антибиотикотерапию (1000 мг/сут ципрофлоксацина) в течение одной недели. Затем группа пациенток была рандомизирована на приём 2 г/сут D-маннозы, 50 мг/сут нитрофурантоина (одного из самых эффективных антибиотиков для терапии цистита) или плацебо в течение 6 мес. За это время рецидивы цистита были зарегистрированы у 32 % пациенток (рис. 3), причём частота рецидивов цистита была значительно выше в группе плацебо (60 %) по сравнению с группами, получавшими нитрофурантоин (20 %) или D-маннозу (15 %). Приём D-маннозы был связан с 4-кратным снижением риска рецидивов ИМП [43].
Анализ данных клинических исследований, проведённый в работе [44], показал сопоставимые частоты клинического ответа при лечении неосложнённых форм ИМП фосфомицином, нитрофурантоином, другими антибиотиками или D-маннозой (рис. 4). Напомним, что частота неосложнённых ИМП выше у молодых женщин [45].
Помимо оценки эффективности лечения ИМП, определяемой по частоте клинического/микробиологического ответа, продолжительность времени до улучшения симптомов также играет важную роль в повышении качества жизни пациенток. Для сравнения времени до улучшения симптомов при лечении D-маннозой и антибиотиками вычислялись среднесуточные баллы симптоматики ИМП, значения которых сравнивались между D-маннозой и различными антибиотиками. В результате, с точки зрения быстроты наступления клинического ответа, эффективность монотерапии D-маннозой или монотерапией тем или иным антибиотиком была сопоставима (рис. 5) [44].
На момент начала терапии значения нормализованных баллов симптоматики ИМП были сопоставимы в различных группах (50–55 %). На 3-й день во всех группах отмечалось отчетливое снижение симптоматики до 10–25 %, а через 7 дней нормализованный общий балл симптомов снизился до 0–12 %. В целом, при различных видах лечения была обнаружена четкая тенденция в отношении облегчения симптомов с течением времени. Нормализованная оценка симп- томов ИМП при монотерапии D-маннозой снизилась с 52 % в начале исследования до 5,6 % на 4-е сутки. В случае антибиотиков баллы снизились от 51 % в начале исследования до 8,2 % на 4-й день. Таким образом, динамика уменьшения симптомов ИМП была сходной при монотерапии D-маннозой и при антибиотикотерапии (рис. 4).
Приём D-маннозы снижает частоту рецидивирующих ИМП при хроническом воспалении уротелия (Cystitis cystica, CC) у женщин в постменопаузе (13 пациенток с СС, 14 пациенток без СС). До начала приёма D-маннозы у пациенток с СС отмечен более высокий уровень заболеваемости ИМП (4,69 рецидивов ИМП в год), чем у пациенток без СС (2,93 рецидивов/год; р = 0,021). На фоне регулярного приёма D-маннозы заболеваемость ИМП достоверно снизилась и у пациенток с СС (до 2,23 рецидивов/год; р = 0,0028) и у пациенток без СС (до 1,64 рецидивов/год; р = 0,0007) [46].
Сравнительная оценка безопасности применения D-маннозы и нитрофурантоина показала, что пациенты, получавшие D-маннозу длительно (2 г/сут, 6 мес), характеризовались в 3 раза более низким риском побочных эффектов (отношение шансов (ОШ) = 0,27; р = 0,0001). При этом единственным побочным эффектом применения D-маннозы являлась лёгкая диарея (8/130 пациентов, 7,8 %). В то же время побочные эффекты при применении нитрофурантоина наблюдались у 29/103 пациентов (27 %) и включали диарею (10 %), тошноту (5,8 %), ощущение жжения во влагалище (8,7 %), головную боль (2,9 %) и высыпания на коже (0,97 %) [43]. Таким образом, терапия ИМП D-маннозой не уступает по эффективности антибиотикотерапии и существенно выигрывает по безопасности.
Об использовании экстрактов клюквы в терапии ИМП / Regarding administration of cranberry extracts in UTIs treatment
Терапевтическое действие D-маннозы при цистите и других ИМП эффективно дополняется антоцианинами клюквы. Экстракты клюквы, стандартизированные по антоцианинам, содержат значительное количество проантоцианидинов А-типа, обладающих, подобно D-маннозе, антиадгезионной активностью по отношению к уропатогенным бактериям. Исследования in vitro и in vivo показали, что экстракты клюквы нарушают адгезию уропатогенов (таких, как кишечная палочка) к эпителиальным клеткам в мочевом пузыре, периуретральной области и кишечном тракте [47]. Проантоцианидины клюквы характеризуются антиадгезивной активностью против бактерий уже в концентрации 60 мкг/мл, в то время как, например, проантоцианидины винограда проявляют незначительную антиадгезивную активность даже при высоких концентрациях (~1200 мкг/мл). Таким образом, проантоцианидины А-типа в экстрактах клюквы проявляют специфическую антиадгезивную активность против уропатогенных бактерий [48].
Систематический обзор 7 клинических исследований D-маннозы у пациенток с ИМП/циститом показал, что по отдельности D-манноза назначалась только в 2 работах. В 5 исследованиях приём D-маннозы сочетался с приёмом других не-антибиотических компонентов – экстрактов клюквы, плодов лимонника, граната, лактобацилл и др. Во всех исследованиях сообщалось об уменьшении симптомов после лечения ИМП/цистита D-маннозой как при ее изолированном применении, так и в комбинации с другими действующими началами [49].
Метаанализ 7 рандомизированных плацебо-контролируемых исследований по использованию стандартизированных экстрактов клюквы у женщин (n = 1498) с неосложненными ИМП (цистит, пиурия, дизурия, бактериурия, пиелонефрит) показал, что стандартизированные экстракты клюквы снижают риск ИМП на 26 % (ОШ = 0,74; 95 % ДИ = 0,55–0,98) (рис. 6). Терапия стандартизированными экстрактами клюквы хорошо переносилась пациентками: частоты жалоб со стороны желудочно-кишечного тракта (изжога, лёгкая тошнота) были одинаковы в группах терапии и плацебо [50].
Комбинация D-маннозы, экстрактов клюквы и прополиса эффективна для профилактики рецидивов ИМП у женщин в перименопаузе (n = 150). Полная ремиссия симптомов ИМП наблюдалась у 60 % пациенток [51]. Метаанализ 23 исследований (n = 3979) показал, что потребление клюквы может значительно снизить заболеваемость ИМП (ОШ = 0,70; 95 % ДИ = 0,59–0,83; р < 0,01), в том числе у женщин с рецидивирующими ИМП снизить риск рецидивов на 32 % (ОШ = 0,68; 95 % ДИ = 0,56–0,81). Привлекательным фактором при лечении антоцианинами клюквы является практически полное отсутствие побочных эффектов и хорошая приверженность пациентов к лечению [52].
Сочетанное применение лактобацилл, D-маннозы и экстрактов клюквы клинически эффективно / A combined administration of Lactobacilli, D-mannose and cranberry extracts exerts clinical effectiveness
D-манноза ингибирует адгезию бактерий к уротелию, регенерирует гликозаминогликаны мочевого пузыря и поверхности слизистой оболочки после повреждения и отщепляет бактерии, уже прикрепившиеся к уротелию [53]. Комбинация экстракта клюквы, D-маннозы, пробиотиков L. plantarum и L. paracasei значительно снижала симптоматику острого цистита (n = 33): дизурию, частое мочеиспускание, сильные позывы к мочеиспусканию и рези внизу живота [54]. На основании этих данных можно предположить, что синергетическое действие лактобактериального пробиотика L. paracasei LC11, D-маннозы и клюквы может быть полезным для снижения риска рецидивирующих ИМП.
В клиническом исследовании женщин в пременопаузе с рецидивирующими неосложненными ИМП (средний возраст 39 лет; 95 % ДИ = 20–46 лет; n = 55) подтверждена перспективность перорального приёма комбинации Lactobacillus paracasei LC11, экстракта клюквы и D-маннозы (Lactoflorene® Цист) против ИМП [55]. Женщины были разделены на 3 группы: сначала лечили фосфомицином (3 г один раз в день в течение 2 дней) для устранения какой-либо основной инфекции (группа 1), затем принимали Lactoflorene® Цист один раз в день в течение 90 дней (группа 2), без лечения (группа 3; контроль). Рецидивы ИМП существенно чаще наблюдались в контрольной группе (группа 1 – 16 %, группа 2 – 15,5 %, контрольная группа – 53 %; р < 0,01). Респондентами считались женщины без эпизодов рецидива ИМП, частичными респондентами – не более одного эпизода рецидива ИМП за время наблюдения, нон-респондентами – более 2 рецидивов. Значительно более высокие доли респондентов отмечены в группе 1 (65,8 %) и в группе 2 (68,7 %) по сравнению с контролем (37 %). В то же время процент нон-респондентов был всего 16 % в группах 1 и 2 (контроль – 53 %). Нежелательных явлений у женщин, принимающих участие в исследовании, не зарегистрировано. Таким образом, профилактический приём пробиотического комплекса Lactoflorene® Цист был эффективным и безопасным при рецидивирующих неосложненных ИМП у женщин в пременопаузе [55].
Результаты исследования продемонстрировали, что пероральная профилактика ИМП комбинацией Lactobacillus paracasei LC11, экстракта клюквы и D-маннозы (Lactoflorene® Цист) безопасна и эффективна для снижения частоты рецидивов ИМП у женщин в пременопаузе [55]. Кроме того, первоначальное лечение антибиотиками с помощью фосфомицина может дополнительно помочь в снижении концентрации уропатогенов с последующим профилактическим приёмом Lactoflorene® Цист, который помогает поддерживать «положительную» биоплёнку, способствующей защите уротелия от уропатогенов.

Рисунок 1. Устойчивость к антибиотикам уропатогенных штаммов E. coli [19].
Figure 1. Antibiotic resistance of uropathogenic E. coli strains [19].
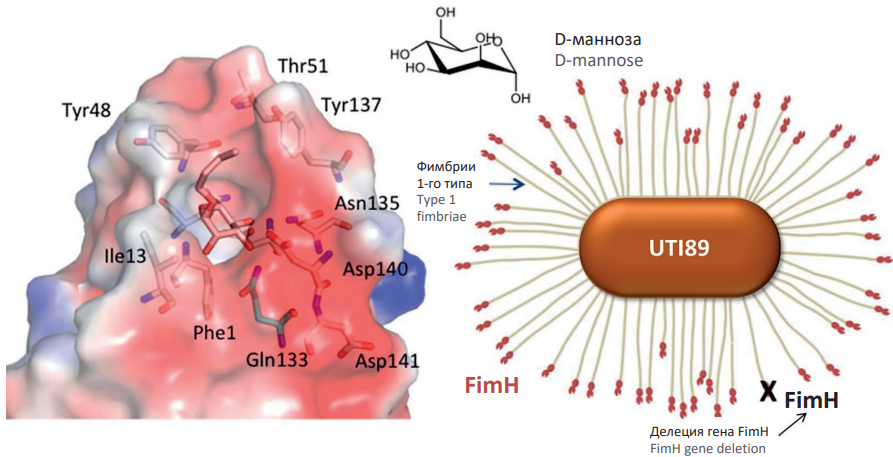
Рисунок 2. Пример D-манноза-связывающего бактериального белка, кодируемого геном FimH, в уропатогенных штаммах E. coli [рисунок авторов].
Figure 2. D-mannose-binding bacterial protein encoded by uropathogenic E. coli FimH gene [drawn by authors].
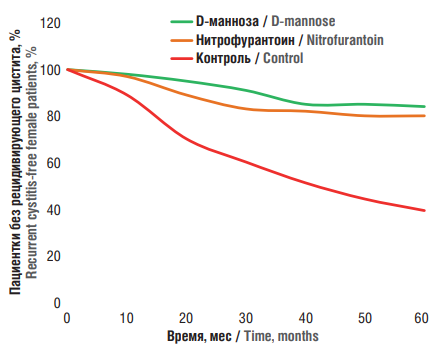
Рисунок 3. Характеристика рецидивов инфекций мочевыводящих путей в динамике лечения нитрофурантоином или D-маннозой [43].
Figure 3. Recurrence characteristics of urinary tract infections in the course of treatment with nitrofurantoin or D-mannose [43].
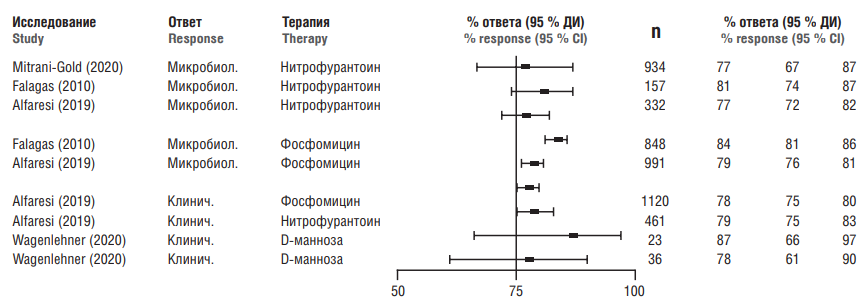
Рисунок 4. Сравнение частот клинического ответа пациенток с инфекций мочевыводящих путей, получавших нитрофурантоин, фосфомицин или D-маннозу [43–46].
Примечание: 95 % ДИ – 95 % доверительный интервал.
Figure 4. Comparison of clinical response rates in patients with urinary tract infection treated with nitrofurantoin, fosfomycin, or D-mannose [43–46].
Note: 95 % CI – 95 % confidence interval.
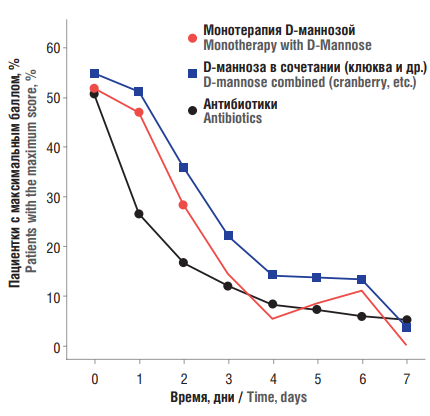
Рисунок 5. Динамика средней оценки симптомов инфекций мочевыводящих путей в течение одной недели у пациентов, получающих D-маннозу, по сравнению со средней оценкой симптомов у пациентов, получающих антибиотики [44].
Figure 5. A one-week time-dependent mean symptom scores of urinary tract infections in patients treated with D-mannose vs. antibiotics [44].

Рисунок 6. Метаанализ влияния стандартизированных экстрактов клюквы на профилактику инфекций мочевыводящих путей [50].
Примечание: ОШ – отношение шансов; 95 % ДИ – 95 % доверительный интервал.
Figure 6. Meta-analysis assessing standardized cranberry extracts for prevention of urinary tract infections [50].
Note: OR – odds ratio; 95 % CI – 95 % confidence interval.
Заключение / Conclusion
Цистит и другие ИМП вызываются уропатогенными штаммами E. coli и другими микроорганизмами. Антибиотикотерапия ИМП вызывает нежелательные побочные эффекты (гибель положительной микробиоты, развитие кандидоза, формирование устойчивых к антибиотикам патогенных штаммов бактерий и др.). Гигиенические меры и соблюдение режима мочеиспускания помогают защитить урогенитальный тракт от инфекций. Пребиотики, такие как клюква или D-манноза, ингибируют рецидивы цистита, предотвращая адгезию бактерий к эпителию мочевыводящих путей.
Профилактика ИМП эффективными и безопасными средствами (D-манноза, экстракты клюквы, стандартизированные по антоцианинам, пробиотики) – наилучшая врачебная стратегия. Блокируя взаимодействие фимбрий уропатогенных бактерий с уротелием, D-манноза и антоцианины клюквы предотвращают заселение мочеполового тракта патогенными бактериями. Клинические исследования подтвердили высокую эффективность и безопасность использования D-маннозы, антоцианинов клюквы, лактобактериальных антибиотиков для терапии и профилактики ИМП у женщин репродуктивного возраста. Комплексов, содержащих D-маннозу, достаточно много. Lactoflorene® Цист отличается уникальным составом и синергией действия компонентов, включающий D-маннозу (1000 мг), стандартизированный экстракт клюквы (126 мг, проантоцианидинов – 36 мг) и Lactobacillus paracasei LC11 (109 КОЕ).
Список литературы
1. Getaneh T., Negesse A., Dessie G. et al. Prevalence of urinary tract infection and its associated factors among pregnant women in Ethiopia: a systematic review and meta-analysis. Biomed Res Int. 2021;2021:6551526. https://doi.org/10.1155/2021/6551526.
2. Chelkeba L., Fanta K., Mulugeta T., Melaku T. Bacterial profile and antimicrobial resistance patterns of common bacteria among pregnant women with bacteriuria in Ethiopia: a systematic review and metaanalysis. Arch Gynecol Obstet. 2022;306(3):663–86. https://doi.org/10.1007/s00404-021-06365-4.
3. González-Garay A., Velasco-Hidalgo L., Ochoa-Hein E., Rivera-Luna R. Efficacy and safety of quinolones for the treatment of uncomplicated urinary tract infections in women: a network meta-analysis. Int Urogynecol J. 2021;32(1):3–15. https://doi.org/10.1007/s00192-020-04255-y.
4. Lenger S.M., Bradley M.S., Thomas D.A. et al. D-mannose vs other agents for recurrent urinary tract infection prevention in adult women: a systematic review and meta-analysis. Am J Obstet Gynecol. 2020;223(2):265.e1–265.e13. https://doi.org/10.1016/j.ajog.2020.05.048.
5. Зайцев А.В., Перепанова Т.С., Гвоздев М.Ю., Арефьева О.А. Инфекции мочевыводящих путей: методические рекомендации № 57. М.: АБВ-пресс, 2018. 26 с.
6. Delcaru C., Alexandru I., Podgoreanu P. et al. Microbial biofilms in urinary tract infections and prostatitis: etiology, pathogenicity, and combating strategies. Pathogens. 2016;5(4):65. https://doi.org/10.3390/pathogens5040065.
7. McMillan A., Dell M., Zellar M.P. et al. Disruption of urogenital biofilms by lactobacilli. Colloids Surf B Biointerfaces. 2011;86(1):58–64. https://doi.org/10.1016/j.colsurfb.2011.03.016.
8. Soto M. Importance of biofilms in urinary tract infections: new therapeutic approaches. Adv Biol. 2014;5:1–13. https://doi.org/10.1155/2014/543974.
9. Hall-Stoodley L., Costerton J.W., Stoodley P. Bacterial biofilms: from the natural environment to infectious diseases. Nat Rev Microbiol. 2004;2(2):95–108. https://doi.org/10.1038/nrmicro821.
10. Parsek M.R., Singh P.K. Bacterial biofilms: an emerging link to disease pathogenesis. Annu Rev Microbiol. 2003;57:677–701. https://doi.org/10.1146/annurev.micro.57.030502.090720.
11. Imamura Y., Chandra J., Mukherjee P.K. et al. Fusarium and Candida albicans biofilms on soft contact lenses: model development, influence of lens type, and susceptibility to lens care solutions. Antimicrob Agents Chemother. 2008;52(1):171–82. https://doi.org/10.1128/AAC.00387-07.
12. Patterson J.L., Girerd P.H., Karjane N.W., Jefferson K.K. Effect of biofilm phenotype on resistance of Gardnerella vaginalis to hydrogen peroxide and lactic acid. Am J Obstet Gynecol. 2007;197(2):170.e1–7. https://doi.org/10.1016/j.ajog.2007.02.027.
13. Patterson J.L., Stull-Lane A., Girerd P.H., Jefferson K.K. Analysis of adherence, biofilm formation and cytotoxicity suggests a greater virulence potential of Gardnerella vaginalis relative to other bacterial-vaginosisassociated anaerobes. Microbiology (Reading). 2010;156(Pt 2):392–9. https://doi.org/10.1099/mic.0.034280-0.
14. Swidsinski A., Mendling W., Loening-Baucke V. et al. An adherent Gardnerella vaginalis biofilm persists on the vaginal epithelium after standard therapy with oral metronidazole. Am J Obstet Gynecol. 2008;198(1):97.e1–6. https://doi.org/10.1016/j.ajog.2007.06.039.
15. Rogers A.H. Molecular oral microbiology. Caister Academic Press, 2008. 292 p. https://doi.org/10.21775/9781912530069.
16. Gondil V.S., Subhadra B. Biofilms and their role on diseases. BMC Microbiol. 2023;23(1):203. https://doi.org/10.1186/s12866-023-02954-2.
17. Garg S.S., Dubey R., Sharma S. et al. Biological macromolecules-based nanoformulation in improving wound healing and bacterial biofilmassociated infection: a review. Int J Biol Macromol. 2023;247:125636. https://doi.org/10.1016/j.ijbiomac.2023.125636.
18. Громова О.А., Торшин И.Ю. Микронутриенты и репродуктивное здоровье: руководство. M.: ГЭОТАР-Медиа, 2019. 672 с.
19. Tabasi M., Asadi Karam M.R., Habibi M. et al. Phenotypic assays to determine virulence factors of uropathogenic Escherichia coli (UPEC) isolates and their correlation with antibiotic resistance pattern. Osong Public Health Res Perspect. 2015;6(4):261–8. https://doi.org/10.1016/j.phrp.2015.08.002.
20. Komesu Y.M., Dinwiddie D.L., Richter H.E. et al.; Eunice Kennedy Shriver National Institute of Child Health and Human Development Pelvic Floor Disorders Network. Defining the relationship between vaginal and urinary microbiomes. Am J Obstet Gynecol. 2020;222(2):154.e1–154.e10. https://doi.org/10.1016/j.ajog.2019.08.011.
21. Murina F., Graziottin A., Felice R., Di Francesco S. Coital pain in the elderly: could a low dose estriol gel thrill the vulvar vestibule? Eur J Obstet Gynecol Reprod Biol. 2016;207:121–4. https://doi.org/10.1016/j.ejogrb.2016.10.016.
22. Shim Y.H., Lee S.J., Lee J.W. Antimicrobial activity of lactobacillus strains against uropathogens. Pediatr Int. 2016;58(10):1009–13. https://doi.org/10.1111/ped.12949.
23. Schwendicke F., Korte F., Dörfer C.E. et al. Inhibition of Streptococcus mutans growth and biofilm formation by probiotics in vitro. Caries Res. 2017;51(2):87–95. https://doi.org/10.1159/000452960.
24. Gomes A.C., Hoffmann C., Mota J.F. Gut microbiota is associated with adiposity markers and probiotics may impact specific genera. Eur J Nutr. 2020;59(4):1751–62. https://doi.org/10.1007/s00394-019-02034-0.
25. Cannarella L.A.T., Mari N.L., Alcântara C.C. et al. Mixture of probiotics reduces inflammatory biomarkers and improves the oxidative/nitrosative profile in people with rheumatoid arthritis. Nutrition. 2021;89:111282. https://doi.org/10.1016/j.nut.2021.111282.
26. Громова О.А., Торшин И.Ю., Тетруашвили Н.К. Систематический анализ исследований по D-маннозе и перспективы ее применения при рецидивирующих инфекциях мочеполовых путей у женщин репродуктивного возраста. Акушерство, Гинекология и Репродукция. 2019;13(2):119–31. https://doi.org/10.17749/2313-7347.2019.13.2.119-131.
27. Торшин И.Ю., Аполихина И.А., Громов А.Н., Громова О.А. Свойства D-маннозы: противовоспалительный и противоопухолевый эффекты. Экспериментальная и клиническая урология. 2020;(2):164–70. https://doi.org/10.29188/2222-8543-2020-12-2-164-170.
28. Торшин И.Ю., Галустян А.Н., Иванова М.И. и др. Хемомикробиомный анализ синергизма D-маннозы и D-фруктозы в сравнении с другими метабиотиками. Эффективная фармакотерапия. 2020;16(20):22–31. https://doi.org/10.33978/2307-3586-2020-16-20-22-31.
29. Eden C.S., Hagberg L., Hanson L.A. et al. Adhesion of Escherichia coli in urinary tract infection. Ciba Found Symp. 1981;80:161–87. https://doi.org/10.1002/9780470720639.ch11.
30. Schaeffer A.J., Chmiel J.S., Duncan J.L., Falkowski W.S. Mannosesensitive adherence of Escherichia coli to epithelial cells from women with recurrent urinary tract infections. J Urol. 1984;131(5):906–10. https://doi.org/10.1016/s0022-5347(17)50706-5.
31. Agata N., Ohta M., Miyazawa H. et al. Serological response to P-fimbriae of Escherichia coli in patients with urinary tract infections. Eur J Clin Microbiol Infect Dis. 1989;8(2):156–9. https://doi.org/10.1007/BF01963903.
32. Nowicki B., Svanborg-Eden C., Hull R., Hull S. Molecular analysis and epidemiology of the Dr hemagglutinin of uropathogenic Escherichia coli. Infect Immun. 1989;57(2):446–51. https://doi.org/10.1128/iai.57.2.446-451.1989.
33. Cordeiro M.A., Werle C.H., Milanez G.P., Yano T. Curli fimbria: an Escherichia coli adhesin associated with human cystitis. Braz J Microbiol. 2016;47(2):414–6. https://doi.org/10.1016/j.bjm.2016.01.024.
34. Pani A., Valeria L., Dugnani S. et al. Pharmacodynamics of D-mannose in the prevention of recurrent urinary infections. J Chemother. 2022;34(7):459–64. https://doi.org/10.1080/1120009X.2022.2061184.
35. Toyota S., Fukushi Y., Katoh S. et al. Anti-bacterial defense mechanism of the urinary bladder. Role of mannose in urine. Nihon Hinyokika Gakkai Zasshi. 1989;80(12):1816–23. (In Japanese). https://doi.org/10.5980/jpnjurol1989.80.1816.
36. De Nunzio C., Bartoletti R., Tubaro A. et al. Role of D-mannose in the prevention of recurrent uncomplicated cystitis: state of the art and future perspectives. Antibiotics. 2021;10(4):373. https://doi.org/10.3390/antibiotics10040373.
37. Торшин И.Ю., Громова О.А. Под ред. А.Г. Чучалина А.Г. Микронутриенты против коронавирусов. Вчера, сегодня, завтра. M.: ГЭОТАРМедиа, 2023. 448 с.
38. Берников А.Н., Куприянов Ю.А., Строганов Р.В. и др. Симптомы нижних мочевыводящих путей и COVID-19. Урология. 2021;(5):78–83. https://doi.org/10.18565/urology.2021.5.78-83.
39. Mitrani-Gold F.S., Raychaudhuri A., Rao S. Systematic review and metaanalysis to estimate the antibacterial treatment effect of nitrofurantoin for a non-inferiority trial in uncomplicated urinary tract infection. J Glob Antimicrob Resist. 2020;22:68–77. https://doi.org/10.1016/j.jgar.2020.01.027.
40. Agresti A., Caffo B. Simple and effective confidence Intervals for proportions and differences of proportions result from adding two successes and two failures. Am Stat. 2000;54(4):280–8.
41. Falagas M.E., Vouloumanou E.K., Togias A.G. et al. Fosfomycin versus other antibiotics for the treatment of cystitis: a meta-analysis of randomized controlled trials. J Antimicrob Chemother. 2010;65(9):1862–77. https://doi.org/10.1093/jac/dkq237.
42. Alfaresi M., Hassan K., Alnjadat R.M.H. Single-dose Fosfomycin trometamol versus other antimicrobial regimens for treatment of uncomplicated lower urinary tract infection: a systematic review and meta-analysis. Open Microbiol J. 2019;13(1):193–9. https://doi.org/10.2174/1874285801913010193.
43. Kranjcec B., Papes D., Altarac S. D-mannose powder for prophylaxis of recurrent urinary tract infections in women: a randomized clinical trial. World J Urol. 2014;32(1):79–84. https://doi.org/10.1007/s00345-013-1091-6.
44. Wagenlehner F., Lorenz H., Ewald O., Gerke P. Why D-mannose may be as efficient as antibiotics in the treatment of acute uncomplicated lower urinary tract infections-preliminary considerations and conclusions from a non-interventional study. Antibiotics. 2022;11(3):314. https://doi.org/10.3390/antibiotics11030314.
45. Kaur R., Kaur R. Symptoms, risk factors, diagnosis and treatment of urinary tract infections. Postgrad Med J. 2021;97(1154):803–12. https://doi.org/10.1136/postgradmedj-2020-139090.
46. Chiu K., Zhang F., Sutcliffe S. et al. Recurrent urinary tract infection incidence rates decrease in women with cystitis cystica after treatment with D-mannose: a cohort study. Female Pelvic Med Reconstr Surg. 2022;28(3):e62–e65. https://doi.org/10.1097/SPV.0000000000001144.
47. Harmidy K., Tufenkji N., Gruenheid S. Perturbation of host cell cytoskeleton by cranberry proanthocyanidins and their effect on enteric infections. PLoS One. 2011;6(11):e27267. https://doi.org/10.1371/journal.pone.0027267.
48. Howell A.B., Reed J.D., Krueger C.G. et al. A-type cranberry proanthocyanidins and uropathogenic bacterial anti-adhesion activity. Phytochemistry. 2005;66(18):2281–91. https://doi.org/10.1016/j.phytochem.2005.05.022.
49. Parazzini F., Ricci E., Fedele F. et al. Systematic review of the effect of D-mannose with or without other drugs in the treatment of symptoms of urinary tract infections/cystitis (Review). Biomed Rep. 2022;17(2):69. https://doi.org/10.3892/br.2022.1552.
50. Fu Z., Liska D., Talan D., Chung M. Cranberry reduces the risk of urinary tract infection recurrence in otherwise healthy women: a systematic review and meta-analysis. J Nutr. 2017;147(12):2282–8. https://doi.org/10.3945/jn.117.254961.
51. DE Leo V., Cappelli V., Massaro M.G. et al. Evaluation of the effects of a natural dietary supplement with cranberry, Noxamicina® and D-mannose in recurrent urinary infections in perimenopausal women. Minerva Ginecol. 2017;69(4):336–41. (In Italian). https://doi.org/10.23736/S0026-4784.17.04074-6.
52. Xia J.Y., Yang C., Xu D.F. et al. Consumption of cranberry as adjuvant therapy for urinary tract infections in susceptible populations: a systematic review and meta-analysis with trial sequential analysis. PLoS One. 2021;16(9):e0256992. https://doi.org/10.1371/journal.pone.0256992.
53. Raditic D.M. Complementary and integrative therapies for lower urinary tract diseases. Vet Clin North Am Small Anim Pract. 2015;45(4):857–78. https://doi.org/10.1016/j.cvsm.2015.02.009.
54. Vicariotto F. Effectiveness of an association of a cranberry dry extract, D-mannose, and the two microorganisms Lactobacillus plantarum LP01 and Lactobacillus paracasei LPC09 in women affected by cystitis: a pilot study. J Clin Gastroenterol. 2014;48 Suppl 1:S96–101. https://doi.org/10.1097/MCG.0000000000000224.
55. Murina F., Vicariotto F., Lubrano C. Efficacy of an orally administered combination of Lactobacillus paracasei LC11, cranberry and D-mannose for the prevention of uncomplicated, recurrent urinary tract infections in women. Urologia. 2021;88(1):64–68. https://doi.org/10.1177/0391560320957483.
Об авторах
О. А. ГромоваРоссия
Громова Ольга Алексеевна – д.м.н., профессор, ведущий научный сотрудник
119333 Москва, ул. Вавилова, д. 44, корп. 2
И. Ю. Торшин
Россия
Торшин Иван Юрьевич – к.ф-м.н., к.х.н., старший научный сотрудник
Scopus Author ID: 7003300274.
Author ID: 54104
WOS ID: C-7683-2018
119333 Москва, ул. Вавилова, д. 44, корп. 2
Рецензия
Для цитирования:
Громова О.А., Торшин И.Ю. О перспективах применения лактобактериальных пробиотиков, D-маннозы и экстрактов клюквы в терапии инфекций мочевыводящих путей. Акушерство, Гинекология и Репродукция. 2023;17(4):485-499. https://doi.org/10.17749/2313-7347/ob.gyn.rep.2023.442
For citation:
Gromova O.A., Torshin I.Yu. Regarding the prospects of using Lactobacillus-based probiotics, D-mannose and cranberry extracts in therapy of urinary tract infections. Obstetrics, Gynecology and Reproduction. 2023;17(4):485-499. (In Russ.) https://doi.org/10.17749/2313-7347/ob.gyn.rep.2023.442

Контент доступен под лицензией Creative Commons Attribution-NonCommercial-ShareAlike 4.0 International License.











































