Перейти к:
Гомоцистеин, рак и онкотромбозы
https://doi.org/10.17749/2313-7347/ob.gyn.rep.2023.431
Аннотация
Введение. Гипергомоцистеинемия (ГГЦ) является одним из звеньев патогенеза тромботических осложнений у онкогинекологических пациенток.
Цель: оценка вклада ГГЦ в развитие тромботических осложнений у пациенток со злокачественными новообразованиями женских половых органов и молочной железы.
Материалы и методы. Выполнена ретроспективная оценка данных 236 пациенток: с опухолями яичников (n = 63), раком шейки матки (n = 51), опухолями молочных желез (n = 64), злокачественными новообразованиями тела матки (n = 58). Контрольную группу составили 50 женщин без злокачественных новообразований. Проведен анализ концентрации гомоцистеина (ГЦ), частоты полиморфизмов генов ферментов фолатного цикла MTHFR C677T, MTHFR A1298C, MTRR A66G, MTR A2756G, частоты тромботических осложнений. Проведена оценка риска тромботических осложнений в зависимости от концентрации ГЦ в крови.
Результаты. Концентрация ГЦ в плазме крови составила ≥ 22 мкмоль/л у 30,5 % пациенток. Тромботические осложнения в течение 1 года после выписки из стационара развились у 15,3 %. Риск тромботических осложнений оказался выше у пациенток с высоким уровнем ГЦ (≥ 22 мкмоль/л) в плазме крови (отношение шансов = 2,99; 95 % доверительный интервал = 1,11–8,08). Достоверного увеличения частоты встречаемости полиморфизмов генов ферментов фолатного цикла среди онкогинекологических пациенток выявлено не было.
Заключение. Мониторинг содержания ГЦ у онкогинекологических пациенток вносит свой вклад в прогнозирование вероятности тромботических осложнений. Назначение препаратов, снижающих уровень ГЦ (фолиевая кислота), и проведение мониторинга его концентрации у онкогинекологических пациенток на фоне терапии, в том числе и химиотерапии, потенциально способно снизить частоту развития тромботических осложнений.
Ключевые слова
Для цитирования:
Бицадзе В.О., Слуханчук Е.В., Солопова А.Г., Хизроева Д.Х., Щербаков Д.В., Якубова Ф.Э., Гри Ж., Элалами И., Дегтярева Н.Д., Лазарчук А.В., Гилева М.А., Самбурова Н.В., Асланова З.Д., Блинов Д.В., Шкода А.С., Макацария А.Д. Гомоцистеин, рак и онкотромбозы. Акушерство, Гинекология и Репродукция. 2023;17(4):390-401. https://doi.org/10.17749/2313-7347/ob.gyn.rep.2023.431
For citation:
Bitsadze V.O., Slukhanchuk E.V., Solopova A.G., Khizroeva J.Kh., Shcherbakov D.V., Yakubova F.E., Gris J., Elalamy I., Degtyareva N.D., Lazarchuk A.V., Gileva M.A., Samburova N.V., Aslanova Z.D., Blinov D.V., Shkoda A.S., Makatsariya A.D. Homocysteine, cancer and oncothrombosis. Obstetrics, Gynecology and Reproduction. 2023;17(4):390-401. (In Russ.) https://doi.org/10.17749/2313-7347/ob.gyn.rep.2023.431
Введение / Introduction
Венозный тромбоз и злокачественный процесс неразделимы. Тромбоз у онкологических пациентов является важным предиктором плохого прогноза. Венозная тромбоэмболия (ВТЭ) развивается примерно у 8 % пациентов со злокачественными новообразованиями [1]. На риск тромботических осложнений при раке оказывают влияние различные факторы, в частности, источник опухоли, например, колоректальный рак имеет больший риск тромбоза, чем другие опухоли [2].
Гипергомоцистеинемия (ГГЦ) характеризуется повышением концентрации гомоцистеина (ГЦ) в плазме крови, которая в плазме крови здоровых людей составляет 5–15 мкмоль/л; при ГГЦ она может достигать 500 мкмоль/л. Значение ГГЦ доказано в патогенезе нейродегенеративных (деменция, болезнь Паркинсона, болезнь Альцгеймера) и сердечно-сосудистых заболеваний, сахарного диабета [3][4], мегалобластной анемии, арахнодактилии [5] и др.
Многочисленные исследования проведены и ведутся в настоящее время для подтверждения связи между ГГЦ и раком. И тому есть ряд предпосылок. Во-первых, у онкологических пациентов наблюдается более высокий уровень ГЦ в плазме крови при ВТЭ, которая является второй по частоте причиной смерти. Во-вторых, некоторые полиморфизмы генов ферментов – участников путей детоксикации ГЦ (транссульфирование и реметилирование) чаще встречаются при определенных опухолях [6]. ГЦ также был предложен в качестве потенциального биомаркера опухолевого роста для различных видов рака [7].
Цель: оценка вклада ГГЦ в развитие тромботических осложнений у пациенток со злокачественными новообразованиями женских половых органов и молочной железы.
Материалы и методы / Materials and Мethods
Дизайн исследования / Study design
Проведено ретроспективное исследование архивного материала – результатов обследования 608 пациенток с новообразованиями женских половых органов и молочных желез I–IV стадий, госпитализированных с 2016 по 2020 гг. в ГБУЗ ГКОБ № 1 ДЗМ. Во время госпитализации у пациенток проводили отбор проб крови для определения маркеров наследственной и приобретенной тромбофилии, оценки состояния системы гемостаза, уровня ГЦ; все данные были внесены в общую базу. Для проведения данного исследования использованы данные из базы, а также данные амбулаторных карт пациенток в течение 1 года после выписки из стационара. Контрольная группа была сформирована из условно здоровых сотрудниц базы проводимого исследования.
Критерии включения и исключения / Inclusion and exclusion criteria
Критерии включения: возраст 18 и старше; диагноз онкологического заболевания (злокачественные новообразования яичников, шейки матки, тела матки и молочных желез I–IV стадий) по данным медицинской документации; наличие информации о состоянии здоровья в течение 1 года после выписки из стационара по данным амбулаторной карты.
Критерии включения (контрольная группа): возраст 18 и старше; отсутствие тромбозов и тромбоэмболий, онкологических, хронических воспалительных заболеваний в анамнезе.
Критерии исключения: возраст до 18 лет; активный инфекционный и/или воспалительный процесс на момент обследования по данным медицинской документации; декомпенсированный сахарный диа- бет; тяжелые сердечно-сосудистые заболевания; обострение хронических заболеваний почек и печени; наличие других сопутствующих онкологических заболеваний; тромбоцитопатии и коагулопатии; тромбоэмболические осложнения и прием антикоагулянтов и антиагрегантов; тромботический или геморрагический синдром; отсутствие данных о здоровье в течение 1 года после выписки из стационара в амбулаторной карте.
Группы обследованных / Patients groups
В исследование вошли 236 пациенток: 63 с опухолями яичников (группа 1), 51 с раком шейки матки (группа 2), 64 с опухолями молочных желез (группа 3), 58 со злокачественными новообразованиями тела матки (группа 4). Контрольную группу составили 50 женщин (рис. 1).
Методы исследования / Study methods
Оценивали следующие характеристики: возраст, индекс массы тела (ИМТ), источник опухоли, стадия заболевания на момент отбора крови, подтвержденный факт развития тромботического осложнения в динамике в течение 1 года.
Были проанализированы следующие лабораторные показатели: концентрация ГЦ плазмы крови, наличие или отсутствие полиморфизмов генов ферментов фолатного цикла – полиморфизмы С677Т и A1298C гена метилентетрагидрофолатредуктазы (англ. methy-lenetetrahydrofolatereductase, MTHFR), полиморфизм A2756G гена 5-метилтетрагидрофолат-гомоцистеин метилтрансферазы (англ. 5-methyltetrahydrofolate-homocysteine methyltransferase, MTR) и полиморфизм A66G гена 5-метилтетрагидрофолат-гомоцистеин метилредуктазы (англ. 5-methyltetrahydrofolate-homocysteine methyltransferase reductase, MTRR).
Отбор проб крови / Blood sampling
При поступлении в стационар однократно у всех пациенток путем венепункции получали образцы плазмы, которые хранились после центрифугирования при температуре –80° С. Отбор крови натощак проводился сухой стерильной иглой из локтевой вены в пробирку с 3,8 % раствором трехзамещенного цитрата натрия в соотношении 9:1. У женщин контрольной группы образцы плазмы отбирали однократно при проведении профилактического ежегодного осмотра.
Оценка содержания гомоцистеина / Assessing homocysteine level
Определение общего L-гомоцистеина в плазме крови проводили с помощью набора Axis® Homocysteine Enzyme Immunoassay (TECAN, Швейцария) методом конкурентного иммуноферментного анализа. Нормальное содержание ГЦ в плазме крови (у мужчин и женщин) составляет 5–15 мкмоль/л. Легкой степенью ГГЦ принято считать уровень ГЦ в 15–30 мкмоль/л, средней степенью – 31–100 мкмоль/л, тяжелой – более 100 мкмоль/л. В исследовании границей между группами был выбран показатель 22 мкмоль/л (среднее значение диапазона легкой степени ГГЦ).
Оценка полиморфизмов генов фолатного цикла / Assessing of folate cycle gene polymorphisms
В выделенной ДНК из плазмы крови обследованных участниц с помощью набора праймеров и рес- триктаз производства ООО «Центр молекулярной генетики» (Россия) амплифицированы полиморфные локусы методом полимеразной цепной реакции, далее проведен с помощью специфических эндонуклеаз рестрикционный анализ с использованием стандартного оборудования молекулярно-биологической лаборатории для проведения полимеразной цепной реакции. Продукты амплификации и рестрикции проанализированы путем электрофореза в 3 %-м агарозном геле с окрашиванием бромистым этидием. Оценена частота следующих полиморфизмов фолатного цикла: MTHFR C677T, MTHFR A1298C, MTRR A66G, MTR A2756G.
Этические аспекты / Ethical aspects
Все процедуры, выполненные в данном исследовании, соответствовали этическим стандартам Хельсинской декларации 1964 г., ее последующим изменениям и сопоставимым нормам этики. В связи с ретроспективным характером исследования в его рамках оценивались обезличенные данные участниц исследования.
Статистический анализ / Statistical analysis
Для проведения статистического анализа использовано программное обеспечение Statistica 7.0 (StatSoft, Inc., США). Анализ проводился с приведением среднеквадратического отклонения (SD), средней арифметической (M), минимальных и максимальных значений показателей. Нормальность распределения изучена с помощью теста Харке–Бера (Jarque–Bera test). Нулевая гипотеза H0 (остатки значений показателей групп имеют нормальное распределение) при значении p ≤ 0,05 была отклонена. Сравнение значений показателей между группами и непараметрическая оценка проведены с применением критерия Манна–Уитни для несвязанных выборок (Mann–Whitney U-test). За нулевую гипотезу H0 принято отсутствие различий между группами. H0 отклонялась при значениях p≤ 0,05. Модель логистической регрессии использовалась для оценки отношения шансов (ОШ; англ. odds ratio, ОR) и 95 % доверительного интервала (ДИ; англ. confidence interval, CI) концентрации ГЦ у онкогинекологических пациенток с тромбоэмболическими осложнениями и без них.

Рисунок 1. Формирование групп пациенток для исследования.
Figure 1. Formation of patient groups for study.
Результаты / Results
Средний возраст онкогинекологических пациенток (65,39 ± 11,55 лет) значимо не отличался (р = 0,045) от среднего возраста женщин контрольной группы (51,28 ± 9,41 год). Частота тромботических осложнений в течение 1 года после выписки из стационара составила 15,3 % (36/236), при этом у 30,5 % женщин концентрация ГЦ в плазме крови составила ≥ 22 мкмоль/л (72/236). Характеристика пациенток представлена в таблице 1.
Как показал логистический регрессионный анализ (табл. 2), по сравнению с пациентками с содержанием ГЦ < 22 мкмоль/л риск ВТЭ был в 2,99 раз выше у пациенток с концентрацией ГЦ в плазме крови ≥ 22 мкмоль/л (95 % ДИ = 1,1–8,08).
Достоверных различий в частоте полиморфизмов генов ферментов фолатного цикла в группах онкогинекологических пациенток и контрольной группе выявлено не было (р > 0,05) (табл. 3).
При этом у онкогинекологических пациенток с выявленными полиморфизмами генов ферментов фолатного цикла средние значения ГЦ в плазме крови оказались значимо выше (р < 0,05), чем у женщин контрольной группы с полиморфизмами (табл. 4).
Таблица 1. Характеристика обследованных пациенток.
Table 1. Characteristics of the patients examined.
|
Показатель Parameter |
Группа / Group |
С тромботическими осложнениями With thrombotic complications n = 36 n (%) |
Без тромботических осложнений Without thrombotic complications n = 200 n (%) |
р |
|||
|
1 n = 63 n |
2 n = 51 n |
3 n = 64 n |
4 n = 58 n |
||||
|
Возраст, лет / Age, years < 60 ≥ 60 |
12 51 |
2 49 |
26 38 |
20 38 |
8 (22,2) 28 (77,8) |
52 (26,0) 148 (74,0) |
0,632 |
|
Индекс массы тела / Body mass index < 18,4 18,4–24,0 > 24 |
2 44 17 |
2 37 12 |
10 21 33 |
2 14 42 |
8 (22,2) 12 (33,3) 16 (44,4) |
8 (4,0) 104 (52,0) 88 (44,0) |
< 0,001 |
|
Стадия заболевания / Disease stage 1 2 3 4 |
0 7 40 16 |
3 7 41 0 |
7 30 27 0 |
10 20 28 0 |
0 (0,0) 8 (22,2) 28 (77,8) 0 (0,0) |
20 (10,0) 56 (28,0) 108 (54,0) 16 (8,0) |
0,015 |
|
Концентрация гомоцистеина, мкмоль/л Homocysteine level, µmol/L < 22 ≥ 22 |
46 17 |
48 13 |
44 20 |
36 22 |
12 (33,3) 24 (66,7) |
152 (76,0) 48 (24,0) |
< 0,001 |
Примечание: р – статистическая значимость различий между группами с тромботическими осложнениями и без тромботических осложнений.
Note: p – significant differences between groups with and without thrombotic complications.
Таблица 2. Результаты логистического регрессионного анализа у онкогинекологических пациенток с тромботическими осложнениями.
Table 2. Logistic regression analysis data in female cancer patients with thrombotic complications.
|
Показатель Parameter |
ОШ (95 % ДИ) OR (95 % СI) |
сОШ (95 % ДИ) aOR (95 % CI) |
|
Концентрация гомоцистеина, мкмоль/л: Homocysteine level, µmol/L: ≥ 22 < 22 |
5,25 (2,38–11,59) 1,00 |
2,99 (1,11–8,08) |
Примечание: ОШ – отношение шансов; сОШ – скорректированное отношение шансов; ДИ – доверительный интервал.
Note: OR – odds ratio; aOR – adjusted odds ratio; CI – confidence interval.
Таблица 3. Распространенность полиморфизмов генов ферментов фолатного цикла в группах обследованных женщин.
Table 3. The prevalence of polymorphisms in the genes encoding folate cycle enzymes in groups of women examined.
|
Показатель Parameter |
Группа / Group |
Контрольная Control n = 58 n (%) |
р |
|||
|
1 n = 63 n (%) |
2 n = 51 n (%) |
3 n = 64 n (%) |
4 n = 58 n (%) |
|||
|
MTHFR C677T СС СТ ТТ |
29 (46,0) 25 (39,7) 9 (14,3) |
21 (41,2) 23 (45,1) 7 (13,7) |
26 (40,6) 30 (46,9) 8 (12,5) |
19 (32,8) 30 (51,7) 9 (15,5) |
23 (46,0) 22 (44,0) 5 (10,0) |
> 0,05 |
|
MTHFR A1298C АА АС СС |
35 (55,6) 21 (33,3) 7 (11,1) |
30 (58,8) 19 (17,6) 2 (3,9) |
33 (51,6) 25 (39,0) 6 (9,4) |
30 (51,2) 23 (39,7) 5 (8,6) |
26 (52,0) 20 (40,0) 4 (8,0) |
> 0,05 |
|
MTRR A66G AA AG GG |
20 (31,7) 41 (65,1) 2 (3,2) |
18 (35,3) 30 (58,8) 3 (5,9) |
18 (28,1) 42 (65,6) 4 (6,3) |
15 (25,9) 41 (70,7) 2 (3,4) |
17 (34,0) 30 (60,0) 3 (6,0) |
> 0,05 |
|
MTR A2756G AA AG GG |
37 (58,7) 23 (36,5) 3 (4,8) |
31 (60,8) 18 (35,3) 2 (3,9) |
39 (60,9) 23 (35,9) 2 (3,1) |
34 (58,6) 21 (36,2) 3 (5,2) |
32 (64,0) 16 (32,0) 2 (4,0) |
> 0,05 |
Примечание: р – статистическая значимость различий между контрольной группой и подгруппами онкогинекологических пациенток 1, 2, 3, 4.
Note: p – significant differences between control group and subgroups of female cancer patients 1, 2, 3, 4.
Таблица 4. Концентрация гомоцистеина у обследованных женщин с выявленными полиморфизмами генов ферментов фолатного цикла.
Table 4. Homocysteine level in women examined with identified polymorphisms of the genes encoding folate cycle enzymes.
|
Показатель Parameter |
Концентрация гомоцистеина, мкмоль/л, M ± SD Homocysteine level, µmol/L, M ± SD |
р |
|
|
Онкогинекологические пациентки Female cancer patients n = 236 |
Контрольная группа Control group n = 50 |
||
|
MTHFR C677T СС СТ ТТ |
14,43 ± 6,13 19,51 ± 10,72 22,38 ± 21,50 |
10,55 ± 2,98 13,01 ± 6,63 20,85 ± 11,76 |
< 0,05 |
|
MTHFR A1298C АА АС СС |
13,47 ± 6,47 18,92 ± 12,29 22,64 ± 20,39 |
10,12 ± 2,17 12,67 ± 5,44 19,25 ± 10,52 |
< 0,05 |
|
MTRR A66G AA AG GG |
15,52 ± 5,69 17,83 ± 10,99 23,70 ± 23,51 |
10,88 ± 2,67 12,67 ± 5,13 18,15 ± 10,48 |
< 0,05 |
|
MTR A2756G AA AG GG |
12,23 ± 5,16 20,43 ± 15,32 21,15 ± 23,30 |
10,71 ± 3,30 13,39 ± 7,91 19,97 ± 12,88 |
< 0,05 |
Примечание: р – статистическая значимость различий между контрольной группой и группой онкогинекологических пациенток.
Note: p – significant differences between the control group and group of female cancer patients.
Обсуждение / Discussion
Метаболизм гомоцистеина / Нomocysteine metabolism
Гомоцистеин представляет собой серосодержащую аминокислоту в составе фолатного цикла [8] (рис. 2). Находится ГЦ на путях взаимопревращения цистеина и метионина. Обмен ГЦ происходит двумя путями: через транссульфатирование и реметилирование [9]. При избытке метионина преобладает транссульфатирование, при котором с помощью фермента цистатион-β-синтазы (англ. cystathion-β-synthase, CBS) и пиридоксаль-5'-фосфата в качестве кофактора идет превращение ГЦ в цистатионин [10] (рис. 2). При низкой концентрации метионина ГЦ через бетаин- или фолат-зависимые реакции реметилируется в метионин. Фермент бетаин-гомоцистеин-S-метилтрансфераза (англ. betaine homocysteine-S-methyltransferase, BHMT) в бетаин-зависимом пути [11] катализирует включение метильной группы из бетаина в ГЦ с формированием метионина. В фолат-зависимом пути ГЦ с помощью MTR, также известной как метионинсинтаза, которая работает совместно с кофактором – витамином B12, получает метильную группу из N-5-метилтетрагидрофолата. Реакции с участием данного фермента запускают рециркуляцию тетрагидрофолата (из N-5-метилтетрагидрофолата), который далее может быть использован для синтеза нуклеотидов [12]. Тем самым фермент метионинсинтаза связывает пути обмена ГЦ и фолиевой кислоты (рис. 2). Синтез тетрагидрофолата зависит от присутствия экзогенных фолатов, и низкая концентрация фолиевой кислоты затрудняет реметилирование, что ведет к росту концентрации ГЦ в плазме крови.
Дефицит кобаламина и витамина B6, фолиевой кислоты [13], прием лекарственных средств, в частности противосудорожных препаратов [14], могут приводить к росту концентрации ГЦ в плазме. Способствуют росту концентрации ГЦ за счет снижения концентрации фолиевой кислоты и препараты таких групп, как оральные контрацептивы, диуретики, иммуносупрессоры и противовоспалительные [15]. Снижение концентрации фолиевой кислоты происходит при употреблении алкоголя [16], курении, сахарном диабете и псориазе [17]. Уровень ГЦ нарастает и при наличии у пациентов полиморфизмов генов ферментов фолатного цикла.
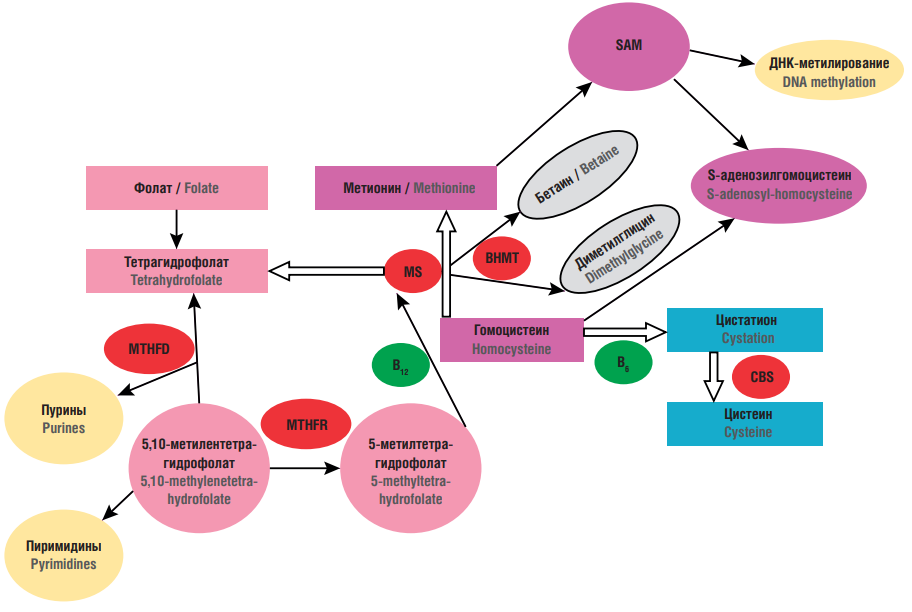
Рисунок 2. Обмен гомоцистеина [рисунок авторов].
Примечание: SAM – S-аденозил-1-метионин; BHMT – бетаин-гомоцистеин-S-метилтрансфераза; МS – метионинсинтаза; MTHFR – метилентетрагидрофолатредуктаза; MTHFD – метилентетрагидрофолатдегидрогеназа; CBS – цистатион-β-синтаза.
Figure 2. Homocysteine metabolism [drawn by authors].
Note: SAM – S-adenosyl-1-methionine; BHMT – betaine homocysteine-S-methyltransferase; MS – methionine synthase; MTHFR – methylenetetrahydrofolate reductase; MTHFR – methylenetetrahydrofolate dehydrogenase; CBS – cystathion-β-synthase.
Гомоцистеин и рак / Нomocysteine and cancer
Фолиевая кислота принимает участие не только в синтезе нуклеотидов. Она необходима и для превращения в тимидинмонофосфат дезоксиуридинмонофосфата (англ. deoxyuridine monophosphate, dUMP) [18]. Тимидилатсинтетаза (англ. thymidylate synthetase, TYMS) в норме осуществляет переход dUMP в тимидинмонофосфат, в качестве донора метильной группы выступает MTHFR. При дефиците фолиевой кислоты идет накопление dUMP, что приводит к дисбалансу дезоксирибонуклеотидов, избыточному включению урацила в ДНК вместо тимина. Данный дефект в норме устраняется ферментом урацил-ДНК-гликозилазой, которая удаляет ошибочно включенный урацил из цепи ДНК [19]. При резком снижении концентрации фолиевой кислоты (в связи с повышенной концентрацией ГЦ) ДНК-гликозилаза не справляется с репарацией ДНК, что приводит к хромосомным повреждениям и далее может привести к злокачественному перерождению клеток [20].
Метилирование ДНК имеет решающее значение для нормального генома. Параллельно метилированию ДНК гомоцистеин переходит в метионин под действием метионинсинтазы. Метилирование ДНК осуществляется с помощью донора метильной группы – S-аденозил-1-метионина (англ. S-adenosyl-1-methioni- ne, SAM), образуемого из метионина путем АТФ-зависимой реакции с участием S-аденозилметилсинтетазы [21]. Осуществляется метилирование ДНК совместно тремя типами ДНК-метилтрансфераз (англ. DNA methyltransferase, DNMT) – DNMT1, DNMT3a и DNMT3b. Поскольку SAM образуется из 5-метилтетрагидрофолата (англ. 5-methyltetrahydrofolate, 5'-MTHF), низкая концентрация фолиевой кислоты ограничивает доступность субстрата для метионинсинтазы, тем самым приводя к гипометилированию ДНК. Гипометилирование ДНК ведет к деконденсации гетерохроматина и активации элементов ретротранспозона [22]. Глобальное геномное гипометилирование встречается при многих видах рака, включая рак предстательной железы и гепатоцеллюлярную карциному. Регионарное гипометилирование последовательности ДНК также часто наблюдается на ранних стадиях онкогенеза и при доброкачественных состояниях, таких как гиперплазия [23].
При раке концентрация фолиевой кислоты в плазме крови снижается, так как опухолевые клетки используют ее для синтеза пуринов de novo [24]. При всех видах опухолей на поздних стадиях отмечены высокие концентрации ГЦ в плазме крови, в то время как на ранних стадиях значительных изменений в содержании ГЦ не выявлено. К резкому росту уровня ГЦ приводит и химиотерапия, на фоне которой отмечен рост тромбоэмболических осложнений. Наиболее часто используемые в химиотерапии препараты (например, антиметаболиты, метотрексат, гормоны и антагонисты) являются антифолатами [25]. Их применение вызывает дополнительное снижение концентрации фолиевой кислоты в плазме крови.
В проведенном нами исследовании было показано, что у 30,5 % (72/236) обследованных пациенток концентрация ГЦ в плазме крови составила ≥ 22 мкмоль/л. В исследовании преобладали пациентки II и III стадии заболевания.
Полиморфизмы генов фолатного цикла / Folate cycle gene polymorphisms
Резкое повышение концентрации ГЦ в плазме крови носит название гомоцистинурия. Состояние это связано с генетическим дефектом цистатионин-β-синтазы (CBS), фермента путей транссульфатирования и реметилирования в фолатном цикле [26]. Существует и ряд других генетических причин, приводящих к росту содержания ГЦ.
Многочисленные исследования доказали наличие мутаций и полиморфизмов генов ферментов участников обмена ГЦ (MTHFR, CBS, MTRR, MTR, MTHFD, BHMT, TYMS, TCN 2) [27–29]. Полиморфные аллели этих генов оказались ответственными за развитие дефектов нервной трубки плода и сосудистые осложнения [30][31]. Недавние исследования показали, что эти же полиморфизмы связаны с различными типами опухолей. Например, ген фермента MTHFR имеет около 6375 полиморфизмов, два из них – С677T [32] и А1298C [33] связаны с некоторыми опухолями, включая аденокарциному эндо- метрия. Ген фермента MTRR имеет 9461 полиморфизм. У гена фермента MTR выявлено 26150 полиморфизмов; один них – MTR A2756G, по данным некоторых исследований, сопряжен с развитием таких опухолей, например, как рак шейки матки и рак тела матки [34][35].
Однако в проведенном нами исследовании при оценке распространенности полиморфизмов генов ферментов фолатного цикла (MTHFR C677T, MTHFR A1298C, MTRR A66G, MTR A2756G) достоверных различий в частоте полиморфизмов в группе онкогинекологических пациенток и контрольной группе выявлено не было (р > 0,05). Возможно, отсутствие различий объясняется особенностями исследуемой популяции, либо размерами выборки.
Рак и онкотромбозы / Cancer and oncothrombosis
На поздних стадиях у онкологических пациентов развиваются как ГГЦ, так и ВТЭ [36]. Пациенты после химиотерапии составляют 13 % от общего пула ВТЭ и имеют повышенные концентрации ГЦ в плазме крови [37]. Есть основания полагать, что существует тесная связь между гомоцистеин-индуцированной ВТЭ и раком.
Лежащий в основе рак-ассоциированного тромбоза механизм, индуцированный ГГЦ, является сложным и не до конца изученным. Эндотелиальные нарушения, вызванные образованием свободных радикалов, могут быть одним из компонентов этого механизма [38]. ГЦ способен формировать димеры и комплексы с белком, способствующие появлению свободных радикалов. ГЦ также может образовывать активное производное под названием гомоцистеин-тиолактон. Гомоцистеин-тиолактон формирует ковалентные связи с остатками лизина или аргинина в белках, что приводит к образованию нерастворимых белковых агрегатов или амилоидов [39], нарушающих нормальную работу сердечно-сосудистой системы. Модификация гемостатических протеинов (путем N-гомоцистеинилирования или S-гомоцистеинилирования) препятствует нормальному обмену оксида азота (NO) и вызывает повреждение клеток эндотелия [40].
Гомоцистеин нарушает работу тромбомодулина и протеин С-зависимую инактивацию фактора Va [41], снижает секрецию NO, приводит к усилению агрегации тромбоцитов и уменьшению антитромботической активности эндотелиальных клеток [42].
При повышении концентрации ГЦ его свободная тиоловая группа вызывает окислительный стресс и активирует тромбоциты, что приводит к эндотелиальной дисфункции, повреждению стенки сосудов и тромбозу. ГЦ также может вызывать гомоцистеинилирование белков, образуя аминные связи с остатками лизина, изменяя структуру и функцию белков и вызывая повреждение белков через тиоловые радикалы, что также приводит к тромбозу [43].
Гомоцистеин увеличивает синтез реактивных форм кислорода с последующим формированием гидроксильных радикалов, способствующих окислению липидов, белков, углеводов и нуклеиновых кислот, развитию эндотелиальной дисфункции, повреждению сосудистой стенки и, в конечном итоге, к активации тромбоцитов и тромбозу [44]. На фоне дефицита фолиевой кислоты происходит нарушение обмена метионина, что приводит к накоплению ГЦ в организме [45].
Результаты нашего исследования показали, что частота тромботических осложнений у онкогинекологических пациенток составила 15,3 % (36/236), при этом 33,3 % (12/36) пациенток имели высокую концентрацию ГЦ крови. При проведении логистической регрессии определено, что риск ВТЭ в 2,99 раза выше у пациенток с содержанием ГЦ в плазме крови ≥ 22 мкмоль/л по сравнению с пациентками с концентрацией ГЦ < 22 мкмоль/л (95 % ДИ = 1,11–8,08). У онкогинекологических пациенток с выявленными полиморфизмами генов ферментов фолатного цикла средний уровень ГЦ в плазме крови оказался достоверно выше, чем в контрольной группе женщин с полиморфизмами (р < 0,05).
Таким образом, концентрация ГЦ в плазме крови является независимым фактором риска ВТЭ в онкогинекологии. Влияние фолиевой кислоты на риск тромбоза может быть обусловлено участием в реметилировании ГЦ [46][47]. Следовательно, имеет смысл рассмотреть необходимость обогащать рацион пациенток фолиевой кислотой, контролировать уровень ГЦ в плазме крови и использовать соответствующие препараты, содержащие достаточные дозы фолиевой кислоты при ведении онкологических пациентов.
Ограничения исследования / Study limitations
Было проведено одноцентровое ретроспективное исследование, с анализом ограниченного количества архивного материала. Кроме того, в этом исследовании не рассматривалась возможная роль фолиевой кислоты, витамина B12 как кофермента метаболического пути ГЦ.
Заключение / Conclusion
Установлены достоверные различия в концентрации ГЦ в плазме крови у онкогинекологических пациенток с тромботическими осложнениями и без них. Терапевтический эффект фолиевой кислоты на уровень ГЦ у онкогинекологических пациенток может быть использован в качестве дополнительной тромбопрофилактики в группах риска.
Значимого увеличения частоты встречаемости полиморфизмов генов ферменов фолатного цикла среди онкогинекологических пациенток выявлено не было, что позволяет усомниться в том, что данные полиморфизмы участвуют в патогенезе опухолей данной локализации. При этом у пациенток с повышенной концентрацией ГЦ в плазме крови полиморфизмы определяли достоверно чаще.
Объективные факты свидетельствуют о существовании генетических, эпигенетических и экологических причин нарушения обмена ГЦ у онкологических пациентов. Необходимо и далее рассматривать возможность назначения препаратов, снижающих содержание ГЦ в крови, и проводить мониторинг его концентрации у онкологических пациентов на фоне терапии, в том числе и химиотерапии. На сегодняшний день влияние ГЦ на рост и пролиферацию опухолевых клеток остается плохо изученным. Возможно, работы в этом направлении будут потенциально эффективны в разработке новых противоопухолевых стратегий.
Список литературы
1. Alcalay A., Wun T., Khatri V. et al. Venous thromboembolism in patients with colorectal cancer: incidence and effect on survival. J Clin Oncol. 2006;24(7):1112–8. https://doi.org/10.1200/JCO.2005.04.2150.
2. Khorana A.A., Francis C.W., Culakova E. et al. Frequency, risk factors, and trends for venous thromboembolism among hospitalized cancer patients. Cancer. 2007;110(10):2339–46. https://doi.org/10.1002/cncr.23062.
3. Sharma G.S., Kumar T., Dar T.A., Singh L.R. Protein N-homocysteinylation: From cellular toxicity to neurodegeneration. Biochim Biophys Acta. 2015;1850:2239–45. https://doi.org/10.1016/j.bbagen.2015.08.013.
4. Brustolin S., Giugliani R., Felix T.M. Genetics of homocysteine metabolism and associated disorders. Braz J Med Biol Res. 2010;43(1):1–7. https://doi.org/10.1590/s0100-879x2009007500021.
5. Seshadri S. Elevated plasma homocysteine levels: risk factor or risk marker for the development of dementia and Alzheimer's disease? J Alzheimer's Dis. 2006;9(4):393–8. https://doi.org/10.3233/jad-2006-9404.
6. Mancardi D., Penna C., Merlino A. et al. Physiological and pharmacological features of the novel gasotransmitter: hydrogen sulfide. Biochim Biophys Acta. 2009;1787(7):864–72. https://doi.org/10.1016/j.bbabio.2009.03.005.
7. Wu L.L., Wu J.T.. Hyperhomocysteinemia is a risk factor for cancer and a new potential tumor marker. Clin Chim Acta. 2002;322(1–2):21–8. https://doi.org/10.1016/s0009-8981(02)00174-2.
8. Seshadri S., Beiser A., Selhub J. et al. Plasma homocysteine as a risk factor for dementia and Alzheimer's disease. N Engl J Med. 2002;346(7):476–83. https://doi.org/10.1056/NEJMoa011613.
9. Selhub J. Homocysteine metabolism. Annu Rev Nutr. 1999;19:217–46. https://doi.org/10.1146/annurev.nutr.19.1.217.
10. Jacques P.F., Bostom A.G., Williams R.R. et al. Relation between folate status, a common mutation in methylenetetrahydrofolate reductase, and plasma homocysteine concentrations. Circulation. 1996;93(1):7–9. https://doi.org/10.1161/01.cir.93.1.7.
11. Williams K.T., Schalinske K.L. New insights into the regulation of methyl group and homocysteine metabolism. J Nutr. 2007;137(2):311–4. https://doi.org/10.1093/jn/137.2.311.
12. Locasale J.W. Serine, glycine and one-carbon units: cancer metabolism in full circle. Nat Rev Cancer. 2013;13(8):572–83. https://doi.org/10.1038/nrc3557.
13. Zhang S.M., Willett W.C., Selhub J. et al. Plasma folate, vitamin B6, vitamin B12, homocysteine, and risk of breast cancer. J Natl Cancer Inst. 2003;95(5):373–80. https://doi.org/10.1093/jnci/95.5.373.
14. Siniscalchi A., Mancuso F., Gallelli L. et al. Increase in plasma homocysteine levels induced by drug treatments in neurologic patients Pharmacol Res. 2005;52(5):367–75. https://doi.org/10.1016/j.phrs.2005.05.013.
15. Hjelt K., Brynskov J., Hippe E. et al. Oral contraceptives and the cobalamin (vitamin B12) metabolism. Acta Obstet Gynecol Scand. 1985;64(1):59–63. https://doi.org/10.3109/00016348509154689.
16. Matsuo K., Hamajima N., Hirai T. et al. Methionine synthase reductase gene A66G polymorphism is associated with risk of colorectal cancer. Asian Pac J Cancer Prev. 2002;3(4):353–9.
17. Obwegeser R., Hohlagschwandtner M., Sinzinger H. Homocysteine – a pathophysiological cornerstone in obstetrical and gynaecological disorders? Hum Reprod Update. 1999;5(1):64–72. https://doi.org/10.1093/humupd/5.1.64.
18. Montfort W.R., Perry K.M., Fauman E.B. et al. Structure, multiple site binding, and segmental accommodation in thymidylate synthase on binding dUMP and an anti-folate. Biochemistry. 1990;29(30):6964–77. https://doi.org/10.1021/bi00482a004.
19. Blount B.C., Mack M.M., Wehr C.M. et al. Folate deficiency causes uracil misincorporation into human DNA and chromosome breakage: implications for cancer and neuronal damage. Proc Natl Acad Sci U S A. 1997;94(7):3290–5. https://doi.org/10.1073/pnas.94.7.3290.
20. Hay R.K., Park J.-G., Gazdar A. Atlas of human tumor cell lines. Academic Press, 2013. 490
21. Crider K.S., Yang T.P., Berry R.J., Bailey L.B. Folate and DNA methylation: a review of molecular mechanisms and the evidence for folate's role. Adv Nutr. 2012;3(1):21–38. https://doi.org/10.3945/an.111.000992.
22. Hall L.E., Mitchell S.E, O’Neill R.J. Pericentric and centromeric transcription: a perfect balance required. Chromosome Res. 2012;20(5):535–46. https://doi.org/10.1007/s10577-012-9297-9.
23. Ehrlich M. DNA hypomethylation, cancer, the immunodeficiency, centromeric region instability, facial anomalies syndrome and chromosomal rearrangements. J Nutr. 2002;132(8 Suppl):2424S–2429S. https://doi.org/10.1093/jn/132.8.2424S.
24. Zhang D., Wen X., Wu W. et al. Elevated homocysteine level and folate deficiency associated with increased overall risk of carcinogenesis: metaanalysis of 83 case-control studies involving 35,758 individuals. PLoS One. 2015;10(5):e0123423. https://doi.org/10.1371/journal.pone.0123423.
25. Stathopoulou A., Vlachonikolis I., Mavroudis D. et al. Molecular detection of cytokeratin-19-positive cells in the peripheral blood of patients with operable breast cancer: Evaluation of their prognostic significance. J Clin Oncol. 2002;20(16):3404–12. https://doi.org/10.1200/JCO.2002.08.135.
26. Mcdonald L., Bray C., Field C. et al. Homocystinuria, thrombosis, and the blood-platelets. Lancet. 1964;1(7336):745–6. https://doi.org/10.1016/s0140-6736(64)92852-1.
27. Tonetti C., Amiel J., Munnich A., Zittoun J. Impact of new mutations in the methylenetetrahydrofolate reductase gene assessed on biochemical phenotypes: a familial study. J Inherit Metab Dis. 2001;24(8):833–42. https://doi.org/10.1023/a:1013988123902.
28. Sibani S., Christensen B., O'Ferrall E. et al. Characterization of six novel mutations in the methylenetetrahydrofolate reductase (MTHFR) gene in patients with homocystinuria. Hum Mutat. 2000;15(3):280–7. https://doi.org/10.1002/(SICI)1098-1004(200003)15:3<280::AID-HUMU9>3.0.CO;2-I.
29. Kluijtmans L.A., Wendel U., Stevens E. et al. Identification of four novel mutations in severe methylenetetrahydrofolate reductase deficiency. Eur J Hum Genet. 1998;6(3):257–65. https://doi.org/10.1038/sj.ejhg.5200182.
30. Brezovska-Kavrakova J., Krstevska M., Bosilkova G. et al. Hyperhomocysteinemia and of methylenetetrahydrofolate reductase (C677T) genetic polymorphism in patients with deep vein thrombosis. Mater Sociomed. 2013;25(3):170–4. https://doi.org/10.5455/msm.2013.25.170-174.
31. van der Put N.M., Steegers-Theunissen R.P., Frosst P. et al. Mutated methylenetetrahydrofolate reductase as a risk factor for spina bifida. Lancet. 1995;346(8982):1070–1. https://doi.org/10.1016/s0140-6736(95)91743-8.
32. Robien K., Ulrich C.M. 5, 10-Methylenetetrahydrofolate reductase polymorphisms and leukemia risk: a HuGE minireview. Am J Epidemiol. 2003;157(7):571–82. https://doi.org/10.1093/aje/kwg024.
33. Weisberg I.S., Jacques P.F., Selhub J. et al. The 1298A→ C polymorphism in methylenetetrahydrofolate reductase (MTHFR): in vitro expression and association with homocysteine. Atherosclerosis. 2001;156(2):409–15. https://doi.org/10.1016/s0021-9150(00)00671-7.
34. Alberg A.J., Selhub J., Shah K.V. et al. The risk of cervical cancer in relation to serum concentrations of folate, vitamin B12, and homocysteine. Cancer Epidemiol Biomarkers Prev. 2000;9(7):761–4.
35. Powers H.J. Interaction among folate, riboflavin, genotype, and cancer, with reference to colorectal and cervical cancer. J Nutr. 2005;135(12 Suupl):2960S–2966S. https://doi.org/10.1093/jn/135.12.2960S.
36. Gatt A., Makris A., Cladd H. et al. Hyperhomocysteinemia in women with advanced breast cancer. Int J Lab Hematol. 2007;29(6):421–5. https://doi.org/10.1111/j.1751-553X.2007.00907.x.
37. Heit J.A., O'Fallon W.M., Petterson T.M. et al. Relative impact of risk factors for deep vein thrombosis and pulmonary embolism: a populationbased study. Arch Intern Med. 2002;162(11):1245–8. https://doi.org/10.1001/archinte.162.11.1245.
38. Welch G.N., Loscalzo J. Homocysteine and atherothrombosis. N Engl J Med. 1998;338(15):1042–50. https://doi.org/10.1056/NEJM199804093381507.
39. Sharma G.S., Kumar T., Singh L.R. N-homocysteinylation induces different structural and functional consequences on acidic and basic proteins. PLoS One. 2014;9:e116386. https://doi.org/10.1371/journal.pone.0116386.
40. Kumar T., Sharma G.S., Singh L.R. Homocystinuria: therapeutic approach. Clin Chim Acta. 2016;458:55–62. https://doi.org/10.1016/j.cca.2016.04.002.
41. Lentz S.R., Sobey C.G., Piegors D.J. et al. Vascular dysfunction in monkeys with diet-induced hyperhomocyst (e) inemia. J Clin Invest. 1996;98(1):24–9. https://doi.org/10.1172/JCI118771.
42. FitzGerald G.A. Parsing an enigma: the pharmacodynamics of aspirin resistance. Lancet. 2003;361(9357):542–4. https://doi.org/10.1016/S0140-6736(03)12560-3.
43. Sibrian-Vazquez M., Escobedo J.O., Lim S. et al. Homocystamides promote free-radical and oxidative damage to proteins. Proc Natl Acad Sci U S A. 2010;107(2):551–4. https://doi.org/10.1073/pnas.0909737107.
44. Zhang J.-.W, Yan R., Tang Y.-S. et al. Hyperhomocysteinemia-induced autophagy and apoptosis with downregulation of hairy enhancer of split 1/5 in cortical neurons in mice. Int J Immunopathol Pharmacol. 2017;30(4):371–82. https://doi.org/10.1177/0394632017740061.
45. Škovierová H., Vidomanová E., Mahmood S. et al. The molecular and cellular effect of homocysteine metabolism imbalance on human health. Int J Mol Sci. 2016;17(10):1733. https://doi.org/10.3390/ijms17101733.
46. Biron F., Rousseau J., Baulin J. et al. Thromboembolic event and metabolic hyperhomocysteinemia: A case report and review of literature. Ann Cardiol Angeiol (Paris). 2021;70(3):177–82. (In French). https://doi.org/10.1016/j.ancard.2021.01.008.
47. Aday A.W., Duran E.K, Van Denburgh M. et al. Homocysteine is associated with future venous thromboembolism in 2 prospective cohorts of women. Arterioscler Thromb Vasc Biol. 2021;41(7):2215–24. https://doi.org/10.1161/ATVBAHA.121.316397.
Об авторах
В. О. БицадзеРоссия
Бицадзе Виктория Омаровна – д.м.н., профессор РАН, профессор кафедры акушерства, гинекологии и перинатальной медицины Клинического института детского здоровья имени Н.Ф. Филатова
Scopus Author ID: 6506003478.
Researcher ID: F-8409-2017.
119991 Москва, ул. Большая Пироговская, д. 2, стр. 4
Е. В. Слуханчук
Россия
Слуханчук Екатерина Викторовна – к.м.н., доцент кафедры акушерства, гинекологии и перинатальной медицины Клинического института детского здоровья имени Н.Ф. Филатова
119991 Москва, ул. Большая Пироговская, д. 2, стр. 4
А. Г. Солопова
Россия
Солопова Антонина Григорьевна – д.м.н., профессор кафедры акушерства, гинекологии и перинатальной медицины Клинического института детского здоровья имени Н.Ф. Филатова
Scopus Author ID: 6505479504.
Researcher ID: Q-1385-
119991 Москва, ул. Большая Пироговская, д. 2, стр. 4
Д. Х. Хизроева
Россия
Хизроева Джамиля Хизриевна – д.м.н., профессор кафедры акушерства, гинекологии и перинатальной медицины Клинического института детского здоровья имени Н.Ф. Филатова
Scopus Author ID: 57194547147.
Researcher ID: F-8384-2017
119991 Москва, ул. Большая Пироговская, д. 2, стр. 4
Д. В. Щербаков
Россия
Щербаков Денис Викторович – к.м.н., доцент кафедры общей гигиены института общественного здоровья имени Ф.Ф. Эрисмана
119991 Москва, ул. Большая Пироговская, д. 2, стр. 4
Ф. Э. Якубова
Россия
Якубова Фидан Эльчин кызы – клинический ординатор кафедры акушерства, гинекологии и перинатальной медицины Клинического института детского здоровья имени Н.Ф. Филатова
119991 Москва, ул. Большая Пироговская, д. 2, стр. 4
Ж.-К. Гри
Россия
Гри Жан-Кристоф – д.м.н., профессор кафедры акушерства, гинекологии и перинатальной медицины Клинического института детского здоровья имени Н.Ф. Филатова Ф Сеченовского университета; профессор гематологии, зав. лабораторией гематологии факультета биологических и фармацевтических наук Университета Монпелье и Университетской больницы Нима, Франция; иностранный член РАН
Scopus Author ID: 7005114260.
Researcher ID: AAA-2923-2019
119991 Москва, ул. Большая Пироговская, д. 2, стр. 4;
Франция, 34090 Монпелье, ул. Огюста Бруссоне, д. 163
И. Элалами
Россия
Элалами Исмаил – д.м.н., профессор кафедры акушерства, гинекологии и перинатальной медицины Клинического института детского здоровья имени Н.Ф. Филатова Сеченовского Университета,; профессор медицинского Университета Сорбонны; директор гематологии Центра Тромбозов, Госпиталь Тенон
Scopus Author ID: 7003652413.
Researcher ID: AAC-9695-2019
119991 Москва, ул. Большая Пироговская, д. 2, стр. 4;
Франция, 75006 Париж, Улица медицинского факультета, д. 12;
Франция, 75020 Париж, Китайская улица, д. 4
Н. Д. Дегтярева
Россия
Дегтярева Наталья Дмитриевна – студент 5-го курса Клинического института детского здоровья имени Н.Ф. Филатова
119991 Москва, ул. Большая Пироговская, д. 2, стр. 4
А. В. Лазарчук
Россия
Лазарчук Арина Владимировна – студент 5-го курса Клинического института детского здоровья имени Н.Ф. Филатова
119991 Москва, ул. Большая Пироговская, д. 2, стр. 4
М. А. Гилева
Россия
Гилева Мария Алексеевна – клинический ординатор кафедры акушерства, гинекологии и перинатальной медицины Клинического института детского здоровья имени Н.Ф. Филатова
119991 Москва, ул. Большая Пироговская, д. 2, стр. 4
Н. В. Самбурова
Россия
Самбурова Наталья Викторовна – к.м.н., доцент кафедры патофизиологии Института биодизайна и моделирования сложных систем
Scopus Author ID: 57208129705
119991 Москва, ул. Большая Пироговская, д. 2, стр. 4
З. Д. Асланова
Россия
Асланова Замиля Джамалидиновна – аспирант кафедры акушерства, гинекологии и перинатальной медицины Клинического института детского здоровья имени Н.Ф. Филатова
119991 Москва, ул. Большая Пироговская, д. 2, стр. 4
Д. В. Блинов
Россия
Блинов Дмитрий Владиславович – к.м.н., ассистент кафедры спортивной медицины и медицинской реабилитации Института клинической медицины имени Н.В. Склифосовского Сеченовского Университета; руководитель по медицинским и научным вопросам, Институт Превентивной и Социальной Медицины; доцент кафедры спортивной, физической и реабилитационной медицины АНО ДПО «Московский медико-социальный институт имени Ф.П. Гааза»
Scopus Author ID: 6701744871.
Researcher ID: E-8906-2017
119991 Москва, ул. Большая Пироговская, д. 2, стр. 4;
127006 Москва, ул. Садовая-Триумфальная, д. 4–10;
123056 Москва, 2-я Брестская ул., д. 5, с. 1–1а;
А. С. Шкода
Россия
Шкода Андрей Сергеевич – д.м.н., профессор, главный врач
123423 Москва, ул. Саляма Адиля, д. 2/44
А. Д. Макацария
Россия
Макацария Александр Давидович – д.м.н., профессор, академик РАН, зав. кафедрой акушерства, гинекологии и перинатальной медицины Клинического института детского здоровья имени Н.Ф. Филатова Сеченовского Университета; вице-президент Российского общества акушеров-гинекологов (РОАГ); Заслуженный врач Российской Федерации; Почетный профессор Венского Университета
Scopus Author ID: 57222220144.
Researcher ID: M-5660-2016
119991 Москва, ул. Большая Пироговская, д. 2, стр. 4
Рецензия
Для цитирования:
Бицадзе В.О., Слуханчук Е.В., Солопова А.Г., Хизроева Д.Х., Щербаков Д.В., Якубова Ф.Э., Гри Ж., Элалами И., Дегтярева Н.Д., Лазарчук А.В., Гилева М.А., Самбурова Н.В., Асланова З.Д., Блинов Д.В., Шкода А.С., Макацария А.Д. Гомоцистеин, рак и онкотромбозы. Акушерство, Гинекология и Репродукция. 2023;17(4):390-401. https://doi.org/10.17749/2313-7347/ob.gyn.rep.2023.431
For citation:
Bitsadze V.O., Slukhanchuk E.V., Solopova A.G., Khizroeva J.Kh., Shcherbakov D.V., Yakubova F.E., Gris J., Elalamy I., Degtyareva N.D., Lazarchuk A.V., Gileva M.A., Samburova N.V., Aslanova Z.D., Blinov D.V., Shkoda A.S., Makatsariya A.D. Homocysteine, cancer and oncothrombosis. Obstetrics, Gynecology and Reproduction. 2023;17(4):390-401. (In Russ.) https://doi.org/10.17749/2313-7347/ob.gyn.rep.2023.431

Контент доступен под лицензией Creative Commons Attribution-NonCommercial-ShareAlike 4.0 International License.











































