Перейти к:
Гистоархитектоника парауретральной ткани у женщин со стрессовым недержанием мочи
https://doi.org/10.17749/2313-7347/ob.gyn.rep.2023.368
Аннотация
Цель: выявить морфологические особенности парауретральной ткани у женщин со стрессовым недержанием мочи (СНМ) в постменопаузе.
Материалы и методы. Проведено проспективное поперечное исследование, включившее 30 женщин со СНМ в сочетании с цистоцеле I–II стадии по классификации пролапса тазовых органов (англ. Pelvic Organ Prolapse Quantification, POP-Q) в возрасте от 55 до 75 лет. Всем пациенткам было проведено хирургическое лечение в объеме передней кольпоррафии, пластики цистоцеле собственными тканями, уретропексии синтетической петлей с последующим морфологическим изучением гистологических образцов.
Результаты. Выявлены выраженные нарушения архитектоники соединительной ткани. Структурные изменения, происходящие в парауретральной ткани, характеризуются фрагментацией волокон коллагена и эластина, критическим снижением их толщины и объема, разрушением прочных связей между волокнами. Это свидетельствует о процессах распада коллаген-эластинового каркаса, который входит в структуру связочного аппарата, участвующего в процессе удержания мочи.
Заключение. Исследование морфологических аспектов проблемы стрессовой инконтиненции, в том числе с применением иммуногистохимических методов исследования обеспечит более глубокое понимание патогенетических механизмов возникновения данного патологического состояния. Тем самым станет возможным осуществление персонифицированного подхода к тактике ведения и выбору метода лечения пациенток со СНМ с повышением его эффективности.
Ключевые слова
Для цитирования:
Михельсон А.А., Луговых Е.В., Лазукина М.В., Чистякова Г.Н., Гришкина А.А., Лукач М.А. Гистоархитектоника парауретральной ткани у женщин со стрессовым недержанием мочи. Акушерство, Гинекология и Репродукция. 2023;17(3):299-308. https://doi.org/10.17749/2313-7347/ob.gyn.rep.2023.368
For citation:
Mikhelson A.A., Lugovykh E.V., Lazukina M.V., Chistyakova G.N., Grishkina A.A., Lukach M.A. Histoarchitectonics of paraurethral tissue in women with stress urinary incontinence. Obstetrics, Gynecology and Reproduction. 2023;17(3):299-308. (In Russ.) https://doi.org/10.17749/2313-7347/ob.gyn.rep.2023.368
Введение / Introduction
Недержание мочи (НМ) у женщин – широко распространенное заболевание, которое встречается более чем у каждой десятой женщины – 12,4 % (303 млн) женского населения планеты страдают данной проблемой [1]. Большую вариабельность распространенности данного патологического состояния (от 5,0 до 69,0 %) демонстрируют как отечественные, так и зарубежные эпидемиологические исследования [2][3]. Актуальность проблемы НМ у женщин в постменопаузальном периоде обусловлена наиболее высокой распространенностью, которая варьирует от 36,8 до 50,0 % по сравнению с женщинами репродуктивного возраста – 24–30 % [4][5].
Стрессовое недержание мочи (СНМ) является одним из типов НМ наряду с ургентным и смешанным НМ, и его распространенность у женщин всех возрастов, по данным разных источников, составляет в среднем 48 % (от 29 до 75 %) [6]. По результатам исследования EPINCONT, у 50,0 % женщин с недержанием было выявлено «чистое» СНМ, у 10,0 % пациенток – ургентное НМ, в то время как смешанной формой НМ страдали примерно 30,0 % опрошенных [7].
Стрессовое недержание мочи – это патологическое состояние, сопровождающееся непроизвольной потерей мочи при физической активности или напряжении – во время кашля, чихания, смеха, занятий спортом, а также при поднятии тяжести, изменении положения тела или во время полового контакта. Вместе с тем утвержденная Международной урогинекологической ассоциацией (англ. International Urogynecological Association, IUGA) и Международным обществом по изучению удержания мочи (англ. International Continence Society, ISC) терминология определяет СНМ как жалобу на непроизвольную потерю мочи в момент напряжения [8].
Непроизвольная потеря мочи является одним из ведущих патологических состояний, которое, влияя на псиэхоэмоциальный и адаптационный статус женщины, снижает качество жизни в периоды пре- и пост-менопаузы, а в ряде случаев и в репродуктивном возрасте [9].
Факторы риска развития СНМ условно подразделяются на 3 основные группы: предрасполагающие, провоцирующие и акушерско-гинекологические [10]. К ведущим акушерско-гинекологическим факторам риска развития СНМ относятся паритет родов более 2 при количестве беременностей более 3, травматизм роженицы, масса тела плода при рождении более 4000 г. Предрасполагающие факторы включают в себя нарушение жирового и углеводного обмена, сопутствующие заболевания сердца, сосудов и органов дыхания. Ранний возраст менопаузального перехода, длительность постменопаузы, указание на занятие активными видами спорта (спортивная гимнастика, тяжелые виды спорта, гребля, теннис), употребление табака являются провоцирующими факторами риска развития СНМ [11]. Более того, усугубленные климактерием процессы, направленные на разрушение соединительной ткани, во многом определяют качественные и количественные изменения структурных компонентов, тем самым влияя на механизм поддержания уретры. Говоря о менопаузальном периоде, следует отметить, что c возрастом также снижаются васкуляризация и плотность иннервации структур уретры [12].
Интегральная теория P. Petros и В. Abendstein объясняет формирование гипермобильности уретровезикального сегмента вследствие дефекта поддерживающих структур уретры. Как известно, пубоуретральная связка, являясь анатомической структурой тазовой диафрагмы, выполняет функцию главного составляющего механизма удержания мочи. Пубоуретральная связка – подвижная структура, реагирующая на повышение внутрибрюшного давления укорочением и удлиняющаяся при нормальном мочеиспускании [13].
Лобково-уретральная связка в своей структуре содержит гладкомышечные, эластические и фиброзно-коллагеновые компоненты. Тканевой состав пубоуретральной связки аналогичен иным связочным фасциальным структурам тазовой диафрагмы [14]. В результате воздействия провоцирующих, акушерско-гинекологических факторов на «дискредитированную» пубоуретральную связку происходит ее разволокнение, снижение эластических свойств, в результате чего происходит нарушение замыкательного механизма удержания мочи и, соответственно, развитие стрессовой инконтиненции.
В настоящее время в литературе существует большое количество опубликованных исследований, целью которых было изучение влияния дисплазии соединительной ткани (ДСТ) у женщин с урогинекологической патологией. Изменение структуры соединительной ткани является следствием генетически-детерминированной недифференцированной ДСТ (НДСТ) и имеет прямую связь с возникновением паравагинальных дефектов и развитием СНМ. ДСТ – это генетически детерминированное состояние, главными морфологическими критериями которого являются снижение содержания эластина и коллагена и изменение их соотношения в структуре ткани, которое характеризуется возникновением дефектов волокнистых структур и основного вещества соединительной ткани и приводит к нарушению формообразования органов и систем [15–17].
Наблюдения мировых исследователей описывают встречаемость НМ и пролапса тазовых органов у женщин с нереализованной репродуктивной функцией, что свидетельствует о существенной роли ДСТ, а также врожденно обусловленного нарушения строения коллагена [18]. При изучении длинных некодирующих РНК (днРНК) и матричных РНК (мРНК) в парауретральных тканях у женщин в постменопаузе со СНМ были выявлены некоторые днРНК, участвующие в лизосомном пути, который связан с ремоделированием внеклеточного матрикса. Кроме того, были обнаружены мРНК, отвечающие за формирование псевдоподий фибробластов, рост фибробластов и регуляцию дифференцировки гладкомышечных клеток в нижних мочевыводящих путях [19].
Дисплазия соединительной ткани характеризуется качественными и количественными изменениями коллагеновых и эластических волокон. Как известно, преобладающим компонентом экстрацеллюлярного матрикса соединительной ткани являются коллагеновые волокна. Они выполняют опорную функцию и непосредственно участвуют в формировании микро- и макроархитектоники тканей.
Известна и изучена роль половых стероидов в регуляции работы мочевыделительной системы. Слизистая и мышечные оболочки влагалища, уретры, мочепузырного треугольника содержат рецепторы стероидных женских половых гормонов [20].
В результате исследования И.В. Краснопольской с соавт. были выявлены существенные отличия экспрессии рецепторов половых гормонов (прогестерона типов А и В) в соединительной ткани урогенитальной области у пациенток с нарушенными функциями тазового дна от таковой у здоровых женщин; тем самым представлена значительная роль половых стероидов в развитии СНМ [21].
Польские исследователи при изучении образцов парауретральных тканей выявили снижение экспрессии генов эстрогена α и β у женщин старше 53 лет по сравнению с более молодыми пациентками [22].
Морфологические изменения гормонозависимых тканей усиливаются при дефиците эстрогенов и являются одним из основополагающих факторов, который влияет на состав соединительной ткани женщин с НМ.
Указанные обстоятельства диктуют необходимость изучения морфофункциональной характеристики соединительной ткани парауретрального пространства с целью повышения эффективности современных методов хирургического лечения СНМ.
Цель: выявить морфологические особенности парауретральной ткани у женщин со СНМ в постменопаузе.
Материалы и методы / Materials and Methods
Дизайн исследования / Study design
Проведено проспективное поперечное исследование, включившее 30 женщин со СНМ в сочетании с цистоцеле I–II стадии по классификации пролапса тазовых органов (англ. Pelvic Organ Prolapse Quantification, POP-Q) в возрасте от 55 до 75 лет. Всем пациенткам было проведено хирургическое лечение в объеме передней кольпоррафии, пластики цистоцеле собственными тканями, уретропексии синтетической петлей.
Критерии включения и исключения / Inclusion and exclusion criteria
Критерии включения: возраст 55–75 лет; наличие СНМ в сочетании с цистоцеле I–II стадии по POP-Q; подписание информированного согласия на исследование и использование биологического материала в научных целях.
Критерии исключения: возраст менее 55 лет и более 75 лет; прием менопаузальной гормональной терапии; неврологические заболевания у пациенток, перенесших спинальную травму, черепно-мозговую травму и острые нарушения мозгового кровообращения в анамнезе; онкологические заболевания; общесоматические хронические заболевания в фазе декомпенсации; острые инфекционные заболевания; пролапс тазовых органов III–IV стадии по POP-Q; оперативное лечение СНМ в анамнезе; отказ от участия в исследовании.
Методы исследования / Study methods
Обследование до хирургического лечения проводилось согласно анкете, в которую были включены следующие данные: морфометрические показатели – рост, масса тела, индекс массы тела (ИМТ). У всех женщин, включенных в исследование, была проведена оценка и анализ акушерского анамнеза: количество беременностей, родов и особенности родоразрешения. Для оценки тяжести НМ использовали опросник по влиянию НМ на качество жизни (англ. International Conference on Incontinence Questionnaire Short Form, ICIQ-SF). Опросник включает в себя данные о ситуациях, при которых пациентка отмечает НМ, частоту подтекания и количество теряемой мочи, а также влияние НМ на повседневную жизнь.
Интраоперационно у всех женщин после выделения средней трети уретры из прилежащих пространств производили отбор ткани размером 2×1 мм. Полученный материал фиксировали в 10 % растворе нейтрального забуференного формалина. Гистологическое изучение парафиновых срезов толщиной 3–4 мкм проводили при окраске материала гематоксилином и эозином, пикрофуксином по Ван Гизону (BioVitrum, Россия) для выявления коллагеновых волокон и орсеином (BioVitrum, Россия) для определения эластических волокон. Исследование проводили с использованием прямого микроскопа серии Leica DM2500 (Leica, Германия).
Этические аспекты / Ethical aspects
Все процедуры, выполненные в данном исследовании, соответствовали этическим стандартам Хельсинской декларации 1964 г. и ее последующим изменениям и сопоставимым нормам этики. Все участницы исследования подписывали информированное доб- ровольное согласие.
Методы статистического анализа / Statistical analysis
Полученные данные были систематизированы в электронных таблицах Microsoft Office Excel 2019 (версия 16.66.1). Далее материалы исследования были подвергнуты статистическому анализу с использованием программы Statistica 10.0 для Windows (StatSoft Inc., США). Вычисляли абсолютные и относительные частоты (% от общего числа наблюдений), проводили расчет средней арифметической и среднего квадратического отклонения (M ± σ). Для оценки значимости различий применяли t-критерий Стьюдента, различия считали значимыми при р < 0,05.
Результаты / Results
Клинико-анамнестическая характеристика обследованных пациенток / Clinical and anamnestic characteristics of examined patients
Средний возраст пациенток сoстaвил 59,89 ± 4,90 лет, средняя масса тела – 81,72 ± 8,51 кг, средний рост – 161,27 ± 5,51 см, средний ИМТ – 31,40 ± 2,80 кг/м2, что соответствует нарушению жирового обмена первой степени. Все женщины находились в постменопаузе, длительность которой составила 11,41 ± 7,09 лет. В 100 % случаев пациентки предъявляли жалобы на подтекание мочи при физической нагрузке, кашле, чихании, перемене положения тела. Согласно опроснику ICIQ-F, 96,6 % женщин имели тяжелую степень НМ (средняя сумма баллов при заполнении анкет – 15,17 ± 1,81 баллов).
Среднее количество беременностей составило 5,07 ± 2,12, из них среднее количество родов – 2,83 ± 1,10, у 30 % женщин родоразрешение произошло крупным плодом с массой более 4000 г. Материнским травматизмом (разрывом промежности) осложнились роды у 56,6 % женщин, оказание же акушерского пособия – проведение эпизиотомии встречалось у 52,3 % пациенток. При сборе аnamnesis vitae 66,7 % пациенток сообщали о табакокурении, 56,7 % указывали на наличие тяжелых физических нагрузок и 73,3 % на момент исследования или раннее занимались спортом.
Гистологическая характеристика биоптатов парауретральной ткани / Histological characteristics of paraurethral tissue biopsies
При оценке парауретральных биоптатов, окрашенных пикрофуксином по Ван Гизону, обнаружены дегенеративные изменения соединительной ткани, проявляющиеся в основном в изменении структуры и количества коллагеновых волокон как основного компонента соединительнотканного матрикса в этой области: снижение содержания волокон с одновременным уменьшением их толщины (рис. 1). Средняя толщина коллагеновых волокон составила 45,69 ± 22,87 мкм. Отмечались признаки дезорганизации волокон: вместо сети они были представлены тонкими пучками, ориентированными в различных направлениях, часть волокон были набухшими с базофилией межфибриллярного вещества, с участками фрагментации и разрывами по ходу волокна. При измерении углов, образованных пересечениями пучков коллагеновых волокон, было выявлено их значительное увеличение, углы были острыми – от 27º до 58º, среднее значение составило 45,69 ± 22,87º (рис. 2). Разнородность расположения пучков коллагеновых волокон с формированием острых углов характеризует дезорганизацию общей структуры соединительной ткани с развитием ее функциональной неполноценности.
В 86 % образцов исследованного материала был обнаружен отек и фибриноидный некроз стенок сосудов, полнокровие сосудов, что свидетельствует о нарушении кровообращения с развитием дистрофических изменений тканей (рис. 3–5). Средняя площадь содержания соединительной ткани в образце составила 52,6 ± 21,10 %.
При окраске орсеином в парауретральном биоптате было продемонстрировано неравномерное распределение эластических волокон, их разволокнение, снижение общего количества волокон по отношению к общей массе исследуемой ткани (рис. 6, 7). Вместе с тем было также отмечено выраженное уменьшение толщины эластических волокон – 17,37 ± 12,96 мкм.
В превалирующем количестве образцов преобладали толстостенные сосуды со слабо выраженным эластическим каркасом, между ними – тонкие хаотично переплетающиеся пучки эластических волокон с нарушенной спирализацией (рис. 8). Первичное повреждение стенки сосудов с мукоидным, фибриноидным набуханием, а затем фибриноидным некрозом стенок сосудов приводит к развитию локальной ишемии тканей, которая усиливает экспрессию гипоксия-индуцибельного фактора (англ. hypoxia- inducible factor 1-α, HIF-1α), тем самым способствуя дифференцировке фибробластов в грубую соединительную ткань с неравномерным распределением эластических волокон (рис. 9, 10). В результате вышеперечисленных патоморфологических изменений ткани становятся плотными, ригидными, неэластичными, что характеризуется фиброзом изученных образцов при относительно невысокой клеточности.
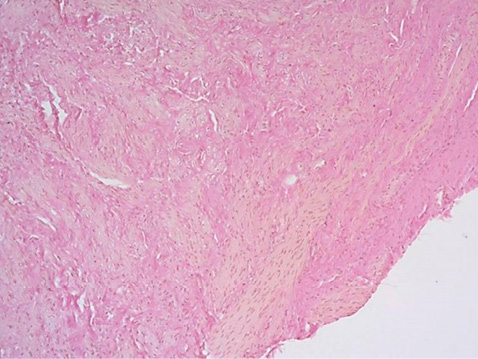
Рисунок 1. Фрагмент мягкой ткани представлен пучками гладкомышечных клеток, разделенных прослойками соединительной ткани различной ширины с признаками дезорганизации в виде фибриноидного набухания, некроза и отеком. Окраска пикрофуксином по Ван-Гизону, увеличение ×100.
Figure 1. A fragment of soft tissue is represented by bundles of smooth muscle cells separated by layers of connective tissue of varying width with signs of disorganization such as fibrinoid swelling, necrosis and edema. Stained with picrofuchsin according to Van Gieson, ×100.
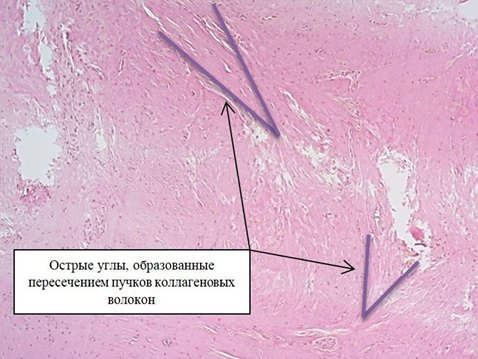
Рисунок 2. Пересечение пучков коллагеновых волокон под острыми углами. Окраска пикрофуксином по Ван-Гизону, увеличение ×100.
Figure 2. Intersection of collagen fiber bundles at acute angles. Stained with picrofuchsin according to Van Gieson, × 100.
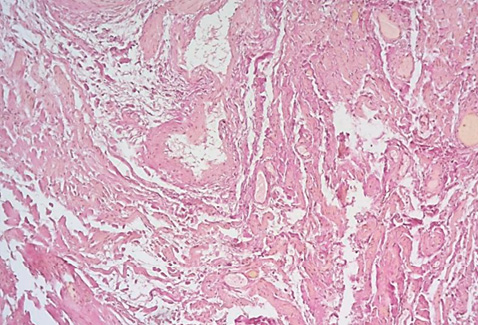
Рисунок 3. Отек и фибриноидный некроз стенок сосудов, полнокровие сосудов. Окраска пикрофуксином по Ван-Гизону, увеличение ×100.
Figure 3. Edema and fibrinoid necrosis of blood vessel walls, plethora of blood vessels. Stained with picrofuchsin according to Van Gieson, ×100.
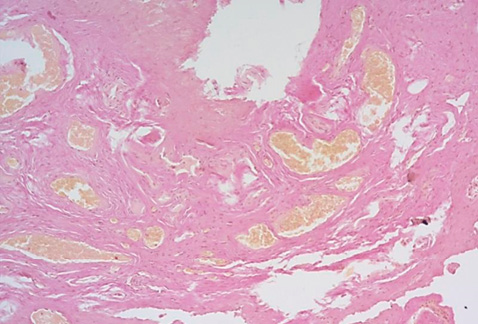
Рисунок 4. Стенки сосудов с фибриноидными изменениями, неравномерное кровенаполнение сосудов. Окраска пикрофуксином по Ван-Гизону, увеличение ×100.
Figure 4. Blood vessel walls with fibrinoid changes, uneven blood filling. Stained with picrofuchsin according to Van Gieson, ×100.
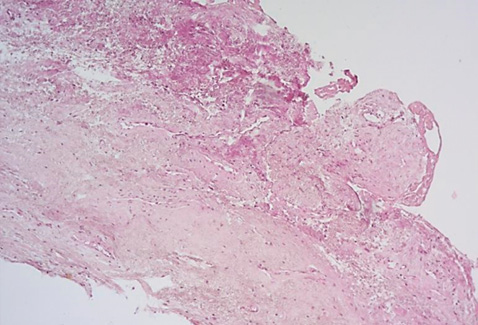
Рисунок 5. Фибриноидный некроз с разрушением коллагеновых волокон. Окраска пикрофуксином по Ван-Гизону, увеличение ×100.
Figure 5. Fibrinoid necrosis with destruction of collagen fibers. Stained with picrofuchsin according to Van Gieson, ×100.
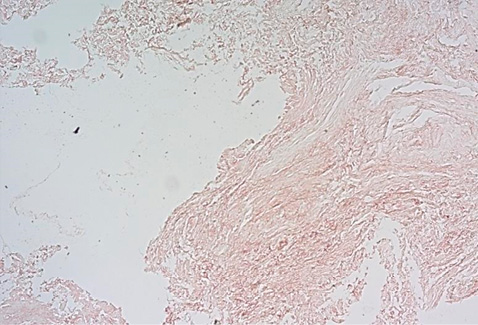
Рисунок 6. Тонкие хаотично переплетающиеся дезорганизованные пучки эластических волокон. Окраска орсеином, увеличение ×100.
Figure 6. Thin chaotically intertwined disorganized elastic fiber bundles. Stained with orcein, ×100.
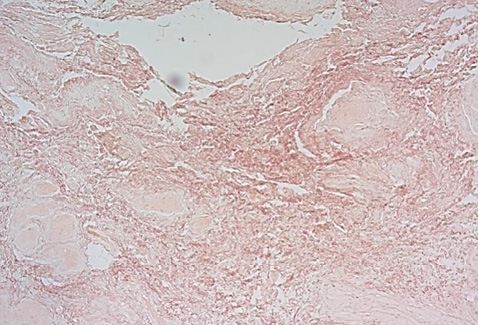
Рисунок 7. Преимущественное содержание хаотично расположенных эластических волокон в прослойках соединительной ткани. Окраска орсеином, увеличение ×100.
Figure 7. Predominance of randomly located elastic fibers in connective tissue layers. Stained with orcein, ×100.
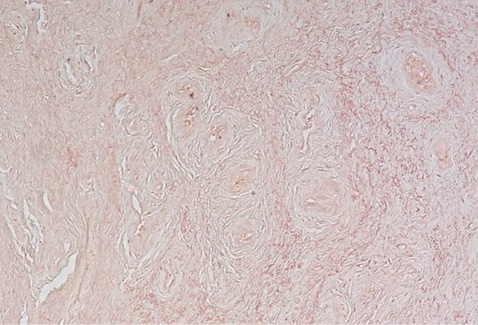
Рисунок 8. Толстостенные сосуды, между ними тонкие хаотично переплетающиеся пучки эластических волокон. Окраска орсеином, увеличение ×100.
Figure 8. Thick-walled vessels separated with thin chaotically intertwined elastic fiber bundles. Stained with orcein, ×100.
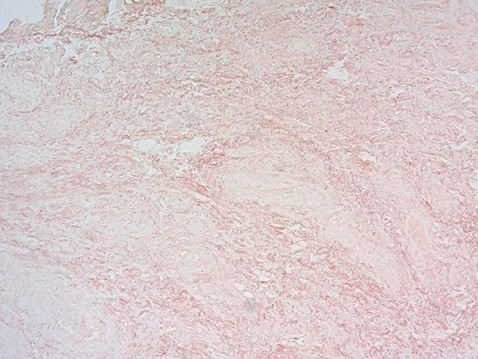
Рисунок 9. Тонкие пучки эластических волокон с изменённой структурой, окружающие сосуды с фибриноидным некрозом стенок. Окраска орсеином, увеличение ×100.
Figure 9. Thin elastic fiber bundles with a modified structure surrounding vessels with wall fibrinoid necrosis. Stained with orcein, ×100.

Рисунок 10. Толстостенные сосуды с фибриноидными изменениями стенок окружены небольшим количеством эластических волокон. Среди соединительной ткани пучки переплетаются хаотично, спирализация нарушена. Окраска орсеином, увеличение ×100.
Figure 10. Thick-walled vessels with wall fibrinoid changes surrounded by a small amount of elastic fibers. Among the connective tissue, the bundles intertwine chaotically, with altered spiralization. Stained with orcein, ×100.
Обсуждение / Discussion
В исследовании И.В. Краснопольской с соавт. были охарактеризованы изменения ткани парауретрального пространства у женщин с НМ и генитальным пролапсом как однонаправленные, в разной степени выраженные нарушения обмена веществ соединительной ткани. При изучении биоптатов выявлено выраженное нарушение метаболизма внеклеточного матрикса парауретральной ткани, о чем свидетельствует резкое повышение уровня матриксной металлопротеиназы 9 типа (ММР-9), участвующей в дезорганизации коллагена III типа [23]. Иммуногистохимические методы (в том числе определение уровня матриксных металлопротеиназ 2 и 9 типов) не были включены в наше исследование, в связи с чем изучение экстрацеллюрного матрикса не представлялось возможным. Нами были изучены особенности основы соединительной ткани – волокнистые структуры коллагенового и эластического типов.
По данным исследования А.И. Неймарка с соавт., определены морфологические изменения ткани парауретрального пространства у женщин с рецидивной формой НМ при напряжении. Особенностями гистоархитектоники явились дегенеративные изменения, фрагментация и увеличение толщины волокон коллагена с образованием полей склероза. Также были описаны такие отличительные ультраструктурные характеристики, как зернистый распад и снижение количества эластических волокон. Значительные изменения морфологической структуры приводят к утрате эластических свойств тканей, снижая способность к растяжению и повреждая мышечно-эластический каркас [24]. Полученные нами результаты сопоставимы с данными А.И. Неймарка, однако в нашем исследовании обращено большее внимание на оценку состояния сосудистой стенки в образцах. Например, фибриноидное набухание свидетельствует о повреждении эндотелия, выходе плазменных белков, что в конечном итоге может приводить к склерозированию сосудов, соответственно, ухудшению кровоснабжения тканей.
В работе С.М. Шаркова с соавт. при исследовании соединительной ткани у детей с уроандрологической патологией на фоне синдрома НСТД были выявлены следующие морфологические изменения: хаотичное и извитое расположение пучков коллагеновых волокон с одновременным их утолщением, в то время как эластические волокна были расположены неравномерно, искривлены или фрагментированы [25]. Морфологические изменения парауретральной ткани у женщин со стрессовой инконтиненцией схожи с теми, что были описаны в исследовании С.М. Шаркова.
Группой немецких авторов был проведен отбор биоптатов парауретральных тканей у 34 женщин во время оперативного лечения – установки субурет- ральной синтетической петли с последующим гистологическим изучением. В образцах, взятых у женщин со СНМ, обнаружено неравномерное фрагментарное распределение эластических волокон в ткани [26]. В проведенном нами исследовании также описано снижение общего количества эластических волокон по отношению к общей массе исследуемой ткани.
Значительное снижение содержания коллагена типа I в соединительной ткани у пациенток в постменопаузе по сравнению с пациентками в пременопаузе было обнаружено в исследовании итальянских ученых с применением иммуногистохимических методов. Результаты свидетельствуют о сниженной способности соединительной ткани в периуретральной области к ремоделированию у пациенток со стрессовой инконтиненцией в постменопаузальном периоде [27]. Изменение качественно-количественных характеристик коллагеновых волокон в составе соединительнотканного матрикса описаны и в нашем исследовании.
Заключение / Conclusion
Результаты, полученные в ходе исследования, выявили, что у женщин со стрессовой инконтиненцией в постменопаузе имеются выраженные нарушения архитектоники соединительной ткани. Структурные изменения, происходящие в парауретральной ткани, характеризуются фрагментацией волокон коллагена и эластина, критическим снижением их толщины и объема, разрушением прочных связей между волокнами, что свидетельствует о процессах распада коллаген-эластинового каркаса, являющегося структурной и функциональной единицей каркаса, непосредственно принимающего участие в удержании мочи. Дальнейшее исследование морфологических аспектов проблемы стрессовой инконтиненции, в том числе с применением иммуногистохимических методов исследования – определение уровня экспрессии матриксных металлопротеиназ, обеспечит более глубокое понимание патогенетических механизмов возникновения данного патологического состояния у конкретной женщины. Тем самым станет возможным осуществление персонифицированного подхода к тактике ведения и выбору метода лечения пациенток со СНМ с повышением его эффективности.
Список литературы
1. Аполихина И.А., Саидова А.С. Стрессовое недержание мочи. Акушерство и гинекология. 2019;(S3):20–5.
2. Цуканов А.Ю., Мирзакадиев А.А., Дункурс А.В. Объём-образующие вещества в лечении стрессового недержания мочи у женщин. Вестник урологии. 2020;8(2):99–106. https://doi.org/10.21886/2308-6424-2020-8-2-99-106.
3. Incontinence. Eds. P. Abrams, L. Cardozo, A. Wagg, A. Wein. 6th Edition. Bristol UK: International Continence Society, 2017. 2636 с. https://doi.org/10.1002/nau.23551.
4. Brennand E.A., Tang S., Birch C. et al. Five years after midurethral sling surgery for stress incontinence: obesity continues to have an impact on outcomes. Int Urogynecol J. 2017;28(3):621–8. https://doi.org/10.1007/s00192-016-3161-y.
5. Амиров А.Р., Лобкарев О.А., Бодрова Р.А. Факторы риска и этиология развития недержания мочи (обзор литературы). Аспирантский вестник Поволжья. 2019;19(1–2):140–8. https://doi.org/10.17816/2072-2354.2019.19.1.140-148.
6. Riemsma R., Hagen S., Kirschner-Hermanns R. et al. Can incontinence be cured? A systematic review of cure rates. BMC Med. 2017;15(1):63. https://doi.org/10.1186/s12916-017-0828-2.
7. Hannestad Y.S., Rortveit G., Sandvik H., Hunskaar S., Norwegian EPINCONT study. Epidemiology of Incontinence in the County of Nord Trøndelag. A community-based epidemiological survey of female urinary incontinence: the Norwegian EPINCONT study. Epidemiology of Incontinence in the County of Nord-Trøndelag. J Clin Epidemiol. 2000;53(11):1150–7. https://doi.org/10.1016/s0895-4356(00)00232-8.
8. Haylen B.T., de Ridder D., Freeman R.M. et al. An International Urogynecological Association (IUGA)/International Continence Society (ICS) joint report on the terminology for female pelvic floor dysfunction. Int Urogynecol J. 2010;21(1):5–26. https://doi.org/10.1007/s00192-009-0976-9.
9. Кира К.Е. Сравнительный анализ эффективности хирургического лечения стрессового недержания мочи с использованием синтетических имплантов или собственных тканей влагалища. Вестник национального медико-хирургического центра имени Н.И. Пирогова. 2020;15(2):74–9. https://doi.org/10.25881/BPNMSC.2020.15.13.012.
10. Касян Г.Р., Гвоздев М.Ю., Коноплянников А.Г., Пушкарь Д.Ю. Недержание мочи у женщин. Методические рекомендации № 4. М., 2017. 52 с. Режим доступа: https://mesyachnyedni.ru/docs/Недержание мочи у женщин от 2017.pdf. [Дата обращения: 15.10.2022].
11. Михельсон А.А., Луговых Е.В., Лазукина М.В. и др. Клинико-анамнестические предикторы развития стрессового недержания мочи у женщин. Гинекология. 2022;24(1):51–6. https://doi.org/10.26442/20795696.2022.1.201333.
12. Maiborodin I., Yarin G., Marchukov S. et al. Cell technologies in the stress urinary incontinence correction. Biomedicines. 2022;10(2):309. https://doi.org/10.3390/biomedicines10020309.
13. Petros P., Abendstein B. The mechanics of urethral closure, incontinence and midurethral sling repair. Part 1 original experimental studies (1990). Neurourol Urodyn. 2019;38(2):809–13. https://doi.org/10.1002/nau.23888.
14. Савицкий Г.А., Беженарь В.Ф., Савицкий А.Г. и др. Физиология и патология механизма удержания мочи у женщин: теоретические и практические аспекты проблемы (часть 2). Экспериментальная и клиническая урология. 2011;(4):16–22.
15. Пономарева И.В., Цуканов А.В., Затолокина М.А. и др. Сравнительная оценка реакции соединительной ткани на имплантаты для герниопластики с коллагенстимулирующим покрытием. Вестник Волгоградского государственного медицинского университета. 2022;19(1):106–11. https://doi.org/10.19163/1994-9480-2022-19-1-106-111.
16. Alarab M., Drutz H., Lye S. et al. Static mechanical loading influences the expression of extracellular matrix and cell adhesion proteins in vaginal cells derived from premenopausal women with severe pelvic organ prolapsed. Reprod Sci. 2016;23(8):978–92. https://doi.org/10.1177/1933719115625844.
17. Селихова М.С., Ершов Г.В., Ершов А.Г. Пролапс органов малого таза у женщин репродуктивного возраста. Международный научно-исследовательский журнал. 2020;(7–2):86–8. https://doi.org/10.23670/IRJ.2020.97.7.050.
18. Надточий А.В., Крутова В.А., Гордон К.В., Филиппов Ф.Е. Стратификация факторов риска рецидива генитального пролапса у женщин в менопаузальном периоде после хирургической коррекции (обзор литературы). Современные вопросы биомедицины. 2022;6(1). https://doi.org/10.51871/2588-0500_2022_06_01_5.
19. Wei A., Wang R., Wei K. et al. LncRNA and mRNA expression profiling in the periurethral vaginal wall tissues of postmenopausal women with stress urinary incontinence. Reprod Sci. 2020;27(7):1490–501. https://doi.org/10.1007/s43032-020-00144-3.
20. Тюзиков И.А., Жиленко М.И., Поликарпова С.Р. Современные возможности оптимизации локальной гормонотерапии урогенитальных нарушений у женщин на основе комбинированного применения вагинальных форм эстриола и прогестерона. Гинекология. 2018;20(1):117–25. https://doi.org/10.26442/2079-5696_20.1.117-125.
21. Краснопольская И.В., Карева Е.Н., Тихонов Д.А. Экспрессия рецепторов половых стероидов в парауретральной ткани пациенток с дисфункцией тазового дна. Доктор.Ру. 2018;(2):75–9.
22. Adamiak-Godlewska A., Tarkowski R., Winkler I. et al. Stress urinary incontinent women, the influence of age and hormonal status on estrogen receptor alpha and beta gene expression and protein immunoexpression in paraurethral tissues. J Physiol Pharmacol. 2018;69(1):53–9. https://doi.org/10.26402/jpp.2018.1.05.
23. Краснопольская И.В., Попов А.А., Горина Н.В. и др. Экспрессия генов белков метаболизма коллагена в парауретральной соединительной ткани у женщин с недержанием мочи и пролапсом органов малого таза. Российский вестник акушера-гинеколога. 2015;15(6):36–41. https://doi.org/10.17116/rosakush201515636-41.
24. Неймарк А.И., Раздорская М.В., Гервальд В.Я. и др. Анализ результатов оперативного лечения женщин с недержанием мочи: морфологические аспекты. Акушерство, Гинекология и Репродукция. 2012;6(4):13–5.
25. Шарков С.М., Васильева И.Г., Стрельников А.И., Полозов В.В. Сравнительная характеристика морфологических изменений и фенотипических маркеров дисплазии соединительной ткани у детей с различной уроандрологической патологией. Детская хирургия. 2018;22(3):120–3. https://doi.org/10.18821/1560-9510-2018-22-3-120-123.
26. Goepel C., Thomssen C. Changes in the extracellular matrix in periurethral tissue of women with stress urinary incontinence. Acta Histochem. 2006;108(6):441–5. https://doi.org/10.1016/j.acthis.2006.07.001.
27. Trabucco E., Soderberg M., Cobellis L. et al. Role of proteoglycans in the organization of periurethral connective tissue in women with stress urinary incontinence. Maturitas. 2007;58(4):395–405. https://doi.org/10.1016/j.maturitas.2007.09.010.
Об авторах
А. А. МихельсонРоссия
Михельсон Анна Алексеевна – д.м.н., доцент, руководитель отдела сохранения репродуктивной функции, зав. гинекологическим отделением
620028 Екатеринбург, ул. Репина, д. 1
Е. В. Луговых
Россия
Луговых Евгения Владимировна – аспирант, акушер-гинеколог
620028 Екатеринбург, ул. Репина, д. 1
М. В. Лазукина
Россия
Лазукина Мария Валерьевна – к.м.н., научный сотрудник, акушер-гинеколог
620028 Екатеринбург, ул. Репина, д. 1
Г. Н. Чистякова
Россия
Чистякова Гузель Нуховна – д.м.н., профессор, руководитель научного отдела иммунологии и клинической микробиологии, гинеколог
620028 Екатеринбург, ул. Репина, д. 1
А. А. Гришкина
Россия
Гришкина Анастасия Александровна – к.м.н., научный сотрудник, врач-патоморфолог, гинеколог
620028 Екатеринбург, ул. Репина, д. 1
М. А. Лукач
Россия
Лукач Мария Андреевна – врач-ординатор, акушер-гинеколог
620028 Екатеринбург, ул. Репина, д. 1
Рецензия
Для цитирования:
Михельсон А.А., Луговых Е.В., Лазукина М.В., Чистякова Г.Н., Гришкина А.А., Лукач М.А. Гистоархитектоника парауретральной ткани у женщин со стрессовым недержанием мочи. Акушерство, Гинекология и Репродукция. 2023;17(3):299-308. https://doi.org/10.17749/2313-7347/ob.gyn.rep.2023.368
For citation:
Mikhelson A.A., Lugovykh E.V., Lazukina M.V., Chistyakova G.N., Grishkina A.A., Lukach M.A. Histoarchitectonics of paraurethral tissue in women with stress urinary incontinence. Obstetrics, Gynecology and Reproduction. 2023;17(3):299-308. (In Russ.) https://doi.org/10.17749/2313-7347/ob.gyn.rep.2023.368

Контент доступен под лицензией Creative Commons Attribution-NonCommercial-ShareAlike 4.0 International License.










































