Перейти к:
Ранний неонатальный сепсис в эпоху COVID-19
https://doi.org/10.17749/2313-7347/ob.gyn.rep.2023.389
Аннотация
Введение. Ранний неонатальный сепсис (РНС) остается основной причиной серьезной заболеваемости и смертности во всех странах мира. На современном этапе особый интерес представляет влияние пандемии COVID-19 на заболеваемость другими инфекциями.
Цель: провести сравнительный анализ особенностей течения РНС у новорожденных до пандемии (2018) и на фоне пандемии (2021) COVID-19.
Материалы и методы. Выполнено ретроспективное когортное сплошное одноцентровое исследование. Обследовано 73 новорожденных с РНС, родившихся и госпитализированных в ГУЗ «Перинатальный центр» (ПЦ) на базе ГБУЗ КО КОКБ: группа 1 (n = 26) – период пребывания в ПЦ с января по октябрь 2018 г., группа 2 (n = 47) – период пребывания в ПЦ с января по октябрь 2021 г. Индикаторами тяжести РНС были выбраны потребность в назначении норадреналина, сурфактанта и свежезамороженной плазмы (СЗП).
Результаты. Заболеваемость РНС в 2021 г. в группе 2 была статистически значимо выше, чем в 2018 г. в группе 1: отношение шансов (ОШ) = 3,27; 95 % доверительный интервал (ДИ) = 1,57–6,40 (р = 0,001). В группе 1 по сравнению с группой 2 гестационный возраст, оценка по шкале Aпгар на 1-й и 5-й минутах были статистически значимо больше: 36,2 [33,3; 38,0] нед против 33,3 [28,5; 36,1] нед (р = 0,016), 7,0 [5,0; 7,0] баллов против 5,0 [3,0; 7,0] баллов (р = 0,019) и 8,0 [6,8; 8,0] баллов против 6,0 [5,0; 8,0] баллов (р = 0,012) соответственно. У детей с РНС в 2021 г. по сравнению с 2018 г. установлено статистически значимое увеличение потребности в назначении норадреналина – 42/47 и 16/26 детей (ОШ = 5,25; 95 % ДИ = 1,58– 17,44; р = 0,007), трансфузии СЗП – 47/47 и 19/26 детей (ОШ = 36,54; 95 % ДИ = 2,05–649,84: р < 0,001) и проведении сурфактантной терапии – 32/47 и 7/26 детей (ОШ = 5,79; 95 % ДИ = 2,04–16,45; р = 0,001). Летальность пациентов с РНС в 2021 г. по сравнению с 2018 г. была статистически значимо больше – 13/47 (21,3 %) против 2/26 (7,7 %) детей соответственно (ОШ = 9,56; 95 % ДИ = 1,22–74,96; р = 0,014).
Заключение. У новорожденных детей Калужской области выявлен статистически значимый рост заболеваемости РНС и смертности от него на фоне пандемии COVID-19. Зарегистрировано повышение в 2021 г. при РНС потребности в применении сурфактантной, вазопрессорной терапии и трансфузии СЗП.
Ключевые слова
Для цитирования:
Карпова А.Л., Мостовой А.В., Дудкина Е.А., Авдей О.В., Карпов Н.Ю. Ранний неонатальный сепсис в эпоху COVID-19. Акушерство, Гинекология и Репродукция. 2023;17(3):284-298. https://doi.org/10.17749/2313-7347/ob.gyn.rep.2023.389
For citation:
Karpova A.L., Mostovoi A.V., Dudkina E.А., Avdei O.V., Karpov N.Yu. Early neonatal sepsis in COVID-19 era. Obstetrics, Gynecology and Reproduction. 2023;17(3):284-298. (In Russ.) https://doi.org/10.17749/2313-7347/ob.gyn.rep.2023.389
Введение / Introduction
Ранний неонатальный сепсис (РНС) остается основной причиной серьезной заболеваемости и смертности во всех странах мира. Расчетная заболеваемость РНС в США и Западной Европе ежегодно составляет от 0,5 до 5,0 случаев на 1000 живорождений [1]. Согласно исследованию B.J. Stoll c соавт., проводившемуся в 2006–2009 гг., в которое было включено 396 586 живорожденных, РНС развился у 389 младенцев (0,98 случая на 1000 рожденных живыми) [2]. По данным J.F. Camargo c соавт. (2021), частота РНС составляет 4 случая на 1000 живорождений [3]. Манифестация РНС происходит в первые 72 ч после рождения [4], характеризуется наличием признаков генерализованного инфекционного процесса (как правило, это очаги инфекции, интоксикация), системной воспалительной реакции, полиорганной недостаточности (ПОН) и маркеров воспаления [5][6]. Маркерами воспаления, которые наиболее широко применяются в неонатальной практике с целью верификации наличия инфекции у новорожденного, считаются С-реактивный белок (СРБ) и прокальцитонин (ПКТ) [7].
Среди очагов инфекции при РНС наиболее часто встречаются пневмония и менингит. По данным J.F. Camargo c соавт. (2021), из 35 случаев РНС у 7 (20,0 %) детей была диагностирована пневмония, у 4 (11,4 %) детей – менингит [3]; по данным D. Isaacs с соавт. (1995), менингит может развиваться практически у каждого четвертого ребенка с РНС (23,0 %) [8]. Выявление последнего, по мнению T.E. Wiswell с соавт. (1995), может быть отложено или пропущено в случае отсутствия практики проведения при РНС люмбальной пункции [9]. Сравнивая заболеваемость менингитом новорожденных с РНС и без него, отдельный интерес представляет исследование P.B. Smith с соавт. (2008), которые, проведя в период с 1997 по 2004 гг. в 150 отделениях интенсивной терапии новорожденных когортное исследование, направленное на оценку результатов первой люмбальной пункции у 4632 новорожденных со сроком гестации менее 34 нед, выявили 95 (2,0 %) случаев менингита [10].
Спектр микроорганизмов, вызывающих РНС, достаточно разнообразен, однако лидирующие позиции во всем мире занимают стрептококки группы В и кишечная палочка [11]. Так, по данным B.J. Stoll с соавт. (2011), стрептококки группы В у детей с РНС выявляются в 43 % случаев (0,41 на 1000 живорождений), а кишечная палочка – в 29 % (0,28 на 1000 живорождений). Большинство детей со стрептококками группы В рождались доношенными (73 %); 81 % детей, у которых была обнаружена кишечная палочка, родились недоношенными [2]. Прогноз заболевания во многом зависит от гестационного возраста (менее 32 нед увеличивается риск летального исхода) и массы тела при рождении (уровень инфицирования увеличивается с уменьшением массы тела при рождении, низкая масса тела чаще связана с летальным исходом) [2][12], а также от тяжести полиорганных повреждений. РНС увеличивает риск развития тяжелых неврологических нарушений, в частности детского церебрального паралича [13][14], и в 3 раза чаще в группе детей с очень низкой массой тела приводит к летальному исходу [14].
На современном этапе особый интерес для исследователей во всем мире представляет влияние пандемии COVID-19 на различную заболеваемость младенцев. Так, D.D. Flannery с соавт. (2022) изучали респираторные заболевания в течение первого года пандемии COVID-19 у младенцев, родившихся во время первого пика COVID-19 [15]. N. Cimolai (2021) в своем обзоре рассуждает о том, что распространенность COVID-19 в эпоху пандемии гарантирует развитие сопутствующих инфекционных заболеваний (ко-инфекций) с различными многообразными патогенами [16]. S. Mittal с соавт. (2022) указывают на то, что пандемия COVID-19 привела к увеличению заболеваемости серьезными бактериальными инфекциями у младенцев с лихорадкой в возрасте 56 дней и младше [17]. Исследований, посвященных изучению особенностей течения РНС в эпоху пандемии COVID-19, при анализе баз PubMed, Google Scolar с использованием поисковых фраз, включавших «early-onset sepsis», «neonatal sepsis», «SARS-CoV-2», «COVID-19», «severe congenital infection», «bacterial neonatal sepsis», ограниченное количество. В ходе поиска публикаций в отечественной базе данных eLibrary.Ru и научной электронной библиотеке «КиберЛенинка», посвященных влиянию пандемии COVID-19 на течение РНС, нам не удалось обнаружить подобные работы, поэтому мы предприняли попытку проведения собственного исследования, которое позволило бы объективизировать последствия пандемии COVID-19 для новорожденных с РНС.
Цель: провести сравнительный анализ особенностей течения РНС у новорожденных до пандемии (2018) и на фоне пандемии (2021) COVID-19.
Материалы и методы / Materials and Methods
Дизайн исследования / Study design
Ретроспективное когортное сплошное исследование проводилось в условиях одного центра; обследовали новорожденных с РНС, родившихся и госпитализированных в ГУЗ «Перинатальный центр» (ПЦ) на базе ГБУЗ КО КОКБ; размер выборки не рассчитывался. Выполняли анализ медицинской документации (историй болезни). Пациенты, получавшие высокотехнологическую помощь в условиях отделения реанимации и интенсивной терапии новорожденных (ОРИТН), находились на лечении в периоды с 01.01.2018 по 01.11.2018 и с 01.01.2021 по 01.11.2021.
Критерии включения и исключения / Inclusion and exclusion criteria
Критерии включения: наличие у новорожденного РНС (критерии постановки диагноза РНС определены чек-листом, который был утвержден в ГБУЗ КО КОКБ (см. приложение); наличие в истории болезни пациента информации, соответствующей первичным переменным данного исследования (параметры искусственной вентиляции легких (ИВЛ), потребность в респираторной терапии, показатели витальных функций, значения лабораторных показателей, газового состава крови, наличие микробиологического исследования из различных локусов, потребность в применении норадреналина, дополнительного введения сурфактанта, трансфузии свежезамороженной плазмы).
Критерии исключения: тяжелые врожденные пороки развития; хромосомные и/или генетические аномалии; отечная форма гемолитической болезни новорождённых; неиммунная водянка плода.
Группы исследования / Study groups
Всего критериям включения отвечали 73 новорож-денных, родившихся и находившихся на госпитализации в ГУЗ ПЦ (Калуга). Все дети были разделены на 2 группы: группа 1 – 26 детей с РНС находились на госпитализации в ПЦ в период 01.01.2018 по 01.11.2018, группа 2 – 47 детей с РНС находились на госпитализации в ПЦ с 01.01.2021 по 01.11.2021 (рис. 1).
Методы исследования / Study methods
Оценивали следующие клинические показатели: особенности течения беременности и родов; массу тела, длину тела и гестационный возраст (ГВ) при рождении; баллы по шкале Апгар на 1-й и 5-й минутах после рождения; потребность в интубации трахеи в родильном зале; возраст манифестации РНС; потребность в проведении ИВЛ и высокочастотной осцилляторной ИВЛ (ВЧО ИВЛ); максимальные показатели фракции кислорода (FiO2) и среднего давления в дыхательных путях (англ. mean airway pressure, МАР) в первые 72 ч жизни; самые низкие из зафиксированных в истории болезни показатели среднего артериального давления (АД) и самые высокие показатели частоты сердечных сокращений (ЧСС); наличие тахикардии. За тахикардию принимали ЧСС более 160 ударов в минуту [18].
Среди лабораторных показателей анализировали содержание в крови глюкозы, лактата, С-реактивного белка (СРБ), прокальцитонина (ПКТ), количество лейкоцитов и значения нейтрофильного индекса (НИ), показатель дефицита оснований (ВЕ); проведен анализ высеваемой из различных локусов флоры. НИ рассчитывали по формуле [19]: НИ = незрелые нейтрофилы/общее количество нейтрофилов.
Индикаторами тяжести течения РНС среди лечебных мероприятий были выбраны такие характеристики, как потребность в назначении норадреналина, сурфактанта и свежезамороженной плазмы (СЗП), среди ближайших исходов – тяжелое внутрижелудочковое кровоизлияние (ВЖК) 3–4-й степени согласно классификации L. Papile с соавт. [20] и летальный исход.
Все беременные и роженицы, у которых дети заболели РНС в 2021 г., на момент родов не демонстрировали признаков, характерных для инфекции COVID-19. Поиск антигена SARS-CoV-2 и антител к нему у матерей и детей, включенных в исследование, не проводился.
Этические аспекты / Ethical aspects
Субъекты исследования получали лечение в условиях рутинной клинической практики, база данных была обезличена, исследование носило ретроспективный описательный характер и было проведено в соответствии с этическими стандартами Хельсинской декларации Всемирной медицинской ассоциации 1964 г. и ее последующими изменениями.
Статистический анализ / Statistical analysis
Сбор данных осуществляли путем заполнения деперсонифицированной индивидуальной регистрационной карты (ИРК). Далее собранная информация загружалась в деперсонифицированную базу данных с использованием электронных таблиц Microsoft Office Excel (2016). Статистическая обработка результатов проводилась с использованием Microsoft Excel и SPSS 17.0. Количественные показатели оценивали на предмет соответствия нормальному распределению, для этого использовали критерий Шапиро–Уилка. В случае описания количественных показателей, имевших нормальное распределение, проводили расчет средних арифметических величин (M) и стандартных отклонений (SD). При сравнении средних величин в нормально распределенных совокупностях количественных данных рассчитывали t-критерий Стьюдента. Совокупности количественных показателей, распределение которых отличалось от нормального, описывали при помощи значений медианы и нижнего и верхнего квартилей (Me [Q1; Q3]). Для сравнения несвязанных выборок применяли U-критерий Манна–Уитни. Результаты качественных признаков выражены в абсолютных числах с указанием долей (%). Сравнение номинальных данных в группах проводили при помощи критерия Фишера. Статистически значимыми считали различия при p ≤ 0,05.
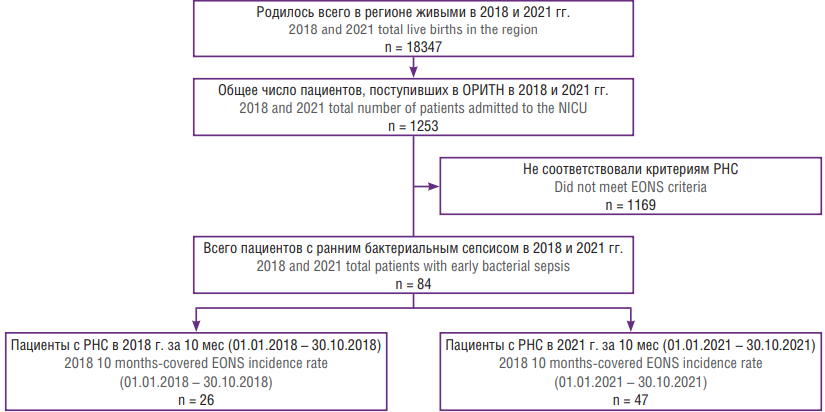
Рисунок 1. Потоковая диаграмма, характеризующая порядок отбора пациентов в исследование.
Примечание: ОРИТН – отделение реанимации и интенсивной терапии новорожденных; РНС – ранний неонатальный сепсис.
Figure 1. Flowchart characterizing the order for patient selection in the study.
Note: NICU – neonatal intensive care unit; EONS – еarly-onset neonatal sepsis.
Результаты / Results
Анализ заболеваемости ранним неонатальным сепсисом / Incidence rate of еarly-onset neonatal sepsis
Заболеваемость РНС за один и тот же период времени (с 1 января по 1 ноября), но с разницей в 3 года, в одном из которых (2018 г.) не было пандемии COVID-19 (n = 26), в 2021 г. (n = 47) статистически значимо выросла по сравнению с 2018 г. (отношение шансов (ОШ) = 3,27; 95 % доверительный интервал (ДИ) = 1,57–6,40; р = 0,001). При этом особенности течения беременности и родов по основным изучаемым в нашем исследовании индикаторам в обеих группах не имели статистически значимых различий (рис. 2).
Анализ основных клинических характеристик / Analysis of the major clinical characteristics
Основные клинические характеристики новорожденных с РНС в зависимости от года рождения представлены в таблице 1.
Как видно из таблицы 1, новорожденные, заболевшие РНС, статистически значимо различались по гестационному возрасту и оценке по шкале Апгар с более низкими значениями данных показателей в 2021 г. в сравнении с 2018 г. Несмотря на то что дети группы 2 были менее зрелыми, средняя масса тела (M ± SD) обеих групп не различалась статистически значимо и составляла в 2018 г. 2608,0 ± 762,0 г, в 2021 г. – 2214,0 ± 1008,0 г. (Student t-тест, р = 0,064). Манифестация РНС статистически значимо раньше была в 2021 г., когда минимальный возраст начала заболевания приходился на первый час жизни, максимальный – на второй час жизни. В 2018 г. самое ранее начало РНС было также зарегистрировано на первом часу жизни, а самое позднее – в возрасте 11 ч жизни ребенка (р = 0,031), при этом в 2021 г. более ранее начало РНС статистически значимо чаще сопровождалось потребностью в интубации трахеи уже в родильном зале (ОШ = 3,04; 95 % ДИ = 1,14–8,13; р = 0,031).
Полиорганная недостаточность у детей с РНС проявлялась поражением четырех систем и более, в частности, в 100,0 % случаев развитием тяжелой дыхательной недостаточности (ДН) с потребностью в проведении ИВЛ. При этом тяжесть ДН у детей в 2021 г. была статистически значимо более выраженной, учитывая то, что они нуждались в более высокой FiO2 (р = 0,001), а также на основании статистически значимо более часто возникающей потребности в проведении ВЧО ИВЛ (ОШ = 4,67; 95 % ДИ = 1,70–12,82; р = 0,005). У всех детей с РНС имел место дистрибутивный шок, который в подавляющем большинстве случаев сопровождался развитием тахикардии. В группе 1 тахикардию регистрировали у 25 из 26 (96,2 %) детей, в группе 2 – у 26 из 36 (72,2 %) детей (ОШ = 0,10; 95 % ДИ = 0,01–0,84; Fisher exact test, р = 0,018). Процентильное распределение максимальных показателей ЧСС и среднего АД представлено в таблице 2.
Медиана минимального среднего АД из всех зарегистрированных его значений в ходе терапии септического шока демонстрирует снижение среднего АД в 2018 г. до 27 [ 23,7; 29,0] мм рт. ст., в 2021 г. – до 25 [ 19,7; 30,0] мм рт. ст. Медиана максимальных значений тахикардии в 2021 г. – 200,0 [ 190,0; 210,0] ударов в минуту статистически значимо превышала таковую в 2018 г. – 190,0 [ 180,0; 200,0] ударов в минуту (р = 0,029). Тахикардия могла развиться на фоне фебрильной лихорадки, однако последняя статистически значимо чаще встречалась у детей группы 1 в сравнении с группой 2 – у 16 из 26 (61,5 %) и 14 из 47 (33,3 %) детей, соответственно (ОШ = 0,31; 95 % ДИ = 0,11–0,85; Fisher exact test, р = 0,027). Из других, характерных для РНС проявлений, легочное кровотечение встречалось в обеих группах с практически одинаковой частотой: в 2018 г. у 3 из 26 (11,5 %) детей, в 2021 г. – у 8 из 47 (17,0 %) детей (ОШ = 1,57; 95 % ДИ = 0,39–6,37; Fisher exact test, р = 0,736). В 2018 г. менингит на фоне РНС диагностировали у каждого четвертого ребенка. Менингитов в 2021 г. выявлено меньше, чем в 2018 г., однако данные различия не были статистически значимы: 7 из 47 (14,9 %) в группе 2 и 6 из 26 (23,1 %) в группе 1 (ОШ = 0,58; 95 % ДИ = 0,18–1,93; Fisher exact test, р = 0,524).
Анализ основных лабораторных показателей / Analysis of the main laboratory parameters
Динамика основных лабораторных показателей в первые 72 ч жизни, отражающих тяжесть течения инфекционного процесса и выраженность гемодинамических нарушений, представлена в таблице 3.
Лабораторные показатели у обследованных (табл. 3) свидетельствуют, что в большинстве случаев при РНС развивалась гипергликемия – в 2018 г. у 65,4 % детей, в 2021 г. – у 80,4% детей (ОШ = 2,24; 95 % ДИ = 0,77–6,52, Fisher exact test, р = 0,165), которая достигала 33,0 ммоль/л; количество лейкоцитов в крови в 2018 г. колебалось от 2,27×109/л до 88,11×109/л, существенно не отличаясь от значений в 2021 г.; НИ при РНС достигал 0,63–0,74, уровень СРБ в крови – 127,2 мг/л, а ПКТ – 100,0 нг/мл. Повышение в крови уровня лактата и ВЕ иллюстрирует тяжесть нарушений перфузии в тканях на фоне септического шока.
Анализ бактериологического исследования / Bacteriological analysis
Результаты бактериологического исследования материала, отобранного у детей в первые часы жизни из различных локусов (анус, носоглотка, эндотрахеальная трубка, кровь), представлены на рисунке 3.
Спектр микроорганизмов, которые обнаруживались у новорожденных с РНС при проведении бактериологического исследования материала, отобранного из разных локусов в первые минуты жизни ребенка, демонстрирует достаточно выраженное разнообразие бактерий с преобладанием кишечной палочки и эпидермального стафилококка. Все представленные на рисунке 3 микроорганизмы встречались в единичных случаях и по частоте регистрации не имели статистически значимых различий между группами. Доля положительных результатов бактериологического исследования из любого локуса в общей группе включенных в исследование новорожденных (n = 73) составила 34,3 %, рост бактерий в крови встречался в единичных случаях – 3 из 73 (4,1 %) положительных результата.
Анализ патогенетической терапии / Analysis of pathogenetic therapy
Результаты сравнительного анализа патогенетической терапии у новорожденных с РНС – назначение вазоконстрикторной терапии (норадреналин) в ходе купирования септического шока, сурфактантной терапии в лечении ДН и трансфузии СЗП в связи с развитием ДВС-синдрома представлены на рисунке 4.
На рисунке 4 наглядно продемонстрировано статистически значимое увеличение потребности новорожденных с РНС в 2021 г. в сравнении с 2018 г. в назначении норадреналина – 42/47 и 16/26 детей соответственно (ОШ = 5,25; 95 % ДИ = 1,58–17,44; Fisher exact test, р = 0,007), трансфузии СЗП – 47/47 и 19/26 детей соответственно (ОШ = 36,54; 95 % ДИ = 2,05–649,84; Fisher exact test, р < 0,001) и проведении сурфактантной терапии – 32/47 и 7/26 детей соответственно (ОШ = 5,79; 95 % ДИ = 2,04–16,45; Fisher exact test, р = 0,001).
Анализ неблагоприятных исходов РНС выявил статистически значимое увеличение количества неонатальных потерь среди новорожденных с РНС в 2021 г. в сравнении 2018 г. – 13/47 (21,3 %) против 2/26 (7,7 %) детей соответственно (ОШ = 9,56; 95 % ДИ = 1,22–74,96; Fisher exact test, р = 0,014). При этом заболеваемость ВЖК 3-й степени также имела тенденцию к росту в 2021 г., однако данные различия не были статистически значимыми – 10/47 (27,2 %) против 1/26 (3,9 %) ребенка соответственно (ОШ = 3,24; 95 % ДИ = 0,67–15,66; Fisher exact test, р = 0,192).
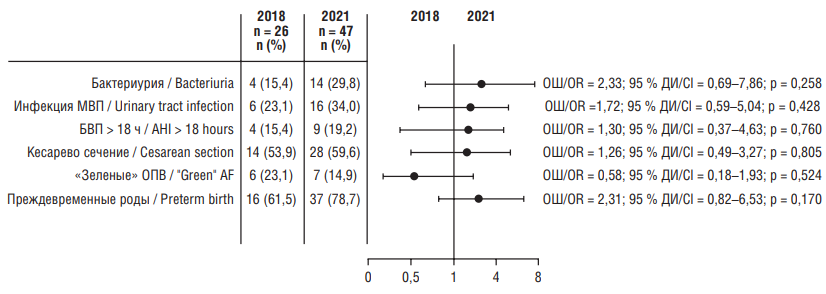
Рисунок 2. Особенности течения беременности и родов.
Примечание: МВП – мочевыводящие пути; БВП – безводный промежуток; ОПВ – околоплодные воды; ОШ – отношение шансов; ДИ – доверительный интервал.
Figure 2. Features of the course of pregnancy and delivery.
Note: UT – urinary tract; AHI – anhydrous interval; AF – amniotic fluid; OR – odds ratio; CI – confidence interval.
Таблица 1. Основные клинические характеристики новорожденных с ранним неонатальным сепсисом в зависимости от года рождения.
Table 1. Major clinical characteristics of neonates with early-onset neonatal sepsis depending on the year of birth.
|
Параметр Parameter |
Группа 1 (2018) Group 1 (2018) n = 26 |
Группа 2 (2021) Group 2 (2021) n = 47 |
р |
|
Мужской пол, n (%) Male, n (%) |
17 (65,4) |
30 (63,8) |
0,648* |
|
Гестационный возраст, нед, Ме [Q1; Q3] Gestational age, weeks, Me [Q1; Q3] |
36,2 [ 33,3; 38,0] |
33,3 [ 28,5; 36,1] |
0,016** |
|
Масса тела при рождении, г, Ме [Q1; Q3] Body weight at birth, g, Me [Q1; Q3] |
2610,0 [ 2138,0; 2963,0] |
2200,0 [ 1340,0; 3070,0] |
0,094** |
|
Оценка по шкале Апгар на 1-й мин, баллы, Ме [Q1; Q3] Apgar score at minute 1, points, Me [Q1; Q3] |
7,0 [ 5,0; 7,0] |
5,0 [ 3,0; 7,0] |
0,019** |
|
Оценка по шкале Апгар на 5-й мин, баллы, Ме [Q1; Q3] Apgar score at minute 5, points, Me [Q1; Q3] |
8,0 [ 6,8; 8,0] |
6,0 [ 5,0; 8,0] |
0,012** |
|
Возраст манифестации РНС, ч, Ме [Q1; Q3] Age of EONS manifestation, hours, Me [Q1; Q3] |
1,0 [ 1,0; 1,0] |
1,0 [ 1,0; 1,0] |
0,031** |
|
Интубация трахеи в родильном зале, n (%) Tracheal intubation in delivery room, n (%) |
9 (34,6) |
29 (61,7) |
0,031* |
|
Искусственная вентиляция легких (ИВЛ), n (%) Mechanical lung ventilation (MLV), n (%) |
26 (100,0) |
47 (100,0) |
1,000* |
|
Потребность в высокочастотной осцилляторной ИВЛ, n (%) Required high-frequency oscillatory MLV, n (%) |
10 (38,5) |
35 (74,5) |
0,005* |
|
Максимальная фракция кислорода (FiO2) в первые 72 ч жизни, Ме [Q1; Q3] Maximum fraction of inspiratory oxygen (FiO2) within the first 72 hours of life, Me [Q1; Q3] |
0,43 [ 0,25; 1,00] |
1,00 [ 0,55; 1,00] |
0,001** |
|
Максимальное среднее давление в дыхательных путях (MAP) в первые 72 ч жизни, см вод. ст., Ме [Q1; Q3] The maximum mean airway pressure (MAP) within the first 72 hours of life, cm H2O, Me [Q1; Q3] |
10,8 [ 8,3; 17,5] |
15,0 [ 10,0; 18,0] |
0,126 |
Примечание: р – значимость различий; * – точный критерий Фишера; ** – U-критерий Манна–Уитни: выделены значимые различия.
Note: р – significance of differences; * – Fisher's exact test; ** – Mann–Whitney U-test; significant differences highlighted.
Таблица 2. Процентильное распределение значений среднего артериального давления (АД) и частоты сердечных сокращений (ЧСС) у новорожденных с ранним неонатальным сепсисом в зависимости от года рождения.
Table 2. Percentile distribution of mean arterial pressure (BP) and heart rate (HR) in neonates with early-onset neonatal sepsis depending on the year of birth.
|
Параметр Parameter |
Медиана Median (Me) |
Процентили / Percentiles |
p |
||||||
|
5 |
10 |
25 |
50 |
75 |
90 |
95 |
|||
|
Минимальное среднее АД, мм рт. ст., 2018 Minimum mean BP, mm Hg, 2018 (n = 26) |
27,0 |
18,1 |
21,4 |
23,7 |
27,0 |
29,0 |
30,3 |
31,6 |
0,364 |
|
Минимальное среднее АД, мм рт. ст., 2021 Minimum mean BP, mm Hg, 2021 (n = 42) |
25,0 |
12,0 |
13,0 |
19,7 |
25,0 |
30,0 |
31,4 |
32,8 |
|
|
Максимальная ЧСС, ударов в минуту, 2018 Maximum HR, beats per minute, 2018 (n = 26) |
190,0 |
157,0 |
170,0 |
180,0 |
190,0 |
200,0 |
213,0 |
220,0 |
0,029 |
|
Максимальная ЧСС, ударов в минуту, 2021 Maximum HR, beats per minute, 2021 (n = 27) |
200,0 |
170,0 |
170,0 |
190,0 |
200,0 |
210,0 |
220,0 |
220,0 |
|
Примечание: АД – артериальное давление; ЧСС – частота сердечных сокращений; р – значимость различий (U-критерий Манна–Уитни).
Note: BP – blood pressure; HR – heart rate; p – significance of differences (Mann–Whitney U-test).
Таблица 3. Процентильное распределение лабораторных показателей у новорожденных с ранним неонатальным сепсисом в зависимости от года рождения в первые 72 ч жизни.
Table 3. Percentile distribution of laboratory parameters in neonates with early-onset neonatal sepsis depending on the year of birth within the first 72 hours of life.
|
Параметр Parameter |
Медиана Median (Me) |
Процентили / Percentiles |
p |
||||||
|
5 |
10 |
25 |
50 |
75 |
90 |
95 |
|||
|
Максимальный уровень глюкозы в крови, ммоль/л, 2018 Maximum blood glucose level, mmol/L, 2018 (n = 17/26) |
11,90 |
7,10 |
7,42 |
8,00 |
11,90 |
19,00 |
20,68 |
– |
0,072 |
|
Максимальный уровень глюкозы в крови, ммоль/л, 2021 Maximum blood glucose level, mmol/L, 2021 (n = 39/47) |
16,00 |
10,10 |
11,00 |
12,40 |
16,00 |
18,10 |
23,30 |
33,00 |
|
|
Максимальное количество лейкоцитов, ×109/л, 2018 Maximum leukocyte count, ×109/L, 2018 (n = 26/26) |
21,00 |
2,27 |
3,37 |
10,07 |
21,00 |
32,83 |
55,48 |
88,11 |
0,558 |
|
Максимальное количество лейкоцитов, ×109/л, 2021 Maximum leukocyte count, ×109/L, 2021 (n = 46/47) |
20,13 |
9,55 |
11,36 |
15,17 |
20,13 |
30,97 |
49,24 |
65,11 |
|
|
Нейтрофильный индекс, 2018 Neutrophilic index, 2018 (n = 26/26) |
0,21 |
0,08 |
0,12 |
0,14 |
0,21 |
0,29 |
0,56 |
0,74 |
0,738 |
|
Нейтрофильный индекс, 2021 Neutrophilic index, 2021 (n = 46/47) |
0,21 |
0,06 |
0,08 |
0,13 |
0,21 |
0,31 |
0,46 |
0,63 |
|
|
Уровень СРБ в крови, мг/л, 2018 Blood CRP level, mg/L, 2018 (n = 21/26) |
12,00 |
2,21 |
4,28 |
8,46 |
12,00 |
22,65 |
51,56 |
85,84 |
0,203 |
|
Уровень СРБ в крови, мг/л, 2021 Blood CRP level, mg/L, 2021 (n = 47/47) |
9,40 |
0,44 |
0,97 |
3,80 |
9,40 |
16,60 |
55,94 |
127,20 |
|
|
Уровень ПКТ в крови, нг/мл, 2021 Blood PCT level, ng/ml, 2021 (n = 33/47) |
7,12 |
0,00 |
0,00 |
0,04 |
7,12 |
17,30 |
100,00 |
100,00 |
– |
|
Уровень лактата в крови, ммоль/л, 2018 Blood lactate level, mmol/L, 2018 (n = 24/26) |
5,60 |
2,03 |
2,75 |
3,60 |
5,60 |
9,58 |
14,00 |
16,00 |
0,175 |
|
Уровень лактата в крови, ммоль/л, 2021 Blood lactate level, mmol/L, 2021 (n = 47/47) |
4,90 |
1,78 |
2,20 |
2,70 |
4,90 |
7,50 |
11,60 |
13,60 |
|
|
Максимальное отклонение ВЕ в крови, 2018 Blood BE maximum change, 2018 (n = 26/26) |
–5,75 |
–14,97 |
–13,15 |
–10,13 |
–5,75 |
–3,15 |
–2,41 |
–2,20 |
0,187 |
|
Максимальное отклонение ВЕ в крови, 2021 Blood BE maximum change, 2021 (n = 46/47) |
–8,05 |
–13,97 |
–13,34 |
–10,63 |
–8,05 |
–5,48 |
–3,97 |
–2,71 |
|
Примечание: СРБ – С-реактивный белок; ПКТ – прокальцитонин; ВЕ – буферные основания крови; р – значимость различий (U-критерий Манна–Уитни).
Note: CRP – C-reactive protein; PCT – procalcitonin; BE – blood buffer base; p – significance of differences (Mann–Whitney U-test).
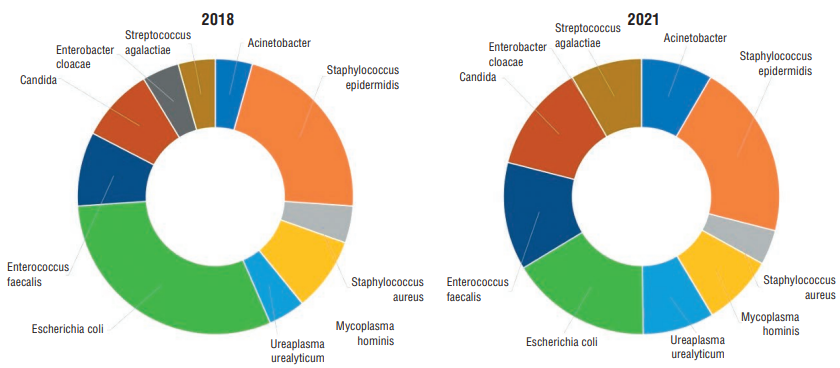
Рисунок 3. Спектр микроорганизмов из различных локусов, обнаруженных у новорожденных детей с ранним неонатальным сепсисом в зависимости от года рождения.
Figure 3. Spectrum of microorganisms derived from diverse loci found in neonates with early-onset neonatal sepsis depending on the year of birth.
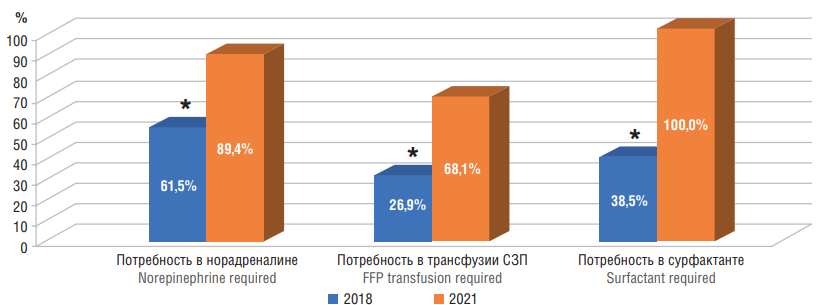
Рисунок 4. Потребность в патогенетической терапии новорожденных с ранним неонатальным сепсисом в зависимости от года рождения.
Примечание: СЗП – свежезамороженная плазма; *p < 0,05 – различия статистически значимы по сравнению с 2021 годом.
Figure 4. Pathogenetic therapy required in neonates with early-onset neonatal sepsis depending on the year of birth.
Note: FFP – fresh frozen plasma; *p < 0.05 – significant differences compared to 2021.
Обсуждение / Discussion
Результаты нашего исследования наглядно продемонстрировали ухудшение ситуации по заболеваемости младенцев ранним неонатальным сепсисом в Калужской области в эпоху пандемии COVID-19, связанное не только с увеличением частоты РНС, но и с усугублением тяжести течения заболевания, что привело к росту количества летальных исходов среди новорожденных, страдающих РНС. На фоне пандемии COVID-19 РНС чаще развивался у более незрелых детей, которые демонстрировали характерную симптоматику в более раннем возрасте (чаще на первом часу жизни), нередко по тяжести ДН нуждаясь в интубации трахеи уже в родильном зале, а в последующем в 2 раза чаще в переводе на ВЧО ИВЛ. В 2021 г. ново- рожденным с РНС значительно чаще требовалось применение экзогенного сурфактанта, норадреналина и СЗП. Увеличение потребности в сурфактантной терапии также можно объяснить более низким ГВ у детей с РНС в 2021 г., более частое назначение норадреналина следует считать отражением тяжести течения септического шока, высокая потребность в трансфузии СЗП – индикатор частоты и тяжести ДВС-синдрома.
В то же время в 2021 г. в сравнении с 2018 г. несколько реже диагностировался менингит (14,9 % против 23,1 % соответственно) и в 2 раза реже встречалась неонатальная лихорадка. Тем не менее наши данные согласуются с результатами исследования D. Isaacs с соавт. (1995), согласно которым частота развития менингита на фоне РНС составляет 23 % [8]. Неонатальная лихорадка в 2021 г. как один из основных диагностических критериев наличия неонатального сепсиса, по нашим данным, регистрировалась у младенцев с РНС в 33,3 % случаев (в 61,5 % в 2018 г.), что перекликается с мнением A.C. Helguera-Repetto с соавт. (2020), которые указывают на встречаемость лихорадки при РНС в 30,1 % случаев [21].
Среди микроорганизмов, которые выявлялись у новорожденных с РНС из различных локусов при проведении бактериологического исследования, по нашим данным, лидировали кишечная палочка и эпидермальный стафилококк, а стрептококки группы В встречались эпизодически, что несколько расходится с данными S. Mukhopadhyay с соавт. (2015), которые проводили свое исследование в двух госпиталях (в одном с 1990 по 2007 гг., в другом с 2006 по 2009 гг.). Большинство микроорганизмов, которые обсуждаются в этой работе как этиологически значимые при развитии РНС, обычно колонизируют желудочно-кишечный и мочеполовой тракты матери. При этом грамположительные бактерии встречаются в 2 раза чаще в сравнении с грамотрицательными, с преобладанием стрептококков группы В и кишечной палочки и крайне редкой встречаемостью стафилококков [11]. В то же время, по данным J.F. Camargo с соавт. (2021), у 35 новорожденных детей с РНС и с ГВ ≥ 35 нед в период с января 2016 г. по декабрь 2019 г. культурально подтвержденный сепсис был вызван S. pneumoniae, S. epidermidis и S. agalactiae [3].
Летальность в 2021 г. младенцев с РНС в нашем исследовании составила 21,3 %, что несколько превышает данные B.J. Stoll с соавт., в работе которых в 2011 г. частота летальных исходов среди инфицированных младенцев составляла 16 %. Причем авторы акцентируют внимание на том, что среди умерших новорожденных в 33 % случаев в качестве этиологически значимого бактериального агента преобладала кишечная палочка [2], которая также лидировала и по нашим данным. Ростом неблагоприятных исходов у новорожденных в эпоху пандемии COVID-19 озаботились исследователи во всем мире. В частности, по данным F. Indrio с соавт. (2021), в отделении интенсивной терапии, где исходная частота выживаемости новорожденных была высокой, зарегистрировано значительное снижение частоты выживаемости [22].
Мы предполагаем, что росту летальности от РНС в Калужской области в 2021 г. мог способствовать, во-первых, более ранний ГВ на момент родов у детей с РНС, родившихся в 2021 г., что перекликается с мнением A. Palatnik с соавт. (2019), которые считают, что более ранний ГВ сопряжен с более высокой заболеваемостью и смертностью при развитии РНС [12]. Во-вторых, с учетом мнения N. Cimolai (2021), распространенность COVID-19 способствует развитию сопутствующих инфекционных заболеваний (ко-инфекций) с различными многообразными патогенами [16], а перенесенный во время беременности COVID-19 влияет на развитие тяжелой неонатальной заболеваемости (ОШ = 2,66; 95 % ДИ = 1,69–4,18], в том числе сепсиса и смертности (ОШ = 2,14; 95 % ДИ = 1,66–2,75) [23]. Данное обстоятельство может быть связано с влиянием материнской инфекции SARS-CoV-2 на любом из сроков беременности на формирование иммунного профиля новорожденного и развитие многочисленных иммунологических нарушений у детей, связанных с воздействием вируса на мать во время беременности; при этом вертикальная передача вируса SARS-CoV-2 может не происходить. Влияние перенесенного COVID-19 на состояние иммунной системы развивающегося плода окончательно не установлено, однако отмечено увеличение процента незрелых иммунокомпетентных клеток и повышение функциональной активности цитокинов у новорожденных, что в свою очередь может усугубить риск развития различных инфекционных процессов в перинатальном периоде [24].
Ограничения исследования / Study limitations
Ограничения нашего исследования заключаются в том, что оно носит ретроспективный характер, пациенты набирались когортно в соответствии с критериями включения, без определённого принципа и стратификации. Ретроспективный характер анализа исключил более полноценное обследование детей с РНС, рожденных в 2021 г., на инфекцию COVID-19, поскольку в рутинной практике при отсутствии указаний на наличие у беременной в родах инфекции, вызванной вирусом SARS-CoV-2, поиск антигена SARS-CoV-2 или антител у матери и новорожденного для выявления COVID-19 не являлся обязательным. Другими ограничениями явились малое количество наблюдений и наличие разницы по ГВ между группами. Результаты нашей работы диктуют необходимость в проведении отечественного проспективного, хорошо спланированного, многоцентрового, когортного обсервационного исследования по изучению особенностей течения РНС на современном этапе.
Заключение / Conclusion
На фоне пандемии COVID-19 у новорожденных Калужской области отмечен рост заболеваемости ранним неонатальным сепсисом, особенно среди недоношенных новорожденных, ухудшение тяжести течения РНС с повышением потребности в применении сурфактантной, вазопрессорной терапии и трансфузии СЗП, увеличение частоты летальных исходов от РНС.
Дополнительная информация / Supplementary Information
В приложении 1 содержится обоснование клинического диагноза (чек-лист по неонатальному сепсису). Приложение размещено после данной статьи и он-лайн на интернет-сайте журнала «Акушерство, Гинекология и Репродукция» https://gynecology.su
Список литературы
1. Avery’s neonatology board review: certification and clinical refresher. Ed. P.R. Chess. Elsevier, 2019. 589 р.
2. Stoll B.J., Hansen N.I., Sánchez P.J. et al.; Eunice Kennedy Shriver National Institute of Child Health and Human Development Neonatal Research Network. Early onset neonatal sepsis: the burden of group B Streptococcal and E. coli disease continues. Pediatrics. 2011;127(5):817–26. https://doi.org/10.1542/peds.2010-2217.
3. Camargo J.F., Caldas J.P.S., Marba S.T.M. Early neonatal sepsis: prevalence, complications and outcomes in newborns with 35 weeks of gestational age or more. Rev Paul Pediatr. 2021;40:e2020388. https://doi.org/10.1590/1984-0462/2022/40/2020388.
4. Giannoni E., Agyeman P.K.A., Stocker M. et al.; Swiss Pediatric Sepsis Study. Neonatal sepsis of early onset, and hospital-acquired and community-acquired late onset: а prospective population-based cohort study. J Pediatr. 2018;201:106–114.e4. https://doi.org/10.1016/j.jpeds.2018.05.048.
5. Неонатология. Национальное руководство. Краткое издание. Под ред. Н.Н. Володина. М.: ГЭОТАР-Медиа, 2013. 887 с.
6. Gomella T.L., Eyal F.G., Bany-Mohammed F. Gomella’s neonatology: management, procedures, on-call problems, diseases, and drugs. 8th Edition. McGraw Hill/Medical, 2020. 1472 p.
7. Puopolo K.M., Benitz W.E., Zaoutis T.E., AAP Committee on fetus and newborn, AAP Committee on infectious diseases. Management of neonates born at ≥ 35 0/7 weeks’ gestation with suspected or proven early-onset bacterial sepsis. Pediatrics. 2018;142(6):e20182894. https://doi.org/10.1542/peds.2018-2894.
8. Isaacs D., Barfield C.P., Grimwood K. et al. Systemic bacterial and fungal infections in infants in Australian neonatal units. Australian Study Group for Neonatal Infections. Med J Aust. 1995;162(4):198–201. https://doi.org/10.5694/j.1326-5377.1995.tb126024.x.
9. Wiswell T.E., Baumgart S., Gannon C.M., Spitzer A.R. No lumbar puncture in the evaluation for early neonatal sepsis: will meningitis be missed? Pediatrics. 1995;95(6):803–6.
10. Smith P.B., Garges H.P., Cotton C.M. et al. Meningitis in preterm neonates: importance of cerebrospinal fluid parameters. Am J Perinatol. 2008;25(7):421–6. https://doi.org/10.1055/s-0028-1083839.
11. Mukhopadhyay S., Puopolo K.M. Neonatal early-onset sepsis: epidemiology and risk assessment. NeoReviews. 2015;16(4):e221–e230. https://doi.org/10.1542/neo.16-4-e221.
12. Palatnik A., Liu L.Y., Lee A., Yee L.M. Predictors of early-onset neonatal sepsis or death among newborns born at <32 weeks of gestation. J Peri- natol. 2019;39(7):949–55. https://doi.org/10.1038/s41372-019-0395-9.
13. Mitha A., Foix-L'Hélias L., Arnaud C. et al.; EPIPAGE Study Group. Neonatal infection and 5-year neurodevelopmental outcome of very preterm infants. Pediatrics. 2013;132(2):e372–80. https://doi.org/10.1542/peds.2012-3979.
14. Klinger G., Levy I., Sirota L. et al.; Israel Neonatal Network. Outcome of early-onset sepsis in a national cohort of very low birth weight infants. Pediatrics. 2010;125(4):e736–40. https://doi.org/10.1542/peds.2009-2017.
15. Flannery D.D., Mukhopadhyay S., Morales K.H. et al. Delivery characteristics and the risk of early-onset neonatal sepsis. Pediatrics. 2022;149(2):e2021052900. https://doi.org/10.1542/peds.2021-052900.
16. Cimolai N. The complexity of co-infections in the era of COVID-19. SN Compr Clin Med. 2021;3(7):1502–14. https://doi.org/10.1007/s42399-021-00913-4.
17. Mittal S., Muthusami S., Marlowe L. et al. Neonatal fever in the COVID-19 pandemic: odds of a serious bacterial infection. Pediatr Emerg Care. 2022;38(1):43–7. https://doi.org/10.1097/PEC.0000000000002601.
18. Jaeggi E., Öhman A.. Fetal and neonatal arrhythmias. Clin Perinatol. 2016;43(1):99–112. https://doi.org/10.1016/j.clp.2015.11.007.
19. Annam V., Medarametla V., Chakkirala N. Evaluation of cord blood – haematological scoring system as an early predictive screening method for the detection of early onset neonatal sepsis. J Clin Diagn Res. 2015;9(9):SC04–6. https://doi.org/10.7860/JCDR/2015/11621.6493.
20. Papile L., Burstein J., Burstein R., Koffier A. Incidence and evolution of subependymal and intraventricular hemorrhage in premature infants: a study of infants < 1,500 gm. J Pediatr. 1978;92(4):529–34. https://doi.org/10.1016/s0022-3476(78)80282-0.
21. Helguera-Repetto A.C., Soto-Ramírez M.D., Villavicencio-Carrisoza O. et al. Neonatal sepsis diagnosis decision-making based on artificial neural networks. Front Pediatr. 2020;8:525. https://doi.org/10.3389/fped.2020.00525.
22. Indrio F., Salatto A., Amato O. et al. COVID-19 pandemic in the neonatal intensive care unit: any effect on late-onset sepsis and necrotizing enterocolitis? Eur J Pediatr. 2021;181(2):853–7. https://doi.org/10.1007/s00431-021-04254-1.
23. Villar J., Ariff S., Gunier R.B. et al. Maternal and neonatal morbidity and mortality among pregnant women with and without COVID-19 infection. The INTERCOVID multinational cohort study. JAMA Pediatr. 2021;175(8):817–26. https://doi.org/10.1001/jamapediatrics.2021.1050.
24. Gee S., Chandiramani M., Seow J., Pollock E. et al. The legacy of maternal SARS-CoV-2 infection on the immunology of the neonate. Nat Immunol. 2021;22(12):1490–502. https://doi.org/10.1038/s41590-021-01049-2.
Об авторах
А. Л. КарповаRussian Federation
Карпова Анна Львовна – к.м.н., анестезиолог-реаниматолог, врач-неонатолог, зав. неонатологическим стационаром; доцент кафедры неонатологии имени профессора В.В. Гаврюшова; ассистент кафедры поликлинической терапии, клинической лабораторной диагностики и медицинской биохимии ИПДО; член Совета Российского общества неонатологов
123423 Москва, ул. Саляма Адиля, д. 2/44;
123995 Москва, ул. Баррикадная, 2/1, корп. 1;
150000 Ярославль, ул. Революционная, д. 5
А. В. Мостовой
Russian Federation
Мостовой Алексей Валерьевич – к.м.н., врач анестезиолог-реаниматолог, врач-неонатолог, руководитель службы реанимации и интенсивной терапии; доцент кафедры неонатологии имени профессора В.В. Гаврюшова; ассистент кафедры поликлинической терапии, клинической лабораторной диагностики и медицинской биохимии ИПДО; главный внештатный специалист-неонатолог Министерства здравоохранения Российской Федерации в Северо-Кавказском федеральном округе; член Совета Российского общества неонатологов; член Европейского общества исследований в области педиатрии (ESPR)
123423 Москва, ул. Саляма Адиля, д. 2/44;
123995 Москва, ул. Баррикадная, 2/1, корп. 1;
150000 Ярославль, ул. Революционная, д. 5
Е. А. Дудкина
Russian Federation
Дудкина Евгения Александровна – врач анестезиолог-реаниматолог отделения реанимации и интенсивной терапии новорожденных; врач ультразвуковой диагностики отделения реанимации и интенсивной терапии новорожденных
123423 Москва, ул. Саляма Адиля, д. 2/44;
2487007, Калуга, ул. Вишневского, д.1, корп. 6
О. В. Авдей
Russian Federation
Авдей Ольга Владимировна – врач анестезиолог-реаниматолог отделения реанимации и интенсивной терапии новорожденных
123423 Москва, ул. Саляма Адиля, д. 2/44
Н. Ю. Карпов
Russian Federation
Карпов Николай Юрьевич – врач акушер-гинеколог
152303 Тутаев, ул. Комсомольская, д. 104
Дополнительные файлы

|
1. ОБОСНОВАНИЕ КЛИНИЧЕСКОГО ДИАГНОЗА (чек-лист по неонатальному сепсису) | |
| Тема | ||
| Тип | Прочее | |
Скачать
(597KB)
|
Метаданные ▾ | |
Рецензия
Для цитирования:
Карпова А.Л., Мостовой А.В., Дудкина Е.А., Авдей О.В., Карпов Н.Ю. Ранний неонатальный сепсис в эпоху COVID-19. Акушерство, Гинекология и Репродукция. 2023;17(3):284-298. https://doi.org/10.17749/2313-7347/ob.gyn.rep.2023.389
For citation:
Karpova A.L., Mostovoi A.V., Dudkina E.А., Avdei O.V., Karpov N.Yu. Early neonatal sepsis in COVID-19 era. Obstetrics, Gynecology and Reproduction. 2023;17(3):284-298. (In Russ.) https://doi.org/10.17749/2313-7347/ob.gyn.rep.2023.389
JATS XML

Контент доступен под лицензией Creative Commons Attribution-NonCommercial-ShareAlike 4.0 International License.










































