Перейти к:
Клиническое значение состояния оси ADAMTS-13/vWF у беременных в различные триместры гестации
https://doi.org/10.17749/2313-7347/ob.gyn.rep.2023.405
Аннотация
Введение. Пандемия новой коронавирусной инфекции продемонстрировала важность оценки оси ADAMTS-13/vWF (металлопротеиназа ADAMTS-13/фактор фон Виллебранда) у пациентов с COVID-19, поскольку снижение этого соотношения отражает тяжесть заболевания. Однако данных в мировой литературе о взаимодействии и уровнях ADAMTS-13/vWF у беременных очень мало и все они весьма противоречивы. Учитывая влияние оси ADAMTS-13/vWF на частоту тромбозов, нарушений в системе гемостаза, исследование этого вопроса является крайне необходимым.
Цель: изучение функционирования оси ADAMTS-13/vWF при физиологической беременности.
Материалы и методы. Проведено контролируемое нерандомизированное исследование: в основную группу вошли 44 женщины с физиологически протекающей беременностью в I, II и III триместрах, контрольную группу составили 45 здоровых небеременных женщин. В плазме крови определяли содержание ингибитора ADAMTS-13 (ADAMTS-13:i), антигена ADAMTS-13 (ADAMTS-13:Ag), антигена vWF (vWF:Ag) и активность ADAMTS-13 (ADAMTS-13:Aс), а также их соотношение (ADAMTS-13:Aс/vWF:Ag).
Результаты. С увеличением срока гестации происходят значительные изменения в соотношении ADAMTS-13:Aс/vWF:Ag. У пациенток из основной группы во II триместре соотношение ADAMTS-13:Aс/vWF:Ag составило 0,359 ± 0,121, в III триместре – 0,253 ± 0,741, что имело статистически значимые различия (p < 0,01) по сравнению с контрольной группой небеременных женщин (1,134 ± 0,308).
Заключение. Наше исследование дает новые представления о функционировании оси ADAMTS-13/vWF у женщин с физиологически протекающей беременностью в I, II и III триместрах. Продемонстрировано снижение ADAMTS-13:Aс на фоне роста уровня vWF:Ag, наблюдавшееся с увеличением срока беременности. По-видимому, прогрессирующее снижение концентра ции ADAMTS-13 во время беременности связано с ее увеличенным потреблением из-за высокого содержания vWF. Однако ввиду небольшой одноцентровой выборки необходимы дальнейшие исследования с бóльшим количеством пациентов.
Для цитирования:
Григорьева К.Н., Гашимова Н.Р., Бицадзе В.О., Панкратьева Л.Л., Хизроева Д.Х., Третьякова М.В., Цибизова В.И., Дегтярева Н.Д., Муленкова А.В., Гри Ж., Кварацхелия М.В., Грандоне Э., Якубова Ф.Э., Блинов Д.В., Макацария А.Д. Клиническое значение состояния оси ADAMTS-13/vWF у беременных в различные триместры гестации. Акушерство, Гинекология и Репродукция. 2023;17(2):221-230. https://doi.org/10.17749/2313-7347/ob.gyn.rep.2023.405
For citation:
Grigoreva K.N., Gashimova N.R., Bitsadze V.O., Pankratyeva L.L., Khizroeva J.Kh., Tretyakova M.V., Tsibizova V.I., Degtyareva N.D., Mulenkova A.V., Gris J., Kvaratskheliia M.V., Grandone E., Yakubova F.E., Blinov D.V., Makatsariya A.D. Clinical significance of ADAMTS-13/vWF axis in pregnant women at different trimesters of gestation. Obstetrics, Gynecology and Reproduction. 2023;17(2):221-230. https://doi.org/10.17749/2313-7347/ob.gyn.rep.2023.405
Введение / Introduction
Системе гемостаза, как одной из базисных звеньев гомеостаза при физиологической и патологической беременности, всегда уделялось большое внимание. Благодаря успехам молекулярной биологии за последние десятилетия были открыты крайне важные звенья гемостаза, к ним относятся цинкосодержащая металлопротеиназа ADAMTS-13 (англ. a disintegrin and metalloproteinase with thrombospondin type 1 motif, member 13) и фактор фон Виллебранда (англ. von Willebrand factor, vWF) [1–3].
Фактор фон Виллебранда – гликопротеин плазмы, производимый эндотелием [4], в организме человека он выполняет множество функций, основной из которых является привлечение и связывание тромбоцитов [5]. Микроскопические исследования показали, что в отсутствие повреждения эндотелия vWF функционирует в складчатой форме, которая препятствует адгезии тромбоцитов. В момент повреждения сосуда vWF «расправляется» и является основной сферой интересов для металлопротеиназы ADAMTS-13, которая расщепляет огромные мультимеры vWF [6]. При большой площади повреждении эндотелия происходит массивный выброс vWF из телец Вейбеля–Паладе и возникает так называемая «относительная» недостаточность vWF-протеазы. Дефицит ADAMTS-13 приводит к накоплению сверкрупных молекул vWF, адгезии тромбоцитов, вследствие чего развивается тромбоцитопения потребления и возникает тромбоз сосудов микроциркуляторного русла [1][5].
В норме беременность характеризуется развитием гиперкоагулянтного состояния. За последние годы благодаря пандемии COVID-19 было установлено, что в условиях гипервоспаления происходит повреждение эндотелия с нарушением регуляции в системе ADAMTS-13/vWF [7], вследствие чего развиваются микроциркуляторные нарушения, ведущие к полиорганной недостаточности. Преэкламспия (ПЭ) является одним из ярких примеров развития эндотелиопатии во время беременности. У пациенток с ПЭ происходят существенные изменения в про- и антикоагулянтных путях, что приводит к развитию сверхгиперкоагулянтного состояния [8][9]. Однако изучение данной проблемы осложняется недостаточностью и крайне противоречивыми данными литературы о физиологии функционирования оси ADAMTS-13/vWF в системе мать–плод.
Цель: изучение функционирования оси ADAMTS-13/vWF при физиологической беременности.
Материалы и методы / Materials and Мethods
Дизайн исследования / Study design
На клинических базах Перинатального центра ГБУЗ ГКБ № 67 им. Л.А. Ворохобова ДЗМ и в ООО «Медицинский женский центр» проведено контролируемое нерандомизированное исследование. В исследовании приняли участие 193 женщины – 148 беременных и 45 небеременных.
Критерии включения и исключения / Inclusion and exclusion criteria
Критерии включения в основную группу: возраст более 18 лет; здоровые беременные с физиологически протекающей беременностью в I, II и III триместрах; наличие письменного добровольного информированного согласия на участие в исследовании.
Критерии включения в контрольную группу: возраст более 18 лет; подтвержденное отсутствие беременности; наличие письменного добровольного информированного согласия на участие в исследовании.
Критерии исключения: женщины, перенесшие во время беременности острые респираторные заболевания (ОРЗ), бактериальную инфекцию; пациентки с ПЭ в анамнезе; с развившейся ПЭ во время беременности; с неудовлетворительными результатами первого скрининга; с положительным глюкозотолерантным тестом; с подтверждённым положительным анализом на антитела к вирусу иммунодефицита человека, маркерами вирусных гепатитов В и С и сифилиса; с наличием злокачественных новообразований в анамнезе, соматической патологии; с преждевременными родами; отказ от участия в исследовании.
Методы исследования / Study methods
Образцы периферической крови у беременных участниц исследования в объеме 9 мл были получены трижды: на первом скрининге (с 11-й по 13-ю неделю), во время перорального глюкозотолерантного теста (с 24-й недели до 26 нед 6 дней), в момент первого периода родов; у здоровых небеременных отбор периферической крови в объеме 9 мл проводили однократно. Отбор проб крови производили сухой стерильной иглой из локтевой вены в вакуумные пробирки в соотношении c антикоагулянтом 9:1. В качестве антикоагулянта использовали забуференный раствор тринатрийцитрата с концентрацией цитрата 3,2 %. Цельную кровь центрифугировали при 2500 g в течение 20 мин при температуре 20–24 °C. После центрифугирования получали образцы плазмы, которые хранили при температуре –80 °С. В полученных образцах плазмы определяли содержание ингибитора ADAMTS-13 (ADAMTS-13:i), антигена ADAMTS-13 (ADAMTS-13:Ag), антигена vWF (vWF:Ag) и активность ADAMTS-13 (ADAMTS-13:Aс) с использованием коммерческих наборов тестов Technoclon Herstellung von Diagnostika und Arzneimitteln Gmb (TECHNOZYM®, Австрия); рассчитывали соотношение ADAMTS-13:Aс/vWF:Ag. Нормальные референтные значения составляли для содержания ADAMTS-13:i менее 15 ЕД/мл, ADAMTS-13:Ag – 0,41–1,41 ЕД/мл, vWF:Ag – 0,5–1,5 МЕ/мл (50–150 %) и активности ADAMTS-13:Aс – 0,4–1,3 МЕ/мл. Сравнивали значения измеренных и рассчитанных параметров у беременных в I, II и III триместрах с показателями небеременных женщин.
Этические аспекты / Ethical aspects
Данное исследование было одобрено локальным этическим комитетом) ФГАОУ ВО Первый МГМУ им. И.М. Сеченова Минздрава России (Сеченовский Университет), протокол № 03-23 от 16.02.2023. Все участницы исследования подписали форму добровольного информированного согласия и получили исчерпывающую информацию о характере исследования. Исследование проведено в соответствии с этическими требованиями Хельсинской декларации Всемирной медицинской ассоциации.
Статистический анализ / Statistical analysis
Статистическая обработка данных из электронных таблиц Microsoft Office Excel 2021 (Microsoft, США) была выполнена с помощью программы Jamovi, версия 2.3.22 (The jamovi project, Австралия). Статистический анализ включал в себя расчёт описательных статистик: средней (M), среднеквадратического отклонения (SD), медианы (Ме), границы 95 % доверительного интервала (95 % ДИ). Для сравнения показателей между группами использовали критерий Манна–Уитни (Mann–Whitney U-test). Точный критерий Фишера применяли для проверки статистической значимости факторов: p ≤ 0,05 свидетельствовало о наличии статистически значимых различий, р > 0,05 – об отсутствии различий.
Результаты и обсуждение / Results and Discussion
Группы обследованных / Patient groups
На начальном этапе в исследовании приняли участие 148 беременных. Однако в процессе работы из исследования были исключены: в I триместре – 7 беременных из-за ОРЗ и 11 из-за неудовлетворительных результатов первого скрининга; во II триместре – 6 беременных из-за ОРЗ, 1 – из-за острого пиелонефрита и 4 – из-за положительного перорального глюкозотолерантного теста; в III триместре – 10 беременных из-за ОРЗ, 2 – из-за преждевременных родов, 3 – из-за ранней ПЭ, 19 – из-за поздней ПЭ и 41 с физиологической беременностью, так как родоразрешение проходило в других лечебных учреждениях (рис. 1).
В основную группу вошли 44 женщины с физиологически протекающей беременностью в I, II и III триместрах, контрольную группу составили 45 здоровых планирующих беременность небеременных женщин.
Клинико-анамнестическая характеристика / Clinical and anamnestic characteristics
Данные клинико-анамнестического обследования участниц исследования и перинатальные исходы представлены в таблице 1.
Обследованные женщины не различались по возрасту, соматическому статусу и индексу массы тела, среди них не было случаев перинатальной смертности. Потери беременности в анамнезе до 10-й недели в основной группе были у 6 из 44 (13,64 %), в контрольной группе – у 4 из 45 (8,89 %). Потеря беременности в анамнезе до 22 нед наблюдалась только в основной группе у 1 из 44 (2,27 %), ее причиной был преждевременный разрыв плодных оболочек. В настоящую беременность роды через естественные родовые пути произошли у 33 из 44 (75,0 %) пациенток с физиологической беременностью в III триместре; родоразрешение путем операции кесарева сечения выполнено у 11 из 44 (25,0 %), срок родоразрешения составил от 37 нед до 41-й недели 2 дней.
Результаты лабораторных исследований / Laboratory results
В таблице 2 представлены результаты лабораторных исследований обследованных женщин.
У обследованных беременных выявлены статистические различия в значениях ADAMTS-13:Aс во II и III триместрах по сравнению с контрольной группой (p < 0,01), свидетельствующие о том, что в норме при увеличении срока гестации активность ADAMTS-13 постепенно снижается, при этом в I триместре активность ADAMTS-13 примерно соответствовала ее уровню у небеременных (рис. 2).
При оценке ADAMTS-13:Ag (рис. 3) определены статистически значимые различия только между основной группой в III триместре и контрольной группой (p < 0,01).
Значения ADAMTS-13:i в основной группе в I триместре составили 1,268 ± 0,697 ЕД/мл, во II триместре – 1,417 ± 0,733 ЕД/мл и в III – 2,413 ± 1,659 ЕД/мл. Статистически значимая разница (р = 0,025) значений ADAMTS-13:i наблюдалась между основной группой в III триместре и контрольной группой (1,486 ± 0,799 ЕД/мл), при этом все значения ADAMTS-13:i находились в референсных пределах (рис. 4).
Существенные различия в содержании vWF:Ag были отмечены между беременными основной группы во II и III триместрах и контрольной группой (p < 0,01), при этом значимых различий в значениях vWF:Ag у пациенток основной группы в I триместре и контрольной группой отмечено не было (рис. 5).
Фактор фон Виллебранда, как демонстрируют многие исследования, имеет тенденцию к увеличению относительно срока беременности [10][11]. Также имеются исследования, показывающие, что у пациенток с ПЭ происходит значительное увеличение уровня vWF по сравнению с физиологической беременностью в III триместре [12][13]. Однако некоторые ученые отрицают эти данные и показывают отсутствие различий между этими группами пациенток [14]. С ADAMTS-13 все гораздо сложнее, в мире нет единого мнения об изменениях активности ADAMTS-13 при беременности. Одни исследования демонстрируют ее снижение, начиная со II триместра физиологической беременности [15, 16]; другие утверждают, что уровень ADAMTS-13 существенно не изменялся в группах сравнения беременных с физиологически протекающей беременностью и небеременными [17]. В нашем исследовании хорошо видно, что с увеличением срока гестации активность ADAMTS-13 снижается, а вот уровень vWF неуклонно растет. Вероятнее всего это связано с массивным выбросом vWF, вследствие чего происходит потребление металлопротеиназы.
При исследовании оси ADAMTS-13:Aс/vWF:Ag выявлены значимые различия (p < 0,01) между женщинами основной группы во II и III триместрах и контрольной группой (рис. 6).
Снижение отношения ADAMTS-13:Aс/vWF:Ag, как было продемонстрировано многими исследованиями при CОVID-19, свидетельствует о прогрессирующей эндотелиопатии и увеличивает риски развития тромбозов, в том числе тромботической микроангиопатии в несколько раз [18–20].
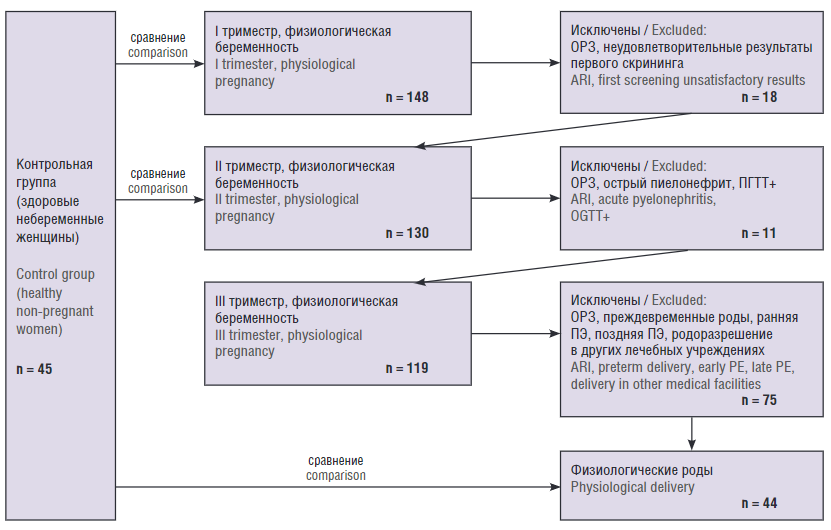
Рисунок 1. Схема отбора пациентов.
Примечание: ОРЗ – острые респираторные заболевания; ПГТТ+ – положительный пероральный глюкозотолерантный тест, ПЭ – преэклампсия.
Figure 1. Patient selection flowchart.
Note: ARI – acute respiratory diseases; OGTT+ – positive oral glucose tolerance test, PE – preeclampsia
Таблица 1. Клинико-анамнестическая характеристика обследованных женщин и перинатальные исходы.
Table 1. Clinical and anamnestic characteristics of the examined women and perinatal outcomes.
|
Показатель Parameter |
Основная группа Main group n = 44 |
Контрольная группа Control group n = 45 |
|
Возраст, лет, М / Age, years, M Min–max |
29,07 22–40 |
28,13 18–37 |
|
Индекс массы тела, кг/м2, М / Body mass index, kg/m2, M |
24,60 |
24,06 |
|
Группа крови, n (%) / Blood group, n (%): • группа крови 0 / blood group 0 • группа крови А / blood group А • группа крови В / blood group В • группа крови АВ / blood group АВ |
19 (43,19) 14 (31,81) 8 (18,19) 3 (6,81) |
15 (33,33) 16 (35,56) 10 (22,22) 4 (8,89) |
|
Акушерско-гинекологический анамнез, n / Obstetric and gynecological history, n: • беременности в анамнезе / former pregnancies • своевременные роды / term delivery • преждевременные роды / preterm delivery • потери беременности до 10 нед / loss of pregnancy before 10 weeks • потери беременности до 22 нед / loss of pregnancy before 22 weeks |
19 15 1 6 1 |
16 15 0 4 0 |
|
Настоящая беременность, n / Current pregnancy, n: • роды через естественные родовые пути / Natural delivery • роды путем кесарева сечения / Cesarian section • оценка по шкале Апгар на 1-й минуте < 8 баллов / Apgar score at 1 min < 8 points • оценка по шкале Апгар на 5-й минуте < 8 баллов / Apgar score at 5 min < 8 points |
33 11 1 0 |
– – – – |
Таблица 2. Результаты изученных лабораторных показателей (М ± SD).
Table 2. A panel of assessed laboratory parameters (M ± SD).
|
Параметр Parameter |
Основная группа / Main group |
Контрольная группа Control group n = 45 |
p |
||
|
I триместр I trimester n = 44 |
II триместр II trimester n = 44 |
III триместр III trimester n = 44 |
|||
|
ADAMTS-13:Aс, МЕ/мл ADAMTS-13:Aс, IU/ml |
0,846 ± 0,094 |
0,526 ± 0,112 |
0,446 ± 0,088 |
0,871 ± 0,109 |
0,534* < 0,01** < 0,01*** |
|
ADAMTS-13:Ag, ЕД/мл ADAMTS-13:Ag, U/ml |
0,991 ± 0,198 |
0,875 ± 0,099 |
0,773 ± 0,139 |
0,961 ± 0,212 |
0,270* 0,072** < 0,01*** |
|
ADAMTS-13:i, ЕД/мл ADAMTS-13:i, U/ml |
1,268 ± 0,697 |
1,417 ± 0,733 |
2,413 ± 1,659 |
1,486 ± 0,799 |
0,478* 0,906** 0,025*** |
|
vWF:Ag, МЕ/мл vWF:Ag, IU/ml |
0,945 ± 0,191 |
1,516 ± 0,122 |
1,761 ± 0,281 |
0,885 ± 0,222 |
0,110* < 0,01** < 0,01*** |
|
ADAMTS-13:Ac/vWF |
0,924 ± 0,323 |
0,359 ± 0,121 |
0,253 ± 0,741 |
1,134 ± 0,308 |
0,348* < 0,01** < 0,01*** |
Примечание: *значимость различий между основной группой (I триместр) и контрольной группой; **значимость различий между основной группой (II триместр) и контрольной группой, ***значимость различий между основной группой (III триместр) и контрольной группой; ADAMTS-13:Aс – активность ADAMTS-13; ADAMTS-13:Ag – антиген ADAMTS-13; ADAMTS-13:i – ингибитор ADAMTS-13; vWF:Ag – антиген фактора фон Виллебранда; выделены значимые различия.
Note: *significant differences between main group (I trimester) and control group; **significant differences between main group (II trimester) and control group, ***significant differences between main group (III trimester) and control group; ADAMTS-13:Ac – ADAMTS-13 activity; ADAMTS-13:Ag – ADAMTS-13 antigen; ADAMTS-13:I – ADAMTS-13 inhibitor; vWF:Ag – von Willebrand factor antigen; significant differences are highlighted in bold.
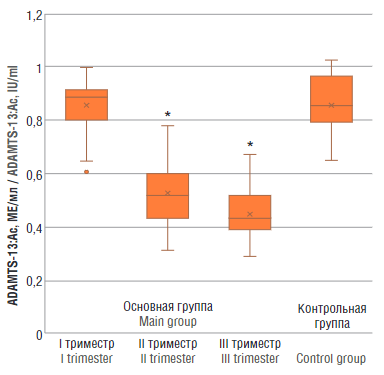
Рисунок 2. Уровень активности ADAMTS-13 (ADAMTS-13:Aс) у женщин с физиологически протекающей беременностью в I, II и III триместрах (основная группа) и у здоровых небеременных женщин (контрольная группа).
Примечание: *р < 0,01 – различия статистически значимы по сравнению с контрольной группой.
Figure 2. ADAMTS-13 (ADAMTS-13:Ac) activity in women with physiological pregnancy at I, II and III trimesters (main group) and in healthy non-pregnant women (control group).
Note: *p < 0.01 – significant differences compared to control group.
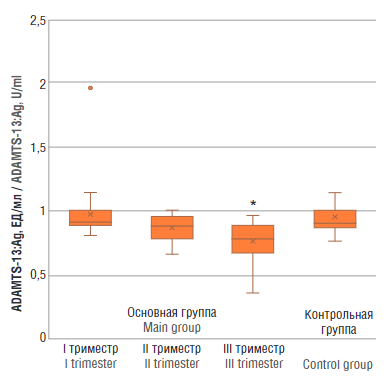
Рисунок 3. Уровень антигена ADAMTS-13 (ADAMTS-13:Ag) у женщин с физиологически протекающей беременностью в I, II и III триместрах (основная группа) и у здоровых небеременных женщин (контрольная группа).
Примечание: *р < 0,01 – различия статистически значимы по сравнению с контрольной группой.
Figure 3. ADAMTS-13 antigen (ADAMTS-13:Ag) level in women with physiological pregnancy at I, II and III trimesters (main group and healthy non-pregnant women (control group).
Note: *p < 0.01 – significant differences compared to control group.
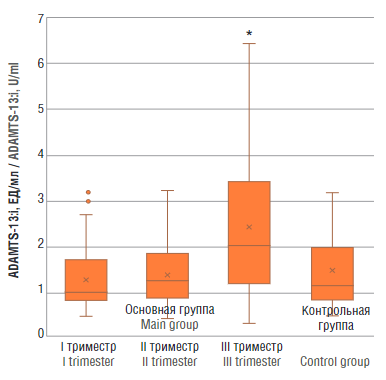
Рисунок 4. Уровень ингибитора ADAMTS-13 (ADAMTS-13:i) у женщин с физиологически протекающей беременностью в I, II и III триместрах (основная группа) и у здоровых небеременных женщин (контрольная группа).
Примечание: *р < 0,05 – различия статистически значимы по сравнению с контрольной группой.
Figure 4. ADAMTS-13 inhibitor (ADAMTS-13:i) level in women with physiological pregnancy at I, II and III trimesters (main group) and in healthy non-pregnant women (control group).
Note: *p < 0.05 – significant differences compared to control group.
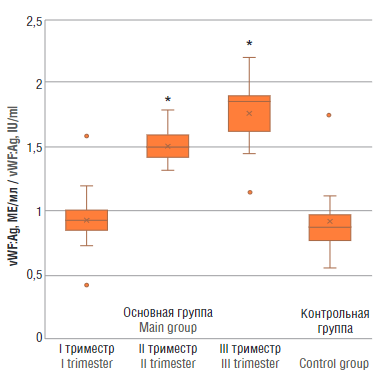
Рисунок 5. Уровень антигена фактора фон Виллебранда (vWF:Ag) у женщин с физиологически протекающей беременностью в I, II и III триместрах (основная группа) и у здоровых небеременных женщин (контрольная группа).
Примечание:*р < 0,01 – различия статистически значимы по сравнению с контрольной группой.
Figure 5. von Willebrand factor antigen (vWF:Ag) level in women with physiological pregnancy at I, II and III trimesters (main group) and in healthy non-pregnant women (control group).
Note: *p < 0.01 – significant differences compared to control group.
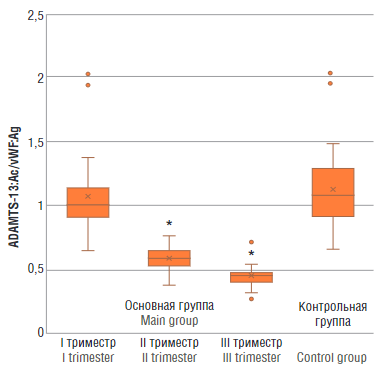
Рисунок 6. Отношение ADAMTS-13:Aс/vWF:Ag у женщин с физиологически протекающей беременностью в I, II и III триместрах (основная группа) и у здоровых небеременных женщин (контрольная группа).
Примечание:*р < 0,01 – различия статистически значимы по сравнению с контрольной группой.
Figure 6. ADAMTS-13:Ac/vWF:Ag ratio in women with physiological pregnancy at I, II and III trimesters (main group) and in healthy non-pregnant women (control group).
Note: *p < 0.01 – significant differences compared to control group.
Заключение / Conclusion
Наше исследование дает новые представления о соотношении ADAMTS-13:Aс/vWF:Ag у женщин с физиологически протекающей беременностью в I, II и III триместрах. Как показала пандемия COVID-19, снижение соотношения ADAMTS-13:Aс/vWF:Ag является одним из самых важных предикторов оценки тяжести больного, а также приводит к повышенному риску развития тромботических осложнений и является главным маркером эндотелиопатии. В нашем исследовании наглядно показано, что с увеличением срока гестации происходит снижение ADAMTS-13:Aс на фоне роста уровня vWF:Ag, что может свидетельствовать о развитии эндотелиопатии. Однако ввиду небольшой одноцентровой выборки необходимы дальнейшие исследования с бóльшим количеством пациентов.
Список литературы
1. Moake J.L., Rudy C.K., Troll J.H. et al. Unusually large plasma factor VIII:von Willebrand factor multimers in chronic relapsing thrombotic thrombocytopenic purpura. N Engl J Med. 1982;(23)307:1432–5. https://doi.org/10.1056/NEJM198212023072306.
2. Tsai H.M. Physiologic cleavage of von Willebrand factor by a plasma protease is dependent on its conformation and requires calcium ion. Blood. 1996;87(10):4235–44.
3. Furlan M., Robles R., Lammle B. Partial purification and characterization of a protease from human plasma cleaving von Willebrand factor to fragments produced by in vivo proteolysis. Blood. 1996;87(10):4223–34.
4. Zhou Y.-F., Eng E.T., Zhu J. et al. Sequence and structure relationships within von Willebrand factor. Blood. 2012;120(2):449–58. https://doi.org/10.1182/blood-2012-01-405134.
5. Lenting P.J., Christophe O.D., Denis CV. von Willebrand factor biosynthesis, secretion, and clearance: connecting the far ends. Blood. 2015;125(13):2019–28. https://doi.org/10.1182/blood-2014-06-528406.
6. De Ceunynck K., De Meyer S.F., Vanhoorelbeke K. Unwinding the von Willebrand factor strings puzzle. Blood. 2013;121(2):270–7. https://doi.org/10.1182/blood-2012-07-442285.
7. Grandone E., Vimercati A., Sorrentino F. et al. Obstetric outcomes in pregnant COVID-19 women: the imbalance of von Willebrand factor and ADAMTS13 axis. BMC Pregnancy Childbirth. 2022;22(1):142. https://doi.org/10.1186/s12884-022-04405-8.
8. English F.A., Kenny L.C., McCarthy F.P. Risk factors and effective management of preeclampsia. Integr Blood Press Control. 2015;8:7–12. https://doi.org/10.2147/IBPC.S50641.
9. Gris J.-C., Bouvier S., Cochery-Nouvellon E. et al. The role of haemostasis in placenta-mediated complications. Thromb Res. 2019;181 Suppl 1:S10–S14. https://doi.org/10.1016/S0049-3848(19)30359-7.
10. Drury-Stewart D., Lannert K., Chung D. et al. Complex changes in von Willebrand factor-associated parameters are acquired during uncomplicated pregnancy. PLoS One. 2014;9(11):e112935. https://doi.org/10.1371/journal.pone.0112935.
11. Chen Y., Huang P., Han C. et al. Association of placenta-derived extracellular vesicles with pre-eclampsia and associated hypercoagulability: A clinical observational study. BJOG. 2020;128(6):1037–46. https://doi.org/10.1111/1471-0528.16552.
12. Gadisseur A., Berneman Z., Schroyens W., Michiels J.J. Laboratory diagnosis of von Willebrand disease type 1/2E (2A subtype IIE), type 1 Vicenza and mild type 1 caused by mutations in the D3, D4, B1-B3 and C1-C2 domains of the von Willebrand factor gene. Role of von Willebrand factor multimers and the von Willebrand factor propeptide/antigen ratio. Acta Haematol. 2009;121(2–3):128–38. https://doi.org/10.1159/000214853.
13. Hulstein J., Heimel P., Franx A. et al. Acute activation of the endothelium results in increased levels of active von Willebrand factor in hemolysis, elevated liver enzymes and low platelets (HELLP) syndrome. J Thromb Haemost. 2006;4(12):2569–75. https://doi.org/10.1111/j.1538-7836.2006.02205.x.
14. Stepanian A., Cohen-Moatti M., Sanglier T. et al. Von Willebrand factor and ADAMTS13: a candidate couple for preeclampsia pathophysiology. Arterioscler Thromb Vasc Biol. 2011;31(7):1703–9. https://doi.org/10.1161/ATVBAHA.111.223610.
15. Ramadan M., Badr D., Hubeish M. et al. HELLP syndrome, thrombotic thrombocytopenic purpura or both: appraising the complex association and proposing a stepwise practical plan for differential diagnosis. J Hematol. 2018;7(1):32–7. https://doi.org/10.14740/jh347w.
16. Sánchez-Luceros A., Farías C., Amaral M. et al. von Willebrand factor-cleaving protease (ADAMTS13) activity in normal non-pregnant women, pregnant and post-delivery women. Thromb Haemost. 2004;92(6):1320–6. https://doi.org/10.1160/TH03-11-0683.
17. Molvarec A., Rigó J., Bõze T. et al. Increased plasma von Willebrand factor antigen levels but normal von Willebrand factor cleaving protease (ADAMTS13) activity in preeclampsia. Thromb Haemost. 2009;101(2):305–11.
18. Joly B.S., Darmon M., Dekimpe C. et al. Imbalance of von Willebrand factor and ADAMTS13 axis is rather a biomarker of strong inflammation and endothelial damage than a cause of thrombotic process in critically ill COVID-19 patients. J Thromb Haemost. 2021;19(9):2193–8. https://doi.org/10.1111/jth.15445.
19. Favaloro E.J., Henry B.M., Lippi G. Increased VWF and decreased ADAMTS-13 in COVID-19: creating a milieu for (micro)thrombosis. Semin Thromb Hemost. 2021;47(4):400–18. https://doi.org/10.1055/s-0041-1727282.
20. Doevelaar A., Bachmann M., Hölzer B. et al. COVID-19 is associated with relative ADAMTS13 deficiency and VWF multimer formation resembling TTP (Preprint). medRxiv. August 25, 2020. https://doi.org/10.1101/2020.0.
Об авторах
К. Н. ГригорьеваРоссия
Григорьева Кристина Николаевна – ассистент кафедры акушерства, гинекологии и перинатальной медицины Клинического института детского здоровья
имени Н.Ф. Филатова
119991 Москва, ул. Большая Пироговская, д. 2, стр. 4
Н. Р. Гашимова
Россия
Гашимова Нилуфар Рамиль кызы – аспирант кафедры акушерства, гинекологии и перинатальной медицины Клинического института детского здоровья
имени Н.Ф. Филатова
119991 Москва, ул. Большая Пироговская, д. 2, стр. 4
В. О. Бицадзе
Россия
Бицадзе Виктория Омаровна – д.м.н., профессор РАН, профессор кафедры акушерства, гинекологии и перинатальной медицины Клинического института
детского здоровья имени Н.Ф. Филатова
Scopus Author ID: 6506003478. Researcher ID: F-8409-2017
119991 Москва, ул. Большая Пироговская, д. 2, стр. 4
Л. Л. Панкратьева
Россия
Панкратьева Людмила Леонидовна – д.м.н., доцент, профессор кафедры педиатрии и организации здравоохранения ФГБУ «Национальный медицинский
исследовательский центр детской гематологии, онкологии и иммунологии имени Дмитрия Рогачева» Министерства здравоохранения Российской
Федерации; врач-неонатолог, врач-гематолог, руководитель научно-клинического центра ГБУЗ «Городская клиническая больница No 67 имени Л.А. Ворохобова Департамента здравоохранения города Москвы»
Scopus Author ID: 7006391091, Author ID: 697284
117997 Москва, ул. Саморы Машела, д. 1
123423 Москва, ул. Саляма Адиля, д. 2/44
Д. Х. Хизроева
Россия
Хизроева Джамиля Хизриевна – д.м.н., профессор кафедры акушерства, гинекологии и перинатальной медицины Клинического института детского
здоровья имени Н.Ф. Филатова
Scopus Author ID: 57194547147, Researcher ID: F-8384-2017
119991 Москва, ул. Большая Пироговская, д. 2, стр. 4
М. В. Третьякова
Россия
Третьякова Мария Владимировна – к.м.н., врач акушер-гинеколог, ассистент кафедры акушерства, гинекологии и перинатальной медицины Клинического института детского здоровья имени Н.Ф. Филатова
119991 Москва, ул. Большая Пироговская, д. 2, стр. 4
В. И. Цибизова
Россия
Цибизова Валентина Ивановна – к.м.н., врач акушер-гинеколог НИЛ оперативной гинекологии Института перинатологии и педиатрии, врач отделения
функциональной ультразвуковой диагностики
197341 Санкт-Петербург, ул. Аккуратова, д. 2
Н. Д. Дегтярева
Россия
Дегтярева Наталья Дмитриевна – студент Клинического института детского здоровья имени Н.Ф. Филатова
119991 Москва, ул. Большая Пироговская, д. 2, стр. 4
А. В. Муленкова
Россия
Муленкова Алёна Валерьевна – студент Клинического института детского здоровья имени Н.Ф. Филатова
119991 Москва, ул. Большая Пироговская, д. 2, стр. 4
Ж.-К. Гри
Франция
Гри Жан-Кристоф – д.м.н., профессор кафедры акушерства, гинекологии и перинатальной медицины Клинического института детского здоровья имени
Н.Ф. Филатова ФГАОУ ВО Первый Московский государственный медицинский университет имени И.М. Сеченова Министерства здравоохранения
Российской Федерации (Сеченовский Университет); профессор гематологии, Университет Монпелье, Монпелье, Франция; иностранный член РАН
Researcher ID: AAA-2923-2019
34090 Монпелье, ул. Огюста Бруссоне, д. 163
М. В. Кварацхелия
Россия
Кварацхелия Маргарита Варламовна – клинический ординатор кафедры акушерства, гинекологии и перинатальной медицины Клинического института
детского здоровья имени Н.Ф. Филатова
119991 Москва, ул. Большая Пироговская, д. 2, стр. 4
Э. Грандоне
Россия
Грандоне Эльвира – д.м.н., профессор кафедры акушерства и гинекологии Клинического института детского здоровья имени Н.Ф. Филатова ФГАОУ ВО
Первый Московский государственный медицинский университет имени И.М. Сеченова Министерства здравоохранения Российской Федерации
(Сеченовский университет); руководитель отделения тромбозов и гемостаза исследовательского центра «Casa Sollievo della Sofferenza»
Scopus Author ID: 7006391091, Researcher ID: M-1127-2019
119991 Москва, ул. Большая Пироговская, д. 2, стр. 4
Италия, 71013 Сан-Джованни-Ротондо, Viale Cappuccini, д. 1
Ф. Э. Якубова
Россия
Якубова Фидан Эльчин кызы – клинический ординатор кафедры акушерства и гинекологии Клинического института детского здоровья имени
Н.Ф. Филатова
119991 Москва, ул. Большая Пироговская, д. 2, стр. 4
Д. В. Блинов
Россия
Блинов Дмитрий Владиславович – к.м.н., ассистент кафедры спортивной медицины и медицинской реабилитации Института клинической медицины имени Н.В. Склифосовского ФГАОУ ВО Первый Московский государственный медицинский университет имени И.М. Сеченова Министерства здравоохранения Российской Федерации (Сеченовский Университет); руководитель по медицинским и научным вопросам, Институт Превентивной и Социальной Медицины; доцент кафедры спортивной, физической и реабилитационной медицины АНО ДПО «Московский медико-социальный институт имени Ф.П. Гааза»
Scopus Author ID: 6701744871, Researcher ID: E-8906-2017, RSCI: 9779-8290
119991 Москва, ул. Большая Пироговская, д. 2, стр. 4
127006 Москва, ул. Садовая-Триумфальная, д. 4–10
123056 Москва, 2-я Брестская ул., д. 5, с. 1–1а
А. Д. Макацария
Россия
Макацария Александр Давидович – д.м.н., профессор, академик РАН, зав. кафедрой акушерства, гинекологии и перинатальной медицины Клинического института детского здоровья имени Н.Ф. Филатова ФГАОУ ВО Первый Московский государственный медицинский университет имени И.М. Сеченова Министерства здравоохранения Российской Федерации (Сеченовский Университет); вице-президент Российского общества акушеров-
гинекологов (РОАГ); Заслуженный врач Российской Федерации; Почетный профессор Венского Университета
Scopus Author ID: 57222220144, Researcher ID: M-5660-2016
119991 Москва, ул. Большая Пироговская, д. 2, стр. 4
Рецензия
Для цитирования:
Григорьева К.Н., Гашимова Н.Р., Бицадзе В.О., Панкратьева Л.Л., Хизроева Д.Х., Третьякова М.В., Цибизова В.И., Дегтярева Н.Д., Муленкова А.В., Гри Ж., Кварацхелия М.В., Грандоне Э., Якубова Ф.Э., Блинов Д.В., Макацария А.Д. Клиническое значение состояния оси ADAMTS-13/vWF у беременных в различные триместры гестации. Акушерство, Гинекология и Репродукция. 2023;17(2):221-230. https://doi.org/10.17749/2313-7347/ob.gyn.rep.2023.405
For citation:
Grigoreva K.N., Gashimova N.R., Bitsadze V.O., Pankratyeva L.L., Khizroeva J.Kh., Tretyakova M.V., Tsibizova V.I., Degtyareva N.D., Mulenkova A.V., Gris J., Kvaratskheliia M.V., Grandone E., Yakubova F.E., Blinov D.V., Makatsariya A.D. Clinical significance of ADAMTS-13/vWF axis in pregnant women at different trimesters of gestation. Obstetrics, Gynecology and Reproduction. 2023;17(2):221-230. https://doi.org/10.17749/2313-7347/ob.gyn.rep.2023.405

Контент доступен под лицензией Creative Commons Attribution-NonCommercial-ShareAlike 4.0 International License.











































