Перейти к:
Вклад внеклеточных ловушек нейтрофилов в протромботическое состояние и прогрессию опухоли у онкогинекологических пациенток
https://doi.org/10.17749/2313-7347/ob.gyn.rep.2023.385
Аннотация
Введение. Одной из ведущих причин в структуре смертности онкологических пациентов являются тромботические осложнения. В недавних исследованиях было показано, что внеклеточные ловушки нейтрофилов (англ. neutrophil extracellular traps, NETs) участвуют в активации свертывания, способствуют инициации и прогрессированию тромбоза. Помимо этого, активно изучается вклад NETs в прогрессию опухоли и метастазирование.
Цель: оценка прокоагулянтной активности NETs у онкогинекологических пациенток.
Материалы и методы. С апреля 2020 г. по октябрь 2022 г. проведено проспективное контролируемое интервенционное нерандомизированное исследование с участием 120 женщин. В основную группу вошли 87 пациенток в возрасте от 32 до 72 лет со злокачественными новообразованиями женских половых органов и молочных желез, госпитализированных в стационар для планового оперативного лечения или проведения химиотерапии: рак тела матки (подгруппа 1; n = 18), рак яичников (подгруппа 2; n = 26), рак шейки матки – аденокарцинома цервикального канала (подгруппа 3; n = 13), рак молочной железы (подгруппа 4; n = 30). Контрольную группу составили 33 здоровые женщины в возрасте от 32 до 68 лет. У всех женщин в плазме крови были оценены концентрации цитруллинированного гистона Н3 (англ. citrullinated histone H3, citH3), антигена миелопероксидазы (МПО:Аг), D-димера и комплексов тромбин–антитромбин (ТАТ).
Результаты. Выраженность процессов нетоза, оцененная у онкологических пациенток в концентрациях citH3 (2,5 ± 0,7 нг/мл, 1,9 ± 0,8 нг/мл, 2,5 ± 0,7 нг/мл, 0,7 ± 0,5 нг/мл в четырех подгруппах, соответственно) и МПО:Аг (29,5 ± 13,1 нг/мл, 12,8 ± 3,7 нг/мл, 22,8 ± 8,7 нг/мл, 6,6 ± 2,5 нг/мл в четырех подгруппах, соответственно), оказалась достоверно выше по сравнению с женщинами контрольной группы (соответственно, 0,3 ± 0,1 нг/мл; р = 0,0001 и 2,5 ± 0,2 нг/мл; р = 0,0001). Параллельно повышению маркеров нетоза в зависимости от стадии заболевания происходило и нарастание концентрации маркеров активации гемостаза – D-димера (1,7 ± 0,6 мкг/мл, 2,0 ± 0,7 мкг/мл, 1,4 ± 0,5 мкг/мл, 1,5 ± 0,7 мкг/мл в четырех подгруппах, соответственно) и комплексов ТАТ (729,8 ± 43,9 пг/мл, 794,1 ± 164,8 пг/мл, 636,2 ± 149,5 пг/мл, 699,6 ± 165,7 пг/мл в четырех подгруппах, соответственно), превышая их содержание в контрольной группе (соответственно, 0,4 ± 0,1 мкг/мл; р = 0,0001 и 362,3 ± 0,1 пг/мл; р = 0,0001). Максимальные значения показателей приходились на более поздние стадии по Международной классификации стадий злокачественных новообразований (англ. tumor, nodus, metastasis, TNM). Выявлена достоверная корреляция уровня ТАТ от содержания citH3 (r = 0,586; р = 0,04) и МПО:Аг (r = 0,631; р = 0,04).
Заключение. Опухолевая ткань создает условия, стимулирующие нейтрофилы к высвобождению NETs, которые, в свою очередь, не только способствуют созданию прокоагулянтного состояния, но также, возможно, являются одним из факторов, обеспечивающих прогрессию опухоли и метастазирование. Разработка таргетной терапии, направленной на NETs, потенциально способна оказать влияние на систему гемостаза у онкологических пациентов и снизить интенсивность опухолевого роста и метастазирования.
Ключевые слова
Для цитирования:
Слуханчук Е.В., Бицадзе В.О., Солопова А.Г., Хизроева Д.Х., Дегтярева Н.Д., Щербаков Д.В., Гри Ж., Элалами И., Макацария А.Д. Вклад внеклеточных ловушек нейтрофилов в протромботическое состояние и прогрессию опухоли у онкогинекологических пациенток. Акушерство, Гинекология и Репродукция. 2023;17(1):53-64. https://doi.org/10.17749/2313-7347/ob.gyn.rep.2023.385
For citation:
Slukhanchuk E.V., Bitsadze V.O., Solopova A.G., Khizroeva J.Kh., Degtyareva N.D., Shcherbakov D.V., Gris J., Elalamy I., Makatsariya A.D. An impact of neutrophil extracellular traps to the prothrombotic state and tumor progression in gynecological cancer patients. Obstetrics, Gynecology and Reproduction. 2023;17(1):53-64. https://doi.org/10.17749/2313-7347/ob.gyn.rep.2023.385
ВВЕДЕНИЕ / INTRODUCTION
Гиперкоагуляция сопутствует онкологическому процессу, прогрессии опухоли, метастазированию, увеличивает риск венозного тромбоза, который является второй по значимости причиной смерти у онкологических пациентов [1]. С другой стороны, тромбопрофилактика, профилактическое использование антикоагулянтов у онкологических пациентов имеет большой потенциал для снижения риска тромбоза, что приводит к улучшению выживаемости [2]. Однако использование антикоагулянтов остается серьезной проблемой из-за различий в частоте венозных тромбозов среди пациентов и высокого риска кровотечения, связанного с их применением [3]. Существует необходимость в углублении понимания патогенеза гиперкоагуляции у онкологических больных с целью разработки новых противотромботических стратегий.
Недавно было показано, что внеклеточные ловушки нейтрофилов (англ. neutrophil extracellular traps, NETs), генерируемые активированными нейтрофилами, состоящие из внеклеточной ДНК, гистонов, цитоплазматических белков и белков гранул нейтрофилов, являются участниками нового прокоагулянтного механизма и рассматриваются как связующее звено между процессами воспаления и тромбоза [4]. Внеклеточная ДНК в составе NETs способствует активации коагуляции через внутренний путь [5], а гистоны индуцируют активацию тромбоцитов и эритроцитов. Воспаление всегда сопутствует опухолевому процессу [6]. В одном из исследований было показано, что нейтрофилы усиливают синтез NETs на фоне опухолевого процесса у мышей и принимают непосредственное участие в тромбообразовании [7]. В другом исследовании на животных было продемонстрировано, что образование NETs сопутствует рак-ассоциированной дисфункции органов [8]. Таким образом, целью данного исследования явилась оценка прокоагулянтной активности NETs у онкогинекологических пациенток. Результаты подтвердили гипотезу о том, что опухолевый рост стимулирует нейтрофилы к высвобождению NETs у онкогинекологических пациенток, что в дальнейшем реализуется в активации коагуляции и может являться одним из факторов, обеспечивающих метастазирование.
Цель: оценка прокоагулянтной активности NETs у онкогинекологических пациенток.
МАТЕРИАЛЫ И МЕТОДЫ / MATERIALS AND МETHODS
Дизайн исследования / Study design
В проспективном контролируемом интервенционном нерандомизированном исследовании, проведенном в период с апреля 2020 г. по октябрь 2022 г., приняли участие 120 женщин. Среди них было 87 пациенток в возрасте от 34 лет до 72 лет, госпитализированных с целью проведения планового оперативного лечения или курса химиотерапии в Университетской клинической больнице № 4 Сеченовского Университета и ФГБНУ РНЦХ им. акад. Б.В. Петровского (основная группа), и 33 участницы в возрасте от 32 до 68 лет, которые были набраны из числа персонала стационаров (контрольная группа).
Критерии включения и исключения / Inclusion and exclusion criteria
Критерии включения (основная группа): возраст старше 18 лет; диагноз при поступлении – злокачественные новообразования яичников, тела матки, шейки матки и молочных желез, подтвержденный данными инструментального, лабораторного и клинического обследования; подписанное информированное добровольное согласие на участие в исследовании.
Критерии включения (контрольная группа): возраст старше 18 лет; без активного рака и онкологических заболеваний, тромбозов и тромбоэмболий, хронических воспалительных заболеваний в анамнезе; подписанное информированное добровольное согласие на участие в исследовании.
Критерии исключения (для обеих групп): возраст младше 18 лет; наличие активного инфекционного и/или воспалительного процесса; сердечно-сосудистые заболевания, тяжелое течение; сахарный диабет в стадии декомпенсации; хронические заболевания печени и почек в стадии обострения; другие сопутствующие онкологические заболевания; тромбоэмболические осложнения, сопутствующие коагулопатии и тромбоцитопатии; прием антикоагулянтов и антиагрегантов; тромботический или геморрагический синдром на момент обследования; отказ от участия в исследовании.
Группы обследованных / Patients groups
В основную группу вошли пациентки со злокачественными заболеваниями молочных желез и женских половых органов стадий I–III: рак тела матки (подгруппа 1; n = 18, из них на стадии 1 TNM (англ. tumor, nodus, metastasis) – 7 пациенток, на стадии 2 TNM – 5 пациенток, на стадии 3 TNM – 6 пациенток), рак яичников (подгруппа 2; n = 26, из них на стадии 1 TNM – 11 пациенток, на стадии 2 TNM – 5 пациенток, на стадии 3 TNM – 10 пациенток), рак шейки матки – аденокарцинома цервикального канала (подгруппа 3; n = 13; все на стадии 1 TNM), рак молочной железы (подгруппа 4; n = 30, из них на стадии 1 TNM – 9 пациенток, на стадии 2 TNM – 6 пациенток, на стадии 3 TNM – 7 пациенток, на стадии 4 TNM – 8 пациенток). В контрольную группу вошли 33 здоровые женщины.
Методы исследования / Study methods
Образцы плазмы получали путем венепункции у всех пациенток однократно при поступлении в отделение (до оперативного лечения, до назначения антикоагулянтов, до начала курса химиотерапии) и хранили при температуре –80° С после центрифугирования. Отбор проб крови натощак сухой стерильной иглой из локтевой вены производили в пластиковую пробирку с антикоагулянтом в соотношении 9:1. Раствор 3,8 % трехзамещенного цитрата натрия использовали в качестве антикоагулянта.
Определение маркеров нетоза / Assessing NETosis markers
Для определения концентрации в плазме крови антигена миелопероксидазы человека (MПO:Aг) использовали набор для иммуноферментного анализа (ИФА) Hycult Biotech (Нидерланды), в соответствии с которым нормальный референтный уровень МПО:Аг составляет 2,56 ± 0,33 нг/мл.
Определение в плазме крови цитруллинированного гистона H3 (англ. citrullinated histone H3, citH3) выполняли с помощью набора для ИФА Citrullinated Histone H3 ELISA Kit (Cayman Chemical, Ann Arbor, США).
Определение маркеров тромбинемии и фибринообразования / Assessing markers of thrombinemia and fibrin formation
Определение маркеров тромбинемии – комплексов тромбин–антитромбин (ТАТ) проводили иммуноферментным способом с помощью набора Siemens Healthineers EnzygnostTM ТАТ MicroKit (Siemens Healthcare Diagnostics Products GmbH, Германия) иммуноферментным способом на спектрофотометре Boehnringer ELISA-Photometr (Boehnringer, Германия).
Содержание D-димера измеряли с помощью коммерческого иммуноанализа (TECHNOLEIA®, Австрия, реагент Techoclone). Концентрацию D-димера > 250 нг/мл считали патологической в соответствии с данными производителя.
Этические аспекты / Ethical aspects
Исследование проводили с учетом требований Хельсинской декларации. Пациентки после получения исчерпывающей информации подписывали информированное согласие.
Статистический анализ / Statistical analysis
Обработку данных осуществляли с использованием специализированного программного обеспечения Statistica 7.0 (StatSoft, Inc., США).
Статистическая обработка данных включала в себя расчёт описательных статистик: средней арифметической (M), среднеквадратического отклонения (SD), минимального и максимального значений лабораторных показателей.
Оценка на нормальность распределения проводилась при помощи теста Харке–Бера (Jarque–Bera test). Нулевая гипотеза H0 о том, что остатки значений рассматриваемых показателей групп участников имеют нормальное распределение, была нами отклонена на уровне значимости p ≤ 0,05.
Непараметрическая оценка и сравнение значений показателей между группами пациенток была проведена при помощи критерия Манна–Уитни для несвязанных выборок (Mann–Whitney U-test). Нулевая гипотеза H0 была сформулирована нами как отсутствие различий между группами пациенток. H0 отклонялась во всех случаях при уровнях значимости p ≤ 0,05.
При изучении связей между переменными с точки зрения отражения соответствующих причинно-следственных отношений между значениями МПО:Aг и citН3 проводили расчет ρ – коэффициента ранговой корреляции Спирмена (англ. Spearman Rank Order Correlations) с фиксацией уровня значимости коэффициента в корреляционной матрице на уровне значимости p ≤ 0,05.
РЕЗУЛЬТАТЫ / RESULTS
Клинико-анамнестическая характеристика обследованных / Сlinical and anamnestic characteristic
Клинико-анамнестические данные обследованных участниц исследования представлены в таблице 1.
Таблица 1. Клинико-анамнестическая характеристика.
Table 1. Clinical and anamnestic characteristics.
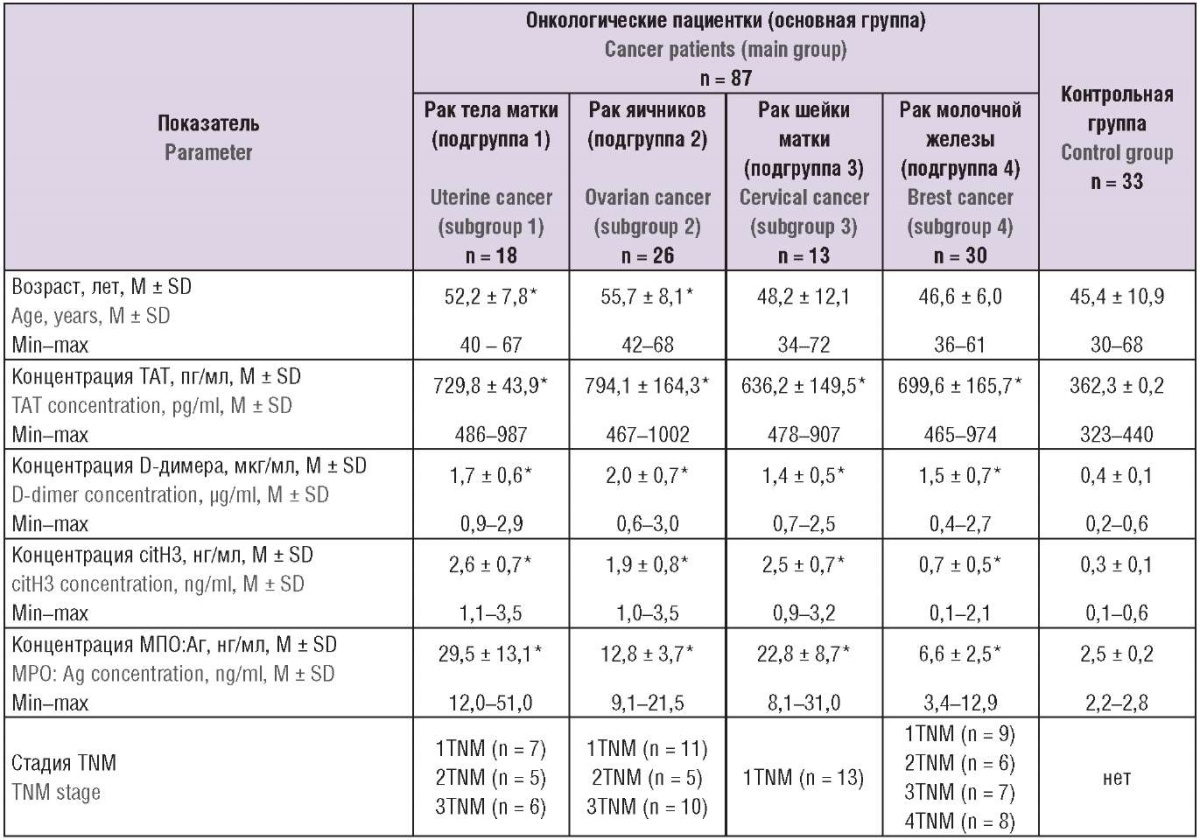
Примечание: *р < 0,05 – различия статистически значимы по сравнению с контрольной группой; ТАТ – комплексы тромбин–антитромбин; сitH3 – цитруллинированный гистон Н3, МПО:Аг – антиген миелопероксидазы человека; TNM – стадирование.
Note: *p < 0.05 – significant differences compared to the control group; TAT – thrombin–antithrombin complexes; citH3 – citrullinated histone H3; MPO:Ag – human myeloperoxidase antigen; TNM (tumor, nodus, metastasis) – staging.
Интенсивность нетоза у онкогинекологических пациенток / NETosis intensity in oncogynecological patients
Для оценки интенсивности нетоза у онкогинекологических пациенток определяли концентрации его маркеров – МПО:Аг и сitH3. Было показано, что содержание обоих маркеров было значительно выше у онкологических пациенток, чем у здоровых лиц (табл. 1, рис. 1, 2).
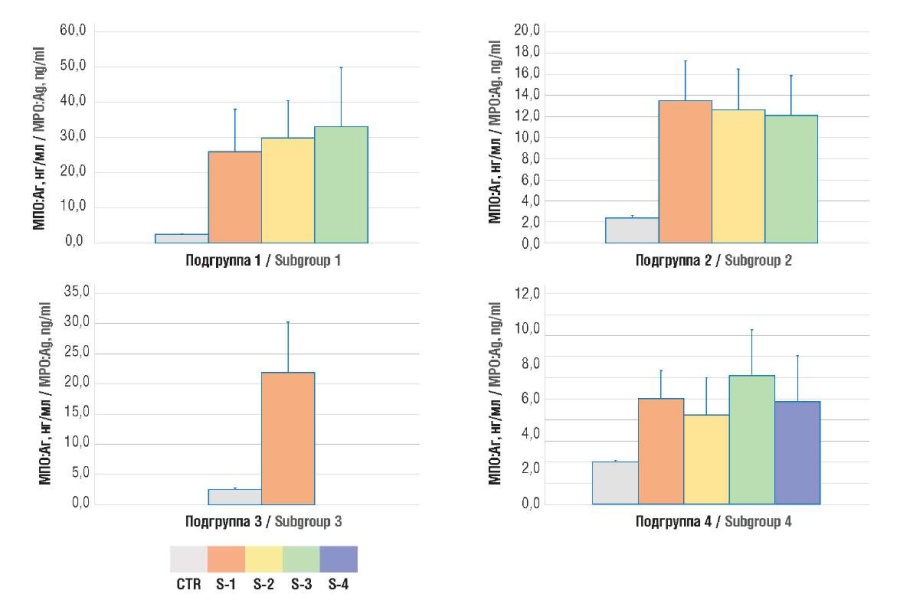
Рисунок 1. Содержание антигена миелопероксидазы человека (MПO:Aг) в плазме крови.
Примечание: подгруппа 1 – рак тела матки; подгруппа 2 – рак яичников; подгруппа 3 – рак шейки матки; подгруппа 4 – рак молочной железы; CTR – контрольная группа; S1-4 – стадии TNM 1-4.
Figure 1. Plasma level of human myeloperoxidase antigen (MPO:Ag).
Note: subgroup 1 – uterine body cancer; subgroup 2 – ovarian cancer; subgroup 3 – cervical cancer; subgroup 4 – breast cancer; CTR – control group; S1-4 – TNM stages 1-4.
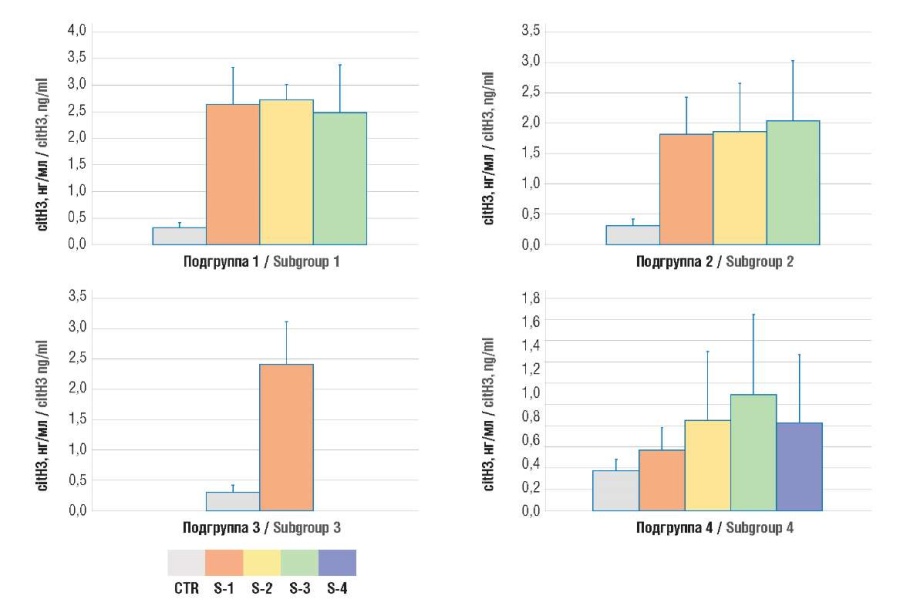
Рисунок 2. Содержание цитруллинированного гистона H3 (citH3) в плазме крови.
Примечание: подгруппа 1 – рак тела матки; подгруппа 2 – рак яичников; подгруппа 3 – рак шейки матки; подгруппа 4 – рак молочной железы; CTR – контрольная группа; S1-4 – стадии TNM 1-4.
Figure 2. Plasma level of citrullinated histone H3 (citH3).
Note: subgroup 1 – uterine body cancer; subgroup 2 – ovarian cancer; subgroup 3 – cervical cancer; subgroup 4 – breast cancer; CTR – control group; S1-4 – TNM stages 1-4.
Активация гемостаза у онкогинекологических пациенток / Hemostasis activation in oncogynecological patients
При анализе уровней D-димера и ТАТ у онкогинекологических пациенток выявлено их достоверное повышение в сравнении с контрольной группой и нарастание показателей с ростом стадии по TNM (рис. 3, 4).
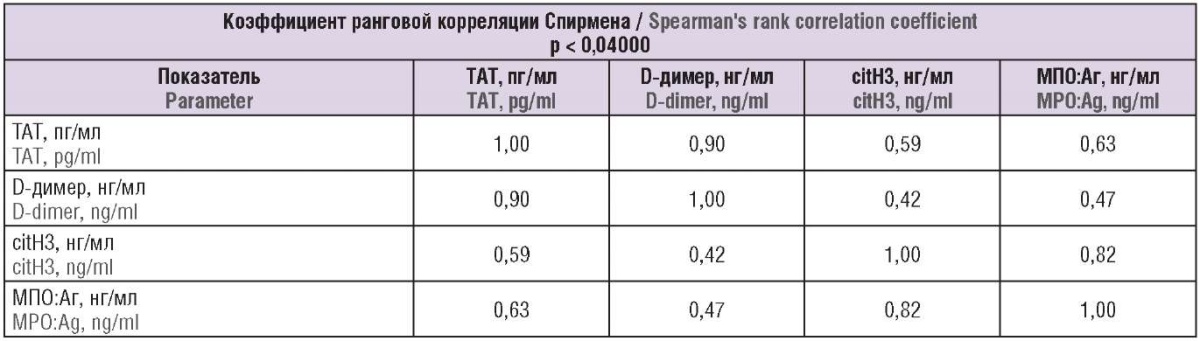
При последующем корреляционом анализе выявлена достоверная кореляция повышения концентрации комплексов ТАТ от концентрации citH3 и МПО:Аг (табл. 2, 3).
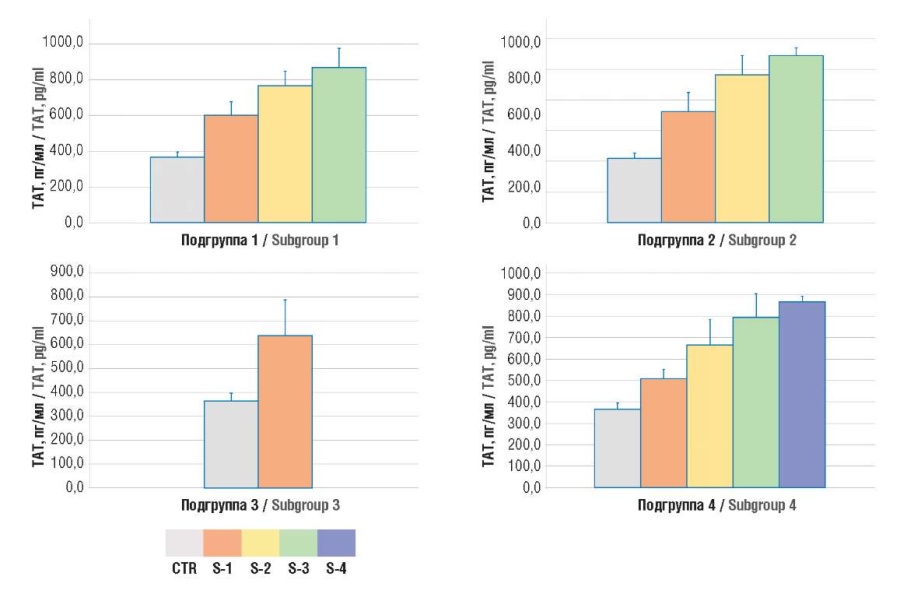
Рисунок 3. Содержание комплексов тромбин–антитромбин (ТАТ) в плазме крови.
Примечание: подгруппа 1 – рак тела матки; подгруппа 2 – рак яичников; подгруппа 3 – рак шейки матки; подгруппа 4 – рак молочной железы; CTR – контрольная группа; S1-4 – стадии TNM 1-4.
Figure 3. Plasma level of thrombin–antithrombin (TAT) complexes.
Note: subgroup 1 – uterine body cancer; subgroup 2 – ovarian cancer; subgroup 3 – cervical cancer; subgroup 4 – breast cancer; CTR – control group; S1-4 – TNM stages 1-4.
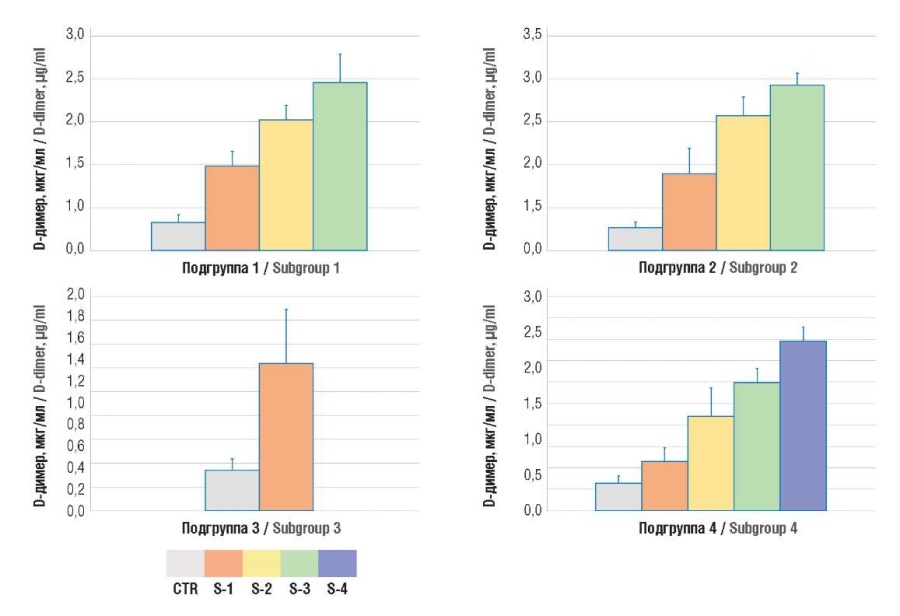
Рисунок 4. Содержание D-димера в плазме крови.
Примечание: подгруппа 1 – рак тела матки; подгруппа 2 – рак яичников; подгруппа 3 – рак шейки матки; подгруппа 4 – рак молочной железы; CTR – контрольная группа; S1-4 – стадии TNM 1-4.
Figure 4. Plasma D-dimer level.
Note: subgroup 1 – uterine body cancer; subgroup 2 – ovarian cancer; subgroup 3 – cervical cancer; subgroup 4 – breast cancer; CTR – control group; S1-4 – TNM stages 1-4.
Таблица 2. Корреляции между содержанием маркеров нетоза (citH3 и МПО:Аг) и комплексов тромбин–антитромбин (ТАТ) и D-димера.
Table 2. Correlations between NETosis markers (citH3 and MPO:Ag), thrombin–antithrombin complex (TAT) and D-dimer levels.
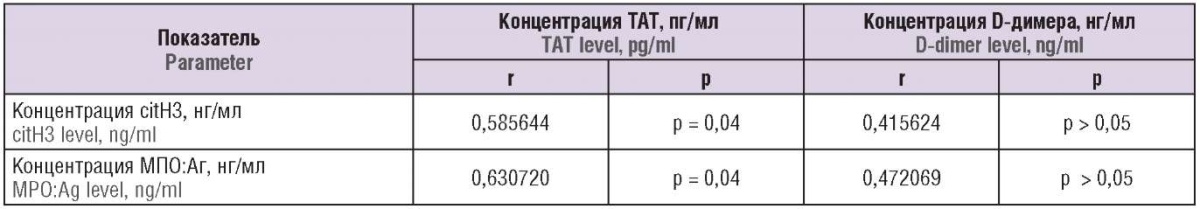
Таблица 3. Корреляционная матрица между концентрациями маркеров нетоза (citH3 и МПО:Аг) и комплексов тромбин–антитромбин (ТАТ) и D-димера (по Спирмену).
Table 3. A correlation matrix between the concentrations of NETosis markers (citH3 and MPO:Ag), thrombin–antithrombin complexes (TAT) and D-dimer (according to Spearman).
ОБСУЖДЕНИЕ / DISCUSSION
Гиперкоагуляция значительно увеличивает летальность у онкологических больных [9]. О взаимосвязи между раком и тромбозом известно еще со времен Армана Труссо, который описал взаимосвязь идиопатического венозного тромбоэмболизма с латентными опухолями. В недавних исследованиях было показано, что NETs участвуют в активации свертывания, способствуют инициации и прогрессированию тромбоза. Помимо этого, активно изучается вклад NETs в прогрессию опухоли и метастазирование.
Впервые NETs были описаны в 2004 г. [10]. NETs высвобождаются из активированных нейтрофилов в процессе нетоза, который первоначально был признан защитным механизмом для организма хозяина. NETs являются производными активированных нейтрофилов и состоят из нитей ДНК и гистонов, которые захватывают и удерживают различные патогены до их уничтожения с помощью белков-ферментов, входящих в состав NETs [11].
Однако впоследствии нетоз стали определять и при асептическом воспалении [4][12][13]. Была продемонстрирована роль NETs в таких аутоиммунных заболеваниях, как псориаз, системная красная волчанка и ревматоидный артрит [14–16]. NETs также принимают участие в патогенезе тромбоза при сахарном диабете, атеросклерозе и васкулитах [17–19].
NETs различными путями оказывают влияние на систему гемостаза, участвуя в создании прокоагулянтного состояния, нарушая работу антикоагулянтов и фибринолиз [20]. При стимуляции нейтрофилов мышей с раком молочной железы и хроническим миеломным лейкозом повышался синтез NETs с последующей активацией гемостаза [21].
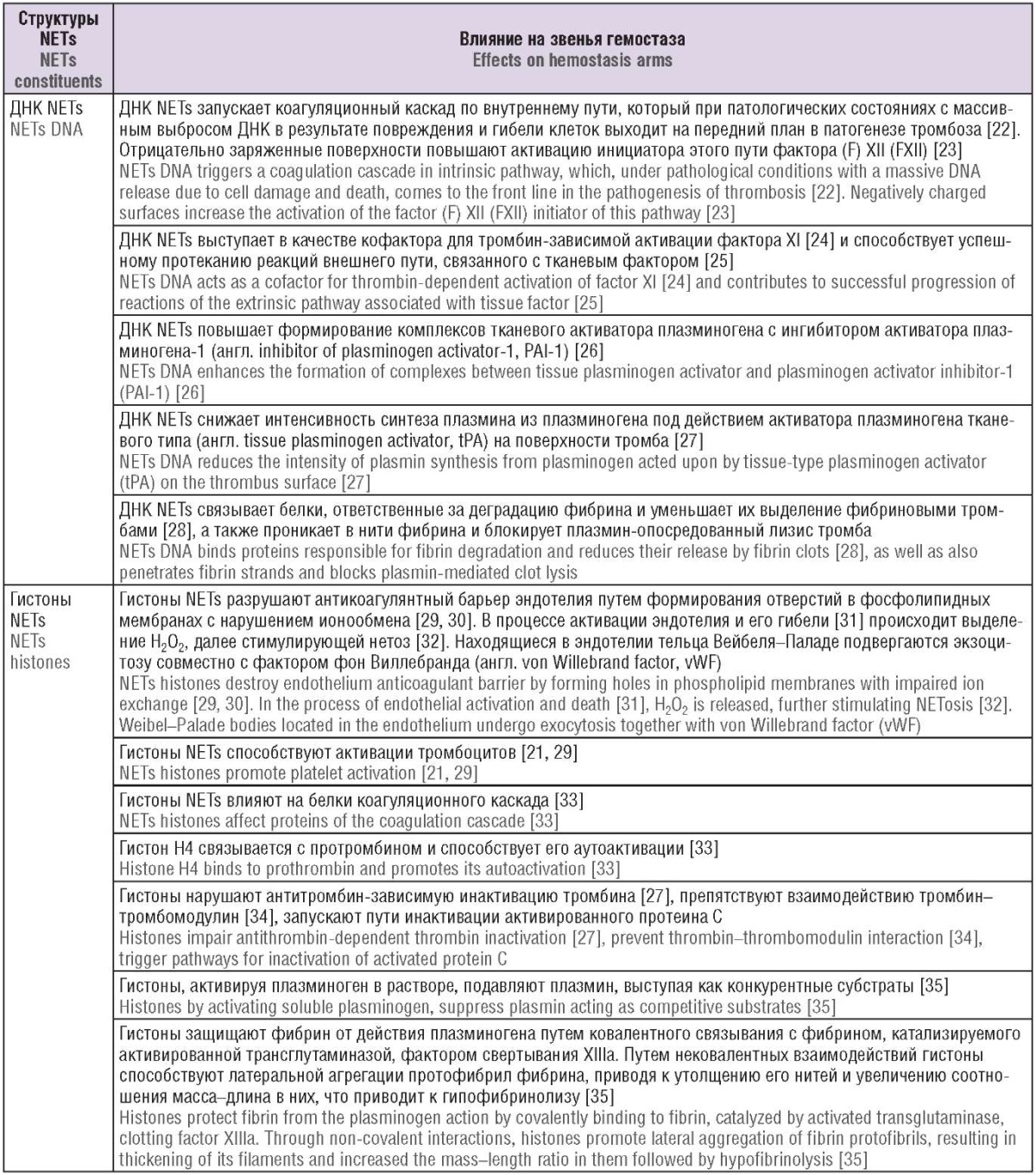
Многочисленные механизмы влияния NETs суммированы в таблице 4.
Таблица 4. Прокоагулянтные и антифибринолитические эффекты внеклеточных ловушек нейтрофилов (NETs).
Table 4. Procoagulant and antifibrinolytic effects of neutrophil extracellular traps (NETs).
В настоящем исследовании продемонстрирована роль NETs в активации системы свертывания у онкогинекологических пациенток с опухолями тела матки, шейки матки, яичников и молочной железы. В исследовании были оценены концентрации маркеров нетоза, таких как концентрации МПО:Аг и citН3 у онкогинекологических пациенток с различными источниками опухолей на разных стадиях заболевания. Одномоментно исследовали содержание D-димера и комплексов ТАТ. В нашем исследовании отмечено повышенное формирование NETs, а именно, достоверное повышение концентрации маркеров нетоза МПО:АГ и citH3 у онкологических пациентов, в большей степени на поздних стадиях TNM. Эти данные косвенно свидетельствуют о том, что повышение опухолевой нагрузки вызывает усиленное образование NETs. Параллельно повышению маркеров нетоза в зависимости от стадии заболевания происходило и нарастание концентрации маркеров активации гемостаза (D-димера и комплексов ТАТ). Выявлена достоверная корреляция между уровнем ТАТ от содержанием citH3 и МПО:Аг.
Роль NETs в процессе опухолевого роста в последние годы активно изучается. Доказано, что клетки-участницы воспалительной реакции и медиаторы воспаления способствуют индукции, росту опухоли и метастазированию [36]. Некоторые компоненты NETs оказывают цитотоксическое действие. Например, MПO повреждает клетки меланомы. При дефиците МПО у пациентов выше риск прогрессии опухоли и рецидивов [37]. Гистоны NETs разъедают сосудистую сеть опухоли, разрушают эпителиальные клетки и способствуют лизису клеток опухоли [7][38]. При этом протеазы NETs способны разрушать внеклеточный матрикс, запуская метастазирование. Выделяемая NETs матриксная металлопротеиназа 9 (англ. matrix metalloproteinase 9, ММР-9) блокирует апоптоз клеток опухоли и обеспечивает миграцию, инвазию и метастазирование, например, при раке легкого [39–41]. В одном из исследований NETs у пациентов с саркомой Юинга в опухолевой ткани были выявлены нейтрофилы, активно выделяющие NETs. При этом нейтрофилы и NETs определялись преимущественно у пациентов на поздних стадиях с метастазами. Болезнь быстро рецидивировала у пациентов с полной ремиссией после химиотерапии [42].
NETs, связываясь с опухолевыми клетками, облегчают им процесс метастазирования, связывая опухолевую клетку и эндотелий в органе-мишени метастаза. На животных моделях показано, что после фиксации NETs к эндотелию сосудов они начинают захват опухолевых клеток нитями ДНК из кровотока. Таким образом, формирование NETs, прогрессия опухоли, метастазирование могут формировать порочный круг у онкологических пациентов. Вышеописанный механизм дает возможность рассматривать NETs в качестве одного из участников процесса метастазирования, а значит, и как возможную мишень для потенциальной терапии. Предотвратить влияние NETs на прогрессию опухоли потенциально возможно введением ингибиторов эластаз или ДНКаз [43].
В данном исследовании параллельно изучению уровней маркеров нетоза проводилась оценка содержания маркеров активации гемостаза, а именно, ТАТ и D-димера, при этом у всех пациенток выявлена достоверная активация гемостаза. Однако при проведении корреляционного анализа достоверная корреляция была установлена лишь между значениями комплексов ТАТ и маркерами нетоза.
В исследованиях на животных моделях рака были выявлены повышенная инфильтрация нейтрофилами тканей различных органов, сосудистые повреждения и тромбоцитарно-нейтрофильные комплексы как результат массивного нетоза. Введение ДНКазы давало положительный эффект в регрессе этих состояний, что еще раз подтверждает вклад нетоза в развитие при раке полиорганной недостаточности [8]. Исследования, не так давно проведенные на животных, показали, что подавление нетоза снижает активность нарастания протромботического состояния и метастазирования [7][8][43].
Таким образом, NETs являются одними из основных игроков в запуске тромбообразования при раке. Соответственно, NETs могут выступать в роли мищени для разработки новых подходов к тромбопрофилактике [44]. Определение маркеров нетоза является потенциальным скринингом начальных нарушений в системе гемостаза в тех ситуациях, когда основные тесты лабораторной оценки еще не изменены.
ЗАКЛЮЧЕНИЕ / CONCLUSION
Результаты проведенного исследования свидетельствуют о том, что опухолевая ткань создает условия, стимулирующие нейтрофилы к высвобождению прокоагулянтных внеклеточных ловушек, которые, в свою очередь не только способствуют созданию прокоагулянтного состояния, но также и являются одним из факторов, обеспечивающих метастазирование. Разработка терапии, направленной на NETs, потенциально способна оказать влияние на систему гемостаза у онкологических пациентов и снизить интенсивность процессов метастазирования.
Список литературы
1. Timp J.F., Braekkan S.K., Versteeg H.H., Cannegieter S.C. Epidemiology of cancer-associated venous thrombosis. Blood. 2013;122(10):1712–23. https://doi.org/10.1182/blood-2013-04-460121.
2. Klerk C.P., Smorenburg S.M., Otten H.-M. et al. The effect of low molecular weight heparin on survival in patients with advanced malignancy. J Clin Oncol. 2005;23(10):2130–5. https://doi.org/10.1200/JCO.2005.03.134.
3. Akl E.A., Schünemann H.J. Routine heparin for patients with cancer? One answer, more questions. N Engl J Med. 2012;366(7):661–2. https://doi.org/10.1056/NEJMe1113672.
4. Stakos D.A., Kambas K., Konstantinidis T. et al. Expression of functional tissue factor by neutrophil extracellular traps in culprit artery of acute myocardial infarction. Eur Heart J. 2015;36(22):1405–14. https://doi.org/10.1093/eurheartj/ehv007.
5. Gould T.J., Vu T.T., Swystun L.L. et al. Neutrophil extracellular traps promote thrombin generation through platelet-dependent and plateletindependent mechanisms. Arterioscler Thromb Vasc Biol. 2014;34(9):1977–84. https://doi.org/10.1161/ATVBAHA.114.304114.
6. Hanahan D., Weinberg R.A. Hallmarks of cancer: the next generation. Cell. 2011;144(5):646–74. https://doi.org/10.1016/j.cell.2011.02.013.
7. Demers M., Krause D.S., Schatzberg D. et al. Cancers predispose neutrophils to release extracellular DNA traps that contribute to cancerassociated thrombosis. Proc Natl Acad Sci U S A. 2012;109(32):13076– 81. https://doi.org/10.1073/pnas.1200419109.
8. Cedervall J., Zhang Y., Huang H. et al. Neutrophil extracellular traps accumulate in peripheral blood vessels and compromise organ function in tumor-bearing animals. Cancer Res. 2015;75(13):2653–62. https://doi.org/10.1158/0008-5472.CAN-14-3299.
9. Nierodzik M.L., Karpatkin S. Thrombin induces tumor growth, metastasis, and angiogenesis: Evidence for a thrombin-regulated dormant tumor phenotype. Cancer Cell. 2006;10(5):355–62. https://doi.org/10.1016/j.ccr.2006.10.002.
10. Brinkmann V., Reichard U., Goosmann C. et al. Neutrophil extracellular traps kill bacteria. Science. 2004;303(5663):1532–5. https://doi.org/10.1126/science.1092385.
11. Papayannopoulos V. Neutrophil extracellular traps in immunity and disease. Nat Rev Immunol. 2018;18(2):134–47. https://doi.org/10.1038/nri.2017.105.
12. Wong S.L., Demers M., Martinod K. et al. Diabetes primes neutrophils to undergo NETosis, which impairs wound healing. Nat Med. 2015;21(7):815–9. https://doi.org/10.1038/nm.3887.
13. Schauer C., Janko C., Munoz L.E. et al. Aggregated neutrophil extracellular traps limit inflammation by degrading cytokines and chemokines. Nat Med. 2014;20(5):511–7. https://doi.org/10.1038/nm.3547.
14. El-Shebini E.M., Shoeib S.A., Elghotmy A.H. Neutrophil extracellular traps in systemic lupus erythematosus. Menoufia Med J. 2020;33(3):729–32. https://doi.org/10.4103/mmj.mmj_431_18.
15. Manneras-Holm L., Baghaei F., Holm G. et al. Coagulation and fibrinolytic disturbances in women with polycystic ovary syndrome. J Clin Endocrinol Metab. 2011;96(4):1068–76. https://doi.org/10.1210/jc.2010-2279.
16. Gray R.D., Hardisty G., Regan K.H. et al. Delayed neutrophil apoptosis enhances NET formation in cystic fibrosis. Thorax. 2018;73(2):134–44. https://doi.org/10.1136/thoraxjnl-2017-210134.
17. Fuchs T.A., Brill A., Duerschmied D. et al. Extracellular DNA traps promote thrombosis. Proc Natl Acad Sci U S A. 2010;107(36):15880–5. https://doi.org/10.1073/pnas.1005743107.
18. Wang L., Zhou X., Yin Y. et al. Hyperglycemia induces neutrophil extracellular traps formation through an NADPH oxidase-dependent pathway in diabetic retinopathy. Front Immunol. 2019;9:3076. https://doi.org/10.3389/fimmu.2018.03076.
19. Warnatsch A., Ioannou M., Wang Q., Papayannopoulos V. Inflammation. Neutrophil extracellular traps license macrophages for cytokine production in atherosclerosis. Science. 2015;349(6245):316–20. https://doi.org/10.1126/science.aaa8064.
20. Gould T., Lysov Z., Liaw P. Extracellular DNA and histones: double-edged swords in immunothrombosis. J Thromb Haemost. 2015;13 Suppl 1:S82– S91. https://doi.org/10.1111/jth.12977.
21. Demers M., Wagner D.D. Neutrophil extracellular traps: A new link to cancer-associated thrombosis and potential implications for tumor progression. Oncoimmunology. 2013;2(2):e22946. https://doi.org/10.4161/onci.22946.
22. Delabranche X., Helms J., Meziani F. Immunohaemostasis: a new view on haemostasis during sepsis. Ann Intensive Care. 2017;7():117. https://doi.org/10.1186/s13613-017-0339-5.
23. Naudin C., Burillo E., Blankenberg S. et al. Factor XII contact activation. Semin Thromb Hemost. 2017;43(8):814–26. https://doi.org/10.1055/s-0036-1598003.
24. Vu T.T., Leslie B.A., Stafford A.R. et al. Histidine-rich glycoprotein binds DNA and RNA and attenuates their capacity to activate the intrinsic coagulation pathway. Thromb Haemost. 2016;115(1):89–98. https://doi.org/10.1160/TH15-04-0336.
25. Noubouossie D.F., Whelihan M.F., Yu Y.-B. et al. In vitro activation of coagulation by human neutrophil DNA and histone proteins but not neutrophil extracellular traps. Blood. 2017;129(8):1021–9. https://doi.org/10.1182/blood-2016-06-722298.
26. Komissarov A.A., Florova G., Idell S. Effects of extracellular DNA on plasminogen activation and fibrinolysis. J Biol Chem. 2011;286(49):41949–62. https://doi.org/10.1074/jbc.M111.301218.
27. Varjú I., Longstaff C., Szabó L. et al. DNA, histones and neutrophil extracellular traps exert anti-fibrinolytic effects in a plasma environment. Thromb Haemost. 2015;113(6):1289–98. https://doi.org/10.1160/TH14-08-0669.
28. Longstaff C., Varjú I., Sótonyi P. et al. Mechanical stability and fibrinolytic resistance of clots containing fibrin, DNA, and histones. J Biol Chem. 2013;288(10):6946–56. https://doi.org/10.1074/jbc.M112.404301.
29. Qi H., Yang S., Zhang L. Neutrophil extracellular traps and endothelial dysfunction in atherosclerosis and thrombosis. Front Immunol. 2017;8:928. https://doi.org/10.3389/fimmu.2017.00928.
30. Xu J., Zhang X., Pelayo R. et al. Extracellular histones are major mediators of death in sepsis. Nat Med. 2009;15(11):1318–21. https://doi.org/10.1038/nm.2053.
31. Saffarzadeh M., Juenemann C., Queisser M.A. et al. Neutrophil extracellular traps directly induce epithelial and endothelial cell death: a predominant role of histones. PLoS One. 2012;7(2):e32366. https://doi.org/10.1371/journal.pone.0032366.
32. Fuchs T.A., Abed U., Goosmann C. et al. Novel cell death program leads to neutrophil extracellular traps. J Cell Biol. 2007;176(2):231–41. https://doi.org/10.1083/jcb.200606027.
33. Barranco-Medina S., Pozzi N., Vogt A.D., Di Cera E. Histone H4 promotes prothrombin autoactivation. J Biol Chem. 2013;288(50):35749–57. https://doi.org/10.1074/jbc.M113.509786.
34. Ammollo C.T., Semeraro F., Xu J. et al. Extracellular histones increase plasma thrombin generation by impairing thrombomodulin-dependent protein C activation. J Thromb Haemost. 2011;9(9):1795–803. https://doi.org/10.1111/j.1538-7836.2011.04422.x.
35. Gould T.J., Vu T.T., Stafford A.R. et al. Cell-free DNA modulates clot structure and impairs fibrinolysis in sepsis. Arterioscler Thromb Vasc Biol. 2015;35(12):2544–53. https://doi.org/10.1161/ATVBAHA.115.306035.
36. Mantovani A., Allavena P., Sica A., Balkwill F. Cancer-related inflammation. Nature. 2008;454(7203):436–44. https://doi.org/10.1038/nature07205.
37. Metzler K.D., Fuchs T.A., Nauseef W.M. et al. Myeloperoxidase is required for neutrophil extracellular trap formation: implications for innate immunity. Blood. 2011;117(3):953–9. https://doi.org/10.1182/blood2010-06-290171.
38. Al-Benna S., Shai Y., Jacobsen F., Steinstraesser L. Oncolytic activities of host defense peptides. Int J Mol Sci. 2011;12(11):8027–51. https://doi.org/10.3390/ijms12118027.
39. Acuff H.B., Carter K.J., Fingleton B. et al. Matrix metalloproteinase-9 from bone marrow–derived cells contributes to survival but not growth of tumor cells in the lung microenvironment. Cancer Res. 2006;66(1):259– 66. https://doi.org/10.1158/0008-5472.CAN-05-2502.
40. Masson V., De La Ballina L.R., Munaut C. et al. Contribution of host MMP-2 and MMP-9 to promote tumor vascularization and invasion of malignant keratinocytes. FASEB J. 2005;19(2):234–6. https://doi.org/10.1096/fj.04-2140fje.
41. Pahler J.C., Tazzyman S., Erez N. et al. Plasticity in tumor-promoting inflammation: impairment of macrophage recruitment evokes a compensatory neutrophil response. Neoplasia. 2008;10(4):329–40. https://doi.org/10.1593/neo.07871.
42. Berger-Achituv S., Brinkmann V., Abu-Abed U. et al. A proposed role for neutrophil extracellular traps in cancer immunoediting. Front Iimmunol. 2013;4:48. https://doi.org/10.3389/fimmu.2013.00048.
43. Cools-Lartigue J., Spicer J., McDonald B. et al. Neutrophil extracellular traps sequester circulating tumor cells and promote metastasis. J Clin Invest. 2013;123(8):3446–58. https://doi.org/10.1172/JCI67484.
44. Gregory A.D., Houghton A.M. Tumor-associated neutrophils: new targets for cancer therapy. Cancer Res. 2011;71()7:2411–6. https://doi.org/10.1158/0008-5472.CAN-10-2583.
Об авторах
Е. В. СлуханчукРоссия
Слуханчук Екатерина Викторовна – к.м.н., доцент кафедры акушерства, гинекологии и перинатальной медицины Клинического института детского здоровья имени Н.Ф. Филатова
119991 Москва, ул. Большая Пироговская, д. 2, стр. 4
В. О. Бицадзе
Россия
Бицадзе Виктория Омаровна – д.м.н., профессор РАН, профессор кафедры акушерства, гинекологии и перинатальной медицины Клинического института детского здоровья имени Н.Ф. Филатова
Scopus Author ID: 6506003478
Researcher ID: F-8409-2017
119991 Москва, ул. Большая Пироговская, д. 2, стр. 4
А. Г. Солопова
Россия
Солопова Антонина Григорьевна – д.м.н., профессор кафедры акушерства, гинекологии и перинатальной медицины Клинического института детского здоровья имени Н.Ф. Филатова
Scopus Author ID: 6505479504
Researcher ID: Q-1385-2015
119991 Москва, ул. Большая Пироговская, д. 2, стр. 4
Д. Х. Хизроева
Россия
Хизроева Джамиля Хизриевна – д.м.н., профессор кафедры акушерства, гинекологии и перинатальной медицины Клинического института детского здоровья имени Н.Ф. Филатова
Scopus Author ID: 57194547147
Researcher ID: F-8384-2017
119991 Москва, ул. Большая Пироговская, д. 2, стр. 4
Н. Д. Дегтярева
Россия
Дегтярева Наталья Дмитриевна – студент 5-го курса Клинического института детского здоровья имени Н.Ф. Филатова
119991 Москва, ул. Большая Пироговская, д. 2, стр. 4
Д. В. Щербаков
Россия
Щербаков Денис Викторович – к.м.н., доцент кафедры общей гигиены института общественного здоровья имени Ф.Ф. Эрисмана
119991 Москва, ул. Большая Пироговская, д. 2, стр. 4
Ж.-К. Гри
Россия
Гри Жан-Кристоф – д.м.н., профессор кафедры акушерства, гинекологии и перинатальной медицины Клинического института детского здоровья имени Н.Ф. Филатова; профессор гематологии, зав. лабораторией гематологии факультета биологических и фармацевтических наук; иностранный член РАН
Scopus Author ID: 7005114260
Researcher ID: AAA-2923-2019
119991 Москва, ул. Большая Пироговская, д. 2, стр. 4
Франция, 34090 Монпелье, ул. Огюста Бруссоне, д. 163
И. Элалами
Россия
Элалами Исмаил – д.м.н., профессор кафедры акушерства, гинекологии и перинатальной медицины Клинического института детского здоровья имени Н.Ф. Филатова; профессор медицинского Университета Сорбонны; директор гематологии Центра Тромбозов, Госпиталь Тенон
Scopus Author ID: 7003652413
Researcher ID: AAC-9695-2019
119991 Москва, ул. Большая Пироговская, д. 2, стр. 4
Франция, 75006 Париж, Улица медицинского факультета, д. 12
Франция, 75020 Париж, Китайская улица, д. 4
А. Д. Макацария
Россия
Макацария Александр Давидович – д.м.н., профессор, академик РАН, зав. кафедрой акушерства, гинекологии и перинатальной медицины Клинического института детского здоровья имени Н.Ф. Филатова
Scopus Author ID: 57222220144
Researcher ID: M-5660-2016
119991 Москва, ул. Большая Пироговская, д. 2, стр. 4
Рецензия
Для цитирования:
Слуханчук Е.В., Бицадзе В.О., Солопова А.Г., Хизроева Д.Х., Дегтярева Н.Д., Щербаков Д.В., Гри Ж., Элалами И., Макацария А.Д. Вклад внеклеточных ловушек нейтрофилов в протромботическое состояние и прогрессию опухоли у онкогинекологических пациенток. Акушерство, Гинекология и Репродукция. 2023;17(1):53-64. https://doi.org/10.17749/2313-7347/ob.gyn.rep.2023.385
For citation:
Slukhanchuk E.V., Bitsadze V.O., Solopova A.G., Khizroeva J.Kh., Degtyareva N.D., Shcherbakov D.V., Gris J., Elalamy I., Makatsariya A.D. An impact of neutrophil extracellular traps to the prothrombotic state and tumor progression in gynecological cancer patients. Obstetrics, Gynecology and Reproduction. 2023;17(1):53-64. https://doi.org/10.17749/2313-7347/ob.gyn.rep.2023.385

Контент доступен под лицензией Creative Commons Attribution-NonCommercial-ShareAlike 4.0 International License.










































