Перейти к:
Прогнозирование задержки роста плода: математическое моделирование
https://doi.org/10.17749/2313-7347/ob.gyn.rep.2022.328
Аннотация
Введение. В мире ежегодно рождается более 13 млн младенцев с задержкой роста плода (ЗРП), которая увеличивает показатели фето-инфантильной заболеваемости и смертности. Поскольку эффективных медикаментозных методов лечения ЗРП не существует, крайне актуальными являются профилактика и прогнозирование этого состояния.
Цель: разработка прогностической клинико-анамнестической математической модели для оценки риска развития ЗРП в течение беременности.
Материалы и методы. Проведено ретроспективное сравнительное открытое исследование. В основную группу (группа 1) были включены 75 пациенток, у которых в течение беременности была выявлена ЗРП; контрольная группа (группа 2) состояла из 414 женщин с благополучным исходом беременности. Всем беременным было проведено обследование, включающее сбор анамнеза, комплекс пренатальной диагностики в I триместре беременности – ультразвуковое исследование, доплерометрию маточных артерий, определение содержания ассоциированного с беременностью протеина-А плазмы (англ. pregnancy-associated plasma protein-A, РАРР-А), свободной бета-субъединицы хорионического гонадотропина человека (β-ХГЧ), плацентарного фактора роста (англ. placental growth factor, PlGF), проведение неинвазивного пренатального теста (НИПТ).
Результаты. Для определения относительного вклада каждого отдельного признака в формирование риска ЗРП и разработки прогностического индекса был проведен дискриминантный анализ, на основании которого был разработан прогностический индекс F. Формула для расчета индекса F включает: возраст беременной; данные акушерского анамнеза; способ зачатия; наличие у беременной никотиновой зависимости, миомы матки; индекс массы тела; биохимические показатели (РАРР-А, β-ХГЧ, PlGF); толщину воротникового пространства плода; пульсационный индекс маточной артерии; уровень фетальной фракции и пол плода (определяются при проведении НИПТ). Показатели чувствительности и специфичности прогноза ЗРП составили соответственно 90,1 и 82,18 %, эффективность способа – 83,97 %.
Заключение. Разработанный способ прогнозирования ЗРП может быть использован в клинической практике для формирования групп риска по развитию ЗРП и для выбора тактики ведения беременности.
Ключевые слова
Для цитирования:
Кудрявцева Е.В., Ковалев В.В., Дектярев А.А., Баранов И.И. Прогнозирование задержки роста плода: математическое моделирование. Акушерство, Гинекология и Репродукция. 2022;16(6):664-675. https://doi.org/10.17749/2313-7347/ob.gyn.rep.2022.328
For citation:
Kudryavtseva E.V., Kovalev V.V., Dektyarev A.A., Baranov I.I. Predicting fetal growth retardation: mathematical modeling. Obstetrics, Gynecology and Reproduction. 2022;16(6):664-675. (In Russ.) https://doi.org/10.17749/2313-7347/ob.gyn.rep.2022.328
ВВЕДЕНИЕ / INTRODUCTION
Задержка роста плода (ЗРП) осложняет течение от 3 до 7 % всех беременностей. ЗРП определяется как состояние, при котором плод не достигает своего потенциала роста, который определен генетически. Ежегодно в мире рождается более 13 млн младенцев с ЗРП [1]. ЗРП увеличивает показатели фето-инфантильной заболеваемости и смертности [1–5]; почти половина случаев мертворождений связана с ЗРП [2][6]. Краткосрочные осложнения возникают вскоре после рождения и включают респираторный дистресс-синдром, перинатальную асфиксию, синдром аспирации мекония, гипогликемию, полицитемию, нефизиологическую гипербилирубинемию, сепсис, гипокальциемию, плохую терморегуляцию и иммунологическую недостаточность [7]. Неонатальная смертность повышена у детей с ЗРП, причем она напрямую связана со степенью тяжести ЗРП и обратно пропорциональна степени зрелости ребенка при рождении. К отдаленным последствиям относятся когнитивные нарушения и расстройства нервной системы, различные нарушения мелкой и крупной моторики, синдром дефицита внимания с гиперактивностью и церебральный паралич. В дальнейшем дети, родившиеся с ЗРП, подвержены повышенному риску ожирения, сердечно-сосудистых заболеваний, метаболического синдрома, гиперхолестеринемии, дислипидемии, сахарному диабету и почечным заболеваниям в более позднем возрасте [8].
Следует отличать ЗРП от такого состояния как «плод, малый для гестационного возраста» (англ. small for gestational age). У плода, малого для гестационного возраста (МГВ), размеры ниже порогового значения для соответствующего срока гестации, но при этом низкий риск перинатальных осложнений, т. е. это плоды, имеющие конституционально маленький размер. В то же время плод с размером выше 10-го процентиля, но у которого есть генетический потенциал для размеров выше среднего, может на самом деле иметь ЗРП и, следовательно, повышенный риск неблагоприятного перинатального и отдаленного исхода [9].
В настоящее время для дифференциальной диагностики ЗРП наиболее эффективным признано использование критериев, одобренных Международным обществом ультразвука в акушерстве и гинекологии (The International Society of Ultrasound in Obstetrics and Gynecology, ISUOG) [10]. Критериями ранней ЗРП являются: срок беременности < 32 нед, окружность живота (ОЖ) или предполагаемая масса плода (ПМП) < 3-го перцентиля, либо ОЖ или ПМП < 10-го перцентиля в комбинации с доплерометрическими показателями – увеличение пульсационного индекса (англ. pulsation index, PI) маточной артерии (МА) или PI пуповинной артерии (ПА) > 95-го перцентиля. Для диагностики поздней ЗРП критериями являются ОЖ или ПМП < 3-го перцентиля или ОЖ или ПМП < 10-го перцентиля в сочетании с цереброплацентарным отношением < 5-го перцентиля и/или PI ПА > 95-го перцентиля [10].
В Российской Федерации разработаны и внедрены клинические рекомендации для диагностики и профилактики ЗРП. В них подробно описан алгоритм действий, направленный на выявление групп риска и описание методов медицинской помощи при ЗРП [9].
Основным методом медицинской помощи при поздней ЗРП является родоразрешение. Однако при ранней ЗРП досрочное родоразрешение не приводит к существенному улучшению перинатальных исходов [11]. После того, как в результате ультразвукового исследования (УЗИ) и доплерометрии выставляется диагноз МГВ или ЗРП, дополнительные исследования преследуют только 2 цели: оценить жизнеспособность плода и возможность пролонгирования беременности с точки зрения безопасности для матери и по возможности установить причину ЗРП [12]. Поскольку эффективных медикаментозных методов лечения ЗРП не существует, крайне актуальными являются прогнозирование и профилактика этого состояния [11].
Изначально с целью скрининга ЗРП проводилось только измерение высоты стояния дна матки с 24 нед беременности. В 32–34 нед беременности чувствительность этого метода составляет 65–85 %, специфичность – 96 % [13]. Но в этом случае речь скорее идет не о выделении группы риска, а о выявлении беременных с уже свершившейся ЗРП.
Для выделения группы риска ЗРП на сегодняшний день оцениваются материнские характеристики. Чаще всего в модели для оценки риска ЗРП включают такие параметры как возраст беременной, массоростовые параметры, этническая принадлежность, патологические зависимости (употребление никотина, алкоголя, психоактивных веществ), соматическая патология (артериальная гипертензия, сахарный диабет, хронические болезни почек, аутоиммуные заболевания), использование вспомогательных репродуктивных технологий, акушерский анамнез [14]. Однако данный набор характеристик существенно зависит от исследуемой популяции.
При использовании большинства моделей уровень риска рассчитывается прежде всего на основе материнских характеристик, а биохимические маркеры – ассоциированный с беременностью протеин-А плазмы (англ. pregnancy-associated plasma protein-A, РАРР-А), свободная бета-субъединица хорионического гонадотропина человека (β-ХГЧ; англ. free betasubunit of human chorionic gonadotropin), плацентарный фактор роста (англ. placental growth factor, PlGF) и доплерометрические показатели лишь уточняют группу риска. При таком подходе значительная часть пациенток, у которых отсутствуют критически важные анамнестические факторы риска, такие как тяжелая соматическая патология или отягощенный акушерский анамнез, могут по результатам скрининга I триместра не попасть в группу высокого риска, а при этом беременность у ряда из них осложнится ЗРП. С другой стороны, при наличии весомых факторов риска у матери, беременная, вероятно, попадет в группу высокого риска независимо от биохимических показателей. Дополнение оценки факторов риска биохимическими параметрами у женщин с высоким риском ЗРП несколько повышает эффективность прогностической модели [5][14]; однако экономическая эффективность при таком подходе не исследовалась и представляется весьма сомнительной.
В настоящее время известно несколько математических моделей, рассчитывающих уровень риска преэклампсии (ПЭ) и ЗРП, однако ни одна из них не была разработана и валидирована на российской популяции. Кроме того, признается, что большинство случаев ЗРП не прогнозируется при проведении скрининга в I триместре, чувствительность скрининга по-прежнему низка – 37–73 % при 10–15 % ложноположительных результатов [15]. На наш взгляд, математические прогностические модели, учитывающие многие факторы риска и клинико-анамнестические данные, могут быть более эффективными для прогнозирования ЗРП.
Цель: разработка прогностической клинико-анамнестической математической модели для оценки риска развития ЗРП в течение беременности.
МАТЕРИАЛЫ И МЕТОДЫ / MATERIALS AND METHODS
Дизайн исследования / Study design
На базе кафедры акушерства и гинекологии, трансфузиологии ФГБОУ ВО УГМУ Минздрава России проведено ретроспективное сравнительное открытое исследование. В период в 2018–2020 гг. обследованы 840 беременных – жительниц Свердловской области, которым в 2018–2020 гг. в 10–18 нед беременности помимо стандартного комплекса пренатальной диагностики был выполнен неинвазивный пренатальный тест (НИПТ).
Критерии включения и исключения / Inclusion and exclusion criteria
Критерии включения: отсутствие врожденных пороков развития (ВПР) плода по данным УЗИ в I триместре; наличие у пациентки результатов НИПТ; согласие пациентки на участие в исследование.
Критерии невключения: наличие тяжелой соматической и/или психической патологии, являющейся противопоказанием для вынашивания беременности [16].
Критерии исключения: отсутствие информации об исходе беременности; тяжелая ПЭ, явившаяся показанием для досрочного родоразрешения; самопроизвольный выкидыш, либо неразвивающаяся беременность; самопроизвольные преждевременные роды; диабетическая фетопатия плода; антенатальная гибель плода, не имеющего ЗРП; отказ пациентки от участия в исследовании.
Группы обследованных / Study groups
В зависимости от исходов беременности пациентки были разделены на 2 группы. В группу 1 (основную) были включены 75 пациенток, у которых в течение беременности была выявлена ЗРП; при этом после рождения у ребенка не было признаков наличия хромосомных анеуплоидий (ХА). Группа 2 (контрольная) состояла из 414 пациенток с благополучным исходом беременности (т. е. беременность, завершившаяся рождением доношенного живого здорового ребенка без признаков ХА и ЗРП). Согласно критериям исключения, 351 пациентка была исключена из исследования.
Методы исследования / Study methods
Обследование участниц исследования включало в себя подробный сбор соматического и акушерскогинекологического анамнеза; комплекс пренатальной диагностики (КПД) в I триместре беременности – ультразвуковое и биохимическое исследование, доплерометрия маточных артерий; НИПТ с определением фетальной фракции (ФФ).
Согласно Приказу Министерства здравоохранения Российской Федерации от 01.11.2012 № 572н «Об утверждении Порядка оказания медицинской помощи по профилю "акушерство и гинекология (за исключением использования вспомогательных репродуктивных технологий)"» [17] у всех женщин осуществляли отбор образцов крови для определения материнских сывороточных маркеров РАРР-А, β-ХГЧ и PlGF. Данные маркеры оценивались в абсолютных значениях (МЕ/мл) и в кратности медиане (англ. multiples of the median, MoM).
Всем женщинам было проведено скрининговое УЗИ в I триместре беременности в сроке 11–14 нед гестации на аппаратах экспертного класса Voluson E6 (GE Ultrasound Korea, Ltd, Корея), в процессе которого врачами экспертами оценивались такие показатели как копчико-теменной размер и толщина воротникового пространства, проводилась оценка анатомии плода и доплерометрия маточных артерий (PI МА).
При выполнении НИПТ (ООО «Геномед», Россия) все этапы анализа проводились в строгом соответствии со стандартными операционными процедурами, инструкциями производителей оборудования и наборов реагентов. В соответствии с рекомендациями экспертов [18], всем пациенткам НИПТ был проведен не ранее 10 нед беременности.
Из плазмы крови беременной выделялась внеклеточная ДНК, фрагменты которой далее подвергались высокопроизводительному секвенированию, в результате чего была получена информация о последовательности нуклеотидов в этих фрагментах для определения принадлежности к определенной хромосоме. Далее устанавливалось количество фрагментов внеклеточной ДНК суммарно материнского и плодового происхождения.
Этические аспекты/ Ethical aspects
Все процедуры, выполненные в данном исследовании, соответствуют этическим стандартам Хельсинкской декларации 1964 г. и ее последующим изменениям или сопоставимым нормам этики.
Дизайн исследования рассмотрен и одобрен локальным этическим комитетом ФГБОУ ВО УГМУ Минздрава России, протокол № 2 от 28.02.2020. Все участницы исследования были проинформированы о методах и характере исследования, включении результатов обследования в научное исследование и подписали добровольное информированное согласие. Перед проведением НИПТ каждая пациентка была ознакомлена с возможностями и ограничениями данного метода исследования и подписывала информированное согласие на проведение данного метода исследования и на участие в научном исследовании.
Методы статистического анализа / Statistical analysis
Статистическая обработка проводилась с помощью компьютерных программ StatPlus (Analyst Soft Inc., США), Jamovi (The jamovi project, Австралия), Microsoft Excel 2016 (Microsoft, США).
Для оценки соответствия распределения нормальному использовали критерии Шапиро–Уилка и Колмогорова–Смирнова. В большинстве случаев распределение нормальному не соответствовало, и величины были представлены с указанием медианы и интерквартильного размаха [Ме (Q1–Q3)]. Для оценки значимости различий между группами использовали U-критерий Манна–Уитни. В тех случаях, когда распределение соответствовало нормальному, указывалось среднее значение и стандартное отклонение выборной совокупности (М ± SD), а для оценки значимости различий между группами применяли t-критерий Стьюдента. При уровне р менее 5 % (р < 0,05) различия принимались за статистически значимые.
При анализе номинальных переменных значения указаны в абсолютных и относительных величинах (%). Для анализа статистической значимости различий между группами использован критерий χ2. При р менее 5 % (р < 0,05) нулевая гипотеза отвергалась. Рассчитывалось отношение шансов (ОШ) с указанием 95-процентного доверительного интервала (95 % ДИ).
При анализе корреляций между изучаемыми признаками для интервальных переменных использовали коэффициент корреляции Пирсона (r).
Для разработки прогностического индекса применяли дискриминантный анализ с указанием стандартизированных и нестандартизированных канонических коэффициентов дискриминантной функции (ККДФ). Чувствительность и специфичность оценивали на экзаменационной выборке. Для оценки качества представленной модели прогнозирования использовали ROC-анализ с измерением площади под кривой (англ. area under curve, AUC) с 95 % ДИ.
Результаты / Results
Клинико-анамнестическая характеристика обследованных пациенток / Clinical and anamnestic characteristics of patients examined
Первоначально было проведено сравнение групп по анамнестическим показателям. Учитывали данные соматического и акушерско-гинекологического анамнеза. Средний возраст пациенток групп 1 и 2 составил соответственно 34,5 (29,0–38,5) лет и 34 (30,8–37,2) года (р > 0,05); различия между группами статистически незначимы.
Также мы провели анализ обследованных по антропометрическим показателям. В группе 1 было 14 (18,7 %) пациенток с дефицитом массы тела, в группе 2 – 45 (10,9 %) женщин (р = 0,06; χ2 = 3,64). По данному показателю различия между группами статистически незначимы, тем не менее мы отметили тенденцию к тому, что в группе 1 относительное количество пациенток с индексом массы тела (ИМТ) < 20 кг/м2 было больше. Участниц исследования с нормальной массой тела в группах 1 и 2 было соответственно 42 (56,0 %) и 306 (73,9 %) (р < 0,014; χ2 = 9,93; ОШ = 0,45; 95 % ДИ = 0,27–0,75). Избыточную массу тела в группах 1 и 2 имели 17 (22,7 %) и 42 (10,1 %) женщины соответственно (р < 0,01; χ2 = 9,38; ОШ = 2,6; 95 % ДИ = 1,38–4,86). Ожирение выявлено только у 2 (2,7 %) пациенток группы 1 и у 21 (5,1 %) женщины в группе 2 (р = 0,37; χ2 = 0,82). Таким образом показано, что нормальная масса тела пациентки увеличивает шансы на благоприятный исход беременности, а избыточная, напротив, снижает.
При оценке риска наличия патологии плода или осложнений беременности, в том числе ЗРП, важно учитывать акушерский анамнез. Средний порядковый номер беременности в группах 1 и 2 соответственно был 2,69 ± 2,09 и 2,68 ± 1,57, среднее количество родов в анамнезе – 0,80 ± 0,83 и 0,87 ± 0,77, различия несущественны. Статистически значимые различия выявлены по количеству многорожавших женщин между группами 1 и 2: соответственно 12 (16,0 %) и 12 (2,9 %) (р < 0,01; χ2 = 23,3; ОШ = 6,38; 95 % ДИ = 2,75–14,8). Статистически значимо чаще пациентки, имевшие беременности с абортивным исходом в анамнезе (артифициальные и самопроизвольные аборты), встречались в группе 1 по сравнению с группой 2 (р = 0,044; χ2 = 4,38; ОШ = 1,69; 95 % ДИ = 1,03–2,79). Помимо этого, получены существенные различия по количеству женщин с рубцом на матке – в группе 1 их было 10 (13,3 %), а в группе 2 – 21 (5,1 %) (р = 0,01; χ2 = 6,1; ОШ = 2,61; 95 % ДИ = 1,19–5,75).
Также мы оценивали частоту встречаемости гинекологической патологии. Между группами 1 и 2 мы выявили значимые различия по частоте встречаемости миомы матки. Эта патология была выявлена в группе 1 у 7 (9,3 %), в группе 2 – у 14 (3,4 %) женщин (р = 0,02; χ2 = 5,47; ОШ = 2,94; 95 % ДИ = 1,14–7,55).
Анализ показателей пренатального скрининга I триместра / Analyzing parameters of the first trimester prenatal screening
Стандартный КПД I триместра имеет надежную доказательную базу, его возможности хорошо изучены. Использование неинвазивного пренатального тестирования на сегодняшний день не регламентировано в России нормативными документами, однако согласно результатам многочисленных исследований оно имеет более высокие показали чувствительности и специфичности и может использоваться как в качестве теста первой линии, так и как дополнение при сомнительных результатах стандартного скрининга [19–21]. В нашей работе все пациентки использовали НИПТ по собственному желанию в качестве теста второй линии после стандартного КПД I триместра. При проведении КПД I триместра по результатам исследования 297 женщин (55,2 %) имели высокий риск ХА у плода (> 1:100), 131 (24,3 %) имели так называемый «умеренный риск» (1:101–1:1000), у 110 (20,4 %) риск был подсчитан как «низкий» (< 1:1000). В обеих группах пациентки вынашивали беременность с плодом, имеющим нормальный хромосомный набор (выявленные у плода ХА были критерием исключения из исследования). При этом доля женщин с высоким риском по результатам КПД I триместра (риск 1:100) в группе 1 была значительно выше – 66,7 % по сравнению с 49,3 % в группе 2 (р < 0,01; χ2 = 7,69; ОШ = 2,05; 95 % ДИ = 1,23–3,45). Таким образом, высокий риск по результатам КПД I триместра при отсутствии ХА у плода более чем в 2 раза увеличивает вероятность развития ЗРП при текущей беременности.
Мы сравнивали биохимические показатели пренатального скрининга I триместра в исследованных группах. Для оценки взаимосвязи биохимических показателей с риском ЗРП мы провели корреляционный анализ и получили статистически значимую обратную взаимосвязь между наличием ЗРП и уровнем РАРР-А и PlGF. Эти данные представлены в нашей более ранней работе [22].
По уровню PI МА между группами 1 и 2 нами также были выявлены значимые различия. Далее был проведен корреляционный анализ, который подтвердил выявленные закономерности – обнаружена слабая прямая взаимосвязь между ЗРП и PI МА [22].
Неинвазивный пренатальный тест / Non-invasive prenatal test
При проведении НИПТ у всех участниц исследования риск ХА был определен как низкий. Размер выборки в данном исследовании не позволил оценить популяционные показатели чувствительности и специфичности данного теста, однако это было сделано в других работах [19][22].
При проведении НИПТ для оценки риска ЗРП нами использовались показатели ФФ и пол плода.
Уровень ФФ в группе 1 составил 8,4 (6,53–11,6)%, в группе 2 – 10 (7,48–13)% (р = 0,02). При проведении корреляционного анализа также выявлена слабая, но статистически значимая обратная взаимосвязь между уровнем ФФ и риском ЗРП (r = –0,11; р = 0,027). Взаимосвязь между ФФ и плацентарной дисфункцией, а следовательно, ЗРП уже была подмечена в ряде научных работ [23–25], но ни в одну из современных прогностических моделей данный показатель в настоящее время не включен.
В группе 1 было 43 (57,3 %) плода женского пола, 32 (42,7 %) мужского, в группе 2 соответственно 184 (44,5 %) и 230 (55,5 %) плодов женского и мужского пола (р = 0,04; χ2 = 4,24; ОШ = 1,67; 95 % ДИ = 1,02– 2,76). Таким образом, женский пол плода несколько повышает риск ЗРП. Ранее такая взаимосвязь была установлена для ПЭ [26]. Во всех случаях пол плода, определенный при проведении НИПТ, был подтвержден после рождения ребенка.
Дискриминантный анализ / Discriminant analysis
Для удобства оценки риска ЗРП и распределения беременных в группы низкого или высокого риска нами был разработан способ прогнозирования с расчетом прогностического индекса F.
Для определения относительного вклада каждого отдельного признака в формирование риска ЗРП и разработки прогностического индекса проведено ранжирование признаков с помощью расчета ККДФ (табл. 1).
Таблица 1. Канонические коэффициенты дискриминантной функции (ККДФ) при расчете индекса F.
Table 1. Canonical Discriminant Function Coefficients (CDFC) in F-index calculation.

Примечание: МоМ – кратное медиане.
Note: МоМ – multiples of median.
Индекс F рассчитывается по формуле:
F = 0,08X1 + 0,85X2 – 0,98X3 – 0,27X4 – 1,51X5 + 0,61X6 – 0,42X7 – 1,64X8 – 1,13X9 + 0,13X10 + 0,9X11 + 0,57X12 + 0,41X13 + 3,16X14 – 1,69X15 + 0,03X16 – 0,05X17 – 7,47,
где X1 – возраст беременной; X2 – порядковый номер беременности; X3 – количество родов в анамнезе; X4 – количество артифициальных абортов в анамнезе; X5 – количество случаев невынашивания беременности в анамнезе; X6 – способ зачатия (естественное – 1, экстракорпоральное оплодотворение – 0); X7 – никотиновая зависимость у пациентки (курит – 1, не курит – 0); X8 – наличие миомы матки (да – 1, нет – 0); X9 – наличие рубца на матке (да – 1, нет – 0); X10 – индекс массы тела, кг/м2; X11 – толщина воротникового пространства (мм); X12 – β-ХГЧ (МоМ); X13 – РАРР-А (МоМ); X14 – PlGF (МоМ); X15 – средний PI МА; X16 – фетальная фракция (%); X17 – пол плода (1 – женский, 0 – мужской).
Если значение F больше либо равно –0,5, то риск развития ЗРП низкий, если F меньше –0,5, то риск ЗРП высокий.
Средние значения F в группах 1 и 2 составили соответственно –1,83 (–0,7 – –2,73) и 0,89 (–0,49 – 2,26). Графически значения индекса F представлены на рисунке 1.
Чтобы оценить эффективность разработанного нами способа прогнозирования ЗРП, мы провели ROC-анализ (рис. 2). Площадь под кривой (AUC) составила 0,84 (95% ДИ = 0,81–0,89), что соответствует отличному качеству модели прогнозирования.
Для определения чувствительности и специфичности представленного способа прогнозирования использовалась экзаменационная выборка. Показатели чувствительности (англ. sensitivity) и специфичности (англ. specificity) составили соответственно 90,1 % и 82,18 %, эффективность способа – 83,97 %. Чувствительность и специфичность при различных значениях индекса F представлены на рисунке 3.
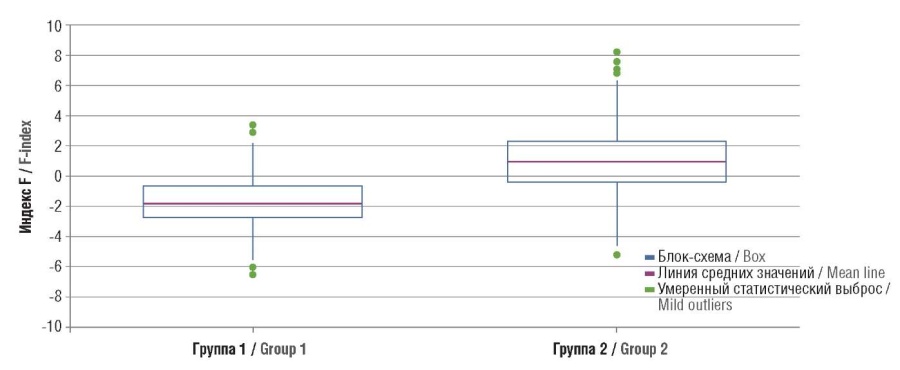
Рисунок 1. Индекс F в основной (группа 1) и контрольной (группа 2) группах.
Figure 1. F-index in the main (group 1) and control (group 2) groups.
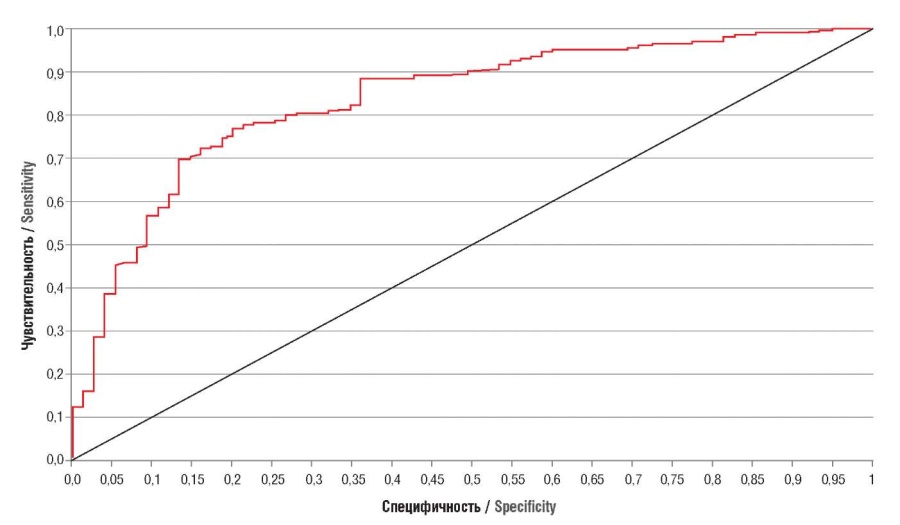
Рисунок 2. ROC-кривая для индекса F.
Figure 2. ROC curve for F-index.
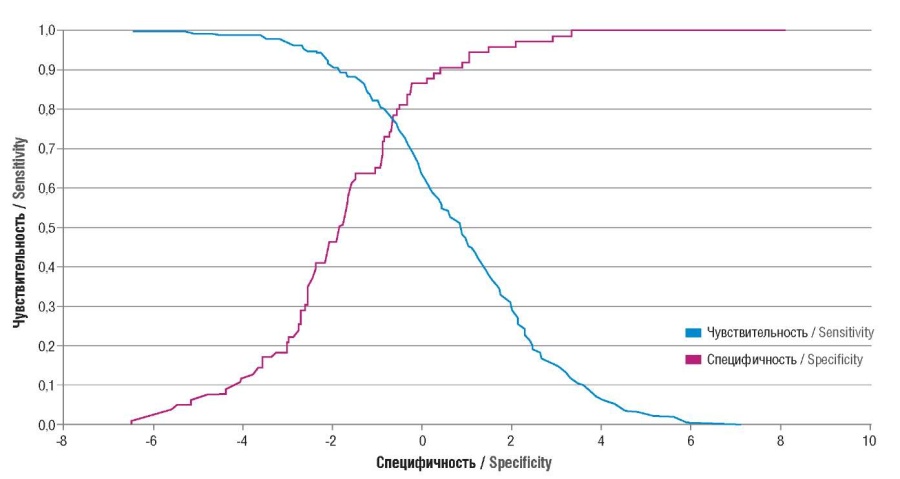
Рисунок 3. Чувствительность и специфичность при различных значениях индекса F.
Figure 3. Sensitivity and specificity at various magnitude of F-index.
ОБСУЖДЕНИЕ / DISCUSSION
Не вызывает сомнений тот факт, что ЗРП является важной медицинской и социальной проблемой и может оказывать существенное влияние на уровень перинатальной смертности и здоровье новорожденного [2–4]. Стратегия оценки размера плода, а также прогнозирование задержки его роста, предполагает, что подобный подход позволяет своевременно определить плацентарную дисфункцию и в ряде случаев предотвратить мертворождение [27].
Во многих работах описаны факторы риска ЗРП [1][13][28], однако прогноз, основанный лишь на наличии или отсутствии факторов риска, отличается низкой эффективностью. Кроме того, на конечный рост плода могут влиять многообразные факторы риска – между населением разных стран имеются значительные различия в том, какие именно факторы риска будут влиять на рост плода и какие окажутся наиболее значимыми [29][30]. На примере ПЭ было четко показано, что прогностическая модель, включающая биохимические показатели скрининга I триместра, имеет намного более высокие показатели чувствительности и специфичности, чем простая оценка факторов риска [31].
Существует также скрининг ЗРП на основе использования УЗИ. Однако было показано, что такой подход не приводит к значительному улучшению перинатальных исходов [1].
В клинических рекомендациях «Недостаточный рост плода, требующий предоставления медицинской помощи матери (задержка роста плода)» указано, что для оценки риска ЗРП могут использоваться показатели РАРР-А и PlGF [9]. При этом не указывается, как именно с помощью данных показателей должна проводиться оценка риска. На сегодняшний день описано несколько многопараметрических моделей оценки риска, но все они нуждаются в проспективной проверке для подтверждения своей эффективности [27][32].
В России с каждым годом все большее количество беременных для уточнения уровня риска ХА плода используют НИПТ, помимо стандартного КПД I триместра [19]. Использование данного теста и для оценки риска ЗРП может увеличить эффективность прогноза. Взаимосвязь уровня ФФ с риском осложнений беременности, в том числе ЗРП, была ранее отмечена в ряде научных работ [23–25]. В нашей работе мы также показали, что более низкий уровень ФФ ассоциирован с более высоким риском ЗРП. При этом данный показатель не может использоваться как единственный маркер, но может быть включен в прогностические модели с учетом других параметров.
Важным вопросом является: нужно ли учитывать пол плода при оценке риска ЗРП? Современные технологии дают возможность определить половую принадлежность плода уже в I триместре, следовательно, этот параметр теоретически может быть использован при составлении прогностических моделей. Согласно нашим результатам, риск ЗРП несколько выше в случае, если плод женского пола. Данные научной литературы противоречивы. B.D. Taylor с соавт. (2018) показали, что женский пол плода может повышать риск ПЭ, а следовательно, и риск ЗРП [26]. В работе J.F. Hebert с соавт. (2018) на мышиной трансгенной модели было показано, что мужской пол плода усугубляет патологическое влияние материнского неблагоприятного генотипа и повышает риск ЗРП [33]. В свою очередь, L.D. Brown с соавт. (2022) изучали влияние пола плода на перинатальные исходы на овцах и утверждают, что пол плода не влияет на уровень риска развития плацентарной недостаточности и ЗРП [34]. S. Stenhouse с соавт. (2019) изучали особенности кровоснабжения эндометрия и беременных свиней и показали, что при наличии плода женского пола чаще наблюдалось нарушение ангиогенеза, чем в случае беременности плодом мужского пола [35]. Возможно, влияние пола плода на риск осложнений гестации зависит от биологического вида. Безусловно, данный вопрос требует дальнейшего изучения, а влияние пола плода на риск ЗРП можно оценивать только в совокупности с другими параметрами.
В представленном нами способе прогнозирования учитывается ряд факторов риска, биохимические и ультразвуковые параметры скрининга I триместра, а также показатели, определенные при проведении НИПТ (ФФ, пол плода). Подобный синтез различных параметров с математической обработкой позволяет увеличить чувствительность и специфичность представленного способа прогнозирования. Кроме того, эффективность представленной модели прогнозирования оценена на российской популяции.
Ограничения исследования / Study limitations
Ограничением данного исследования является то, что разработанная модель прогнозирования применима лишь для женщин, не имеющих тяжелой соматической патологии: в нашем исследовании тяжелая соматическая патология была критерием исключения. Мы полагаем, что у женщин, у которых она имеется, изначально имеется высокий риск ЗРП и других осложнений беременности, что подтверждается результатами многочисленных научных работ [12][28]. Кроме того, все женщины, включенные в исследование, были европеоидами, следовательно, при использовании представленной прогностической модели при другой этнической принадлежности беременной эффективность способа может быть существенно ниже.
Заключение / Conclusion
В представленном способе прогнозирования учитываются анамнестические данные, показатели скрининга I триместра, а также параметры НИПТ. Разработанный способ прогнозирования ЗРП, показатели чувствительности и специфичности которого составили соответственно 90,1 % и 82,18 %, эффективность – 83,97 %, может быть использован в практике акушера-гинеколога для формирования групп пациенток по риску развития ЗРП для выбора тактики ведения такой беременности, а также назначения профилактической или таргетной терапии.
Список литературы
1. Smith G.C.S. Universal screening for foetal growth restriction. Best Pract Res Clin Obstet Gynaecol. 2018;49:16–28. https://doi.org/10.1016/j.bpobgyn.2018.02.008.
2. Ковалев В.В., Кудрявцева Е.В., Беломестнов С.Р. и др. Факторы риска антенатальной гибели плода. Уральский медицинский журнал. 2019;(15):5–9. https://doi.org/10.25694/URMJ.2019.15.04.
3. Kesavan K., Devaskar S.U. Intrauterine growth restriction: postnatal monitoring and Ootcomes. Pediatr Clin North Am. 2019;66(2):403–23. https://doi.org/10.1016/j.pcl.2018.12.009.
4. Hansen D.N., Odgaard H.S., Uldbjerg N. et al. Screening for small-forgestational-age fetuses. Acta Obstet Gynecol Scand. 2020;99(4):503–9. https://doi.org/10.1111/aogs.13764.
5. Hendrix M., Bons J., van Harenet A. et al. Role of sFlt-1 and PlGF in the screening of small-for-gestational age neonates during pregnancy: A systematic review. Ann Clin Biochem. 2020;57(1):44–58. https://doi.org/10.1177/0004563219882042.
6. Spencer K., Macri J.N., Aitken D.A., Connor J.M. Free beta-hCG as firsttrimester marker for fetal trisomy. Lancet. 1992;339(8807):1480. https://doi.org/10.1016/0140-6736(92)92073-o.
7. Hasmasanu M.G., Bolboaca S.D, Baizat M.I. et al. Neonatal short-term outcomes in infants with intrauterine growth restriction. Saudi Med J. 2015;36(8):947–53. https://doi.org/10.15537/smj.2015.8.11533.
8. Valsamakis G., Kanaka-Gantenbein C., Malamitsi-Puchner A., Mastorakos G. Causes of intrauterine growth restriction and the postnatal development of the metabolic syndrome. Ann N Y Acad Sci. 2006:1092:138–47. https://doi.org/10.1196/annals.1365.012.
9. Клинические рекомендации. Недостаточный рост плода, требующий предоставления медицинской помощи матери (задержка роста плода). 2022–2023–2024 (14.02.2022). М.: Министерство здравоохранения Российской Федерации, 2022. 47 с. Режим доступа: http://disuria.ru/_ld/11/1152_kr22O36p5MZ.pdf. [Дата обращения: 25.05.2022].
10. Gordijn S.J., Beune I.M., Thilaganathan B. et al. Consensus definition of fetal growth restriction: a Delphi procedure. Ultrasound Obstet Gynecol. 2016:48(3):333–9. https://doi.org/10.1002/uog.15884.
11. Lausman A., Kingdom J., Maternal Fetal Medicine Committee. Intrauterine growth restriction: screening, diagnosis, and management. J Obstet Gynaecol Can. 2013;35(8):741–8. [Article in English, French]. https://doi.org/10.1016/S1701-2163(15)30865-3.
12. Salomon L.J., Malan V. Managing and identifying the causes of IUGR. J Gynecol Obstet Biol Reprod (Paris). 2013;42(8):929–40. [Article in French]. https://doi.org/10.1016/j.jgyn.2013.09.016.
13. ACOG. Practice Bulletin No 204: Fetal growth restriction. Obstet Gynecol. 2019;133(1):1–25. https://doi.org/10.1097/AOG.0000000000003070.
14. Crovetto F., Triunfo S., Crispi F. et al. Differential performance of firsttrimester screening in predicting small-for-gestational-age neonate orfetal growth restriction. Ultrasound Obstet Gynecol. 2017;49(3):349–56. https://doi.org/10.1002/uog.15919.
15. Tan M.Y., Poon L.C., Rolnik D.L. et al. Prediction and prevention of smallfor-gestational-age neonates: evidence from SPREE and ASPRE. Ultrasound Obstet Gynecol. 2018;52(1):52–9. https://doi.org/10.1002/uog.19077.
16. Приказ Министерства здравоохранения и социального развития РФ от 3 декабря 2007 г. N 736 «Об утверждении перечня медицинских показаний для искусственного прерывания беременности» с изменениями и дополнениями от 27 декабря 2011 г. M., 2011. 19 р. Режим доступа: http://www.crbnovopokrovskay.ru/normativnie_dok/akusher_i_ginek/prikaz_mz_i_socialnogo_razvitija_rf_ot_3.12.2007g-.pdf. [Дата обращения: 25.05.2022].
17. Приказ Министерства здравоохранения РФ от 1 ноября 2012 г. N 572н «Об утверждении Порядка оказания медицинской помощи по профилю "акушерство и гинекология (за исключением использования вспомогательных репродуктивных технологий)"». М.: Министерство здравоохранения Российской Федерации, 2012. 463 с. Режим доступа: http://zdrav.spb.ru/media/komzdrav/documents/document/file/prikaz_minzdrava_01_11_2015_572-n.pdf. [Дата обращения: 25.05.2022].
18. Сухих Г.Т., Трофимов Д.Ю., Барков И.Ю. и др. Неинвазивный пренатальный ДНК-скрининг анеуплоидий плода по крови матери методом высокопроизводительного секвенирования. Акушерство и гинекология. 2016;(6):129–57. https://doi.org/10.18565/aig.2016.6.recomendations.
19. Кудрявцева Е.В., Канивец И.В., Киевская Ю.К. и др. Неинвазивный пренатальный тест в России: популяционное исследование. Акушерство и гинекология. 2019;(12):28–33. https://doi.org/10.18565/aig.2019.12.30-35.
20. van der Meij K.R.M., Sistermans E.A., Macville M.V.E. et al. TRIDENT-2: National implementation of genome-wide non-invasive prenatal testing as a first-tier screening test in the Netherlands. Am J Hum Genet. 2019;105(6):1091–101. https://doi.org/10.1016/j.ajhg.2019.10.005.
21. Дектярев А.А., Кудрявцева Е.В., Ковалев В.В. Патогенетические ассоциации показателей пренатального скрининга первого триместра беременности с задержкой роста плода. Пермский медицинский журнал. 2022;39(1):11–20. https://doi.org/10.17816/pmj39111-20.
22. Кудрявцева Е.В., Ковалев В.В., Канивец И.В. и др. Free-DNA плода: опыт популяционного скрининга хромосомной патологии в России. Вопросы гинекологии, акушерства и перинатологии. 2019;18(3):46–51. https://doi.org/10.20953/1726-1678-2019-3-46-51.
23. Rolnik D.L., da Silva Costa F., Lee T.J. et al. Association between fetal fraction on cell-free DNA testing and first-trimester markers for pre-eclampsia. Ultrasound Obstet Gynecol. 2018;52(6):722–7. https://doi.org/10.1002/uog.18993.
24. Scheffer P.G., Wirjosoekarto S.A.M., Becking E.C. et al. Association between low fetal fraction in cell-free DNA testing and adverse pregnancy outcome: A systematic review. Prenatal Diagn. 2021;41(10):1287–95. https://doi.org/10.1002/pd.6028.
25. Кудрявцева Е.В., Ковалев В.В., Баранов И.В. и др. Низкая фетальная фракция внеклеточной ДНК при проведении неинвазивного пренатального ДНК-скрининга: возможные причины, клиническое значение и тактические решения. Доктор.Ру. 2020;19(8):49–54. https://doi.org/10.31550/1727-2378-2020-19-8-49-54.
26. Taylor B.D., Haggerty C.L., Ness R.B. et al. Fetal sexual dimorphism in systemic soluble fms-like tyrosine kinase 1 among normotensive and preeclamptic women. Am J Reprod Immunol. 2018;80(5):e13034. https://doi.org/10.1111/aji.13034.
27. Coutinho C.M., Melchiorre K., Thilaganathan B. Stillbirth at term: Does size really matter? Int J Gynaecol Obstet. 2020;150(3):299–305. https://doi.org/10.1002/ijgo.13229.
28. Albu A.R., Anca A.F., Horhoianu V.V., Horhoianu I.A. Predictive factors for intrauterine growth restriction. J Med Life. 2014;7(2):165–71.
29. Kiserud T., Benachi A., Hecher K. et al. The World Health Organization fetal growth charts: concept, findings, interpretation, and application. Am J Obstet Gynecol. 2018;218(2S):S619–S629. https://doi.org/10.1016/j.ajog.2017.12.010.
30. Zhang N., Tan J., Yang H., Khalil R.A. Comparative risks and predictors of preeclamptic pregnancy in the Eastern, Western and developing world. Biochem Pharmacol. 2020;182:114247. https://doi.org/10.1016/j.bcp.2020.114247.
31. Chaemsaithong P., Sahota D.S., Poon L.C. First trimester preeclampsia screening and prediction. Am J Obstet Gynecol. 2022;226(2S):S1071–S1097.e2. https://doi.org/10.1016/j.ajog.2020.07.020.
32. Nowacka U., Papastefanou I., Bouariu A. et al. Second-trimester contingent screening for small-for-gestational-age neonate. Ultrasound Obstet Gynecol. 2022;59(2):177–84. https://doi.org/10.1002/uog.23730.
33. Hebert J.F., Millar J.A., Raghavan R. et al. Male fetal sex affects uteroplacental angiogenesis in growth restriction mouse model†. Biol Reprod. 2021;104(4):924–34. https://doi.org/10.1093/biolre/ioab006.
34. Brown L.D., Palmer C., Teynor L. et al. Fetal sex does not impact placental blood flow or placental amino acid transfer in late gestation pregnant sheep with or without placental insufficiency. Reprod Sci. 2022;29(6):1776–89. https://doi.org/10.1007/s43032-021-00750-9.
35. Stenhouse C., Hogg C.O., Ashworth C.J. Novel relationships between porcine fetal size, sex, and endometrial angiogenesis†. Biol Reprod. 2019;101(1):112–25. https://doi.org/10.1093/biolre/ioz068.
Об авторах
Е. В. КудрявцеваРоссия
Кудрявцева Елена Владимировна – д.м.н., доцент кафедры акушерства и гинекологии
620219 Екатеринбург, ул. Репина, д. 3
В. В. Ковалев
Россия
Ковалев Владислав Викторович – д.м.н., профессор, зав. кафедрой акушерства и гинекологии, трансфузиологии
620219 Екатеринбург, ул. Репина, д. 3
А. А. Дектярев
Россия
Дектярев Андрей Александрович – врач ультразвуковой диагностики
620014 Екатеринбург, ул. Бориса Ельцина, д. 3
И. И. Баранов
Россия
Баранов Игорь Иванович – д.м.н., профессор, зав. отделом научно-образовательных программ департамента организации научной деятельности
117997 Москва, ул. академика Опарина, д. 4
Рецензия
Для цитирования:
Кудрявцева Е.В., Ковалев В.В., Дектярев А.А., Баранов И.И. Прогнозирование задержки роста плода: математическое моделирование. Акушерство, Гинекология и Репродукция. 2022;16(6):664-675. https://doi.org/10.17749/2313-7347/ob.gyn.rep.2022.328
For citation:
Kudryavtseva E.V., Kovalev V.V., Dektyarev A.A., Baranov I.I. Predicting fetal growth retardation: mathematical modeling. Obstetrics, Gynecology and Reproduction. 2022;16(6):664-675. (In Russ.) https://doi.org/10.17749/2313-7347/ob.gyn.rep.2022.328

Контент доступен под лицензией Creative Commons Attribution-NonCommercial-ShareAlike 4.0 International License.











































