Перейти к:
Внеклеточные ловушки нейтрофилов как маркеры тромбовоспаления в патогенезе злокачественных новообразований женских половых органов и молочной железы
https://doi.org/10.17749/2313-7347/ob.gyn.rep.2022.335
Аннотация
Введение. Тромбоз является грозным осложнением онкологического процесса, вклад которого в общую летальность остается высоким, несмотря на использование антикоагулянтов. По последним данным, тромбоз при раке представляет собой особый вид протромботического состояния, одной из составных частей которого, как оказалось, является тромбовоспаление. Кроме этого, тромбовоспаление вносит свой вклад и в прогрессию заболевания и в интенсивность процессов метастазирования. Вопросам изучения тромбовоспаления у онкологических пациентов в последнее время посвящено большое количество исследований в мире.
Цель: оценка активности нетоза (процесса синтеза внеклеточных ловушек нейтрофилов), а именно, концентрации цитруллинированного гистона Н3 (citН3) как маркера нетоза в плазме крови пациенток со злокачественными новообразованиями половых органов и молочной железы.
Материалы и методы. В проспективное наблюдательное контролируемое нерандомизированное исследование вошли 45 пациенток (основная группа) со злокачественными новообразованиями тела матки, яичников, шейки матки (аденокарцинома цервикального канала) и молочных желез, поступивших в стационар для проведения планового оперативного лечения (13, 15, 5 и 13 пациенток, соответственно), и 33 женщины с доброкачественными новообразованиями половых органов и молочной железы (контрольная группа). Концентрацию citН3 определяли в плазме c помощью иммуноферментного анализа.
Результаты. У пациенток основной группы уровень citН3 оказался достоверно повышен (1,434–2,058 нг/мл) по сравнению с контрольной группой (0,281–0,371 нг/мл). Содержание citН3 у больных с опухолями тела и шейки матки составляло от 2,271 до 2,992 нг/мл, у больных с опухолями яичников – от 1,357 до 2,123 нг/мл, у больных с опухолями молочной железы – от 0,331 до 0,859 нг/мл. Не выявлено статистически значимых различий в концентрации citН3 у больных с опухолями молочной железы по сравнению с контрольной группой. При повышении концентрации citH3 были достоверно повышены значения таких показателей, как С-реактивный белок и D-димер, количество нейтрофилов и тромбоцитов и соотношение нейтрофилы/лимфоциты. Выявлены значимые различия в количестве тромбоцитов в основной группе (236,68–273,77×109/л) по сравнению с контрольной группой (178,14–202,35×109/л).
Заключение. Продемонстрирована активация процессов нетоза у пациенток с опухолями тела и шейки (аденокациномы) матки и яичников, а также сочетание этой активации с активацией системы гемостаза и системным воспалительным ответом.
Ключевые слова
Для цитирования:
Слуханчук Е.В., Бицадзе В.О., Солопова А.Г., Хизроева Д.Х., Гри Ж., Элалами И., Макацария А.Д. Внеклеточные ловушки нейтрофилов как маркеры тромбовоспаления в патогенезе злокачественных новообразований женских половых органов и молочной железы. Акушерство, Гинекология и Репродукция. 2022;16(4):426-437. https://doi.org/10.17749/2313-7347/ob.gyn.rep.2022.335
For citation:
Slukhanchuk E.V., Bitsadze V.O., Solopova A.G., Khizroeva J.Kh., Gris J., Elalamy I., Makatsariya A.D. Neutrophil extracellular traps as markers of thromboinflammation in the pathogenesis of female genital tract and breast malignant neoplasms. Obstetrics, Gynecology and Reproduction. 2022;16(4):426-437. https://doi.org/10.17749/2313-7347/ob.gyn.rep.2022.335
Введение / Introduction
Нейтрофилы, наряду с дендритными клетками и макрофагами, подобно фагоцитам являются важным компонентом врожденного иммунитета [1]. С вовлечением различных имеющихся в их арсенале механизмов они отражают угрозу со стороны различных патогенов, в том числе бактерий, грибов, простейших, вирусов, антител и иммунных комплексов, цитокинов и хемокинов – интерлейкин-8 (англ. interleukin-8, IL-8), фактор некроза опухоли (англ. tumor necrosis factor, TNF) и др. [2]. Нейтрофилы подвергаются специализированному процессу запрограммированной гибели (без активации каспаз в процессе апоптоза), что приводит к деконденсации хроматина с образованием сетей – внеклеточных ловушек нейтрофилов (англ. neutrophil extracellular traps, NETs).
Впервые NETs были выявлены в 2004 г. [3][4]. NETs состоят из нитей деконцентированной ДНК и множества белковых/ферментных компонентов и химических веществ, в том числе миелопероксидазы (англ. myeloperoxidase, МРО), эластазы нейтрофилов, тканевого фактора [5]. Миелопероксидаза представляет собой пероксидазу, которая использует гем в качестве кофактора и производит хлорноватистую кислоту (HOCl) из перекиси водорода (H2O2) и аниона хлора (Cl–) во время окислительного взрыва нейтрофилов [6]. Нейтрофильная эластаза гидролизует белки внутри специализированных нейтрофильных лизосом, известных как азурофильные гранулы, и разрушает как белок А наружной мембраны, так и факторы вирулентности бактерий [7]. Нейтрофильная эластаза в составе NETs также может разрушать внеклеточный матрикс в тканях организма человека, в состав которого входят коллаген IV и эластин.
Одним из ключевых этапов образования NETs является цитруллинирование гистонов, осуществляемое гистон-специфическим ферментом пептидиларгининдезиминазой 4 (англ. peptidylarginine deiminase type 4, PAD4). Новые данные указывают на то, что цитруллинированный гистон H3 (англ. citrullinated histone H3, citН3), ключевой компонент NETs, может быть признан специфическим маркером нетоза [8] как в образцах тканей, так и в периферической крови [9]. Гиперцитруллинирование гистонов является важным этапом в формировании NETs, а citH3 считается новым и специфическим биомаркером этого процесса. Губительное действие NETs в отношении патогенов обусловлено окислением под влиянием MPO и HOCl и расщеплением нейтрофильной эластазой. Мощные поливалентные эффекты NETs не являются специфическими, дисрегуляция процессов нетоза на фоне острого и хронического воспаления приводит к повреждению тканей, фиброзу, гиперкоагуляции, тромбозу, атеросклерозу, прогрессии опухоли и метастированию [5][10–12]. Образование NETs приводит к локальному тромбозу, по-видимому, направленному изначально на предотвращение распространения патогенов. Кроме того, было показано, что NETs повышают интенсивность фиброза в различных тканях, в частности в легких, и что фиброз легких индуцируется NETs и зависит от PAD4 [13].
Одним из самых частых осложнений и основных причин смертности онкологических больных является рак-ассоциированный тромбоз. Риск первичной венозной тромбоэмболии (ВТЭ) при раке повышен в 4–7 раз, рецидива ВТЭ – в 3 раза, кровотечения, связанного с антикоагулянтами – в 2 раза, смерти от ВТЭ – в 7–10 раз и артериальной тромбоэмболии – в 2 раза по сравнению с пациентами без опухолевых заболеваний [14][15]. Факторы риска тромбоза, связанного с раком, могут быть связаны с пациентом (этническая принадлежность, возраст, сопутствующие заболевания и т. д.), с опухолью (гистологический тип, степень, первичная локализация и время после установления диагноза и т. д.), с лечением (химиотерапия, хирургическое вмешательство/госпитализация, антиангиогенные препараты, центральные венозные катетеры, стимуляторы эритропоэтина и т. д.), а также с важными биомаркерами (количество лейкоцитов и тромбоцитов, содержание D-димера и гемоглобина и т. д.) [16]. Недавними исследования было показано, что NETs обладают поливалентными прокоагуляционными свойствами, обеспечивая «скелетную» поддержку молекул прокоагулянтов в ассоциации с эритроцитами и тромбоцитами, что способствует тромбозу in vitro и in vivo. NETs содержат сложные белковые компоненты, которые могут активировать эндогенный путь коагуляции, способствуя тромбообразованию. Таким образом, было доказано, что NETs являются важными участниками тромбообразования у онкологических больных [17][18].
В настоящее время активно исследуется роль NETs в инициации, формировании и метастазировании рака, а также в тромбозах, связанных с раком. Оказалось, что опухоль может индуцировать нетоз на фоне создания гипоксической микросреды в связи с более высокой экспрессией фактора транскрипции HIF-1α (гипоксией индуцируемый фактор-Iα; англ. hypoxia-inducible factor-Iα), активных форм кислорода при выраженном окислительном стрессе. Также секретируемые опухолью цитокины, протеазы и экзосомы запускают нетоз [19]. Гипоксическая микросреда и окислительный стресс, которые способствуют секреции трансформирующего фактора роста-β1 (англ. transforming growth factor-β1, TGF-β1), являются ключевыми индукторами эндотелиально-мезенхимального перехода (ЭMП). TGF-β играет существенную роль в процессе ЭМП в микроокружении опухоли во время онкогенеза и метастазирования. Было показано, что NETs стимулируют ЭМП для облегчения онкогенеза [20][21], роста [22] и метастазирования [22][23]. Следовательно, NETs могут способствовать росту и прогрессированию опухоли, накапливаясь в микроокружении опухоли [24]. NETs способствуют распространению опухоли на большие расстояния, защищая опухолевые клетки и препятствуя атаке циркулирующих цитотоксических лимфоцитов [25]. Связанная с NETs нейтрофильная эластаза, матриксная металлопротеиназа 9 и катепсин G разрушают межклеточное соединение и базальную мембрану путем протеолиза VE-кадгерина, тем самым увеличивая проницаемость эндотелиальных клеток. Этот процесс также активирует эндотелиальные клетки для рекрутирования циркулирующих опухолевых клеток, которые захватываются NETs, чтобы способствовать метастазированию рака [21].
В первом в мире исследовании NETs изучались в опухолевой ткани у пациентов с саркомой Юинга. Опухоль-ассоциированные NETs были выявлены у пациентов с неблагоприятным прогнозом [26]. Кроме того, NETs были обнаружены в тканях опухолей толстой кишки и метастатических лимфатических узлах. От центра опухоли к ее дистальному краю содержание NETs постепенно снижается [27]. Исследование показало, что концентрация NETs в образцах ткани лимфомы положительно коррелирует с концентрацией их в плазме крови. Высокий уровень NETs коррелировал с плохой выживаемостью. Еще одно исследование показало, что повышенный уровень циркулирующих NETs в послеоперационном периоде у пациентов после резекции печени по поводу метастатического колоректального рака был связан со снижением безрецидивной выживаемости [28]. У пациентов с первичной карциномой печени в сочетании с неалкогольным стеатогепатитом концентрация NETs была выше, чем у пациентов со здоровой печенью или доброкачественными заболеваниями печени [29].
Цель: оценка активности нетоза (процесса синтеза внеклеточных ловушек нейтрофилов), а именно, концентрации citН3 как маркера нетоза в плазме крови пациенток со злокачественными новообразованиями женских половых органов и молочной железы.
Материалы и методы / Materials and Methods
Дизайн исследования / Study design
С сентября 2019 г. по март 2022 г. на базе ГБУЗ ГКОБ № 1 ДЗМ, а также на базе ФГБНУ РНЦХ им. акад. Б.В. Петровского проведено проспективное контролируемое наблюдательное нерандомизированное исследование с участием 78 пациенток в возрасте от 30 до 72 лет, госпитализированных в стационар для планового оперативного лечения.
Группы обследованных пациенток / Groups of patients examined
В основную группу вошли 45 пациенток со злокачественными новообразованиями половых органов и молочных желез I–III стадий: рак яичников (n = 13), рак тела матки (n = 15), рак шейки матки (аденокарцинома цервикального канала, n = 5) и рак молочных желез (n = 13).
Контрольную группу составили 33 женщины с доброкачественными новообразованиями женских половых органов и молочной железы.
Критерии включения и исключения / Inclusion and exclusion criteria
Критерии включения в основную группу: наличие злокачественного новообразования яичников, тела матки, шейки матки и молочных желез, подтвержденное данными клинического и инструментального обследования; добровольное информированное согласие на участие в исследовании.
Критерии включения в контрольную группу: наличие доброкачественных новообразований женских половых органов и молочной железы; отсутствие в анамнезе активного рака и онкологических заболеваний, тромбозов и тромбоэмболий, хронических воспалительных заболеваний; добровольное информированное согласие на участие в исследовании.
Критерии исключения: наличие активного инфекционного и/или воспалительного процесса; аллергическая реакция на контрастные вещества; применение антикоагулянтов, препаратов химиотерапии; признаки тромботического или геморрагического синдрома на момент первого обследования.
Методы исследования / Study methods
Отбор проб крови производили натощак за сутки до операции сухой стерильной иглой из локтевой вены в пластиковую пробирку в соотношении с антикоагулянтом 9:1. В качестве антикоагулянта использовали 3,8% раствор трехзамещенного цитрата натрия.
Гиперцитруллинирование гистонов является важным этапом в формировании NETs, а citH3 считается новым и специфическим биомаркером этого процесса. Определение уровня citH3 в плазме крови пациенток основной и контрольной групп осуществляли с использованием иммуноферментного анализа (Citrullinated Histone H3 ELISA Kit, Cayman Chemical, Ann Arbor, Michigan, США).
Определение концентрации D-димера выполняли методом латекс-теста Dimertest (Agen, Австралия), основанного на взаимодействии высокоспецифичных антител к D-димеру, фиксированных на латексных частицах. D-димер является одним из наиболее специфических тестов для диагностики ДВС-синдрома, наличия тромбофилии и тромботических осложнений, позволяет выявить интенсивность полимеризации фибрина в процессе внутрисосудистого свертывания крови. Общий анализ крови и измерение значений С-реактивного белка (СРБ) проводили с использованием рутинных методик из венозной крови.
Этические аспекты / Ethical aspects
Исследование проводилось согласно требованиям Хельсинской декларации Всемирной медицинской организации. Все пациентки получили исчерпывающую информацию и подписали форму информированного согласия.
Статистический анализ / Statistical analysis
Статистический анализ проводили посредством программного обеспечения IBM SPSS Statistics версии 25 с использованием в анализе непараметрических критериев Манна–Уитни, Краскела–Уоллиса, доверительных интервалов и апостериорного критерия Даннета. Статистически значимые различия оценивали в случае достижения достоверного уровня значимости (р < 0,05), а также в случае различий между границами доверительных интервалов в сравниваемых группах. Для анализа связи между переменными, выраженными в количественной размерности, использовали корреляционно-регрессионный анализ. На этапе корреляционного анализа применяли непараметрический критерий Спирмена (связь считается слабой при значении коэффициента корреляции до 0,3, средней – от 0,3 до 0,7 и высокой – свыше 0,7). Использование непараметрической статистики связано с отсутствием нормальности в распределении переменных.
Результаты / Results
Клинико-анамнестическая характеристика обследованных пациенток / Clinical and anamnestic characteristics of patients examined
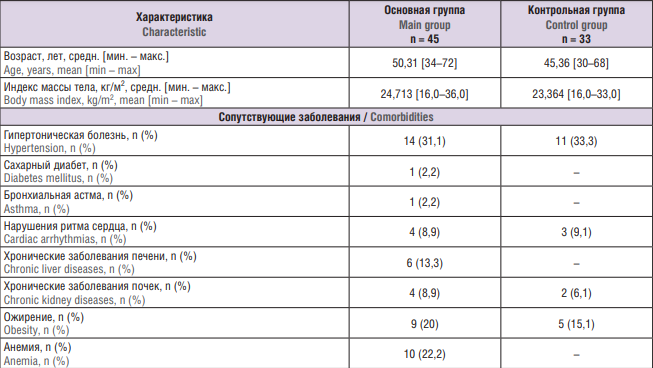
Клинико-анамнестические данные обследованных женщин представлены в таблице 1. Пациентки основной и контрольной групп достоверно не различались по возрасту и индексу массы тела. Обращает на себя внимание большое количество пациенток с ожирением как в основной, так и в контрольной группе, особенно среди женщин с доброкачественными и злокачественными заболеваниями молочных желез и эндометрия. В основной группе было существенно повышено количество пациенток с анемией, особенно в подгруппах рака эндометрия и рака яичников.
Таблица 1. Клинико-анамнестическая характеристика обследованных пациенток.
Table 1. Clinical and anamnestic characteristics of women examined.
В таблице 2 представлены результаты изученных лабораторных показателей обследованных пациенток. Выявлены значимые различия (р < 0,05) между основной и контрольной группой в отношении таких показателей, как содержание D-димера (1,635 мкг/мл и 0,379 мкг/мл) и citH3 (1,746 нг/мл и 0,326 нг/мл), отношение нейтрофилы/лимфоциты (6,1 и 1,914), число тромбоцитов (255,2×109/л и 190,2×109/л) и концентрация С-реактивного белка (3,779 мг/дл и 0,207 мг/дл), соответственно.
Таблица 2. Лабораторные показатели крови обследованных пациенток.
Table 2. Laboratory blood parameters of patients examined.
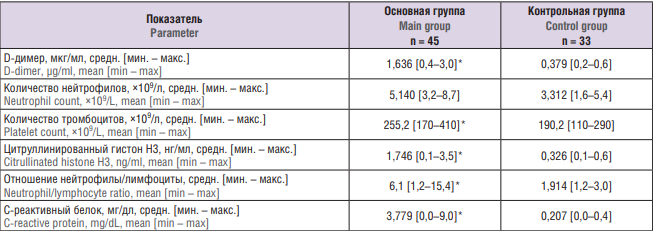
Примечание: *р < 0,05 – различия статистически значимы по сравнению с контрольной группой.
Note: *p < 0.05 – significant differences compared to control group.
Для поиска различий в концентрациях citH3 в основной и контрольной группах использован непараметрический критерий Манна–Уитни, при этом продемонстрирована высокая степень значимости различий (р = 0,0001). У 95 % пациенток основной группы содержание citH3 в плазме крови колебалось от 1,434 до 2,058 нг/мл, у 95 % пациенток контрольной группы – от 0,281 до 0,371 нг/мл при использовании доверительного интервала (рис. 1).
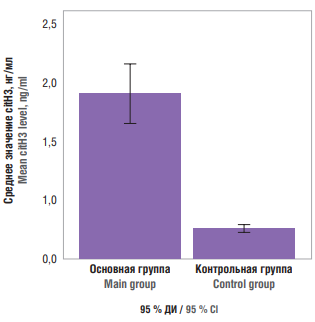
Рисунок 1. Содержание цитруллинированного гистона Н3 (citH3) в плазме крови обследованных пациенток.
Figure 1. Blood plasma citrullinated histone H3 (citH3) level in patients examined.
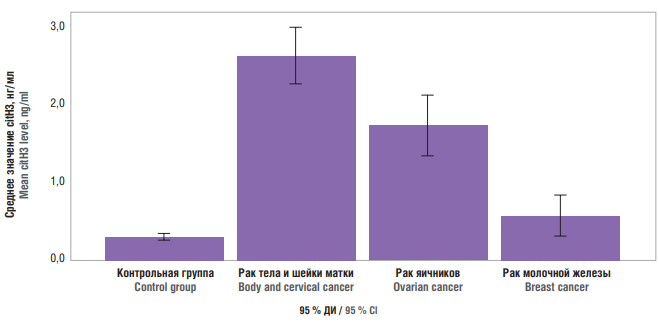
Рисунок 2. Содержание цитруллинированного гистона Н3 (citH3) в плазме крови при различных источниках опухоли.
Figure 2. Blood plasma citrullinated histone H3 (citH3) level in varying tumor tissue sources.
Для выявления различий в концентрации citH3 среди онкологических пациенток с различными источниками опухоли использован непараметрический критерий Краскела–Уоллиса, анализ доверительных интервалов и апостериорный критерий Даннета. Установлено, что значения citН3 у пациенток с опухолями тела и шейки матки колебались от 2,271 до 2,992 нг/мл, у пациенток с опухолями яичника – от 1,357 до 2,123 нг/мл, у пациенток с опухолями молочной железы – от 0,331 до 0,859 нг/мл. Таким образом, содержание citН у пациенток с опухолями тела и шейки матки, а также с опухолями яичников оказалось достоверно выше, чем у пациенток контрольной группы, при этом концентрация у пациенток с опухолями молочной железы значимо не отличалась от контрольной группы (рис. 2, табл. 3).
Таблица 3. Содержание цитруллинированного гистона Н3 (citH3) в плазме крови при различных источниках опухоли.
Table 3. Blood plasma citrullinated histone H3 (citH3) level in varying tumor tissue sources.
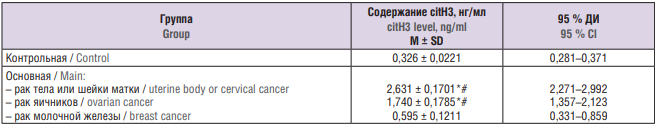
Примечание: *р < 0,05 – различия статистически значимы по сравнению с контрольной группой; #р < 0,05 – различия статистически значимы по сравнению с пациентами с раком молочной железы; М – среднее значение; SD – стандартное отклонение; 95 % ДИ – 95 % доверительный интервал.
Note: *p < 0.05 – significant differences compared to control group; #p < 0.05 – significant differences compared to patients with breast cancer; M – mean; SD – standard deviation; 95 % Cl – 95 % confidence interval.
Оценку взаимосвязей между значениями citН3, СРБ, D-димера как маркера активации гемостаза, количеством нейтрофилов и тромбоцитов и соотношением нейтрофилы/лимфоциты у всех обследованных пациенток проводили с использованием корреляционно-регрессионного анализа и непараметрического критерия Спирмена. В результате была получена значимая (р = 0,0001) степень корреляции всех независимых переменных (СРБ, D-димера, нейтрофилов, тромбоцитов и соотношения нейтрофилы/лимфоциты) с концентрацией citН3. Коэффициент корреляции во всех случаях достигал среднего уровня (от 0,3 до 0,7) за исключением корреляции между концентрациями citН3 и СРБ, которая являлась самой высокой и достигала 0,75. Как можно видеть (рис. 3), значение citН3 практически линейно возрастало до значения 2 нг/мл при одновременном росте СРБ до уровня от 5 до 6 мг/дл. Далее увеличение концентрации citН3 не сопровождалось увеличением концентрации СРБ.
Рост числа тромбоцитов прослеживался равномерно при росте значений citН3. При минимальных концентрациях citН3 число тромбоцитов не превышало 250×109/л, при росте концентрации citН3 до 4 нг/мл линейно возрастало количество тромбоцитов от 250×109/л до 350×109/л (рис. 4).
В процессе изучения полученных данных проведено сравнение количества тромбоцитов в крови всех обследованных пациенток с использованием критерия Манна–Уитни и доверительного интервала. В результате установлено, что между группами существуют значимые различия с высоким уровнем значимости (р = 0,0001). Анализ доверительного интервала показал, что количество тромбоцитов в контрольной группе колебалось от 178,14 до 202,35×109/л, в группе больных – от 236,68 до 273,77×109/л (рис. 5).
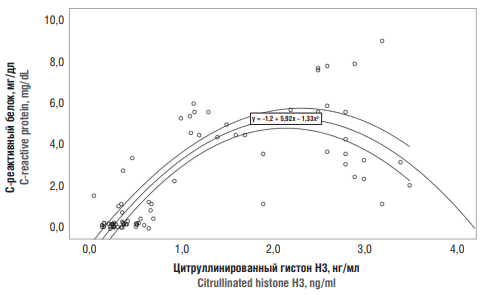
Рисунок 3. Взаимосвязь между значениями цитруллинированного гистона Н3 и С-реактивного белка в плазме крови пациенток обеих групп.
Figure 3. A relationship between serum citrullinated histone H3 and C-reactive protein level in both patient groups.
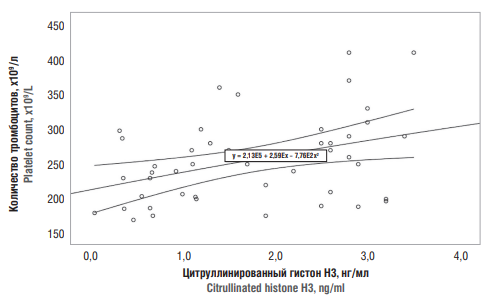
Рисунок 4. Взаимосвязь между значениями цитруллинированного гистона Н3 и числом тромбоцитов у обследованных пациенток обеих групп.
Figure 4. A relationship between serum citrullinated histone H3 and platelet count in both patient groups.
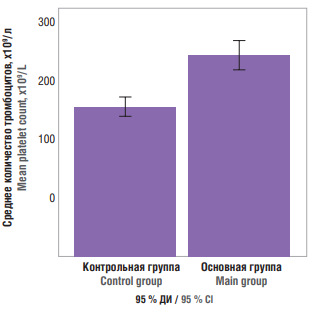
Рисунок 5. Количество тромбоцитов в крови обследованных пациенток.
Figure 5. Blood platelet count in patients examined.
Обсуждение / Discussion
Недавние результаты многочисленных исследований позволяют нам рассматривать нейтрофилы как потенциальных ключевых игроков в неопластических процессах в дополнение к их роли в защите хозяина от инфекции. При этом некоторые данные убедительно свидетельствуют о том, что нейтрофилы могут играть роль в прогрессии опухоли и рак-ассоциированном тромбозе, катастрофическую для хозяина. К сожалению, в настоящее время не разработана эффективная терапия, направленная на нейтрофилы в контексте прогрессии опухоли и тромботических рисков. Однако по мере того, как наше понимание проонкогенных и протромбогенных механизмов нейтрофилов улучшается, появляется возможность разработки новых мишеней противоопухолевой терапии и улучшения исходов у пациентов.
Как показали исследования, NETs способствуют пролиферации опухоли [30], метастазированию [31] и тромбозу [32]. В предыдущих исследованиях сообщалось об обнаружении NETs в плазме крови при различных заболеваниях, таких как аутоиммунный васкулит мелких сосудов, колоректальный рак и гепатоцеллюлярный рак [28][29][33]. В проведенном нами исследовании впервые был оценен вклад нетоза в течение опухолевого процесса при опухолях тела и шейки (аденокарцинома) матки, яичников, а также молочных желез. Концентрация citH3, маркера нетоза, у пациентов с опухолями тела и шейки матки, а также яичников оказались выше, чем у пациентов с доброкачественными заболеваниями, что позволяет предположить, что нейтрофилы и высвобождаемые NETs играют важную роль в развитии опухолей этой локализации.
Лейкоцитоз характерен для онкологических больных. При опухолевом процессе лейкоцитоз представлен преимущественно зрелыми нейтрофилами. Гранулоцитарный колониестимулирующий фактор (ГКСФ), продуцируемый опухолевой тканью, повышает количество нейтрофилов и усиливает их активацию. Повышенное содержание нейтрофилов у онкологических больных сочетается с неблагоприятным прогнозом течения заболевания. В эксперименте введение ГКСФ здоровым мышам приводило к гиперцитруллинизации гистона H3 в нейтрофилах и повышению интенсивности нетоза. Введение ГКСФ мышам с опухолями молочной железы приводило к повышению концентрации NETs, укорочению времени кровотечения и микротромбообразованию в почках и легких. Фрагменты нейтрофильных ловушек запускают активацию и агрегацию тромбоцитов, формирование эритроцитарных тромбов, выделение фактора фон Виллебранда [34][35]. В нашем исследовании было показано, что концентрация citH3 значительно коррелирует с количеством нейтрофилов и соотношением нейтрофилы/лимфоциты, что подтверждает роль нейтрофилов как основных источников NETs и роль нетоза в опухолевом росте.
Системный воспалительный ответ характеризуется увеличением концентрации циркулирующих белков острой фазы, в частности, СРБ. Было показано, что до операции этот показатель является независимым от стадии заболевания прогностическим фактором при многих типах рака [36]. Клетки-участники системного воспалительного ответа, такие как нейтрофилы, лимфоциты, моноциты и тромбоциты, имеют прогностическое значение у пациентов со злокачественными новообразованиями [37]. Предоперационные изменения циркулирующих лейкоцитов и, в частности, соотношение нейтрофилов и лимфоцитов использовались для прогнозирования общей и опухоль ассоциированной выживаемости при многочисленных злокачественных опухолях [38]. В проведенном исследовании помимо взаимосвязи опухолевого процесса и повышенной концентрации маркера нетоза было показано также, что повышение содержания citH3 достоверно коррелировало с увеличением концентрации СРБ.
О связи между раком и тромбозом известно еще со времен Армана Труссо, описавшего взаимосвязь между идиопатическим венозным тромбоэмболизмом и латентным опухолевым ростом. Тромбоз является одним из важных осложнений онкологического процесса, находясь на втором месте среди всех причин смерти у онкологических больных. Некоторые исследования показали, что NETs выступают в качестве строительного материала, и путем стимуляции агрегации тромбоцитов они участвуют в формировании тромбов при раке [35]. На моделях рака молочной железы отмечено увеличение количества нейтрофилов на фоне роста опухоли. На более поздних стадиях заболевания, когда уровни свободно циркулирующей ДНК в плазме крови (как составной части NETs) и citH3 начинают определяться в плазме крови, манифестируют первые тромбозы.
Тромбоцитоз традиционно сопутствует паранеопластическому процессу. Во многих исследованиях доказано, что тромбоцитоз выступает в роли предиктора отдаленных метастазов, в частности колоректального рака [39]. Некоторые типы опухолевых клеток, в частности опухолей яичников, способны производить тромбопоэтин – цитокин, стимулирующий дифференцировку и пролиферацию мегакариоцитов и, как следствие, продукцию тромбоцитов. В проведенном нами исследовании было достоверно показано увеличение количества тромбоцитов у пациенток с опухолями яичников, тела и шейки матки, а также молочной железы по сравнению с женщинами с доброкачественными новообразованиями женских половых органов и молочной железы. Кроме этого, была выявлена значимая связь между увеличением количества тромбоцитов и концентрацией citH3 у онкологических пациенток, что свидетельствует о параллельно протекающих процессах воспаления и тромбообразования. Значимая корреляция также выявлена между повышением концентрации гистона citH3 и уровнем D-димера, как одного из главных маркеров тромбообразования, свидетельствующего о наличии протромботического состояния.
Учитывая вышеизложенное, NETs можно рассматривать как один из протромбогенных факторов у онкологических пациентов и возможную мишень для разработки новых вариантов тромбопрофилактики и антитромботической терапии. Кроме этого, определение маркеров нетоза может являться скринингом начала нарушений в системе гемостаза в ситуациях, когда основные рутинные тесты еще не изменены, а также маркером неблагоприятного прогноза развития заболевания.
Заключение / Conclusion
В представленном исследовании впервые проведена оценка выраженности процессов нетоза у пациенток с опухолями тела и шейки (аденокациномы) матки, яичников и молочных желез. В результате анализа полученных данных было показано, что у онкологических больных содержание citН3 существенно повышено и составляет от 1,434 до 2,058 нг/мл, что превышает концентрацию citН3 у женщин с доброкачественными новообразованиями женских половых органов и молочной железы, которое составляет от 0,281 до 0,371 нг/мл. Уровень citН3 у больных с опухолями тела и шейки матки колеблется от 2,271 до 2,992 нг/мл, у больных с опухолями яичников – от 1,357 до 2,123 нг/мл, у больных с опухолями молочной железы – от 0,331 до 0,859 нг/мл. Настоящее исследование не установило существенных различий в уровне citН3 у больных с опухолями молочной железы по сравнению с женщинами с доброкачественными новообразованиями молочной железы. При повышении концентрации citH3 значимо повышаются значения таких показателей как СРБ, D-димер, число нейтрофилов и тромбоцитов и соотношение нейтрофилы/лимфоциты. Выявлены существенные различия в количестве тромбоцитов в основной группе (236,68–273,77×109/л) по сравнению с контрольной группой (178,14–202,35×109/л).
Настоящее исследование демонстрирует лишь часть общей картины показателей, характеризующих взаимосвязь между процессами тромбовоспаления и опухолевого роста, отличающихся сложностью и многомерностью взаимосвязей. Вскрытие этих взаимосвязей способно привести к значительному прогрессу в вопросах патогенеза и диагностики.
Список литературы
1. van Kessel K.P., Bestebroer J., van Strijp J.A. Neutrophil-mediated phagocytosis of Staphylococcus aureus. Front Immunol. 2014;5:467. https://doi.org/10.3389/fimmu.2014.00467.
2. Lazzaretto B., Fadeel B. Intra- and extracellular degradation of neutrophil extracellular traps by macrophages and dendritic cells. J Immunol. 2019;203(8):2276–90. https://doi.org/10.4049/jimmunol.1800159.
3. Nirmala J.G., Lopus M. Cell death mechanisms in eukaryotes. Cell Biol Toxicol. 2020;36(2):145–64. https://doi.org/10.1007/s10565-019-09496-2.
4. Vorobjeva N., Chernyak B. NETosis: molecular mechanisms, role in physiology and pathology. Biochemistry (Moscow). 2020;85(10):1178–90. https://doi.org/10.1134/S0006297920100065.
5. Libby P., Pasterkamp G., Crea F., Jang I.-K. Reassessing the mechanisms of acute coronary syndromes: the “vulnerable plaque” and superficial erosion. Circ Res. 2019;124(1):150–60. https://doi.org/10.1161/CIRCRESAHA.118.311098.
6. Heinecke J.W., Li W., Francis G.A., Goldstein J.A. Tyrosyl radical generated by myeloperoxidase catalyzes the oxidative cross-linking of proteins. J Clin Invest. 1993;91(6):2866–72. https://doi.org/10.1172/JCI116531.
7. Weinrauch Y., Drujan D., Shapiro S.D. et al. Neutrophil elastase targets virulence factors of enterobacteria. Nature. 2002;417(6884):91–4. https://doi.org/10.1038/417091a.
8. Pertiwi K.R., de Boer O.J., Mackaaij C. et al. Extracellular traps derived from macrophages, mast cells, eosinophils and neutrophils are generated in a time-dependent manner during atherothrombosis. J Pathol. 2019;247(4):505–12. https://doi.org/10.1002/path.5212.0.1002/path.5212.
9. Bryk A.H., Prior S.M., Plens K. et al. Predictors of neutrophil extracellular traps markers in type 2 diabetes mellitus: associations with a prothrombotic state and hypofibrinolysis. Cardiovasc Diabetol. 2019;18(1):1–12. https://doi.org/10.1186/s12933-019-0850-0.
10. Middleton E.A., He X.Y., Denorme F et al. Neutrophil extracellular traps contribute to immunothrombosis in COVID-19 acute respiratory distress syndrome. Blood. 2020;136(10):1169–79. https://doi.org/10.1182/blood.2020007008.
11. Yang D., Liu J. Neutrophil extracellular traps: A new player in cancer metastasis and therapeutic target. J Exp Clin Cancer Research. 2021;40(1):233. https://doi.org/10.1186/s13046-021-02013-6
12. Doring Y., Soehnlein O., Weber C. Neutrophil extracellular traps in atherosclerosis and atherothrombosis. Circ Res. 2017;120(4):736–43. https://doi.org/10.1161/CIRCRESAHA.116.309692.
13. Erpenbeck L., Chowdhury C.s, Zsengellér Z.K. et al. PAD4 deficiency decreases inflammation and susceptibility to pregnancy loss in a mouse model. Biol Reprod. 2016;95(6):132. https://doi.org/10.1095/biolreprod.116.140293.
14. Streiff M.B., Abutalib S.A., Farge D. et al. Update on guidelines for the management of cancer-associated thrombosis. Oncologist. 2021;26(1):e24–e40. https://doi.org/10.1002/onco.13596.
15. Navi B.B., Reiner A.S., Kamel H. et al. Risk of arterial thromboembolism in patients with cancer. J Am Coll Cardiol. 2017;70(8):926–38. https://doi.org/10.1016/j.jacc.2017.06.047.
16. Lyman G.H. Venous thromboembolism in the patient with cancer: focus on burden of disease and benefits of thromboprophylaxis. Cancer. 2011;117(7):1334–49. https://doi.org/10.1002/cncr.25714.
17. Zhou Y., Tao W., Shen F. et al. The emerging role of neutrophil extracellular traps in arterial, venous and cancer-associated thrombosis. Front Cardiovasc Med. December 2021. https://doi.org/10.3389/fcvm.2021.786387.
18. Efrimescu C.I., Buggy P.M., Buggy D.J. Neutrophil extracellular trapping role in cancer, mtastases, and cancer-related thrombosis: a narrative review of the current evidence base. Curr Oncol Rep. 2021;23(10):118. https://doi.org/10.1007/s11912-021-01103-0.
19. Chen Q., Zhang L., Li X., Zhuo W. Neutrophil extracellular traps in tumor metastasis: pathological functions and clinical applications. Cancers (Basel). 2021;13(11):2832. https://doi.org/10.3390/cancers13112832.
20. Hong D., Fritz A.J., Zaidi S.K. et al. Epithelial-to-mesenchymal transition and cancer stem cells contribute to breast cancer heterogeneity. J Cell Physiol. 2018;233(12):9136–44. https://doi.org/10.1002/jcp.26847.
21. Pieterse E., Rother N., Garsen M. et al. Neutrophil extracellular traps drive endothelial-to-mesenchymal transition. Arterioscler Thromb Vasc Biol. 2017;37(7):1371–9. https://doi.org/10.1161/ATVBAHA.117.309002.
22. Hedrick C.C., Malanchi I. Neutrophils in cancer: heterogeneous and multifaceted. Nat Rev Immunol. 2022;22(3):173–87. https://doi.org/10.1038/s41577-021-00571-6.
23. Martins-Cardoso K., Almeida V.H., Bagri K.M. et al. Neutrophil extracellular traps (NETs) promote pro-metastatic phenotype in human breast cancer cells through epithelial–mesenchymal transition. Cancers (Basel). 2020;12(6):1542. https://doi.org/10.3390/cancers12061542.
24. Snoderly H.T., Boone B.A., Bennewitz M.F. Neutrophil extracellular traps in breast cancer and beyond: current perspectives on NET stimuli, thrombosis and metastasis, and clinical utility for diagnosis and treatment. Breast Cancer Res. 2019;21(1):145. https://doi.org/10.1186/s13058-019-1237-6.
25. Faget J., Groeneveld S., Boivin G. et al. Neutrophils and snail orchestrate the establishment of a pro-tumor microenvironment in lung cancer. Cell Rep. 2017;21(11):3190–204. https://doi.org/10.1016/j.celrep.2017.11.052.
26. Berger-Achituv S., Brinkmann V., Abu-Abed U. et al. A proposed role for neutrophil extracellular traps in cancer immunoediting. Front Immunol. 2013;4:48. https://doi.org/10.3389/fimmu.2013.00048.
27. Arelaki S., Arampatzioglou A., Kambas K. et al. Gradient infiltration of neutrophil extracellular traps in colon cancer and evidence for their involvement in tumour growth. PloS One. 2016;11(5):e0154484. https://doi.org/10.1371/journal.pone.0154484.
28. Tohme S., Yazdani H.O., Al-Khafaji A.B. et al. Neutrophil extracellular traps promote the development and progression of liver metastases after surgical stress. Cancer Res. 2016;76(6):1367–80. https://doi.org/10.1158/0008-5472.CAN-15-1591.
29. van der Windt D.J., Sud V., Zhang H. et al. Neutrophil extracellular traps promote inflammation and development of hepatocellular carcinoma in nonalcoholic steatohepatitis. Hepatology. 2018;68(4):1347–60. https://doi.org/10.1002/hep.29914.
30. Nie M., Yang L., Bi X. et al. Neutrophil extracellular traps induced by IL8 promote diffuse large B-cell lymphoma progression via the TLR9 signaling. Clin Cancer Res. 2019;25(6):1867–79. https://doi.org/10.1158/1078-0432.CCR-18-1226.
31. Lee W., Ko S.Y., Mohamed M.S. et al. Neutrophils facilitate ovarian cancer premetastatic niche formation in the omentum. J Exp Med. 2019;216(1):176–94. https://doi.org/10.1084/jem.20181170.
32. Wolach O., Sellar R.S., Martinod K. et al. Increased neutrophil extracellular trap formation promotes thrombosis in myeloproliferative neoplasms. Sci Transl Med. 2018;10(436):eaan8292. https://doi.org/10.1126/scitranslmed.aan8292.
33. Kessenbrock K., Krumbholz M., Schonermarck U. et al. Netting neutrophils in autoimmune small-vessel vasculitis. Nat Med. 2009;15(6):623–5. https://doi.org/10.1038/nm.1959.
34. Demers M., Krause D.S., Schatzberg D. et al. Cancers predispose neutrophils to release extracellular DNA traps that contribute to cancerassociated thrombosis. Proc Natl Acad Sci U S A. 2012;109(32):13076–81. https://doi.org/10.1073/pnas.1200419109.
35. Demers M., Wagner D.D. Neutrophil extracellular traps: A new link to cancer-associated thrombosis and potential implications for tumor progression. Oncoimmunology. 2013;2(2):e22946. https://doi.org/10.4161/onci.22946.
36. McMillan D., Canna K., McArdle C. Systemic inflammatory response predicts survival following curative resection of colorectal cancer. Br J Surg. 2003;90(2):215–19. https://doi.org/10.1002/bjs.4038.
37. Hauser C.A,. Stockler M.R., Tattersall M.H. Prognostic factors in patients with recently diagnosed incurable cancer: a systematic review. Support Care Cancer. 2006;14(10):999–1011. https://doi.org/10.1007/s00520-006-0079-9.
38. Walsh S., Cook E., Goulder F. et al. Neutrophil-lymphocyte ratio as a prognostic factor in colorectal cancer. J Surg Oncol. 2005;91(3):181–4. https://doi.org/10.1002/jso.20329.
39. Cravioto-Villanueva A., Luna-Perez P., Gutierrez-de la Barrera M. et al. Thrombocytosis as a predictor of distant recurrence in patients with rectal cancer. Arch Med Res. 2012;43(4):305–11. https://doi.org/10.1016/j.arcmed.2012.06.008.
Об авторах
Е. В. СлуханчукРоссия
Слуханчук Екатерина Викторовна – к.м.н., доцент кафедры акушерства и гинекологии Клинического института детского здоровья имени Н.Ф. Филатова
Россия, 119991 Москва, ул. Большая Пироговская, д. 2, стр. 4
В. О. Бицадзе
Россия
Бицадзе Виктория Омаровна – д.м.н., профессор РАН, профессор кафедры акушерства и гинекологии Клинического института детского здоровья имени Н.Ф. Филатова
Scopus Author ID: 6506003478. Researcher ID: F-8409-2017
Россия, 119991 Москва, ул. Большая Пироговская, д. 2, стр. 4
А. Г. Солопова
Россия
Солопова Антонина Григорьевна – д.м.н., профессор кафедры акушерства и гинекологии Клинического института детского здоровья имени Н.Ф. Филатова
Scopus Author ID: 6505479504. Researcher ID: Q-1385-2015
Россия, 119991 Москва, ул. Большая Пироговская, д. 2, стр. 4
Д. Х. Хизроева
Россия
Хизроева Джамиля Хизриевна – д.м.н., профессор кафедры акушерства и гинекологии Клинического института детского здоровья имени Н.Ф. Филатова
Scopus Author ID: 57194547147. Researcher ID: F-8384-2017.
Россия, 119991 Москва, ул. Большая Пироговская, д. 2, стр. 4
Ж.-К. Гри
Россия
Гри Жан-Кристоф – д.м.н., профессор кафедры акушерства и гинекологии Клинического института детского здоровья имени Н.Ф. Филатова; профессор гематологии, зав. лабораторией гематологии факультета биологических и фармацевтических наук; иностранный член РАН
Scopus Author ID: 7005114260. Researcher ID: AAA-2923-2019.
Россия, 119991 Москва, ул. Большая Пироговская, д. 2, стр. 4
Франция, 34090 Монпелье, ул. Огюста Бруссоне, д. 163
И. Элалами
Россия
Элалами Исмаил – д.м.н., профессор кафедры акушерства и гинекологии Клинического института детского здоровья имени Н.Ф. Филатова; профессор; директор гематологии Центра Тромбозов
Scopus Author ID: 7003652413. Researcher ID: AAC-9695-2019
Россия, 119991 Москва, ул. Большая Пироговская, д. 2, стр. 4
Франция, 75006 Париж, Улица медицинского факультета, д. 12
Франция, 75020 Париж, Китайская улица, д. 4
А. Д. Макацария
Россия
Макацария Александр Давидович – д.м.н., профессор, академик РАН, зав. кафедрой акушерства и гинекологии Клинического института детского здоровья имени Н.Ф. Филатова
Scopus Author ID: 57222220144. Researcher ID: M-5660-2016
Россия, 119991 Москва, ул. Большая Пироговская, д. 2, стр. 4
Рецензия
Для цитирования:
Слуханчук Е.В., Бицадзе В.О., Солопова А.Г., Хизроева Д.Х., Гри Ж., Элалами И., Макацария А.Д. Внеклеточные ловушки нейтрофилов как маркеры тромбовоспаления в патогенезе злокачественных новообразований женских половых органов и молочной железы. Акушерство, Гинекология и Репродукция. 2022;16(4):426-437. https://doi.org/10.17749/2313-7347/ob.gyn.rep.2022.335
For citation:
Slukhanchuk E.V., Bitsadze V.O., Solopova A.G., Khizroeva J.Kh., Gris J., Elalamy I., Makatsariya A.D. Neutrophil extracellular traps as markers of thromboinflammation in the pathogenesis of female genital tract and breast malignant neoplasms. Obstetrics, Gynecology and Reproduction. 2022;16(4):426-437. https://doi.org/10.17749/2313-7347/ob.gyn.rep.2022.335

Контент доступен под лицензией Creative Commons Attribution-NonCommercial-ShareAlike 4.0 International License.











































