Перейти к:
Клиническое значение определения уровня аутоантител в диагностике ранней и поздней формы задержки роста плода
https://doi.org/10.17749/2313-7347/ob.gyn.rep.2022.340
Аннотация
Цель: анализ возможностей диагностики ранней и поздней формы задержки роста плода (ЗРП) на основании изучения аутоиммунных антител (АТ).
Материалы и методы. В одноцентровое проспективное когортное сравнительное исследование включены 98 беременных: 79 с ЗРП (основная группа I) и 19 c физиологическим течением беременности (группа сравнения II). Беременные с ЗРП в зависимости от срока манифестации были разделены на 2 подгруппы – с ранней формой ЗРП (подгруппа IА, n = 41) и с поздней формой ЗРП (подгруппа IВ, n = 38). Всем пациенткам был выполнен отбор проб венозной крови для определения содержания аутоиммунных АТ к 12 антигенам методом ЭЛИ-П-Тест: к антигену хорионического гонадотропина человека (ХГЧ), к ДНК, к β2-гликопротеину (англ. β2-glycoprotein, β2-GP), к коллагену, к константному фрагменту молекул иммуноглобулинов класса IgG (англ. fragment crystallizable of immunoglobulin G, Fc-IgG), к инсулину, к тиреоглобулину, к белку S100, к общему для клеток простаты, сперматозоидов и некоторых бактерий мембранному антигену (англ. surface antigen of germ cell and prostate, Spr), к белку мембраны тромбоцитов (англ. thrombocyte membrane protein, TrM), к антинейтрофильным цитоплазматическим антителам (англ. antineutrophil cytoplasmic antibodies, ANCA); к мембранному антигену клеток клубочков почек (англ. membrane antigen of glomerular cells, KiMS). Отбор проб венозной крови проводили в основной группе (группа I) на момент постановки диагноза ЗРП (во всех наблюдениях – в III триместре гестации): при ранней манифестации ЗРП – в 29 [28; 31] нед, при поздней манифестации ЗРП – в 35 [33; 36] нед, в группе сравнения (группа II) – в 33 [32; 34] нед.
Результаты. Для диагностики ранней формы ЗРП статистическую значимость показало повышение уровня следующих аутоиммунных АТ – к антигену ХГЧ, коллагену, белку S100, TrM, ANCA, KiMS (p = 0,037; р = 0,001; р = 0,013; р = 0,005; р = 0,003; p < 0,001, соответственно), а для диагностики поздней формы ЗРП – АТ к ДНК, коллагену, инсулину, белку S100 (p = 0,002; p = 0,003; p = 0,010; p < 0,001, соответственно).
Заключение. Определение аутоиммунных АТ показало свою информативность у беременных с ЗРП, изменение уровня аутоантител может выступать в качестве лабораторного маркера ранней и поздней формы ЗРП.
Для цитирования:
Игнатко И.В., Якубова Д.И., Меграбян А.Д., Тимохина E.В. Клиническое значение определения уровня аутоантител в диагностике ранней и поздней формы задержки роста плода. Акушерство, Гинекология и Репродукция. 2022;16(4):450-462. https://doi.org/10.17749/2313-7347/ob.gyn.rep.2022.340
For citation:
Ignatko I.V., Yakubova D.I., Megrabyan A.D., Timokhina E.V. Clinical significance of assessing autoantibody level in diagnostics of early and late fetal growth retardation. Obstetrics, Gynecology and Reproduction. 2022;16(4):450-462. (In Russ.) https://doi.org/10.17749/2313-7347/ob.gyn.rep.2022.340
Введение / Introduction
Задержка роста плода (ЗРП) имеет повышенный риск перинатальной заболеваемости и смертности и неблагоприятных долгосрочных исходов, таких как сердечно-сосудистые заболевания или плохое когнитивное развитие в дальнейшем [1][2]. Смертность при ЗРП в антенатальном периоде составляет 12 %, в неонатальном периоде – 8 % [3], а риск рецидива ЗРП составляет до 40 % [4].
В клинической практике повсеместно используются критерии ЗРП, разработанные международным консенсусом, достигнутым в рамках протокола Delphi. В соответствии с критериями консенсуса экспертов, ЗРП дифференцируют на ранний и поздний фенотип, в зависимости от того, был ли он идентифицирован до или после 32 нед гестации [5][6]. Ранний фенотип ЗРП (< 32 нед) ставится на основании 3 основных параметров – окружность живота (ОЖ) < 3-го процентиля, предполагаемая масса плода (ПМП) < 3-го процентиля и отсутствие конечно-диастолического кровотока в пупочной артерии (ПА) и 4 сопутствующих параметров – ОЖ или ПМП < 10-го процентиля в сочетании с пульсаторным индексом (ПИ) > 95-го процентиля либо в ПА, либо в маточной артерии. Поздний фенотип ЗРП (≥ 32 нед) ставится на основании 2 основных параметров (ОЖ или ПМП < 3-го процентиля) и 4 сопутствующих параметров (ОА или ПМП < 10-го процентиля, ОЖ и ПМП > двух квартилей на графиках роста, церебро-плацентарное отношение < 5-го процентиля или соотношение ПА/ПИ > 95-го процентиля). ЗРП с поздней манифестацией (после 32 нед беременности) составляет 70–80 % и характеризуется гипоксическим состоянием, обусловленным хроническим воспалением и оксидативным стрессом. Это приводит к поздним плацентарным изменениям и модификациям церебрально-плацентарного соотношения [7]. ЗРП с ранней манифестацией (до 32 нед беременности) составляет 20–30 %, в основном связана с плацентарной гипоперфузией, приводящей к состоянию хронической гипоксии плода. Раннее выявление ЗРП в совокупности с выбором оптимального метода и срока родоразрешения снижают антенатальную гибель плода. Основной задачей антенатального наблюдения, особенно в случаях с ранним началом, является нахождение баланса между внутриутробными рисками пролонгирования беременности для плода и неонатальными рисками в связи с показаниями к преждевременным родам.
Нормальный рост плода обеспечивает динамическая и сложная связь между материнской, эмбриональной и плацентарной средой. Любое несоответствие или отсутствие взаимосвязи в этой сложной системе может привести к ЗРП.
Одна из теорий развития ЗРП – иммунологическая. Вопрос об иммунных механизмах возникновения ЗРП – один из основных и спорных моментов на сегодняшний день. Беременность, в целом, является иммуноопосредованным процессом, включающим сложные взаимодействия между полуаллогенными фетальными клетками и материнскими иммунными клетками. Взаимодействие между этими клетками не только предотвращает нарушения в работе иммунной системы, но также способствует созданию подходящей среды для течения беременности [8]. Плацента – это место, в котором происходит большинство иммуномодулирующих процессов. Связь между материнскими иммунными клетками и фетальными трофобластами является двунаправленной, она в основном опосредована прямым контактом и высвобождением множества аутокринных, паракринных и эндокринных сигналов, включая цитокины, факторы роста и молекулы адгезии, экспрессируемые на поверхности клетки, такие как интегрины, кадгерины, селектины и иммуноглобулины [9]. Посредством этих механизмов плацентарные трофобласты управляют действиями резидентных децидуальных клеток, влияя также на привлечение циркулирующих лейкоцитов к маточно-плодовому кровотоку [10].
Аутоиммунные антитела (АТ) являются важным звеном в регуляции работы иммунной системы. В организме здорового человека в течение всей жизни синтезируются естественные аутоантитела, направленные к эндогеным и экзогенным антигенам (белкам цитоскелета, компонентам межклеточного матрикса, гистонам, маркерам главного комплекса гистосовместимости, ДНК, гормонам и др.) [11].
Согласно большому многообразию исследований, посвященных изучению аутоиммунных АТ, при развитии патологического процесса в организме изменяется их содержание [11–15].
Своевременное выявление ЗРП в антенатальном периоде направлено на снижение неблагоприятных перинатальных исходов, но это возможно только при наличии эффективных процедур скрининга ЗРП. С целью выявления наиболее специфичных и чувствительных биомаркеров для неинвазивной диагностики ЗРП мы изучили аутоантитела у беременных с ЗРП.
Цель: анализ возможностей диагностики ранней и поздней формы ЗРП на основании изучения аутоиммунных АТ.
Материалы и методы/ Materials and Methods
Дизайн исследования / Study design
С сентября 2020 г. по сентябрь 2021 г. на базе Перинатального центра при ГБУЗ ГКБ им С.С. Юдина ДЗМ проведено одноцентровое проспективное когортное сравнительное исследование с участием 98 беременных с одноплодной беременностью в возрасте от 18 до 43 лет.
Критерии включения, невключения и исключения / Inclusion and exclusion criteria
Критерии включения в основную группу: возраст старше 18 лет; одноплодная беременность; срок гестации от 22 нед; отягощенное течение данной беременности в виде ЗРП; согласие пациентки на участие в исследовании.
Критерии включения в группу сравнения: возраст старше 18 лет; одноплодная беременность; срок гестации от 22 нед; физиологическое течение беременности; согласие пациентки на участие в исследовании.
Критерии невключения: возраст младше 18 лет; многоплодная беременность.
Критерии исключения: отсутствие данных об исходах беременности; пороки развития и хромосомные аномалии плода; гестационный сахарный диабет; сахарный диабет 1-го и 2-го типа; прием иммуносупрессорных препаратов; активный инфекционный процесс; антифосфолипидный синдром; отказ от участия в исследовании.
Группы обследованных пациенток / Groups of patients examined
Основную группу (группа I) составили 79 беременных с ЗРП, которую диагностировали на основании замедления показателей прироста предполагаемой массы плода (ПМП) и/или окружности живота (ОЖ) < 10-го процентиля в сочетании с нарушением кровотоков по данным доплерографического исследования, либо значения ПМП и/или ОЖ < 3-го процентиля [5]. Учитывая критерии консенсуса экспертов [5], беременные основной группы были разделены на подгруппы: IА – 41 беременная с ранним фенотипом ЗРП, IВ – 38 беременных с поздним фенотипом ЗРП. Срок гестации на момент постановки диагноза ЗРП составил при ранней манифестации ЗРП 29 [ 28; 31] нед, при поздней манифестации ЗРП – 35 [ 33; 36] нед.
Изначально в группу сравнения было включено 29 беременных с физиологическим течением беременности; 10 беременных, которым был выполнен отбор венозной крови на определение аутоиммунных АТ методом ЭЛИ-П-Тест до 32 нед, были исключены из исследования в соответствии с критериями исключения. Таким образом, группу сравнения (группу II) составили 19 относительно здоровых беременных с физиологическим течением беременности, которым был проведен ЭЛИ-П-Тест при поступлении в стационар в срок гестации 33 [ 32; 35] нед.
Методы исследования / Study methods
У всех участниц исследования был выполнен отбор проб венозной крови с целью определения содержания ряда аутоантител, а также изменения иммунореактивности методом ЭЛИ-П-Тест (репродуктивное здоровье женщин), разработанного Медицинским исследовательским центром «Иммункулус» (Москва, Россия).
Анализ всех проб выполнялся в лаборатории «Иммункулус». Образцы крови в стерильных пробирках помещали на 30 мин в термостат при температуре +37 °С, затем 1–2 ч выдерживали при комнатной температуре до формирования сгустка. После этого шприцем удаляли сыворотку. Полученные образцы сыворотки крови центрифугировали 10 мин при 1000 g. Перед проведением анализа образцы сыворотки прогревали до +56 °С в течение 30 мин, затем к каждой из анализируемых сывороток добавляли 2000 мкл рабочего буферного раствора для разведения проб и перемешивали при помощи вортекса.
Количественным методом (в усл. ед.) и на основании цветных гистограмм осуществляли оценку реактивности сывороток. Гистограмма может иметь зеленые, желтые и красные участки в соответствии со значениями и их отклонениями от нормальных. В лунках панели ЭЛИ-П-Тест находятся антигены соответствующих органов и тканей. Избыток антигенов приводит к индукции синтеза АТ 1-го порядка (по данным ЭЛИ-П-Теста – положительные числа). Если в результате избытка АТ 1-го порядка происходит синтез антиидиопатических антител (АИАТ2), и их становится больше, чем АТ 1-го порядка, тогда при проведении ЭЛИ-П-Теста смотрят только АТ 1-го порядка (в данном случае – цифры с отрицательным результатом). Таким образом проводилась оценка амплитуды пиков сывороточной иммунореактивности. Референсный интервал составляет от –15 % до + 10 %. Избирательные сдвиги относительной иммунореактивности с теми или иными антигенами выше +10 % или ниже –15 % от индивидуального среднего уровня рассматривали как аномальные пики.
ЭЛИ-П-Тест представлен аутоиммунными АТ к антигену хорионического гонадотропина человека (ХГЧ) – гормону, необходимому для нидации зиготы и развития плаценты; к ДНК – антигенному компоненту любых типов клеток; к β2-гликопротеину (англ. β2-glycoprotein, β2-GP) – основному фосфолипидсвязывающему белку плазмы крови; к коллагену (коллаген II типа – основной белок соединительного матрикса); к константному фрагменту молекул иммуноглобулинов класса IgG (англ. fragment crystallizable of immunoglobulin G, Fc-IgG); к инсулину (гормон пептидной природы); к тиреоглобулину (специфический компонент цитоплазмы клеток щитовидной железы); к белку S100 – тканеспецифичному протеину, который экспрессируется преимущественно астроглиальными клетками в головном мозге, а также клетками меланомы, являющемуся маркером воспаления, ряда опухолей и дифференцировки многих типов клеток; к общему для клеток простаты, сперматозоидов и некоторых бактерий мембранному антигену (англ. surface antigen of germ cell and prostate, Spr); к белку мембраны тромбоцитов (англ. thrombocyte membrane protein, TrM); антинейтрофильные цитоплазматические антитела (англ. antineutrophil cytoplasmic antibodies, ANCA); к мембранному антигену клеток клубочков почек (англ. membrane antigen of glomerular cells, KiMS).
Этические аспекты / Ethical aspects
Исследование одобрено локальным этическим комитетом ФГАОУ ВО Первый МГМУ им. И.М. Сеченова Минздрава России (Сеченовский университет), протокол № 03-20 от 19.02.2020, соответствует этическим стандартам Хельсинской декларации Всемирной медицинской ассоциации (Форталеза, Бразилия, 2013). Все участницы исследования подписывали информированное согласие.
Статистический анализ / Statistical analysis
Для статистического анализа использована программа StatTech v. 2.8.4 (ООО «Статтех», Россия). Для оценки количественных показателей с нормальным распределением применяли критерии Шапиро–Уилка (при числе исследуемых менее 50) и Колмогорова– Смирнова (при числе исследуемых более 50). Для описания количественных показателей с нормальным распределением использовали средние арифметические величины (M) и стандартные отклонения (SD), границы 95 % доверительного интервала (95 % ДИ). При нормальном распределении 2 группы сравнивали с помощью t-критерия Стьюдента, где условием являлось равенство дисперсий.
Описание количественных показателей в случае ненормального распределения осуществляли с помощью медианы (Me) и интерквартильного размаха [Q1; Q3]. При ненормальном распределении 2 группы сравнивали с использованием U-критерия Манна– Уитни, а при сравнении 3 и более групп – с помощью критерия Краскела–Уоллиса и критерия Данна с поправкой Холма (апостериорные). Анализ многопольных таблиц, а именно, сравнение процентных долей проводили с использованием критерия χ2 Пирсона.
Абсолютные значения и процентные доли были использованы при описании категориальных данных. Посредством ROC-анализа (англ. Receiver Operator Characteristic; рабочая характеристика приемника) осуществляли определение диагностической значимости при прогнозировании определенного исхода. Разделяющее значение количественного признака в точке cutoff определяли по наивысшему значению индекса Юдена. Количественная интерпретация ROC даёт показатель площадь под кривой (англ. Area Under Curve, AUC). Статистически значимой разницей считали p < 0,05.
Результаты / Results
Клинико-анамнестическая характеристика обследованных пациенток / Clinical and anamnestic characteristics of the patients examined
С целью прогнозирования различных фенотипов ЗРП проанализированы данные 41 (41,8 %) беременной с ранним фенотипом ЗРП (подгруппа IA), 38 (38,8 %) с поздним фенотипом ЗРП (подгруппа IB) и 19 (19,4 %) c физиологическим течением беременности (группа II).
При оценке возраста беременных между группами I и II были определены статистически значимые различия (p = 0,009), при оценке возраста между подгруппами IA и IВ статистических различий не выявлено (p = 0,879). Средний возраст пациенток при раннем фенотипе ЗРП составил 32 [ 25; 37] года, при позднем – 32 [ 24; 35] года, у беременных группы II – 24 [ 23; 30] года. По паритету родов и индексу массы тела статистически значимых различий между группами не установлено.
Отбор проб венозной крови проводили в основной группе (группа I) на момент постановки диагноза ЗРП (во всех наблюдениях – в III триместре гестации): при ранней манифестации ЗРП – в 29 [ 28; 31] нед, при поздней манифестацией ЗРП – в 35 [ 33; 36] нед, в группе сравнения (группа II) – в 33 [ 32; 34] нед.
На момент постановки диагноза ЗРП и оценки аутоиммунных АТ срок гестации составил: при ЗРП с ранней манифестацией (подгруппа IА) – 29 [ 28; 31] нед, при ЗРП с поздней манифестацией (подгруппа IВ) – 35 [ 33; 36] нед; срок беременности в группе II на момент оценки аутоиммунных АТ (при поступлении в стационар) составил 33 [ 32; 35] нед (рIA–IB–II < 0,001; рIA–IB < 0,001; pIA–II < 0,001; pIB–II = 0,047). Срок беременности на момент родов при раннем фенотипе ЗРП составил 32 [ 31; 34] нед, при позднем фенотипе ЗРП – 37 [ 37; 38] нед, в группе II – 39 [ 39; 40] нед (рIA–IB–II < 0,001; рIA–IB < 0,001; pIA–II < 0,001; pIB–II = 0,001).
Исходы беременности / Pregnancy outcomes
При анализе метода родоразрешения были выявлены статистически значимые различия (р < 0,001): естественные роды были у 1 из 41 (2,4 %) беременной подгруппы IA, у 13 из 38 (34,2 %) беременных подгруппы IВ, у 16 из 19 (84,2 %) женщин группы II. Путем операции кесарева сечения было родоразрешено 40 из 41 (97,6 %) пациенток подгруппы IA, 25 из 38 (65,8 %) пациенток подгруппы IВ и 3 из 19 (15,8 %) женщин группы II (рIA–IB–II < 0,001; pIА–IВ = 0,001; pIA–II = 0,001; pIB–II = 0,001). Как при ранней, так и при поздней форме ЗРП приоритетным выбором было родоразрешение путем операции кесарева сечения.
Средняя масса тела новорожденных при рождении при ранней форме ЗРП (подгруппа IA) составила 1350 [ 1040; 1750] г, при поздней форме ЗРП (подгруппа IB) – 2290 [ 2088; 2350] г, в группе II – 3450 [ 3175; 3665] г; различия показателей были статистически значимы (рIA–IB–II < 0,001; pIA–IB < 0,001; pIA–II < 0,001; pIB–II < 0,001). В результате анализа роста детей при рождении в зависимости от групп были также выявлены статистически значимые различия: при раннем фенотипе ЗРП – 40 [ 36; 42] см, при позднем фенотипе ЗРП – 46 [ 44; 46] см, в группе II – 50 [ 49; 51] см (рIA–IB–II < 0,001; pIA–IB < 0,001; pIA–II < 0,001; pIB–II < 0,001). Установлены статистически значимые различия при анализе состояния новорожденных по шкале Апгар на 1-й и 5-й минутах. У новорожденных в подгруппе IA оценка по шкале Апгар на 1-й минуте составила 6 [ 6; 7] баллов, в подгруппе IВ – 8 [ 7; 8] баллов, в группе II – 8 [ 8; 9] баллов (рIA–IB–II < 0,001; pIA–IB < 0,001; pIA–II < 0,001; pIB–II < 0,022). Оценка новорожденных по шкале Апгар на 5-й минуте в погруппе IA составила 7 [ 7; 8] баллов, в подгруппе IВ – 8 [ 8; 9] баллов, в группе II – 9 [ 8; 9] баллов (рIA–IB–II < 0,001; pIA–IB < 0,001; pIA–II < 0,001; pIB–II = 0,008).
Исследование спектра аутоиммунных антител / Study of autoimmune antibody profile
При исследовании содержания аутоиммунных АТ класса IgG в сыворотке крови беременных методом ЭЛИ-П-Тест были выявлены статистически значимые различия между группами. Частота отклонений содержания аутоиммунных АТ от нормальных значений (за норму принимали значение от –15 % до +10 %) у беременных с ЗРП и беременных с физиологическим течением беременности представлена в таблице 1. При сопоставлении показателей сывороточного содержания АТ к антигену ХГЧ, ДНК, β2-GP, коллагену, Fc-IgG, инсулину, белку S100, Spr, TrM, ANCA, KiMS в зависимости от групп были выявлены существенные различия. При оценке АТ к тиреоглобулину статистически значимых различий не установлено (p = 0,529).
Таблица 1. Частота отклонений содержания аутоиммунных антител (АТ) от нормальных значений среди обследованных беременных.
Table 1. Frequency of altered autoimmune antibody (AВ) level compared to normal range in pregnant women examined.
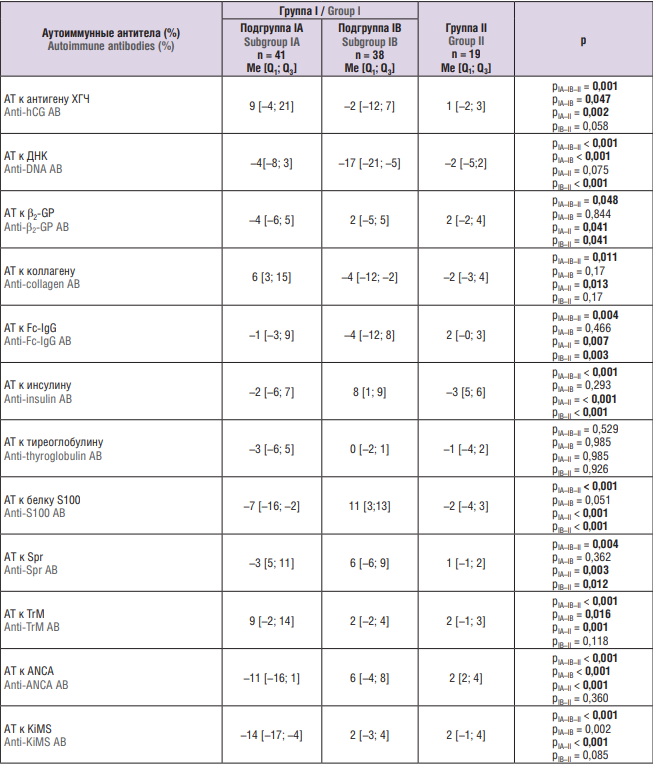
Примечание: рIA–IB–II – различия между подгруппами IA, IB и группой II (сравнение трех групп); pIA–IB – различия между подгруппами IA и IB; pIA–II – различия между подгруппой IA и группой II; pIB–II – различия между подгруппой IВ и группой II; ХГЧ – хорионический гонадотропин человека; β2- GP – β2-гликопротеин; Fc-IgG – константный фрагмент молекул иммуноглобулинов класса IgG; Spr – общий для клеток простаты, сперматозоидов и некоторых бактерий мембранный антиген; TrM – белок мембраны тромбоцитов; ANCA – антинейтрофильные цитоплазматические антитела; KiMS – мембранный антиген клеток клубочков почек; выделены статистически значимые различия.
Note: рIA–IB–II – differences between subgroups IA, IB and group II (comparison of the three groups); pIA–IB – differences between subgroups IA and IB; pIA–II – differences between subgroup IA and group II; pIB–II – differences between subgroup IB and group II; hCG – human chorionic gonadotropin; β2-GP – β2-glycoprotein; Fc-IgG – fragment crystallisable of immunoglobulin G; Spr – surface antigen of germ cell and prostate; TrM – thrombocyte membrane protein; ANCA – antineutrophil cytoplasmic antibodies; KiMS – membrane antigen of glomerular cells; significant differences are highlighted in bold.
При ЗРП с ранней манифестацией статистически значимо чаще по сравнению с подгруппой IB и группой II встречались отклонения в спектре аутоантител: АТ к антигену ХГЧ (pIA–IB = 0,047; pIA–II = 0,002), к коллагену (pIA–II = 0,013), к TrM (pIA–IB = 0,016; pIA–II = 0,001), АNCA (pIA–IB < 0,001; pIA–II < 0,001), к KiMS (pIA–IB = 0,002; pIA–II < 0,001). При ЗРП с поздней манифестацией статистически значимо чаще по сравнению с подгруппой IА и группой II встречались отклонения аутоантител к ДНК (рIA–IB < 0,001; pIB–II < 0,001) и инсулину (рIA–IB < 0,001; pIB–II < 0,001).
При этом обнаружена высокая частота отклонений содержания от нормальных значений аутоантител к белку S100 при ЗРП как с ранней манифестацией, так и с поздней. При оценке АТ к белку S100 между подгруппами IA и IB не определено статистически значимых различий, статистически значимые различия были выявлены между группами I и II (p < 0,001).
Анализ аномального содержания аутоантител к β2-GP, Fc-IgG, Spr показал отсутствие статистических различий между ранней и поздней формами ЗРП. Следует отметить отсутствие данных аутоантител у беременных с физиологическим течением беременности (группа II).
В таблице 2 представлены уровни аутоантител класса IgG в обследованных группах.
Таблица 2. Уровень аутоиммунных антител (АТ) у обследованных беременных.
Table 2. Аutoimmune antibody (AВ) level in pregnant women examined.
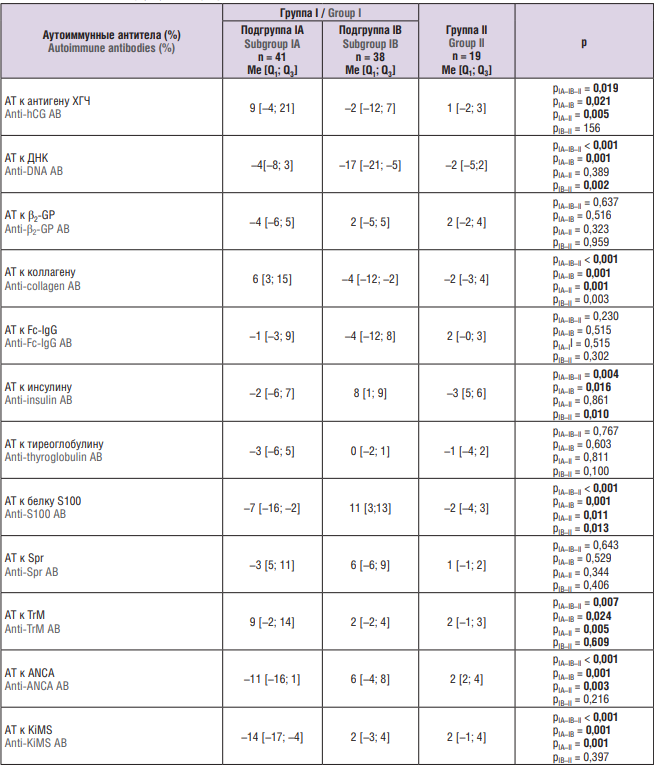
Примечание: рIA–IB–II – различия между подгруппами IA, IB и группой II (сравнение трех групп); pIA–IB – различия между подгруппами IA и IB; pIA–II – различия между подгруппой IA и группой II; pIB–II – различия между подгруппой IВ и группой II; ХГЧ – хорионический гонадотропин человека; β2- GP – β2-гликопротеин; Fc-IgG – константный фрагмент молекул иммуноглобулинов класса IgG; Spr – общий для клеток простаты, сперматозоидов и некоторых бактерий мембранный антиген; TrM – белок мембраны тромбоцитов; ANCA – антинейтрофильные цитоплазматические антитела; KiMS – мембранный антиген клеток клубочков почек; выделены статистически значимые различия.
Note: рIA–IB–II – differences between subgroups IA, IB and group II (comparison of the three groups); pIA–IB – differences between subgroups IA and IB; pIA–II – differences between subgroup IA and group II; pIB–II – differences between subgroup IB and group II; hCG – human chorionic gonadotropin; β2-GP – β2-glycoprotein; Fc-IgG – fragment crystallisable of immunoglobulin G; Spr – surface antigen of germ cell and prostate; TrM – thrombocyte membrane protein; ANCA – antineutrophil cytoplasmic antibodies; KiMS – membrane antigen of glomerular cells; significant differences are highlighted in bold.
У беременных с ранней формой ЗРП медианные значения аутоантител к антигену ХГЧ, ДНК, коллагену и к TrM были статистически значимо выше, чем у беременных с поздней формой ЗРП (р = 0,021; р = 0,001; р < 0,001; р = 0,024). Уровень АТ к антигену ХГЧ в группе ранней манифестации ЗРП был также значимо выше, чем в группе II (p = 0,019). Медианные значения аутоантител к инсулину и ANCA были статистически значимо выше при поздней форме ЗРП.
Медианный уровень аутоантител к белку S100 был статистически значимо выше при поздней форме ЗРП (р < 0,001) по сравнению с подгруппой IA и группой II. Медианный уровень аутоантител к KiMS был одинаковым при поздней форме ЗРП и в группе II, но статистически значимо ниже при ранней форме ЗРП (p < 0,001).
Диагностическая значимость исследования аутоиммунных антител / Diagnostic significance of assessing serum autoimmune antibody level
Результаты нашего исследования показали статистически значимые различия в полученных моделях (табл. 3, 4). При анализе значимости аутоантител при ранней форме ЗРП высокий уровень диагностической значимости показали АТ к антигену ХГЧ, коллагену, белку S100, TrM, ANCA, KiMS (p = 0,037; р = 0,001; р = 0,013; р = 0,005; р = 0,003; p < 0,001, соответственно). При поздней форме ЗРП показали высокий уровень диагностической значимости АТ к ДНК, коллагену, инсулину, белку S100 (p = 0,002; p = 0,003; p = 0,010; p < 0,001, соответственно).
Таблица 3. Диагностическая значимость аутоиммунных антител (АТ) при ранней форме задержки роста плода.
Table 3. Diagnostic significance of autoimmune antibody (AВ) level in early fetal growth retardation
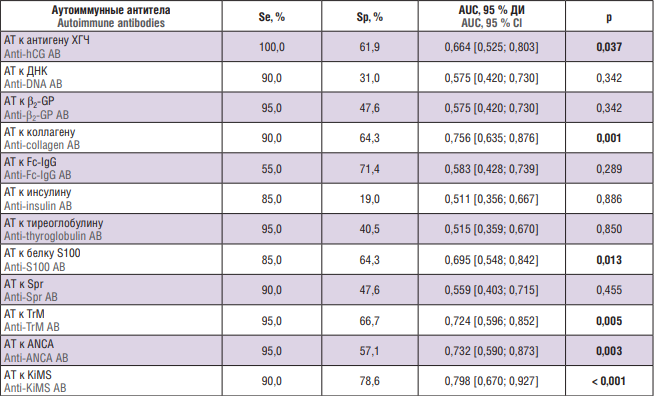
Примечание: Se – чувствительность; Sp – специфичность; AUC – площадь под ROC-кривой c 95 % доверительным интервалом (ДИ); ХГЧ – хорионический гонадотропин человека; β2-GP – β2-гликопротеин; Fc-IgG – константный фрагмент молекул иммуноглобулинов класса IgG; Spr – общий для клеток простаты, сперматозоидов и некоторых бактерий мембранный антиген; TrM – белок мембраны тромбоцитов; ANCA – антинейтрофильные цитоплазматические антитела; KiMS – мембранный антиген клеток клубочков почек; выделены статистически значимые различия.
Note: Se – sensitivity; Sp – specificity; AUC – area under the ROC-curve with 95 % confidence interval (Cl); hCG – human chorionic gonadotropin; β2-GP – β2-glycoprotein; Fc-IgG – fragment crystallisable of immunoglobulin G; Spr – surface antigen of germ cell and prostate; TrM – thrombocyte membrane protein; ANCA – antineutrophil cytoplasmic antibodies; KiMS – membrane antigen of glomerular cells; significant differences are highlighted in bold.
Таблица 4. Диагностическая значимость аутоиммунных антител (АТ) при поздней форме задержки роста плода.
Table 4. Diagnostic significance of autoimmune antibody (AВ) level in late fetal growth retardation.
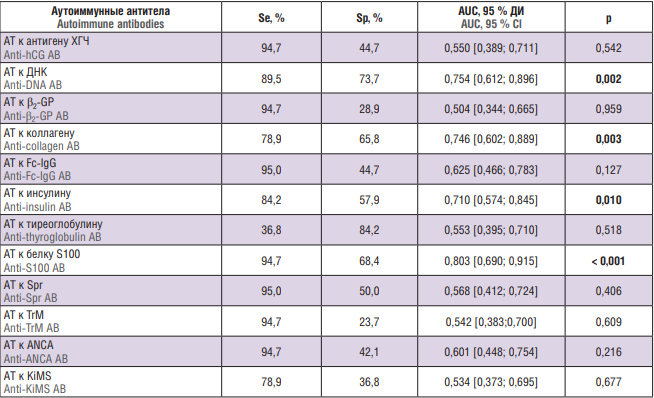
Примечание: Se – чувствительность; Sp – специфичность; AUC – площадь под ROC-кривой c 95 % доверительным интервалом (ДИ); ХГЧ – хорионический гонадотропин человека; β2-GP – β2-гликопротеин; Fc-IgG – константный фрагмент молекул иммуноглобулинов класса IgG; Spr – общий для клеток простаты, сперматозоидов и некоторых бактерий мембранный антиген; TrM – белок мембраны тромбоцитов; ANCA – антинейтрофильные цитоплазматические антитела; KiMS – мембранный антиген клеток клубочков почек; выделены статистически значимые различия.
Note: Se – sensitivity; Sp – specificity; AUC – area under the ROC-curve with 95 % confidence interval (Cl); hCG – human chorionic gonadotropin; β2-GP – β2-glycoprotein; Fc-IgG – fragment crystallisable of immunoglobulin G; Spr – surface antigen of germ cell and prostate; TrM – thrombocyte membrane protein; ANCA – antineutrophil cytoplasmic antibodies; KiMS – membrane antigen of glomerular cells; significant differences are highlighted in bold.
Поскольку были установлены статистически значимые различия между исследованными подгруппами, проведен ROC-анализ с целью прогнозирования раннего и позднего фенотипа ЗРП. На рисунке 1 представлены ROC-кривые для АТ к антигену ХГЧ, коллагену, белку S100, TrM, KiMS и ANCA для ранней формы ЗРП. Площадь ROC-кривых при соответствующей взаимосвязи ранней формы ЗРП у беременных с аномальным содержанием аутоиммунных аутоантител составила: АТ к ХГЧ – 0,664 ± 0,071 (95 % ДИ = 0,525–0,803); АТ к коллагену – 0,756 ± 0,062 (95 % ДИ = 0,635–0,876); АТ к белку S100 – 0,695 ± 0,075 (95 % ДИ = 0,548–0,842); АТ к TrM – 0,724 ± 0,065 (95 % ДИ = 0,596 0,852); АТ к KiMS – 0,798 ± 0,066 (95 % ДИ = 0,670–0,927); AT к АNCA – 0,732 ± 0,072 (95 % ДИ = 0,590–0,873). Полученные модели были статистически значимы (р = 0,037; р = 0,001; р = 0,013; р = 0,005; р < 0,001; р = 0,003).
На рисунке 2 представлены ROC-кривые для АТ к коллагену, белку S100, ДНК инсулину для поздней формы ЗРП. Площадь ROC-кривых при соответствующей взаимосвязи поздней формы ЗРП у беременных с аномальным содержанием аутоиммунных антител составила: АТ к коллагену – 0,746 ± 0,073 (95 % ДИ = 0,602–0,889); к белку S100 – 0,803 ± 0,058 (95 % ДИ = 0,690–0,915); АТ к ДНК – 0,754 ± 0,072 (95 % ДИ = 0,612–0,896); АТ к инсулину – 0,710 ± 0,069 (95 % ДИ = 0,574–0,845). Полученные модели были статистически значимы (р = 0,003; p < 0,001; p = 0,002; p = 0,010).
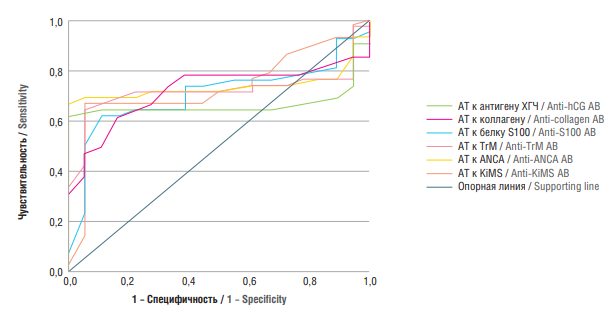
Рисунок 1. ROC-анализ прогнозирования раннего фенотипа задержки роста плода.
Примечание: АТ – антитела; ХГЧ – хорионический гонадотропин человека; TrM – белок мембраны тромбоцитов; ANCA – антинейтрофильные цитоплазматические антитела; KiMS – мембранный антиген клеток клубочков почек.
Figure 1. ROC analysis for predicting early fetal growth retardation phenotype.
Note: АВ – antibodies; hCG – human chorionic gonadotropin; TrM – thrombocyte membrane protein; ANCA – antineutrophil cytoplasmic antibodies; KiMS – membrane antigen of glomerular cells.
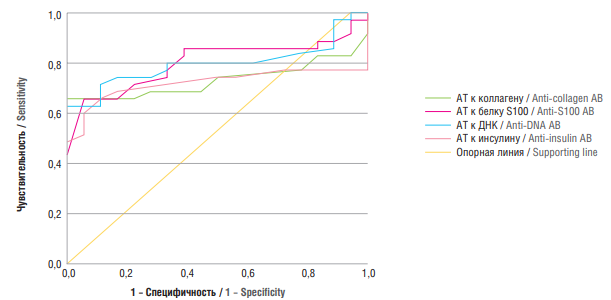
Рисунок 2. ROC-анализ прогнозирования позднего фенотипа задержки роста плода.
Примечание: АТ – антитела.
Figure 2. ROC analysis for predicting late fetal growth retardation phenotype.
Note: АВ – antibodies.
Обсуждение / Discussion
Результаты изучения уровня и аномального содержания аутоиммунных АТ показали статистически значимые различия между исследованными подгруппами, что дает возможность прогнозирования раннего и позднего фенотипа ЗРП на основании определения аутоантител методом ЭЛИ-П-Тест. Для прогнозирования раннего фенотипа ЗРП по результатам ROC-анализа показали статистическую значимость следующие аутоантитела: АТ к антигену ХГЧ, коллагену, белку S100, TrM, ANCA, KiMS, а для прогнозирования позднего фенотипа ЗРП – АТ к ДНК, коллагену, инсулину, белку S100.
Следует отметить, что поданным ROC-анализа повышение уровня аутоиммунных АТ к белку S100 и коллагену было статистистически значимым при ранней и поздней форме ЗРП. Уровень антител к коллагену является показателем активности соединительнотканных нарушений воспалительного генеза.
Белок S100 является надежным маркером поражения нервной системы, обнаруживаемым в спиномозговой жидкости, в моче и в крови взрослых и новорожденных. ЗРП вносит свои коррективы в развитие мозга, влияющие как на серое, так и на белое вещество, однако объем серого вещества предпочтительно уменьшается из-за потери клеток и уменьшения роста нейритов сохранившихся нейронов. Важно отметить, что изменения в развитии мозга при ЗРП связаны с когнитивными и поведенческими нарушениями [16].
При анализе литературы аналогов нашему исследованию найдено не было. Преимуществом нашего исследования является прогнозирование раннего и позднего фенотипа ЗРП.
Из имеющихся на сегодня исследований следует отметить, что в работе, проведенной в 2015 г. В.К. Лазаревой с соавт. [17], показано изменение уровня регуляторных аутоантител, а именно, АТ к инсулину, к суммарным фосфолипидам, ДНК, β2-GP, к ассоциированному с беременностью протеину-А плазмы (англ. pregnancy-associated plasma protein-A, РАРР-А), к коллагену, ХГЧ, ANCA в зависимости от степени ЗРП. По результатам данного исследования вероятность реализации ЗРП составила 79–91 % при сочетании повышения пульсационного индекса и наличия патологических аутоантител к РАРР-А, инсулину, коллагену.
Заключение / Conclusion
Таким образом, определение аутоиммунных антител методом ЭЛИ-П-Тест показало свою информативность у беременных с ЗРП и может выступать в качестве лабораторного предиктора ранней и поздней формы. Учитывая полученные данные, мы могли бы уменьшить материнский стресс, ненужные визиты и госпитализации, скорректировать время введения антенатальных кортикостероидов и родов. Мы также могли бы усилить бдительность в отношении беременностей, действительно подвергающихся повышенному риску. В целом, определение аутоантител может помочь найти индивидуальный подход к ведению беременности с ранней и поздней формой ЗРП, так как современная медицина идет по пути персонализированной помощи.
Список литературы
1. Sacchi C., Marino C., Nosarti C. et al. Association of intrauterine growth restriction and small for gestational age status with childhood cognitive outcomes: A systematic review and meta-analysis. JAMA Pediatr. 2020;174(8):772–81. https://doi.org/10.1001/jamapediatrics.2020.1097.
2. Henrichs J., de Jonge A., Westerneng M. et al. Cost-effectiveness of routine third trimester ultrasound screening for fetal growth restriction compared to care as usual in low-risk pregnancies: a pragmatic nationwide stepped-wedge cluster-randomized trial in the Netherlands (the IRIS Study). Int J Environ Res Public Health. 2022;19(6):3312. https://doi.org/10.3390/ijerph19063312.
3. Pels A., Beune I.M., van Wassenaer-Leemhuis A.G. et al. Early-onset fetal growth restriction: A systematic review on mortality and morbidity. Acta Obstet Gynecol Scand. 2020;99(2):153–66. https://doi.org/10.1111/aogs.13702.
4. Malacova E., Regan A., Nassar N. et al. Risk of stillbirth, preterm delivery, and fetal growth restriction following exposure in a previous birth: systematic review and meta-analysis. BJOG. 2018;125(2):183–92. https://doi.org/10.1111/1471-0528.14906.
5. Gordijn S.J., Beune I.M., Thilaganathan B. et al. Consensus definition of fetal growth restriction: a Delphi procedure. Ultrasound Obstet Gynecol. 2016;48(3):333–9. https://doi.org/10.1002/uog.15884.
6. Клинические рекомендации. Недостаточный рост плода. требующий предоставления медицинской помощи матери (задержка роста плода) – 2022-2023-2024. М.: Министерство здравоохранения Российской Федерации, 2022. 47 с. Режим доступа: http://disuria.ru/_ld/11/1152_kr22O36p5MZ.pdf. [Дата доступа: 10.07.2022].
7. Figueras F., Gratacós E. Update on the diagnosis and classification of fetal growth restriction and proposal of a stage-based management protocol. Fetal Diagn Ther. 2014;36(2):86–98. https://doi.org/10.1159/000357592.
8. Mor G., Cardenas I. The immune system in pregnancy: a unique complexity. Am J Reprod Immunol. 2010;63(6):425–33. https://doi.org/10.1111/j.1600-0897.2010.00836.x.
9. Kim S.M., Kim J.S. A review of mechanisms of implantation. Dev Reprod. 2017;21(4):351–359. https://doi.org/10.12717/DR.2017.21.4.351.
10. Tong M., Abrahams V.M. Immunology of the placenta. Obstet Gynecol Clin North Am. 2020;47(1):49–63. https://doi.org/10.1016/j.ogc.2019.10.006.
11. Полетаев А.Б. Физиологическая иммунология (естественные аутоантитела и проблемы наномедицины). М.: Миклош, 2015. 218 с.
12. Мальсагова А.А., Цахилова С.Г., Сарахова Д.Х. и др. О возможностях использования некоторых аутоантител в диагностике преэклампсии. Акушерство и гинекология. 2017;(4):27–32. https://doi.org/10.18565/aig.2017.4.27-32.
13. Паттарова Г.Р., Хомякова Т.И., Мотовилов Д.Е., Хомякова Ю.Н. Оценка статуса репродуктивной системы женщин на основании определения уровня продукции аутоантител. Научный междисциплинарный журнал «ПАМ-Research». 2021;(5):1–20. Режим доступа: https://pam-research.com/projects/pam-research.com/downloads/issue-05/estimation-of-women-reproductive-system-status.pdf. [Дата доступа: 10.07.2022].
14. Чепанов С.В., Кривонос М.И., Аржанова О.Н. и др. Характеристика аутоантител, ассоциированных с невынашиванием беременности. Акушерство и гинекология. 2019;(3):72–7. https://doi.org/10.18565/aig.2019.3.72-77.
15. Менжинская И.В., Мелкумян А.Г., Павлович С.В. и др. Распространенность и значение аутоантител для неинвазивной диагностики наружного генитального эндометриоза у женщин. Акушерство и гинекология. 2022;(3):59–67. https://doi.org/10.18565/aig.2022.3.59-67.
16. Dudink I., Hüppi P.S., Sizonenko S.V. et al. Altered trajectory of neurodevelopment associated with fetal growth restriction. Exp Neurol. 2022 Jan;347:113885. https://doi.org/10.1016/j.expneurol.2021.113885.
17. Лазарева В.К., Замалеева Р.С., Черепанова Н.А. Клиническое значение определения содержания регуляторных аутоантител у беременных с задержкой развития плода. Казанский медицинский журнал. 2014;95(6):836–40.
Об авторах
И. В. ИгнаткоРоссия
Игнатко Ирина Владимировна – д.м.н., член-корр. Российской академии наук, профессор кафедры акушерства, гинекологии и перинатологии Института клинической медицины
119991 Москва, ул. Трубецкая, д. 8, стр. 2
Д. И. Якубова
Россия
Якубова Диана Ифраимовна – аспирант кафедры акушерства, гинекологии и перинатологии Института клинической медицины
119991 Москва, ул. Трубецкая, д. 8, стр. 2
А. Д. Меграбян
Россия
Меграбян Арен Дереникович – аспирант кафедры акушерства, гинекологии и перинатологии Института клинической медицины
119991 Москва, ул. Трубецкая, д. 8, стр. 2
E. В. Тимохина
Россия
Тимохина Елена Владимировна – д.м.н., профессор кафедры акушерства, гинекологии и перинатологии Института клинической медицины
Scopus Author ID: 15118951800
119991 Москва, ул. Трубецкая, д. 8, стр. 2
Рецензия
Для цитирования:
Игнатко И.В., Якубова Д.И., Меграбян А.Д., Тимохина E.В. Клиническое значение определения уровня аутоантител в диагностике ранней и поздней формы задержки роста плода. Акушерство, Гинекология и Репродукция. 2022;16(4):450-462. https://doi.org/10.17749/2313-7347/ob.gyn.rep.2022.340
For citation:
Ignatko I.V., Yakubova D.I., Megrabyan A.D., Timokhina E.V. Clinical significance of assessing autoantibody level in diagnostics of early and late fetal growth retardation. Obstetrics, Gynecology and Reproduction. 2022;16(4):450-462. (In Russ.) https://doi.org/10.17749/2313-7347/ob.gyn.rep.2022.340

Контент доступен под лицензией Creative Commons Attribution-NonCommercial-ShareAlike 4.0 International License.











































