Перейти к:
Роль коагуляционного гемостаза в реализации ранней преэклампсии у пациенток низкого риска
https://doi.org/10.17749/2313-7347/ob.gyn.rep.2022.324
Аннотация
Цель: определение роли отдельных параметров коагуляционного гемостаза в реализации тяжелой ранней преэклампсии (рПЭ) в группе пациенток низкого риска ее развития.
Материалы и методы. Одноцентровое проспективное исследование включало 40 пациенток с физиологическим течением беременности и родами в срок (контрольная группа) и 41 беременную с реализованной тяжелой рПЭ (основная группа). В сроках гестации 19–21 и 27–28 нед исследовали активность тканевого фактора (англ. tissue factor; TF); ингибитора пути тканевого фактора (англ. tissue factor pathway inhibitor; TFPI) и способность к генерации тромбина в тесте калиброванной тромбографии.
Результаты. У пациенток с реализованной рПЭ зарегистрировано достоверное повышение активности TF относительно контрольной группы в обеих точках исследования: 49;1 пмоль/мл против 5;3 пмоль/мл (р < 0;0001) и 56;7 пмоль/мл против 6;6 пмоль/мл (р < 0;0001); соответственно. Уровень TFPI в сроки 19–21 нед в основной группе отличался значимо низким показателем относительно контрольной группы (1;1 Ед/мл против 1;6 Ед/мл; р < 0;0001) с достоверным его повышением на 82 % к сроку 27–28 нед гестации до 2,1 Ед/мл. В обеих точках исследования выявлено статистически значимое повышение генерации тромбина в группе женщин с реализованной рПЭ.
Заключение. Развитие рПЭ характеризуется повышенной способностью к генерации тромбина. В качестве более чувствительного маркера активации коагуляционного гемостаза определен TF, достоверно значимое повышение активности которого регистрируется в сроке 19–21 нед, что позволяет рассматривать TF в качестве прогностического биомаркера.
Ключевые слова
Для цитирования:
Николаева М.Г., Щеклеина К.В., Момот А.П., Терехина В.Ю., Григорьева Е.В. Роль коагуляционного гемостаза в реализации ранней преэклампсии у пациенток низкого риска. Акушерство, Гинекология и Репродукция. 2022;16(4):391-400. https://doi.org/10.17749/2313-7347/ob.gyn.rep.2022.324
For citation:
Nikolaeva M.G., Shchekleina K.V., Momot A.P., Terekhina V.Yu., Grigorieva E.V. The role of coagulation hemostasis for development of early-onset preeclampsia in low-risk patients. Obstetrics, Gynecology and Reproduction. 2022;16(4):391-400. (In Russ.) https://doi.org/10.17749/2313-7347/ob.gyn.rep.2022.324
Введение / Introduction
Преэклампсия (ПЭ) описывается как комплексное расстройство в системе «мать–плацента–плод», затрагивающее все системы органов как матери, так и плода, возникает после 20 нед беременности, характеризуется артериальной гипертензией в сочетании с протеинурией, а при тяжелом течении – явлениями полисистемной недостаточности. В литературе описано и проанализировано более 20 специфических биомаркеров, дисбаланс которых может рассматриваться как предикция развития ПЭ [1][2]. При этом роль гемостатических реакций в формировании акушерской патологии, в том числе ПЭ, неоспорима и изучается на протяжении многих десятилетий. Результаты исследований свидетельствуют о том, что вклад нарушений в различных звеньях системы гемостаза определяет 5–15 % плацентарных осложнений, при этом ключевая роль в их инициации принадлежит повышенному образованию тромбина [3][4]. Предполагается, что один из механизмов повышения тромбинообразования заключается в избыточном синтезе и высвобождении тканевого фактора (англ. tissue factor, TF) [5][6]. При этом источник повышенной экспрессии TF до настоящего времени не совсем ясен, поскольку он может выделяться тромбоцитами и моноцитами крови в ответ на действие провоспалительных цитокинов, эндотелием сосудов и плацентой [7][8].
Необходимо отметить, что трофобласт характеризуется повышенной экспрессией TF на протяжении всей беременности. Однако в отличие от эндотелия кровеносных сосудов, который экспрессирует TF только при воспалительных и протромботических стимулах, клетки трофобласта конститутивно экспрессируют TF, проявляя, таким образом, даже в условиях физиологической беременности признаки активированного эндотелия. Системное влияние TF реализуется через контакт клеток трофобласта, экспрессирующих TF, с переносимыми материнской кровью факторами VII и X, что активирует их и инициирует образование тромбина [9]. Тромбин, в свою очередь, может реализовывать свое действие как локально, ингибируя пролиферацию и регулируя инвазивность клеток трофобласта, так и системно – вместе с фибриногеном и фактором XIII, финализируя каскад коагуляции.
Другими словами, локальное повышение генерации тромбина определяет образование фибрина и формирование фибриновых отложений [7][10]. Как известно, именно избыточное отложение фибрина в межворсинчатом пространстве является одной из причин недостаточной инвазии ворсин хориона в гравидарный эндометрий, что ведет к нарушению процессов имплантации и впоследствии к неадекватной перфузии, которая при длительном существовании, как правило, реализуется в изменении линейных размеров антенатальной плаценты, визуализируемой при выполнении ультразвукового исследования (УЗИ) [11]. Учитывая вышеизложенное, нам представилось необходимым рассмотреть параметры коагуляционного гемостаза в качестве биомаркеров прогнозирования ранней ПЭ (рПЭ). Как правило, данный вид патологии манифестирует у пациенток группы низкого риска ее развития, имеет тяжелое клиническое течение и неблагоприятный прогноз как для матери, так и для новорожденного [12].
Цель: определение роли отдельных параметров коагуляционного гемостаза в реализации тяжелой рПЭ в группе пациенток низкого риска ее развития.
Материалы и методы / Materials and Methods
Дизайн исследования / Study design
Выполнено одноцентровое проспективное исследование с включением 90 пациенток в сроки гестации 19–21 нед. На этапе формирования когорты исследования основную группу составили 50 беременных низкого риска развития ПЭ по результатам расчетов калькулятора FMF (англ. Fetal Medicine Foundation; Фонд медицины плода) в сроки гестации 11–13 нед, но с показателем индекса плацентарного отношения (англ. placental ratio index, PRi) ≥ 7, рассчитанного в сроки гестации 19–21 нед. PRi – это интегральный показатель, отношение длины (Lp) плаценты к ее толщине (Thp), измеренных в миллиметрах (PRi = Lp/Thp), полученный нами ранее по результатам исследования, направленного на поиск ультразвуковых маркеров развития рПЭ в сроки гестации 19–21 нед в группе беременных низкого риска по результатам расчетов калькулятора FMF при первом скрининге. При значении PRi ≥ 7 развитие рПЭ, как было показано, может прогнозироваться в 91,3 % случаев: чувствительность (англ. sensitivity, Se) = 90 %, специфичность (англ. specificity, Sp) = 87,5 % [13].
Контрольная группа представлена 40 соматически здоровыми женщинами с физиологическим течением беременности, родами в срок новорожденными без признаков гипотрофии.
Критерии включения и исключения / Inclusion and exclusion сriteria
Критерии включения в основную группу: возраст женщины 18–35 лет; первые предстоящие роды; беременность одним плодом; отсутствие соматических заболеваний (артериальная гипертензия, сахарный диабет); индекс массы тела не более 25 до момента вступления в беременность; показатель PRi ≥ 7 в сроки гестации 19–21 нед.
Критерии исключения из основной группы: беременность как результат использования программ вспомогательных репродуктивных технологий; репродуктивные потери в анамнезе после 22 нед беременности; личная история ПЭ; соматические заболевания, такие как артериальная гипертензия, сахарный диабет; генетическая или приобретенная тромбофилия.
Методы исследования / Study methods
Исследование коагуляционного гемостаза / Study of coagulation hemostasis
Все женщины, включенные в исследование, наряду с применением регламентированных методов – активированное частичное тромбопластиновое время (АЧТВ), содержание фибриногена, протромбиновое (тромбопластиновое) время (ПВ), количество тромбоцитов [14], были обследованы в сроки гестации 19–21 и 27–28 нед на уровень отдельных параметров коагуляционного звена гемостаза: TF, ингибитор пути тканевого фактора (англ. tissue factor pathway inhibitor, TFIP), способность к тромбинообразованию в тесте калиброванной тромбографии по показателям: пиковая концентрация тромбина (Рeak thrombin, нмоль/л) – максимальная концентрация тромбина, достигаемая в процессе его генерации в образце), и эндогенный тромбиновый потенциал (еndogenous thrombin potential, ETP, нмоль/мин) – площадь под кривой генерации тромбина.
Для количественного определения активности TF использовали набор реагентов Actichrome® TF (Bio Medica Diagnostics, США), а активности TFPI – Actichrome® TFPI того же производителя. При исследовании генерации тромбина использовали планшетный флуориметр Fluoroskan Ascent (Thermo Fisher Scientific, Финляндия) с программным обеспечением Thrombinoscope 3.0.0.26. Коагуляция исследуемой плазмы крови осуществлялась в присутствии 5,0 пмоль тканевого фактора и 4 мкмоль фосфолипидов (PPP-Reagent 5 pM, Thrombin Calibrator, FluCaKit, Нидерланды) [15].
Из принятых в исследование 50 пациенток основной группы тяжелая рПЭ развилась в 41 наблюдении; две пациентки выбыли из исследования по причине переезда в другой регион; у двух пациенток реализовались спонтанные преждевременные роды в 34 нед; 5 беременных родоразрешены в доношенном сроке гестации: 4 – оперативным путем (1 случай – преждевременная отслойка нормально расположенной плаценты, 3 эпизода – аномалии родовой деятельности), и только в одном наблюдении роды были через естественные родовые пути. По факту родоразрешения заявленные тесты коагуляционного гемостаза выполнены 41 женщине основной группы и 40 пациенткам группы контроля.
Ультразвуковое исследование / Ultrasound examination
УЗИ выполнялось, как минимум, двумя специалистами, имеющими сертификаты FMF, на сканере экспертного класса GE Voluson E10 (GE Healthcare, Австрия) трансабдоминально с использованием конвексного объемного датчика RAB6-D с частотой 2–8 МГц. Квалификация специалистов позволяла проводить расчеты риска акушерских осложнений при помощи акушерско-гинекологического модуля базы данных Astraia (Astraia Software Gmbh, Германия).
Этические аспекты / Ethical aspects
Исследование проведено в соответствии с этическими стандартами Хельсинской декларации Всемирной медицинской ассоциации 1964 г. и ее последующими изменениями. Дизайн и методы исследования обсуждены и одобрены локальным этическим комитетом ФГБОУ ВО АГМУ Минздрава России, протокол № 8 от 25.10.2019. Перед отбором биологического материала (периферическая кровь) каждая участница исследования подписала информированное согласие.
Методы статистического анализа / Statistical analysis
Распределение полученных данных на нормальность с учетом малого объема выборки в группах сравнения определялось с использованием критерия Шапиро–Уилка (Shapiro-Wilk’s W-test). Качественные данные, включая номинальные, представлены абсолютные числами (n), описанные расчётом их доли (%) в анализируемой выборке. Сравнительный анализ качественных данных в двух независимых выборках проводился посредством заполнения таблиц сопряженности и расчета точного теста Фишера. Пороговый значимый уровень различий (p) определен на уровне p < 0,05. Ряд анализируемых данных представлен непрерывными рядами (лабораторные показатели; данные о весе новорожденных, плацент, пациенток; показатели артериального давления и протеинурии), которые в большинстве своем не имели нормального распределения Гаусса, что определило выбор методов непараметрической статистики для анализа; эти данные представлены в виде медианы (Ме), 95 % доверительного интервала (95 % ДИ) для медианы и интерквартильного размаха [Q1–Q3]. Для определения чувствительности и специфичности теста проводили ROCанализ (англ. Receiver Operating Characteristic) с расчетом площади под кривой (англ. Area Under Curve, AUC), отражающей качество диагностического теста. Для статистической обработки данных использовали пакет программного обеспечения MedCalcVersion 17.9.7 (MedCalc Software LTD, Бельгия).
Результаты / Results
Клинико-анамнестическая характеристика обследованных / Clinical and anamnestic characteristics of the patients examined
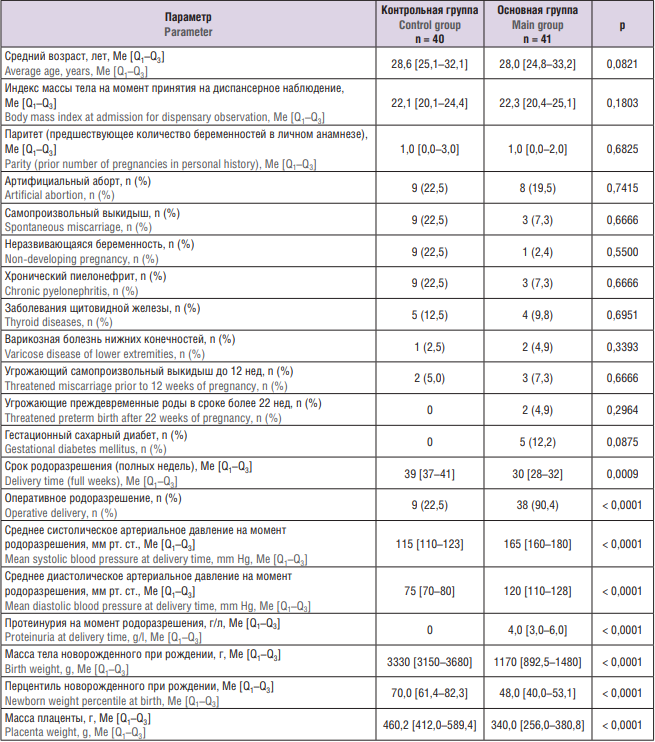
Анализируемые группы были идентичны по возрасту, паритету и соматической патологии (табл. 1). Течение I триместра беременности было благоприятным у женщин обеих групп. Только в основной группе во II триместре беременности зарегистрирован гестационный сахарный диабет в 5 наблюдениях, что не имело достоверной разницы с группой контроля. При этом уровень глюкозы в плазме крови у пациенток корригировался сбалансированной диетой. Среднее давление как систолическое, так и диастолическое у пациенток основной группы было значимо больше, а протеинурия определялась только у пациенток c реализованной ПЭ. Также женщины в группе с ПЭ имели значимо меньший гестационный срок родоразрешения и массу тела новорожденных по сравнению с женщинами с физиологической беременностью.
Таблица 1. Клиническая характеристика обследованных женщин.
Table 1. Clinical characteristics of the women examined.
Результаты исследования коагуляционного гемостаза / The results of examining coagulation hemostasis
Ключевым моментом нашей работы явилось определение отдельных параметров коагуляционного гемостаза при реализации рПЭ в группе низкого риска. При анализе уровня прокоагулянтной активности TF определено, что в группе пациенток с реализованной рПЭ она превышала аналогичный в группе контроля в 9,2 раза (рис. 1А). При анализе уровня ингибитора TF (TFPI) выявлена обратная тенденция: в сроке гестации 19–21 нед активность TFPI в основной группе определена в 1,5 раза ниже, чем в группе контроля, а к сроку 27–28 нед, т. е. за 1–3 недели до реализации ПЭ показатель TFPI по медиане оказался сопоставимым с таковым в группе контроля, при этом его уровень значимо увеличивался (82,0 %) относительно точки 19–21 нед (рис. 1В).
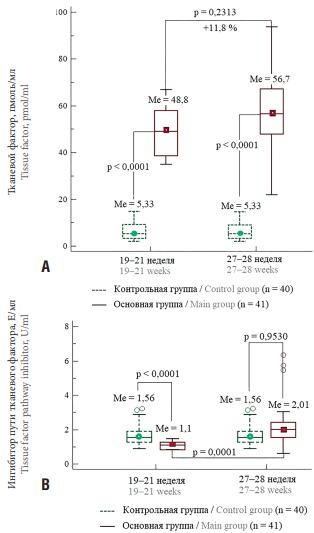
Рисунок 1. Значения медианы тканевого фактора (А) и ингибитора пути тканевого фактора (В) в 19–21 и 27–28 нед при физиологическом течении беременности (контрольная группа) и при реализации ранней преэклампсии (основная группа).
Figure 1. Serum level of tissue factor (A) and tissue factor pathway inhibitor (B) at gestational age of 19–21 and 27–28 weeks during physiological course of pregnancy (control group) and early preeclampsia (main group). The data are presented as medians.
Анализ способности к генерации тромбина в тесте калиброванной тромбографии выявил следующие закономерности. В группе женщин с реализованной рПЭ отмечено достоверное повышение тромбинообразования по показателям «Пик тромбина – Peak thrombin» (рис. 2А) и «Эндогенный тромбиновый потенциал – ETP» (рис. 2В). При этом в сроке беременности 19–21 нед определена достоверная значимая корреляция умеренной силы между показателем коагуляционной активности TF и показателем Peak thrombin (r = 0,58; p = 0,0375).
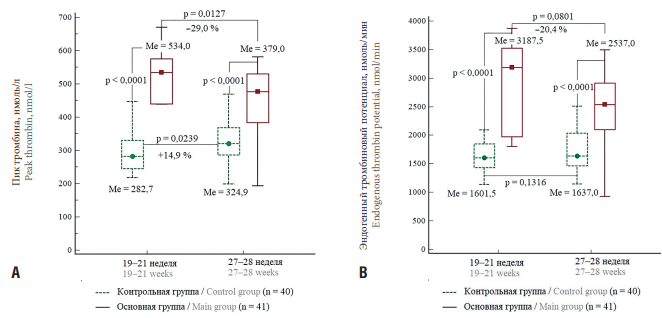
Рисунок 2. Значения медианы показателей пик тромбина (А) и эндогенный тромбиновый потенциал (В) в тесте калиброванной тромбографии в 19–21 и 27–28 нед при физиологическом течении беременности и при реализации ранней преэклампсии.
Figure 2. Peak thrombin (A) and endogenous thrombin potential (B) in calibrated thrombography test at gestational age of 19–21 and 27–28 weeks during physiological course of pregnancy and in developing early preeclampsia. The data are presented as medians.
Критерии для прогнозирования развития ранней преэклампсии / Criteria to predict developing early preeclampsia
Учитывая значимые различия анализируемых параметров в группах сравнения, проведен комбинированный ROC-анализ для выявления наиболее чувствительного критерия для прогнозирования развития рПЭ в сроки гестации 19–21 нед (рис. 3).
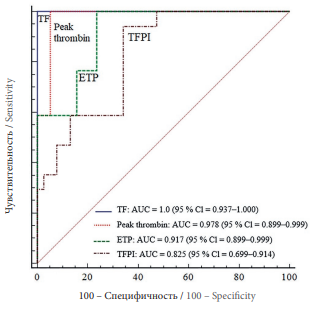
Рисунок 3. Результаты комбинированного ROC-анализа уровня прокоагулянтной активности тканевого фактора (TF), ингибитора пути тканевого фактора (TFPI), показателей пик тромбина (Peak thrombin) и эндогенный тромбиновый потенциал (ETP), определенных в сроки гестации 19–21 нед с целью прогнозирования плацентарной преэклампсии.
Примечание: AUC – площадь под кривой; 95 % Cl – 95 % доверительный интервал.
Figure 3. A combined ROC analysis assessing the level of procoagulant activity for tissue factor (TF), tissue factor pathway inhibitor (TFPI), Рeak thrombin and endogenous thrombin potential (ETP), determined at 19–21 weeks of pregnancy for predicting placental preeclampsia.
Note: AUC – Area Under Curve; 95 % Cl – 95 % confidence interval.
Установлено, что все анализируемые тесты имеют высокую прогностическую значимость, однако при уровне активности TF более 14,74 пмоль/мл риск развития ПЭ в сроки 19–21 нед у пациенток с PRi ≥ 7 прогнозируется в 100 % случаев (95 % ДИ = 0,947–1,000; р < 0,0001), что позволяет рассматривать TF в представленной когорте беременных идеальным прогностическим биомаркером.
Обсуждение / Discussion
Наше предположение о роли TF в патогенетическом каскаде развития ранней (плацентарной) ПЭ основано на представлении биологического действия TF и тромбина на многоступенчатый процесс становления плаценты. Как известно, TF наряду с основной функцией – инициацией каскада свертывания крови участвует также в развитии асептического воспаления, инвазии хориона и ангиогенезе – основных звеньев патогенеза ПЭ [16]. Предметом научных дискуссий в литературе являются 2 направления. Во-первых, роль TF в развитии осложнений, связанных с нарушением становления плаценты, во-вторых, вклад повышенной активности и/или уровня TF в плазме крови в усиление тромбинообразования у пациенток с реализованной ПЭ.
Имеется ряд работ, свидетельствующих о повышенном уровне TF в группе женщин с реализованной ПЭ в сроке гестации 36 и более недель при неизменном уровне его естественного ингибитора TFPI [4][17]. Другие же авторы делают акцент на изменение уровня/активности TFPI в плазме крови у беременных с реализованной ПЭ. При этом чаще исследователи отмечают повышение уровня последнего показателя: при реализации поздней ПЭ после 36 нед [18–20], либо с 24 нед гестации при отсутствии достоверной разницы между уровнем TFPI в группе с ПЭ и без таковой до 20 нед беременности [21]. Тем не менее ряд работ свидетельствуют о снижении показателя TFPI в плазме крови в когорте женщин с осложнениями гестации, включая тяжелую ПЭ [17].
В представленном нами исследовании в группе женщин с реализованной рПЭ отмечено значимое повышение уровня TF как в 19–21 нед, так и в 27–28 нед беременности. Показатели TFPI в 19–21 нед (на стадии клинического благополучия) определены в группе пациенток с ПЭ как значимо более низкие относительно группы контроля с достоверным ростом показателя на 82 % к сроку 27–28 нед, т. е. за 1–3 недели до клинической манифестации. По нашему мнению, динамическое повышение уровня TFPI является вторичным и связано с несколькими моментами: нарастающим повышением уровня TF в плазме крови [21] и дисбалансом в системе протеина С, а именно, со снижением резистентности фактора Va к активированному протеину C и снижением уровня протеина S – специфичные изменения для пациенток с ПЭ [22][23].
Способность к повышенному тромбинообразованию при развитии ПЭ в доступных для анализа работах оценивали посредством проведения теста калиброванной тромбографии. По данному вопросу выводы исследователей единодушны: у пациенток с реализованной ПЭ в сроки гестации 36 нед и более отмечаются значимо более высокие значения показателей Peak thrombin и ETP [24][25], что согласуется с результатами представленного исследования. Кроме того, нами проведена оценка линейных связей между показателями Peak thrombin и TF, результаты которой свидетельствует о наличии прямой положительной корреляционной связи умеренной силы, что подтверждает участие TF в инициации тромбинообразования и совпадает с мнением других исследователей [4].
Отличительной особенностью представленной работы является динамическое исследование показателей, описывающих состояние коагуляционного гемостаза у пациенток, определенных в группу низкого риска развития рПЭ по результатам расчётов калькулятора FMF в I триместре. Как известно, именно группа низкого риска является наиболее уязвимой в реализации ранней, так называемой плацентарной ПЭ. Для проведения исследования коагуляционного гемостаза выделена когорта беременных с неудовлетворительными результатами плацентометрии в сроки гестации 19–21 нед, что является следствием неадекватной инвазии и/или перфузии плаценты, и вне зависимости от причин, первично вызвавших данное нарушение, в конечном счете реализуется избыточным тромбинообразованием на локальном уровне и отложением фибрина в межворсинчатом пространстве [26]. Необходимо отметить также, что в клинической практике отклонение от референтных значений линейных измерений плаценты по данным УЗИ является предметом научных дискуссий, но не является предпосылкой для пересмотра риска развития осложнений гестации.
Полученные в представленной работе результаты в части прогностической способности уровня прокоагулянтной активности TF в сроки гестации 19–21 нед позволяют рассмотреть возможность дополнения стратегии скрининга у пациенток с неудовлетворительными результатами плацентометрии, а именно, с показателем PRi ≥ 7. Также достаточно интересным выглядит возможность коррекции повышенного образования тромбина низкомолекулярным гепарином на доклинических стадиях развития рПЭ.
Заключение / Conclusion
Результаты представленного исследования расширяют представления о роли отдельных параметров коагуляционного гемостаза в реализации рПЭ. Определено значимое повышение способности к тромбинообразованию по результатам калиброванной тромбографии в сроке 19–21 нед по показателю Peak thrombin в 1,9 раза и показателю ETP в 2 раза. Наличие положительной корреляционной связи умеренной силы между показателями Peak thrombin и TF подтверждает участие TF в инициации тромбинообразования и позволяет рассматривать его в качестве прогностического биомаркера развития рПЭ. Кроме того, перспективным выглядит представление повышенной генерации тромбина в качестве биологической мишени для таргетного терапевтического воздействия низкомолекулярным гепарином, что требует проведения дальнейших исследований.
Список литературы
1. Liu N.; Guo Y.-N.; Gong L.-K.; Wang B.-S. Advances in biomarker development and potential application for preeclampsia based on pathogenesis. Eur J Obstet Gynecol Reprod Biol X. 2020;9:100119. https://doi.org/10.1016/j.eurox.2020.100119.
2. Poon L.C.; Shennan A.; Hyett J.A. et al. The International Federation of Gynecology and Obstetrics (FIGO) initiative on pre-eclampsia: A pragmatic guide for first-trimester screening and prevention. Int J Gynaecol Obstet. 2019;145 Suppl 1(Suppl 1):1–33. https://doi.org/10.1002/ijgo.12802.
3. Грибкова И.В., Королева Н.С., Давыдовская М.В., Мурашко А.В. Повышенное образование тромбина – потенциальный маркер неблагоприятных исходов беременности. Акушерство и гинекология. 2018;(8):92–7. https://doi.org/10.18565/aig.2018.8.92-97.
4. Erez O.; Romero R.; Vaisbuch E. et al. The pattern and magnitude of "in vivo thrombin generation" differ in women with preeclampsia and in those with SGA fetuses without preeclampsia. J Matern Fetal Neonatal Med. 2018;31(13):1671–80. https://doi.org/10.1080/14767058.2017.1323327.
5. Rietveld I.M.; Schreuder M.; Reitsma P.H.; Bos M.H.A. Elevated coagulation factor levels affect the tissue factor-threshold in thrombin generation. Thromb Res. 2018;172:104–9. https://doi.org/10.1016/j.thromres.2018.10.020.
6. Chu A.J. Tissue factor; blood coagulation; and beyond: an overview. Int J Inflam. 2011;2011:367284. https://doi.org/10.4061/2011/367284.
7. Mackman N. Role of tissue factor in haemostasis; thrombosis; and vascular development. Arterioscler Thromb Vasc Biol. 2004;24(6):1015–22. https://doi.org/10.1161/01.ATV.0000130465.23430.74.
8. Rice N.T.; Szlam F.; Varner J.D. et al. Differential contributions of intrinsic and extrinsic pathways to thrombin generation in adult; maternal and cord plasma samples. PLoS One. 2016;11(5):e0154127. https://doi.org/10.1371/journal.pone.0154127.
9. Milovanov A.P.; Kuznetsova N.B.; Fokina T.V. Role of immune distribution of tissue factor in the development of hemostasis during the first trimester of normal pregnancy. Bull Exp Biol Med. 2019;166(4):503–6. https://doi.org/10.1007/s10517-019-04382-7.
10. Guettler J.; Forstner D; Gauster M. Maternal platelets at the first trimester maternal-placental interface – Small players with great impact on placenta development. Placenta. 2022;125:61–7. https://doi.org/10.1016/j.placenta.2021.12.009.
11. Hasija A.; Balyan K.; Debnath E. et al. Prediction of hypertension in pregnancy in high risk women using maternal factors and serial placental profile in second and third trimester. Placenta. 2021;104:236–42. https://doi.org/10.1016/j.placenta.2021.01.005.
12. Magee L.A.; Pels A.; Helewa М. et al.; Canadian Hypertensive Disorders of Pregnancy Working Group. Diagnosis; evaluation; and management of the hypertensive disorders of pregnancy: executive summary. J Obstet Gynaecol Can. 2014;36(5):416–41. https://doi.org/10.1016/s1701-2163(15)30588-0.
13. Щеклеина К.В.; Николаева М.Г. Плацентометрия в прогнозировании ранней преэклампсии. Доктор.Ру. 2022;21(1):13–7. https://doi.org/10.31550/1727-2378-2022-21-1-13-17.
14. Клинические рекомендации. Нормальная беременность. М.: Министерство здравоохранения Российской Федерации; 2020. 80 с. Режим доступа: https://minzdrav.samregion.ru/wp-content/uploads/sites/28/2020/12/normalnaya-beremennost.pdf. [Дата доступа: 10.05.2022].
15. Lancé M.D. A general review of major global coagulation assays: thrombelastography; thrombin generation test and clot waveform analysis. Thromb J. 2015;13:1. https://doi.org/10.1186/1477-9560-13-1.
16. Erez O.; Romero R.; Hoppensteadt D. et al. Tissue factor and its natural inhibitor in pre-eclampsia and SGA. J Matern Fetal Neonatal Med. 2008;21(12):855–69. https://doi.org/10.1080/14767050802361872.
17. Teng Y.; Jiang R.; Lin Q. et al. The relationship between plasma and placental tissue factor; and tissue factor pathway inhibitors in severe pre-eclampsia patients. Thromb Res. 2010;126(1):41–5. https://doi.org/10.1016/j.thromres.2010.02.012.
18. Dusse L.M.; Godoi L.C.; Gomes K.B. et al. Tissue factor-dependent pathway in severe preeclampsia revisited: a Brazilian cohort study. Blood Coagul Fibrinolysis. 2016;27(4):436–40. https://doi.org/10.1097/MBC.0000000000000507.
19. Egan K.; O'Connor H.; Kevane B. et al. Elevated plasma TFPI activity causes attenuated TF-dependent thrombin generation in early onset preeclampsia. Thromb Haemost. 2017;117(8):1549–57. https://doi.org/10.1160/TH16-12-0949.
20. MacDonald T.M.; Tong S.; Myers J. et al. Circulating Tissue Factor Pathway Inhibitor (TFPI) is increased preceding preeclampsia diagnosis and in established preeclampsia. Placenta. 2021;105:32–40. https://doi.org/10.1016/j.placenta.2021.01.018.
21. Di Bartolomeo A.; Chauleur C.; Gris J.C. et al. Tissue factor pathway inhibitor for prediction of placenta-mediated adverse pregnancy outcomes in high-risk women: AngioPred study. PLoS One. 2017;12(3):e0173596. https://doi.org/10.1371/journal.pone.0173596.
22. Tchaikovski S.N.; Thomassen M.C.; Costa S.D. et al. Role of protein S and tissue factor pathway inhibitor in the development of activated protein C resistance early in pregnancy in women with a history of preeclampsia. Thromb Haemost. 2011;106(5):914–21. https://doi.org/10.1160/TH11-04-0244.
23. Peraramelli S.; Rosing J.; Hackeng T.M. TFPI-dependent activities of protein S. Thromb Res. 2012;129 Suppl 2:S23–6. https://doi.org/10.1016/j.thromres.2012.02.024.
24. Van Dreden P.; Lefkou E.; Aurélie Rousseau; Grigorios T. Gerotziafas profile of thrombin generation assay and thromboelastometry in women with moderate and severe preeclampsia. The Roadmap-Preeclampsia Study. Blood. 2020;136(Suppl 1):37–8. https://doi.org/10.1182/blood-2020-137384.
25. Lalic-Cosic S.; Dopsaj V.; Kovac M. et al. Evaluation of global haemostatic assays and fibrin structure in patients with pre-eclampsia. Int J Lab Hematol. 2020;42(3):322–30. https://doi.org/10.1111/ijlh.13183.
26. Mayrink J.; Costa M.L.; Cecatti J.G. Preeclampsia in 2018: revisiting concepts; physiopathology; and prediction. Scientific World Journal. 2018;2018:6268276. https://doi.org/10.1155/2018/6268276.
Об авторах
М. Г. НиколаеваРоссия
Николаева Мария Геннадьевна – д.м.н., профессор кафедры акушерства и гинекологии с курсом ДПО; старший научный сотрудник
Scopus Author ID: 57191960907.
Россия, 656038 Барнаул, пр. Ленина, д. 40
Россия, 656045 Барнаул, ул. Ляпидевского, д. 1
К. В. Щеклеина
Россия
Щеклеина Ксения Владимировна – младший научный сотрудник лаборатории гемостаза; врач акушер-гинеколог, врач ультразвуковой диагностики центра антенатальной охраны плода.
Россия, 656038 Барнаул, пр. Ленина, д. 40
Россия, 656019 Барнаул, ул. Гущина, д. 179
А. П. Момот
Россия
Момот Андрей Павлович – д.м.н., профессор, руководитель лаборатории гемостаза; директор
Россия, 656038 Барнаул, пр. Ленина, д. 40
Россия, 656045 Барнаул, ул. Ляпидевского, д. 1
В. Ю. Терехина
Россия
Терехина Василиса Юрьевна – ассистент кафедры акушерства и гинекологии с курсом ДПО; акушер-гинеколог кабинета диспансерного наблюдения беременных группы высокого риска.
Россия, 656038 Барнаул, пр. Ленина, д. 40
Россия, 656019 Барнаул, ул. Гущина, д. 179
Е. В. Григорьева
Россия
Григорьева Елена Владимировна – к.м.н., старший научный сотрудник лаборатории гемостаза института клинической медицины; младший научный сотрудник лаборатории гемостаза
Россия, 656038 Барнаул, пр. Ленина, д. 40
Россия, 656045 Барнаул, ул. Ляпидевского, д. 1
Рецензия
Для цитирования:
Николаева М.Г., Щеклеина К.В., Момот А.П., Терехина В.Ю., Григорьева Е.В. Роль коагуляционного гемостаза в реализации ранней преэклампсии у пациенток низкого риска. Акушерство, Гинекология и Репродукция. 2022;16(4):391-400. https://doi.org/10.17749/2313-7347/ob.gyn.rep.2022.324
For citation:
Nikolaeva M.G., Shchekleina K.V., Momot A.P., Terekhina V.Yu., Grigorieva E.V. The role of coagulation hemostasis for development of early-onset preeclampsia in low-risk patients. Obstetrics, Gynecology and Reproduction. 2022;16(4):391-400. (In Russ.) https://doi.org/10.17749/2313-7347/ob.gyn.rep.2022.324

Контент доступен под лицензией Creative Commons Attribution-NonCommercial-ShareAlike 4.0 International License.











































