Перейти к:
Система комплемента у беременных с тяжелой преэклампсией
https://doi.org/10.17749/2313-7347/ob.gyn.rep.2025.626
Аннотация
В статье рассматриваются существующие теории патогенеза преэклампсии (ПЭ), роль системы комплемента в развитии ПЭ, а также влияние нарушений системы комплемента на исход беременности и тяжесть течения заболевания. Проведенные исследования в области ПЭ действительно зародили множество новых научных вопросов и гипотез. Один из ключевых вопросов заключается в том, является ли активация системы комплемента первопричиной развития ПЭ, или же она представляет собой следствие одного или нескольких патологических процессов, связанных с этим синдромом.
Ключевые слова
Для цитирования:
Антонова А.С., Хизроева Д.Х., Калашникова И.С., Третьякова М.В., Попёнова Ю.А., Кунешко Н.Ф., Фаткуллина Л.С. Система комплемента у беременных с тяжелой преэклампсией. Акушерство, Гинекология и Репродукция. 2025;19(3):443-452. https://doi.org/10.17749/2313-7347/ob.gyn.rep.2025.626
For citation:
Antonova A.S., Khizroeva J.Kh., Kalashnikova I.S., Tretyakova M.V., Popyonova Yu.A., Kuneshko N.F., Fatkullina L.S. The complement system in pregnant women with severe preeclampsia. Obstetrics, Gynecology and Reproduction. 2025;19(3):443-452. (In Russ.) https://doi.org/10.17749/2313-7347/ob.gyn.rep.2025.626
Введение / Introduction
На сегодняшний день существует несколько десятков теорий этиологии и патогенеза преэклампсии (ПЭ), однако ни одна из них не способна в полной мере описать процессы, происходящие в организме беременной при данной патологии. На доклинической стадии развитие ПЭ связано с нарушениями в области иммунологии, молекулярной генетики и эпигенетики, которые ведут к изменениям как в структуре, так и в функционировании клеток [1].
В последние десятилетия в понимании патогенеза ПЭ произошли значительные изменения, что связано с углублением знаний о разнообразной природе данного синдрома. У женщин, страдающих ПЭ, можно наблюдать широкий спектр клинических и лабораторных изменений, которые варьируются по степени выраженности (от умеренной до тяжелой формы) и по времени возникновения заболевания (ранняя и поздняя). ПЭ может развиваться как до 34 недель беременности (ранняя), так и после этого срока (поздняя), а также может проявляться в процессе родов или в послеродовой период. Следует подчеркнуть, что современные классификации ПЭ имеют ограничения в своей способности к стратификации женщин по риску неблагоприятных исходов для здоровья матери. Эти классификации зачастую не учитывают полное разнообразие клинических проявлений и патогенетических механизмов, что затрудняет их применение для точной оценки индивидуальных рисков и разработки четких стратегий ведения таких пациенток.
В клинических рекомендациях, разработанных профессиональными сообществами акушеров-гинекологов из разных стран, действительно уделяется внимание не только клинико-биологическим, но также анамнестическим факторам, связанным с риском возникновения гипертензивных расстройств у беременных. Эти рекомендации опираются на принципы доказательной медицины и охватывают широкий спектр факторов. К ним относятся возраст пациенток, наличие гипертензивных расстройств в семейном анамнезе, хронические и сопутствующие заболевания, такие как нарушение жирового обмена, сахарный диабет, почечная патология [2][3].
Вместе с тем на практике в некоторых случаях тяжелая ПЭ и сопутствующие ей опасные акушерские состояния могут развиваться у женщин, у которых нет очевидных факторов риска. Это подчеркивает сложность и многообразие клинического течения заболевания, а также необходимость тщательного наблюдения за всеми пациентками, независимо от их анамнестических данных. У многих пациенток может не быть традиционных предрасполагающих факторов, и большинство случаев ПЭ развивается без каких-либо заметных упреждающих симптомов.
Эта ситуация предполагает, что не все факторы риска могут быть учтены или идентифицированы заранее. Учитывая сложность механизмов, приводящих к развитию ПЭ, открытым остается вопрос о генетических, молекулярных и других еще недостаточно изученных факторах, которые могут влиять на возникновение этого состояния.
Таким образом, необходимо проявлять повышенное внимание не только к традиционным факторам риска, но и к индивидуальным особенностям каждой беременной, включая изменения в ее состоянии на разных сроках беременности. Это позволит обеспечить своевременное диагностирование и оказание помощи, что может снизить риск возникновения тяжелых акушерских осложнений.
Тяжелая преэклампсия: патогенез и клиническая картина / Severe preeclampsia: pathogenesis and clinical picture
Диагноз «тяжелая преэклампсия» устанавливается по критериям, изложенным в клинических рекомендациях Минздрава России. К основным симптомам относятся высокое артериальное давление (систолическое выше 160 мм рт. ст. и диастолическое выше 110 мм рт. ст.) и протеинурия (более 5 г белка в моче за 24 часа или 3 г в двух пробах). Также учитываются признаки полиорганной недостаточности, такие как HELLP-синдром, головные боли, тошнота, рвота, олигурия и повышение уровня креатинина, печеночных ферментов, а также тромбоцитопения, диспептические расстройства; со стороны плода – задержка роста и антенатальная гибель [3].
Среди причин этого состояния – иммунологические, плацентарные, нейрогенные, гормональные, генетические и др. Тем не менее объективно зарегистрированные отклонения свидетельствуют о комплексности патогенеза и полиэтиологичности этого акушерского осложнения [4].
На рисунке 1 представлена двухступенчатая модель развития ПЭ по C.W Redman, подчеркивающая, что это сложное состояние возникает из взаимодействия ранних нарушений и последующих патологических реакций организма [5].
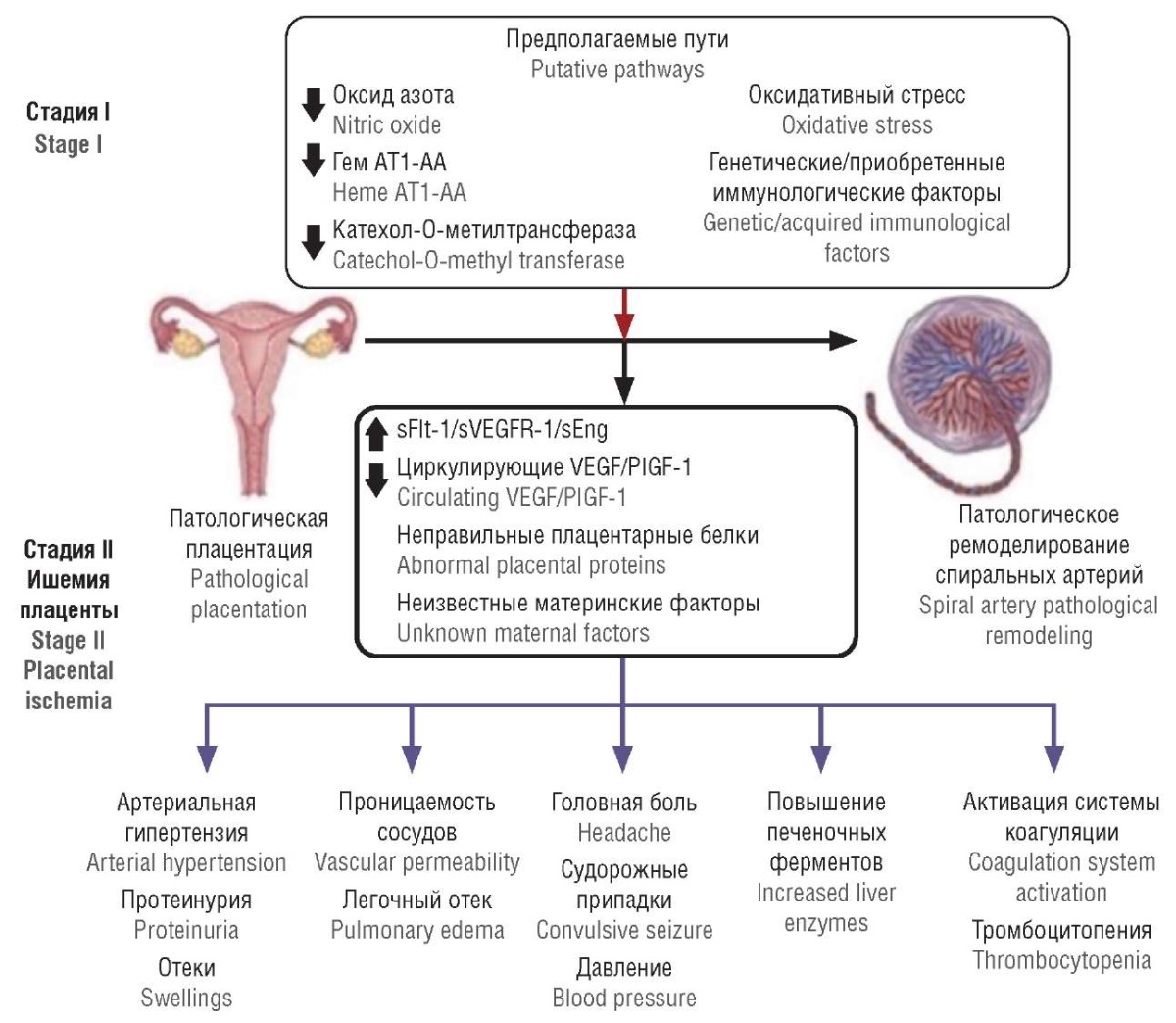
Рисунок 1. Двухступенчатая модель развития преэклампсии [5].
Примечание: АТ1-АА – аутоантитело-агонист рецептора ангиотензина II типа 1; sFlt-1 – растворимая fms-подобная тирозинкиназа-1; sVEGFR-1 – рецептор 1 васкулоэндотелиального фактора роста; sEng – растворимый эндоглин; VEGF – фактор роста эндотелия сосудов; PIGF-1 – плацентарный фактор роста; АГ – артериальная гипертензия.
Figure 1. Тwo-stage model of preeclampsia development [5].
Note: AT1-AA – agonistic autoantibodies against angiotensin II type 1 receptor; sFlt-1 – soluble fms-like tyrosine kinase-1; sVEGFR-1 – soluble vascular endothelial growth factor receptor-1; sEng – soluble endoglin; VEGF – vascular endothelial growth factor; PIGF-1 – рlacental growth factor; AH – arterial hypertension.
Отсутствие трансформации миометральной части спиральных артерий приводит к плацентарной ишемии (стадия I). Это вызывает высвобождение антиангиогенных факторов из ишемической плаценты в материнский кровоток, что способствует повреждению эндотелия и развитию эндотелиальной дисфункции, соответствующей стадии II [6].
Нарушение процессов инвазии трофобласта приводит к ишемическим и гипоксическим повреждениям клеток и тканей плаценты. Это вызывает нарушение плацентарного барьера и увеличение количества аномальных клеток и фетальных микрочастиц в системном кровотоке матери. В результате активации материнской иммунной системы происходит повышенный синтез провоспалительных цитокинов. Эта иммунная реакция способствует развитию генерализованной эндотелиальной дисфункции, что в тяжелых случаях может привести к полиорганной недостаточности [7].
I.L. Sargent с соавт. рассматривают ПЭ как заболевание, состоящее из 2 ключевых этапов [8]. На первом этапе наблюдается снижение экспрессии молекулы HLA-G (англ. histocompatibility antigen, class I, G; лейкоцитарный антиген), что приводит к уменьшению числа децидуальных NK-клеток (англ. natural killer cells; естественные киллеры). Эти клетки играют важную роль в выработке иммунорегуляторных цитокинов и ангиогенных факторов, необходимых для успешного внедрения трофобласта в стенку матки. Нарушение их функционирования может негативно сказаться на процессе имплантации и развитии плаценты.
На втором этапе заболевания наблюдается развитие системной воспалительной реакции, в которую вовлечены лейкоциты и эндотелиальные клетки. На этом этапе плацента становится не только органом, обеспечивающим метаболический обмен с плодом, но и источником провоспалительных медиаторов. Кроме того, высвобождение продуктов клеточного апоптоза в материнский кровоток приводит к изменениям в иммунных реакциях и усугубляет воспалительные процессы, что проявляется в ухудшении клинической картины болезни [8].
Большинство исследователей считают, что основным пусковым фактором, инициирующим развитие ПЭ, является недостаточная инвазия трофобласта. Этот процесс может быть обусловлен снижением экспрессии молекулы HLA-G, которая играет критическую роль в регуляции иммунного ответа в области плаценты [8]. Недостаточный уровень HLA-G способствует активности натуральных киллеров (NK-клеток), что приводит к агрессивному иммунному ответу со стороны этих клеток. Увеличенная активность NK-клеток в условиях недостаточной инвазии трофобласта может вызывать локальное воспаление и повреждение сосудистых структур. Эта недостаточность инвазии приводит к значительному снижению плацентарной перфузии [9].
Возникающая на границе мать/плод гипоксия действительно имеет серьезные последствия для как матери, так и плода. Этот процесс инициирует дисбаланс фактора роста эндотелия сосудов (англ. vascular endothelial growth factor, VEGF) и других подобных молекул, которые играют ключевую роль в ангиогенезе и поддержании нормального функционирования сосудистого русла [5]. При гипоксии, которая возникает из-за недостаточной плацентарной перфузии, изменяется содержание этих факторов роста. Это, в свою очередь, ухудшает кровоснабжение не только плаценты, но и тканей матери и плода, что может инициировать возникновение «порочного круга», приводящего к еще большей гипоксии и развитию различных патологических состояний [5].
Эндотелиальная дисфункция сопровождается увеличением проницаемости сосудов (дезинтеграция сосудистой стенки), что может приводить к отекам и другим клиническим проявлениям. Кроме того, это состояние связано с повышением риска развития тромбообразования и сердечно-сосудистых заболеваний как у матери, так и у ребенка [10].
Система комплемента как ключевой элемент иммунной системы / The complement system as a key arm in immune system
При ПЭ возникают патологические реакции, характеризующиеся как «иммунологическое воспаление». Система комплемента (СК) является важным маркером воспалительных процессов и иммунной активности, а также играет ключевую роль в защитных механизмах организма и его неспецифической резистентности. Так, проведенное A.M. Lynch с соавт. проспективное исследование, включавшее 1013 беременных пациенток, продемонстрировало, что активация СК приводит к значительному усилению неспецифической воспалительной реакции в период беременности. Увеличение активности компонентов СК способствует не только усугублению воспалительных процессов, но также может негативно влиять на плацентарную функцию. Это, в свою очередь, может усиливать клинические проявления ПЭ и ухудшать состояние как матери, так и плода [11].
Система комплемента является важной частью врожденного иммунного ответа, и ее развитие в филогенезе предшествует формированию иммунной системы как таковой. Это имеет свои корни в эволюционных процессах, которые привели к возникновению сложных иммунных систем у более высокоорганизованных существ. С самого раннего периода онтогенеза, а именно, с шестинедельного возраста эмбриона уже наблюдается способность к синтезу отдельных компонентов этой системы. С увеличением срока беременности уже с десятой недели можно выявить гемолитическую активность синтезированных факторов, что указывает на функциональное развитие СК [12].
Несмотря на то что некоторые компоненты системы начинают синтезироваться на ранних стадиях, нормальные концентрации всех ее элементов достигаются только к первому году жизни. Это подчеркивает корреляцию динамики развития как самого организма, так и его защитных механизмов. Общая доля сывороточных белков, приходящихся на систему комплемента, составляет около 10 %. Это неощутимое на первый взгляд количество показывает значимость СК в защите организма [12].
Функциональные дефекты СК могут иметь серьезные последствия. Отсутствие или недостаточная активность компонентов может приводить к рецидивирующим инфекциям, так как соединения комплемента важны для активации и усиления иммунных реакций. Могут возникать патологические состояния, связанные с образованием иммунных комплексов, приводя сначала к различным дисфункциям, а затем и заболеваниям [12].
Существует прямая связь между СК и фагоцитарной системой, что очень важно для понимания иммунного ответа. Связывание компонентов СК с бактериями как напрямую, так и опосредованно через антитела способствует процессу опсонизации, что значительно усиливает фагоцитоз. Это позволяет фагоцитам, таким как макрофаги и нейтрофилы, более эффективно поглощать и уничтожать патогенные микроорганизмы [13].
Система комплемента представляет собой ключевой элемент иммунной системы, играющий решающую роль в патогенезе воспалительных реакций, а также в гуморальном иммунном ответе. Она включает более 30 различных белков, находящихся в плазме крови в неактивированной форме [12].
Система комплемента активируется двумя основными способами: классическим и альтернативным. Классический путь начинается с комплекса антиген-антитело, который запускает активацию компонентов СК, тогда как альтернативный путь активируется напрямую на чужеродных клетках без участия антител. В 1990-х годах был открыт лектиновый путь, также независимый от антител. Альтернативный и лектиновый пути связаны с врожденным иммунитетом, тогда как классический путь относится к приобретенному иммунитету [14, 15].
Фрагмент C4, известный как C4b, взаимодействует с фрагментом C2, что приводит к образованию комплекса C4b2a. Этот комплекс функционирует в качестве C3-конвертазы, способной связываться и катализировать расщепление молекул C3. В результате данного расщепления образуются 2 фрагмента: C3a, который выводится из системы, и C3b, обладающий способностью взаимодействовать с фактором B. Это взаимодействие инициирует формирование дополнительных C3-конвертаз через альтернативный путь активации СК. Таким образом, в результате каскадных реакций образуется C5-конвертаза, что способствует активации последующих этапов каскада комплемента, играющего важную роль в иммунном ответе организма [15].
C5-конвертазы, возникающие в результате активации СК, катализируют расщепление белка C5 на 2 фрагмента: C5a и C5b. C5a выполняет роль мощного хемотаксического агента, способствующего привлечению иммунных клеток к очагу инфекции и усилению воспалительной реакции. В то же время C5b взаимодействует с компонентами C6 и C7, формируя комплекс C5b,6,7. Данный комплекс, благодаря гидрофобным свойствам C7, интегрируется в липидный слой клеточной мембраны патогена, создавая высокоаффинный комплекс, который затем связывается с белком C8. Этот белок, представляющий собой трехмерное соединение, укрепляет ассоциацию с комплексом C5b,6,7, что в последующем приводит к активации C9. Полимеризация C9 инициирует формирование пор в мембране патогена, что способствует его лизису и уничтожению. На рисунке 2 изображена схема формирования C5-конвертазы и мембраноатакующего комплекса (англ. membrane attack complex, МАС) [15].
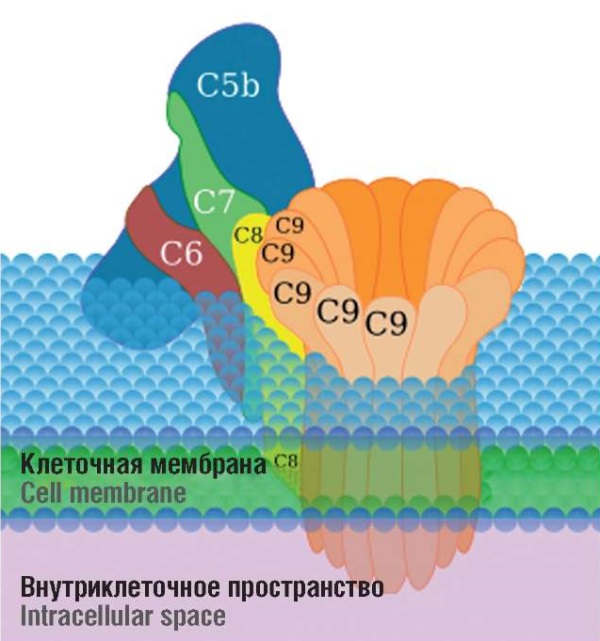
Рисунок 2. Строение мембраноатакующего комплекса [15].
Figure 2. Structure of the membrane attack complex [15].
Последствия действия МАС заключаются не только в прямом повреждении патогенных микроорганизмов, но и в повреждении собственных клеток организма. Это приводит к активации процессов опсонизации и фагоцитоза, а также стимулирует работу клеток иммунной системы, часто вызывая выраженные воспалительные реакции [16].
Система комплемента и беременность / Complement system and pregnancy
Исследования показывают, что в условиях физиологической беременности происходит умеренная активация СК, что, вероятно, предназначено для защиты фетоплацентарной системы от патогенных микроорганизмов и обеспечения успешного процесса плацентации [17].
В ходе нормальной беременности наблюдается повышение сывороточных уровней C3a и C4 на 10–50 %. Кроме того, в плазме беременных отмечают значительно более высокие концентрации C3a, C4a и C5a по сравнению с небеременными. Эти результаты указывают на активацию СК, что играет важную роль в адаптационных процессах, необходимых для поддержания здоровья матери и плода, обеспечивая защитные механизмы и иммунный ответ в период беременности [5][18].
Исследования, касающиеся роли СК и, в частности, белка C1q в контексте ПЭ, открывают новые горизонты в понимании патогенеза данного состояния. Экспериментальные данные, свидетельствующие о том, что ингибирование активации СК уменьшает тяжесть ПЭ, делают акцент на важности данного механизма как потенциальной мишени для терапевтического вмешательства. Поскольку C1q играет ключевую роль в классическом пути активации СК, его участие в защитной функции материнского организма становится все более очевидным [19][20].
При анализе активации СК в контексте ПЭ возникает сложная картина. Наличие компонента C5b-9 на трофобластах у женщин с ПЭ, как указывают исследователи, связано с отложением фибрина в травмированных областях ворсинок; однако остается открытым вопрос о том, действительно ли активация СК является первопричиной или всего лишь последствием плацентарного повреждения. Таким образом, для дальнейших исследований необходимо выяснить, возможно ли, основываясь на диагностике активации СК, спрогнозировать состояние плода? Это может иметь важное значение для клинической практики [21].
Альтернативный путь активации СК, как показали исследования, также принимает участие в патогенезе ПЭ [12]. Увеличение содержания компонента С3а в материнском циркуляторном системном кровотоке должно рассматриваться как ранний маркер активации СК, обнаруженный на практике у женщин с этим состоянием. Эта информация наводит на мысль о том, что наличие избытка жировой ткани может способствовать активации СК.
Дефицит компонентов СК, таких как C1q, C1r, C1s, C4 или C2, и их влияние на клиренс циркулирующих иммунных комплексов (ЦИК) продемонстрировали, что в случае недостатка этих компонентов, ЦИК может преципитировать, вызывая весь спектр нарушений, ассоциируемых с реакциями гиперчувствительности. Это приводит к активации классического пути комплемента, генерируя анафилотоксин, что в свою очередь инициирует воспалительный процесс с привлечением макрофагов и другого клеточного ответа, нарушая нормальное функционирование сосудистой системы. Все эти изменения могут быть критически важными в понимании взаимосвязи активации СК с прогрессированием ПЭ и могут служить основой для разработки новых подходов к диагностике и лечению данного состояния [22].
Функциональное состояние печени играет жизненно важную роль в процессе элиминации ЦИК, что становится особенно актуальным в контексте патологии, такой как ПЭ. Элиминация иммунных комплексов осуществляется через несколько ключевых этапов. Основной механизм заключается в том, что иммунные комплексы прикрепляются к мембранам эритроцитов, которые несут на своей поверхности специфические рецепторы. Благодаря этому взаимодействию иммунные комплексы транспортируются с кровотоком в печень, где они подвергаются дальнейшей переработке [23].
В печени звездчатые ретикулоэндотелиоциты, которые являются специализированными клетками, играющими ключевую роль в фагоцитозе, поглощают эти комплексные структуры. Внутри клеток происходит переработка составных частей иммунных комплексов, которые затем захватываются фагоцитарными клетками, такими как макрофаги. Этот процесс ведет к возвращению в систему циркуляции очищенных эритроцитов, что важно для поддержания их нормальной функции [23].
Следует отметить, что активный фагоцитоз иммунных комплексов приводит к увеличению потребления кислорода и глюкозы и накоплению молочной кислоты, что указывает на метаболический стресс. Этот процесс, известный как «окислительный взрыв», сопровождается значительными затратами энергии и имеет важное значение для адекватного иммунного ответа. При тяжелой ПЭ наблюдается снижение функции печеночных макрофагов, что препятствует элиминации ЦИК и может нарушить иммунологическую толерантность тканей матери к антигенам плода, что способствует развитию иммунного конфликта [24].
Таким образом, формирование иммунокомплексных нарушений при ПЭ и развитие острого эндотелиоза, а также активация эндотелиальных клеток тесно связаны с несколькими взаимосвязанными факторами. Прежде всего, массивное поступление плодовых антигенов в кровоток матери происходит в результате повышения проницаемости сосудов маточно-плацентарного барьера, что может быть спровоцировано ишемическим повреждением плаценты. Это ведет к поступлению в системный кровоток большого количества чужеродных антигенов, что, в свою очередь, инициирует иммунный ответ [23].
Дефицит защитных антител в материнском организме также проявляется на фоне данной ситуации. Защитные антитела, которые могли бы нейтрализовать эти антигены, в частности на поверхности плаценты, образуются в недостаточном количестве [23]. Это приводит к уязвимости организма матери к чужеродным компонентам, таким как плодовые антигены, что, в свою очередь, создает условия для формирования иммунных комплексов.
Нарушение функции печени, отвечающей за расщепление и выведение иммунных комплексов, приводит к их накоплению в крови и тканях. Это накопление может вызывать адгезию иммунных комплексов к эндотелию сосудов печени и почек, а также к форменным элементам крови, что способствует развитию патологий, связанных с ПЭ, и вызывает нарушения микроциркуляции и системное воспаление [25].
Активация СК представляет собой ключевой элемент острого воспалительного ответа, затрагивающего как сосудистую стенку, так и отдельные ее участки [12]. Этот процесс инициирует каскадную активацию различных молекул, включая лизосомальные ферменты, протеазы и медиаторы, а также прокоагулянтные белки и компоненты калликреин-кининовой системы. Результатом данного взаимодействия становится продукция вазоконстрикторов и антиагрегантов, что в свою очередь усугубляет воспалительную реакцию [12].
Одним из критически важных аспектов, способствующих развитию серьезной иммунологической реактивности, является недостаточная элиминация иммунных комплексов [23]. Это приводит к образованию компонентов комплемента C5-C9, обладающих цитолитическими свойствами, воздействующих на клеточные мембраны, что может серьезно повредить клетки организма. Формирование мембраноатакующего иммунного комплекса не только усиливает процесс воспаления, но и может приводить к повреждению тканей [23].
Таким образом, обеспечение структурной целостности барьерных мембран становится важной защитной стратегией против иммунокомплексной патологии. Эти барьеры, включая эндотелий сосудов и клеточные мембраны, функционируют как физические и функциональные преграды, предотвращающие агрессивное воздействие активированных компонентов СК, и способствуют поддержанию гомеостаза в организме. В этом контексте сохранение целостности данных мембран и оптимальное функционирование систем, ответственных за иммунный ответ, играют решающую роль в защите от патофизиологических процессов [24].
Система комплемента играет ключевую роль в связи между врожденным и приобретенным иммунитетом, помогая распознавать антигены. При ПЭ, которая патогенетически связана с иммунной дезадаптацией и оксидативным стрессом, наблюдается повышенная активация СК в тканях плода. Это взаимодействие позволяет рассматривать компоненты СК как возможные биомаркеры для оценки риска ПЭ у беременных.
Беременность может быть охарактеризована как уникальная форма аллотрансплантации, в рамках которой материнская иммунная система взаимодействует с тканями плода. Процесс, в ходе которого отторжение плода не происходит, обусловлен наличием определенных механизмов, поддерживающих толерантность материнского иммунитета к плоду. Однако полное понимание вышеуказанных механизмов, а также реакций плода на материнские антигены, остается предметом значительного научного интереса и требует дальнейших исследований.
Заключение / Conclusion
Системная активация комплемента усиливает воспалительный ответ, что ведет к нарушению гомеостаза в организме беременной. В этом контексте важным является уточнение роли активации СК в развитии ангиогенного дисбаланса, который играет центральную роль в патогенезе ПЭ. Данная проблема требует глубокого и многогранного подхода, включая молекулярно-биологические, клинические и эпидемиологические исследования.
Также заслуживает внимания взаимосвязь между ожирением и ПЭ, так как оба эти состояния ассоциированы с активными изменениями в СК. Изучение механизмов, связывающих избыточную массу тела и риск развития ПЭ, может привести к обнаружению новых биомаркеров и терапевтических мишеней.
Кроме того, открытым остается вопрос о том, как местная и системная активация СК способствует возникновению ПЭ. Следует выяснить, является ли данный синдром следствием чрезмерной активации СК, недостаточного контроля над ее активностью, либо одновременно проявлениями обоих этих аспектов. Ответы на эти вопросы могут значительно расширить наше понимание патогенеза ПЭ и позволить разработать более эффективные профилактические и лечебные стратегии.
Таким образом, СК выполняет важные, однако противоречивые функции в процессе беременности. Ее адекватная регуляция необходима для успешного гестационного исхода, требуя дальнейших исследований для полного понимания ее ролей и механизмов в этом сложном биологическом процессе.
Список литературы
1. Стрельцова В.Л., Падруль М.М. Теория адаптационных реакций в акушерстве. Пермский медицинский журнал. 2012;29(6):111–20.
2. Клинические рекомендации – Нормальная беременность – 2023-2024-2025 (15.02.2024). М.: Министерство здравоохранения Российской Федерации, 2024. 58 с. Режим доступа: https://medhelp-rb.ru/images/docs/beremennost/klinich_rekomendacii_pri_normal_berem.pdf. [Дата обращения: 25.02.2025].
3. Клинические рекомендации – Преэклампсия. Эклампсия. Отеки, протеинурия и гипертензивные расстройства во время беременности, в родах и послеродовом периоде – 2021-2022-2023 (24.06.2021). М.: Министерство здравоохранения Российской Федерации, 2021. 54 с. Режим доступа: http://disuria.ru/_ld/10/1046_kr21O10O16MZ.pdf. [Дата обращения: 25.02.2025].
4. Murphy M.S., Tayade C., Smith G.N. Maternal circulating microRNAs and preeclampsia: challenges for diagnostic potential. Mol Diagn Ther. 2017;21(1):23–30. https://doi.org/10.1007/s40291-016-0233-0.
5. Redman C.W., Sargent I.L. Placental stress and pre-eclampsia: a revised view. Placenta. 2009;30:Suppl A:38–42. https://doi.org/10.1016/j.placenta.2008.11.021.
6. Каптильный В.А., Рейштат Д.Ю. Преэклампсия: определение, новое в патогенезе, методические рекомендации, лечение и профилактика. Архив акушерства и гинекологии имени В.Ф. Снегирева. 2020;7(1):19–30. https://doi.org/10.18821/2313-8726-2020-7-1-19-30.
7. Szarka A., Rigo J., Lazar L. et al. Circulating cytokines, chemokines and adhesion molecules in normal pregnancy and preeclampsia determined by multiplex suspension array. BMC Immunol. 2010;11:59. https://doi.org/10.1186/1471-2172-11-59.
8. Sargent I.L., Borzychowski A.M., Redman C.W.G. Immunoregulation in normal pregnancy and pre-eclampsia: an overview. Reprod Biomed Online. 2006;13(5):680–6. https://doi.org/10.1016/s1472-6483(10)60659-1.
9. Cooper M.A., Fehniger T.A., Сaligiuri M.A. The biology of human natural killer-cell subset. Trends Immunol. 2001;22(11):633–40. https://doi.org/10.1016/s1471-4906(01)02060-9.
10. Santner-Nanan B., Peek M.J., Khanam R. et al. Systemic increase in the ratio between Foxp3+ and IL-17-producing CD4+ T cells in healthy pregnancy but not in preeclampsia. J Immunol. 2009;183(11):7023–30. https://doi.org/10.4049/jimmunol.0901154.
11. Lynch A.M., Eckel R.H., Murphy J.R. et al. Prepregnancy obesity and complement system activation in early pregnancy and the subsequent development of preeclampsia. Am J Obstet Gynecol. 2012;206(5):428.e1–8. https://doi.org/10.1016/j.ajog.2012.02.035.
12. Абдуллаева Н.К. Состояние системы комплемента при преэклампсии. Российский вестник акушера-гинеколога. 2014;14(6):19–23.
13. Morgan B.P., Holmes C.H. Immunology of reproduction: protecting the placenta. Curr Biol. 2000;10(10):R381–3. https://doi.org/10.1016/s0960-9822(00)00476-0.
14. Макацария А.Д., Бицадзе В.О., Баймурадова С.М. и др. Антифосфолипидный синдром – иммунная тромбофилия в акушерстве и гинекологии. М.: Триада-Х, 2007. 456 с.
15. Abbas A.K., Litchman A.H., Pillai S. Cellular and molecular immunology. 10th edition. Elsevier, 2021. 618 р.
16. Contro E., Bernabini D., Farina A. Cell-free fetal DNA for the prediction of pre-eclampsia at the first and second trimesters: a systematic review and meta-analysis. Mol Diagn Ther. 2017;21(2):125–35. https://doi.org/10.1007/s40291-016-0245-9.
17. Tempfer C.B., Bancher-Todesca D., Zeisler H. et al. Placental expression and serum concentrations of cytokeratin 19 in preeclampsia. Obstet Gynecol. 2000;95(5):677–82. https://doi.org/10.1016/s0029-7844(00)00797-3.
18. Tedesco F., Radillo O., Candussi G. et al. Immunohistochemical detection of terminal complement complex and S protein in normal and preeclamptic placentae. Clin Exp Immunol. 1990;80(2):236–40. https://doi.org/10.1111/j.1365-2249.1990.tb05240.x.
19. Rampersad R., Barton A., Sadovsky Y., Nelson D.M. The C5b-9 membrane attack complex of complement activation localizes to villous trophoblast injury in vivo and modulates human trophoblast function in vitro. Placenta. 2008;29(10):855–61. https://doi.org/10.1016/j.placenta.2008.07.008.
20. Shamonki J.M., Salmon J.E., Hyjek E., Baergen R.N. Excessive complement activation is associated with placental injury in patients with antiphospholipid antibodies. Am J Obstet Gynecol. 2007;196(2):167.e1–5. https://doi.org/10.1016/j.ajog.2006.10.879 .
21. Qing X., Redecha P.B., Burmeister M.A. et al. Targeted inhibition of complement activation prevents features of preeclampsia in mice. Kidney Int. 2011;79(3):331–9. https://doi.org/10.1038/ki.2010.393.
22. Sarween N., Drayson M.T., Hodson J. et al. Humoral immunity in late-onset pre-eclampsia and linkage with angiogenic and inflammatory markers. Am J Reprod Immunol. 2018;80(5):e13041. https://doi.org/10.1111/aji.13041.
23. Иванов И.И., Прочан Е.Н., Черипко М.В., Косолапова Н.В. Динамика уровня циркулирующих иммунных комплексов при лечении преэклампсии. Крымский журнал экспериментальной и клинической медицины. 2011;1(3–4)37–42.
24. Сидорова И.С., Галинова И.Л. Эндотелиальная дисфункция в развитии гестоза. Вопросы гинекологии, акушерства и перинатологии. 2006;5(1):75–81.
25. Тягунова А.В., Васильева З.В., Сластен О.П., Баранова И.Н. Диагностическая ценность некоторых показателей иммунитета в клинике гестозов. Клиническая лабораторная диагностика. 1998;(4):38–40.
Об авторах
А. С. АнтоноваRussian Federation
Антонова Александра Сергеевна - Scopus Author ID: 57215934525.
119048 Москва, ул. Трубецкая, д. 8, стр. 2
Д. Х. Хизроева
Russian Federation
Хизроева Джамиля Хизриевна - д.м.н., проф. Scopus Author ID: 57194547147. WoS ResearcherID: F-8384-2017.
119048 Москва, ул. Трубецкая, д. 8, стр. 2
И. С. Калашникова
Russian Federation
Калашникова Ирина Сергеевна - к.м.н.
119048 Москва, ул. Трубецкая, д. 8, стр. 2
М. В. Третьякова
Russian Federation
Третьякова Мария Владимировна - к.м.н.
119048 Москва, ул. Трубецкая, д. 8, стр. 2
Ю. А. Попёнова
Russian Federation
Попёнова Юлия Александровна
123423 Москва, ул. Саляма Адиля, д. 2/44
Н. Ф. Кунешко
Russian Federation
Кунешко Нарт Фарук - к.м.н. WoS ResearcherID: AGZ-5143-2022.
117209 Москва, Севастопольский проспект, д. 24а
Л. С. Фаткуллина
Russian Federation
Фаткуллина Лариса Сергеевна - к.м.н.
420012 Казань, ул. Бутлерова, д. 49
Что уже известно об этой теме?
► Система комплемента – важная часть иммунной системы, играющая ключевую роль в защите организма и в регуляции воспалительного ответа. Она состоит из более чем 30 белков, которые взаимодействуют друг с другом, образуя каскад реакций, способствующих уничтожению патогенов, воспалению и активации других иммунных компонентов.
► Система комплемента обеспечивает поддержание гомеостаза и регуляцию иммунного ответа. Продукты активации комплемента выполняют функции, способствующие антисептическим эффектам в организме, одновременно предотвращая чрезмерные воспалительные реакции.
► У женщин с преэклампсией (ПЭ) наблюдается повышенная активация определенных компонентов системы комплемента, что может приводить к активации воспалительных процессов и повреждению эндотелия сосудов.
Что нового дает статья?
► Активация комплемента, в частности, компонентов C3 и C5, происходит в плацентарной ткани и вызывает воспалительные реакции, что, в свою очередь, усиливает сосудистую проницаемость. Это не только усугубляет клинические проявления ПЭ, но и может приводить к системным осложнениям.
► Клинические исследования нацелены на идентификацию молекулярных и генетических маркеров, позволяющих предсказать риск возникновения ПЭ, связанный с дисфункцией комплемента. Это открывает новые возможности для профилактических стратегий у женщин, находящихся в группе повышенного риска.
Как это может повлиять на клиническую практику в обозримом будущем?
► Исследования в этой области продолжаются, и их результаты могут открыть новые подходы к диагностике и лечению ПЭ, а также помогут понять более глубокие механизмы, участвующие в регуляции иммунного ответа во время беременности.
► Нерегулируемая активация комплемента – угроза сохранения беременности. Одним из ключевых аспектов является необходимость интеграции многопрофильных стратегий, направленных как на раннее выявление, так и на эффективное управление возможными осложнениями.
► Внедрение методик, направленных на контроль за уровнями специфических маркеров системной воспалительной реакции, может стать важным шагом на пути к профилактике ПЭ.
Рецензия
Для цитирования:
Антонова А.С., Хизроева Д.Х., Калашникова И.С., Третьякова М.В., Попёнова Ю.А., Кунешко Н.Ф., Фаткуллина Л.С. Система комплемента у беременных с тяжелой преэклампсией. Акушерство, Гинекология и Репродукция. 2025;19(3):443-452. https://doi.org/10.17749/2313-7347/ob.gyn.rep.2025.626
For citation:
Antonova A.S., Khizroeva J.Kh., Kalashnikova I.S., Tretyakova M.V., Popyonova Yu.A., Kuneshko N.F., Fatkullina L.S. The complement system in pregnant women with severe preeclampsia. Obstetrics, Gynecology and Reproduction. 2025;19(3):443-452. (In Russ.) https://doi.org/10.17749/2313-7347/ob.gyn.rep.2025.626
JATS XML

Контент доступен под лицензией Creative Commons Attribution-NonCommercial-ShareAlike 4.0 International License.










































