Перейти к:
Венозные и артериальные тромбозы в программах ВРТ: эпидемиология и превентивные стратегии
https://doi.org/10.17749/2313-7347/ob.gyn.rep.2025.656
Аннотация
В данном обзоре представлены современные данные о взаимосвязи между процедурами экстракорпорального оплодотворения (ЭКО) и тромботическими осложнениями с акцентом на эпидемиологические, патофизиологические и клинические аспекты. Тромбоз, хотя и является редким осложнением ЭКО (частота составляет около 0,2 %), представляет собой серьезную проблему, особенно у пациенток с синдромом гиперстимуляции яичников (СГЯ). При СГЯ риск тромботических осложнений значительно возрастает, что подчеркивает необходимость тщательного мониторинга и профилактики. Артериальные тромбозы, хотя и встречаются реже венозных, чаще связаны с СГЯ и возникают на ранних этапах после стимуляции. Также характерна атипичная локализация тромбозов: верхние конечности, шея и церебральные вены. Риск тромбообразования наиболее высок в I триместре беременности, наступившей в результате ЭКО, и может сохраняться в течение нескольких недель после разрешения СГЯ. К ключевым факторам риска тромботических осложнений относятся: СГЯ, который увеличивает риск тромбозов в 100 раз; тромбофилия (как наследственная, так и приобретенная), особенно у женщин с множественными факторами риска; ожирение, которое ассоциировано с повышением уровня эстрогенов и прокоагулянтных факторов; возраст матери старше 35 лет; синдром поликистозных яичников, который увеличивает риск венозных тромботических осложнений в 5 раз. Особое внимание уделено стратегиям снижения риска тромботических осложнений. Использование ревитализированных эмбрионов может значительно снизить риск тромбозов по сравнению с переносом свежих эмбрионов, что связано с отсутствием значительного повышения уровня эстрогенов и исключением риска СГЯ.
Ключевые слова
Для цитирования:
Бицадзе В.О., Хизроева Д.Х., Грандоне Э., Габидуллина Р.И., Третьякова М.В., Макацария Н.А., Гашимова Н.Р., Григорьева К.Н., Воробьев А.В., Лазарчук А.В., Муравьёва М.М., Кренделева А.Г., Полякова Т.Е., Зайнулина М.С., Капанадзе Д.Л., Ягубова Ф.Э., Гри Ж., Элалами И., Геротзиафас Г., Ван Дреден П., Макацария А.Д. Венозные и артериальные тромбозы в программах ВРТ: эпидемиология и превентивные стратегии. Акушерство, Гинекология и Репродукция. 2025;19(3):377-388. https://doi.org/10.17749/2313-7347/ob.gyn.rep.2025.656
For citation:
Bitsadze V.O., Khizroeva J.Kh., Grandone E., Gabidullina R.I., Tretyakova M.V., Makatsariya N.A., Gashimova N.R., Grigoreva K.N., Vorobev A.V., Lazarchuk A.V., Muravyova M.M., Krendeleva A.G., Polyakova T.E., Zainulina M.S., Kapanadze D.L., Yagubova F.E., Gris J., Elalamy I., Gerotziafas G., Van Dreden P., Makatsariya A.D. Venous and arterial thromboses in ART programs: epidemiology and preventive strategies. Obstetrics, Gynecology and Reproduction. 2025;19(3):377-388. (In Russ.) https://doi.org/10.17749/2313-7347/ob.gyn.rep.2025.656
Введение / Introduction
В 1978 г. Роберт Эдвардс и Патрик Стептоу совершили прорыв в репродуктивной медицине, сообщив о рождении первого ребенка, зачатого с помощью экстракорпорального оплодотворения (ЭКО). С тех пор эта технология получила широкое распространение, и на сегодняшний день благодаря ЭКО в мире родилось более 8 млн детей [1]. Согласно данным Европейского консорциума ЭКО-мониторинга (англ. European IVF Monitoring, EIM) Европейского общества репродукции человека и эмбриологии (англ. European Society of Human Reproduction and Embryology, ESHRE) за 2019 г., в 40 европейских странах функционирует 1487 клиник, предлагающих вспомогательные репродуктивные технологии (ВРТ). За год в этих клиниках было проведено 1077813 лечебных циклов, включая 160782 цикла ЭКО [2].
Одним из ключевых этапов процедуры ЭКО является стимуляция яичников, которая позволяет получить достаточное количество ооцитов. Для этого применяется контролируемая индукция овуляции, включающая введение экзогенных гонадотропинов: фолликулостимулирующего гормона (англ. follicle stimulating hormone, FSH), лютеинизирующего гормона (англ. luteinizing hormone, LH) и гонадотропин-рилизинг гормона (англ. gonadotropin-releasing hormone, GnRH).). Завершающим этапом стимуляции является введение хорионического гонадотропина человека (ХГЧ), который инициирует окончательное созревание ооцитов [3]. Однако чрезмерный ответ на экзогенные гонадотропины может быть связан с риском тромботических осложнений, что требует тщательного мониторинга и индивидуального подхода к дозированию препаратов [4][5].
Тромботические осложнения при ЭКО / IVF-related thrombotic complications
Вспомогательные репродуктивные технологии, ставшие сегодня рутинным стандартом медицинской помощи, открыли новую эру в репродуктивной медицине. Однако вместе с этим прогрессом мы наблюдаем и рост факторов риска тромбозов, связанных с беременностью. Это обусловлено широким внедрением передовых методов, которые еще не использовались 30 лет назад или их роль в возникновении тромбозов не была изучена.
При ЭКО тяжелые осложнения встречаются редко [6]. Но увеличение количества процедур привело к тому, что все больше женщин сталкиваются с осложнениями. Наиболее распространенным и серьезным осложнением является синдром гиперстимуляции яичников (СГЯ) [7], который характеризуется увеличением яичников, повышением проницаемости сосудов и массивным выходом жидкости во внесосудистое пространство [8] (рис. 1).
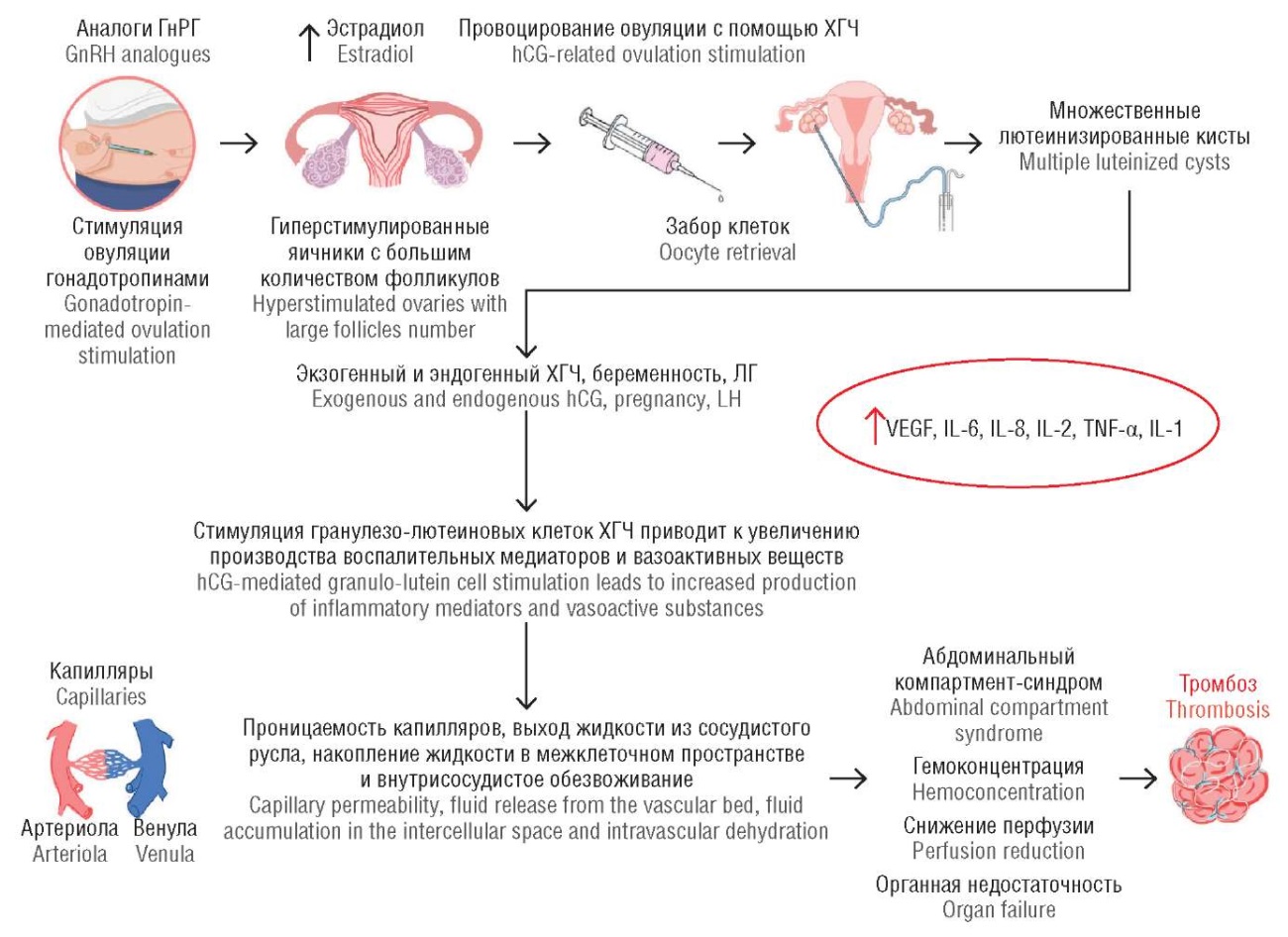
Рисунок 1. Патофизиология синдрома гиперстимуляции яичников [рисунок авторов].
Примечание: ГнРГ – гонадотропин-рилизинг гормон; ХГЧ – хорионический гонадотропин человека; ЛГ – лютеинизирующий гормон; VEGF – фактор роста эндотелия сосудов; IL – интерлейкин; TNF-α – фактор некроза опухоли-альфа.
Figure 1. Pathophysiology of ovarian hyperstimulation syndrome [drawn by authors].
Note: GnRH – gonadotropin-releasing hormone; hCG – human chorionic gonadotropin; LH – luteinizing hormone; VEGF – vascular endothelial growth factor; IL – interleukin; TNF-α – tumor necrosis factor-alpha.
Умеренная или тяжелая форма СГЯ встречается в 3–8 % случаев проведенных циклов ЭКО, значительно повышая риск развития как артериальных, так и венозных тромбозов [5]. Частота венозных тромбозов в циклах ЭКО составляет 0,1–0,5 % [9–11], а артериальных тромбозов – еще меньше [12][13]. Однако СГЯ увеличивает тромботический риск примерно на 2,0 % в абсолютном выражении [11][14].
Артериальные тромботические осложнения в циклах ЭКО наблюдаются относительно редко [14–16]. Согласно данным, такие осложнения обычно возникают в среднем через 10 дней после последнего введения ХГЧ [15–17]. В когортных исследованиях, проведенных в Дании, Франции и Италии, была изучена связь между артериальными тромботическими осложнениями и процедурами ЭКО. Результаты показали, что такие осложнения встречаются в 1–2 циклах стимуляции яичников на 1000 проведенных процедур [9][13][18]. Интересно, что в некоторых случаях множественные тромбозы могут возникать одновременно в рамках одного цикла. Например, описан случай одновременного тромбоза лучевой артерии и брыжеечной вены у пациентки с легким СГЯ во время ее пятого цикла ЭКО [9].
Ряд исследований связывают артериальную тромбоэмболию (АТЭ) почти исключительно с СГЯ [15][17]. По данным W.S. Chan и М.Е. Dixon, до 95 % случаев АТЭ ассоциированы с СГЯ [19]. Однако механизмы этой связи остаются недостаточно изученными. Например, во французском когортном исследовании, включавшем 2490 случаев СГЯ, распространенность артериальных тромбозов составила 3 % (n = 78) [18]. В то же время датское когортное исследование, в котором участвовали 30884 женщины, прошедшие 75141 процедуру ЭКО, не выявило значимой связи между СГЯ и АТЭ [13]. Важно отметить, что женщины с тяжелым СГЯ в этом исследовании получали низкомолекулярные гепарины (НМГ) для профилактики венозной тромбоэмболии (ВТЭ), что могло повлиять как на риск ВТЭ, так и на риск АТЭ [13].
Популяционные исследования демонстрируют, что частота артериальных тромбозов у женщин, использующих ВРТ, незначительно отличается от показателей в общей популяции [13]. В исследовании А.Т. Hansen с соавт. был проанализирован 75141 цикл ЭКО; 6-месячный показатель заболеваемости артериальными тромбозами составил 0,8 на 1000 циклов, что не имеет статистически значимых отличий от контрольной группы молодых женщин (контрольный показатель – 2,5; отношение коэффициентов заболеваемости = 0,36; 95 % доверительный интервал (ДИ) = 0,04–1,30) [13].
Венозная тромбоэмболия, включающая тромбоз глубоких вен с легочной эмболией или без нее, встречается чаще, чем АТЭ (табл. 1), однако остается относительно редким осложнением в циклах ЭКО. Распространенность ВТЭ оценивается в 0,5 %, что соответствует 1,6 случаям на 100 тыс. циклов или женщин [9]. Венозный тромбоз чаще всего возникал в среднем через 26,6 дней после введения ХГЧ в циклах индукции овуляции (табл. 1) [16]. Французское когортное исследование выявило повышенный риск ВТЭ как в неудачных, так и в успешных циклах ЭКО [18]. В частности, ВТЭ была зарегистрирована в 75 из 705186 неудачных циклов и в 207 из 82821 успешного цикла. При этом обычная стимуляция яичников, исключающая применение кломифена цитрата, была связана с увеличением риска ВТЭ (относительный риск (ОР) = 1,74; 95 % ДИ = 1,30–2,34) [18].
Таблица 1. Имеющиеся данные о частоте, анатомической локализации и сроках развития артериальных и венозных тромботических событий.
Table 1. Current data on the frequency, anatomical localization and onset for developing arterial and venous thrombotic events.
|
Источник Reference |
Авторы Authors |
Тип исследования Study type |
Количество пациенток Number of patients |
Количество циклов Number of cycles |
АТЭ ATE n |
АТЭ на цикл, % ATE per cycle, % |
Время наступления АТЭ (среднее количество дней после ХГЧ) ATE onset (mean days post-hCG) |
ВТЭ VTE n |
ВТЭ на цикл, % VTE per cycle, % |
Локализация ВТЭ VTE localization |
Время наступления ВТЭ (среднее количество дней после ХГЧ) VTE onset (mean days post-hCG) |
|
[30] |
Delvigne A. et al. |
Случай-контроль / Case-control |
384 |
na |
0 |
0 |
na |
1 |
0,01 |
Мозг / Brain |
na |
|
[29] |
Kodama H. et al. |
Серия случаев / Case series |
23 |
1316 |
0 |
0 |
na |
1 |
0,08 |
Мозг / Brain |
11 |
|
[34] |
Abramov Y. et al. |
Случай-контроль / Case-control |
163 |
163 |
0 |
0 |
na |
4 |
2,50 |
Легкое / Lung |
na |
|
[14] |
Serour G.I. et al. |
Случай-контроль / Case-control |
2924 |
3500 |
2 |
0,05 |
na |
4 |
0,12 |
Верхняя конечность / Upper limb |
na |
|
[28] |
Aboulghar M.A. et al. |
История болезни / Medical history |
2 |
2 |
0 |
0 |
na |
2 |
100,0 |
Мозг / Brain |
5 |
|
[31] |
Dulitzky M. et al. |
Когорта / Cohort |
61 |
na |
1 |
na |
na |
2 |
na |
Легкое / Lung |
nNa |
|
[9] |
Grandone Е. et al. |
Случай-контроль / Case-control |
305 |
747 |
3 |
0,40 |
na |
2 |
0,30 |
Мозг, кишечник Brain, intestines |
na |
|
[54] |
Yinon Y. et al. |
Когорта / Cohort |
24 |
73 |
0 |
0 |
na |
0 |
0 |
na |
na |
|
[25] |
Chan W.S., Ginsberg J.S. |
Обзор серии случаев / Case series review |
37 |
2500 |
0 |
0 |
na |
37 |
1,48 |
Верхняя конечность, шея / Upper limb, neck |
28 |
|
[15] |
Girolami А. et al. |
Обзор серии случаев / Case series review |
34 |
na |
34 |
na |
13,7 |
0 |
0 |
na |
na |
|
[27] |
Salomon О. et al. |
Серия случаев / Case series |
5 |
na |
0 |
0 |
na |
5 |
na |
Верхняя конечность, шея / Upper limb, neck |
16 |
|
[16] |
Chan W.S. |
Обзор серии случаев / Case series review |
96 |
na |
35 |
na |
10,7 |
61 |
na |
Верхняя конечность, шея / Upper limb, neck |
26,6 |
|
[38] |
Ricci G. et al. |
Когорта / Cohort |
480 |
1105 |
0 |
0 |
na |
0 |
0 |
na |
na |
|
[11] |
Rova K. et al. |
Когорта / Cohort |
19194 |
na |
0 |
0 |
na |
32 |
na |
na |
45 |
|
[13] |
Hansen A.T. et al. |
Когорта / Cohort |
30884 |
75141 |
2 |
0,003 |
na |
7 |
0,009 |
na |
na |
|
[26] |
Fleming T. et al. |
Серия случаев / Case series |
2 |
2 |
0 |
0 |
na |
2 |
100,0 |
Шея / Neck |
39,5 |
|
[10] |
Henriksson P. et al. |
Когорта / Cohort |
23498 |
na |
0 |
0 |
na |
99 |
na |
Легкое / Lung |
na |
|
[47] |
Hansen A.T. et al. |
Когорта / Cohort |
18787 |
na |
0 |
0 |
na |
36 |
na |
Легкое, другие неуказанные объекты / Lung, other not specified sites |
na |
|
[51] |
Villani M. et al. |
Когорта / Cohort |
234 |
684 |
0 |
0% |
na |
6 |
0,88 |
Легкое, нижняя конечность / Lung, lower limb |
na |
|
[17] |
Yang S. et al. |
Серия случаев / Case series |
38 |
na |
29 |
na |
8 |
9 |
na |
Мозг / Brain |
8,33 |
|
[20] |
Villani M. et al. |
Когорта / Cohort |
661 |
1836 |
0 |
0 |
na |
5 |
0,27 |
Легкое, нижняя конечность / Lung, lower limb |
na |
|
[32] |
Grandone Е. et al. |
Когорта / Cohort |
41 |
ns |
0 |
0 |
na |
41 |
na |
Легкое, нижняя и верхняя конечности / Lung, lower and upper limbs |
na |
|
[18] |
Filipovic-Pierucci A. et al. |
Когорта / Cohort |
277913 |
788007 |
78 |
0,01 |
na |
282 |
0 |
Легкое, нижняя конечность / Lung, lower limb |
na |
|
[33] |
Olausson N. et al. |
Когорта / Cohort |
30328 |
na |
0 |
0 |
na |
161 |
na |
Нижняя конечность, кишечник / Lower limb, intestines |
na |
Примечание: АТЭ – артериальная тромбоэмболия; ВТЭ – венозная тромбоэмболия; ХГЧ – хорионический гонадотропин человека; na – данные отсутствуют или недоступны.
Note: ATE – arterial thromboembolism; VTE – venous thromboembolism; hCG – human chorionic gonadotropin; na – not available.
Тем не менее данные о значительном риске ВТЭ в циклах ЭКО остаются противоречивыми. Например, итальянское когортное исследование сообщило о развитии ВТЭ в 2 из 1518 неудачных циклов (1,3 ‰) по сравнению с 3 из 318 успешных циклов (9,4 ‰) (ОР = 0,14; 95 % ДИ = 0,02–1,02; p = 0,04) [20]. В то же время датское когортное исследование, включавшее 30884 женщины, не выявило повышенного риска ВТЭ в течение 6 и 12 месяцев после применения ВРТ (отношение коэффициентов заболеваемости – 0,95; 95 % ДИ = 0,38–1,95 и 1,27; 95 % ДИ = 0,69–2,12, соответственно) [13].
Согласно данным многочисленных исследований, наиболее частым артериальным тромботическим осложнением, связанным с ЭКО, является инсульт [17]. Прогноз при этом осложнении часто неблагоприятный, особенно у женщин с СГЯ [21–24]. Кроме того, зафиксированы случаи ВТЭ нетипичных локализаций (табл. 1), таких как верхние конечности, шея [16][14][25–27] и церебральные вены [28–31]. Изолированная тромбоэмболия легочной артерии (ТЭЛА) также часто ассоциируется с процедурами ЭКО [10][18][20][31–34].
Причины распространения тромбозов нетипичных локализаций остаются недостаточно изученными. Одна из гипотез предполагает, что изменения системы гемостаза, происходящие во время контролируемой стимуляции яичников, способствуют увеличению объема перитонеальной жидкости. Эта жидкость оттекает через грудной проток в подключичные вены, создавая локальную среду с повышенным риском развития ВТЭ в верхней части тела [35][36].
Хорионический гонадотропин человека, ранее широко использовавшийся для стимуляции окончательного созревания ооцитов и овуляции, также оказывает значительное влияние на систему гемостаза. Он снижает уровни естественных антикоагулянтов, таких как протеины C и S и антитромбин, одновременно повышая уровни эндотелиальных маркеров, таких как тромбомодулин, что указывает на повреждение сосудистой стенки [37]. Дополнительным фактором риска ВТЭ нетипичных локализаций может быть наличие бронхиальных кист, расположенных вблизи яремной или подключичной вен. При СГЯ эти кисты, заполненные жидкостью, могут сдавливать сосуды, нарушая кровообращение и способствуя развитию тромбозов [27].
Согласно данным исследований, применение ЭКО, особенно при развитии СГЯ, может приводить к развитию гиперкоагуляционного состояния, которое способствует тромбообразованию [16][32]. При этом важно принимать во внимание, что риск ВТЭ может дополнительно возрастать при наличии как наследственных, так и приобретенных форм тромбофилии. Например, зарубежные исследования указывают, что у 85 % женщин с тяжелым СГЯ выявляется тромбофилия, что подчеркивает ее важную роль в развитии ВТЭ после стимуляции яичников [31]. Однако результаты других исследований не всегда подтверждают эту связь. Так, проспективное обсервационное исследование не выявило случаев тяжелого СГЯ среди носителей распространенных наследственных тромбофилий, таких как фактор V Лейдена и мутация гена протромбина G20210A [38]. Аналогично, исследование Е. Grandone с соавт. не обнаружило значимой связи между наследственными тромбофилиями и тромботическими осложнениями, связанными с ЭКО, у женщин с низким риском [9][32]. Однако обсервационное исследование, включавшее 305 женщин, прошедших стимуляцию яичников, выявило статистически значимую ассоциацию между повышенным уровнем гомоцистеина и риском ВТЭ (ОР = 15,2; 95 % ДИ = 2,0–115,0), в то время как другие формы тромбофилии не показали аналогичного влияния [9]. Кроме того, данные регистра RIETE, в котором сравнивались случаи ВТЭ, связанные с ЭКО, и другие случаи ВТЭ у женщин репродуктивного возраста, также не подтвердили повышенного риска ВТЭ у женщин с тромбофилией [32].
В ходе систематического обзора и метаанализа было проанализировано 14 исследований, направленных на оценку частоты и факторов риска ВТЭ, связанных с применением ВРТ [39]: общая частота составила 0,23 % (95 % ДИ = 0,07–0,46). Женщины, подвергавшиеся ВРТ, имели 2,66-кратное увеличение риска ВТЭ по сравнению с женщинами с естественной беременностью (ОР = 2,66; 95 % ДИ = 1,60–4,43). Риск ВТЭ после ВРТ, осложненной СГЯ, был выше по сравнению с ВРТ без СГЯ, однако разница не достигла статистической значимости (ОР = 14,83; 95 % ДИ = 0,86–255,62). Основными факторами риска ВТЭ, ассоциированными с ВРТ, были: процедура ЭКО – относительный риск варьировал от 1,77 (95 % ДИ = 1,41–2,23) до 4,99 (95 % ДИ = 1,24–20,05); гипергомоцистеинемия – ОР = 15,2 (95 % ДИ = 2,0–115,0); синдром поликистозных яичников (СПКЯ) – ОР = 4,8 (95 % ДИ = 1,7–13,4); успешная процедура ВРТ с последующей беременностью – ОР = 13,94 (95 % ДИ = 1,41–137,45). Эти противоречивые данные подчеркивают сложность взаимодействия между тромбофилией, стимуляцией яичников и риском тромботических осложнений. Необходимы дальнейшие исследования для уточнения роли тромбофилии в развитии ВТЭ у женщин, проходящих процедуры ЭКО, и разработки персонализированных подходов к профилактике.
Также следует отметить, что в целом среди пациенток, проходящих процедуры ЭКО, частота выявления генетических и приобретенных форм тромбофилии выше, чем в общей популяции. Это связано с несколькими факторами, включая особенности контингента пациенток, обращающихся в связи с бесплодием, а также влияние самой процедуры ЭКО на систему гемостаза. Генетические тромбофилии, такие как мутация фактора V Лейдена (G1691A) и мутация гена протромбина (G20210A), являются одними из наиболее распространенных наследственных причин повышенного тромботического риска. Эти мутации приводят к гиперкоагуляционному состоянию, которое может усугубляться на фоне гормональной стимуляции яичников при ЭКО. Согласно исследованиям, у женщин с бесплодием, особенно с такими состояниями, как СПКЯ или эндометриоз, частота носительства генетических тромбофилий выше, чем в общей популяции [40][41]. Приобретенные тромбофилии, такие как антифосфолипидный синдром (АФС), также чаще, чем в популяции, встречаются среди пациенток, проходящих ЭКО, поскольку АФС характеризуется наличием антител к фосфолипидам, что приводит к повышенному риску тромбозов и осложнений беременности, включая потерю плода. Женщины с АФС часто обращаются за помощью в клиники репродукции из-за связанного с этим синдромом бесплодия или привычного невынашивания беременности [42][43]. В частности исследование, проведенное H.S. Qublan с соавт., показало, что у женщин с повторными неудачными попытками ЭКО частота выявления антифосфолипидных антител достигает 15–20 % [44].
Процедура ВРТ, особенно контролируемая стимуляция яичников, сопровождается изменениями в системе гемостаза. Введение экзогенных гонадотропинов и ХГЧ приводит к повышению уровня эстрогенов, что в свою очередь, стимулирует синтез прокоагулянтных факторов (таких как фибриноген, фактор VIII и фактор фон Виллебранда) и снижает активность естественных антикоагулянтов (например, протеина S) [45]. Эти изменения создают гиперкоагуляционное состояние, которое может усугубляться на фоне уже существующей тромбофилии. Кроме того, тромбофилия может негативно влиять на исходы ЭКО, увеличивая риск неудачных попыток имплантации и потери беременности на ранних сроках [46]. Таким образом, высокая частота генетических и приобретенных форм тромбофилии среди пациенток, проходящих ЭКО, обусловлена как особенностями контингента (например, наличием сопутствующих гинекологических заболеваний), так и влиянием самой процедуры на систему гемостаза. Это подчеркивает необходимость тщательного скрининга на тромбофилию у женщин, планирующих ЭКО, и разработки индивидуальных стратегий профилактики тромботических осложнений.
К другим факторам риска ВТЭ относится возраст женщины, который является значимым фактором, влияющим на риск ВТЭ. Исследования показывают, что возраст старше 35 лет значительно повышает риск тромботических осложнений [9][11]. Например, крупное популяционное исследование выявило двукратное увеличение риска ВТЭ у женщин в возрасте 40 лет (ОР = 2,1; 95 % ДИ = 1,3–3,7) по сравнению с более молодыми пациентками [11]. Однако данные не всегда однозначны: датское когортное исследование не подтвердило значимого влияния возраста матери на риск ВТЭ во время беременности, хотя авторы отметили, что в послеродовом периоде риск ВТЭ у женщин старше 35 лет возрастает (ОР = 2,4; 95 % ДИ = 0,8–7,7) [47]. Индекс массы тела (ИМТ) также играет важную роль в оценке риска ВТЭ. У женщин с ожирением (ИМТ > 30 кг/м²) риск ВТЭ увеличивается, при этом OP варьирует от 1,23 (95 % ДИ = 1,01–1,49) до 3,2 (95 % ДИ = 2,2–4,6) [9][11]. Предполагается, что у женщин с ожирением повышенный уровень эстрогенов может стимулировать синтез прокоагулянтных факторов, что способствует тромбообразованию [10].
Курение как фактор риска тромботических осложнений во время и после ЭКО изучен недостаточно. На данный момент систематические данные о влиянии курения на риск ВТЭ и АТЭ отсутствуют, что подчеркивает необходимость дальнейших исследований в этой области. Однако курение является установленным фактором риска развития гипергомоцистеинемии, которая, как было сказано выше, значительно увеличивает риск ВТЭ [39]. Исследования показывают, что курение способствует повышению уровня гомоцистеина за счет нескольких механизмов: во-первых, токсичные компоненты табачного дыма, такие как кадмий и свинец, ингибируют активность ферментов, участвующих в метаболизме гомоцистеина, включая цистатионин-β-синтазу и метилентетрагидрофолатредуктазу (MTHFR) [48]. Во-вторых, курение снижает уровень витаминов группы B (B6, B12, фолиевой кислоты), которые являются кофакторами в процессе превращения гомоцистеина в метионин и цистеин [49]. Кроме того, метаанализ, проведенный L.A. Bazzano с соавт. (2003), подтвердил, что курение является независимым фактором риска гипергомоцистеинемии, что может объяснять повышенный риск сердечно-сосудистых заболеваний и тромботических осложнений у курильщиков [50]. Таким образом, обоснованно утверждение, что курение будет дополнительным фактором риска ВТЭ у пациенток, проходящих процедуры ВРТ.
Таким образом, возраст матери, ожирение и, вероятно, курение являются важными факторами, которые необходимо учитывать при оценке риска тромботических осложнений у женщин, проходящих ЭКО (рис. 2).
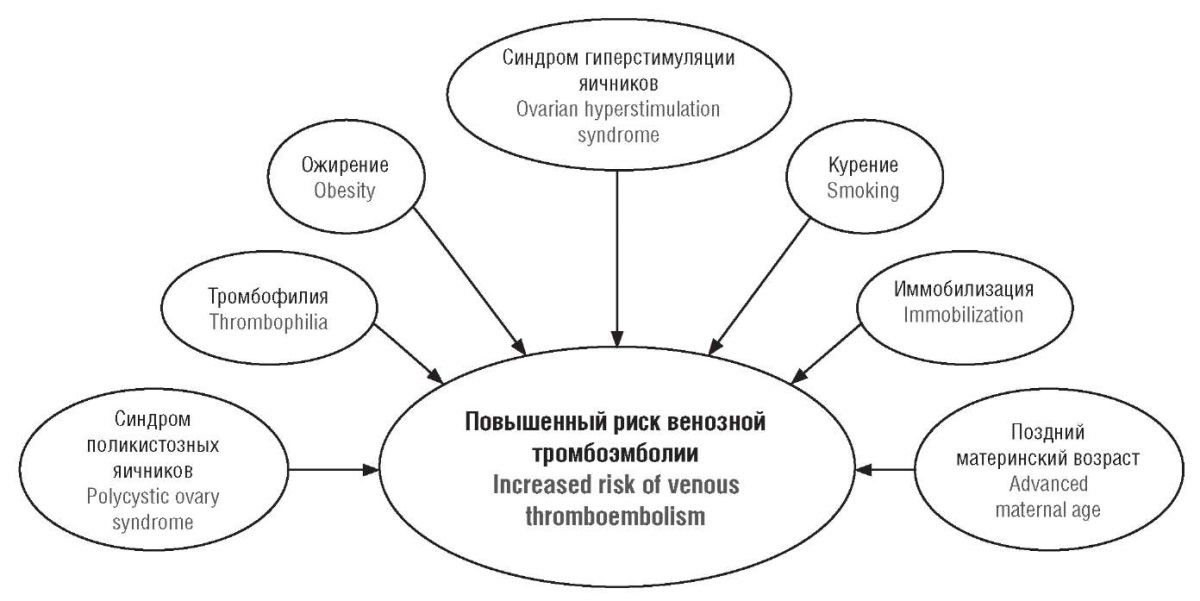
Рисунок 2. Факторы риска, предрасполагающие к тромбоэмболическим событиям при экстракорпоральном оплодотворении [рисунок авторов].
Figure 2. Risk factors predisposing to thromboembolic events during in vitro fertilization [drawn by authors].
Риск венозного тромбоза при беременности после ЭКО / Risk of post-IVF in-pregnancy venous thrombosis
Согласно данным исследований, риск ВТЭ при беременности, наступившей в результате ЭКО, значительно выше, чем при естественном зачатии [10][47][51]. Это связано с множеством факторов, предрасполагающих к тромботическим осложнениям, включая тромбофилию, ожирение, курение, возраст матери старше 35 лет и иммобилизацию [25][52]. Процедура ЭКО сама по себе увеличивает риск ВТЭ в 3–4 раза по сравнению с естественной беременностью [47][51][53].
Особую группу риска составляют женщины с СПКЯ. Датское когортное исследование показало, что у пациенток с СПКЯ риск ВТЭ увеличивается в 5 раз [47]. Кроме того, СГЯ остается ключевым фактором, ассоциированным с тромботическими осложнениями. У женщин, забеременевших после успешной стимуляции яичников, риск ВТЭ может возрастать в 100 раз [10][11][16][47][51]. Этот риск сохраняется с первой недели после переноса эмбрионов и продолжается до конца I триместра, а в некоторых случаях – в течение нескольких недель после разрешения СГЯ [16][54]. В связи с этим клинические рекомендации, например, Американской коллегии торакальных врачей (англ. American College of Chest Physician, ACCP) предполагают проведение профилактической антикоагулянтной терапии НМГ в течение 3 месяцев после разрешения тяжелого СГЯ [55][56]. Повышение уровня эстрадиола при ЭКО также играет значительную роль в увеличении тромботического риска. Эстрадиол снижает фибринолитическую активность, способствуя гиперкоагуляции [57][58]. Кроме того, повышенный уровень эстрадиола коррелирует с увеличением активности фактора VIII и фактора фон Виллебранда, а также со снижением уровня металлопротеиназы ADAMTS-13 (англ. англ. a disintegrin and metalloproteinase with thrombospondin type 1 motif, member 13), что дополнительно повышает риск тромбообразования [59].
Примечательно, что беременность, наступившая после переноса ревитализированных эмбрионов без предварительной стимуляции овуляции и значительного повышения уровня эстрогенов, не сопровождается увеличением риска ВТЭ по сравнению с естественным зачатием. Шведское исследование подтвердило, что перенос замороженных эмбрионов не увеличивает риск ВТЭ [11]. Более того, недавнее когортное исследование показало, что использование замороженных эмбрионов снижает риск ВТЭ в I триместре беременности [33]. Частота ВТЭ после переноса свежих эмбрионов была более чем в 8 раз выше по сравнению с естественным зачатием, тогда как при использовании замороженных эмбрионов этот риск не увеличивался [33]. Это позволяет предположить, что перенос замороженных эмбрионов может быть более безопасным с точки зрения риска тромботических осложнений у матери. Таким образом, выбор стратегии ЭКО, включая использование замороженных эмбрионов, может играть важную роль в снижении риска ВТЭ у пациенток с высоким тромботическим риском.
Заключение / Conclusion
Тромбоэмболические осложнения, хотя и редкие, представляют собой значимую проблему у женщин, проходящих процедуру ЭКО. АТЭ встречается реже, чем ВТЭ, однако оба состояния требуют пристального внимания из-за потенциально тяжелых последствий. Ключевым фактором, ассоциированным с тромботическими осложнениями при ЭКО, является СГЯ, который значительно увеличивает риск тромбозов, особенно у женщин, забеременевших после успешной стимуляции. Это подтверждает необходимость строгого соблюдения рекомендаций современных руководств по тромбопрофилактике, включая использование НМГ у пациенток с высоким риском.
Тем не менее остается множество нерешенных вопросов, связанных с влиянием тромбофилии, особенно у женщин с множественными факторами риска, такими как ожирение, возраст старше 35 лет, курение и наследственные или приобретенные нарушения системы гемостаза. Необходимы дальнейшие исследования для уточнения роли тромбофилии в развитии тромботических осложнений при ЭКО, а также для разработки персонализированных подходов к профилактике.
Особый интерес представляет использование ревитализированных эмбрионов, что может снижать риск ВТЭ по сравнению с переносом свежих эмбрионов. Это связано с отсутствием значительного повышения уровня эстрогенов и исключением риска СГЯ. Однако для подтверждения этих данных и определения оптимальных стратегий применения замороженных эмбрионов необходимы дополнительные крупномасштабные исследования.
Таким образом, несмотря на значительный прогресс в понимании тромботических осложнений при ЭКО, остается необходимость в дальнейшем изучении факторов риска, разработке эффективных профилактических мер и уточнении роли различных подходов к проведению ЭКО, включая использование замороженных эмбрионов. Это позволит минимизировать риски для пациенток и улучшить исходы лечения бесплодия.
Список литературы
1. Calhaz-Jorge C., De Geyter C.H., Kupka M.S. et al. Survey on ART and IUI: legislation, regulation, funding and registries in European countries: The European IVF-monitoring Consortium (EIM) for the European Society of Human Reproduction and Embryology (ESHRE). Hum Reprod Open. 2020;2020(1):hoz044. https://doi.org/10.1093/hropen/hoz044.
2. European IVF Monitoring Consortium (EIM) for the European Society of Human Reproduction and Embryology (ESHRE); Smeenk J., Wyns C., De Geyter C. et al. ART in Europe, 2019: results generated from European registries by ESHRE. Hum Reprod. 2023;3(12):2321–38. https://doi.org/10.1093/humrep/dead197.
3. Farquhar C., Marjoribanks J., Brown J. et al. Management of ovarian stimulation for IVF: narrative review of evidence provided for World Health Organization guidance. Reprod Biomed Online. 2017;35(1):3–16. https://doi.org/10.1016/j.rbmo.2017.03.024.
4. Nelson S.M. Venous thrombosis during assisted reproduction: novel risk reduction strategies. Thromb Res. 2013;131 Suppl 1:S1–3. https://doi.org/10.1016/S0049-3848(13)00023-6.
5. Grandone E., Villani M. Assisted reproductive technologies and thrombosis. Thromb Res. 2015;135 Suppl 1:S44–5. https://doi.org/10.1016/S0049-3848(15)50441-6.
6. Kupka M.S., Ferraretti A.P., de Mouzon J. et al.; European IVF-Monitoring Consortium, for the European Society of Human Reproduction and Embryology. Assisted reproductive technology in Europe, 2010: results generated from European registers by ESHRE†. Hum Reprod. 2014;29(10):2099–113. https://doi.org/10.1093/humrep/deu175.
7. Sennström M., Rova K., Hellgren M. et al. Thromboembolism and in vitro fertilization – a systematic review. Acta Obstet Gynecol Scand. 2017;96(9):1045–52. https://doi.org/10.1111/aogs.13147.
8. Practice Committee of American Society for Reproductive Medicine. Ovarian hyperstimulation syndrome. Fertil Steril. 2008;90(5 Supple):S188–93. https://doi.org/10.1016/j.fertnstert.2008.08.034.
9. Grandone E., Colaizzo D., Vergura P. et al. Age and homocysteine plasma levels are risk factors for thrombotic complications after ovarian stimulation. Hum Reprod. 2004;19(8):1796–9. https://doi.org/10.1093/humrep/deh346.
10. Henriksson P., Westerlund E., Wallén H. et al. Incidence of pulmonary and venous thromboembolism in pregnancies after in vitro fertilisation: cross sectional study. BMJ. 2013;346:е8632. https://doi.org/10.1136/bmj.e8632.
11. Rova K., Passmark H., Lindqvist P.G. Venous thromboembolism in relation to in vitro fertilization: an approach to determining the incidence and increase in risk in successful cycles. Fertil Steril. 2012;97(1):95–100. https://doi.org/10.1016/j.fertnstert.2011.10.038.
12. Nelson S.M. Prophylaxis of VTE in women – during assisted reproductive techniques. Thromb Res. 2009;123 Suppl 3:S8–S15. https://doi.org/10.1016/S0049-3848(09)70127-6.
13. Hansen A.T., Kesmodel U.S., Juul S., Hvas A.M. No evidence that assisted reproduction increases the risk of thrombosis: a Danish national cohort study. Hum Reprod. 2012;27(5):1499–503. https://doi.org/10.1093/humrep/des041.
14. Serour G.I., Aboulghar M., Mansour R. et al. Complications of medically assisted conception in 3,500 cycles. Fertil Steril. 1998;70(4):638–42. https://doi.org/10.1016/s0015-0282(98)00250-7.
15. Girolami A., Scandellari R., Tezza F. et al. Arterial thrombosis in young women after ovarian stimulation: case report and review of the literature. J Thromb Thrombolysis. 2007;24(2):169–74. https://doi.org/10.1007/s11239-007-0009-9.
16. Chan W.S. The 'ART' of thrombosis: a review of arterial and venous thrombosis in assisted reproductive technology. Curr Opin Obstet Gynecol. 2009;21(3):207–18. https://doi.org/10.1097/GCO.0b013e328329c2b8.
17. Yang S., Yuan J., Qin W. et al. The clinical characteristics of acute cerebrovascular accidents resulting from ovarian hyperstimulation syndrome. Eur Neurol. 2017;77(5–6):221–30. https://doi.org/10.1159/000463383.
18. Filipovic-Pierucci A., Gabet A., Deneux-Tharaux C. et al. Arterial and venous complications after fertility treatment: a French nationwide cohort study. Eur J Obstet Gynecol Reprod Biol. 2019;237:57–63. https://doi.org/10.1016/j.ejogrb.2019.02.034.
19. Chan W.S, Dixon M.E. The "ART" of thromboembolism: a review of assisted reproductive technology and thromboembolic complications. Thromb Res. 2008;121(6):713–26. https://doi.org/10.1016/j.thromres.2007.05.023.
20. Villani M., Favuzzi G., Totaro P. et al. Venous thromboembolism in assisted reproductive technologies: comparison between unsuccessful versus successful cycles in an Italian cohort. J Thromb Thrombolysis. 2018;45(2):234–9. https://doi.org/10.1007/s11239-017-1584-z.
21. Mozes M., Bogokowsky H., Antebi E. et al. Thromboembolic phenomena after ovarian stimulation with human gonadotrophins. Lancet. 1965;2(7424):1213–5. https://doi.org/10.1016/s0140-6736(65)90636-7.
22. Kermode A.G., Churchyard A., Carroll W.M. Stroke complicating severe ovarian hyperstimulation syndrome. Aust N Z J Med. 1993;23(2):219–20. https://doi.org/10.1111/j.1445-5994.1993.tb01823.x.
23. Inbar O.J., Levran D., Mashiach S., Dor J. Ischemic stroke due to induction of ovulation with clomiphene citrate and menotropins without evidence of ovarian hyperstimulation syndrome. Fertil Steril. 1994;62(5):1075–6. https://doi.org/10.1016/s0015-0282(16)57078-2.
24. Cluroe A.D., Synek B.J. A fatal case of ovarian hyperstimulation syndrome with cerebral infarction. Pathology. 1995;27(4):344–6. https://doi.org/10.1080/00313029500169273.
25. Chan W.S., Ginsberg J.S. A review of upper extremity deep vein thrombosis in pregnancy: unmasking the 'ART' behind the clot. J Thromb Haemost. 2006;4(8):673–7. https://doi.org/10.1111/j.1538-7836.2006.02026.x.
26. Fleming T., Sacks G., Nasser J. Internal jugular vein thrombosis following ovarian hyperstimulation syndrome. Aust N Z J Obstet Gynaecol. 2012;52(1):87–90. https://doi.org/10.1111/j.1479-828X.2011.01392.x.
27. Salomon O., Schiby G., Heiman Z. et al. Combined jugular and subclavian vein thrombosis following assisted reproductive technology – new observation. Fertil Steril. 2009;92(2):620–5. https://doi.org/10.1016/j.fertnstert.2008.07.1708.
28. Aboulghar M.A., Mansour R.T., Serour G.I., Amin Y.M. Moderate ovarian hyperstimulation syndrome complicated by deep cerebrovascular thrombosis. Hum Reprod. 1998;13(8):2088–91. https://doi.org/10.1093/humrep/13.8.2088.
29. Kodama H., Fukuda J., Karube H. et al. Characteristics of blood hemostatic markers in a patient with ovarian hyperstimulation syndrome who actually developed thromboembolism. Fertil Steril. 1995;64(6):1207–9. https://doi.org/10.1016/s0015-0282(16)57987-4.
30. Delvigne A., Demoulin A., Smitz J. et al. The ovarian hyperstimulation syndrome in in-vitro fertilization: a Belgian multicentric study. I. Clinical and biological features. Hum Reprod. 1993;8(9):1353–60. https://doi.org/10.1093/oxfordjournals.humrep.a138260.
31. Dulitzky M., Cohen S.B., Inbal A. et al. Increased prevalence of thrombophilia among women with severe ovarian hyperstimulation syndrome. Fertil Steril. 2002;77(3):463–7. https://doi.org/10.1016/s0015-0282(01)03218-6.
32. Grandone E., Di Micco P.P., Villani M. et al.; RIETE Investigators. Venous thromboembolism in women undergoing assisted reproductive technologies: Data from the RIETE Registry. Thromb Haemost. 2018;118(11):1962–8. https://doi.org/10.1055/s-0038-1673402.
33. Olausson N., Discacciati A., Nyman A.I. et al. Incidence of pulmonary and venous thromboembolism in pregnancies after in vitro fertilization with fresh respectively frozen-thawed embryo transfer: nationwide cohort study. J Thromb Haemost. 2020;18(8):1965–73. https://doi.org/10.1111/jth.14840.
34. Abramov Y., Elchalal U., Schenker J.G. Obstetric outcome of in vitro fertilized pregnancies complicated by severe ovarian hyperstimulation syndrome: a multicenter study. Fertil Steril. 1998;70(6):1070–6. https://doi.org/10.1016/s0015-0282(98)00350-1.
35. Bauersachs R.M., Manolopoulos K., Hoppe I. et al. More on: the 'ART' behind the clot: solving the mystery. J Thromb Haemost. 2007;5(2):438–9.
36. Richardson M.A., Berg D.T., Calnek D.S. et al. 17beta-estradiol, but not raloxifene, decreases thrombomodulin in the antithrombotic protein C pathway. Endocrinology. 2000;141(10):3908–11. https://doi.org/10.1210/endo.141.10.7798.
37. Rogolino A., Coccia M.E., Fedi S. et al. Hypercoagulability, high tissue factor and low tissue factor pathway inhibitor levels in severe ovarian hyperstimulation syndrome: possible association with clinical outcome. Blood Coagul Fibrinolysis. 2003;14(3):277–82. https://doi.org/10.1097/01.mbc.0000061296.28953.d0.
38. Ricci G., Bogatti P., Fischer-Tamaro L. et al. Factor V Leiden and prothrombin gene G20210A mutation and in vitro fertilization: prospective cohort study. Hum Reprod. 2011;26(11):3068–77. https://doi.org/10.1093/humrep/der261.
39. Goualou M., Noumegni S., de Moreuil C. et al. Venous thromboembolism associated with assisted reproductive technology: a systematic review and meta-analysis. Thromb Haemost. 2023;123(3):283–94. https://doi.org/10.1055/s-0042-1760255.
40. Pabinger I., Grafenhofer H., Kaider A. et al. Risk of pregnancy-associated recurrent venous thromboembolism in women with a history of venous thrombosis. J Thromb Haemost. 2005;3(5):949–54. https://doi.org/10.1111/j.1538-7836.2005.01307.x.
41. Milenkovic J., Milojkovic M., Mitic D. et al. Interaction of thrombophilic SNPs in patients with unexplained infertility-multifactor dimensionality reduction (MDR) model analysis. J Assist Reprod Genet. 2020;37(6):1449–58. https://doi.org/10.1007/s10815-020-01808-4.
42. Santos T.D.S., Ieque A.L., de Carvalho H.C. et al. Antiphospholipid syndrome and recurrent miscarriage: A systematic review and meta-analysis. J Reprod Immunol. 2017;123:78–87. https://doi.org/10.1016/j.jri.2017.09.007.
43. El Hasbani G., Khamashta M., Uthman I. Antiphospholipid syndrome and infertility. Lupus. 2020;29(2):105–17. https://doi.org/10.1177/0961203319893763.
44. Qublan H.S., Eid S.S., Ababneh H.A. et al. Acquired and inherited thrombophilia: implication in recurrent IVF and embryo transfer failure. Hum Reprod. 2006;21(10):2694–8. https://doi.org/10.1093/humrep/del203.
45. Nesbit C., Gunalp C., Zhang J. et al. Longitudinal assessment of coagulation potential before, during, and following an in vitro fertilization cycle. Thromb Res. 2024;238:97–102. https://doi.org/10.1016/j.thromres.2024.04.020.
46. Azem F., Many A., Ben Ami I. et al. Increased rates of thrombophilia in women with repeated IVF failures. Hum Reprod. 2004;19(2):368–70. https://doi.org/10.1093/humrep/deh069.
47. Hansen A.T., Kesmodel U.S., Juul S., Hvas A.M. Increased venous thrombosis incidence in pregnancies after in vitro fertilization. Hum Reprod. 2014;29(3):611–7. https://doi.org/10.1093/humrep/det458.
48. Refsum H., Nurk E., Smith A.D. et al. The Hordaland Homocysteine Study: a community-based study of homocysteine, its determinants, and associations with disease. J Nutr. 2006;136(6 Suppl):1731S–1740S. https://doi.org/10.1093/jn/136.6.1731S.
49. Fuchs H.E., O'Connell K., Du M. et al. Vitamin B12 supplementation and vitamin B12 blood serum levels: evaluation of effect modification by gender and smoking status. Nutr Cancer. 2022;74(7):2373–83. https://doi.org/10.1080/01635581.2021.2007271.
50. Bazzano L.A., He J., Muntner P. et al. Relationship between cigarette smoking and novel risk factors for cardiovascular disease in the United States. Ann Intern Med. 2003;138(11):891–7. https://doi.org/10.7326/0003-4819-138-11-200306030-00010.
51. Villani M., Dentali F., Colaizzo D. et al. Pregnancy-related venous thrombosis: comparison between spontaneous and ART conception in an Italian cohort. BMJ Open. 2015;5(10):e008213. https://doi.org/10.1136/bmjopen-2015-008213.
52. Rosendaal F.R. Risk factors for venous thrombotic disease. Thromb Haemost. 1999;82(2):610–9.
53. Grandone E., Ageno W. The legacy of Edwards and Steptoe and the windy roads of assisted reproduction: where do we stand with venous thromboembolism? Thromb Haemost. 2023;123(3):267–9. https://doi.org/10.1055/a-1996-1341.
54. Yinon Y., Pauzner R., Dulitzky M. et al. Safety of IVF under anticoagulant therapy in patients at risk for thrombo-embolic events. Reprod Biomed Online. 2006;12(3):354–8. https://doi.org/10.1016/s1472-6483(10)61009-7.
55. Bates S.M., Greer I.A., Middeldorp S. et al. VTE, thrombophilia, antithrombotic therapy, and pregnancy: Antithrombotic Therapy and Prevention of Thrombosis, 9th ed: American College of Chest Physicians Evidence-Based Clinical Practice Guidelines. Chest. 2012;141(2 Suppl):e691S–e736S. https://doi.org/10.1378/chest.11-2300.
56. Grandone E., Piazza G. Thrombophilia, inflammation, and recurrent pregnancy loss: a case-based review. Semin Reprod Med. 2021;39(1–02):62–8. https://doi.org/10.1055/s-0041-1731827.
57. Sticchi E., Romagnuolo I., Cellai A.P. et al. Fibrinolysis alterations in infertile women during controlled ovarian stimulation: influence of BMI and genetic components. Thromb Res. 2012;130(6):919–24. https://doi.org/10.1016/j.thromres.2012.07.005.
58. Gurunath S., Vinekar S., Biliangady R. Assisted reproductive techniques in a patient with history of venous thromboembolism: a case report and review of literature. J Hum Reprod Sci. 2018;11(2):193–7. https://doi.org/10.4103/jhrs.JHRS5817.
59. Westerlund E., Antovic A., Hovatta O. et al. Changes in von Willebrand factor and ADAMTS13 during IVF. Blood Coagul Fibrinolysis. 2011;22(2):127–31. https://doi.org/10.1097/MBC.0b013e32834363ea.
Об авторах
В. О. БицадзеRussian Federation
Бицадзе Виктория Омаровна - д.м.н., проф., профессор РАН. Scopus Author ID: 6506003478. WoS ResearcherID: F-8409-2017.
119048 Москва, ул. Трубецкая, д. 8, стр. 2
Д. Х. Хизроева
Russian Federation
Хизроева Джамиля Хизриевна - д.м.н., проф. Scopus Author ID: 57194547147. WoS ResearcherID: F-8384-2017.
119048 Москва, ул. Трубецкая, д. 8, стр. 2
Э. Грандоне
Italy
Грандоне Эльвира – д.м.н., проф. Scopus Author ID: 7006391091. WoS ResearcherID: M-1127-2019.
119048 Москва, ул. Трубецкая, д. 8, стр. 2; 71013 Сан-Джованни-Ротондо, Viale Cappuccini, д. 1; 71122 Фоджа, Via Antonio Gramsci, д. 89
Р. И. Габидуллина
Russian Federation
Габидуллина Рушанья Исмагиловна - д.м.н., проф. Scopus Author ID: 57215670415.
420012 Казань, ул. Бутлерова, д. 49
М. В. Третьякова
Russian Federation
Третьякова Мария Владимировна - к.м.н.
119048 Москва, ул. Трубецкая, д. 8, стр. 2
Н. А. Макацария
Russian Federation
Макацария Наталия Александровна - к.м.н. WoS ResearcherID: F-8406-2017.
119048 Москва, ул. Трубецкая, д. 8, стр. 2
Н. Р. Гашимова
Russian Federation
Гашимова Нилуфар Рамиль кызы - к.м.н.
119048 Москва, ул. Трубецкая, д. 8, стр. 2
К. Н. Григорьева
Russian Federation
Григорьева Кристина Николаевна - к.м.н.
119048 Москва, ул. Трубецкая, д. 8, стр. 2
А. В. Воробьев
Russian Federation
Воробьев Александр Викторович - к.м.н. Scopus Author ID: 57191966265. Wos ResearcherID: F-8804-2017. eLibrary SPIN-code: 5806-7062.
А. В. Лазарчук
Russian Federation
Лазарчук Арина Владимировна
119048 Москва, ул. Трубецкая, д. 8, стр. 2
М. М. Муравьёва
Russian Federation
Муравьёва Марианна Михайловна
119048 Москва, ул. Трубецкая, д. 8, стр. 2
А. Г. Кренделева
Russian Federation
Кренделева Анна Геннадьевна
119048 Москва, ул. Трубецкая, д. 8, стр. 2
Т. Е. Полякова
Russian Federation
Полякова Татьяна Евгеньевна - WoS ResearcherID: LSJ-7886-2024.
119048 Москва, ул. Трубецкая, д. 8, стр. 2
М. С. Зайнулина
Russian Federation
Зайнулина Марина Сабировна - д.м.н., проф. Scopus Author ID: 37076359000. WoS Researcher ID: B-5746-2018.
192014 Санкт-Петербург, ул. Маяковского, д. 5; 197022 Санкт-Петербург, ул. Льва Толстого, д. 6/8
Д. Л. Капанадзе
Georgia
Капанадзе Дареджан Левановна - к.м.н.
0179 Тбилиси, ул. Узнадзе, д. 78
Ф. Э. Ягубова
France
Ягубова Фидан Эльчин кызы
119048 Москва, ул. Трубецкая, д. 8, стр. 2
Ж.-К. Гри
France
Гри Жан-Кристоф - д.м.н., проф. Scopus Author ID: 7005114260. WoS ResearcherID: AAA-2923-2019.
119048 Москва, ул. Трубецкая, д. 8, стр. 2; 34090 Монпелье, ул. Огюста Бруссоне, д. 163
И. Элалами
France
Элалами Исмаил - д.м.н., проф. Scopus Author ID: 7003652413. WoS ResearcherID: AAC-9695-2019.
119048 Москва, ул. Трубецкая, д. 8, стр. 2; 75020 Париж, Китайская улица, д. 4; 75006 Париж, Улица медицинского факультета, д. 12
Г. Геротзиафас
France
Геротзиафас Григориос - д.м.н., проф.
119048 Москва, ул. Трубецкая, д. 8, стр. 2; 75020 Париж, Китайская улица, д. 4; 75006 Париж, Улица медицинского факультета, д. 12
П. Ван Дреден
France
Ван Дреден Патрик - д.м.н., проф. Scopus Author ID: 55915955300.
75006 Париж, Улица медицинского факультета, д. 12
А. Д. Макацария
Russian Federation
Макацария Александр Давидович - д.м.н., проф., академик РАН. Scopus Author ID: 57222220144. WoS ResearcherID: M-5660-2016.
119048 Москва, ул. Трубецкая, д. 8, стр. 2
Что уже известно об этой теме?
► Тяжелые формы синдрома гиперстимуляции яичников (СГЯ) рассматриваются в качестве ведущего этиопатогенетического фактора развития тромбоэмболических осложнений при проведении процедур экстракорпорального оплодотворения (ЭКО).
► Наличие наследственных и приобретенных форм тромбофилии, в том числе мутации фактора V Лейден, G20210A протромбина и антифосфолипидного синдрома, ассоциировано с повышенным риском тромбозов при стимуляции овуляции, особенно у пациенток с коморбидным фоном.
► Перенос криоконсервированных эмбрионов сопряжен с существенно меньшим риском венозных тромбоэмболических осложнений по сравнению со свежими циклами ЭКО, что связано с исключением воздействия высоких концентраций эстрогенов и предотвращением развития СГЯ.
Что нового дает статья?
► Впервые акцентировано внимание на роли гипергомоцистеинемии (ГГЦ) как независимого фактора риска венозного тромбоза в циклах ЭКО, что может служить основанием для включения этого маркера в алгоритмы скрининга.
► Обоснована необходимость дифференцированного подхода к тромбопрофилактике с учетом характера стимуляции овуляции, наличия СГЯ и сопутствующих факторов риска, включая тромбофилии и метаболические нарушения.
► Установлена патогенетическая связь между типом переносимого эмбриона (свежий или криоконсервированный) и частотой венозной тромбоэмболии (ВТЭ) в I триместре, особенно в группе женщин с тромбофилией, что позволяет оптимизировать тактику вспомогательных репродуктивных технологий (ВРТ).
Как это может повлиять на клиническую практику в обозримом будущем?
► Внедрение рутинного скрининга на тромбофилию у женщин, планирующих ЭКО, позволит провести стратификацию риска и определить показания к профилактике тромбозов еще до начала гормональной стимуляции.
► Использование процедуры криопереноса у пациенток с высоким тромботическим риском может стать предпочтительной стратегией, позволяя минимизировать вероятность ВТЭ без снижения эффективности программ ЭКО.
► Включение факторов метаболического профиля (ожирение, ГГЦ) в оценку тромботического риска расширит возможности персонализированного подбора тактики ВРТ и профилактических мероприятий.
Рецензия
Для цитирования:
Бицадзе В.О., Хизроева Д.Х., Грандоне Э., Габидуллина Р.И., Третьякова М.В., Макацария Н.А., Гашимова Н.Р., Григорьева К.Н., Воробьев А.В., Лазарчук А.В., Муравьёва М.М., Кренделева А.Г., Полякова Т.Е., Зайнулина М.С., Капанадзе Д.Л., Ягубова Ф.Э., Гри Ж., Элалами И., Геротзиафас Г., Ван Дреден П., Макацария А.Д. Венозные и артериальные тромбозы в программах ВРТ: эпидемиология и превентивные стратегии. Акушерство, Гинекология и Репродукция. 2025;19(3):377-388. https://doi.org/10.17749/2313-7347/ob.gyn.rep.2025.656
For citation:
Bitsadze V.O., Khizroeva J.Kh., Grandone E., Gabidullina R.I., Tretyakova M.V., Makatsariya N.A., Gashimova N.R., Grigoreva K.N., Vorobev A.V., Lazarchuk A.V., Muravyova M.M., Krendeleva A.G., Polyakova T.E., Zainulina M.S., Kapanadze D.L., Yagubova F.E., Gris J., Elalamy I., Gerotziafas G., Van Dreden P., Makatsariya A.D. Venous and arterial thromboses in ART programs: epidemiology and preventive strategies. Obstetrics, Gynecology and Reproduction. 2025;19(3):377-388. (In Russ.) https://doi.org/10.17749/2313-7347/ob.gyn.rep.2025.656
JATS XML

Контент доступен под лицензией Creative Commons Attribution-NonCommercial-ShareAlike 4.0 International License.










































