Перейти к:
Система гемостаза и метастазирование: терапевтический потенциал антикоагулянтов при раке яичников
https://doi.org/10.17749/2313-7347/ob.gyn.rep.2025.644
Аннотация
Цель: провести сравнительный анализ частоты рецидивов эпителиального рака яичников (РЯ) у пациенток, получавших длительную антикоагулянтную терапию (АКТ) в рамках вторичной профилактики тромботических осложнений, и у пациенток, не получавших антикоагулянты.
Материалы и методы. Проведено проспективное интервенционное нерандомизированное сравнительное исследование, включившее 126 пациенток с эпителиальным РЯ III–IV стадии. Основная группа (n = 66) получала длительную АКТ (60–72 месяцев) в рамках вторичной профилактики венозных тромбоэмболических осложнений, группа сравнения (n = 60) антикоагулянты не получала. Обе группы были сопоставимы по возрасту, стадии заболевания и объему противоопухолевого лечения. В качестве препаратов использовались прямые оральные антикоагулянты: дабигатран, ривароксабан и апиксабан. Оценивали частоту рецидивов РЯ и тромботических осложнений.
Результаты. Частота рецидивов в основной группе составила 31,8 % (n = 21), тогда как в группе сравнения – 65 % (n = 39; p < 0,05). Частота тромботических осложнений была сопоставима между группами: 18,2 % против 16,7 % соответственно. Полученные данные свидетельствуют о статистически значимом снижении риска рецидива РЯ при применении длительной АКТ.
Заключение. Длительная АКТ у пациенток с эпителиальным РЯ, проводимая с целью профилактики рецидивирующих тромбозов, может оказывать дополнительное противоопухолевое действие. Выявленное снижение частоты рецидивов подтверждает гипотезу о вовлечении системы гемостаза в механизмы опухолевой инвазии и метастазирования. Необходимы дальнейшие рандомизированные исследования для оценки эффективности антикоагулянтов как потенциальных модификаторов прогрессирования злокачественных новообразований.
Ключевые слова
Для цитирования:
Воробьев А.В., Бицадзе В.О., Хизроева Д.Х., Солопова А.Г., Мамчич Д.М., Мун Э.Д., Блинов Д.В., Гри Ж., Элалами И., Геротзиафас Г., Ван Дреден П., Макацария А.Д. Система гемостаза и метастазирование: терапевтический потенциал антикоагулянтов при раке яичников. Акушерство, Гинекология и Репродукция. 2025;19(3):351-359. https://doi.org/10.17749/2313-7347/ob.gyn.rep.2025.644
For citation:
Vorobev A.V., Bitsadze V.O., Khizroeva J.Kh., Solopova A.G., Mamchich D.M., Mun E.D., Blinov D.V., Gris J., Elalamy I., Gerotziafas G., Van Dreden P., Makatsariya A.D. Haemostasis and metastasis: anticoagulants therapeutic potential in ovarian cancer. Obstetrics, Gynecology and Reproduction. 2025;19(3):351-359. (In Russ.) https://doi.org/10.17749/2313-7347/ob.gyn.rep.2025.644
Введение / Introduction
Злокачественные новообразования (ЗНО) остаются одной из ведущих причин смертности в мире. Особое место среди них занимает распространенный эпителиальный рак яичников (РЯ), характеризующийся высокой агрессивностью, частыми рецидивами и неблагоприятным прогнозом. Согласно данным Всемирной организации здравоохранения (ВОЗ), ежегодно диагностируется более 300 тыс. новых случаев РЯ, причем у значительного числа пациенток заболевание выявляется уже на поздних стадиях [1].
Одним из ключевых видов осложнений для онкологических пациентов является опухоль-ассоциированная венозная тромбоэмболия (ВТЭ). В это понятие включают тромбоэмболию легочной артерии (ТЭЛА), тромбоз глубоких вен нижних конечностей (ТГВ). Данные состояния могут стать решающим фактором в продолжительности жизни пациентов, так как являются частыми причинами смерти у больных с ЗНО [2]. В целом, риск ВТЭ у пациентов с онкологическими заболеваниями в 5–9 раз выше, чем у населения в целом. Помимо прочего, вероятность ВТЭ зависит не только от наличия онкологии, но и от типа опухоли: так, рак поджелудочной железы, лимфома Ходжкина, неходжкинские лимфомы и РЯ ассоциированы с наибольшей частотой тромбозов [3]. При высоком риске ВТЭ должна проводиться профилактика с учетом тромботических и геморрагических событий в каждом индивидуальном случае. Онкологические больные составляют около 20 % среди всех пациентов с ВТЭ [4].
Активация системы гемостаза связана с опухолевым процессом, степень активации коррелирует со стадией онкологического процесса, типом опухоли, что не только повышает риск ВТЭ, но и активно участвует в механизмах прогрессирования опухоли и метастазирования [5–7].
Опухолевые клетки обладают прокоагулянтным действием посредством увеличения количества тромбоцитов и их агрегационной способности, экспрессии тканевого фактора (англ. tissue factor, TF) и P-селектина, которые взаимодействуют с фактором VIIa, инициируя образование тромбина [8–10]. Образование тромбина стимулирует активацию тромбоцитов, что приводит к созданию фибринового матрикса, защищающего опухолевые клетки от иммунной системы и способствующего их распространению по организму. Согласно современным представлениям, активация системы гемостаза может способствовать не только прогрессированию опухолевого процесса, но и формированию микросреды, благоприятной для его роста [11].
Данную гипотезу косвенно подтверждает исследование, проведенное в Японии. В нем авторы наглядно продемонстрировали, что факторы коагуляции, присутствующие в асцитической жидкости и плевральном выпоте, вызывают скопление раковых клеток, а введение гепарина, эдоксабана и аргатробана блокирует кластеризацию клеток. Исследование показало, что скопление раковых клеток связано с фибриногенезом; TF необходим и достаточен для кластеризации клеток, он также необходим для скопления раковых клеток in vivo и метастазирования в брюшную полость [12]. Перечисленные данные подтверждают гипотезу о важности факторов свертывания в развитии онкологического процесса.
Цель: провести сравнительный анализ частоты рецидивов эпителиального РЯ у пациенток, получавших длительную антикоагулянтную терапию (АКТ) в рамках вторичной профилактики тромботических осложнений, и у пациенток, не получавших антикоагулянты.
Материалы и методы/ Material and methods
Дизайн исследования / Study design
Проведено проспективное интервенционное сравнительное нерандомизированное исследование, в выборку вошли 126 пациенток с РЯ III–IV стадии.
Группы пациенток / Patient groups
Основная группа состояла из 66 женщин с РЯ III–IV стадии, которым из-за рецидивирующего тромбоза была назначена длительная АКТ с целью вторичной профилактики ВТЭ. Группа сравнения включала 60 пациенток, не получавших антикоагулянты, сопоставимых по основным характеристикам: стадия заболевания, возраст, вид проводимой противоопухолевой терапии.
Критерии включения и исключения / Inclusion and exclusion criteria
Критерии включения: возраст 18 лет и старше; подтвержденный диагноз РЯ III–IV стадий; добровольное информированное согласие пациентки на участие в исследовании.
Критерии исключения: возраст менее 18 лет; наличие онкогинекологической патологии за пределами заявленных нозологических форм; отказ от участия в исследовании на любом этапе.
Методы исследования / Study methods
Инструментальные и лабораторные исследования включали:
- магнитно-резонансную томографию (МРТ) органов малого таза, компьютерную томографию (КТ) брюшной полости и грудной клетки для оценки распространенности опухолевого процесса и динамики лечения;
- коагулограмму, анализ крови на D-димер и протромбиновый индекс, мониторинг уровня тромбоцитов и гемоглобина.
Терапия / Therapy
Все пациентки проходили стандартное комбинированное лечение:
- неоадъювантную химиотерапию: цисплатин (75 мг/м²) и паклитаксел (175 мг/м²) 3–4 курса;
- хирургическое лечение: циторедуктивные операции, направленные на удаление первичной опухоли, метастазов в малом тазу и большом сальнике;
- послеоперационную химиотерапию: дополнительно проведены 3–6 курсов полихимиотерапии.
Пациенткам основной группы (n = 66), у которых в ходе противоопухолевого лечения были зафиксированы эпизоды рецидивирующей ВТЭ, была назначена длительная АКТ, направленная на профилактику рецидивов тромбозов. Продолжительность приема антикоагулянтов составила от 60 до 72 месяцев, что соответствует современным принципам вторичной профилактики ВТЭ у онкологических пациенток с рецидивирующими тромбозами [13–15]. Подбор антикоагулянта осуществлялся индивидуально, с учетом функционального состояния почек, общего клинического профиля и лабораторных параметров, включая уровень D-димера, служивший ориентиром для оценки остаточной гиперкоагуляции и мониторинга эффективности терапии. В качестве средств профилактики использовались препараты из группы прямых оральных антикоагулянтов (ПОАК): дабигатран (селективный ингибитор тромбина) в дозе 50 мг дважды в сутки после оценки клиренса креатинина; ривароксабан (ингибитор фактора Ха) – 10 мг один раз в сутки; апиксабан (ингибитор фактора Ха) – по 2,5 мг дважды в сутки. При выявлении повышения уровня D-димера, появлении клинических симптомов тромботических осложнений или признаков геморрагий проводилась оценка состояния пациентки с возможной корректировкой дозировки антикоагулянта, либо его временной отменой. Такая тактика обеспечивала индивидуализированный подход к управлению тромботическим риском в условиях продолжительной АКТ.
Статистический анализ / Statistical analysis
Данные пациенток вносились в электронную таблицу Microsoft Office Excel 2013 (Microsoft, США). Статистическая обработка результатов исследования осуществлялась с помощью программы Statistica 10 (StatSoft Inc., США). Для проверки статистической значимости факторов с учетом небольшого объема выборки использовали U-критерий Манна–Уитни с проверкой нормальности распределения по критерию Шапиро–Уилка; значение p ≤ 0,05 свидетельствовало о наличии статистически значимых различий, р > 0,05 – об отсутствии статистических различий.
Результаты / Results
В основной группе, включавшей 66 пациенток, которым была назначена АКТ в рамках вторичной профилактики ВТЭ, рецидив опухоли в течение периода наблюдения был зафиксирован у 21 (31,8 %) женщины; в группе сравнения, включавшей 60 пациенток со схожими клинико-прогностическими характеристиками, но не получавших антикоагулянты, частота рецидивов выявлена у 39 пациенток (66 %), почти в 2 раза превышая соответствующий показатель в основной группе (рис. 1).
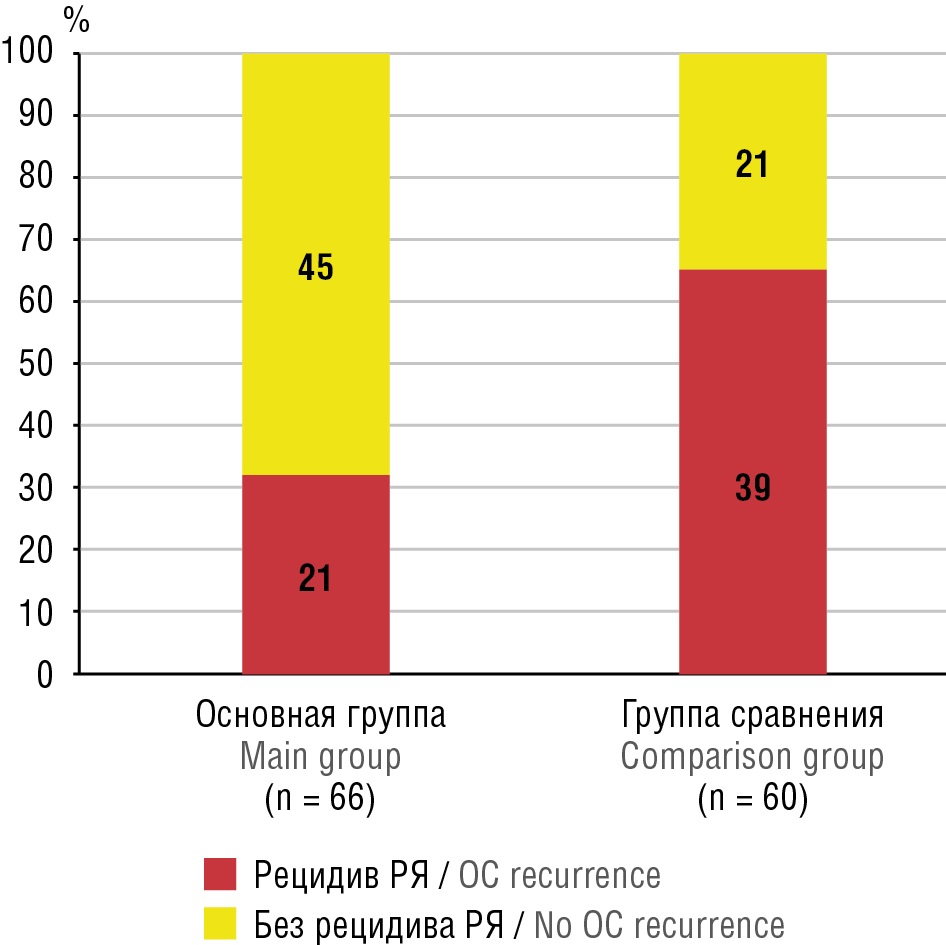
Рисунок 1. Частота рецидивов рака яичника (РЯ) в ходе длительного наблюдения.
Figure 1. Recurrence rate of ovarian cancer (OC) and bleeding during long-term follow-up.
Таким образом, было продемонстрировано статистически (p < 0,05) и клинически значимое различие в частоте рецидивов эпителиального РЯ между пациентками, получавшими длительную АКТ, и теми, кто не получал антикоагулянтов.
Дополнительно была проведена оценка частоты тромботических осложнений в обеих группах. В основной группе тромбозы были зарегистрированы у 12 (18,2 %) пациенток: ТГВ – у 8 (12,1 %), ТЭЛА – у 4 (6,1 %), тогда как в группе сравнения – у 10 (16,7 %) пациенток: ТГВ – у 7 (11,7 %), ТЭЛА – у 3 (5,0 %). Таким образом, несмотря на сравнимую частоту тромботических событий среди пациенток, получавших АКТ, применение данной стратегии сопровождалось выраженным снижением частоты рецидивов опухолевого процесса.
Полученные результаты позволяют предположить, что длительная АКТ с целью профилактики повторных тромбозов может оказывать дополнительное противоопухолевое действие, снижая вероятность метастазирования и рецидива заболевания. Данный эффект, вероятно, обусловлен вмешательством в патогенетические механизмы прогрессирования опухоли, включая торможение тромбинопосредованной инвазии, подавление кластеризации опухолевых клеток и разрушение фибринового матрикса, способствующего их миграции и защите от иммунного надзора.
Обсуждение / Discussion
Рецидивирование эпителиального РЯ представляет собой сложный многоэтапный процесс, в котором участвуют как сами опухолевые клетки, так и компоненты микроокружения, включая систему гемостаза. На фоне опухолевой прогрессии активируются молекулярные механизмы, способствующие инвазии, ангиогенезу и формированию благоприятной среды для имплантации и диссеминации клеток. В последние годы внимание исследователей все больше привлекает потенциальная роль системы свертывания крови в этих процессах. Тромбин, фибрин, тромбоциты и их медиаторы не только участвуют в формировании тромботических осложнений, но и создают механический барьер, защищающий опухолевые клетки от иммунного надзора и способствующий их транспортировке. В этом контексте все более актуальным становится изучение АКТ не только как средства профилактики ВТЭ, но и как возможного модификатора метастатического потенциала опухоли.
Было показано, что частота рецидивирования эпителиального РЯ за двухлетний период наблюдения составила 51,4 % среди пациенток, достигших ремиссии после первичного лечения [16]. Наиболее выраженное влияние на частоту рецидивов оказали стадия согласно классификации Международной федерации гинекологов и акушеров (англ. International Federation of Gynecology and Obstetrics, FIGO) и объем остаточной опухоли после циторедуктивной операции. У пациенток с опухолевыми остатками > 2 см риск рецидива был выше в 2,15 раза по сравнению с теми, у кого резидуальная опухоль составляла < 2 см. Аналогично, риск рецидива у пациенток с распространенными стадиями заболевания (FIGO III–IV) был выше в 2,44 раза по сравнению с ранними стадиями. При этом двухлетняя безрецидивная выживаемость на стадии I составляла 62,8 %, на стадии II – 34,1 %, на стадии III – 18,2 %, а на стадии IV рецидив развился у всех пациенток в течение первых 7 месяцев наблюдения.
Анализ ретроспективного исследования, проведенного в Индии, показал, что у большинства пациенток с рецидивом эпителиального РЯ заболевание изначально диагностировалось на поздних стадиях (III–IV), что обусловливало высокую частоту повторного прогрессирования [17]. Авторы подчеркивают, что несмотря на применение стандартных режимов химиотерапии, ограниченность доступа к современным таргетным препаратам и невозможность выполнения вторичной циторедукции могли отрицательно повлиять на выживаемость пациенток.
Полученные данные свидетельствуют, что АКТ у пациенток с эпителиальным РЯ может снижать риск рецидива, что позволяет рассматривать ее не только как средство профилактики ВТЭ, но и как потенциальный модификатор биологических механизмов прогрессии и метастазирования опухоли. В нашем исследовании частота рецидива у пациенток, получавших АКТ, составила 31,8 %, тогда как в группе без АКТ – 65,0 % (p < 0,05), что свидетельствует в пользу гипотезы о возможности влияния антикоагулянтов на процессы метастазирования и прогрессирования рака. Некоторые исследования показывают, что использование низкомолекулярных гепаринов (НМГ) и ПОАК способствует уменьшению активности тромбина и предотвращению образования микрокластеров, состоящих из тромбоцитов и опухолевых клеток. Особое значение имеет предотвращение активации Р-селектина, который способствует адгезии клеток к эндотелию сосудов. Применение антикоагулянтов снижает уровень Р-селектина и других проинвазивных молекул, что приводит к уменьшению вероятности инвазии и метастазирования.
Проведенные ранее исследования редко рассматривали АКТ как способ профилактики метастазирования и распространения онкологического заболевания. В основном антикоагулянты использовались в целях борьбы с осложнениями, вызванными химиолучевой терапией и оперативным лечением, а также ВТЭ. Споры об эффективности АКТ в качестве противоопухолевого средства ведутся достаточно длительное время. В настоящее время существуют исследования, которые доказывают наличие противоракового действия у антикоагулянтов. Систематический обзор 2024 г. проанализировал 135 исследований, в которых проверяли противоопухолевые свойства новых оральных антикоагулянтов (НОАК), варфарина, гепарина и его производных [18]. После анализа данных авторы указали, что из 12 исследований только в 4 дабигатран подавлял рост опухоли, а в остальных не оказывал никакого эффекта. Касаемо влияния на метастазирование, дабигатран также дал неоднозначные результаты. В одном исследовании не наблюдалось никакого эффекта, а в другом он уменьшил метастазирование. Ривароксабан оказал влияние на рост опухоли и процесс метастазирования только в случае фибросаркомы. Во всех остальных случаях не наблюдалось никакой динамики.
В свою очередь варфарин оценивался в 20 исследованиях. Препарат тестировался на различных видах раковых клеток на моделях мышей (18 исследований) и человеческих клетках (2 исследования). Анализ результатов исследования выявил, что варфарин снижал рост опухоли только у раковой линии клеток саркомы, нейробластомы, карциномы легких у мышей и двух видов рака поджелудочной железы человека. В остальных видах опухолей никакого влияния на рост не наблюдалось, но в 14 исследованиях продемонстрировано подавление метастазирования [18].
Касательно гепарина и его производных: тинзапарин оказался более эффективным, чем другие НМГ, в плане замедления роста опухоли и метастазирования. В 10 из 24 исследований тинзапарин снизил рост опухоли и в 12 из 24 – метастазирование. Надропарин и фраксипарин не влияли на рост опухоли, а далтепарин и эноксапарин показали неоднозначные результаты в плане замедления роста опухоли. С другой стороны, производные гепарина, не обладающие антикоагулянтными свойствами, показали многообещающие противораковые свойства, в частности сульфатированный неантикоагулянтный гепарин. Данный препарат снизил рост опухоли в 4 из 8 исследований и в 5 из 8 исследований сократил процесс метастазирования [18].
Систематический обзор, проведенный в 2020 г., оценивал противоопухолевый эффект ПОАК (ксимелагатран, дабигатран, этексилат и ривароксабан) [19]. Авторы включили в анализ 9 исследований, в которых было проведено в общей сложности 19 экспериментов на животных (мышах и крысах). Результаты оказались неоднозначны: лечение ПОАК снизило рост опухоли в месте имплантации и в месте метастазирования в 18,8 и 20,0 % экспериментов соответственно. В другом ряде наблюдений, наоборот, НОАК усилили рост опухоли в месте имплантации и в месте метастазирования в 6,3 и 20,0 % экспериментов соответственно. Причиной таких разных результатов исследований была совокупность факторов: вид исследуемого рака, время от введения мышам раковых клеток до начала АКТ, корм мышей, геморрагические осложнения на фоне воздействия препаратов. Итоговый вывод систематического обзора указал, что монотерапия НОАК привела к неопластическим изменениям в исследовании канцерогенности у крыс, показала отсутствие эффекта в моделях ксенотрансплантации у мышей, в то время как влияние на рост и метастазирование рака в сингенных моделях у мышей зависело от времени начала лечения НОАК (1–14-й день после введения раковых клеток в организм мыши) и типа используемой модели рака.
В исследовании, проведенном китайскими специалистами, показана значимая роль тромбина в прогрессировании онкологического процесса. Помимо этого в эксперименте они выявили, что ингибирование тромбина подавляет миграцию клеток, их инвазию и ангиогенез, а прямые ингибиторы тромбина обладают противоинвазивными и противометастатическими свойствами в модели рака легких у мышей [7].
Ограничения исследования / Study limitations
Ограничениями настоящего исследования являются его нерандомизированный характер и ограниченный размер выборки, что требует осторожности при интерпретации полученных результатов. Тем не менее выявленная разница в частоте рецидивов позволяет предполагать клиническую значимость вмешательства и требует дальнейшего изучения в рамках проспективных контролируемых исследований. Использование антикоагулянтов может рассматриваться не только как профилактика тромботических осложнений, но и как возможный способ ингибирования механизмов метастазирования за счет предотвращения образования тромбоцитарных микрокластеров вокруг опухолевых клеток и снижения пролиферативной активности клеток опухоли.
Заключение / Conclusion
Полученные в ходе проведенного исследования данные позволяют расширить представления о потенциальной роли АКТ в комплексном лечении эпителиального РЯ. Длительное применение антикоагулянтов у пациенток с высоким риском тромботических осложнений, назначенное с целью вторичной профилактики ВТЭ, ассоциировалось с достоверным снижением частоты рецидивов по сравнению с группой, не получавшей АКТ. Несмотря на сопоставимую частоту тромботических событий в обеих группах, продемонстрированный эффект позволяет предполагать, что антикоагулянты, помимо своей основной профилактической функции, могут оказывать влияние на биологическое поведение опухоли. Обнаруженное различие в частоте рецидивов подтверждает актуальность гипотезы о вовлеченности факторов свертывания в процессы опухолевой инвазии, метастазирования и формирования фибринового матрикса и опухолевого микроокружения. Полученные результаты согласуются с экспериментальными и клиническими данными о возможном противоопухолевом потенциале препаратов, воздействующих на систему гемостаза. Вместе с тем, учитывая ограничения дизайна настоящего исследования, в частности нерандомизированный характер и ограниченный объем выборки, необходимы дальнейшие многоцентровые проспективные исследования для верификации полученных выводов и оценки целесообразности включения АКТ в протоколы противоопухолевого лечения с позиции не только тромбопрофилактики, но и модификации риска прогрессирования заболевания.
Список литературы
1. Sung H., Ferlay J., Siegel R.L. at al. Global Cancer Statistics 2020: GLOBOCAN Estimates of incidence and mortality worldwide for 36 cancers in 185 countries. CA Cancer J Clin. 2021;71(3):209–49. https://doi.org/10.3322/caac.21660
2. Бредихин Р.А., Ахметзянов Р.В., Хайруллин Р.Н. Расширение возможностей лечения и профилактики венозных тромбоэмболических осложнений у пациентов с онкологическими заболеваниями. Роль пероральных антикоагулянтов. Клиницист. 2022;16(2):17–26. https://doi.org/10.17650/1818-8338-2022-16-2-К667.
3. Mulder F.I., Horváth-Puhó E., van Es N. et al. Venous thromboembolism in cancer patients: a population-based cohort study. Blood. 2021;137(14):1959–69. https://doi.org/10.1182/blood.2020007338.
4. Streiff M.B. Thrombosis in the setting of cancer. Hematology Am Soc Hematol Educ Program. 2016;2016(1):196–205. https://doi.org/10.1182/asheducation-2016.1.196.
5. Guo J., Gao Y., Gong Z. et al. Plasma D-dimer level correlates with age, metastasis, recurrence, tumor-node-metastasis classification (TNM), and treatment of non-small-cell lung cancer (NSCLC) patients. Biomed Res Int. 2021;2021:9623571. https://doi.org/10.1155/2021/9623571.
6. Hisada Y., Mackman N. Tissue factor and cancer: regulation, tumor growth and metastasis. Semin Thromb Hemost. 2019;45(4):385–95. https://doi.org/10.1055/s-0039-1687894.
7. Zhao B., Wu M., Hu Z. et al. A novel oncotherapy strategy: direct thrombin inhibitors suppress progression, dissemination and spontaneous metastasis in non-small cell lung cancer. Br J Pharmacol. 2022;179(22):5056–73. https://doi.org/10.1111/bph.15384.
8. Hisada Y., Mackman N. Cancer-associated pathways and biomarkers of venous thrombosis. Blood. 2017;130(13):1499–506. https://doi.org/10.1182/blood-2017-03-743211.
9. Слуханчук Е.В., Бицадзе В.О., Хизроева Д.Х. и др. Тромбоциты, тромбовоспаление и онкологический процесс. Акушерство, Гинекология и Репродукция. 2021;15(6):755–76. https://doi.org/10.17749/2313-7347/ob.gyn.rep.2021.274.
10. Stone R.L., Nick A.M., McNeish I.A. et al. Paraneoplastic thrombocytosis in ovarian cancer. N Engl J Med. 2012;366(7):610–8. https://doi.org/10.1056/NEJMoa1110352.
11. Zhou L., Zhang Z., Tian Y. et al. The critical role of platelet in cancer progression and metastasis. Eur J Med Res. 2023;28(1):385. https://doi.org/10.1186/s40001-023-01342-w.
12. Miyazaki M., Nakabo A., Nagano Y. et al. Tissue factor-induced fibrinogenesis mediates cancer cell clustering and multiclonal peritoneal metastasis. Cancer Lett. 2023;553:215983. https://doi.org/10.1016/j.canlet.2022.215983.
13. Cohen A.T., Hamilton M., Mitchell S.A. et al. Comparison of the novel oral anticoagulants apixaban, dabigatran, edoxaban, and rivaroxaban in the initial and long-term treatment and prevention of venous thrombo-embolism: systematic review and network meta-analysis. PLoS One. 2015;10(12):e0144856. https://doi.org/10.1371/journal.pone.0144856.
14. Farge D., Frere C., Connors J.M. et al.; International Initiative on Thrombosis and Cancer (ITAC) advisory panel. 2022 international clinical practice guidelines for the treatment and prophylaxis of venous thromboembolism in patients with cancer, including patients with COVID-19. Lancet Oncol. 2022;23(7):e334–e347. https://doi.org/10.1016/S1470-2045(22)00160-7.
15. Key N.S., Khorana A.A., Kuderer N.M. et al. Venous thromboembolism prophylaxis and treatment in patients with cancer: ASCO Guideline Update. J Clin Oncol. 2023;41(16):3063–71. https://doi.org/10.1200/JCO.23.00294.
16. Kurube I., Ambari E., Iskandar T. et al. Factors associated with recurrence of epithelial ovarian cancer In RSUP Dr. Kariadi Semarang. DIMJ. 2022;3(2):74–80. https://doi.org/10.14710/dimj.v3i2.15448.
17. Joy J., Kumar J., Kumar S., Arshad M. Clinical profiles and survival outcomes of patients with relapsed ovarian cancer: a single-center study. Cureus. 2024;16(11):e74724. https://doi.org/10.7759/cureus.74724.
18. Al-Azzawi H.M.A., Hamza S.A., Paolini R. et al. Towards an emerging role for anticoagulants in cancer therapy: a systematic review and meta-analysis. Front Oral Health. 2024;5:1495942. https://doi.org/10.3389/froh.2024.1495942.
19. Najidh S., Versteeg H.H., Buijs J.T. A systematic review on the effects of direct oral anticoagulants on cancer growth and metastasis in animal models. Thromb Res. 2020;187:18–27. https://doi.org/10.1016/j.thromres.2019.12.022.
Об авторах
А. В. ВоробьевРоссия
Воробьев Александр Викторович - к.м.н. Scopus Author ID: 57191966265.
119048 Москва, ул. Трубецкая, д. 8, стр. 2
В. О. Бицадзе
Россия
Бицадзе Виктория Омаровна - д.м.н., проф., профессор РАН. Scopus Author ID: 6506003478. WoS ResearcherID: F-8409-2017.
119048 Москва, ул. Трубецкая, д. 8, стр. 2
Д. Х. Хизроева
Россия
Хизроева Джамиля Хизриевна - д.м.н., проф. Scopus Author ID: 57194547147. WoS ResearcherID: F-8384-2017.
119048 Москва, ул. Трубецкая, д. 8, стр. 2
А. Г. Солопова
Россия
Солопова Антонина Григорьевна - д.м.н., проф. Scopus Author ID: 6505479504. WoS ResearcherID: Q-1385-2015.
119048 Москва, ул. Трубецкая, д. 8, стр. 2
Д. М. Мамчич
Россия
Мамчич Дарья Михайловна
119048 Москва, ул. Трубецкая, д. 8, стр. 2
Э. Д. Мун
Россия
Мун Эмма Денисовна
117513 Москва, ул. Островитянова, д. 1
Д. В. Блинов
Россия
Блинов Дмитрий Владиславович - к.м.н. Scopus Author ID: 6701744871. WoS ResearcherID: E-8906-2017.
101000 Москва, Лялин переулок, д. 11–13/1; 123056 Москва, 2-я Брестская ул., д. 5, с. 1–1а; 141551 Московская область, деревня Голубое, Родниковая ул., стр. 6, к. 1
Ж.-К. Гри
Франция
Гри Жан-Кристоф - д.м.н., проф. Scopus Author ID: 7005114260. WoS ResearcherID: AAA-2923-2019.
119048 Москва, ул. Трубецкая, д. 8, стр. 2; 34090 Монпелье, ул. Огюста Бруссоне, д. 163
И. Элалами
Франция
Элалами Исмаил - д.м.н., проф. Scopus Author ID: 7003652413. WoS ResearcherID: AAC-9695-2019
119048 Москва, ул. Трубецкая, д. 8, стр. 2; 75006 Париж, Улица медицинского факультета, д. 12; 75020 Париж, Китайская улица, д. 4
Г. Геротзиафас
Франция
Геротзиафас Григориос - д.м.н., проф.
119048 Москва, ул. Трубецкая, д. 8, стр. 2; 75006 Париж, Улица медицинского факультета, д. 12; 75020 Париж, Китайская улица, д. 4
П. Ван Дреден
Франция
Ван Дреден Патрик - д.м.н., проф. Scopus Author ID: 55915955300.
119048 Москва, ул. Трубецкая, д. 8, стр. 2; 75006 Париж, Улица медицинского факультета, д. 12
А. Д. Макацария
Россия
Макацария Александр Давидович - д.м.н., проф., академик РАН. Scopus Author ID: 57222220144. WoS ResearcherID: M-5660-2016.
119048 Москва, ул. Трубецкая, д. 8, стр. 2
Что уже известно об этой теме?
► Активация системы гемостаза способствует росту и метастазированию опухоли за счет образования фибринового матрикса, активации тромбоцитов и защиты опухолевых клеток от иммунной системы.
► Венозная тромбоэмболия у онкологических пациентов ассоциирована с более агрессивным течением опухоли и повышенным риском рецидива.
► Некоторые антикоагулянты демонстрируют противоопухолевую активность в доклинических моделях, влияя на ангиогенез, инвазию и миграцию опухолевых клеток.
Что нового дает статья?
► Впервые на клиническом материале показано, что эффективность антикоагулянтов может проявляться не только в профилактике тромбозов, но и в снижении частоты рецидивов при длительном применении.
► Ставится под вопрос традиционная парадигма использования антикоагулянтов в онкологической практике с акцентом на их потенциальный противоопухолевой эффект в рамках адъювантной терапии.
► Подтверждена потенциальная роль антикоагулянтов как модификаторов опухолевого микроокружения и метастазирования у пациенток с распространенным раком яичников.
Как это может повлиять на клиническую практику в обозримом будущем?
► Результаты исследования могут способствовать расширению показаний к длительной антикоагулянтной терапии у пациенток с раком яичников, особенно при высоком риске тромботических осложнений и опухолевого прогрессирования.
► Работа может стимулировать внедрение проспективного мониторинга влияния антикоагулянтов на частоту рецидивов и формирование опухолевого микроокружения в рамках клинических протоколов.
► Исследование открывает перспективу пересмотра роли антикоагулянтов как возможных модификаторов течения злокачественного процесса, что может изменить подход к ведению пациенток с распространенными стадиями заболевания.
Рецензия
Для цитирования:
Воробьев А.В., Бицадзе В.О., Хизроева Д.Х., Солопова А.Г., Мамчич Д.М., Мун Э.Д., Блинов Д.В., Гри Ж., Элалами И., Геротзиафас Г., Ван Дреден П., Макацария А.Д. Система гемостаза и метастазирование: терапевтический потенциал антикоагулянтов при раке яичников. Акушерство, Гинекология и Репродукция. 2025;19(3):351-359. https://doi.org/10.17749/2313-7347/ob.gyn.rep.2025.644
For citation:
Vorobev A.V., Bitsadze V.O., Khizroeva J.Kh., Solopova A.G., Mamchich D.M., Mun E.D., Blinov D.V., Gris J., Elalamy I., Gerotziafas G., Van Dreden P., Makatsariya A.D. Haemostasis and metastasis: anticoagulants therapeutic potential in ovarian cancer. Obstetrics, Gynecology and Reproduction. 2025;19(3):351-359. (In Russ.) https://doi.org/10.17749/2313-7347/ob.gyn.rep.2025.644

Контент доступен под лицензией Creative Commons Attribution-NonCommercial-ShareAlike 4.0 International License.











































