Перейти к:
Фетальный синдром системного воспалительного ответа, тромбовоспаление и неонатальный септический шок: патогенез, диагностика и лечение
https://doi.org/10.17749/2313-7347/ob.gyn.rep.2025.619
Аннотация
Статья посвящена патогенетическим механизмам, диагностическим критериям и лечению синдрома системного воспалительного ответа (ССВО), тромбовоспаления и септического шока у плодов и новорожденных. ССВО в современном контексте рассматривается как гиперреакция организма на внешний стресс, во время которой происходит нарушение баланса между воспалением и адаптивными механизмами, с участием биологически активных молекул, цитокинов, например, факторa некроза опухоли альфа (англ. tumor necrosis factor-alpha, TNF-α) и интерлейкина (англ. interleukin, IL) IL-1. Особое внимание уделяется синдрому воспалительного ответа плода (англ. fetal inflammatory response syndrome, FIRS). В статье описано широкое воздействие FIRS на жизненно важные органы и системы, которые поражаются в результате данного состояния. Обсуждаются трудности диагностики и лечения септического шока у новорожденных, подчеркивается взаимосвязь воспаления и системы гемостаза. Несмотря на прогресс в понимании молекулярных механизмов развития FIRS и сепсиса, на сегодняшний день до сих пор наблюдаются проблемы в разработке эффективных терапевтических стратегий. Это подчеркивает необходимость целенаправленных исследований для снижения заболеваемости и смертности, связанных с тромбовоспалением и септическим шоком.
Ключевые слова
Для цитирования:
Бицадзе В.О., Хизроева Д.Х., Третьякова М.В., Макацария Н.А., Габидуллина Р.И., Мостовой А.В., Карпова А.Л., Войновский А.Е., Новосатрян М.Г., Лазарчук А.В., Хисамиева А.Р., Татаринцева А.Ю., Воробьев А.В., Агасян К.В., Капанадзе Д.Л., Зайнулина М.С., Серов В.Н., Блинов Д.В., Гри Ж., Ван Дреден П., Элалами И., Геротзиафас Г., Макацария А.Д. Фетальный синдром системного воспалительного ответа, тромбовоспаление и неонатальный септический шок: патогенез, диагностика и лечение. Акушерство, Гинекология и Репродукция. 2025;19(2):250-272. https://doi.org/10.17749/2313-7347/ob.gyn.rep.2025.619
For citation:
Bitsadze V.O., Khizroeva J.Kh., Tretyakova M.V., Makatsariya N.A., Gabidullina R.I., Mostovoi A.V., Karpova A.L., Voynovskiy A.E., Novosartyan M.G., Lazarchuk A.V., Khisamieva A.R., Tatarintseva A.Yu., Vorobev A.V., Agasyan K.V., Kapanadze D.L., Zainulina M.S., Serov V.N., Blinov D.V., Gris J., Van Dreden P., Elalamy I., Gerotziafas G., Makatsariya A.D. Fetal systemic inflammatory response syndrome, thromboinflammation and neonatal septic shock: pathogenesis, diagnostics and treatment. Obstetrics, Gynecology and Reproduction. 2025;19(2):250-272. (In Russ.) https://doi.org/10.17749/2313-7347/ob.gyn.rep.2025.619
Введение / Introduction
Синдром системного воспалительного ответа (ССВО) и септический шок (СШ) являются одними из наиболее серьезных и жизнеугрожающих состояний в перинатальной медицине. Эти патологические процессы связаны с гиперактивацией иммунной системы, нарушением баланса между воспалением и гемостазом, что приводит к развитию полиорганной недостаточности (ПОН) и высокой смертности.
Одним из ключевых аспектов данной проблемы является синдром воспалительного ответа плода (англ. fetal inflammatory response syndrome, FIRS), который развивается в ответ на внутриутробное инфицирование и сопровождается активацией провоспалительных цитокинов. Этот процесс оказывает разрушительное влияние на жизненно важные органы плода, включая нервную, дыхательную и сердечно-сосудистую системы.
Несмотря на значительный прогресс в понимании молекулярных механизмов воспаления и коагуляции, диагностика и лечение FIRS и неонатального СШ остаются сложными задачами. Современные методы диагностики не всегда позволяют своевременно выявить угрожающее состояние, что затрудняет раннее начало терапии. Кроме того, отсутствуют универсальные подходы к лечению СШ у новорожденных, что требует разработки персонализированных стратегий терапии.
Синдром системного воспалительного ответа, тромбовоспаление и септический шок у плодов и новорожденных / Systemic inflammatory response syndrome and septic shock in fetuses and newborns
Открытие модели сепсиса и СШ принадлежит двум великим врачам и ученым – Джузеппе Санарелли и Григорию Шварцману, которые изучали реакцию орагнизма на токсины бактерий, а именно, Salmonella typhosus. Феномен Санарелли–Шварцмана представляет собой локализованную или генерализованную реакцию организма на эндотоксины, приводящую к тромбозу и последующему некрозу пораженных тканей. Различные состояния, такие как ССВО, СШ, гемолитико-уремический синдром и синдром Уотерхауса–Фридериксена можно рассматривать как проявления феномена Санарелли-Шварцмана. В основе данного процесса лежит активация системы свертывания крови, что вызывает коагулопатию потребления и внутрисосудистую коагуляцию в микрососудистом русле. В 2020 г. имена Григория Шварцмана и Джузеппе Санарелли снова приобрели известность в научном сообществе в связи с пандемией COVID-19 [1].
Синдром системного воспалительного ответа определяется как чрезмерная реакция организма на внешний стрессовый фактор, например, воспаление в результате инфекции, хирургического вмешательства или онкологического заболевания [2]. Регуляция ответной реакции организма должна эффективно подавлять причину воспаления, однако при развитии ССВО происходит нарушение равновесия между воспалительными и адаптивными противовоспалительными механизмами [3]. Основные диагностические критерии ССВО представлены в таблице 1. Наличие 2 и более критериев свидетельствует о развитии ССВО [4].
Таблица 1. Критерии диагностики синдрома системного воспалительного ответа [4].
Table 1. Criteria for diagnosing systemic inflammatory response syndrome [4].
|
Критерий / Criteria |
Значение / Value |
|
Температура тела Body temperature |
> 38,5 °C или < 36,0 °C > 38.5 °C or < 36.0 °C |
|
Частота сердечных сокращений Heart rate |
Тахикардия ≥ 90 уд/мин, либо брадикардия у детей младше 1 года ниже 10-го перцентиля Tachycardia ≥ 90 bpm or bradycardia in children under 1 year below the 10th percentile |
|
Частота дыхательных движений Respiratory rate |
≥ 20 в минуту или гипервентиляция с содержанием диоксида углерода в крови ≤ 32 мм рт. ст. ≥ 20 per minute or hyperventilation with blood carbon dioxide level ≤ 32 mm Hg |
|
Количество лейкоцитов Leukocyte сount |
Лейкоцитоз или лейкопения или смещение лейкоцитарной формулы влево Leukocytosis or leukopenia or WBC left shift |
В патогенезе ССВО ключевую роль играет продукция провоспалительных цитокинов, таких как фактор некроза опухоли альфа (англ. tumor necrosis factor-alpha, TNF-α) и интерлейкины (англ. interleukin, IL) IL-1, IL-6, IL-8, IL-10, которые распространяются за пределы первичного очага воспаления. Также важным этапом патогенеза является развитие дисфункции эндотелия, которая происходит за счет продукции тканевого фактора (англ. tissue factor, TF). TF в свою очередь активируется TNF-α и IL-1. Возникает системное нарушение гемостаза, связанное с воздействием на эндотелий и дисбалансом между процессами свертывания крови и фибринолизом, что проявляется чрезмерным тромбообразованием, нарушением микроциркуляции и ПОН. Цитокины также стимулируют сигнальные пути MAPK/NF-κB (англ. mitogen-activated protein kinase/nuclear factor kappa B) в эндотелиальных клетках, что способствует увеличению синтеза и высвобождения факторов, усиливающих свертывание крови [5].
Синдром системного воспалительного ответа плода тесно связан с инфекционно-воспалительными изменениями в плаценте. Большое разнообразие микроорганизмов, которые могут инфицировать плод, а также необходимость применения разных способов их диагностики затрудняет верификацию возбудителя, особенно у новорожденных детей высокой степени риска. В некоторых исследованиях было продемонстрировано, что наличие внутриматочной инфекции во время беременности, независимо от наличия клинических проявлений инфекции в неонатальном периоде, сопряжено с высоким риском развития у детей серьезных отдаленных последствий, включая экссудативный средний отит и нейро-эндокринно-иммунный дисбаланс [6][7]. Поэтому определенный интерес представляет рассмотрение проблемы внутриутробного инфицирования с позиции FIRS, так как несмотря на высокий уровень заболеваемости и смертности, отсутствуют убедительные данные о ранней диагностике и способах эффективного лечения данной патологии.
Хотя молекулярные механизмы FIRS остаются недостаточно изученными, было предложено классифицировать этот синдром на 2 типа в зависимости от особенностей воспалительного ответа. Для FIRS 1-го типа характерно увеличение содержания IL-6, IL-8, CXCL10 (англ. C-X-C motif chemokine ligand 10; хемокин, уровень которого повышается в околоплодных водах у пациентов с хроническим хориоамнионитом), IL-1β и TNF-α по сравнению со здоровыми новорожденными. Кроме того, при этом типе наблюдаются специфические изменения в экспрессии генов, что приводит к угнетению Т-клеточной иммунорегуляции [8]. Одним из объяснений такого ответа является инволюция тимуса, часто встречающаяся у новорожденных с острым воспалением [9].
В исследовании Z. Straňák с соавт., основанном на анализе пуповинной крови 100 недоношенных детей, была выявлена связь между наличием FIRS и повышенными уровнями IL-6, С-реактивного белка (СРБ) и прокальцитонина. FIRS 1-го типа сопровождался материнским лейкоцитозом (р < 0,001), преждевременным разрывом плодных оболочек (ПРПО) (р < 0,001) и гипертонусом матки (р < 0,0001) [10].
В случае FIRS 2-го типа острый воспалительный ответ отсутствует. Однако были зафиксированы изменения в регуляции генов гистосовместимости человека (англ. Human Leukocyte Antigens, HLA) HLA-F, HLA-C и HLA-DRA, а также значительное увеличение уровня CXCL10 при нормальных показателях провоспалительных цитокинов, что напоминает механизмы реакции отторжения трансплантата [11].
Полиорганное поражение при FIRS / Multiple organ failure in FIRS
Основой FIRS является воспалительная реакция матери (англ. maternal inflammatory response, MIR), которая включает в себя острый субхорионит, воспаление плаценты и внеплацентарных оболочек. У пациентов с FIRS 2-го типа могут отсутствовать воспалительная реакция плода (англ. fetal inflammatory response, FIR) и матери (MIR), что не отменяет вероятности последующих неонатальных осложнений [12].
При FIRS у плода появляются признаки поражения многих органов и систем организма. Чаще всего в патологический процесс вовлечены кровеносная система, легкие, центральная нервная система (ЦНС), тимус, селезенка и почки.
Нейтрофилы являются основным компонентом врожденной иммунной системы. У плодов с FIRS чаще наблюдалось повышенное содержание нейтрофилов в крови больше 95-го перцентиля для гестационного возраста – 71 % (30/42) vs. 35 % (37/105) (p < 0,001) [13]. Гранулоцитарный колониестимулирующий фактор (англ. granulocyte colony-stimulating factor, G-CSF) приводит к продукции различных клеток, в том числе нейтрофилов, макрофагов, эозинофилов, Т-хелперов (англ. T-helper cells, Th) Th1 и Th17, а также клеток некоторых типов опухолей [14][15]. Также G-CSF ведет к высвобождению нейтрофилов. В исследовании Т. Chaiworapongsa с соавт. выявили, что уровень G-CSF у плодов с FIRS значительно выше, чем в группе контроля (p < 0,001), и концентрация G-CSF в плазме плода ≥ 134 пг/мл являлась значимым предиктором хориоамнионита, инфекции и совокупной неонатальной заболеваемости и смертности [16]. При FIRS также наблюдается повышение количества ядросодержащих эритроцитов, которые относятся к незрелым формам. Повышенное количество неонатальных ядросодержащих эритроцитов было зарегистрировано у пациентов с длительным разрывом плодных оболочек (> 24 часов), гистологически подтвержденным хориоамнионитом и неонатальным сепсисом с ранним началом, что свидетельствует об усилении эритропоэза [17][18]. Циркуляция ядросодержащих эритроцитов чаще рассматривается как предиктор гипоксии; однако при FIRS у плодов не было отмечено ацидоза и гипоксемии, а показатели pH (–0,026 и –0,016), парциальное давление кислорода в артериальной крови PaO2 (0,25 и 5,9 мм рт. ст.) и ВЕ (–2,4 и –2,6 ммоль/л) не отличались от таковых у плодов без FIRS (p < 0,05) [19].
В исследовании G.C. Zaharie с соавт. была проанализирована динамика концентрации ключевых провоспалительных цитокинов в плазме на первый и третий день жизни, а также выявлена связь между их уровнями и показателями неонатальной заболеваемости и смертности [20]. В исследовании приняли участие 80 новорожденных, у которых были измерены параметры рН, сатурация кислорода, доля вдыхаемого кислорода (FiO2), срок беременности при ПРПО и концентрация цитокинов (СРБ, IL-6, CXCL-5, IL-10, TNF-α) в венозной крови. Полученные данные показали, что у детей, рожденных от матерей с ПРПО, содержание всех исследованных цитокинов было значительно выше. Некротический энтероколит (НЭК) был связан с высоким уровнем IL-6, развитие внутрижелудочкового кровоизлияния у новорожденных коррелировало с повышенными значениями CXCL-5 (р = 0,037), а развитие сепсиса – с увеличенным уровнем IL-10 (р = 0,02).
Легкие являются одним из ключевых органов-мишеней у плода при развитии FIRS. Повышение уровня IL-6 в пуповинной крови часто ассоциируется с возникновением бронхолегочной дисплазии (БЛД) у новорожденных. Исследование S.G. Kallapur с соавт. показало, что введение внутриамниотического эндотоксина in vivo провоцирует усиление воспалительного ответа и значительное увеличение экспрессии матричной РНК (мРНК) провоспалительных цитокинов, таких как IL-1, IL-6, IL-8 и TNF-α, что подтверждено при проведении бронхоальвеолярного лаважа [21]. В исследовании В.Н. Yoon с соавт. была проанализирована связь между концентрацией IL-6 в пуповинной крови, амниотической жидкости и развитием БЛД. Согласно полученным результатам, у детей с БЛД уровень IL-6 в пуповинной крови был существенно выше (отношение шансов (ОШ) = 4,2; 95 % доверительный интервал (ДИ) = 1,6–11,2) [22]. Однако метаанализ, проведенный L. Sarno с соавт., не подтвердил значимой связи между хориоамнионитом и развитием БЛД при учете гестационного возраста (ОШ = 0,99; 95 % ДИ = 0,76–1,3), что подчеркивает необходимость дальнейших исследований для выяснения точных патогенетических механизмов [23]. Среди других осложнений перинатального периода у новорожденных выделяют респираторный дистресс-синдром (РДС), обусловленный повышенной секрецией кортизола, дефицитом сурфактанта и стойкой легочной гипертензией [24]. Работа N.S. Dessardo с соавт. продемонстрировала, что наличие FIRS является значимым фактором риска развития хронических заболеваний легких у недоношенных (ОШ = 31,05; 95 % ДИ = 10,7–87,75; p < 0,001) [25].
Многие исследователи разделяют мнение о том, что FIRS оказывает влияние на функции головного мозга плода и способствует развитию нейровоспаления [26]. Патогенетические механизмы повреждения мозга остаются недостаточно изученными, но предполагается, что они связаны с концепцией «двойного удара» (double-hit). Под воздействием хориоамнионита происходит диффузное повреждение нейронов белого и серого вещества мозга, вероятно, из-за прямого влияния провоспалительных цитокинов, таких как TNF-α, IL-1, IL-6 и др. [27–29]. Воспалительные медиаторы также могут нарушать целостность гематоэнцефалического барьера, увеличивая его проницаемость для различных белков и усиливая повреждения мозга [30–32]. Существенную роль в развитии мозговых нарушений играет активация микроглии, что приводит к изменению иммунореактивности основного белка миелина и апоптозу олигодендроцитов [33]. В 2023 г. Е. Giovannini с соавт. установили, что наиболее опасным состоянием для новорожденных после перенесенного FIRS является гипоксия головного мозга [34]. Для таких детей рекомендуется проведение нейросонографии или магнитно-резонансной томографии головного мозга с целью выявления перивентрикулярной лейкомаляции, кистозных изменений и очагов поражения [35]. Еще одним серьезным осложнением FIRS является неонатальная энцефалопатия, которая характеризуется нарушением уровня сознания, судорогами, изменением мышечного тонуса и проблемами с дыханием. Неонатальная энцефалопатия связана с высоким риском летального исхода, когнитивными расстройствами, а также поражением органов зрения и слуха. Развивающиеся у детей с неонатальной энцефалопатией эпилептические синдромы и детский церебральный паралич могут сопровождаться двигательными и сенсорными нарушениями, задержкой психического развития, проблемами поведения, восприятия и сознания [36–39].
Одной из значимых проблем, возникающих после перенесенного хориоамнионита, является увеличение частоты случаев ретинопатии недоношенных. Данное состояние развивается вследствие различных нарушений, которые препятствуют нормальному нервно-сосудистому росту в незрелой сетчатке глаза, а эти процессы могут быть связаны с гипоксией головного мозга. Высокий уровень IL-6 в плазме крови оказывает влияние на степень тяжести ретинопатии недоношенных, что делает его потенциальным прогностическим маркером для оценки риска развития заболевания [40][41].
В исследовании В. Gibson с соавт. был проанализирован риск развития различных психических расстройств у почти 5000 детей с FIRS в анамнезе. Результаты статистического анализа подтвердили, что у детей с FIRS чаще выявляются нервно-психические расстройства (ОШ = 1,21; 95 % ДИ = 1,09–1,35), включая расстройство аутистического спектра (ОШ = 1,35; 95 % ДИ = 1,08–1,67), синдром дефицита внимания и гиперактивности (ОШ = 1,27; 95 % ДИ = 1,07–1,49), расстройство поведения (ОШ = 1,50; 95 % ДИ = 1,24–1,81) и посттравматическое стрессовое расстройство (ОШ = 2,46; 95 % ДИ = 1,21–5,04). Это исследование, проводившееся в течение 7 лет, позволило оценить долгосрочные последствия FIRS у детей [42].
Почки часто подвергаются повреждениям при наличии FIRS у плода. Поскольку количество околоплодных вод напрямую зависит от функции почек и мочеиспускания, была исследована связь уровня околоплодных вод с наличием внутриамниотической инфекции. Положительный результат посева и повышение содержания матриксной металлопротеиназы (англ. matrix metalloproteinase, ММР) ММР-8 > 23 нг/мл, IL-6 и TNF-α чаще встречались у женщин с маловодием (p < 0,05) [43][44]. Н. Azpurua с соавт. подтвердили, что дети, рожденные от матерей с внутриамниотическим воспалением, имели повышенные уровни IL-6 и мочевины, однако изменений в работе почечных сосудов по данным ультразвуковой доплерографии не наблюдалось [45]. Исследования на животных моделях показали, что при хориоамнионите наблюдается снижение числа почечных клубочков (p < 0,05) [46][47]. В то же время по результатам исследования Т. Muk с соавт. было продемонстрировано, что воспаление в амниотическом пространстве приводит к увеличению концентрации креатинина и микроальбумина, что свидетельствует о дисфункции почек. Также в почечных тканях был зафиксирован рост уровней маркеров повреждения почек – LRG1 (англ. leucine-rich alpha-2-glycoprotein 1; лейцин-обогащенный альфа-2-гликопротеин 1), KIM1 (англ. kidney injury molecule-1; молекула повреждения почек 1), NGAL (англ. neutrophil gelatinase-associated lipocalin; липокалин, ассоциированный с желатиназой нейтрофилов), HIF1A (англ. hypoxia-inducible factor 1-alpha; индуцируемый гипоксией фактор 1-альфа) и CASP3 (англ. caspase-3; каспаза 3 [48].
При FIRS в патологический процесс также вовлекается вилочковая железа. В исследовании Е. Kuypers с соавт. было зафиксировано снижение уровня лимфоцитов и уменьшение кортико-медуллярной зоны тимуса после введения эндотоксина в амниотическое пространство. Через сутки после введения наблюдалось значительное повышение содержания IL-6, мРНК IL-17 и мРНК толл-подобного рецептора 4 (англ. toll-like receptor 4, TLR4), что указывало на активацию тимуса в ответ на воспаление [49]. Согласно данным исследования, воспаление в тимусе приводит к изменениям в составе CD8+ Т-лимфоцитов и активации CD4+ Т-лимфоцитов, что проявляется увеличением экспрессии CD25 (p = 0,0001), HLA-DR и CD69 (p = 0,0003) [50][51].
При FIRS могут быть затронуты и другие органы и системы, такие как селезенка, печень, щитовидная железа и кишечник [52–54]. Поражение кишечника при FIRS происходит вследствие повышения уровня TNF-α, который влияет на микроциркуляцию стенок кишечника, а также из-за снижения экспрессии фактора роста эндотелия сосудов (англ. vascular endothelial growth factor, VEGF) [55][56]. Хориоамнионит также может приводить к изменению функции печени [57]. При введении эндотоксинов в печени активируются клетки Купфера, которые начинают вырабатывать провоспалительные цитокины. Также наблюдается повышение содержания IL-8 и IL-18, которое предшествует воспалению кишечника, что может указывать на влияние печеночных цитокинов на развитие НЭК [58].
Фуникулит пупочных сосудов является одним из индикаторов FIRS и согласно некоторым исследованиям чаще встречается у недоношенных детей, у которых в сыворотке крови наблюдается повышение уровня растворимой молекулы межклеточной адгезии-1 (англ. soluble intercellular adhesion molecule, sICAM-1) [59]. Существует гипотеза о связи FIRS с эндотелиальной дисфункцией, так как снижение воспалительной активности у пациентов сопровождается повышением концентрации sICAM-1 и активацией эндотелиальных клеток. У новорожденных с синдромом угнетения ЦНС также было зафиксировано повышение уровня sICAM-1 [60][61].
В настоящее время в научной литературе существует ограниченное количество исследований, четко связывающих конкретные гемодинамические нарушения с FIRS. S.N. Eloundou с соавт. изучили влияние внутриутробного воспаления на гемодинамические и структурные изменения в плаценте и их последствия для плода. В эксперименте на мышах было зафиксировано повреждение эндотелия плаценты, образование тромбов, вызванное снижением уровня фибриногена, и истончение плаценты [62].
Следует отметить, что синтез антифосфолипидных антител (англ. antiphospholipid antibodies, aPL) de novo может быть реакцией на внутриамниотическое воспаление, рассматриваемое как «first hit» («первый удар»). В результате перинатального воспаления могут произойти значительные изменения в популяции периферических регуляторных Т-клеток в пуповинной крови, что приводит к перепрограммированию еще не полностью зрелой врожденной и адаптивной иммунной системы плода, а затем и новорожденного [63]. В первые 3 месяца жизни новорожденный получает иммунную защиту через материнские антитела, однако через год уровень IgG и IgM достигает лишь 50 % от нормального уровня у взрослых. Это может объяснить повышенную восприимчивость к сепсису, септическому шоку и другим угрожающим жизни состояниям в неонатальном периоде, особенно у недоношенных детей [64][65]. Недоношенные новорожденные, обладающие незрелостью как иммунной системы, так и большинства органов и систем, включая систему гемостаза, подвержены высокому риску смертности и развития осложнений, связанных с воспалением и тромбозом. Иммунные изменения, вызванные внутриутробной инфекцией и синтезом aPL de novo, могут играть важную роль в возникновении неонатальных тромбозов [63].
У новорожденных с FIRS также увеличивается риск развития неонатального сепсиса [66]. В исследовании М. Nomiyama с соавт. было установлено, что у новорожденных с FIRS и MIR/FIR наблюдается более высокая частота сепсиса по сравнению с новорожденными без этих состояний (p < 0,001) [12].
Основные осложнения неонатального периода после перенесенного FIRS представлены на рисунке 1.
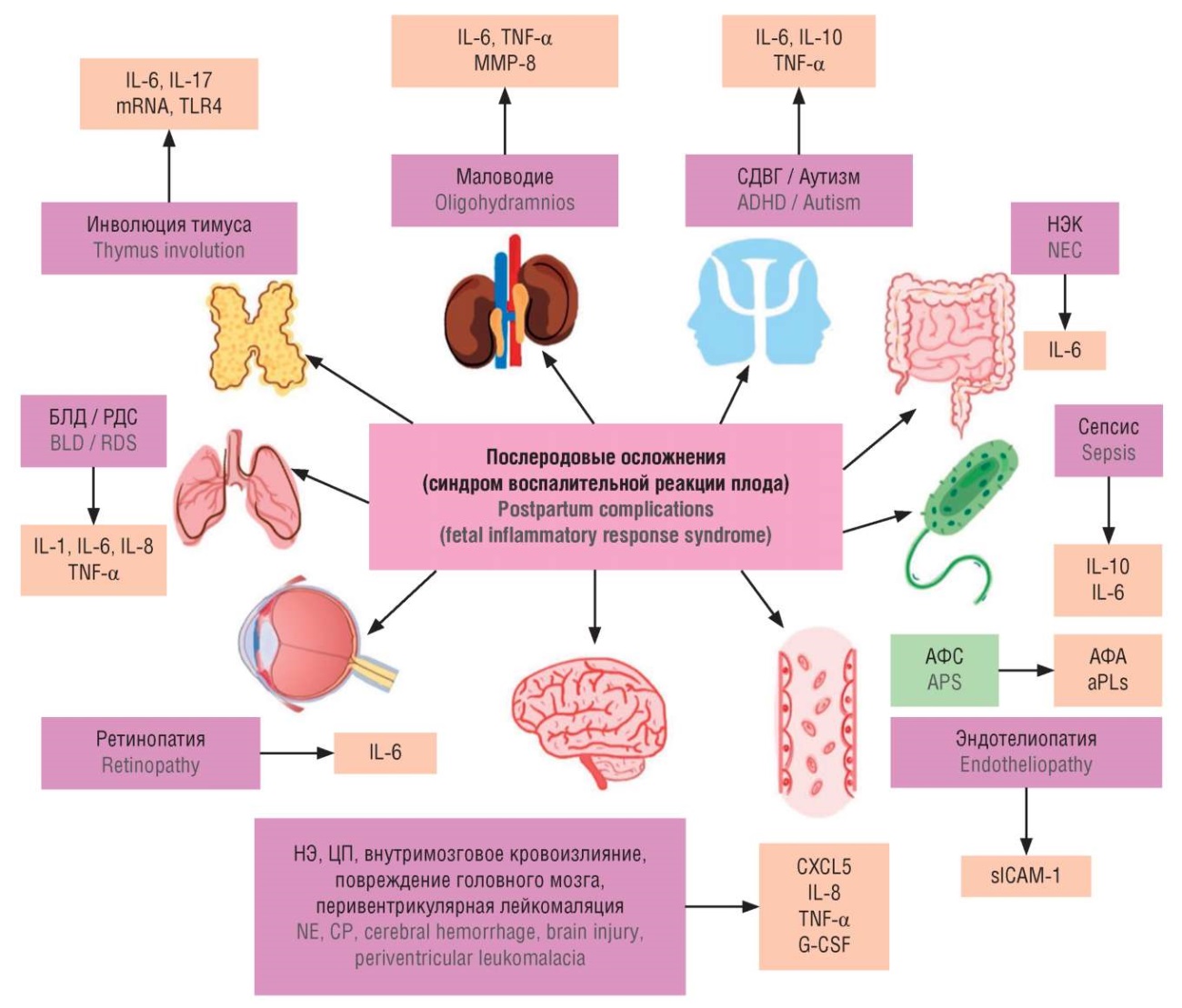
Рисунок 1. Послеродовые осложнения перенесенного синдрома воспалительной реакции плода [рисунок авторов].
Примечание: TNF-α – фактор некроза опухоли альфа; IL – интерлейкин; ММР-8 – матриксная металлопротеиназа; mRNA – матричная РНК; TLR4 – толл-подобный рецептор 4; СДВГ – синдром дефицита внимания и гиперактивности; НЭК – некротический энтероколит; БЛД – бронхолегочная дисплазия; РДС – респираторный дистресс-синдром; АРS – антифосфолипидный синдром; АФА – антифосфолипидные антитела; НЭ – неонатальная энцефалопатия; ЦП – церебральный паралич; sICAM-1 – растворимая молекула межклеточной адгезии; CXCL5 – нейтрофил-активирующий пептид; G-CSF – гранулоцитарный колониестимулирующий фактор.
Figure 1. Postpartum complications of fetal inflammatory response syndrome [drawn by authors].
Note: TNF-α – tumor necrosis factor alpha; IL – interleukin; MMP-8 – matrix metalloproteinase 8; mRNA – messenger RNA; TLR4 – Toll-like receptor 4; ADHD – attention deficit and hyperactivity disorder; NEC – necrotizing enterocolitis; BPD – bronchopulmonary dysplasia; RDS – respiratory distress syndrome; APS – antiphospholipid syndrome; aPLs – antiphospholipid antibodies; NE – neonatal encephalopathy; CP – cerebral palsy; sICAM-1 – soluble intercellular adhesion molecule; CXCL5 – C-X-C motif chemokine ligand 5; G-CSF – granulocyte colony-stimulating factor.
Перинатальные аспекты септического шока / Septic shock perinatal aspects
Шок – это состояние гипоперфузии органов, которое характеризуется клеточной дисфункцией. Патогенез шока включает несколько механизмов, среди которых основными являются снижение объема циркулирующей крови, снижение сердечного выброса и вазодилатация. Сепсис – это угрожающее состояние, возникающее в результате чрезмерного иммунного ответа на инфекцию, что приводит к нарушению функций органов. Для новорожденных сепсис является особенно опасным состоянием, тесно связанным с высокой смертностью (ОШ = 4,41; 95 % ДИ = 1,75–11,1) [67].
Факторы, способствующие развитию сепсиса, можно условно разделить на 2 группы (табл. 2): факторы риска со стороны матери и со стороны новорожденного [68].
Таблица 2. Факторы риска развития сепсиса [68].
Table 2. Risk factors for sepsis development [68].
|
Факторы риска со стороны матери Maternal risk factors |
1. Возраст старше 30 лет / Age over 30 years 2. Хориоамнионит / Chorioamnionitis 3. Преждевременные роды / Preterm birth 4. Выход мекония в околоплодные воды / Meconium-stained amniotic fluid 5. Ректовагинальная колонизация стрептококком группы B / Rectovaginal Group B Streptococcus colonization 6. Инфекционные заболевания (инфекция мочевыводящих путей) и гипертермия в родах / Infectious diseases (urinary tract infection) and hyperthermia in labor |
|
Факторы риска со стороны плода Fetal risk factors |
1. Постановка центрального венозного катетера / Central venous catheter placement 2. Недоношенность (возраст ребенка менее 37 недель) / Prematurity (gestational age < 37 weeks) 3. Низкая масса тела при рождении (менее 2500 г) / Low birth weight (< 2500 g) 4. Оценка по шкале Апгар менее 5 баллов / Apgar score < 5 5. Нахождение ребенка на искусственной вентиляции легких / Mechanical ventilation 6. Отсутствие энтерального питания / Lack of enteral nutrition 7. Патология желудочно-кишечного тракта / Gastrointestinal pathology 8. Гемодинамические нарушения (нейтропения и снижение концентрации IgG в сыворотке) / Hemodynamic disorders (neutropenia and decreased serum IgG level) |
Септический шок у новорожденных является опасным для жизни осложнением сепсиса, сопровождающимся высокой смертностью. Несвоевременная диагностика или неправильное лечение сепсиса может привести к распространению инфекции, что, в свою очередь, способствует развитию генерализованного воспаления эндотелия и последующему СШ. Согласно данным на 2010 г., СШ развивается у 10–15 % детей с сепсисом, при этом среди всех новорожденных СШ встречается в 0,01–0,015 % случаев [69]. Высокая летальность при СШ связана с нехарактерной клинической картиной и задержкой в диагностике, что требует особого внимания со стороны медицинских специалистов.
В процессе развития СШ важную роль играют клетки иммунной системы и сам возбудитель инфекции. При попадании инфекционного агента в кровоток макрофаги и моноциты активируют рецепторы на своей поверхности, что запускает внутриклеточные каскады и высвобождение цитокинов и хемокинов. Это приводит к активации эндотелиальных клеток, лимфоцитов и компонентов системы комплемента, что, в свою очередь, вызывает общее воспаление и развитие шока [70].
Системное распространение возбудителя и генерализованная активация эндотелия приводят к нарушению микроциркуляции и развитию тканевой гипоксии, ацидоза и гипотонии, что обуславливает развитие симптомов СШ у новорожденных [71]. К симптомам СШ у новорожденных можно отнести поражение дыхательной и сердечно-сосудистой систем, а также некоторые другие неспецифические симптомы, например, снижение тонуса мышц у детей, изменение цвета кожных покровов [72]. Отсутствие сердечной компенсации при СШ у новорожденных обусловлено слабостью сердечной мышцы.
Клиническая картина СШ включает в себя 3 этапа развития, каждый из которых имеет свою клиническую характеристику:
1) первая стадия называется компенсированный шок и включает в себя активацию нейроэндокринных компенсаторных механизмов [70]; к симптомам первой стадии можно отнести тахикардию, олигурию и снижение тканевой перфузии;
2) некомпенсированный шок является следующим этапом в развитии СШ и включает в себя симптомы системной гипотензии и метаболического ацидоза;
3) третьим и заключительным этапом развития СШ является необратимый шок, который характеризуется выраженными нарушениями микроциркуляции и необратимым повреждением клеток, что приводит к некрозу и развитию ПОН.
Для детей характерно развитие так называемого холодного СШ, который проявляется повышением системного сосудистого сопротивления из-за периферической вазоконстрикции. В клиническую картину холодного СШ входят замедление и ослабление пульса, снижение объема мочи и мраморность кончиков пальцев. На второй стадии шока развивается метаболический ацидоз, который ведет к увеличению легочного сопротивления, что становится основным фактором в развитии правожелудочковой недостаточности.
Гемостаз у новорожденных / Hemostasis in newborns
Особенности гемостаза у новорожденных обуславливают развитие неспецифической клинической картины СШ и ССВО. К этим особенностям можно отнести удлинение активированного частичного тромбопластинового времени (АЧТВ), протромбинового времени (ПВ) и замедленное образование тромбина. У здорового новорожденного способность вырабатывать тромбин в плазме значительно снижена и замедлена по сравнению с взрослыми. Система гемостаза у новорожденных функционирует за счет баланса между факторами, способствующими кровотечению, и теми, которые ведут к тромбообразованию. К факторам, способствующим кровотечению, относятся снижение активности тромбоцитов, низкие уровни факторов свертывания II, VII, IX, X, XI, XII и повышение уровня α2-макроглобулина. Образованию тромбов способствует повышение значений гематокрита, среднего объема эритроцитов (англ. mean corpuscular volume, MCV), фактора фон Виллебранда (англ. von Willebrand factor, vWF), а также снижение содержания протеинов S и C, кофермента гепарина II. Продукция тромбина у новорожденных составляет около 90 % от уровня у взрослых, что вполне достаточно для формирования гемостатического сгустка. Время кровотечения и тромбообразования у новорожденных короче, чем у взрослых. Гемостаз у новорожденных имеет ограниченную буферную способность, что повышает риск тромбообразования при наличии дополнительных факторов, таких как сопутствующие заболевания, снижение фибринолитической активности, резистентность к гепарину из-за низкого уровня антитромбина и повышенный клиренс нефракционированного гепарина [73].
Функция и физиология тромбоцитов также изменяются с возрастом. В одном из исследований было показано, что количество тромбоцитов у плода увеличивается примерно на 2×10⁹/л каждую неделю беременности. Среднее количество тромбоцитов у недоношенных детей составляло ≥ 200×10⁹/л, что соответствует норме для взрослых. Нормальные значения количества тромбоцитов для новорожденных – от 150×10⁹/л до 450×10⁹/л. Однако у недоношенных детей это значение может быть ниже, в связи с чем недоношенные дети имеют повышенный риск кровотечений. Реактивность тромбоцитов увеличивается с возрастом, а у недоношенных детей она развивается в результате снижения экспрессии мембранных гликопротеинов [74][75].
Изменения гемостаза новорожденных при септическом шоке / Hemostasis changes in newborns with septic shock
У пациентов с сепсисом и шоком наблюдаются выраженные расстройства гемостаза, которые могут проявляться в хронической, подострой и острой формах (например, ДВС-синдром). Взаимосвязь воспаления и гемостаза рассматривается с позиции «петли усиления», при которой воспаление инициирует и поддерживает коагуляцию, а продукты коагуляции, в свою очередь, усиливают и поддерживают воспалительные процессы [76, 77]. Активация гемостаза при сепсисе и шоке происходит в результате повреждения сосудистого эндотелия токсинами микроорганизмов, активированными иммунными клетками крови и провоспалительными цитокинами (в особенности IL-6 и TNF-α), что сопровождается продукцией и высвобождением TF, главным образом моноцитами-макрофагами и эндотелиальными клетками. Также происходит генерация тромбина через TF, угнетается активность протеина С и подавляется фибринолиз [78].
Еще одним механизмом, в рамках которого возможно существование «петли усиления», является взаимодействие рецепторов, активируемых протеазами (англ. protease-activated receptors, PARs), с факторами свертывания, в частности, комплексом TF-VIIa и фактором Ха (рис. 2). Это взаимодействие инициирует внутриклеточные сигнальные пути в эндотелиальных клетках, что способствует усилению воспалительных процессов. Однако у новорожденных не до конца изучен данный механизм развития СШ [79].
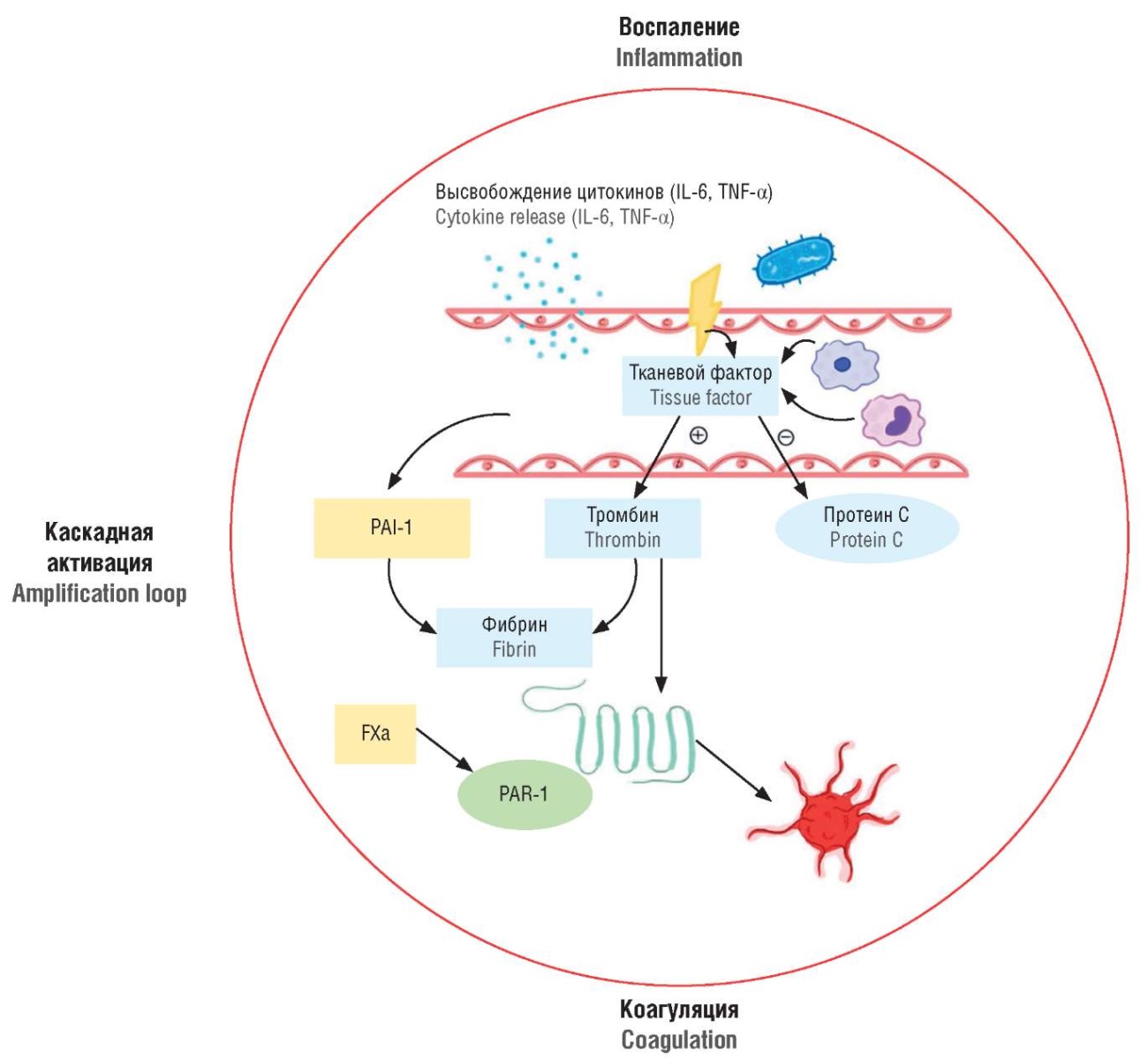
Рисунок 2. Связь между гемостазом и воспалением – «петля усиления» [рисунок авторов].
Примечание: IL – интерлейкин; TNF-α – фактор некроза опухоли альфа; PAI-1 – ингибитор активатора плазминогена-1; FXa – фактор свертывания FXa; PAR-1 – рецептор, активируемый протеазами.
Figure 2. A crosstalk between hemostasis and inflammation – the “amplification loop” [drawn by authors].
Note: IL – interleukin; TNF-α – tumor necrosis factor alpha; PAI-1 – plasminogen activator inhibitor-1; FXa – coagulation factor FXa; PAR-1 – protease-activated receptor.
Развитие сепсиса сопровождается повышенным высвобождением ингибитора активатора плазминогена-1 (англ. plasminogen activator inhibitor-1, PAI-1) из эндотелиоцитов, что подавляет активность плазмина. Бактериемия ассоциирована с ранней активацией фибринолиза за счет повышения уровня тканевого активатора плазминогена (англ. tissue plasminogen activator, tPA), что в свою очередь ведет к высвобождению PAI-1. В свою очередь повышение уровня PAI-1 связано с циркуляцией провоспалительных цитокинов. Следует отметить, что уровни TNF-α и PAI-1 у пациентов с сепсисом прямо коррелируют с тяжестью ДВС-синдрома и сепсиса, а также ассоциируются с плохим прогнозом и высоким риском летального исхода. В исследовании J. Green с соавт., проведенном на 107 пациентах с сепсисом, повышенные уровни TF и PAI-1 были связаны с повышением уровня IL-6, развитием сердечно-сосудистых и почечных заболеваний, печеночной недостаточностью, коагулопатией и увеличением смертности (p < 0,05) [80].
Еще одним важным аспектом в нарушении системы гемостаза является тромбин-активируемый ингибитор фибринолиза (англ. thrombin-activated fibrinolysis inhibitor, TAFI) [81–83]. Активированный TAFI подавляет фибринолиз, удаляя концевую молекулу лизина в фибрине, что препятствует связыванию с плазмином через высокоаффинный сайт. В литературе встречаются данные о полиморфизме гена TAFI, однако не установлено, какие варианты этого гена способствуют более тяжелому течению заболеваний [84]. Роль TAFI у новорожденных исследована недостаточно, но М. Emonts с соавт. зафиксировали снижение уровня TAFI у пациентов с СШ и повышение уровня пептида активации TAFI (англ. TAFI activation peptide, TAFI-AP) у детей с ДВС-синдромом [85].
Система комплемента является ключевым компонентом иммунного ответа, от которого зависит успешная нейтрализация чужеродных агентов. При сепсисе наблюдается нарушение нормального функционирования системы комплемента, что приводит к бесконтрольному выбросу хемоаттрактантов С3а и С5а, которые взаимодействуют с рецепторами на поверхности макрофагов и нейтрофилов [86]. Компонент С5а активирует пристеночную систему коагуляции, включая фактор XII и калликреин, что способствует образованию макротромбозов и развитию ДВС-синдрома [87].
Помимо симптомов ДВС-синдрома, у пациентов с СШ могут развиваться признаки тромботической тромбоцитопенической пурпуры (ТТП) – патологии, вызванной дефицитом металлопротеиназы ADAMTS-13 (англ. a disintegrin and metalloproteinase with thrombospondin type 1 motif, member 13), которая обычно бывает приобретенной, реже врожденной. Металлопротеиназа ADAMTS-13 отвечает за расщепление мультимеров vWF на мономеры [88]. Недостаток ADAMTS-13 ведет к микроваскулярной обструкции, повреждению органов, включая головной мозг и почки, а также тромбоцитопении и неиммунной гемолитической анемии [89]. Тромбоцитопения (менее 100×10⁹/л) у пациентов с сепсисом может быть вызвана не только чрезмерным потреблением тромбоцитов, но и замедленным их образованием или секвестрацией в селезенке [90]. Воспалительные медиаторы, такие как IL-8 и TNF-α, стимулируют образование мультимеров vWF, в то время как IL-6 и антимикробные пептиды, выделяемые нейтрофилами, ингибируют действие ADAMTS-13 [91]. Кроме того, воспаление приводит к окислению vWF и ADAMTS-13, что препятствует расщеплению мультимеров vWF металлопротеиназой [92].
Согласно данным ряда исследований, более трети пациентов с сепсисом имеют уровень ADAMTS-13, который в 2 раза ниже нормы, а около 15 % пациентов – менее 10 % от нормального значения. Чем ниже уровень ADAMTS-13, тем выше вероятность летального исхода у пациентов с сепсисом и СШ [93–96], поскольку дефицит этого фермента приводит к накоплению и продлению действия vWF, что связано с повышением смертности из-за формирования протромботического состояния [97][98]. Р. Papadogeorgou с соавт. также обнаружили значительное снижение уровня ADAMTS-13 у новорожденных с сепсисом в острой фазе инфекции по сравнению с контрольной группой (488,5 ± 75,4 нг/мл и 577,2 ± 113,6 нг/мл; p = 0,015) [99].
Тромбоциты играют ключевую роль в коагулопатии, вызванной сепсисом. В условиях системного воспаления на их поверхности экспрессируется P-селектин, который является частью класса белков межклеточной адгезии. P-селектин локализуется в α-гранулах тромбоцитов и секреторных гранулах (тельцах Вейбеля–Паладе) эндотелиальных клеток, где он участвует в первичном взаимодействии полиморфноядерных нейтрофилов и эндотелиоцитов, особенно в зоне воспаления. Исследования показывают, что взаимодействуя с цитокинами, P-селектин может регулировать синтез интегринов [100]. Бактерии из родов Staphylococcus и Escherichia coli способствуют повышению экспрессии гликопротеиновых рецепторов GPIIb/IIIa на активированных тромбоцитах и активации рецептора тромбоцитов FcγRIIA [101]. Тромбоциты также способствуют привлечению других клеток врожденного иммунитета, таких как гранулоциты, моноциты и врожденные лимфоидные клетки (англ. innate lymphoid cells, ICL) [102][103]. Таким образом, тромбоциты играют важную роль в иммунном ответе на бактериальную инвазию.
У пациентов с СШ всегда отмечается тромбоцитопения, которая обычно связана с повышенными затратами тромбоцитов на формирование тромбов [104]. Тромбоцитопения у новорожденных вероятнее всего связана со снижением экспрессии TLR4 и связана с повышенным уровнем смертности [105]. Также у недоношенных новорожденных с гистологически подтвержденным хориоамнионитом наблюдались более высокие уровни экспрессии CD40L в тромбоцитах по сравнению с группой контроля (5,3 ± 2,9 % vs. 1,6 ± 0,7 %; p < 0,05), что свидетельствует о значительном вовлечении тромбоцитов в патологический процесс [106][107].
В последнее время нейтрофилам и образованию внеклеточных ловушек нейтрофилов (англ. neutrophil extracellular traps, NETs), также известному как нетоз, придается все большее значение в патогенезе антифосфолипидного синдрома (АФС) [108–113]. Ранее нейтрофилы считались однородной популяцией, однако в настоящее время их классифицируют по плотности, выраженности поверхностных маркеров и стадиям созревания [114]. NETs представляют собой структуры, состоящие из измененного хроматина, белков цитоплазмы, ядер и гранул нейтрофилов, обладающих антимикробной активностью. Нетоз может быть инициирован не только микроорганизмами, но и тромбоцитами, иммунными комплексами, компонентами системы комплемента, противовоспалительными цитокинами и другими активными веществами [115]. NETs создают каркас для связывания тромбоцитов, эритроцитов и белков плазмы [116]. У доношенных и недоношенных новорожденных наблюдается сниженное образование NETs, что связано с повышенной частотой сепсиса в ранний период жизни [117]. Хотя считается, что образование NETs снижает распространение инфекции, они также ассоциируются с развитием ДВС-синдрома и повреждениями микрососудов [118], что требует дальнейших исследований этого механизма у детей.
Повреждение гликокаликса клеток эндотелия играет ключевую роль в развитии сепсиса у детей. Гликокаликс отвечает за поддержание гемостаза, регулирование проницаемости сосудов, управление микроциркуляцией, предотвращение тромбоза в микрососудах и контроль прикрепления лейкоцитов. При шоке, сопровождающемся активацией симпатоадреналовой системы, страдают как эндотелиальные клетки, так и сам гликокаликс. Эта молекула взаимодействует с антикоагулянтной системой, включая антитромбин III, который подавляет активность тромбина и факторов IX и X. Усиление функции антитромбина III обеспечивается его соединением с гепарансульфатом – важным элементом гликокаликса [119]. Одними из возможных маркеров повреждения гликокаликса при неонатальном сепсисе являются MMP-8 и MMP-9. В исследованиях была выявлена корреляция между уровнями MMP-8 и MMP-9 с ранним развитием сепсиса и повышением риска ПОН у детей [120][121].
МикроРНК – это маленькие некодирующие молекулы РНК, которые регулируют экспрессию генов, связываясь с мРНК и участвуя в иммунных и воспалительных реакциях в качестве модуляторов ключевых биологических путей и процессов [122]. Экспрессия микроРНК была нарушена при сепсисе, что свидетельствует об их диагностическом потенциале. По сравнению с традиционными методами диагностики, такими как лейкоцитоз и мониторинг температуры, микроРНК являются более специфичным и стабильным профилем биомаркеров. Различные микроРНК доступны для неинвазивного тестирования, в результате чего возможно более раннее и точное диагностирование СШ [123–125]. Этот новый подход не только помогает в ранней диагностике, но и предоставляет информацию о молекулярных механизмах, лежащих в основе сепсиса, открывая путь для целенаправленных терапевтических вмешательств.
Роль конвергентной модели коагуляции в развитии септического шока / A role of convergent coagulation model in developing septic shock
Конвергентная модель коагуляции представляет собой новый подход к пониманию гемостаза, который объединяет воспаление и активацию врожденного иммунитета в единую реакцию на сосудистое повреждение [126]. Эта модель развивает ранее полученные знания о каскаде коагуляции, включая роль молекул, ассоциированных с повреждением тканей (англ. damage-associated molecular patterns, DAMPs), которые способствуют взаимодействию различных систем для усиления и регулирования формирования тромбов. Модель описывает взаимодействие путей коагуляции и врожденного иммунитета при сосудистом повреждении, акцентируя внимание на совместном механизме, необходимом для образования тромба (рис. 3). При сосудистом повреждении запускается каскад коагуляции, что приводит к активации таких иммунных клеток, как тромбоциты, моноциты/макрофаги и нейтрофилы. Тромбоциты участвуют в формировании тромба и выделяют цитокины и хемокины, которые привлекают дополнительные иммунные клетки на место повреждения, усиливая иммунный ответ. Моноциты и макрофаги активируют TF, который является важным инициатором внешнего пути коагуляции, что связывает коагуляцию с иммунной активацией. Нейтрофилы выделяют NETs, которые образуют структуру для формирования тромба и захвата патогенов, усиливая как коагуляцию, так и иммунную защиту. Этот интегрированный ответ подчеркивает сложные и взаимосвязанные взаимодействия между системой коагуляции и врожденным иммунитетом, которые необходимы для поддержания гомеостаза и защиты от инфекций [127].
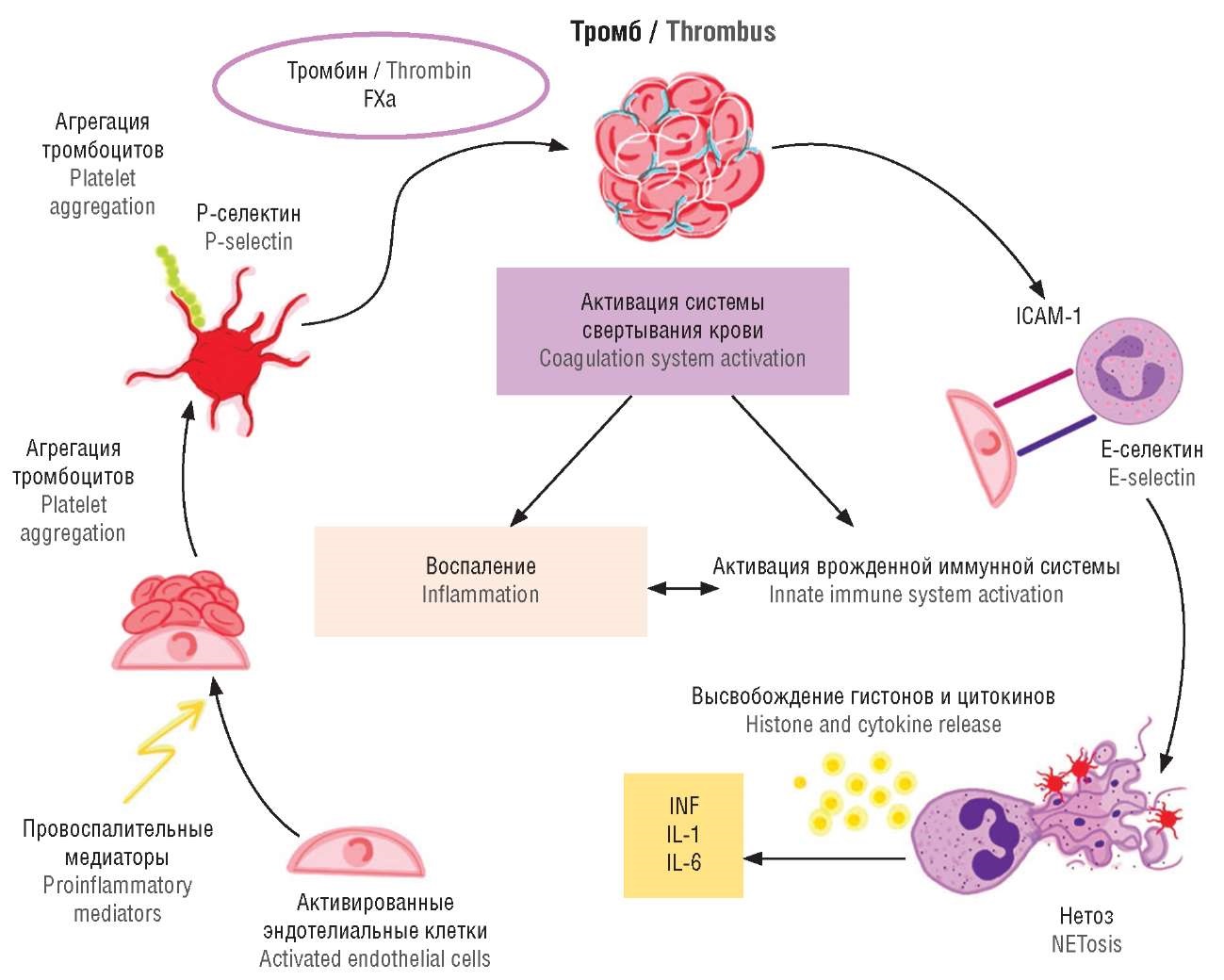
Рисунок 3. Конвергентная модель коагуляции (адаптировано из [113], [114]).
Примечание: FXa – фактор свертывания FXa; ICAM-1 – молекула межклеточной адгезии; INF – интерферон; IL – интерлейкин.
Figure 3. Convergent coagulation model (adapted from [113], [114]).
Note: FXa – coagulation factor FXa; ICAM-1 – intercellular adhesion molecule; INF – interferon; IL – interleukin.
Ранняя диагностика и лечение септического шока / Early diagnostics and treatment of septic shock
Согласно международным рекомендациям, при развитии острой ПОН рекомендуется проведение систематического скрининга с целью выявления сепсиса и СШ [128]. Ранее выявление сепсиса и СШ позволяет начать своевременное и адекватное лечение. Диагностика сепсиса и СШ в первую очередь основана на выделении возбудителя в посеве крови, при этом необходимо производить высев возбудителя до начала антибиотикотерапии. Также необходимо различать СШ и другие виды шока, которые могут иметь схожие с СШ проявления. Неспецифическим маркером сепсиса и СШ является лактат, который отражает наличие тканевой гипоперфузии; однако согласно международным рекомендациям измерение лактата в крови не показано.
Лечение сепсиса и СШ включает в себя комплекс мероприятий, который заключается в поддержке сердечно-сосудистой и дыхательной систем. Поражения сердечно-сосудистой системы требуют инфузионной терапии или инотропной поддержки [129]. При наличии у новорожденного таких симптомов СШ, как цианоз, мраморность, ослабление пульсовой волны, рекомендуется начать лечение простагландинами [130]. S.L. Weiss с соавт. в 2020 г. разработали Международные рекомендации по ведению СШ и органной дисфункции, связанной с сепсисом у детей, которые включают в себя следующие этапы лечения [115].
Антимикробная терапия / Antimicrobial therapy
При первых признаках СШ у новорожденных рекомендуется немедленно начинать антибиотикотерапию. При этом у детей с ПОН, связанной с сепсисом, но без симптомов СШ, также рекомендуется начать антимикробную терапию в течение нескольких часов после развития клинической картины сепсиса. В качестве начала терапии рекомендуется выбирать антибиотик широкого спектра действия с широким терапевтическим окном во избежание развития нежелательных побочных эффектов антибиотикотерапии. Отмена антибиотикотерапии возможна в случае ее неэффективности, развития побочных эффектов и отсутствии выделенного возбудителя. Не рекомендуется устанавливать внутрисосудистый доступ, так как катетеры могут являться дополнительным источником сепсиса, а также осложнять течение СШ, удлиняя период выздоровления [131]. Высокая смертность новорожденных с сепсисом и СШ является следствием неправильной или поздней антибиотикотерапии. В связи с этим следует назначать наиболее безопасные лекарственные средства с учетом всех патологических симптомов новорожденного, а также соотносить риск и пользу для каждого пациента, исходя из индивидуальности каждого клинического случая СШ. В качестве стартовой терапии внебольничного сепсиса можно использовать цефалоспорины третьего поколения (цефтриаксон). При наличии антибиотикорезистености к цефалоспоринам следует поменять тактику антибиотикотерапии и назначить лекарственное средство из группы аминогликозидов [132]. Наиболее устойчивыми к терапии являются внутрибольничный сепсис и СШ, которые вызваны резистентными бактериями, например, метициллинрезистентным золотистым стафилококком (methicillin-resistant Staphylococcus aureus, MRSA); в этом случае рекомендуется добавить к терапии ванкомицин.
Инфузионная терапия / Infusion therapy
Рекомендуется проведение инфузионной терапии для коррекции гиповолемии, вызванной СШ, в виде 40–60 мл/кг болюсно (10–20 мл/кг болюсно) в течение первого часа. При этом также необходимо производить контроль артериального давления и пульса. В случае развития признаков перегрузки жидкостью инфузионную терапию рекомендуется прекратить. В качестве инфузионной терапии вместо альбумина и физиологического раствора рекомендуется использовать кристаллоиды, так как они обладают меньшим количеством побочных эффектов. Не рекомендуется использовать крахмал (например, Hydroxyethyl starch) в качестве метода лечения СШ у детей. В исследовании, которое проводилось с участием взрослых пациентов с СШ, крахмал повышал риск смерти, коагулопатии и острого почечного повреждения [133]. Уровень лактата не рекомендуется использовать в качестве маркера СШ у детей, однако он может быть использован для оценки адекватности и эффективности инфузионной терапии [134]. Высокий уровень лактата в крови может свидетельствовать о неполной или неадекватной гемодинамической реанимации, что в свою очередь требует продолжения инфузионной терапии или увеличения объема жидкости для болюсного введения.
Вазоактивные лекарственные препараты / Vasoactive drugs
Согласно международным рекомендациям, у детей с сепсисом и СШ в качестве первой линии терапии рекомендуется использовать адреналин или норадреналин вместо дофамина. При признаках нарушения перфузии после проведенной инфузионной терапии следует начать инфузию вазоактивными лекарственными препаратами внутривенно или внутрикостно (при наличии соответствующего доступа). При сравнении эффективности адреналина и дофамина было доказано, что терапия адреналином приводила к уменьшению смертности в отличие от дофамина (ОШ = 0,63; 95 % ДИ = 0,40–0,99) [135, 136].
Кортикостероиды / Corticosteroids
Исходя из международных клинических рекомендаций, использование глюкокортикостероидов допустимо в случае неэффективности инфузионной терапии и терапии с использованием вазоактивных препаратов. Для оценки эффективности терапии глюкокортикостероидами у детей было проведено исследование, по результатам которого можно сделать вывод, что купирование СШ наступало раньше, если пациентам вводили глюкокортикостероиды (р = 0,046) [137]. Также на сегодняшний день нет более обширных и подробных исследований на детской популяции по поводу использования гидрокортизона в терапии СШ.
Жаропонижающая терапия / Antipyretic therapy
Нет однозначного мнения об использовании жаропонижающих препаратов у детей, так как внутривенное введение, например, парацетамола может приводить к критической гипотензии. Однако в литературе на сегодняшний день не существует убедительных доказательств того, что прием парацетамола вызывает серьезное снижение артериального давления у новорожденных [138][139].
На данный момент времени однозначного и единого протокола лечения неонатального сепсиса и СШ у новорожденных нет. Тактика лечения зависит от множества факторов, включая возраст и массу тела ребенка, от наличия или отсутствия у него неспецифических симптомов и сопутствующих заболеваний, а также от генетически обусловленного ответа на лекарственную терапию. В первую очередь терапия СШ должна быть направлена на спасение жизни пациента, нивелирование неблагоприятных симптомов основного заболевания и минимизацию нежелательных побочных эффектов лекарственной терапии [140]. Международные рекомендации могут дать лишь общее представление о подходе к терапии СШ, оставляя множество вопросов о лечении и диагностики СШ у новорожденных открытыми.
Заключение / Conclusion
Синдром воспалительного ответа плода (FIRS) и СШ оказывают значительное влияние на все системы организма новорожденного. Отдельного внимания заслуживают изменения, протекающие в еще не созревшей системе гемостаза. Неспецифическая клиническая картина СШ, которая характеризуется поражением различных систем организма (от сердечно-сосудистой до эндокринной), является основной проблемой для врачей-клиницистов. Новорожденные имеют уникальные особенности организма, из-за чего клиническая картина детей и взрослых имеет существенные различия. Усовершенствование знаний патогенетических механизмов позволит улучшить терапевтические подходы и прогноз у таких детей.
Список литературы
1. Линников В.И., Линников С.В., Макацария Н.А. Санарелли и Шварцман, историческая справка. Акушерство, Гинекология и Репродукция. 2022;16(3):324–7. https://doi.org/10.17749/2313-7347/ob.gyn.rep.2022.320.
2. Chakraborty R.K., Burns B. Systemic inflammatory response syndrome. In: StatPearls. Treasure Island (FL): StatPearls Publishing, 2025 Jan.
3. Wang Y., Dong H., Dong T. et al. Treatment of cytokine release syndrome-induced vascular endothelial injury using mesenchymal stem cells. Mol Cell Biochem. 2024;479(5):1149–64. https://doi.org/10.1007/s11010-023-04785-1.
4. Безнощенко Г.Б. Синдром системного воспалительного ответа в акушерской клинике: решенные вопросы и нерешенные проблемы. Российский вестник акушера-гинеколога. 2018;18(4):6–10. https://doi.org/10.17116/rosakush20181846.
5. Sikora J.P., Karawani J., Sobczak J. Neutrophils and the systemic inflammatory response syndrome (SIRS). Int J Mol Sci. 2023;24(17):13469. https://doi.org/10.3390/ijms241713469.
6. De Felice C., De Capua B., Costantini D. et al. Recurrent otitis media with effusion in preterm infants with histologic chorioamnionitis – a 3 years follow-up study. Early Hum Dev. 2008;84(10):667–71. https://doi.org/10.1016/j.earlhumdev.2008.04.008.
7. Karrow N.A. Activation of the hypothalamic-pituitary-adrenal axis and autonomic nervous system during inflammation and altered programming of the neuroendocrine-immune axis during fetal and neonatal development: lessons learned from the model inflammagen, lipopolysaccharide. Brain Behav Immun. 2006;20(2):144–58. https://doi.org/10.1016/j.bbi.2005.05.003.
8. Para R., Romero R., Miller D. et al. The distinct immune nature of the fetal inflammatory response syndrome type I and type II. Immunohorizons. 2021;5(9):735–51. https://doi.org/10.4049/immunohorizons.2100047.
9. Glavina-Durdov M., Springer O., Capkun V. et al. The grade of acute thymus involution in neonates correlates with the duration of acute illness and with the percentage of lymphocytes in peripheral blood smear. Pathological study. Biol Neonate. 2003;83(4):229–34. https://doi.org/10.1159/000069481.
10. Stra??k Z., Berka I., ?irc J. et al. Role of umbilical interleukin-6, procalcitonin and C-reactive protein measurement in the diagnosis of fetal inflammatory response syndrome. Ceska Gynekol. 2021;86(2):80–5. https://doi.org/10.48095/cccg202180.
11. Persson G., J?rgensen N., Nilsson L.L. et al. A role for both HLA-F and HLA-G in reproduction and during pregnancy? Hum Immunol. 2020;81(4):127–33. https://doi.org/10.1016/j.humimm.2019.09.006.
12. Nomiyama M., Nakagawa T., Yamasaki F. et al. Contribution of fetal inflammatory response syndrome (FIRS) with or without maternal-fetal inflammation in the placenta to increased risk of respiratory and other complications in preterm neonates. Biomedicines. 2023;11(2):611. https://doi.org/10.3390/biomedicines11020611.
13. Romero R., Savasan Z.A., Chaiworapongsa T. et al. The hematologic profile of the fetus with systemic inflammatory response syndrome. J Perinat Med. 2011;40(1):19–32. https://doi.org/10.1515/JPM.2011.100.
14. Ead J.K., Armstrong D.G. Granulocyte-macrophage colony-stimulating factor: conductor of the wound healing orchestra? Int Wound J. 2023;20(4):1229–34. https://doi.org/10.1111/iwj.13919.
15. Зурочка А.В., Зурочка В.А., Добрынина М.А., Гриценко В.А. Иммунобиологические свойства гранулоцитарно-макрофагального колониестимулирующего фактора и синтетических пептидов его активного центра. Медицинская иммунология. 2021;23(5):1031–54. https://doi.org/10.15789/1563-0625-IPO-2216.
16. Chaiworapongsa T., Romero R., Berry S.M. et al. The role of granulocyte colony-stimulating factor in the neutrophilia observed in the fetal inflammatory response syndrome. J Perinat Med. 2011;39(6):653–66. https://doi.org/10.1515/jpm.2011.072.
17. Leikin E., Garry D., Visintainer P. et al. Correlation of neonatal nucleated red blood cell counts in preterm infants with histologic chorioamnionitis. Am J Obstet Gynecol. 1997;177(1):27–30. https://doi.org/10.1016/s0002-9378(97)70433-2.
18. Mandel D., Oron T., Mimouni G.S. et al. The effect of prolonged rupture of membranes on circulating neonatal nucleated red blood cells. J Perinatol. 2005;25(11):690–3. https://doi.org/10.1038/sj.jp.7211389.
19. Romero R., Soto E., Berry S.M. et al. Blood pH and gases in fetuses in preterm labor with and without systemic inflammatory response syndrome. J Matern Fetal Neonatal Med. 2012;25(7):1160–70. https://doi.org/10.3109/14767058.2011.629247.
20. Zaharie G.C., Drugan T., Crivii C. et al. Postpartum assessment of fetal inflammatory response syndrome in a preterm population with premature rupture of membranes: a Romanian study. Exp Ther Med. 2021;22(6):1427. https://doi.org/10.3892/etm.2021.10862.
21. Kallapur S.G., Willet K.E., Jobe A.H. et al. Intra-amniotic endotoxin: chorioamnionitis precedes lung maturation in preterm lambs. Am J Physiol Lung Cell Mol Physiol. 2001;280(3):L527–36. https://doi.org/10.1152/ajplung.2001.280.3.L527.
22. Yoon B.H., Romero R., Kim K.S. et al. A systemic fetal inflammatory response and the development of bronchopulmonary dysplasia. Am J Obstet Gynecol. 1999;181(4):773–9. https://doi.org/10.1016/s0002-9378(99)70299-1.
23. Sarno L., Corte L. D., Saccone G. et al. Histological chorioamnionitis and risk of pulmonary complications in preterm births: a systematic review and meta-analysis. J Matern Fetal Neonatal Med. 2021;34(22):3803–12. https://doi.org/10.1080/14767058.2019.1689945.
24. Wu J., Wang Y., Zhao A., Wang Z. Lung ultrasound for the diagnosis of neonatal respiratory distress syndrome: a meta-analysis. Ultrasound Q. 2020;36(2):102–10. https://doi.org/10.1097/RUQ.0000000000000490.
25. Dessardo N.S., Dessardo S., Musta? E. et al. Chronic lung disease of prematurity and early childhood wheezing: is foetal inflammatory response syndrome to blame? Early Hum Dev. 2014;90(9):493–9. https://doi.org/10.1016/j.earlhumdev.2014.07.002.
26. Yap V., Perlman J.M. Mechanisms of brain injury in newborn infants associated with the fetal inflammatory response syndrome. Semin Fetal Neonatal Med. 2020;25(4):101110. https://doi.org/10.1016/j.siny.2020.101110.
27. Muraskas J.K., Kelly A.F., Nash M.S. et al. The role of fetal inflammatory response syndrome and fetal anemia in nonpreventable term neonatal encephalopathy. J Perinatol. 2016;36(5):362–5. https://doi.org/10.1038/jp.2015.214.
28. Yoon B.H., Romero R., Kim C.J. et al. High expression of tumor necrosis factor-? and interleukin-6 in periventricular leukomalacia. Am J Obstet Gynecol. 1997;177(2):406–11. https://doi.org/10.1016/s0002-9378(97)70206-0.
29. Kadhim H., Tabarki B., Verellen G. et al. Inflammatory cytokines in the pathogenesis of periventricular leukomalacia. Neurology. 2001;56(10):1278–84. https://doi.org/10.1212/wnl.56.10.1278.
30. Stolp H.B., Dziegielewska K.M., Ek C.J. et al. Breakdown of the blood-brain barrier to proteins in white matter of the developing brain following systemic inflammation. Cell Tissue Res. 2005;320(3):369–78. https://doi.org/10.1007/s00441-005-1088-6.
31. Александров А.Г., Блинов Д.В. Прорыв гематоэнцефалического барьера после острой гипоксии головного мозга у детей. Реабилитология. 2024;2(1):107–14. https://doi.org/10.17749/2949-5873/rehabil.2024.13.
32. Александров А.Г., Петренко Д.А. Перспективные биомаркеры нарушения проницаемости гематоэнцефалического барьера в реабилитации детей с перинатальным гипоксическии-шемическим поражением центральной нервной системы. Реабилитология. 2024;2(2):207–15. https://doi.org/10.17749/2949-5873/rehabil.2024.9.
33. Zhang Z., Jyoti A., Balakrishnan B. et al. Trajectory of inflammatory and microglial activation markers in the postnatal rabbit brain following intrauterine endotoxin exposure. Neurobiol Dis. 2018;111:153–62. https://doi.org/10.1016/j.nbd.2017.12.013.
34. Giovannini E., Bonasoni M.P., Pascali J.P. et al. Infection induced fetal inflammatory response syndrome (FIRS): state-of- the-art and medico-legal implications – a narrative review. Microorganisms. 2023;11(4):1010. https://doi.org/10.3390/microorganisms11041010.
35. Goncalves L.F., Cornejo P., Towbin R. Neuroimaging findings associated with the fetal inflammatory response syndrome. Semin Fetal Neonatal Med. 2020;25(4):101143. https://doi.org/10.1016/j.siny.2020.101143.
36. Boog G. Cerebral palsy and perinatal asphyxia (I – diagnosis). Gynecol Obstet Fertil. 2010;38(4):261–77. (In French). https://doi.org/10.1016/j.gyobfe.2010.02.009.
37. Кожанова Т.В., Жилина С.С., Мещерякова Т.И. и др. SPTAN1-ассоциированная энцефалопатия развития и эпилептическая энцефалопатия. Эпилепсия и пароксизмальные состояния. 2023;15(3):246–29. https://doi.org/10.17749/2077-8333/epi.par.con.2023.150.
38. Малов А.Г., Калашникова Т.П., Вдовина Н.А. Клинические особенности эволюционной и эпилептической энцефалопатии, вызванной мутацией в гене KCNQ2. Эпилепсия и пароксизмальные состояния. 2023;15(4):354–60. https://doi.org/10.17749/2077-8333/epi.par.con.2023.171.
39. Абусуева Б.А., Шанавазова М.Д., Аскевова М.А. и др. Случай атипичного течения тяжелой миоклонической эпилепсии младенчества (синдрома Драве). Эпилепсия и пароксизмальные состояния. 2024;16(2):130–6. https://doi.org/10.17749/2077-8333/epi.par.con.2024.180.
40. Song J.S., Woo S.J., Park K.H. et al. Association of inflammatory and angiogenic biomarkers in maternal plasma with retinopathy of prematurity in preterm infants. Eye (Lond). 2023;37(9):1802–9. https://doi.org/10.1038/s41433-022-02234-9.
41. Park Y.J., Woo S.J., Kim Y.M. et al. Immune and inflammatory proteins in cord blood as predictive biomarkers of retinopathy of prematurity in preterm infants. Invest Ophthalmol Vis Sci. 2019;60(12):3813–20. https://doi.org/10.1167/iovs.19-27258.
42. Gibson B., Goodfriend E., Zhong Y., Melhem N.M. Fetal inflammatory response and risk for psychiatric disorders. Transl Psychiatry. 2023;13(1):224. https://doi.org/10.1038/s41398-023-02505-3.
43. Yoon B.H., Kim Y.A., Romero R. et al. Association of oligohydramnios in women with preterm premature rupture of membranes with an inflammatory response in fetal, amniotic, and maternal compartments. Am J Obstet Gynecol. 1999;181(4):784–788. https://doi.org/10.1016/s0002-9378(99)70301-7.
44. Lee S.E., Romero R., Lee S.M., Yoon B.H. Amniotic fluid volume in intra-amniotic inflammation with and without culture-proven amniotic fluid infection in preterm premature rupture of membranes. J Perinat Med. 2010;38(1):39–44. https://doi.org/10.1515/jpm.2009.123.
45. Azpurua H., Dulay A.T., Buhimschi I.A. et al. Fetal renal artery impedance as assessed by Doppler ultrasound in pregnancies complicated by intraamniotic inflammation and preterm birth. Am J Obstet Gynecol. 2009;200(2):203.e1–11. https://doi.org/10.1016/j.ajog.2008.11.001.
46. Galinsky R., Moss T.J.M., Gubhaju L. et al. Effect of intra-amniotic lipopolysaccharide on nephron number in preterm fetal sheep. Am J Physiol Renal Physiol. 2011;301(2):F280–5. https://doi.org/10.1152/ajprenal.00066.2011.
47. Stantsidou A., Pagonopoulou O., Deftereou T. Effects of chorioamnionitis in fetal renal glomeruli. Hippokratia. 2021;25(2):98.
48. Muk T., Jiang P.-P., Stensballe A. et al. Prenatal endotoxin exposure induces fetal and neonatal renal inflammation via innate and Th1 immune activation in preterm pigs. Front Immunol. 2020;11:565484. https://doi.org/10.3389/fimmu.2020.565484.
49. Kuypers E., Wolfs T.G.A.M., Collins J.J.P. et al. Intraamniotic lipopolysaccharide exposure changes cell populations and structure of the ovine fetal thymus. Reprod Sci. 2013;20(8):946–56. https://doi.org/10.1177/1933719112472742.
50. Luciano A.A., Yu H., Jackson L.W. et al. Preterm labor and chorioamnionitis are associated with neonatal T cell activation. PLoS One. 2011;6(2):e16698. https://doi.org/10.1371/journal.pone.0016698.
51. Melville J.M., Bischof R.J., Meeusen E.N. et al. Changes in fetal thymic immune cell populations in a sheep model of intrauterine inflammation. Reprod Sci. 2012;19(7):740–7. https://doi.org/10.1177/1933719111432873.
52. Kramer B.W., Moss T.J., Willet K.E. et al. Dose and time response after intraamniotic endotoxin in preterm lambs. Am J Respir Crit Care Med. 2001;164(6):982–8. https://doi.org/10.1164/ajrccm.164.6.2103061.
53. Kuypers E., Willems M.G.M., Jellema R.K. et al. Responses of the spleen to intraamniotic lipopolysaccharide exposure in fetal sheep. Pediatr Res. 2015;77(1–1):29–35. https://doi.org/10.1038/pr.2014.152.
54. Musilova I., Kacerovsky M., Hornychova H. et al. Pulsation of the fetal splenic vein – a potential ultrasound marker of histological chorioamnionitis and funisitis in women with preterm prelabor rupture of membranes. Acta Obstet Gynecol Scand. 2012;91(9):1119–23. https://doi.org/10.1111/j.1600-0412.2012.01450.x.
55. Yan X., Managlia E., Tan X.-D., De Plaen I.G. Prenatal inflammation impairs intestinal microvascular development through a TNF-dependent mechanism and predisposes newborn mice to necrotizing enterocolitis. Am J Physiol Gastrointest Liver Physiol. 2019;31(1)7:G57–G66. https://doi.org/10.1152/ajpgi.00332.2018.
56. Razak A., Malhotra A. Fetal inflammatory response spectrum: mapping its impact on severity of necrotising enterocolitis. Pediatr Res. 2024;95:1179–80. https://doi.org/10.1038/s41390-023-02973-9.
57. Bieghs V., Vlassaks E., Custers A. et al. Chorioamnionitis induced hepatic inflammation and disturbed lipid metabolism in fetal sheep. Pediatr Res. 2010;68(6):466–72. https://doi.org/10.1203/PDR.0b013e3181f70eeb.
58. Heymans C., den Dulk M., Lenaerts K. et al. Chorioamnionitis induces hepatic inflammation and time-dependent changes of the enterohepatic circulation in the ovine fetus. Sci Rep. 2021;11(1):10331. https://doi.org/10.1038/s41598-021-89542-4.
59. Сергеева В.А., Шабалов Н.П., Александрович Ю.С., Нестеренко С.Н. Предопределяет ли фетальный воспалительный ответ осложненное течение раннего неонатального периода? Сибирский медицинский журнал. 2010;(4):75–80.
60. Watterberg K.L., Demers L.M., Scott S.M., Murphy S. Chorioamnionitis and early lung inflammation in infants in whom bronchopulmonary dysplasia develops. Pediatrics. 1996;97(2):210–5.
61. Volpe J.J. Postnatal sepsis, necrotizing entercolitis, and the critical role of systemic inflammation in white matter injury in premature infants. J Pediatr. 2008;153(2):160–3. https://doi.org/10.1016/j.jpeds.2008.04.057.
62. Eloundou S.N., Lee J., Wu D. et al. Placental malperfusion in response to intrauterine inflammation and its connection to fetal sequelae. PLoS One. 2019;14(4):e0214951. https://doi.org/10.1371/journal.pone.0214951.
63. Luciano A.A., Arbona-Ramirez I.M., Ruiz R. et al. Alterations in regulatory T cell subpopulations seen in preterm infants. PLoS One. 2014;9(5):e95867. https://doi.org/10.1371/journal.pone.0095867.
64. Карпова А.Л., Мостовой А.В., Дудкина Е.А. и др. Ранний неонатальный сепсис в эпоху COVID-19. Акушерство, Гинекология и Репродукция. 2023;17(3):284–98. https://doi.org/10.17749/2313-7347/ob.gyn.rep.2023.389.
65. Баялиева А.Ж., Давыдова В.Р. Септический шок в акушерстве: роль эфферентных методик в удалении эндотоксина при грамотрицательном сепсисе. Акушерство, Гинекология и Репродукция. 2024;18(4):504–13. https://doi.org/10.17749/2313-7347/ob.gyn.rep.2024.509.
66. Muraskas J., Astrug L., Amin S. FIRS: neonatal considerations. Semin Fetal Neonatal Med. 2020;25(4):101142. https://doi.org/10.1016/j.siny.2020.101142.
67. Agyeman P.K.A., Schlapbach L.J., Giannoni E. et al. Epidemiology of blood culture-proven bacterial sepsis in children in Switzerland: a population-based cohort study. Lancet Child Adolesc Health. 2017;1(2):124–33. https://doi.org/10.1016/S2352-4642(17)30010-X.
68. Wynn J.L., Wong H.R. Pathophysiology and treatment of septic shock in neonates. Clin Perinatol. 2010;37(2):439–79. https://doi.org/10.1016/j.clp.2010.04.002.
69. Самсыгина Г.А. Сепсис и септический шок у новорожденных детей. Педиатрия. Журнал имени Г.Н. Сперанского. 2009;87(1):120–7.
70. Spaggiari V., Passini E., Crestani S. et al. Neonatal septic shock, a focus on first line interventions. Acta Biomed. 2022;93(3):e2022141. https://doi.org/10.23750/abm.v93i3.12577.
71. Schorr C.A., Zanotti S., Dellinger R.P. Severe sepsis and septic shock. Virulence. 2014;5(1):190–9. https://doi.org/10.4161/viru.27409.
72. de Cássia Silveira R., Giacomini C., Procianoy R.S. Neonatal sepsis and septic shock: concepts update and review. Rev Bras Ter Intensiva. 2010;22(3):280–90. (In English, Portuguese).
73. Khizroeva J., Makatsariya A., Vorobev A. et al. The hemostatic system in newborns and the risk of neonatal thrombosis. Int J Mol Sci. 2023;24(18):13864. https://doi.org/10.3390/ijms241813864.
74. Andrew M., Vegh P., Johnston M. et al. Maturation of the hemostatic system during childhood. Blood. 1992;80(8):1998–2005.
75. Wiedmeier S.E., Henry E., Sola-Visner M.C., Christensen et al. Platelet reference ranges for neonates, defined using data from over 47,000 patients in a multihospital healthcare system. J Perinatol. 2009;29(2):130–6. https://doi.org/10.1038/jp.2008.141.
76. Бицадзе В.О., Суконцева Т.А., Акиньшина С.В. и др. Септический шок. Акушерство, Гинекология и Репродукция. 2020;14(3):314–26. https://doi.org/10.17749/2313-7347/ob.gyn.rep.2020.169.
77. Мальцева Л.А., Базиленко Д.В. Патогенез тяжелого сепсиса и септического шока: анализ современных концепций. Медицина неотложных состояний. 2015;(7):35–40.
78. Бицадзе В.О., Хизроева Д.Х., Макацария Д.А. и др. COVID-19, септический шок и синдром диссеминированного внутрисосудистого свертывания крови. Часть 1. Вестник РАМН. 2020;75(2):118–28. https://doi.org/10.15690/vramn1335.
79. Levi M., van der Poll T. Coagulation and sepsis. Thromb Res. 2017;149:38–44. https://doi.org/10.1016/j.thromres.2016.11.007.
80. Green J., Doughty L., Kaplan S.S. et al. The tissue factor and plasminogen activator inhibitor type-1 response in pediatric sepsis-induced multiple organ failure. Thromb Haemost. 2002;87(2):218–23.
81. Dempfle C.-E. The TAFI system. The new role of fibrinolysis. Hamostaseologie. 2007;27(4):278–81. (In German).
82. Stief T.W., Ijagha O., Weiste B. et al. Analysis of hemostasis alterations in sepsis. Blood Coagul Fibrinolysis. 2007;18(2):179–86. https://doi.org/10.1097/MBC.0b013e328040bf9a.
83. Gando S. Role of fibrinolysis in sepsis. Semin Thromb Hemost. 2013;39(4):392–9. https://doi.org/10.1055/s-0033-1334140.
84. Willemse J.L., Heylen E., Nesheim M.E., Hendriks D.F. Carboxypeptidase U (TAFIa): a new drug target for fibrinolytic therapy? J Thromb Haemost. 2009;7(12):1962–71. https://doi.org/10.1111/j.1538-7836.2009.03596.x.
85. Emonts M., De bruijne E.L.E., Guimar?es A.H.C. et al. Thrombin activatable fibrinolysis inhibitor is associated with severity and outcome of severe meningococcal infection in children. J Thromb Haemost. 2008;6(2):268–76. https://doi.org/10.1111/j.1538-7836.2008.02841.x.
86. Продеус А.П., Устинова М.В., Корсунский А.А., Гончаров А.Г. Новые аспекты патогенеза сепсиса и септического шока у детей. Система комплемента как мишень для эффективной терапии. Инфекция и иммунитет. 2018;8(1):19–24. https://doi.org/10.15789/2220-7619-2018-1-19-24.
87. Hazelzet J.A., de Groot R., van Mierlo G. et al Complement activation in relation to capillary leakage in children with septic shock and purpura. Infect Immun. 1998;66(11):5350–6. https://doi.org/10.1128/IAI.66.11.5350-5356.1998.
88. Kelwick R., Desanlis I., Wheeler G.N., Edwards D.R. The ADAMTS (a disintegrin and metalloproteinase with thrombospondin motifs) family. Genome Biol. 2015;16(1):113. https://doi.org/10.1186/s13059-015-0676-3.
89. Levi M., Scully M., Singer M. The role of ADAMTS-13 in the coagulopathy of sepsis. J Thromb Haemost. 2018;16(4):646–51. https://doi.org/10.1111/jth.13953.
90. Levi M., Opal S.M. Coagulation abnormalities in critically ill patients. Crit Care. 2006;10(4):222. https://doi.org/10.1186/cc4975.
91. Pillai V.G., Bao J., Zander C.B. et al. Human neutrophil peptides inhibit cleavage of von Willebrand factor by ADAMTS13: a potential link of inflammation to TTP. Blood. 2016;128(1):110–9. https://doi.org/10.1182/blood-2015-12-688747.
92. Chen J., Chung D.W. Inflammation, von Willebrand factor, and ADAMTS13. Blood. 2018;132(2):141–7. https://doi.org/10.1182/blood-2018-02-769000.
93. Peigne V., Azoulay E., Coquet I. et al. The prognostic value of ADAMTS13 (a disintegrin and metalloprotease with thrombospondin type 1 repeats, member 13) deficiency in septic shock patients involves interleukin-6 and is not dependent on disseminated intravascular coagulation. Crit Care. 2013;17(6):R273. https://doi.org/10.1186/cc13115.
94. Habe K., Wada H., Ito-Habe N. et al. Plasma ADAMTS13, von Willebrand factor (VWF) and VWF propeptide profiles in patients with DIC and related diseases. Thromb Res. 2012;129(5):598–602. https://doi.org/10.1016/j.thromres.2011.10.011.
95. Ono T., Mimuro J., Madoiwa S. et al. Severe secondary deficiency of von Willebrand factor-cleaving protease (ADAMTS13) in patients with sepsis-induced disseminated intravascular coagulation: its correlation with development of renal failure. Blood. 2006;107(5):528–34. https://doi.org/10.1182/blood-2005-03-1087.
96. Schwameis M., Schörgenhofer C., Assinger A. et al. VWF excess and ADAMTS13 deficiency: a unifying pathomechanism linking inflammation to thrombosis in DIC, malaria, and TTP. Thromb Haemost. 2015;113(4):708–18. https://doi.org/10.1160/TH14-09-0731.
97. Emmer B.T., Ginsburg D., Desch K.C. VWF and ADAMTS13: too much or too little of a good thing? Arterioscler Thromb Vasc Biol. 2016;36(12):2281–2. https://doi.org/10.1161/ATVBAHA.116.308531.
98. Sonneveld M.A.H., Franco O.H., Ikram M.A. et al. Von Willebrand factor, ADAMTS13, and the risk of mortality: the Rotterdam Study. Arterioscler Thromb Vasc Biol. 2016;36(12):2446–51. https://doi.org/10.1161/ATVBAHA.116.308225.
99. Papadogeorgou P., Boutsikou T., Boutsikou M. et al. A global assessment of coagulation profile and a novel insight into Adamts-13 implication in neonatal sepsis. Biology. 2023;12(10):1281. https://doi.org/10.3390/biology12101281.
100. Kansas G.S. Selectins and their ligands: current concepts and controversies. Blood. 1996;88(9):3259–87.
101. Martinod K., Deppermann C. Immunothrombosis and thromboinflammation in host defense and disease. Platelets. 2021;32(3):314–24. https://doi.org/10.1080/09537104.2020.1817360.
102. Rossaint J., Margraf A., Zarbock A. Role of platelets in leukocyte recruitment and resolution of inflammation. Front Immunol. 2018;9:2712. https://doi.org/10.3389/fimmu.2018.02712
103. Iba T., Levy J.H. Inflammation and thrombosis: roles of neutrophils, platelets and endothelial cells and their interactions in thrombus formation during sepsis. J Thromb Haemost. 2018;16(2):231–41. https://doi.org/10.1111/jth.13911.
104. Finkelstein Y., Shenkman B., Sirota L. et al. Whole blood platelet deposition on extracellular matrix under flow conditions in preterm neonatal sepsis. Eur J Pediatr. 2002;161(5):270–4. https://doi.org/10.1007/s00431-002-0938-4.
105. Sadeghi K., Berger A., Langgartner M. et al. Immaturity of infection control in preterm and term newborns is associated with impaired toll-like receptor signaling. J Infect Dis. 2007;195(2):296–302. https://doi.org/10.1086/509892.
106. Sitaru A.-G., Speer C.P., Holzhauer S. et al. Chorioamnionitis is associated with increased CD40L expression on cord blood platelets. Thromb Haemost. 2005;94(6):1219–23. https://doi.org/10.1160/TH05-02-0127.
107. Aoui C., Prigent A., Sut C. et al. The signaling role of CD40 ligand in platelet biology and in platelet component transfusion. Int J Mol Sci. 2014;15(12):22342–64. https://doi.org/10.3390/ijms151222342.
108. Макацария А.Д., Слуханчук Е.В., Бицадзе В.О. и др. Концепция тромбовоспаления как основы тромботических осложнений, прогрессии опухоли и метастазирования у онкогинекологических больных. Акушерство, Гинекология и Репродукция. 2024;18(4):450–63. https://doi.org/10.17749/2313-7347/ob.gyn.rep.2024.542.
109. Слуханчук Е.В., Бицадзе В.О., Солопова А.Г. и др. Внеклеточные ловушки нейтрофилов как маркеры тромбовоспаления в патогенезе злокачественных новообразований женских половых органов и молочной железы. Акушерство, Гинекология и Репродукция. 2022;16(4):426–37. https://doi.org/10.17749/2313-7347/ob.gyn.rep.2022.335.
110. Асланова З.Д., Хизроева Д.Х., Солопова А.Г. и др. Клиническое значение определения внеклеточных ловушек нейтрофилов у женщин с онкогинекологическими заболеваниями. Акушерство, Гинекология и Репродукция. 2023;17(6):751–68. https://doi.org/10.17749/2313-7347/ob.gyn.rep.2023.447.
111. Макацария А.Д. COVID-19 и системные тромботические синдромы. Акушерство, Гинекология и Репродукция. 2024;18(6):908–18. https://doi.org/10.17749/2313-7347/ob.gyn.rep.2024.590.
112. Слуханчук Е.В., Бицадзе В.О., Солопова А.Г. и др. Маркеры внеклеточных ловушек нейтрофилов у женщин со злокачественными новообразованиями репродуктивной системы, получавших хирургическое лечение и адъювантную терапию. Акушерство, Гинекология и Репродукция. 2023;17(4):420–32. https://doi.org/10.17749/2313-7347/ob.gyn.rep.2023.432.
113. Слуханчук Е.В., Бицадзе В.О., Солопова А.Г. и др. Вклад внеклеточных ловушек нейтрофилов в протромботическое состояние и прогрессию опухоли у онкогинекологических пациенток. Акушерство, Гинекология и Репродукция. 2023;17(1):53–64. https://doi.org/10.17749/2313-7347/ob.gyn.rep.2023.385.
114. Андрюков Б.Г., Богданова В.Д., Ляпун И.Н. Фенотипическая гетерогенность нейтрофилов: новые антимикробные характеристики и диагностические технологии. Гематология и трансфузиология. 2019;64(2):211–21. https://doi.org/10.35754/0234-5730-2019-64-2-211-221.
115. Kaplan M.J., Radic M. Neutrophil extracellular traps: double-edged swords of innate immunity. J Immunol. 2012;189(6):2689–95. https://doi.org/10.4049/jimmunol.1201719.
116. Fuchs T.A., Brill A., Duerschmied D. et al. Extracellular DNA traps promote thrombosis. Proc Natl Acad Sci U S A. 2010;107(36):15880–5. https://doi.org/10.1073/pnas.1005743107.
117. Hoppenbrouwers T., Boeddha N.P., Ekinci E. et al. Neutrophil extracellular traps in children with meningococcal sepsis. Pediatr Crit Care Med. 2018;19(6):e286–e291. https://doi.org/10.1097/PCC.0000000000001496.
118. McDonald B., Davis R.P., Kim S.-J. et al. Platelets and neutrophil extracellular traps collaborate to promote intravascular coagulation during sepsis in mice. Blood. 2017;129(10):1357–67. https://doi.org/10.1182/blood-2016-09-741298.
119. Fatmi A., Saadi W., Beltr?n-Garc?a J. et al. The endothelial glycocalyx and neonatal sepsis. Int J Mol Sci. 2022;24(1):364. https://doi.org/10.3390/ijms24010364.
120. Dreschers S., Platen C., Ludwig A. et al. Metalloproteinases TACE and MMP-9 differentially regulate death factors on adult and neonatal monocytes after infection with Escherichia coli. Int J Mol Sci. 2019;20(6):1399. https://doi.org/10.3390/ijms20061399.
121. He Y., Du W.X., Jiang H.Y. et al. Multiplex cytokine profiling identifies interleukin-27 as a novel biomarker for neonatal early onset sepsis. Shock. 2017;47(2):140–7. https://doi.org/10.1097/SHK.0000000000000753.
122. Formosa A., Turgeon P., dos Santos C.C. Role of miRNA dysregulation in sepsis. Mol Med. 2022;28(1):99. https://doi.org/10.1186/s10020-022-00527-z.
123. Bindayna K. MicroRNA as sepsis biomarkers: a comprehensive review. Int J Mol Sci. 2024;25(12):6476. https://doi.org/10.3390/ijms25126476.
124. Zheng X., Zhang Y., Lin S. et al. Diagnostic significance of microRNAs in sepsis. PLoS One. 2023;18(2):e0279726. https://doi.org/10.1371/journal.pone.0279726.
125. Yao J., Lui K.Y., Hu X. et al. Circulating microRNAs as novel diagnostic biomarkers and prognostic predictors for septic patients. Infect Genet Evol. 2021;95:105082. https://doi.org/10.1016/j.meegid.2021.105082.
126. Yong J., Toh C.-H. The convergent model of coagulation. J Thromb Haemost. 2024;22(8):2140–6. https://doi.org/10.1016/j.jtha.2024.05.014.
127. Wilhelm G., Mertowska P., Mertowski S. et al. The crossroads of the coagulation system and the immune system: interactions and connections. Int J Mol Sci. 2023;24(16):12563. https://doi.org/10.3390/ijms241612563.
128. Weiss S.L., Peters M.J., Alhazzani W. et al. Surviving sepsis campaign international guidelines for the management of septic shock and sepsis-associated organ dysfunction in children. Pediatr Crit Care Med. 2020;21(2):e52–e106. https://doi.org/10.1097/PCC.0000000000002198.
129. Haque K.N. Defining common infections in children and neonates. J Hosp Infect. 2007;65 Suppl 2:110–4. https://doi.org/10.1016/S0195-6701(07)60026-7.
130. McGovern M., Giannoni E., Kuester H. et al. Challenges in developing a consensus definition of neonatal sepsis. Pediatr Res. 2020;88(1):14–26. https://doi.org/10.1038/s41390-020-0785-x.
131. Santhanam I., Sangareddi S., Venkataraman S. et al. A prospective randomized controlled study of two fluid regimens in the initial management of septic shock in the emergency department. Pediatr Emerg Care. 2008;24(10):647–55. https://doi.org/10.1097/PEC.0b013e31818844cf.
132. Iroh Tam P.-.Y, Musicha P., Kawaza K. et al. Emerging resistance to empiric antimicrobial regimens for pediatric bloodstream infections in Malawi (1998–2017). Clin Infect Dis. 2019;69(1):61–8. https://doi.org/10.1093/cid/ciy834.
133. Perner A., Haase N., Guttormsen A.B. et al. Hydroxyethyl starch 130/0.42 versus ringer’s acetate in severe sepsis. N Engl J Med. https://doi.org/10.1056/NEJMoa1204242.
134. Scott H.F., Brou L., Deakyne S.J. et al. Lactate clearance and normalization and prolonged organ dysfunction in pediatric sepsis. J Pediatr. 2016;170:149–155.e1–4. https://doi.org/10.1016/j.jpeds.2015.11.071.
135. Ramaswamy K.N., Singhi S., Jayashree M. et al. Double-blind randomized clinical trial comparing dopamine and epinephrine in pediatric fluid-refractory hypotensive septic shock. Pediatr Crit Care Med. 2016;17(11):e502–e512. https://doi.org/10.1097/PCC.0000000000000954.
136. Ventura A.M.C., Shieh H.H., Bousso A. et al. Double-blind prospective randomized controlled trial of dopamine versus epinephrine as first-line vasoactive drugs in pediatric septic shock. Crit Care Med. 2015;43(11):2292–302. https://doi.org/10.1097/CCM.0000000000001260.
137. El-Nawawy A., Khater D., Omar H., Wali Y. Evaluation of early corticosteroid therapy in management of pediatric septic shock in pediatric intensive care patients: a randomized clinical study. Pediatr Infect Dis J. 2017;36(2):155–9. https://doi.org/10.1097/INF.0000000000001380.
138. Ray S., Brick T., Raman S. et al. Haemodynamic changes with paracetamol in critically-ill children. J Crit Care. 2017;40:108–12. https://doi.org/10.1016/j.jcrc.2017.03.026.
139. Nahum E., Weissbach A., Kaplan E., Kadmon G. Hemodynamic effects of intravenous paracetamol in critically ill children with septic shock on inotropic support. J Intensive Care. 2020;8:14. https://doi.org/10.1186/s40560-020-0430-0.
140. Festekjian A., Glavinic J. Pediatric septic shock: recognition and management in the emergency department. Pediatr Emerg Med Pract. 2022;19(11):1–24.
Об авторах
В. О. БицадзеРоссия
Бицадзе Виктория Омаровна, д.м.н., проф., профессор РАН
Scopus Author ID: 6506003478
WoS ResearcherID: F-8409-2017
119048 Москва, ул. Трубецкая, д. 8, стр. 2
Д. Х. Хизроева
Россия
Хизроева Джамиля Хизриевна, д.м.н., проф.
Scopus Author ID: 57194547147
WoS ResearcherID: F-8384-2017
119048 Москва, ул. Трубецкая, д. 8, стр. 2
М. В. Третьякова
Россия
Третьякова Мария Владимировна, к.м.н.
119048 Москва, ул. Трубецкая, д. 8, стр. 2
Н. А. Макацария
Россия
Макацария Наталия Александровна, к.м.н.
WoS ResearcherID: F-8406-2017
119048 Москва, ул. Трубецкая, д. 8, стр. 2
Р. И. Габидуллина
Россия
Габидуллина Рушанья Исмагиловна, д.м.н., проф.
Scopus Author ID: 57215670415
420012 Казань, ул. Бутлерова, д. 49
А. В. Мостовой
Россия
Мостовой Алексей Валерьевич, к.м.н.
Scopus Author ID: 57201723894
Wos ResearcherID: AAR-7908-2021
123423 Москва, ул. Саляма Адиля, д. 2/44
123995 Москва, ул. Баррикадная, д. 2/1, корп. 1
150000 Ярославль, ул. Революционная, д. 5
А. Л. Карпова
Россия
Карпова Анна Львовна, к.м.н.
123423 Москва, ул. Саляма Адиля, д. 2/44
123995 Москва, ул. Баррикадная, д. 2/1, корп. 1
150000 Ярославль, ул. Революционная, д. 5
А. Е. Войновский
Россия
Войновский Александр Евгеньевич, д.м.н., проф.
WoS ResearcherID: S-6385-2016
123423 Москва, ул. Саляма Адиля, д. 2/44
М. Г. Новосатрян
Россия
Новосартян Маргарита Геннадиевна, к.м.н.
350089 Краснодар, ул. имени Генерала И.Л. Шифрина, д. 5
А. В. Лазарчук
Россия
Лазарчук Арина Владимировна
119048 Москва, ул. Трубецкая, д. 8, стр. 2
А. Р. Хисамиева
Россия
Хисамиева Азалия Рустемовна
119048 Москва, ул. Трубецкая, д. 8, стр. 2
А. Ю. Татаринцева
Россия
Татаринцева Алёна Юрьевна
119048 Москва, ул. Трубецкая, д. 8, стр. 2
А. В. Воробьев
Россия
Воробьев Александр Викторович, к.м.н.
Scopus Author ID: 57191966265
Wos ResearcherID: F-8804-2017
119048 Москва, ул. Трубецкая, д. 8, стр. 2
К. В. Агасян
Россия
Агасян Каринэ Вигеновна
119048 Москва, ул. Трубецкая, д. 8, стр. 2
Д. Л. Капанадзе
Грузия
Капанадзе Дареджан Левановна, к.м.н.
0179 Тбилиси, ул. Узнадзе, д. 78
М. С. Зайнулина
Россия
Зайнулина Марина Сабировна, д.м.н., проф.
Scopus Author ID: 37076359000
WoS ResearcherID: B-5746-2018
192014 Санкт-Петербург, ул. Маяковского, д. 5
195271 Санкт-Петербург, Кондратьевский проспект, д. 72, лит. А
В. Н. Серов
Россия
Серов Владимир Николаевич, д.м.н., проф., академик РАН
117997 Москва, ул. академика Опарина, д. 4
Д. В. Блинов
Россия
Блинов Дмитрий Владиславович, к.м.н.
Scopus Author ID: 6701744871
WoS ResearcherID: E-8906-2017
101000 Москва, Лялин переулок, д. 11–13/1
123056 Москва, 2-я Брестская ул., д. 5, с. 1–1а
141551 Московская область, деревня Голубое, Родниковая ул., стр. 6 к. 1
Ж.-К. Гри
Франция
Гри Жан-Кристоф, д.м.н., проф.
Scopus Author ID: 7005114260
WoS ResearcherID: AAA-2923-2019
119048 Москва, ул. Трубецкая, д. 8, стр. 2
34090 Монпелье, ул. Огюста Бруссоне, д. 163
П. Ван Дреден
Франция
Ван Дреден Патрик, д.м.н., проф.
Scopus Author ID: 55915955300
75006 Париж, Улица медицинского факультета, д. 12
И. Элалами
Франция
Элалами Исмаил, д.м.н., проф.
Scopus Author ID: 7003652413
WoS ResearcherID: AAC-9695-2019
119048 Москва, ул. Трубецкая, д. 8, стр. 2
75006 Париж, Улица медицинского факультета, д. 12
75020 Париж, Китайская улица, д. 4
Г. Геротзиафас
Франция
Геротзиафас Григориос, д.м.н., проф.
119048 Москва, ул. Трубецкая, д. 8, стр. 2
75006 Париж, Улица медицинского факультета, д. 12
75020 Париж, Китайская улица, д. 4
А. Д. Макацария
Россия
Макацария Александр Давидович, д.м.н., проф., академик РАН
Scopus Author ID: 57222220144
WoS ResearcherID: M-5660-2016
119048 Москва, ул. Трубецкая, д. 8, стр. 2
Что уже известно об этой теме?
► Синдром системного воспалительного ответа (ССВО) и септический шок (СШ) у новорожденных связаны с активацией воспалительных и коагуляционных каскадов, что приводит к полиорганной недостаточности.
► Синдром воспалительного ответа плода (FIRS) играет ключевую роль в развитии тяжелых осложнений, включая поражения нервной, дыхательной и сердечно-сосудистой систем.
► Несмотря на прогресс в изучении молекулярных механизмов, эффективные терапевтические стратегии для лечения неонатального сепсиса и СШ остаются недостаточно разработанными.
Что нового дает статья?
► Представлен обновленный взгляд на механизмы связи воспаления и гемостаза, включая влияние провоспалительных цитокинов на коагуляцию.
► Описаны новые потенциальные биомаркеры FIRS и СШ, позволяющие обеспечить ранее выявление риска осложнений.
► Подчеркивается необходимость разработки персонализированных стратегий терапии, основанных на молекулярных профилях воспалительного ответа.
Как это может повлиять на клиническую практику в обозримом будущем?
► Улучшение диагностики FIRS и СШ, а также понимание механизмов развития данных патологий способствуют раннему началу терапии и повышению числа благоприятных исходов.
Рецензия
Для цитирования:
Бицадзе В.О., Хизроева Д.Х., Третьякова М.В., Макацария Н.А., Габидуллина Р.И., Мостовой А.В., Карпова А.Л., Войновский А.Е., Новосатрян М.Г., Лазарчук А.В., Хисамиева А.Р., Татаринцева А.Ю., Воробьев А.В., Агасян К.В., Капанадзе Д.Л., Зайнулина М.С., Серов В.Н., Блинов Д.В., Гри Ж., Ван Дреден П., Элалами И., Геротзиафас Г., Макацария А.Д. Фетальный синдром системного воспалительного ответа, тромбовоспаление и неонатальный септический шок: патогенез, диагностика и лечение. Акушерство, Гинекология и Репродукция. 2025;19(2):250-272. https://doi.org/10.17749/2313-7347/ob.gyn.rep.2025.619
For citation:
Bitsadze V.O., Khizroeva J.Kh., Tretyakova M.V., Makatsariya N.A., Gabidullina R.I., Mostovoi A.V., Karpova A.L., Voynovskiy A.E., Novosartyan M.G., Lazarchuk A.V., Khisamieva A.R., Tatarintseva A.Yu., Vorobev A.V., Agasyan K.V., Kapanadze D.L., Zainulina M.S., Serov V.N., Blinov D.V., Gris J., Van Dreden P., Elalamy I., Gerotziafas G., Makatsariya A.D. Fetal systemic inflammatory response syndrome, thromboinflammation and neonatal septic shock: pathogenesis, diagnostics and treatment. Obstetrics, Gynecology and Reproduction. 2025;19(2):250-272. (In Russ.) https://doi.org/10.17749/2313-7347/ob.gyn.rep.2025.619

Контент доступен под лицензией Creative Commons Attribution-NonCommercial-ShareAlike 4.0 International License.











































